
1
Kliniczne Metody Monitorowania
Farmakoterapii
seminarium 2
.
Elżbieta Wojtasik
Zakład Opieki Farmaceutycznej
WUM
Warszawa,2011/12
,
Bezpieczeństwo
farmakoterapii
Bezpieczeństwo farmakoterapii zależy od:
1.
bezpiecznego leku
2. stylu życia
3. monitorowania farmakoterpii
–
monitorowania działań niepożądanych leków - GVP
(‘Good Vigilance
Practices - GVP’)
–
klinicznego i pozaklinicznego monitorowania pacjenta
–
compliance /adherence
–
Interakcji zmieniających skutki działania leków
2

,
Zmiana definicji działania niepożądanego
•
„
adverse reaction – a response to a medicinal product which is noxious and
unintended”
vs
•
„działaniem niepożądanym produktu leczniczego – jest każde niekorzystne i
niezamierzone działanie produktu leczniczego występujące podczas
stosowania dawek zalecanych u ludzi w celach profilaktycznych,
diagnostycznych,
terapeutycznych
lub
dla
modyfikacji
funkcji
fizjologicznych”
„ciężkim niepożądanym działaniem produktu leczniczego – jest działanie,
które bez względu na zastosowaną dawkę produktu leczniczego powoduje
zgon pacjenta, zagrożenie życia, konieczność hospitalizacji lub jej
przedłużenie, trwały lub znaczny uszczerbek na zdrowiu lub inne działanie
produktu leczniczego, które lekarz według swojego stanu wiedzy uzna za
ciężkie, lub jest chorobą, wadą wrodzoną lub uszkodzeniem płodu”
3

,
Inne zmiany legislacyjne
•
Powołanie Komitetu Pharmacovigilance Risk Assessment
Advisory Committee (PRAC)
•
Pharmacovigilance System Master File
źródłowym dokumentem opisującym szczegółowo sposób
monitorowania
działań niepożądanych przez MAH i zarządzania
ryzkiem
wymagany w procesie dopuszczenia do obrotu
4

,
Bezpieczeństwo farmakoterapii
•
Rozporządzenie Parlamentu Europejskiego i Rady 1235/2010 z 15 grudnia 2010 w sprawie
bezpieczeństwa farmakoterapii w odniesieniu do produktów leczniczych stosowanych u ludzi i do
celów weterynaryjnych i nadzoru nad nimi…,
•
Władzami odpowiedzialnymi za nadzór nad bezpieczeństwem farmakoterapii są właściwe władze
państwa członkowskiego, w którym znajduje się pełen opis systemu nadzoru nad bezpieczeństwem
farmakoterapii.”;
Obowiązek MAH : prowadzenie systemu monitorowania działań niepożądanych
prowadzenie systemu zarządzania ryzykiem
wykaz leków wymgających dodatkowego monitorowania.
5
Dodatkowe monitorowanie
leku
Obowiązki MAH:
Zawierających nową substancje aktywną,
biologiczne i biotechnologiczne produkty
lecznicze

,
Compliance
Monitorowanie terapii to b. ważny element dla
przestrzegania zaleceń lekarskich
„Compliance” (nie ma polskiego terminu) oznacza
stosowanie przez pacjenta zaleceń lekarza dotyczących
leków i stylu życia
Przestrzeganie compliance to najważniejszy element opieki
farmaceutycznej / monitorowania terapii
6

,
Compliance
•
Jednostka compliance - Proporcja przyjętej dawki
do dawki zaplanowanej w danym przedziale
czasowym
•
Prawidłowy compliance > 80% przy dawce
codziennej i > 50% przy dawce cotygodniowej
•
Compliance = ------------------------- %
7
Dawka
przyjęta
Dawka zaplanopwana
Gold i wsp., Curr Med. Res Opinions 2006;22:12
Napiórkowska i Franek, Twój Przegl Med 2006;
2:163

,
8
NTI –
NARROW THERAPEUTIC INDEX
Zachowanie wysokiej compliance (>80%) szczególnie
ważne przy stosowaniu leków NTI
•
stosunek LD50/ED50 < 2
•
stosunek C
tox-min
/C
eff-min
< 2
•
lek wymaga „nasycania” chorego i monitorowania (leczenie
pod kontrolą monitorowania)
•
mała zmiana w stężeniu leku w osoczu prowadzi do dużych
zmian w efekcie farmakodynamicznym

,
Food and Drug Administration. Code of
Federal Regulations. Title 21, Part 320:
Bioavailability and Bioequivalence
Requirements. Section 320.33. 2003.
Available at:
http://www.accessdata.fda.gov
.
Accessed September 29, 2003
Uważa się, że NTI określa się wtedy:
kiedy stosunek mediany dawki letalnej do mediany dawki
skutecznej jest mniejszy od 2.
Kiedy stosunek minimalnego stężenia toksycznego we krwi do
minimalnego stężenia „skutecznego” we krwi jest mniejszy od
2.
Definicja leków NTI
9
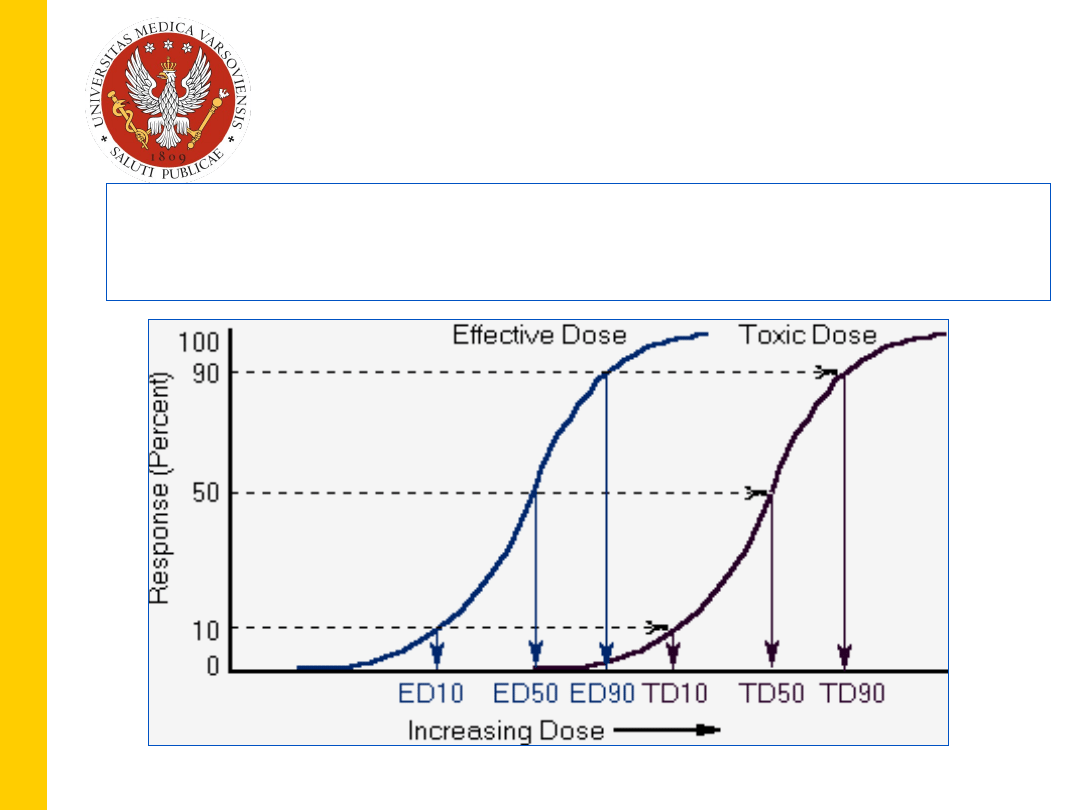
,
KRZYWE ZALEŻNOŚCI EFEKTU (LECZNICZEGO
LUB TOKSYCZNEGO) OD DAWKI
10

,
Adherence
•
Termin
adherence
definiowany jest jako zakres zachowań
pacjenta wynikający z zaakceptowania zaleceń terapeutycznych
rekomendowanych przez lekarza
•
Został on przyjęty przez wielu autorów jako alternatywny wobec
compliance
w celu podkreślenia wolności pacjenta w przyjęciu i
akceptacji planu leczenia oraz stosowania zalecanej
farmakoterapii.
•
Definicja pojęcia adherence jest rozszeniem terminu compliance
i podkreśla ważność zgody pacjenta na leczenie i jego
akceptacji.
11

,
Wymagają monitorowania:
1.
produkty lecznicze , których przedawkowanie grozi zgonem
(np. digoksyna, cyklosporyna)
2. lub brakiem efektu leczniczego (niewydolność serca, odrzut
przeszczepu),
3.obecność generyku (czyli leku, który ma badanie BE) umożliwia
rozpoczęcie terapii tańszym – równie dobrym – produktem,
nie powinno się stosować tych leków wymiennie, zarówno
oryginalnego jak i generyku
12

,
Leki o wąskim przedziale terapeutycznym
digoksyna
klonazepa
m
wigabatryna
gabapentyna
felbamat
tiagabina
lewetiracetam
etosuksymid
cyklosporyna
lewotyroksyna
lit
prokainamid
fenytoina
teofilina
warfaryna
karbamazepina
lamotrygina
okskarbazepina
leki antyarytmiczne
13

,
Uwarunkowania zjawiska compliance/adherence
INDYWIDUALNE – zależne od pacjenta:
od osobowości (zapominanie, rozkojarzenie, nie przywiązywanie wagi do
leczenia)
od zdolności akceptacji choroby przewlekłej (brak akceptacji dla diagnozy
lekarskiej, brak objawów we wczesnych stadiach choroby)
od jego wcześniejszych doświadczeń (negatywne nastawienie do personelu
medycznego)
od sytuacji materialnej pacjenta
od innych schorzeń i przyjmowanych
leków ( duża liczba
obserwowanych działań niepożądanych)
od wiedzy na temat choroby, objawów, jej przebiegu, powikłań
14

,
Uwarunkowania zjawiska compliance/adherence
brak umiejętności prawidłowego zaaplikowania leku :
wynikające z błędnej interpretacji ulotki dla pacjenta
(nieumiejętność zastosowania leku
przeciwastmatycznego w postaci inhalatora
ciśnieniowego)
lub też z przyczyn związanych ze zdrowiem (problemy z
połykaniem, z rozgryzaniem tabletki)
15

,
Uwarunkowania zjawiska compliance
•
INDYWIDUALNE – zależne od lekarza
umiejętności komunikowania się z pacjentem
od motywacji i zaangażowania lekarza
od zakresu informacji udzielanej pacjentowi przez lekarza o
chorobie, sposobach zapobiegania i leczenia
od przedstawienia schematu kolejnych wizyt i sposobów kontaktu z
lekarzem prowadzącym oraz
ustalenia mierzalnych
sposobów oceny skuteczności leczenia
16

,
Uwarunkowania zjawiska compliance
•
ORGANIZACJA SŁUŻBY ZDROWIA:
zdecydowana przewaga leczenia specjalistycznego nad POZ
– terminowość wizyt
– dostępność do lekarza prowadzącego
z drugiej strony ograniczenia formalne
– limity narzucone przez NFZ
– ograniczona dostępność do badań diagnostycznych
17

,
Uwarunkowania zjawiska compliance
Inna uwarunkowania :
Forma farmaceutyczna/postać leku, droga podania
(alendronian – podanie cotygodniowej i comiesięcznej
dawki leku).
Liczba dawek podawana dziennie
18
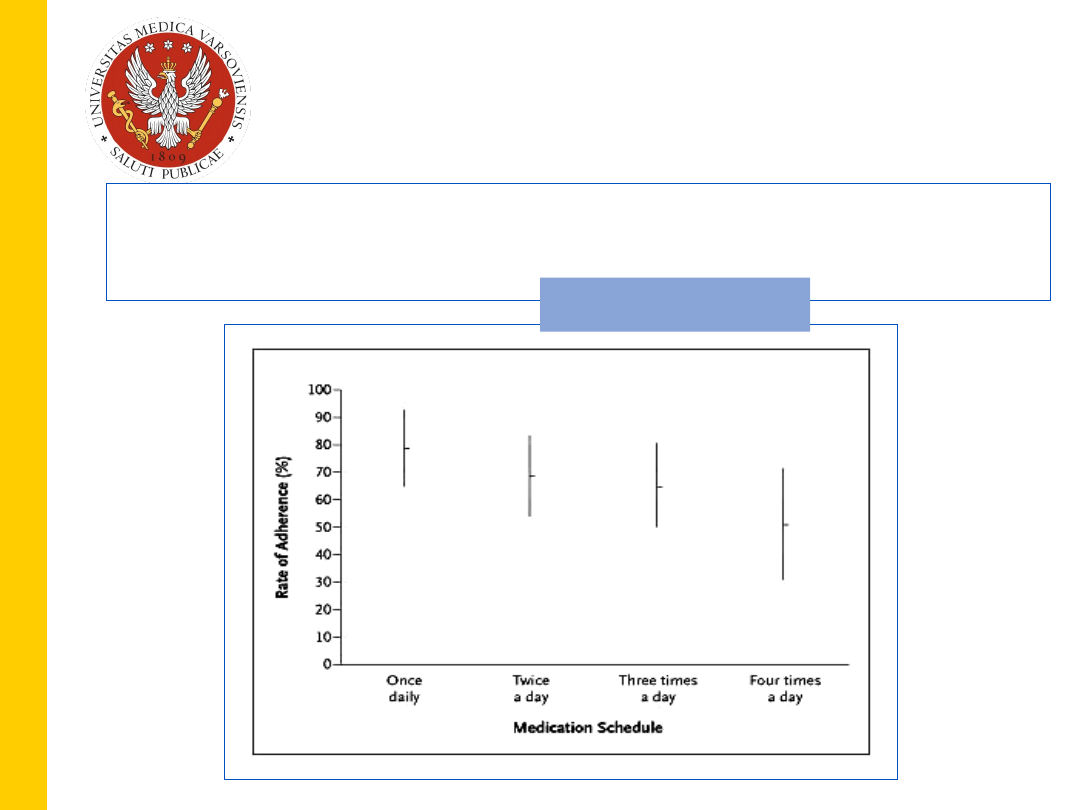
,
Liczba dawek podawanych dziennie
19
Osterberg & Blaschke
NEJM 2005

,
1 Bocuzzi i wsp., Osteopor Int 2005, 16: 129
2 Cramer i wsp., Curr Med. Res Opin 2005; 21: 1453
3 Zanchetta i wsp. Curr Ther Res Clin Exp 2004; 65: 470
4 Ettinger i wsp., J Managed Care Pharm. 1998; 4: 488
Stopień przerywania terapii narasta liniowo z czasem,
przy czym:
Największy odsetek pacjentów przerywa terapię w ciągu
pierwszych 3 miesięcy jej stosowania
Prawie połowa (46,1%) kończy leczenie przed upływem 10
miesięcy
20

,
Lee i wsp. JAMA 2006;296:2563
Chorzy z nadciśnieniem (65 lat):
•
przed interwencją – spadek compliance po 3 m-
cach do
40.5% (czyli o prawie 60%)
a po 6 m-
cach
do 32.7%
•
po interwencji – zarówno po 3 jak i 6 miesiącach
compliance wyższa od 80%
21
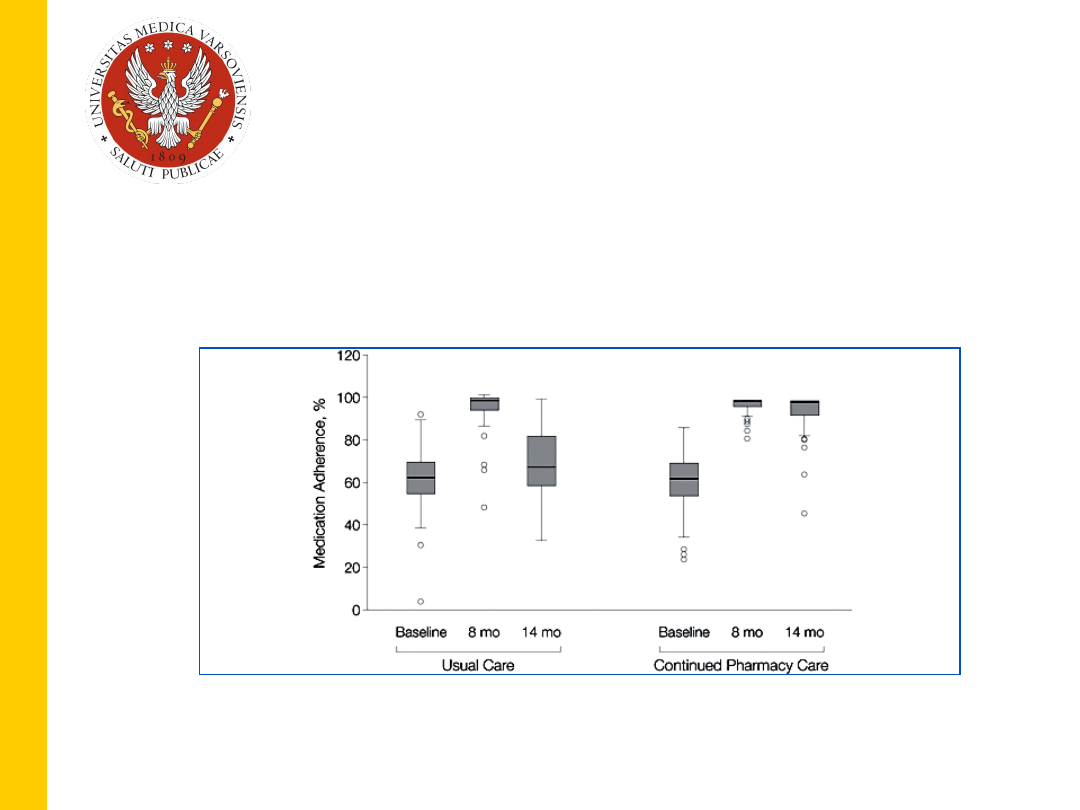
,
Wpływ opieki farmaceutycznej
22

,
Inne powody braku compliance
•
ujawniają się działania niepożądane
•
gdy leczenie jest skuteczne, gdy szybko
widoczne jest ustąpienie objawów (w przypadku
antybiotykoterapii, zwykle już po kilku dobach
pacjent czuje się dobrze i przerywa leczenie,
żeby „się więcej nie truć”
23

,
Koszty non compliance
Koszty pośrednie związane z dodatkowymi hospitalizacjami
•
oszacowano je w
USA
na 100 miliardów dolarów rocznie,
Wszystkie koszty bezpośrednio oraz pośrednio związane
z nieprzestrzeganiem zaleceń terapeutycznych na 290
miliardów dolarów rocznie.
Koszty świadczeń oraz leków w
Polsce,
z powodu
niestosowania się do zaleceń terapeutycznych, ok. 6 miliardów
złotych rocznie.
–
Jest to mniej więcej tyle, ile Narodowy Fundusz Zdrowia wydaje
rocznie na całą podstawową opiekę zdrowotną.
24

,
Kliniczne Monitorowanie terapii lekowej
•
Podstawowa zasad farmakoterapii, to istnienie związku
między farmakologicznym działaniem leku, a osiąganym
stężeniem leku we krwi
•
Różnice
fizjologiczne
i
patofizjologiczne
wymuszają
dostosowanie dawkowania do potrzeb indywidualnego
pacjenta
•
Najważniejsze parametry, decydujące o losach leku:
•
klirens – miara sprawności eliminacji leku
•
objętość dystrybucji – przestrzeń w organiźmie, w której
rozmieszczany jest lek
•
okres półtrwania
•
biodostępność – poziom leku znajdującego się w
krwioobiegu.
25

,
Monitorowanie terapii lekowej
•
Schemat czasowy działania leku odzwierciedla
zmiany stężenia leku określane przez
farmakokinetykę - wchłanianie, dystrybucję i
eliminację .
•
Intensywność działania leku jest związana z ze
stężeniem powyżej wartości minimalnego
stężenia efektywnego.
•
Czas działania leku, to czas w którym stężenie
jest wyższe od tej wartości
26
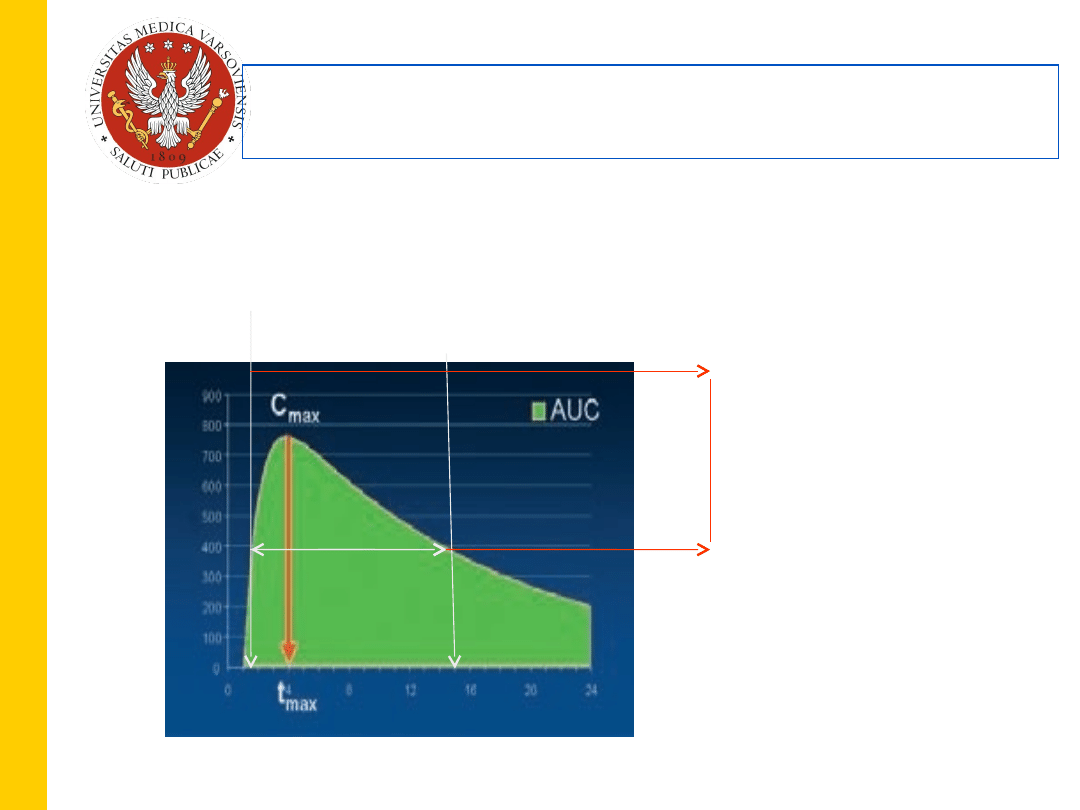
,
TDM – terapeutyczne monitorowanie leków –
optymalizacja dawkowania
27
Początek
działania
leku
Czas działania
Okno terapeutyczne
Mec dla działań niepożądanych
Mec dla działań pożądanych
Dolna
granica
zakresu
terapeutycznego = połowa max efektu
terapeutycznego
Mec – minimum effective concentration
Zakres górnej granicy to taka wartość stężenia leku,
przy którym 5-10% pacjentów odczuwa działania
toksyczne leku.
AUC- miara klirensu i biodostępności ( 100% dla leku podanego dożylnie)

,
Monitorowanie terapii lekowej
•
Pomiar stężenia leku w płynach ustrojowych jest elementem indywidualizacji
terapii względem wybranych leków
•
Pomiar jest skuteczny jeżeli są jasno określone kryteria :
1. istnieje udokumentowana zależność pomiędzy stężeniem leku w
osoczu, a pożądanym efektem terapeutycznym lub efektem toksycznym
( którego należy unikać)
2. zakres stężeń leku w osoczu, pomiędzy wartością konieczną do
uzyskania skuteczności, a wartością przy której występuje toksyczność u
danego pacjenta, nazywa się
oknem terapeutycznym
3. wahania stężenia w osoczu są na tyle duże, że stężenia nie można
przewidzieć tylko na podstawie dawki
4. lek wywołuje zamierzone lub niezamierzone efekty, które są trudne do
monitorowania
5. Indeks terapeutyczny jest niski, jeżeli stężenie konieczne do wywołania
efektu terapeutycznego jest bliskie stężeniu powodującemu toksyczność
28

,
Monitorowanie terapii lekowej
•
Celem terapeutycznym jest osiągnięcie i podtrzymanie
stężeń mieszczących się w oknie terapeutycznym dla
działań pożądanych i min. toksyczności.
•
Optymalizacja dawkowania:
•
częstość oraz stopień ilościowy zmiany dawki
I.
Zmiana dawki nie więcej niż o 50% i co trzy- lub czterokrotność
okresu półtrwania
II.
Leki o niskiej toksyczności dawki
i oczekiwanie maksymalnego
efektu działania - przekroczenie średniej oczekiwanej ilości
przedłuży czas ich działania np. penicyliny.
29
,
TDM – terapeutyczne monitorowanie leków –
optymalizacja dawkowania
•
Zwiększenie dawki leku = przedłuża czas
działania leku i zwiększa ryzyko DN
•
Penicyliny – lek nietoksyczny ; wydłużenie
czasu działania poprzez zwiększenie dawki
leku
30
Zwiększając dawkę
leku ?
Podając nową dawkę
leku ?
Strategia dawki maksymalnej

,
•
O ile lek nie jest toksyczny zwiększenie dawki
nie jest najlepszą strategią przedłużenia czasu
działania.
•
Podanie drugiej dawki leku w takim czasie aby
podtrzymać stężenie leku w zakresie okna
terapeutycznego – jest odpowiednią strategią
postępowania.
31

,
•
Dla wielu leków nie jest możliwe wskazanie zależności pomiędzy
stężeniem leku , a jego skutecznością lub toksycznością :
•
Badania kliniczne leków
p/depresyjnych
- duża liczba pacjentów
odpowiada na placebo
•
Trudno jest określić stężenie leku związane z jego skutecznością
•
Badania
digoksyny
– w oparciu o marker zastępczy wykazano, ze
stężenie 2ng/ml jest progowe dla toksyczności
•
Analiza retrospektywna badań klinicznych vs placebo u chorych z
niewydolnością serca wykazała , że 1,1 ng/ml powoduje zwiększone
ryzyko zgonu z przyczyn sercowych - istotne są dane kontrolowane
32
,
•
Krzywa zależności stężenie vs odpowiedzi terapeutycznej -
krzywa skuteczności i działań toksycznych.
•
Populacyjne okno terapeutyczne określa zakres stężeń, przy
którym prawdopodobieństwo skuteczności jest wysokie, a
prawdopodobieństwo DN niskie.
•
Nie jest ono gwarancją ani skuteczności ani bezpieczeństwa
•
Niezbędne jest monitorowanie klinicznych lub zastępczych
markerów działania leku np. elektrokardiograficzna arytmia
komorowa - marker zastępczy dla digoksyny.
33

,
TDM – terapeutyczne monitorowanie leków – optymalizacja
dawkowania leków stosowanych przewlekle
•
Leki o wąskim indeksie terapeutycznym stosowane
profilaktycznie
–
potencjalne
niebezpieczeństwo
toksyczność /nieskuteczność
•
Dawkowanie ograniczone przez
toksyczność
•
Celem terapeutycznym jest osiągniecie stanu stacjonarnego,
który mieści się w oknie terapeutycznym.
•
Skuteczność i toksyczność leku zależą od stężenia leku,
które jest uwarunkowane wielkością dawki oraz częstością
jej podania.
34

,
Przypadek I. Stosujemy leki o wąskim
indeksie terapeutycznym ( digoksyna,
teofilina,
lidokaina,
aminoglikozydy,
cyklosporyna,
warfaryna,
leki
p/padaczkowe)
Różnica pomiędzy stężeniem skutecznym i toksycznym jest mała (2-
3x)
Określono zakres stężeń w osoczu związany z efektywna terapią
( 1,65 ng/ml)
Wybór terapii opartej na strategii stężenia docelowego ( target –
level), min. toksyczności , max skuteczności
Jakie powinny być dawki podtrzymujące – szybkość podawania leku
i dawka podawana?
oznaczamy max i min.
•
stężenia w okresie pomiędzy dawkami (1,90 i 1,44 ng/ml) - dawka w
wyższej części okna terapeutycznego – działania toksyczne (podawanie
dawki 375 mg co 24h)
•
stężenia w okresie pomiędzy dawkami ( max. 1,26 ng/ml i min. 0,96
ng/ml) – dawka w stanie stacjonarnym wyniesie 1,10 ng/ml ( podawanie
0,250 mg co 24 h.).
35

,
Przypadek II.
Stosujemy lek względnie
nietoksyczny
•
Stosujemy strategie dawki maksymalnej
•
Czas między podaniami może być znaczenie dłuższy niż okres półtrwania.
•
okres półtrwania amoksycyliny – 2h
•
zażywanie leku co 2 h jest niepraktyczne
•
praktykowane podawanie dużych dawek co 8-12 h.
36

,
TDM – terapeutyczne monitorowanie leków – optymalizacja
dawkowania
•
W przypadku niektórych leków efekty działania można łatwo
zmierzyć np.
•
ciśnienie krwi,
•
stężenie cukru we krwi,
•
obwód kończyny dolnej,
•
pomiar stężenia cholesterolu i triglicerydów we krwi –
optymalizacja dawkowania metodą prób i błędów
•
Terapia monitorowana – dążenie do obliczenia rzeczywistej
dawki
podtrzymującej
w
celu
osiągnięcia
efektu
terapeutycznego.
•
Współpraca pacjenta –
compliance /adherence
37

,
TDM- kortykoidów wziewnych
•
Leki inhalacyjne dostarczane są do płuc w formie aerozolu
•
Podanie leku następuje do miejsca jego działania w układzie oddechowym
•
Ograniczenia wynikają z trudnej do przewidzenia skuteczności dawki
terapeutycznej
•
Aerozol powstający w inhalatorze charakteryzuje się pewnym rozkładem
wielkości cząstek; najbardziej pożądane – cząstki poniżej 5 µm ( poniżej 3
µm)
•
Cząstek aerozolu dostarcza :
•
Nebulizowany roztwór
•
Dozy roztworu z inhalatora ciśnieniowego
38

,
•
Utrata efektywnej dawki leku w postaci aerozlu związana jest z :
depozycja w jamie ustnej, gardle, oraz w ustniku inhalatora
•
DPI
– inhalator proszkowy; proszek dostarczany z kapsułki, tabletki
lub rezerwuaru posiada zróżnicowane właściwości fizyczne
wpływające na stopień rozproszenia: czyli de-agregacji proszku
•
Konstrukcja komory aerolizacji
•
Opory przepływu powietrza
•
Lek-nośnik laktozowy
–
Właściwości powierzchniowe cząstek
–
Wielkość ziaren laktozy
39

,
PF- Pirośluzan flutikazonu
•
CNG
- cyklohaler nowej generacji – umożliwia
dostarczenie do płuc analogicznej masy PF przy
dwukrotnie mniejszej dawce nominalnej ( w
porównaniu do DPI)
•
Drobne cząstki generowane przez DPI – ok.23%
dawki
•
Drobne cząstki generowane przez CNG – ok.45%
dawki.
40

,
•
Istotne elementy aerozolo- terapii:
•
Powtarzalność emisji dozy
leku oraz
masa cząstek
drobnych <
5µm , 3 µm
•
Można wnioskować, że zmniejszenie skutecznej dawki leku do
50% jest istotne klinicznie , ze względu na
zmniejszenie częstości
powikłań
po stosowaniu steroidu wziewnego.
•
Brak badań klinicznych porównawczych
DPI i CNG
potwierdzających możliwość zamiennego stosowania PF w
różnych inhalatorach.
•
Badanie in vitro z zastosowaniem Impaktora Andersena (Ph.Eur.)
jest niewystarczające do bezpiecznego zastosowania u pacjenta
41

,
(
Ciclosporinum) 25 mg cyklosporyny
4.1 Wskazania do stosowania
•
Przeszczepianie
•
Przeszczepianie narządów miąższowych
•
Zapobieganie odrzucaniu przeszczepu u pacjentów, którzy otrzymali
allogeniczny przeszczep nerki, wątroby, serca, serca i płuc, płuc lub trzustki.
•
Leczenie odrzucania przeszczepu u pacjentów uprzednio otrzymujących
inne leki immunosupresyjne.
•
Przeszczepianie szpiku
•
Zapobieganie odrzucaniu przeszczepu po transplantacji szpiku.
•
Zapobieganie lub leczenie choroby przeszczep przeciw gospodarzowi (ang.
graft-versus-host disease - GVHD).
42

,
Ciclosporinum) 25 mg
cyklosporyny
Wskazania pozatransplantacyjne:
Choroby o pdłożu autoimmunologicznym:
Endogenne zapalenie błony naczyniowej oka
Zespół nerczycowy
Reumatoidalne zapalenie stawów
Łuszczyca
Atopowe zapalenie skóry
43

,
•
Sposób podania
•
Podany zakres dawek ma służyć tylko jako ogólna wytyczna.
Wymaga się rutynowego monitorowania stężenia cyklosporyny we
krwi np. stosując do oznaczania cyklosporyny metodę
radioimmunologiczną z użyciem przeciwciał monoklonalnych.
Otrzymane wyniki służą do określenia rzeczywistej dawki,
koniecznej do osiągnięcia wymaganych stężeń docelowych u
poszczególnych pacjentów.
44

,
Kliniczne monitorowanie farmakoterapii
Neurotoksyczne powikłania
cyklosporyny
Cyklsporyna :
powikłania – toksyczność narządowa ( nefro- i
hepatotoksyczność), cukrzyca, nadciśnienie,
neurotoksyczność
czynniki ryzyka – nadciśnienie tętnicze,
hipocholesterolemia, hipomagnezemia,
niewydolność naczyń mózgowych
45

,
Mechanizm działania cyklosporyny - interakcje,
metabolizm
mechanizm działania cyklosporyny - hamowanie aktywności
kalcineuryny, która przyczynia się do transkrypcji interleukiny 2 –
proliferacja i aktywacja limfocytów T.
Efekt działania CsA- hamowanie
aktywności limfocytów T – pomocniczych i cytotoksycznych oraz
promowanie komórek supresorowych
.
metabolizm –
CYP3A4
; N-demetylacja, hydroksylacja, sulfatacja,
glukuronizacja w wątrobie i jelicie cienkim ( efekt pierwszego
przejścia i krążenie wątrobo-jelitowe)
nasilają aktywność enzymu: endogenne steroidy (testosteron,
progesteron, kortyzol, estradiol) i egzogenne ( glikokortykosteroidy,
fenobarbital, fenytoina, rimfapicyna)
zmniejszają aktywność enzymu – leki p/grzybicze -imidazole,
antybiotyki makrolidowe, werapamil, diltiazem
46

,
Kliniczne monitorowanie farmakoterapii
cyklosporyną - zmienność osobnicza
•
Międzyosobnicza zmienność stężenia CsA po doustnym podaniu leku:
- różnice w
wątrobowym stężeniu CYP3A4
– zmienność klirensu do 66%
-
różnice w jelitowym stężeniu CYP3A4
-
jelitowa glikoproteina P ( p-gP),
zależna od genu oporności wielolekowej
MDR1 – wpływ na farmakokinetykę CsA ; rezultaty : ok. 30 % różnice w
zakresie stężenia leku we krwi, 17% różnice w klirensie.
-
Zmienność osobnicza powoduje trudności w ustaleniu optymalnej dawki
oraz monitorowaniu leku
-
Niewystarczające jest - pomiar stężenia na czczo C-0 i 2 godziny po
przyjęciu dawki leku C-2
-
Należy monitorować pole pod krzywą AUC zmiany stężenia leku
w czasie
47

,
Monitorowanie terapii - działań niepożądanych
cyklosporyny
Powikłania cyklosporyny:
neurotoksyczność, nefrotoksyczność, hepatotoksyczność,
indukowanie cukrzycy, nadciśnienia tętniczego
neurotoksyczność – OUN i obwodowy :
drżenia, niedowład kończyn dolnych, splątanie i
depresja,
padaczka, ślepota korowa, ból głowy, wzrost
ciśnienia krwi.
Objawy neurologiczne poprzedzone są bólami głowy i
wzrostem ciśnienia tętniczego krwi.
48

,
Kliniczne objawy neurotoksyczności – przyczyny i
postępowanie
Drżenia
Uogólnione i
łagodne
Spowodowane
wysokim i/lub
terapeutycznym
poziomem CsA
Redukcja dawki nie
jest bezwzględnie
konieczna
Odwracalna, tylna
encefalopatia
Bóle głowy,
zaburzenia
osobowości ,
padaczka, ślepota
korowa ; zmiany
radiologiczne półkul
mózgowych
Czynnikiem
sprzyjającym
rozwojowi zespołu
jest nadciśnienie
tętnicze
Leczenie
hipotensyjne oraz
redukcja
dawki/odstawienie
przejściowe -
obserwowane
zmiany
radiologiczne
Encefalopatia
Łagodna (30%)
Pobudzenie,
niepokój ,
bezsenność
Sprzyja nadciśnienie
tętnicze i wysokie
stężenie leku
Redukcja
dawki/odstawienie ;
wyrównanie
ciśnienia tętniczego
Bóle głowy
Przemijajace i
łagodne (ok.37%
pacjentów )
Wzoaktywne
właściwości CsA
Zależna od dawki/
redukcja dawki
49

,
Podsumowanie klinicznego monitorowania CsA
•
Nie stwierdzono zależności pomiędzy stężeniem CsA w surowicy, a ciężkością
i częstością występowania objawów neurotoksycznych
•
Pomiar stężenia leku na czczo i po 2 godzinach od podania nie daje
informacji na temat farmakokinetyki leku u danego pacjenta – wymagane
jest monitorowanie pola pod krzywa AUC w czasie oraz dane na temat
stężenia CsA w płynie mózgowo-rdzeniowym
•
Wymagane jest ścisłe monitorowanie ciśnienia tętniczego, czynności nerek i
wątroby, oznaczenie lipidów oraz potasu i magnezu, kreatyniny,
•
Wymagana jest monitorowanie i analiza czynników ryzyka ( wysokie stężenie
kwasu moczowego u pacjenta)
•
Zmniejszenie dawki/utrzymanie mniejszego stężenia leku w surowicy lub
przejściowe odstawienie leku zmniejsza objawy neurotoksyczne
50

,
SPC
Ciclosporinum
•
Sposób podania
•
Podany zakres dawek ma służyć tylko jako ogólna wytyczna.
•
Wymaga się rutynowego monitorowania stężenia
cyklosporyny we krwi np. stosując do oznaczania
cyklosporyny metodę radioimmunologiczną z użyciem
przeciwciał monoklonalnych.
•
Otrzymane wyniki służą do określenia rzeczywistej dawki,
koniecznej do osiągnięcia wymaganych stężeń docelowych u
poszczególnych pacjentów
.
51

,
•
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące
stosowania
•
Produkt leczniczy Sandimmun Neoral:
•
1. może być przepisywany tylko przez lekarzy mających doświadczenie w
leczeniu immunosupresyjnym, którzy mogą zapewnić właściwą
obserwację podczas leczenia, łącznie z regularnym pełnym badaniem
lekarskim, pomiarem ciśnienia tętniczego krwi i kontrolą laboratoryjnych
parametrów na podstawie, których określa się bezpieczeństwo
stosowania.
•
2. Pacjenci po transplantacji powinni być w okresie leczenia cyklosporyną
prowadzeni przez ośrodki mające możliwość wykonania odpowiednich
badań laboratoryjnych oraz zapewnienia odpowiedniej interwencji
medycznej. Lekarz odpowiedzialny za leczenie podtrzymujące powinien
otrzymać pełną informację potrzebną do obserwacji pooperacyjnej.
52

,
Monitorowanie powikłań po stosowaniu
cycklosporyny (SPC)
•
Cyklosporyna zwiększa ryzyko rozwoju chłoniaków i innych
nowotworów złośliwych, szczególnie nowotworów skóry. Mogą one
prowadzić do rozwoju chorób limfoproliferacyjnych i nowotworów
narządów miąższowych. W niektórych przypadkach zakończyły się one
zgonem.
•
Cyklosporyna zwiększa ryzyko rozwoju różnych zakażeń bakteryjnych,
grzybiczych, pasożytniczych i wirusowych. Często są one wywoływane
przez drobnoustroje oportunistyczne. Takie zakażenia mogą być ciężkie
i (lub) prowadzić do zgonu pacjenta. Należy zastosować skuteczne
metody zapobiegawcze i lecznicze, szczególnie u pacjentów, u których
stosuje się długotrwale wielolekową immunosupresję.
•
Częstym i potencjalnie ciężkim powikłaniem w pierwszych kilku
tygodniach leczenia produktem leczniczym Sandimmun Neoral może
być zwiększenie stężenia mocznika i kreatyniny w surowicy.
Wymienione zmiany czynnościowe są zależne od dawki i przemijające.
Ustępują zwykle po zmniejszeniu dawki.
53

,
Monitorowanie powikłań po stosowaniu cycklosporyny (SPC)
•
W czasie długotrwałego leczenia, u niektórych pacjentów mogą
wystąpić zmiany strukturalne w nerkach (np. zwłóknienie
śródmiąższowe), które u biorców przeszczepów nerkowych należy
odróżniać od zmian wywoływanych przez przewlekłą reakcję
odrzucania.
•
Produkt leczniczy Sandimmun Neoral może także powodować
zależne od dawki i przemijające zwiększenie stężenia bilirubiny w
surowicy, a niekiedy też aktywności enzymów wątrobowych
•
Po wprowadzeniu produktu leczniczego do obrotu, zgłaszano
raporty dotyczące toksycznego działania na wątrobę i uszkodzenia
wątroby, w tym cholestazę, żółtaczkę, zapalenie oraz
niewydolność wątroby, u pacjentów leczonych cyklosporyną
54

,
SPC
Ciclosporinum
Stosowanie u pacjentów w podeszłym wieku
•
Doświadczenie w stosowaniu produktu leczniczego Sandimmun
Neoral u pacjentów w podeszłym wieku jest ograniczone, jednakże
nie zgłaszano żadnych szczególnych problemów, gdy stosowano
produkt w zalecanych dawkach.
•
W badaniach klinicznych z udziałem pacjentów z reumatoidalnym
zapaleniem stawów przyjmujących cyklosporynę, 17,5% stanowili
pacjenci w wieku co najmniej 65 lat.
•
U tych pacjentów obserwowano większą skłonność do
występowania:
•
nadciśnienia skurczowego
w czasie trwania terapii oraz
•
do
zwiększenia stężenia kreatyniny
w surowicy do wartości
ok.50% powyżej wartości wyjściowych po 3 do 4 miesiącach
leczenia.
55

,
SPC
Ciclosporinum
•
W badaniach klinicznych produktu leczniczego Sandimmun Neoral
podawanego pacjentom po przeszczepieniu oraz chorym z
łuszczycą udział pacjentów w wieku co najmniej 65 lat był zbyt
mały, by stwierdzić czy ich odpowiedź na leczenie różni się od
odpowiedzi pacjentów młodszych. W innych opisywanych
doświadczeniach klinicznych nie stwierdzono różnic pomiędzy
pacjentami młodszymi a chorymi w podeszłym wieku.
•
Należy zawsze zachować ostrożność ustalając dawkę dla osób w
wieku podeszłym, zazwyczaj zaczynając od dawek z dolnego
zakresu terapeutycznego, ze względu na częstsze występowanie
zaburzeń czynności wątroby, nerek i serca, a także chorób
współistniejących i konieczności przyjmowania innych leków
56

,
Monitorowanie terapii w ZZW
•
Końcowy przejaw zaburzeń i efektów enzymatycznych,
jelitowej niewydolności absorpcyjnej, prowadzącej do
upośledzenia transportu substancji pokarmowych do przez
błonę śluzową jelita
•
Pełny ZZW – związany z upośledzonym wchłanianiem
większości lub wszystkich składników pokarmowych
•
Niepełny ZZW – nieprawidłowe wchłanianie określonego
składnika
•
Zmiana powierzchni wchłania po resekcji jelita cienkiego
Uwaga leki o
przedłużonym
uwalnianiu

,
Monitorowanie terapii w ZZW
•
Zespół złego wchłaniania spowodowany zaburzeniami
budowy i czynności żołądka i jelita cienkiego ,cechuje
:
1.wpływ na farmakokinetykę leków
2.odmiennych
od
oczekiwanych
efektów
terapeutycznych
3. odmiennych działań niepożądanych i toksyczności
Towarzyszy ZZW – biegunka o zróżnicowanym nasileniu
58

,
Monitorowanie terapii w ZZW
•
Konsekwencje
interakcji lekowych
w tej grupie chorych są
poważniejsze
•
Szczególne istotne interakcje z lekami :
•
O dużej powierzchni wchłaniania
•
Zmieniające pH
•
Chelatujące
•
Zmieniające perystaltykę pp
•
Modyfikujące białka transportowe – glikoproteina P
•
Zmieniające skład jakościowy i ilościowy flory bakteryjnej
•
Modyfikujące aktywność enzymów jelitowych odpowiedzialnych za
metobolizm I przejścia
59

,
Monitorowanie terapii w ZZW
•
Leczenie chirurgiczne patologicznej otyłości
polegające na wyłączeniu dwunastnicy z pasażu
treści pokarmowej efekty:
•
powoduje niedokrwistość,
•
niedobory mikroelementów,
•
niedobory witam A i E,
•
zaburzenia wchłaniania cynku, kwasu foliowego i witaminy B12 .
60

,
Farmakoterapia zindywidualizowana w ZZW
•
Wybór postaci farmaceutycznej z uwzględnieniem alternatywnych
dróg podania ; dodobytnicze , przezskórne, podpoliczkowe,
podjezykowe, wziewne, parenteralne
•
Monitorowanie leczenia za pomocą parametrów klinicznych i
laboratoryjnych – w tym pomiaru stężenia leku we krwi i
indywidualnego dawkowania
•
Dla leków NTI
•
Jeżeli występuje ścisły związek miedzy stężeniem i działaniem
Naturalny przebieg choroby podlega znacznym wahaniom i utrudnia ocenę
działania leczniczego
Objawy przedawkowania trudno odróżnić od objawów choroby
61

,
Farmakoterapia zindywidualizowana w ZZW
•
monitorowanie leczenia przy użyciu wskaźników klinicznych (np.
RR) lub laboratoryjnych (np. INR) oraz
•
zwracanie uwagi na możliwe wystąpienia działañ niepożądanych.
62

,
350 mg Theophyllinum (teofiliny).
4.1 Wskazania do stosowania
•
Leczenie i zapobieganie skurczom oskrzeli w przewlekłych chorobach układu
oddechowego, takich jak:
•
astma oskrzelowa, przewlekła obturacyjna choroba płuc (przewlekłe zapalenie
oskrzeli, rozedma płuc).
4.2 Dawkowanie i sposób podawania
•
Zalecenia ogólne
•
Dawkę teofiliny należy dobierać indywidualnie uwzględniając skuteczność działania
produktu i tolerowanie leku przez pacjenta. Dawkowanie najlepiej jest ustalać po
oznaczeniu stężenia teofiliny w osoczu (zakres stężeń terapeutycznych: 8 - 20 μg/ml).
Dobowa dawka podtrzymująca teofiliny u dorosłych wynosi około 11 do 13 mg/kg mc.
•
Monitorowanie stężenia teofiliny w osoczu jest wskazane zwłaszcza w przypadku
wystąpienia działań niepożądanych lub niewystarczającej odpowiedzi na leczenie.
•
Dawkę należy obliczyć na podstawie beztłuszczowej masy ciała, ponieważ teofilina
nie przenika do tkanki tłuszczowej.
•
W razie zmiany preparatu teofiliny na inny preparat teofiliny należy monitorować
terapię, kontrolując stężenie teofiliny w surowicy.
63

,
Stosowanie teofiliny u palaczy
•
Palaczom należy podawać odpowiednio większą dawkę teofiliny z uwzględnieniem
masy ciała z powodu szybszego wydalania teofiliny.
Eliminacja
U osób dorosłych okres półtrwania teofiliny wynosi około 7,7 h. U osób palących okres półtrwania
jest skrócony do około 5,5 h.
•
Należy zachować szczególną ostrożność podczas dobierania dawki u osób palących,
które są w trakcie rzucania palenia, ponieważ stężenie teofiliny w osoczu jest u nich
zwiększone w porównaniu z osobami niepalącymi.
•
Nikotyna - Indukcja CYP 450 -1A1, 1A2,
2E1
•
Przyspieszenie i nasilenie biotransformacji leków będących substratami dla tych
enzymów
•
Teofilina jest metabolizowana w wątrobie do nieczynnych metabolitów przez
izoenzymy cytochromu P-450: 1A2, 3A3
i 2E1.
64

,
•
Na ogół wydalanie teofiliny przebiega wolniej u pacjentów:
•
z niewydolnością serca,
•
ciężkim niedotlenieniem,
•
przewlekłą obturacyjną chorobą płuc, zapaleniem płuc, ostrym obrzękiem
płuc,
•
zakażeniami wirusowymi (zwłaszcza grypa), gorączką niepoddającą się
leczeniu, u osób w podeszłym wieku oraz
•
u pacjentów przyjmujących równocześnie niektóre leki (patrz punkt 4.5)
oraz
•
po spożyciu większych ilości alkoholu.
Dlatego też tacy pacjenci wymagają zastosowania mniejszych dawek teofiliny
oraz zachowania szczególnej ostrożności przy podejmowaniu decyzji o
zwiększeniu stosowanej dawki.
•
Informowano też o zmniejszeniu wydalania teofiliny po szczepieniu przeciw
grypie i gruźlicy.
•
W takich przypadkach może być konieczne zmniejszenie dawki.
65

,
•
Zaburzenia czynności wątroby lub nerek
•
Bardzo często u pacjentów z zaburzeniami czynności wątroby wydalanie teofiliny jest wolniejsze.
•
U pacjentów z ciężkimi zaburzeniami czynności nerek może dojść do kumulacji metabolitów
teofiliny.
•
Dlatego u tych pacjentów należy stosować mniejsze dawki i zachować szczególną ostrożność
podczas zwiększania dawkowania.
66

,
Należy stale monitorować stężenie teofiliny we krwi u
pacjentów:
•
z niewydolnością krążenia (w zastoinowej niewydolności serca),
•
w przypadku alkoholizmu,
•
w niewydolności wątroby,
•
w przypadku infekcji wirusowych, ponieważ w wymienionych sytuacjach możliwe
jest zmniejszenie klirensu teofiliny,
- doprowadzić do nadmiernego zwiększenia stężenia leku w osoczu
Monitorowania wymagają : osoby starsze i kobiety ciężarne oraz dzieci.
67

,
Warfaryna
3 mg tabletki: jedna tabletka zawiera 3 mg warfaryny sodowej (Warfarinum
natricum).
5 mg tabletki: jedna tabletka zawiera 5 mg warfaryny sodowej (Warfarinum
natricum).
•
4.1 Wskazania do stosowania
•
Leczenie i zapobieganie zakrzepicy żył głębokich i zatorowości
płucnej.
•
Wtórne zapobieganie zawałowi mięśnia sercowego i zapobieganie
powikłaniom zakrzepowo-zatorowym (udar lub zator w krążeniu
obwodowym) po zawale mięśnia sercowego.
•
Zapobieganie powikłaniom zakrzepowo-zatorowym (udar lub zator w
krążeniu obwodowym) u pacjentów z migotaniem przedsionków, z
patologią zastawek lub po protezowaniu zastawek serca.
68

,
•
4.2 Dawkowanie i sposób podawania
•
Docelowy zakres wartości INR (znormalizowany wskaźnik
aktywności protrombiny [ang. International Normalized Ratio])
podczas doustnego leczenia przeciwzakrzepowego:
•
Zapobieganie powikłaniom zakrzepowo-zatorowym u
pacjentów po protezowaniu zastawek serca: INR 2,5 - 3,5.
•
Inne wskazania: INR 2,0 - 3,0.
•
Pomiaru wskaźnika dokonuje się codziennie do czasu
uzyskania stabilnej wartości docelowej ( ok.5-6 dni) terapii
warfaryną , a następnie co 4 tygodnie
69

,
•
W schorzeniach wątroby
,
zaburzeniach wchłaniania
witaminy K, w przypadku dołączania nowych
leków, odstawienia leków dotychczas stosowanych
- wymaga nowej kontroli INR
•
Planowana operacja – wymaga odstawienia
warfaryny na podstawie INR.
70

,
Terapia monitorowana
•
Korzyści monitorowania terapii udowodniona dla leczenia :
•
Lekami p/ padaczkowymi ( fenytoiną )
•
Solami litu
•
Teofiliną
•
Cyklosporyną
•
Chemioterapeutykami (aminoglikozydy, chloramfenikol,
flucytozyna)
•
Wyniki niejednoznaczne uzyskano dla terapii :
•
Lekami antyarytmicznymi
•
Digoksyną
71

,
Posumowanie
•
Pomiar stężenia leku w osoczu pozostaje
najdokładniejsza metodą monitorowania terapii
w szczególnych sytuacjach klinicznych
72
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
- Slide 68
- Slide 69
- Slide 70
- Slide 71
- Slide 72
Wyszukiwarka
Podobne podstrony:
test 2009 farma kliniczna, 5 ROK, FARMAKOLOGIA KLINICZNA
Farma kliniczna, ZDROWIE, FARMAKOLOGIA
Farma kliniczna wyklady farmako Nieznany
Lekarski farmakologia kliniczna,definicja1
Farmakoterapia monitorowana materialy 2012
farma kliniczna- pytania, Medycyna, Pobr materiały, V rok UMB-2015-09-30, V rok UMB, Farmakologia Kl
Seminarium 1 - Farmakoterapia bolu, 5 ROK, FARMAKOLOGIA KLINICZNA
farma.test 1, 6 rok, Farmakologia kliniczna, giełda
wyniki gr. C, 5 ROK, FARMAKOLOGIA KLINICZNA
farmakologia kliniczna 2010, MEDYCYNA - ŚUM Katowice, V ROK, Farmakologia kliniczna
Farmakologia kliniczna
farma wstrzas, Medycyna, Pobr materiały, V rok UMB-2015-09-30, V rok UMB, Farmakologia Kliniczna
Farmakoterapia monitorowana wyklad dla studentow
Farmakoterapia monitorowana
więcej podobnych podstron