
Transaminacja - znaczenie
procesu, znaczenie
kliniczne transaminaz.
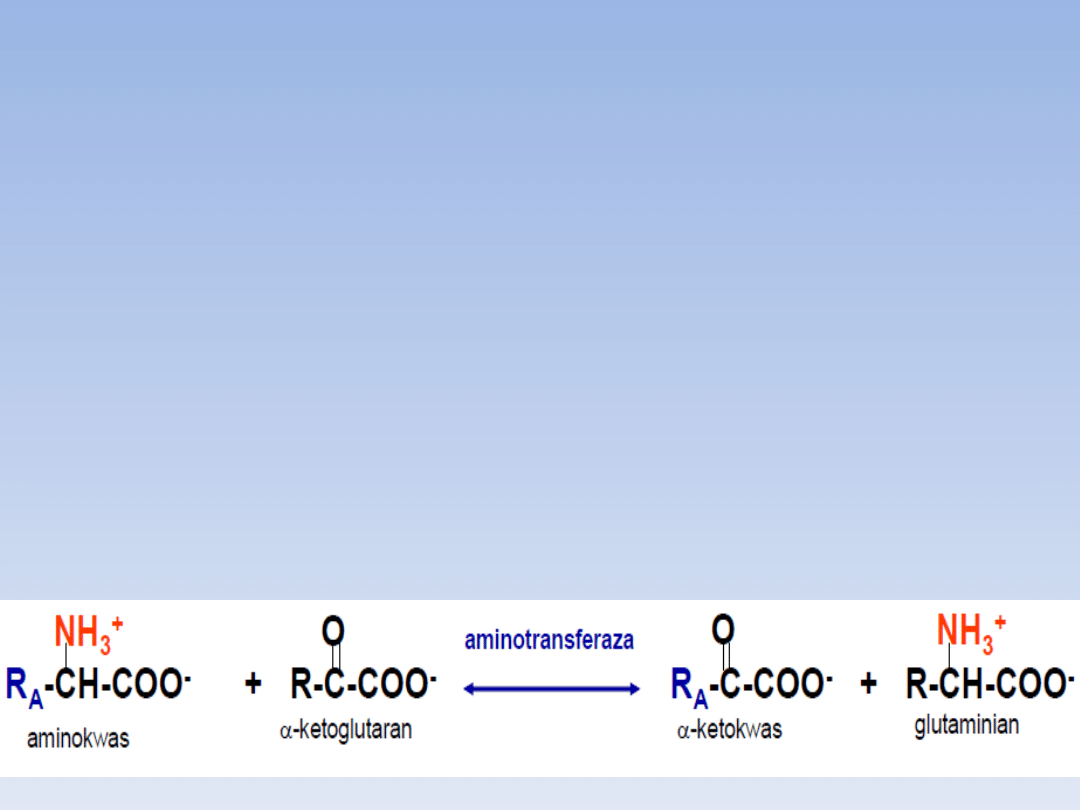
• TRANSAMINACJA:
- przenoszenie grupy aminowej ; donorem
α-aminokwas; akceptorem α-
ketokwas(pirogronian, szczawiooctan, α-
ketoglutaran- uniwersalny akceptor)
- reakcja odwracalna
- koenzymem fosforan pirydoksalu(wit.
B6)
- katalizowane przez aminotransferazy
- bezpośredniej transaminacji nie
ulegają: prolina, treonina, lizyna

• Prolina:
- prolina dehydroprolina γ-
semialdehyd glutaminianu
glutaminian α-ketoglutaran
TRANSAMINACJA POŚREDNIO
POPRZEZ GLUTAMINIAN !
• Treonina :
- transaminacja pośrednio poprzez
glicynę
• Lizyna:
- transaminacja pośrednio poprzez kwas
α-aminoadypinowy

Transaminacja w przemianach
poszczególnych aminokwasów:
• Tryptofan:
- transaminacja prowadzi do powstania
kwasu indolopropionowego
• Fenyloalanina:
- 3-4 miesiąc życia u chorych na
fenyloketonurię - uaktywnienie toru
metabolicznego prowadzącego do
transaminacji fenyloalaniny do kwasu
fenylopirogronowego.
- fenyloalanina kwas
fenylopirogronowy kwas
fenylomlekowy = mysi zapach moczu

• Tyrozyna:
- transaminacja – aminotransferaza tyrozynowa:
tyrozyna p-hydroksyfenylopirogronian
- Tyrozynemia typu II (zespół Richnera-Hanharta):
-> brak lub niedobór cytozolowej aminotransferazy
tyrozynowej
->postać oczno-skórna
-> akumulacja tyrozyny i uruchomienie
alternatywnych szlaków jej przemian: N-acetylacji,
dekarboksylacji
->w moczu zwiększone ilości produktów tych
alternatywnych szlaków: tyraminy i n-acetylotyrozyny
-> podwyższone stężenie tyrozyny w osoczu;
występują tu również: p-hydroksyfenylopirogronian,
p-hydroksyfenylomleczan, p-hydroksyfenylooctan, N-
acetylotyrozyna, tyramina
->objawy:
- uszkodzenie skóry i wzroku
- opóźnienie rozwoju umysłowego

• Seryna
- może powstawać z metabolitu glikolizy:
3-fosfoglicerynian
utlenienie
3-fosfohydroksypirogronian
transaminacja
3-fosfoseryna
hydroliza, fosfataza
seryna

• Arginina, ornityna:
- pod wpływem arginazy – enzymu cyklu
mocznikowego, arginina rozpada się na
mocznik i ornitynę
- ornityna ulega transaminacji z
wytworzeniem γ-semialdehydu
glutaminianu, który jest utleniany do kwasu
glutaminowego i następuje ponowna
transaminacja do α-ketoglutaranu
-defekty w przemianie argininy i ornityny:
->zakrętowy zanik siatkówki:
-defekt δ-transaminazy ornitynowej
- podwyższone stężenie ornityny w
osoczu
- występuje postępujące zwyrodnienie
siatkówkowo-naczyniowe z widzeniem
tunelowym, aż do całkowitej ślepoty

• Cysteina:
- dwa tory przemian cysteiny w pirogronian:
->w procesie bezpośredniego utleniania powstaje
cysteinylosulfinian który transaminowany jest do
β-sulfinylo-pirogronianu
- >bezpośrednia transaminacja do 3-
merkaptopirogronianu katalizowana jest przez
aminotransferazę cysteinową, aminotransferazę
glutaminianową lub asparaginianową
• Histydyna:
- w histydynemii brak enzymu histydynazy
- zahamowanie wzrostu
- opóźnienie rozwoju umysłowego, wady wymowy
- w schorzeniu uruchomiony alternatywny szlak
przekształceń histydyny:
- histydyna transaminowana do
imidazolopirogronianu,
- imidazolopirogronian dekarboksylowany z
utworzeniem imidazolooctanu
- w moczu dużo imidazolopirogronianu i
imidazolooctanu

• Glicyna:
- transaminacja z ketoglutaranem
prowadzi do powstania kwasu
glioksalowego i kwasu glutaminowego
- powstawanie z glikosalanu, który ulega
transaminacji z alaniną lub
glutaminianem

• Walina, leucyna, izoleucyna:
- odwracalna transaminacja w cytozolu –
aminotransferaza swoista dla Leu i Ile, osobny
enzym dla Wal -> powstają α-ketokwasy
- transaminacja leucyny: powstaje alfa-
ketoizokapronian - cytozol
- transaminacja izoleucyny: powstaje alfa-keto-
beta-metylowalerian
- transaminacja waliny z alfa-ketoglutaranem:
powstaje alfa-ketoizowalerian; po szeregu
przemian powstaje semialdehyd metylomalonowy
który w wyniku transaminacji przekształcany
jest w beta-aminoizomaślan
Choroba „moczu o zapachu syropu klonowego”:
- defekt dehydrogenazy rozgałęzionych
aminokwasów,
- ketoanalogi leucyny i izoleucyny hamują
aminotransferazę alaninową, co zwiększa
stężenie alaniny we krwi

• Kwas glutaminowy
- aminotransferaza glutaminowa,
przenosi grupę aminową z różnych
aminokwasów na α-ketoglutaran z
wytworzeniem glutaminianu i α-
ketokwasu
-w wyniku dekarboksylacji powstaje GABA
którego transaminacja prowadzi do
wytworzenia semialdehydu kwasu
bursztynowego, który może być utleniony
do bursztynianu lub zredukowany do
gamma-hydroksymaślanu
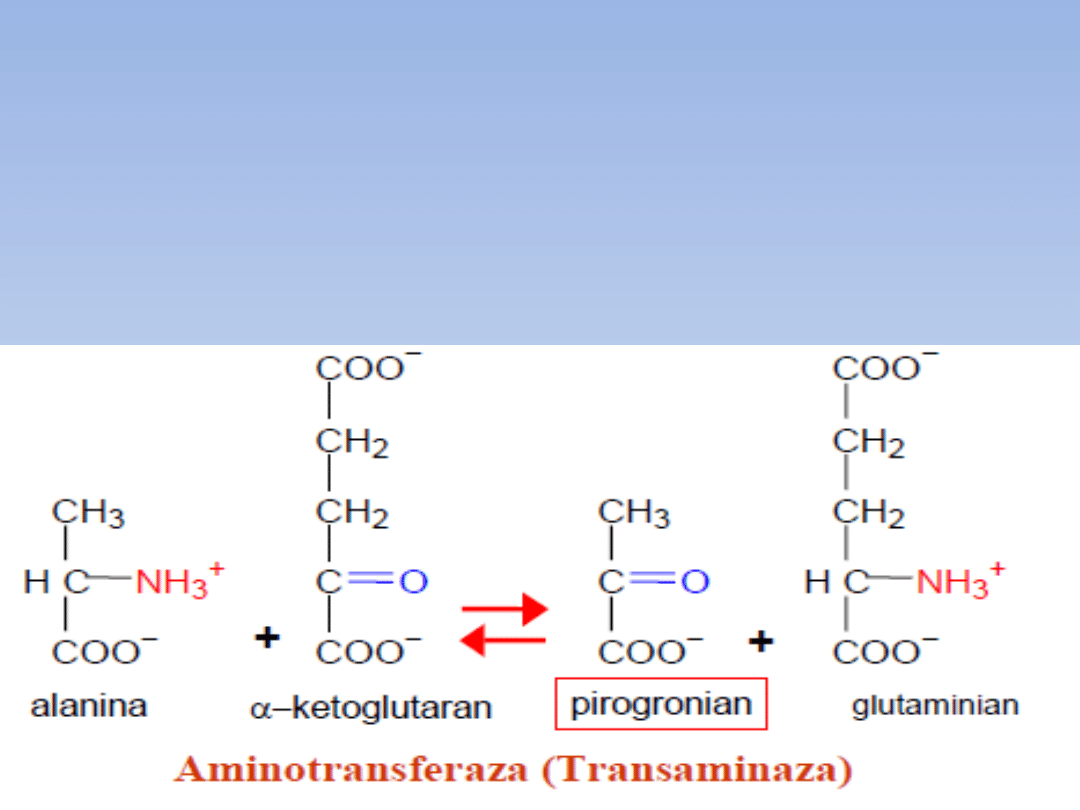
• Alanina
- Cykl alaninowy: w mięśniach z glukozy powstaje
pirogronian który transaminuje z różnymi
aminokwasami dając alaninę; alanina z mięśni trafia
do krwiobiegu i w wątrobie grupa aminowa
przekazywana jest dalej do cyklu mocznikowego,
pirogronian wykorzystywany w glukoneogenezie lub
Cyklu Krebsa
- wytworzona w glukoneogenezie glukoza trafia do
mięśnia, tu spalana do pirogronianu, który znowu
transaminuje do alaniny
Zastosowanie diagnostyczne
transaminaz

• Wzrost aktywności AspAT/AlAT w osoczu:
- zawał mięśnia sercowego
- choroby wątroby z uszkodzeniem hepatocytów
(WZW, toksyczne uszkodzenie, marskość, nowotwory)
- zawały płuca, mózgu, nerki, śledziony, jelit
- choroby mięśni(urazy, zapalenia, dystrofie)
- ostre zapalenie pęcherzyka żółciowego
- ostre zapalenie trzustki
- włośnica, zabiegi kardiochirurgiczne, zapalenie
wsierdzia, zatrucie ciążowe, przełom hemolityczny,
zespół zmiażdżenia, oparzenia, naświetlanie
promieniami X, napadowa mioglobinuria
-zażywane leki(glikokortykosterydy, erytromycyna,
doustne środki antykoncepcyjne, tetracykliny,
morfina, kodeina , salicylany, glikozydy nasercowe)

• wskaźnik de Ritisa
AspAT/AlAT<1 przy:
– wirusowe zapalenia wątroby (ostre i przewlekłe),
– hemochromatoza,
– uszkodzenia polekowe i toksyczne
– niealkoholowe stłuszczeniowe zapalenie wątroby,
– autoimmunologiczne zapalenie wątroby;
• AspAT/AlAT>1 przy:
– toksyczne uszkodzenie wątroby
• alkoholową chorobę wątroby
,
• uszkodzenia polekowe,
– dokonaną marskość wątroby (niezależnie od
przyczyny),
– inna (pozawątrobowa) przyczyna:
• hemolizę,
• choroby mięśni,
• choroby tarczycy.

Reakcje transaminacji mają doprowadzić
do powstania dwóch kluczowych dla
metabolizmu aminokwasów: kwasu
glutaminowego i alaniny. Alanina tworzy
się w wyniku transaminacji
pirogronianu (AlAT), natomiast w
wyniku transaminacji
szczawiooctanu (AspAT), tworzy się
asparaginian. W sensie metabolicznym,
najważniejszym enzymem jest
aminotransferaza glutaminowa, która
zajmuje się przenoszeniem grupy
aminowej z róznych aminokwasów na α-
ketoglutaran z wytworzeniem L-
glutaminianu i α-ketokwasu.

KONIEC
• DZIĘKUJĘ ZA UWAGĘ!
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
Wyszukiwarka
Podobne podstrony:
Transaminacja znaczenie procesu, znaczenie kliniczne transaminaz 2
Transaminacja znaczenie procesu, znaczenie kliniczne transaminaz
Transaminacja znaczenie procesu, znaczenie kliniczne transaminaz 2
Transaminacja znaczenie procesu, znaczenie kliniczne transaminaz 3
Znaczenie kliniczne beta 2 mikroglobuliny w nowotworach
HRV znaczenie kliniczne
Dokumentacja lekarska znaczenie kliniczne i sądowo lekarskie
MIGOTANIE PRZEDSIONKOW, ZAPIS EKG I ZNACZENIE KLINICZNE
Zalewska Koncepcje rozwoju self kontrowersje, problemy i znaczenie w klinicznej praktyce psychologa
Rola i znaczenie wapnia fosforu i magnezu w organizmach przeżuwaczy z uwzględnieniem zmian kliniczny
Cierpiałkowska Koncepcje interakcyjne i systemowe oraz ich znaczenie dla psychologii klinicznej
Znaczenie dzieciństwa w procesie socjlizacji i wychowania, Prace z socjologii, pedagogiki, psycholog
!! Wypracowania !!, 96, ROLA I ZNACZENIE CHRZESCIJANSTWA W PROCESIE KSZTALTOWANIA SIE I UMACNIANIA P
Znaczenie literatury dzieciecej w procesie wychowawczo. doc, Znaczenie literatury dziecięcej w proce
znaczenie procesu socjalizacji praca
Rola i znaczenie wapnia fosforu i magnezu w organizmach przeżuwaczy z uwzględnieniem zmian kliniczny
Oporność wielolekowa i kliniczne znaczenie polimorfizmów
Znaczenie edukacji w procesie terapii dzieci z autyzmem(1)
więcej podobnych podstron