
1
BUDOWA
BUDOWA
ATOMU
ATOMU
1.Cząstki elementarne
2.Budowa powłok elektronowych
3.Konfiguracja elektronowa
pierwiastków
4.Układ okresowy pierwiastków
5.Prawo okresowości pierwiastków
chemicznych

CZĄSTKI ELEMENTARNE
CZĄSTKI ELEMENTARNE
Atom dowolnego pierwiastka jest zbudowany z:
- JĄDRA
- POWŁOKI ELEKTRONOWEJ
Nukleon
(jądro)
1. prawie cała masa atomu jest skoncentrowana w
jądrze,
2. dlaczego jądro ma ładunek dodatni,
3. dlaczego w atomie musi być taka sama liczba
protonów i elektronów.
Atomy różnych pierwiastków różnią się
wartością ładunków swych jąder atomowych,
czyli liczbą protonów.
Atomy danego pierwiastka mają tę samą liczbę
protonów, ale mogą różnić się liczbą neutronów
3
LICZBA ATOMOWA -
LICZBA ATOMOWA -
- Określa liczbę protonów w jądrze atomu
Np. atomy tlenu zawierają 8 protonów (i 8 elektronów)
atomy siarki zawierają 16 protonów (i 16
elektronów)
LICZBA MASOWA -
LICZBA MASOWA -
- Określa liczbę protonów i neutronów (nukleonów) w
jądrze atomu
JĄDRO ATOMU
JĄDRO ATOMU
F
19
9
liczba atomowa
liczba masowa
Całkowity zapis atomu, uwzględniający liczbę
atomową i masową pozwala na określenie liczby
wszystkich
cząstek elementarnych
.

IZOTOPY
IZOTOPY
ATOMY
TEGO
SAMEGO
PIERWIASTKA
ATOMY
TEGO
SAMEGO
PIERWIASTKA
(posiadające
tę
samą
liczbę
protonów),
(posiadające
tę
samą
liczbę
protonów),
RÓŻNIĄCE SIĘ LICZBĄ NEUTRONÓW W JĄDRZE,
RÓŻNIĄCE SIĘ LICZBĄ NEUTRONÓW W JĄDRZE,
NAZYWAMY
NAZYWAMY
IZOTOPAMI
IZOTOPAMI
Izotopy wodoru (masa atomowa – 1,008):
wodór
, symbol H, zawiera w jądrze tylko jeden proton:
H
1
1
H
3
1
tryt
, symbol T, zawiera w jądrze jeden proton i dwa neutrony:
H
2
1
deuter
, symbol D, zawiera w jądrze jeden proton i jeden neutron:
IZOTOPY posiadają te same właściwości
chemiczne, różnią się jednak
właściwościami fizycznymi
Cl
i
Cl
37
17
35
17
Np. chlor Cl: mieszanina dwóch izotopów:
Cl
35
17
Cl
37
17
Masa atomowa chloru wynosi: 35,47
wynika z tego, że w chlorze naturalnym 75,43%
stanowi izotop i 25,57% -
Większość pierwiastków stanowi mieszaninę izotopów.
5
JĄDRO ATOMU
JĄDRO ATOMU
Jądra atomowe mogą być stabilne lub nietrwałe.
STABILNE
STABILNE
są to takie jądra, w których układ nukleonów jest
korzystny pod względem energetycznym.
Stabilność jąder zależy od stosunku liczby neutronów i
protonów:
Ne,
He,
20
10
4
2
2. Wraz ze wzrastającą masą jądra wzrasta
nadwyżka neutronów w stosunku do protonów,
jądra atomowe stają się nietrwałe i dochodzi
wówczas do ich, samorzutnego rozpadu,
któremu towarzyszy wydzielanie
promieniowania
.
Ca
Si,
Mg,
O,
40
20
28
14
24
12
16
8
Pierwiastki składające się z jąder
parzysto-parzystych są bardzo
stabilne i stanowią 70% skorupy
ziemskiej.
1. Bardzo stabilne są jądra z parzystą liczbą neutronów i protonów.

6
jest to zdolność atomu (jądra) do samorzutnej
przemiany w inny atom przez wysłanie promieniowania
- Pierwiastki promieniotwórcze
Pierwiastki promieniotwórcze
promieniowanie
- promieniowanie elektro-
magnetyczne o długości fali: =
10
-10
-10
-13
m.
0
1
promieniowanie
+
- promieniowanie
pozytonów:
0
1
promieniowanie
-
- promieniowanie elektronów:
4
2
promieniowanie
- promieniowanie jąder atomu helu:
Rodzaje promieniowania jądrowego:
P
ro
sz
ę
r
o
zs
ze
rz
y
ć
te
w
ia
d
o
m
o
śc
i
.
Inne cząstki
elementarne:
PROMIENIOTWÓRCZOŚĆ
PROMIENIOTWÓRCZOŚĆ

7
POWŁOKI
POWŁOKI
ELEKTRONOWE
ELEKTRONOWE
Aktualne poglądy dotyczące charakteru elektronu
w atomie można ująć następująco:
1. ELEKTRON MA CHARAKTER DUALISTYCZNY -
własności zarówno KORPUSKULARNE jak i
FALOWE.
2. ODNOSI SIĘ DO NIEGO ZASADA
HEISENBERGA
tzn. zasada nieoznaczoności - nie można
równocześnie określić
położenia
i
pędu
elektronu.
(Pęd - iloczyn masy i prędkości)
3. Najmniejszy obszar przestrzeni wokół
jądra charakteryzujący się określonym
prawdopodobieństwem znalezienia
elektronu nazywa się:
ORBITALEM ATOMOWYM
ORBITALEM ATOMOWYM
8
1.
Elektron w atomie wodoru może znajdować się w
jednym w wielu możliwych STANÓW, tzw. STANÓW
STANÓW
KWANTOWYCH
KWANTOWYCH
:
a w każdym z nich jego: energia, kręt i spin
energia, kręt i spin
PRZYBIERAJĄ ŚCIŚLE OKREŚLONE WARTOŚCI.
KRĘT
-
moment
pędu
-
jest
wielkością
charakteryzującą ruch po okręgu czyli kształt
orbitalu atomowego.
SPIN
- charakteryzuje własności magnetyczne
elektronu czyli ułożenie w przestrzeni i ruch
wokół własnej osi.
BUDOWA POWŁOK
BUDOWA POWŁOK
ELEKTRONOWYCH W
ELEKTRONOWYCH W
ATOMACH
ATOMACH
Liczby określające te wartości noszą nazwę:
LICZB KWANTOWYCH
LICZB KWANTOWYCH
2. ENERGIA ELEKTRONU
(tzw. energia orbitali)
może przybierać w atomie wodoru tylko wartości
określone przez tzw.:
n
- GŁÓWNĄ LICZBĘ KWANTOWĄ,
GŁÓWNĄ LICZBĘ KWANTOWĄ,
która
która
przybiera wartości kolejnych liczb naturalnych
1,2,3......
POWŁOKI
POWŁOKI
ELEKTRONOWE
ELEKTRONOWE
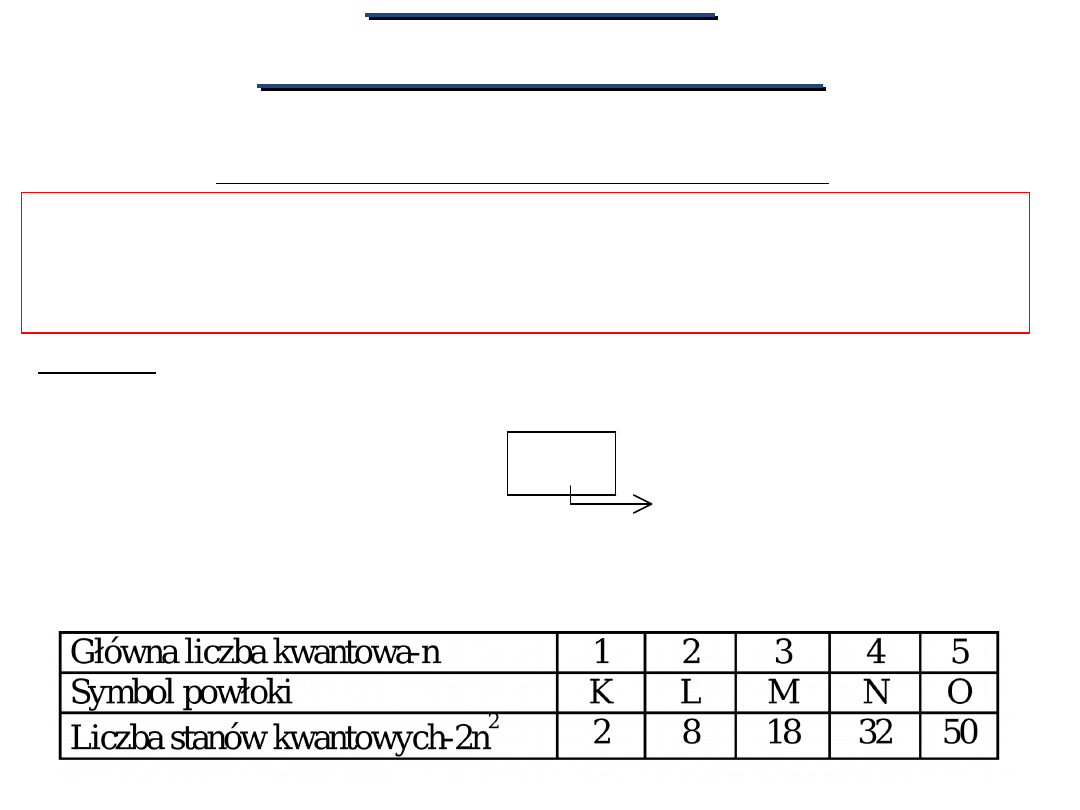
LICZBA STANÓW KWANTOWYCH ELEKTRONU
RÓŻNIĄCYCH SIĘ ENERGIĄ JEST NIESKOŃCZENIE WIELKA
Zatem: Energia elektronu we wszystkich stanach
kwantowych należących do jednej powłoki ma tę
samą wartość.
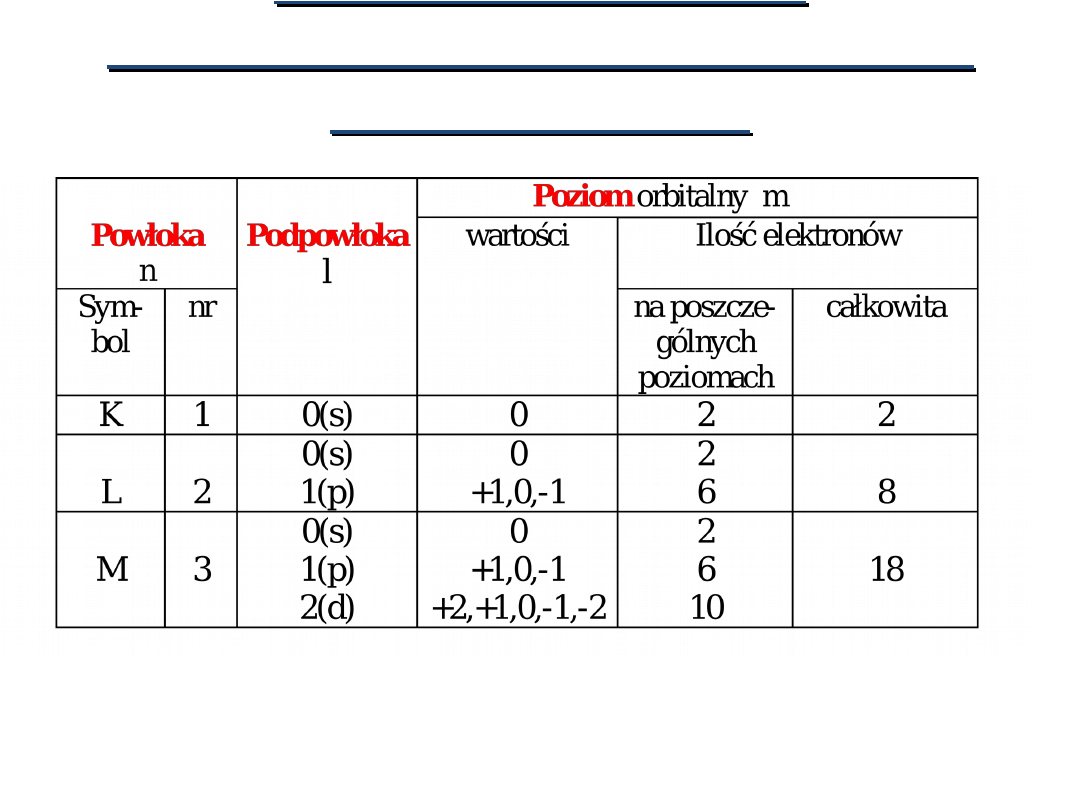
POWŁOKA ELEKTRONOWA
zbiór wszystkich stanów kwantowych o tej samej
wartości głównej liczby kwantowej.
Liczba stanów kwantowych
w powłoce wynosi:
2n
2
Główna liczba kwantowa
Oznaczenia i liczba stanów kwantowych dla
poszczególnych
wartości
głównych
liczb
kwantowych:
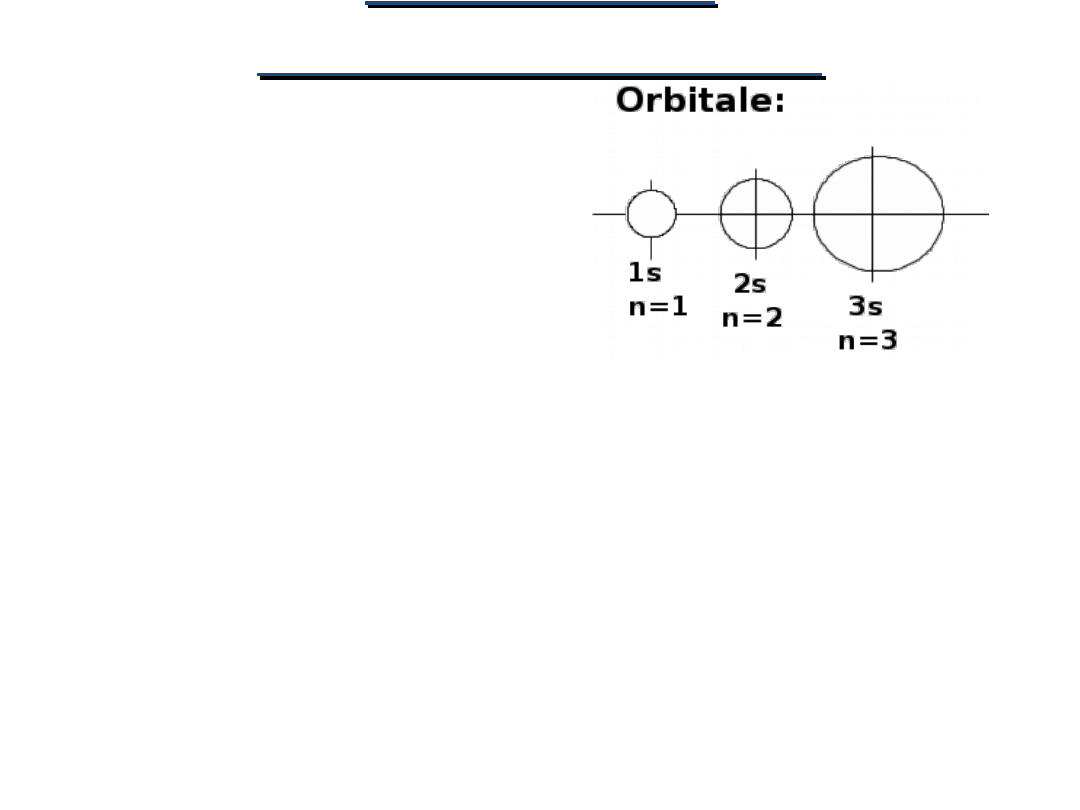
POWŁOKI
POWŁOKI
ELEKTRONOWE
ELEKTRONOWE
Główna liczba kwantowa
decyduje
o
ROZMIARACH
ORBITALU
.
Im większa jest wartość
n
tym większy jest
orbital:
W praktyce elektron w atomie wodoru przebywa
najczęściej w stanie o najniższej energii: n = 1E
1
=
-13,6 EV:
STAN PODSTAWOWY
Wszystkie inne stany energetyczne elektronu:
STANY WZBUDZONE
Doprowadzenie energii z zewnątrz (
ABSORPCJA
energii) powoduje przejście elektronu ze STANU
PODSTAWOWEGO do STANU WZBUDZONEGO ( n = 2,
3, 4 .........)
I odwrotnie w przypadku przechodzenia w stan
kwantowy o niższej energii ma miejsce
EMISJA
energii na zewnątrz atomu.

3
. KRĘT ORBITALNY ELEKTRONU (M)
charakteryzuje
tzw.:
• wartości
pobocznej
liczby
kwantowej
wynoszą:
od 0 do n-1
Np. dla n =4 l: 0, 1, 2, 3.
-
orbitalna (poboczna) liczba kwantowa
(l),
(l),
która:
Zbiór stanów kwantowych o tych samych
wartościach
GŁÓWNEJ I ORBITALNEJ
liczby
kwantowej nosi nazwę:
PODPOWŁOKI ELEKTRONOWEJ
PODPOWŁOKI ELEKTRONOWEJ
Liczba stanów kwantowych w podpowłoce: 4l
4l
+ 2
+ 2
Podpowłoki elektronowe odpowiadające
kolejnym wartościom orbitalnej liczby kwantowej
oznacza się literami:
PODPOWŁOKI ELEKTRONOWE
PODPOWŁOKI ELEKTRONOWE
12
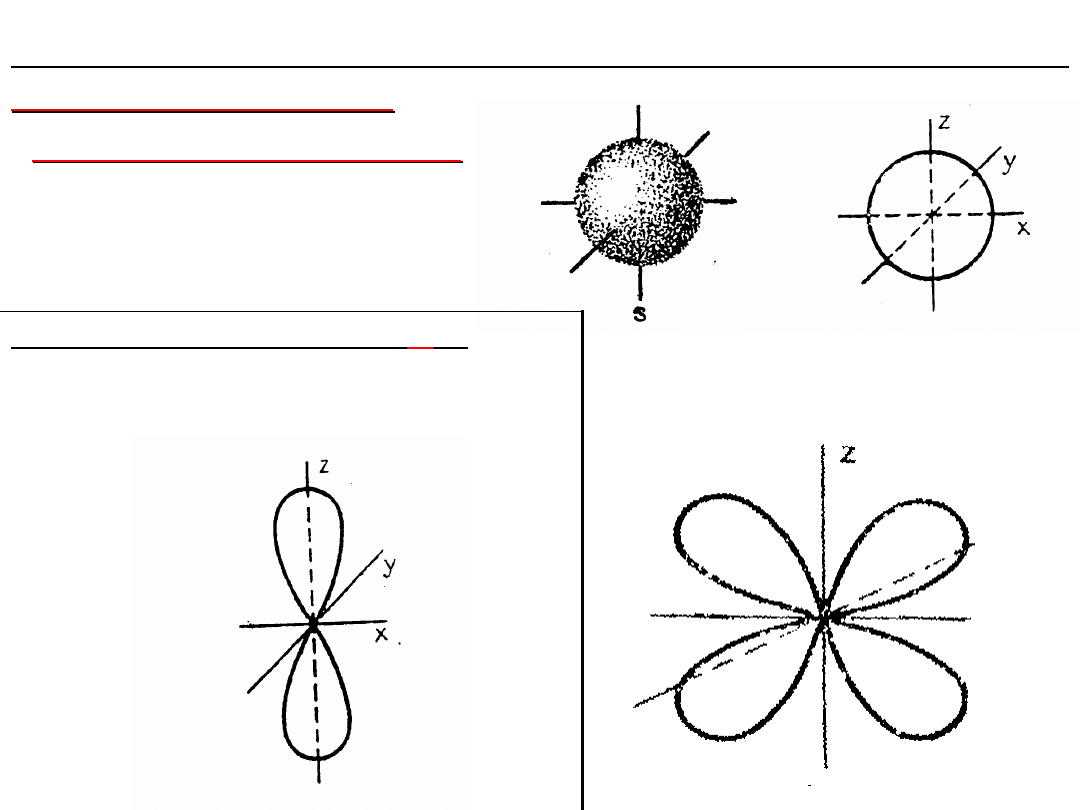
Wartość pobocznej liczby kwantowej określa:
KSZTAŁT ORBITALU
KSZTAŁT ORBITALU
Orbital podpowłoki s
Orbital podpowłoki s
jest
symetryczny
sferycznie
a
powierzchnia
graniczna jest sferą
kuli:
Kształt
orbitalu
d
Orbital podpowłoki
p
ma
kształt figury otrzymanej
przez obrót ósemki
dookoła osi podłużnej:

13
Magnetyczna liczba kwantowa przybiera:
2
l
l +1
wartości całkowitych w zakresie:
od -
l
l do +
l
l
Np. dla l = 2 mamy 2•2+1=5 wartości
magnetycznej liczby kwantowej: -2, -1, 0, +1,
+2.
4.
KRĘT ELEKTRONU
KRĘT ELEKTRONU
charakteryzuje w atomie
tzw.:
magnetyczna liczba kwantowa
-
m
Zbiór stanów kwantowych o tych samych
wartościach:
głównej, pobocznej i magnetycznej
liczb
kwantowych
nosi
nazwę:
POZIOMU
POZIOMU
ORBITALNEGO
ORBITALNEGO
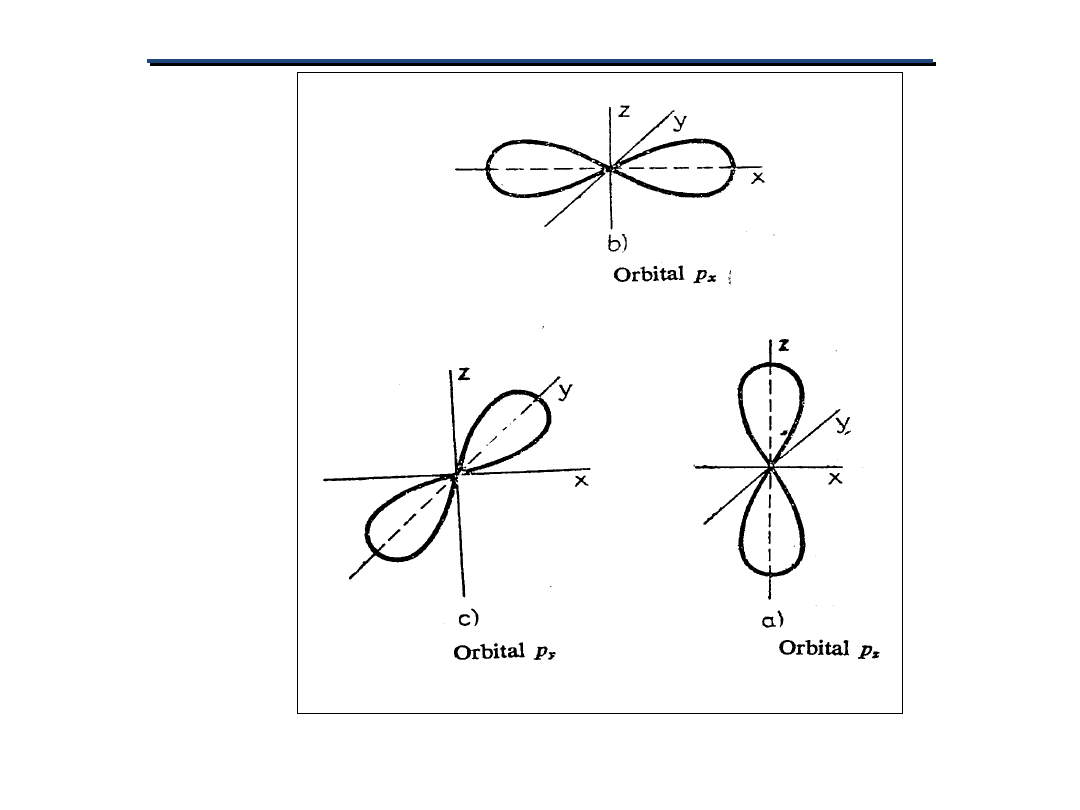
Np. Orbital s ma tylko jedną orientację
przestrzenną.
Orbital p ma 3 orientacje
przestrzenne.
Orbital d ma 5 orientacji
przestrzennych
.
Magnetyczna liczba kwantowa określa:
ORIENTACJĘ PRZESTRZENNĄ ORBITALU
POZIOMY ORBITALNE
POZIOMY ORBITALNE
14
POZIOMY ORBITALNE
POZIOMY ORBITALNE
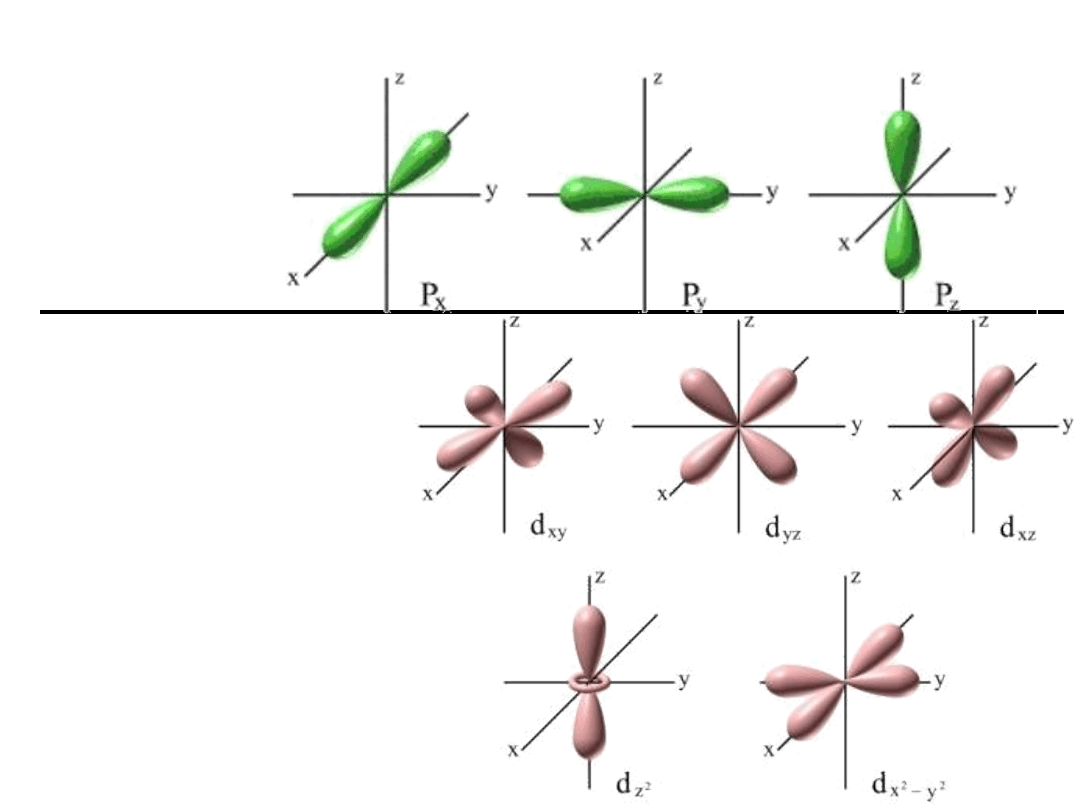
Kształty
przestrze
nne
orbitalu
p:
Kształty przestrzenne
orbitalu d
15
15
Kształty
przestrzenne
orbitalu p:
Kształty
przestrzenne
orbitalu d
Orbital d ma 5 orientacji
przestrzennych
.
Orbital p
ma 3
orientacje
przestrzen
ne.

16
SPIN ELEKTRONU
SPIN ELEKTRONU
KAŻDY POZIOM ORBITALNY, KTÓRY
CHARAKTERYZUJĄ 3 LICZBY KWANTOWE
(n,l,p) MA DWA STANY KWANTOWE
RÓŻNIĄCE SIĘ ORIENTACJĄ
PRZESTRZENNĄ SPINU.
2
1
lub
2
1
Może ona przybierać dwie wartości:
5
.
SPIN ELEKTRONU
SPIN ELEKTRONU,
który charakteryzuje
kierunek ruchu elektronu wokół własnej osi
może przybierać dwie orientacje przestrzenne,
bez względu na wartości pozostałych liczb
kwantowych.
Określa to tzw.
magnetyczna-spinowa liczba kwantowa
- m
s
17
LICZBY KWANTOWE
LICZBY KWANTOWE
18
Rozmieszczenie
Rozmieszczenie
elektronów na poziomach
elektronów na poziomach
kwantowych
kwantowych
19
KONFIGURACJA
KONFIGURACJA
ELEKTRONOWA
ELEKTRONOWA
PIERWIASTKÓW
PIERWIASTKÓW
Przypisanie
elektronów
poszczególnym
powłokom
i podpowłokom, czyli przypisanie im liczb kwantowych nosi nazwę:
KONFIGURACJI ELEKTRONOWEJ
Uproszczony zapis konfiguracji elektronów z uwzględnieniem tylko
POWŁOK i PODPOWŁOK (główna i poboczna liczba kwantowa (n i l )
zawiera trzy informacje:
3p
5
liczba elektronów w podpowłoce
symbol podpowłoki
wartość głównej liczby kwantowej
(numer powłoki)
Np. konfiguracja sodu Na :
1
6
2
2
11
,3s
,2p
,2s
1s
:
Na
co oznacza: 1s
2 -
dwa elektrony zajmują orbital s
powłoki 1;
2s
2 -
dwa elektrony zajmują orbital s powłoki
2;
2p
6 -
sześć elektronów zajmuje orbital p
powłoki 2;
3s
1 -
jeden elektron zajmuje orbital s powłoki
3;
20
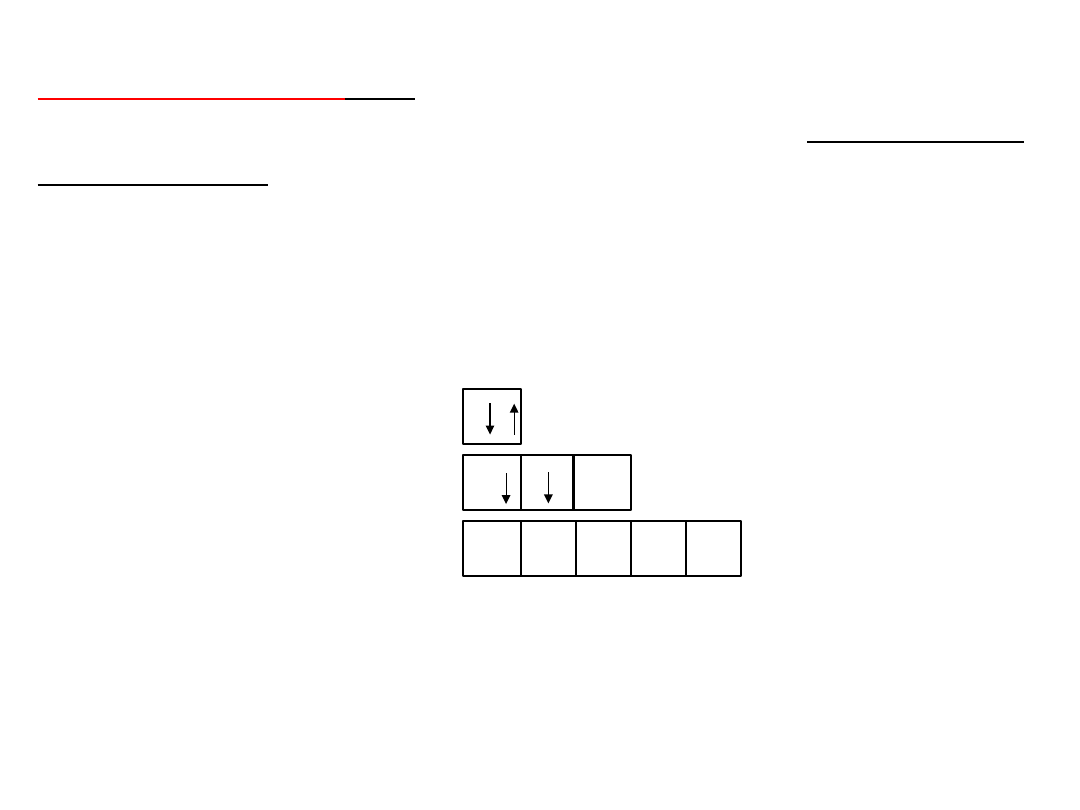
Pojedyncze strzałki () () umieszczone
wewnątrz
klatki
symbolizują
elektrony
zajmujące dany poziom.
Przeciwne zwroty strzałek () oznaczają różne
wartości spinu elektronu
Poziomy
symbolizuje się za pomocą klatek, przy
czym dla każdej podpowłoki rysuje się prostokąt
składający się z tylu klatek ile poziomów
orbitalnych zawiera dana podpowłoka:
podpowłoka s
podpowłoka p
podpowłoka d
Zapis
pełny:
uwzględnia
rozmieszczenie
elektronów
w
poszcze-gólnych
poziomach
orbitalnych danej podpowłoki, oraz orienta-cję
spinów czyli magnetyczną i spinową liczby
kwantowe.
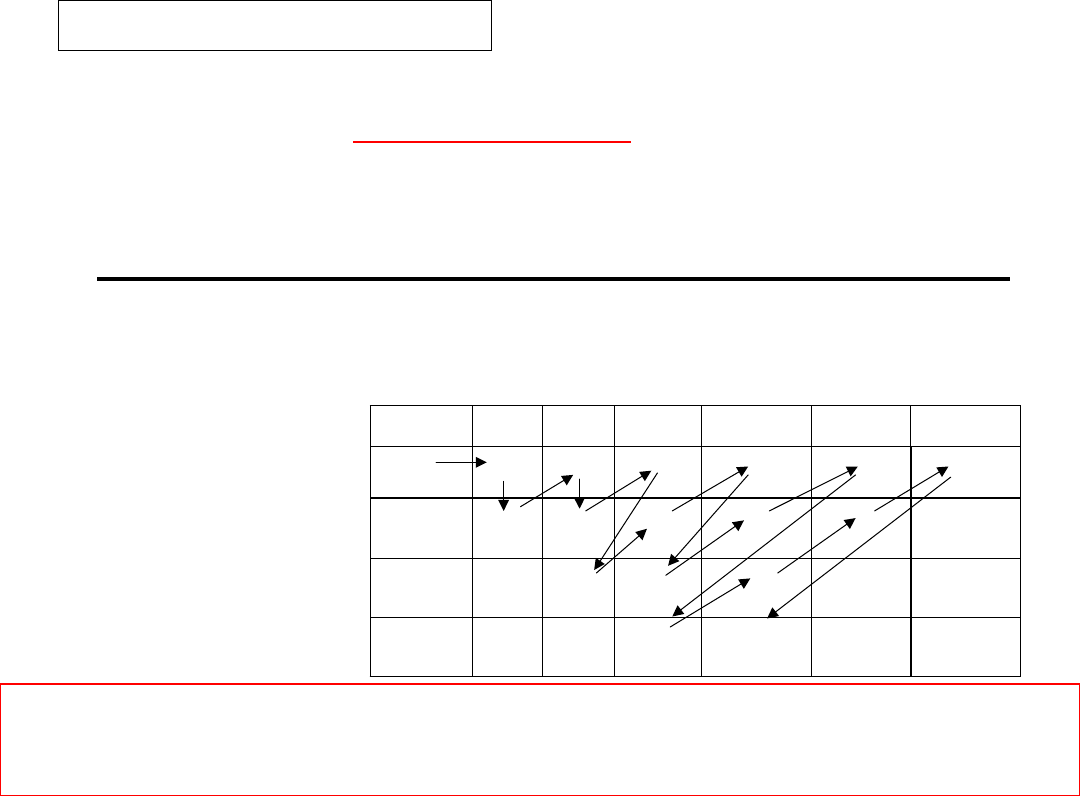
21
Orbitale o niższej energii zapełniają się
elektronami wcześniej niż orbitale o energii
wyższej.
Kolejność
poziomów
energetycznych
atomów
wieloelektronowyc
h, liczoną wg
wzrastających
energii
:
n=1
2
3
4
5
6
7
s
s
s
s
s
s
s
p
p
p
p
p
d
d
d
f
f
Najlepiej zapamiętać ten
schemat
Czyli: 1s-2s-2p-3s-3p-4s-3d-4p-5s-4d-5p-6s-4f-5d-
6p-7s-5f
ZAKAZ PAULIEGO
Na każdym orbitalu (poziomie orbitalnym) mogą
znajdować się
najwyżej dwa elektrony
. Oznacza
to, że każdy stan kwantowy może zostać zajęty
tylko przez jeden elektron, czyli w atomie nie
mogą istnieć dwa elektrony o tych samych
wartościach czterech liczb kwantowych.
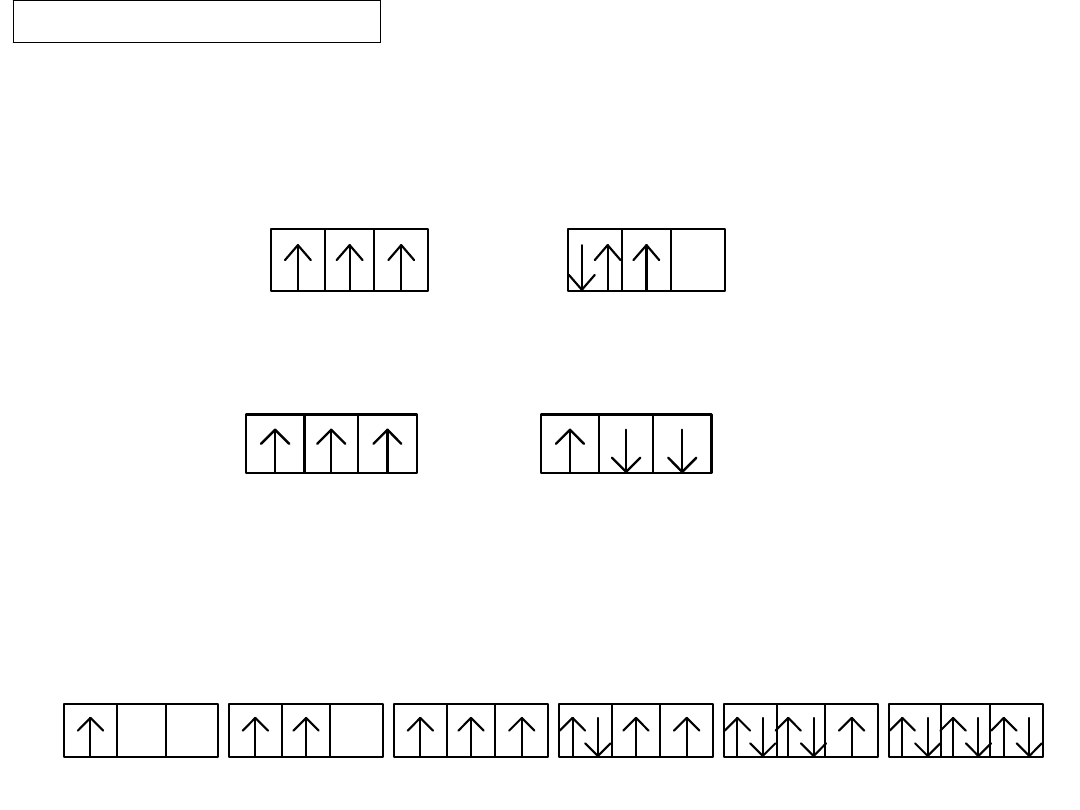
22
ZASADA HUNDA
tzw. zasada trzech:
a nie
1.
Liczba elektronów niesparowanych w danej
podpowłoce powinna być możliwie największa.
np. w przypadku 3 elektronów w podpowłoce p
powinno być:
3.
Pary elektronów tworzą się dopiero po
zapełnieniu wszystkich orbitali (poziomów)
danej
podpowłoki
przez
elektrony
niesparowane:
Np. dla podpowłoki p:
1 elektron
5 elektronów 6 elektronów
4 elektrony
3 elektrony
2 elektrony
2.
Elektrony niesparowane na orbitalach
danej podpowłoki mają jednakowy spin,
a więc:
a nie
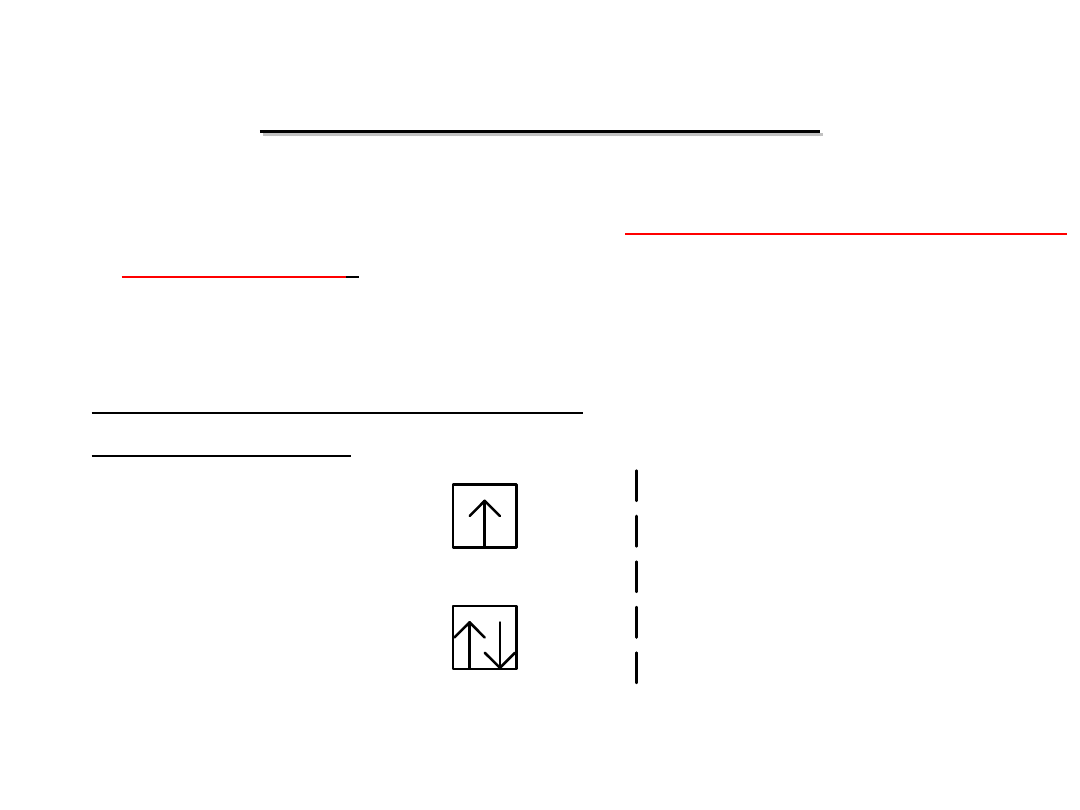
23
KONFIGURACJA
KONFIGURACJA
ELEKTRONOWA
ELEKTRONOWA
PIERWIASTKÓW
PIERWIASTKÓW
KONFIGURACJĘ ELEKTRONÓW
WG ROSNĄCEJ LICZBY
ATOMOWEJ
MOŻNA PRZEDSTAWIĆ ZATEM
NASTĘPUJĄCO:
I
OKRES
układu
okresowego:
H
1
-
1s
1
He
2
-
1s
2
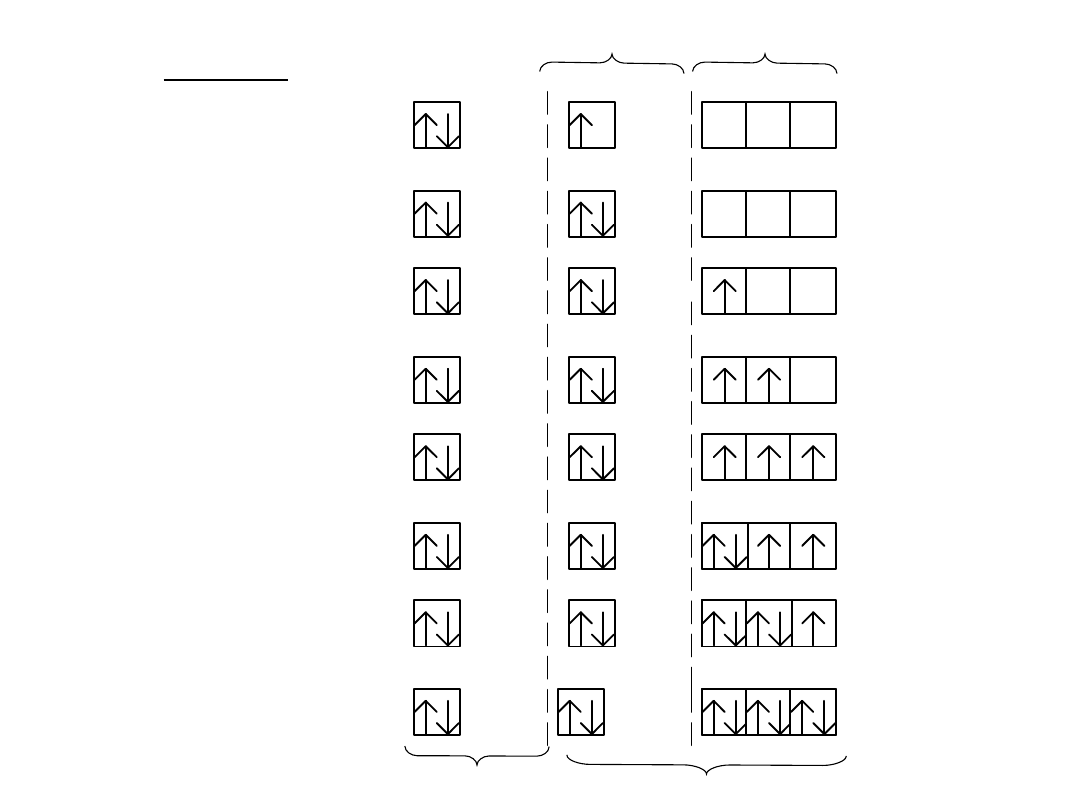
24
Podpowłoka s
Podpowłoka p
II okres:
Powłoka K
Powłoka L
Li
3
-
1s
2
Be
4
-
1s
2
B
5
-
1s
2
C
6
-
1s
2
N
7
-
1s
2
O
8
-
1s
2
F
9
-
1s
2
Ne
10
-
1s
2
2s
1
2s
2
2s
2
2s
2
2s
2
2s
2
2s
2
2s
2
2p
1
2p
2
2p
3
2p
4
2p
5
2p
6
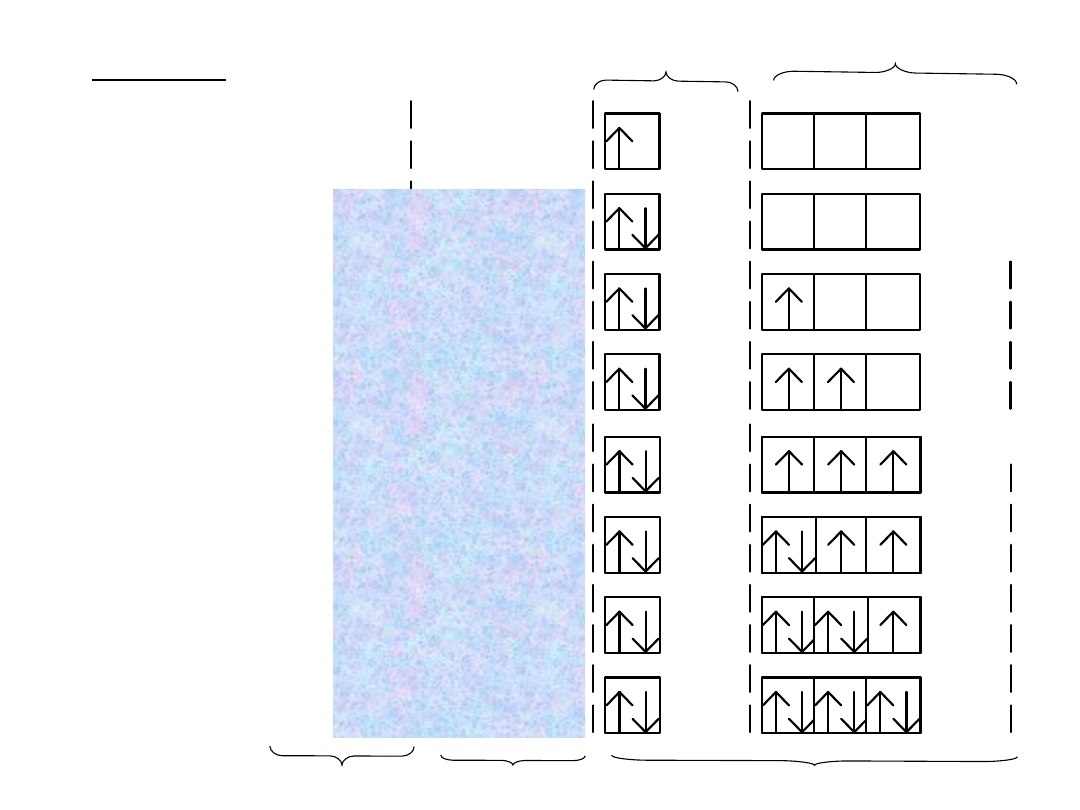
III okres:
Podpowłoka s
Podpowłoka p
Na
11
-
1s
2
2s
2
3s
1
Mg
-
1s 2s
3s
2
2
2
12
Al
13
-
1s
2
2s
2
3s
2
Si
-
1s 2s
3s
2
2
2
14
3p
1
3p
2
2p
6
2p
6
2p
6
2p
6
P
15
-
1s
2
2s
2
3s
2
S
-
1s 2s
3s
2
2
2
16
Cl
17
-
1s
2
2s
2
3s
2
Ar
-
1s 2s
3s
2
2
2
18
3p
5
3p
6
3p
3
3p
4
2p
6
2p
6
2p
6
2p
6
Powłoka K
Powłoka L
Powłoka M
Jak wyżej
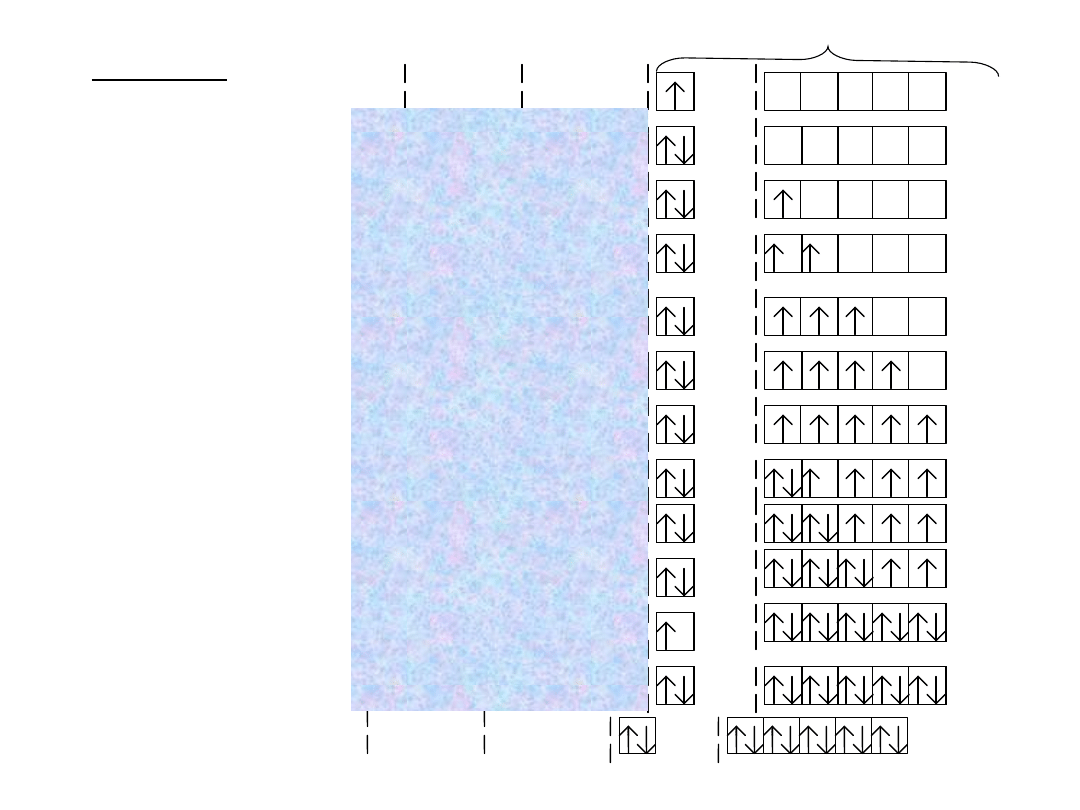
Itd.
IV okres:
K
19
-
2s
2
3s
2
Ca
-
1s 2s
3s
2
2
2
20
Sc
21
-
1s
2
2s
2
3s
2
Ti
-
1s 2s
3s
2
2
2
22
3p
6
3p
6
3p
6
3p
6
2p
6
2p
6
2p
6
2p
6
4s
1
4s
2
4s
2
4s
2
2
1s
3d
1
3d
2
V
23
-
2s
2
3s
2
Cr
-
1s 2s
3s
2
2
2
24
Mn
25
-
1s
2
2s
2
3s
2
Fe
-
1s 2s
3s
2
2
2
26
3p
6
3p
6
3p
6
3p
6
2p
6
2p
6
2p
6
2p
6
4s
2
4s
2
4s
2
4s
2
2
1s
3d
5
3d
6
3d
3
3d
4
Co
27
-
2s
2
3s
2
Ni
-
1s 2s
3s
2
2
2
28
Cu
29
-
1s
2
2s
2
3s
2
Zn
-
1s 2s
3s
2
2
2
30
3p
6
3p
6
3p
6
3p
6
2p
6
2p
6
2p
6
2p
6
4s
2
4s
2
4s
1
4s
2
2
1s
3d
10
3d
7
3d
8
3d
10
Ga
-
1s 2s
3s
2
2
2
3p
6
2p
6
4s
2
3d
10
4p
1
Powłoka N
Jak wyżej

27
1. W kierunku poziomym pierwiastki podzielone zostały
na 7 okresów i numer każdego z nich odpowiada
głównej liczbie kwantowej orbitalu s
, który zaczyna
się nim wypełnić.
W kierunku pionowym układ okresowy podzielony
został na osiem podstawowych grup pierwiastków:
ns
ns
1
1
-
-
np
np
6
6
oraz
szeregi
pierwiastków
przejściowych:
pierwiastki d i f
pierwiastki d i f

I tak: - okres pierwszy zawiera jedynie dwa pierwiastki,
ponieważ wypełnia się w nim jeden orbital - 1s
1s
- okres drugi zawiera osiem pierwiastków, ponieważ na
poziomie energetycznym 2s-2p znajdują się jeden
jeden
orbital
orbital
2s i trzy orbitale 2p
2s i trzy orbitale 2p
W sumie więc wypełniają się cztery orbitale. Itd.
2. Liczba pierwiastków w poszczególnych okresach
stanowi
dwukrotność liczby orbitali
, wypełnianych wg
kolejności energii
ns-np
, gdzie n oznacza numer okresu,
a równocześnie główną liczbę kwantową.
LICZBA ELEKTRONÓW WALENCYJNYCH PIERWIASTKÓW GRUP
GŁÓWNYCH ZGODNA JEST Z NUMEREM DANEJ GRUPY
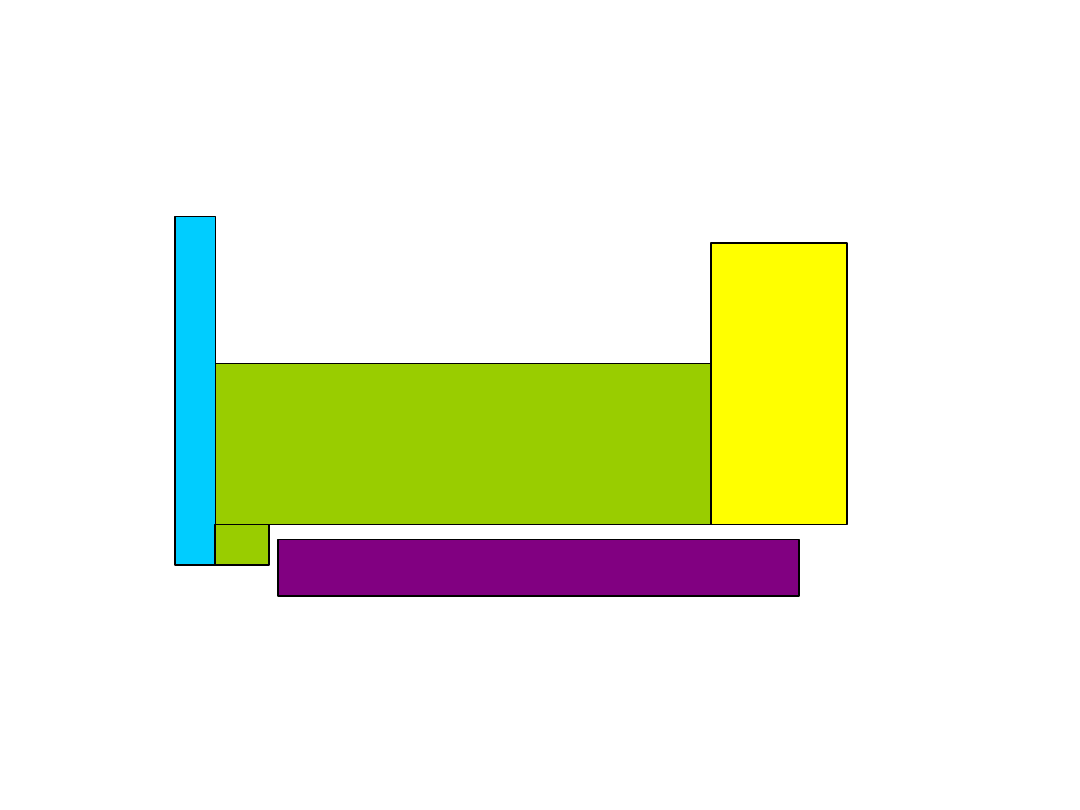
29
3.
W każdym okresie elektrony zaczynają
wypełniać orbitale s, a okres kończy się po
wypełnieniu orbitalu p.
Dlatego układ okresowy można podzielić na
części, w których wypełniają się te same typy
orbitali:
d
s
p
f
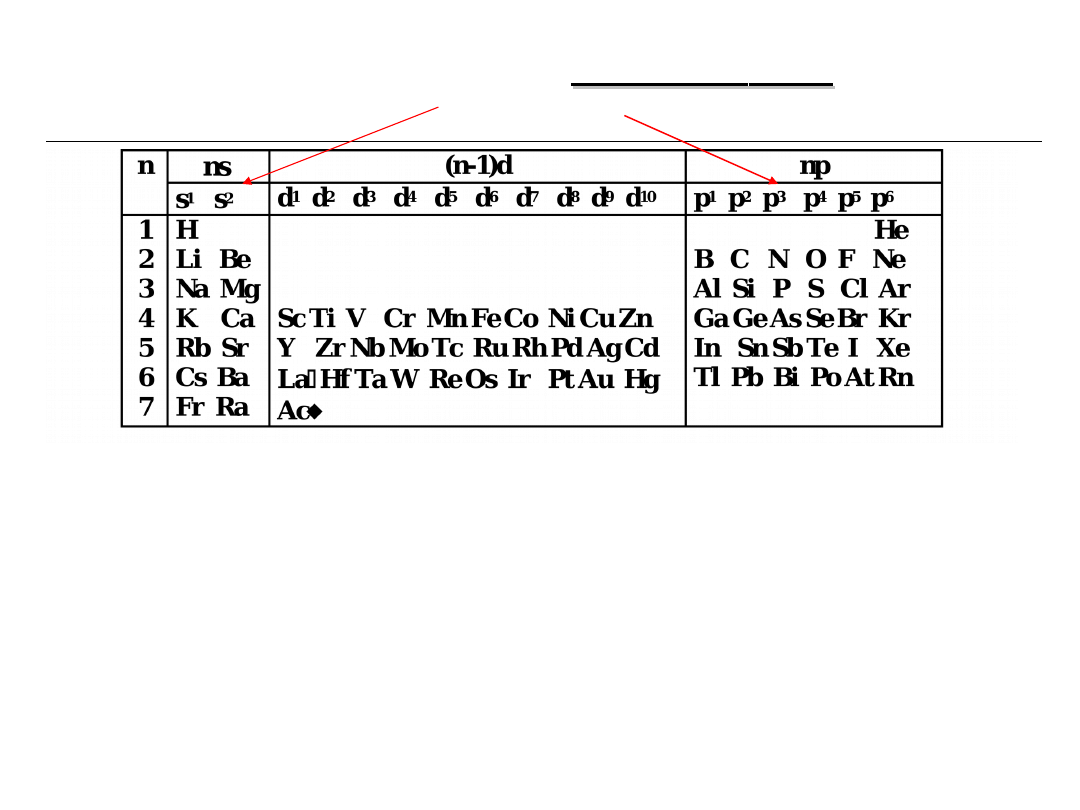
30
Ogólna charakterystyka pierwiastków
Ogólna charakterystyka pierwiastków
tworzących
tworzących
bloki
bloki
s
s
i
i
p
p
Grupa 1 – pierwiastki
ns
1
-
litowce
(metale alkaliczne)
Grupa 2 – pierwiastki
ns
2
–
berylowce
(metale ziem alkalicznych)
Grupa 3 – pierwiastki
ns
2
p
1
-
borowce
– charakter metaliczny, ale
też pośredni, np. Al.
Grupa 4 – pierwiastki
ns
2
p
2
–
węglowce
- przejściowe własności
metali i niemetali
Grupa 5 – pierwiastki
ns
2
p
3
-
azotowce
– charakter niemetali, ale
też As-Bi-metale.
Grupa 6 – pierwiastki
ns
2
p
4
–
tlenowce
- charakter niemetali, ale
też Te-Po-metale
Grupa 7 – pierwiastki
ns
2
p
5
-
fluorowce
– typowe niemetale.
Grupa 8 – pierwiastki
ns
2
p
6
––helowce – gazy szlachetne –
nieaktywne chemicznie
Grupy
Grupy
główne
główne

31
Pierwiastki bloku
Pierwiastki bloku
d -
d - podgrupy
podgrupy
Mają na ogół częściowo wypełnione elektronami podpowłoki
walencyjne (n-1)d.
Wyróżniamy:
-
podgrupa 1
- skandowce: Sc, Y, La, Ac; -
podgrupa 2
-
tytanowce: Ti, Zr, Hf ;
-podgrupa 3
- wanadowce: V, Nb, Ta ; -
podgrupa 4
-
chromowce: Cr, Mo, W ;
-
podgrupa 5
- manganowce: Mn, Tc, Re;
-
podgrupy 6, 7 i 8
- zawierają łącznie 9 pierwiastków
rozmieszczonych w trzech okresach, a mianowicie: żelazowce
(okres 4) - Fe, Co, Ni, o konfiguracji elektronów walencyjnych
(n -
1)d
6,7,8
ns
2,1,2
, platynowce lekkie (okres 5) - Ru, Rh, Pd, o
konfiguracji elektronów walencyjnych
(n - 1)d
6,7,10
ns
1,1,0
,
platynowce ciężkie -osmowce, (okres 6) - Os, Ir, Pt, o konfiguracji
elektronów
walencyjnych
(n-1)d
6,7,9
ns
2,1,1
;
-podgrupa 9
- miedziowce: Cu, Ag, Au; oraz
podgrupa 10
-
cynkowce: Zn, Cd, Hg.
32
• Pierwiastki bloku f - dwie rodziny, rodziny:
lantanowce
i
aktynowce
.
• Rozbudowują odpowiednio podpowloki 4f i 5f.
• Mają powtarzające się struktury elektronowe powłok
walencyjnych:
(n-2)f
0-14
(n-1)d
1
ns
2
, sukcesywnie
rozbudowywane.
• Pierwiastki bloku d i f wykazują pewne wspólne
właściwości: wszystkie są metalami,
Pierwiastki bloku
Pierwiastki bloku
f
f
(n-2)f
Pierwiastki
przejściowe
n
f1 f2 f3 f4 f5 f6 f7 f8 f9 f10 f11
f12 f13 f14
lantanowce
aktynowce
6
7
Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er T
Yb Lu
Th Pa U Np Pu Am Cm Bk Cf Es Fm
Md No Lw

Okresowość własności fizycznych
Okresowość własności fizycznych
1. Promień atomu
maleje w okresach w miarę wzrostu liczby
atomowej. Można to wytłumaczyć tym, że w danym okresie
w miarę wzrostu l.a. wzrasta ładunek jądra, który coraz
silniej przyciągają elektrony, też walencyjne decydujące o
rozmiarach jądra.
2. Energia jonizacji -
energia niezbędna do usunięcia
elektronów walencyjnych atomu. Zależy od odległości od
jądra. Im dalej tym jest mniejsza, a więc maleje ze wzrostem
odległości od jądra. W okresach jest praktycznie jednakowa.
3. Elektroujemność –
miara tendencji atomów w cząsteczce
do przyciągania elektronów. W okresach wzrasta wraz ze
zwiększaniem się liczby atomowej. W grupach maleje wraz
ze zwiększaniem się liczby powłok elektronowych.
Prawo okresowości pierwiastków chemicznych
zostało sformułowane przez Mendelejewa w latach 60.
XIX w. Stwierdził on, że:
-właściwości pierwiastków są periodycznie
-właściwości pierwiastków są periodycznie
zależne od ich mas atomowych,
zależne od ich mas atomowych,
lub
lub
-
-
pierwiastki chemiczne ułożone zgodnie ze
pierwiastki chemiczne ułożone zgodnie ze
wzrastająca liczbą atomową wykazują okresowe
wzrastająca liczbą atomową wykazują okresowe
powtarzanie się właściwości
powtarzanie się właściwości
34
Okresowość własności
Okresowość własności
chemicznych
chemicznych
Ogólne wzory tlenków i wodorków
pierwiastków z każdej grupy:
Grupa
I
II
III
IV
V
VI
VII
Wzór tlenku
X
2
O XO X
2
O
3
XO
2
X
2
O
5
XO
3
X
2
O
7
Wzór
wodorku
XH
XH
2
XH
3
XH
4
XH
3
XH
2
XH
W
poszczególnych
grupach
występują
więc
pierwiastki, których najwyższa wartościowość
dodatnia lub ujemna określa ich przynależność
do danej grupy.
Począwszy
od
grupy
IV
suma
liczbowych
wartościowości dodatniej i ujemnej równa się
8.
Najwyższa
wartościowość
jest
charakterystyczna dla całej grupy, a w każdym
okresie zmienia się ona okresowo od 1 do 8.
Stopniowanie własności pierwiastków przejawia się
także we własnościach ich związków.
Na przykład
własności kwasowe pierwiastków
wzrastają od lewej strony ku prawej,
własności
zasadowe
-
w
kierunku
przeciwnym.
W poszczególnych grupach, licząc w kierunku
pionowym ku dołowi, maleje moc kwasów
tlenowych, ale wzrasta moc zasad.
W górnym, prawym rogu tablicy Mendelejewa
znajdują się pierwiastki o najsilniej zaznaczonym
charakterze kwasotwórczym - a w dolnym, lewym
rogu - pierwiastki tworzące najsilniejsze zasady.
Pierwiastki rodzin dodatkowych zmieniają swe
własności w podobny sposób jak pierwiastki
rodzin głównych. Różnice są jednak stosunkowo
niewielkie oraz zdarzają się pewne odchylenia.
Okresowość własności chemicznych
Okresowość własności chemicznych
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
Wyszukiwarka
Podobne podstrony:
1 d budowa zębinyid 9173 ppt
Budowa i lokalizacja DNA ppt
04 proces budowania firmyid 5160 ppt
1 Budowanie programĂlwid 10307 ppt
05 Budowa ciała stałego ppt
1 d budowa zębinyid 9173 ppt
Budowa i lokalizacja DNA ppt
1 BUDOWA ATOMUid 9080 pptx
03 Budowa polimerów, pojęcia podstawoweid 4327 ppt
1 e budowa cementu korzeniowego i aparatu zawieszeniowego zębaid 9192 ppt
Budowa i funkcjonowanie układu rozrodczego samiczego u ptaków ppt
ppt nr 2 budowa
BUDOWA KWASU DNA, Prezentacje Biologiczne PPT, DNA-budowa i funkcje
10 BUDOWA METALI I ICH STOPÓWid 10532 ppt
1 UK BUDOWA I PODZIAŁ SZKIELETUid 8712 ppt
2 ogolna budowa i struktura wirionuid 20594 ppt
więcej podobnych podstron