
Kontrola jakości cytometru
przepływowego
Istotne jest przeprowadzanie standaryzacji aparatu poprzez :
-Codzienną, wewnętrzną kontrolę jakości układu optycznego,
elektronicznego oraz parametrów fluorescencji w celu zapewnienia
optymalnego działania aparatu.
-Udział w zewnętrznej, międzylaboratoryjnej kontroli jakości która
pozwala na ocenę i porównanie stosowanych procedur oraz na
ocenę jakości i wiarygodności badań.
-Ocenę pracy cytometru oraz używanych odczynników przy użyciu
polistyrenowych, o wystandaryzowanej średnicy fluorosfer lub
stabilizowanych preparatów komórek krwi ludzkiej.
-Standaryzację aparatu należy przeprowadzać z wykorzystaniem
identycznych parametrów odczytów zarówno dla prób kontrolnych
jak i materiału diagnozowanego.

OCENA STABILNOŚCI UKŁADÓW
OPTYCZNEGO ORAZ PRZEPŁYWOWEGO
Codzienną
kontrolę
układu
optycznego
i
przepływowego należy przeprowadzać przy użyciu
zestawu kontrolnego zawierającego zawiesinę
polistyrenowych kulek połączonych z fluorochromem
tzw. fluorosfer, zawieszonych w ośrodku wodnym w
odpowiednim stężeniu, zawierających surfaktanty i
konserwanty. Długość fali światła fluorescencyjnego
emitowanego przez barwnik zawarty w fluorosferach
powinien mieścić się w zakresie od 525 nm do 700
nm przy wzbudzeniu światłem lasera o długości fali
488 nm.
Do oceny uzyskiwanych parametrów należy
wykorzystać wcześniej utworzony wykres Levey-
Jenningsa, gdzie 95% wartości badanych
parametrów powinno mieścić się w zakresie ± 2SD.

OCENA STABILNOŚCI UKŁADÓW
OPTYCZNEGO ORAZ PRZEPŁYWOWEGO
Przygotować protokół zawierający cytogram FS vs SS
oraz
histogramy
jednoparametrowe
dla
FS
i
poszczególnych fluorescencji w skali logarytmicznej
określając wartość kolorów na 0%, na histogramach
należy założyć bramki liniowe.
Za pomocą detektorów ustawić pozycję pików
poszczególnych analizowanych fluorescencji na środku
każdego
histogramu.
Obramkowana
populacja
analizowanych fluorosfer na cytogramie FS vs SS
powinna zawierać min. 95% całości badanych kulek.
W ciągu 5 dni należy wykonać 20 kolejnych prób
kontrolnych, zebrać dane dotyczące wartości położenia
piku i HPCV, obliczyć wartości średnie SD i 2 SD i
utworzyć wykres Levey-Jenningsa.
Codzienną procedurę standaryzacji aparatu należy
wykonywać na podstawie protokołu do analizy zestawu
kontrolnego w sposób wyżej opisany, zapisywać wartości
HPCV oraz pozycję pików i nanosić na wykres Levey-
Jenningsa
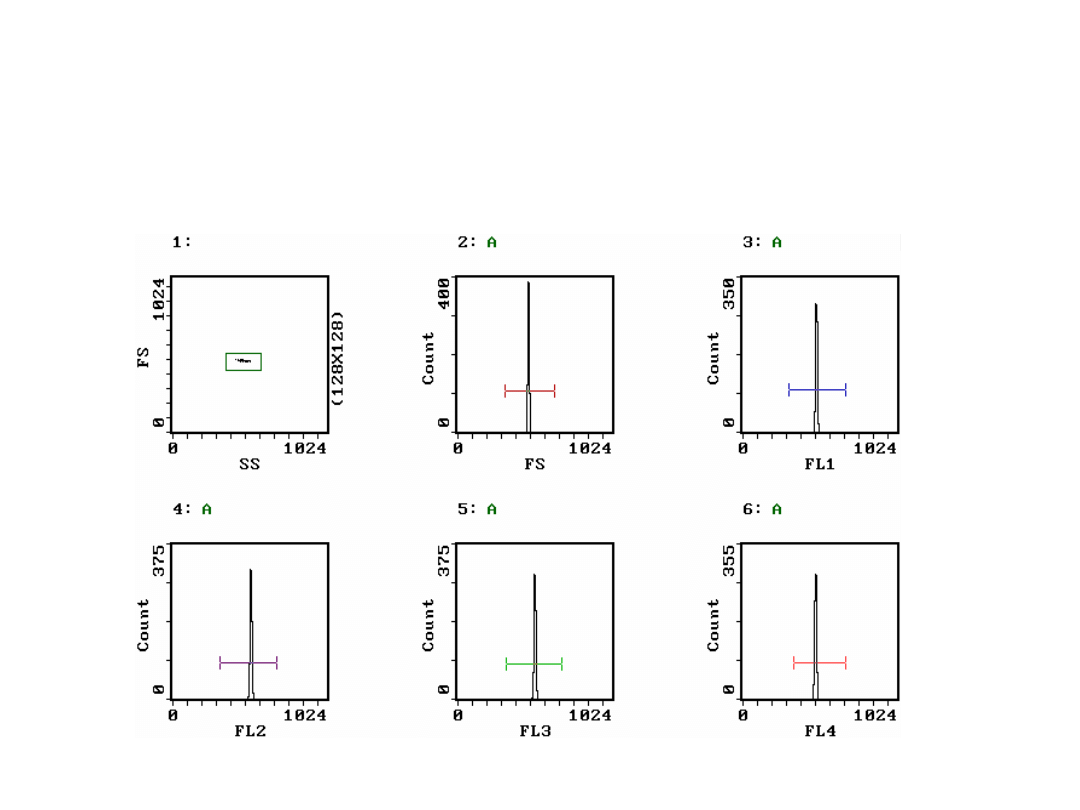
Przykładowe histogramy fluorosfer
wyznakowanych fluorochromami FL1, FL2, FL3
i FL4 [1].
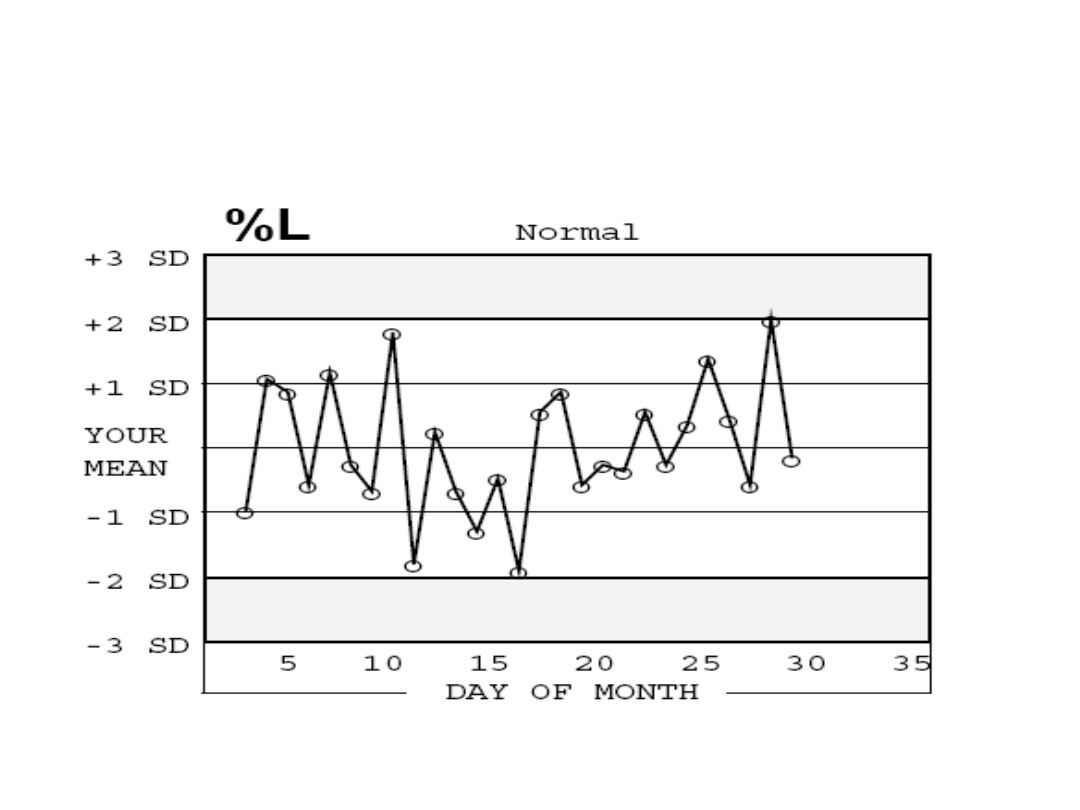
Przykład wykresu Levey-Jenningsa

OCENA STABILNOŚCI SYGNAŁÓW
FLUORESCENCJI ORAZ WERYFIKACJA
LINIOWOŚCI.
Ustalenie
standardów
intensywności
fluorescencji oraz weryfikację liniowości aparatu
stosuje się dla zapewnienia tego samego
wzmocnienia dla sygnałów o małej i dużej
intensywności.
W tym celu można użyć zestawu zawierającego
fluorosfery o różnych, lecz ściśle określonych
poziomach intensywnościach fluorescencji.
Długość światła emitowanego przez barwnik
zawarty w fluorosferach powinien mieścić się w
zakresie od 525 nm do 700 nm przy wzbudzeniu
światłem lasera o długości fali 488 nm.

OCENA STABILNOŚCI SYGNAŁÓW
FLUORESCENCJI ORAZ WERYFIKACJA
LINIOWOŚCI.
Należy utworzyć protokół zawierający
cytogram FS vs SS oraz histogramy
jednoparametrowe
dla
FS
i
poszczególnych
fluorescencji
w
skali
logarytmicznej,
następnie
analizować
próbkę składającą się ze wszystkich
połączonych fluorosfer. Określić każdą
wartość szczytową fluorescencji, zapisując
średnie wartości dla danego kanału.
Wykres
średnich
wartości
powinien
tworzyć linię prostą, co świadczy o
prawidłowym skalibrowaniu aparatu [26,
28, 29].

OCENA KOMPENSACJI FLUORESCENCJI
ORAZ CZUŁOŚCI CYTOMETRU
.
Należy
dokładnie
wyregulować
ustawienia
kompensacji kolorów oraz czułość aparatu. W tym
celu można wykorzystać gotowe zestawy
kontrolne oferowane przez różne firmy.
Mogą to być zestawy kulek fluorescencyjnych
jedno-, dwu- lub trzy kolorowych. Każdy z tych
zestawów zawiera oprócz barwionych fluorosfer
(FITC, PE, PerCP lub PerCP-Cy5,5 oraz APC)
również kulki niewybarwione. Niewybarwione
kulki pozwalają na dokładne określenie pozycji
oraz zakresu kanałów, w jakiej powinna znajdować
się tzw. „negatywna kontrola”. Różnica pomiędzy
średnią wartością kanału dla niewybarwionych
kulek oraz średnią wartością kanału, w którym
znajdują się fluorosfery połączone z odpowiednim
barwnikiem pozwalają określić czułość aparatu.
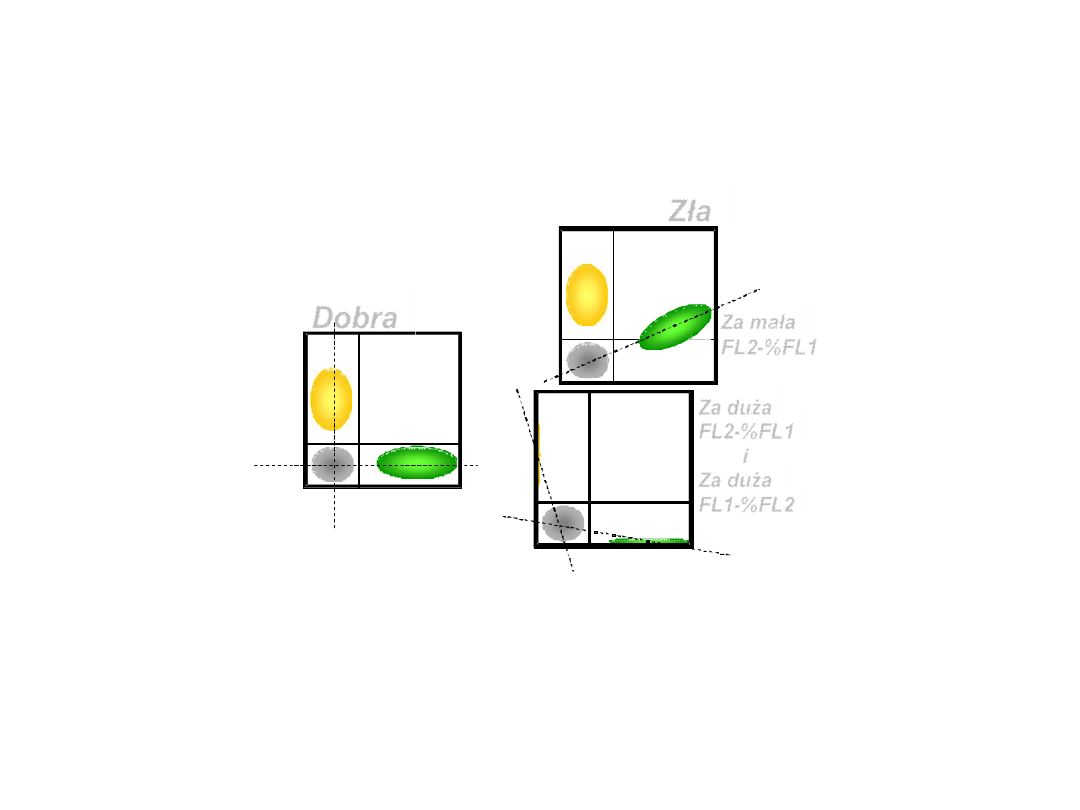
Kompensacjafluorescencji
Zła
FL1
F
L
2
Dobra
x-mean
Q1=Q3
y-mean
Q3=Q4
1 2
3 4
FL1
F
L
2
Za mała
FL2-%FL1
y-mean
Q3 < Q4
1 2
3 4
FL1
L
F
L
2
Za duża
FL2-%FL1
i
Za duża
FL1-%FL2
y-mean
Q3 > Q4
x-mean
Q1 < Q3
1 2
3 4
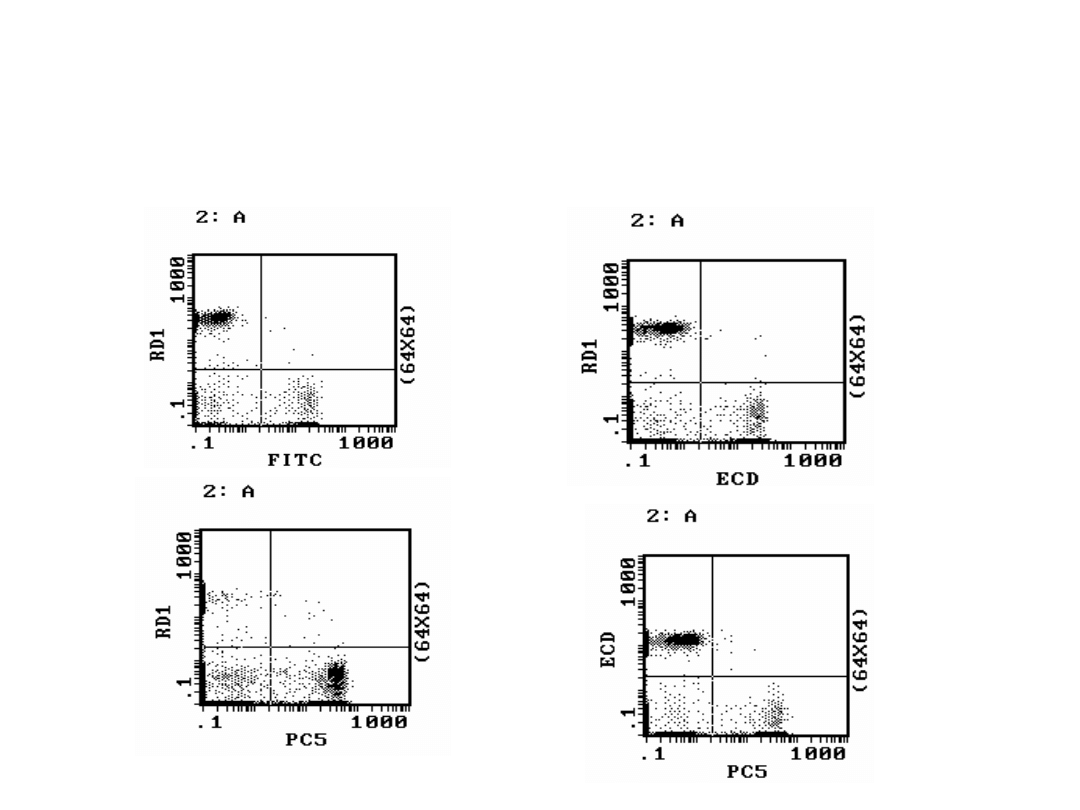
Histogramy dwuparametrowe komórek kontrolnych
wyznakowanych przeciwciałami w kombinacjach z
użyciem 4 kolorów FITC, RD1, ECD, PC5, dla populacji
limfocytów (bramka A), cytometr COULTER EPICS XL [8].
Document Outline
Wyszukiwarka
Podobne podstrony:
2 PODSTAWOWE POJĘCIA I CZYNNOŚCI POMIAROWE I KONTROLNE(2)id 20625 ppt
9 Kontrola strategiczna 2015 (Kopia powodująca konflikty (użytkownik Maciek Komputer) 2016 05 20) pp
Procedura weterynaryjnej kontroli granicznej ppt
Protokół kontroli obowiazkowej zakonczonej budowy obiektu budowlanego, Pliki DOC PPT
Badania kontrolne chorych po radykalnym leczeniu raka piersi ppt
9 Kontrola strategiczna 2015 (Kopia powodująca konflikty (użytkownik Maciek Komputer) 2016 05 20) pp
03 Sejsmika04 plytkieid 4624 ppt
Choroby układu nerwowego ppt
10 Metody otrzymywania zwierzat transgenicznychid 10950 ppt
10 dźwigniaid 10541 ppt
03 Odświeżanie pamięci DRAMid 4244 ppt
Prelekcja2 ppt
więcej podobnych podstron