
Mechanizm
reakcji
• Przy opisie mechanizmu reakcji
użyteczne są następujące
pojęcia:
– Stała równowagi
– Zmiana energii swobodnej
– Entalpia
– Entropia
– Energia dysocjacji wiązania
– Kinetyka
– Energia aktywacji
Specyficzna kolejność rozrywania się i tworzenia wiązań w miarę
przechodzenia od substratu do produktu określana jest jako
mechanizm reakcji
.

•
Termodynamika
zajmuje się relacją między energią
substratów i produktów
•
Kinetyka
opisuje szybkość reakcji
• Aby reakcja miała praktyczne zastosowanie zmiany
energii powinny faworyzować żądany produkt,
a reakcja winna być wystarczająco szybka
Mechanizm reakcji
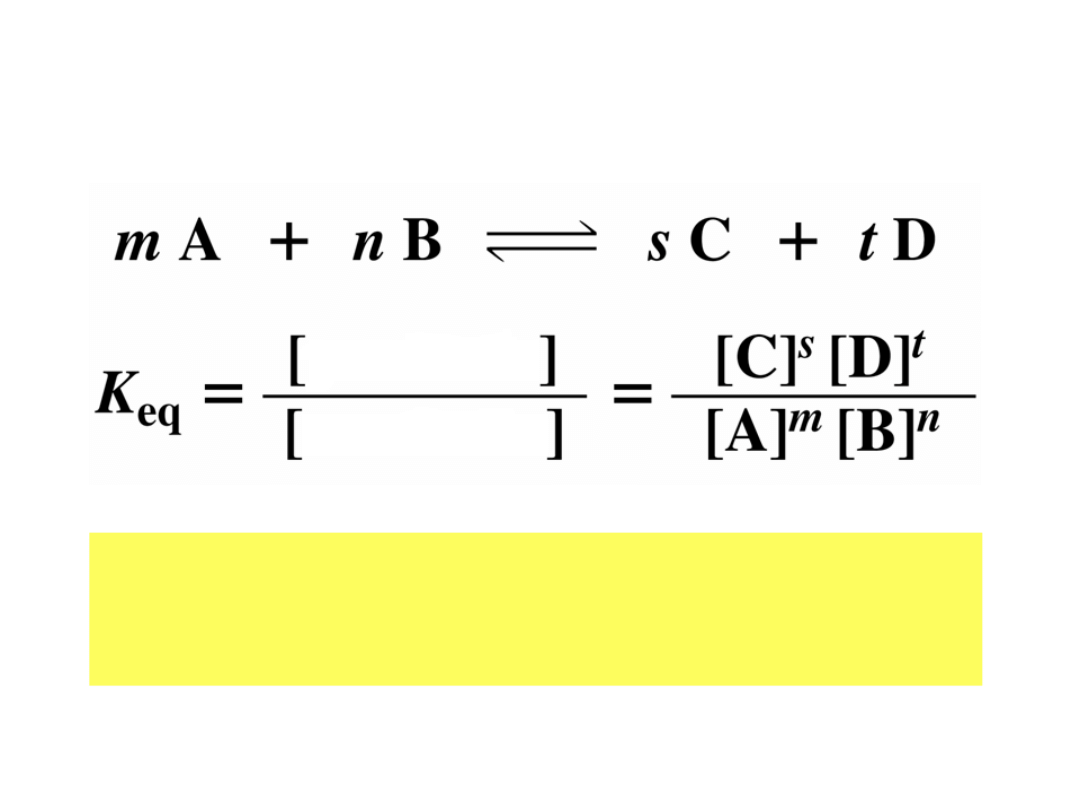
Stała równowagi
• Duża wartość stałej równowagi oznacza, że
reakcja jest niemal całkowicie przesunięta
jest w stronę produktów
produkty
substraty

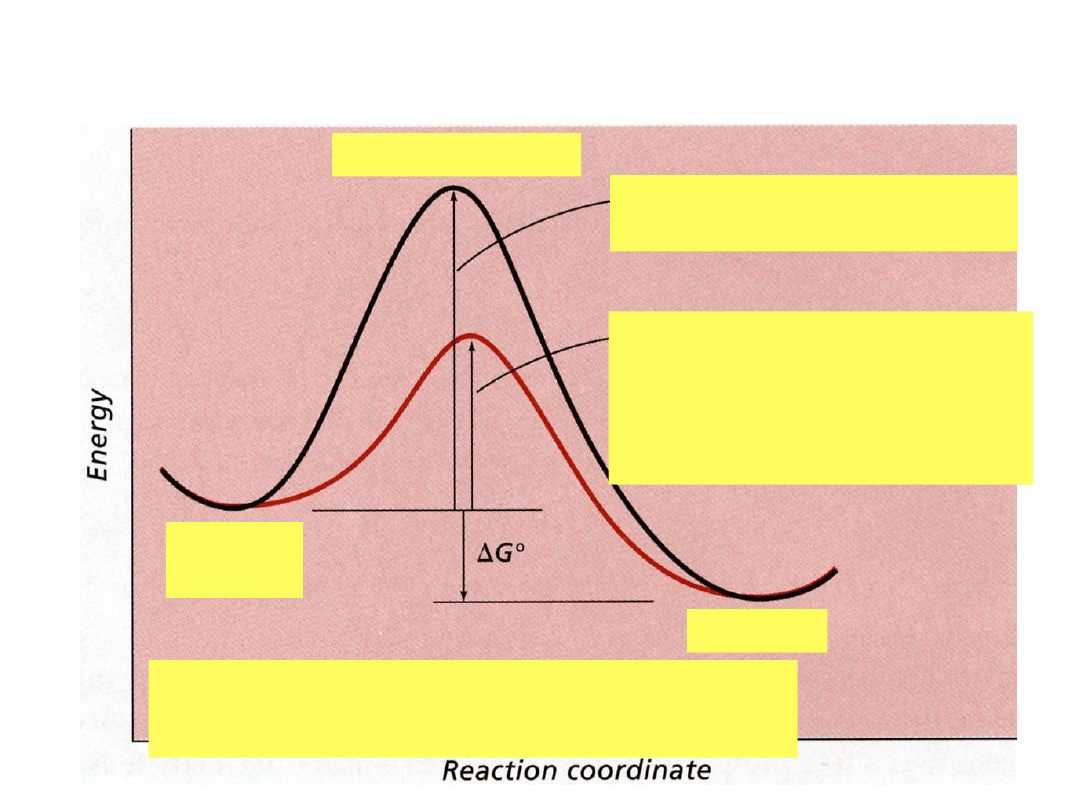
Zmiana energii
swobodnej
• G
o
= energia swobodna (produkty - substraty),
ilość energii wymagana do wykonania pracy
• Ujemna wartość odpowiada reakcji przebiegającej
spontanicznie
G
o
= -RT lnK
eq
gdzie R (stała gazowa) = 8,314 x 10
-3
kJ/K x mol
a T = temperatura w kelvinach

G° określa równowagę reakcji
• Jeśli wartość G° jest
ujemna
, w stanie
równowagi uprzywilejowane są
produkty
• Jeśli wartość G° jest
dodatnia
, w stanie
równowagi uprzywilejowane są
substraty
• Jeśli wartość G° wynosi
zero
, stała
równowagi jest równa
1
Zmiana energii swobodnej

Czynniki określające G
Zmiana energii swobodnej zależy od
•
Entalpii reakcji
•
Entropii reakcji
G = H - TS
H = (entalpia produktów) - (entalpia substratów
)
S = (entropia produktów) - (entropia substratów
)
T = temperatura w kelvinach

Entalpia
• H
o
= ciepło wydzielone lub pochłonięte w
czasie reakcji w warunkach standardowych
• Reakcja egzotermiczna: -H, ciepło jest
wydzielane
• Reakcja endotermiczna:+H, ciepło jest
pochłaniane
• W reakcjach chemicznych uprzywilejowane
są produkty o jak najniższej entalpii:
najsilniejsze wiązania

Entropi
a
• S
o
= zmiana stopnia uporządkowania,
swobody ruchu
• Wzrost temperatury, objętości, swobody
ruchu lub ilości cząstek powoduje wzrost
entropii
• W reakcjach zachodzących
spontanicznie wzrasta
nieuporządkowanie, ale maleje entalpia
• W równaniu G
o
= H
o
– TS
o
dla reakcji
organicznych wartość entropii jest
zwykle pomijalnie niska
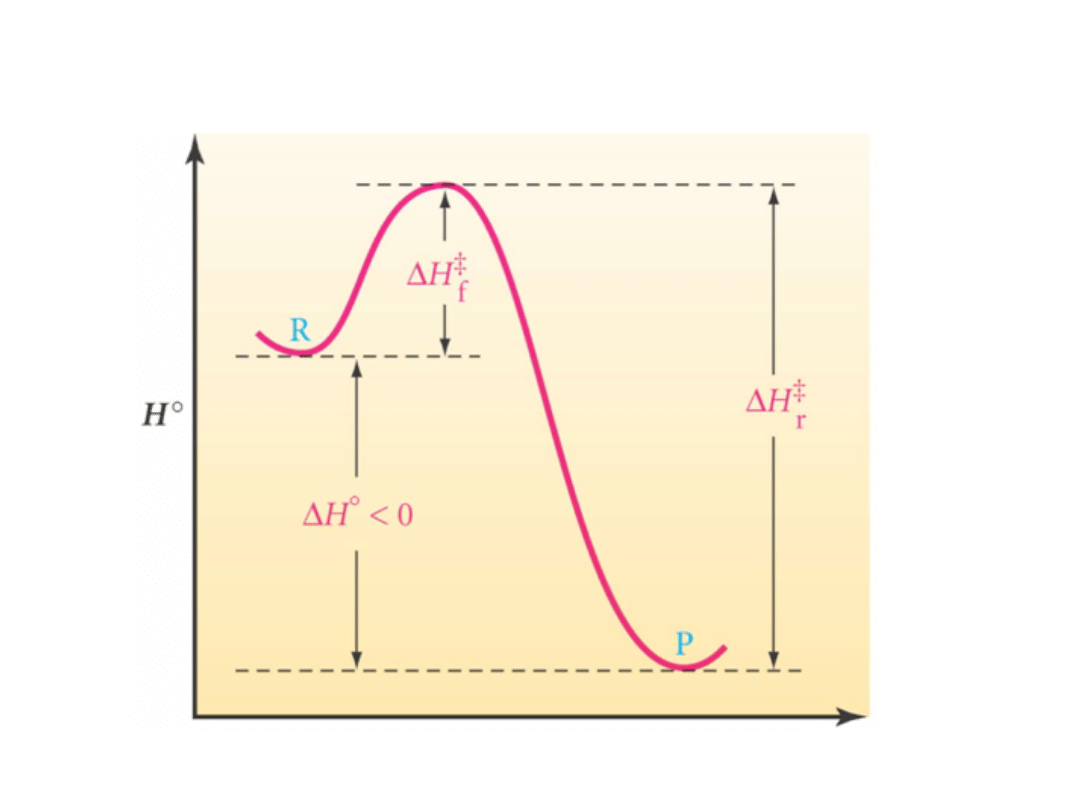
Wykres reakcji egzotermicznej
Postęp
reakcji
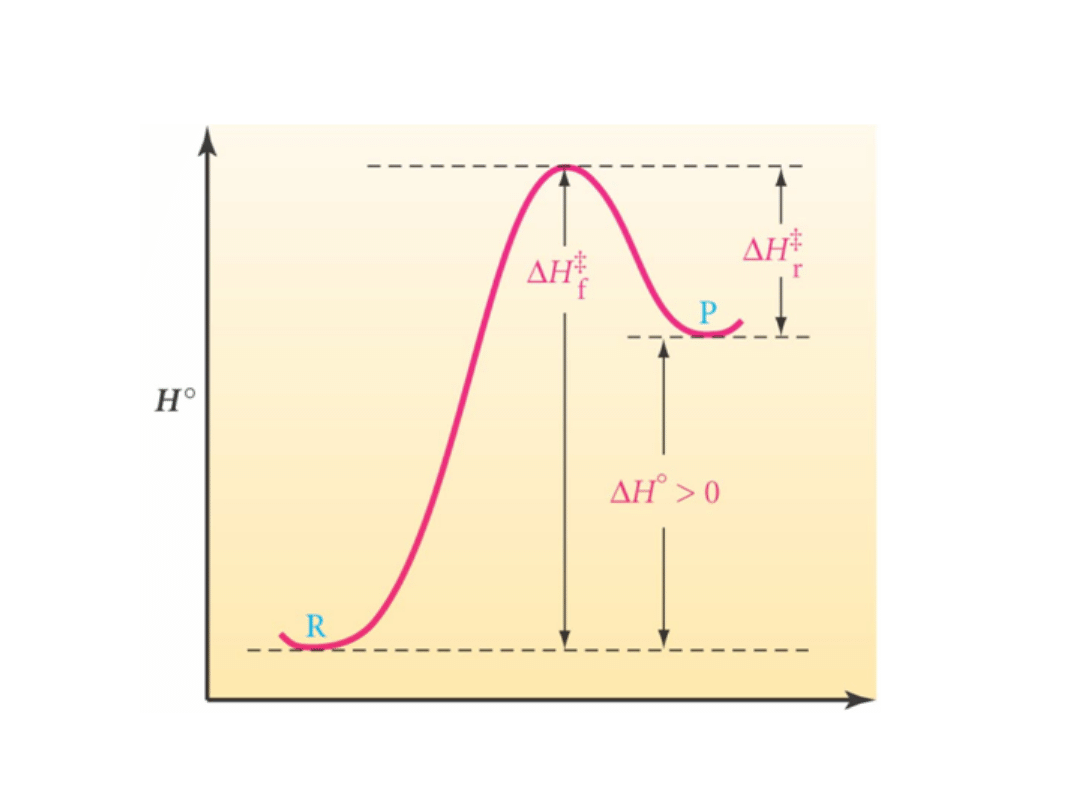
Wykres reakcji endotermicznej
Postęp reakcji
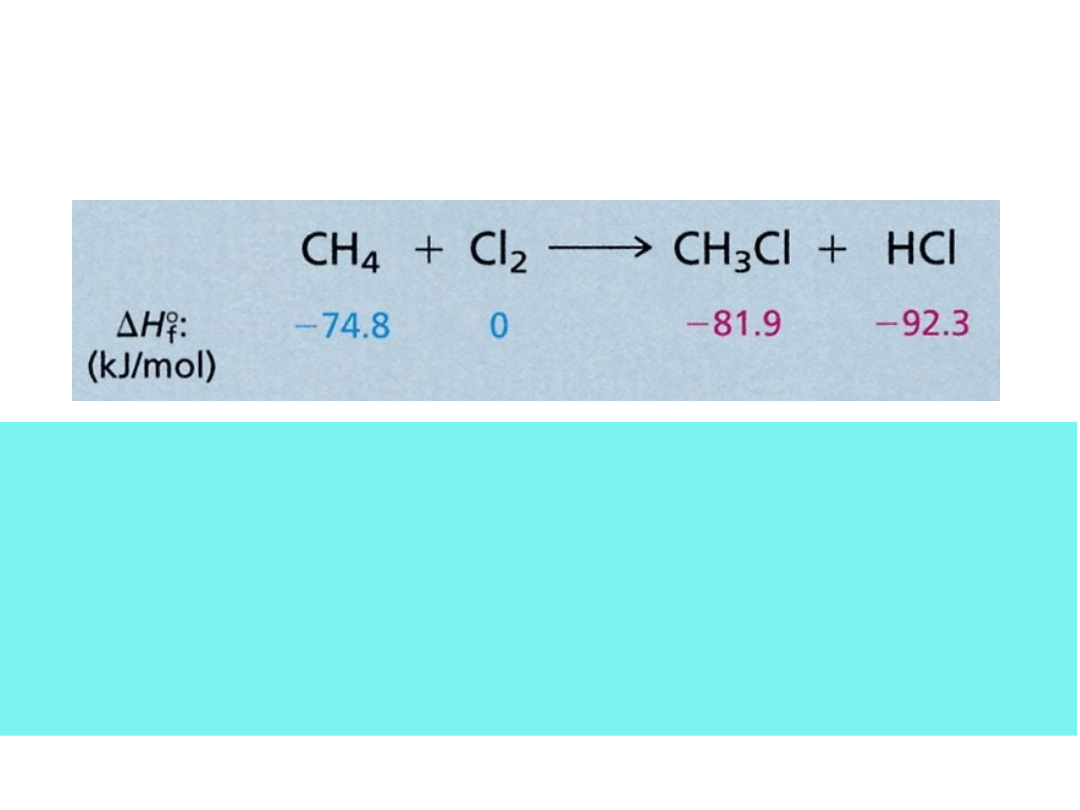
Ogólne ciepło reakcji wyrażone jest równaniem:
H° = (ciepło tworzenia produktów) – (ciepło tworzenia
substratów)
czyli dla chlorowania metanu:
H° = (-81,9 – 92,3) – (-74,8) = 99,4 kJ/mol
Jak oszacować czy reakcja jest egzo- czy
endotermiczna?

Energia dysocjacji wiązania
(BDE)
Do identycznego wniosku można
dojść wykorzystując energię
dysocjacji wiązań.
• Rozerwanie wiązania wymaga
dostarczenia energii (+BDE)
• Tworzenie wiązania przebiega z
wydzieleniem energii (-BDE)
• Do obliczeń wykorzystuje się dane
uzyskane doświadczalnie dla
homolitycznego rozpadu wiązań
A:B A
.
+ B
.
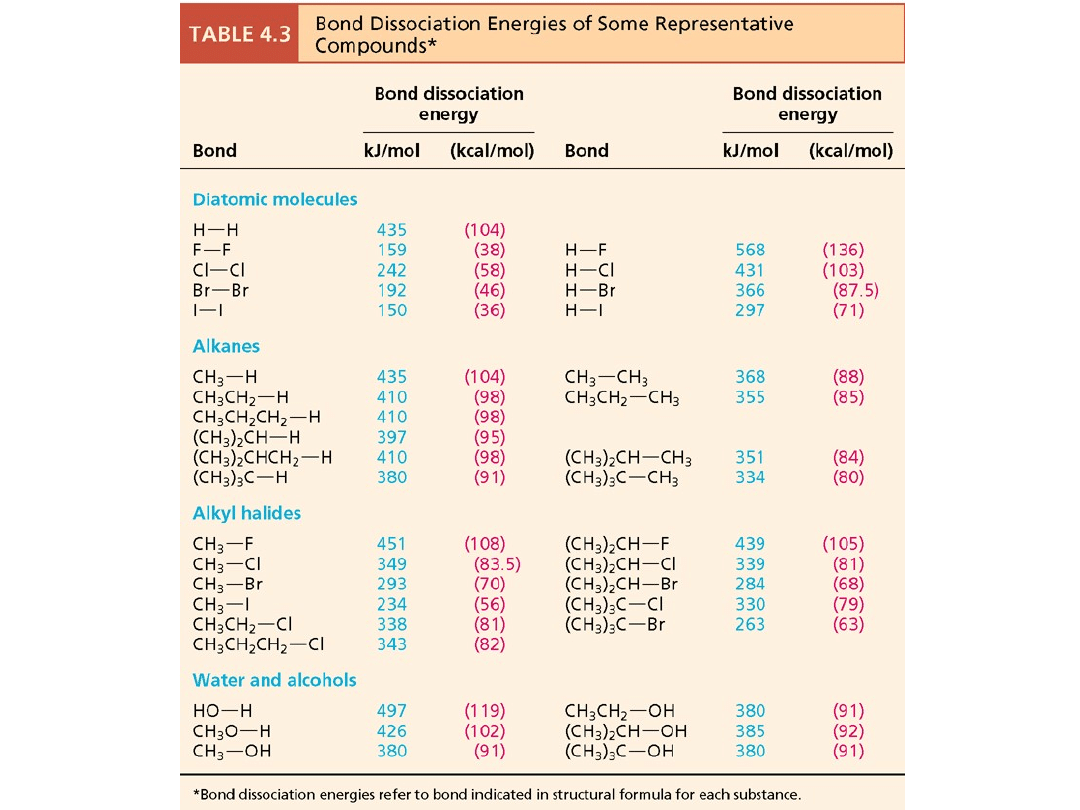
H° = (BDE wiązań rozerwanych) – (BDE wiązań
utworzonych)
dla reakcji chlorowania metanu:
H° = (435 + 242) – (349 + 431) = -103 kJ/mol
Energia dysocjacji wiązania (BDE)
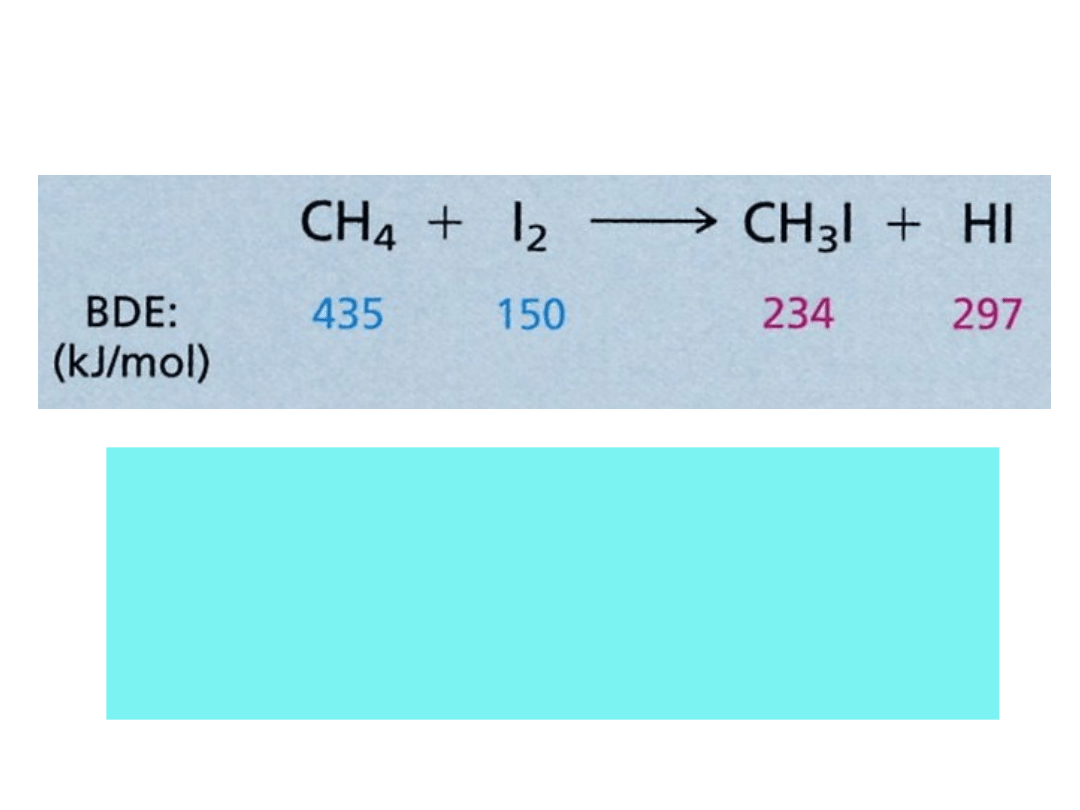
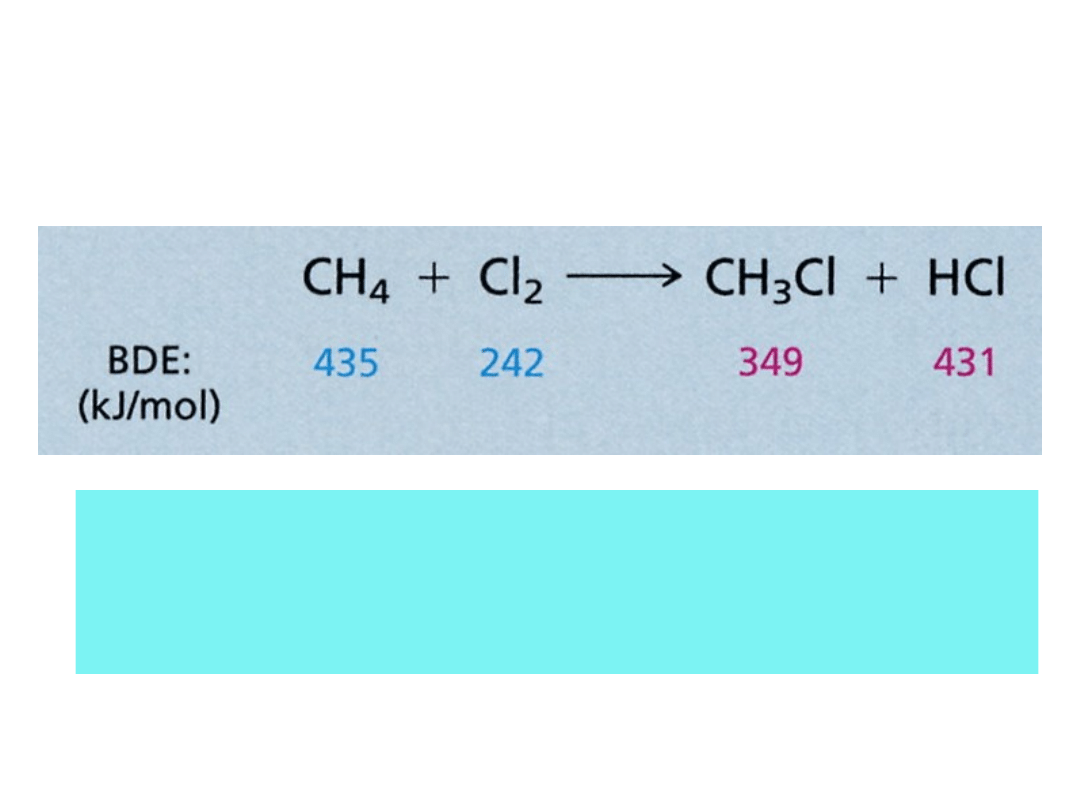
Energia dysocjacji wiązania (BDE)
H° = (BDE wiązań rozerwanych) – (BDE
wiązań
utworzonych)
dla reakcji jodowania metanu:
H° = (435 + 150) – (234 +297) = +54 kJ/mol
Kinetyka
• Odpowiada na pytanie: jak szybko zachodzi
reakcja?
• Szybkość reakcji jest proporcjonalna do
stężenia reagentów podniesionego do potęgi.
Rząd reakcji
• Dla reakcji
A + B C + D
szybkość = k[A]
a
[B]
b
– ‘a’ to rząd reakcji w odniesieniu do
reagenta A, a ‘b’ jest rzędem reakcji dla
reagenta B
– a + b
to
ogólny rząd reakcji
• Rząd to liczba cząsteczek reagenta
obecnego w
etapie określającym
szybkość reakcji
.
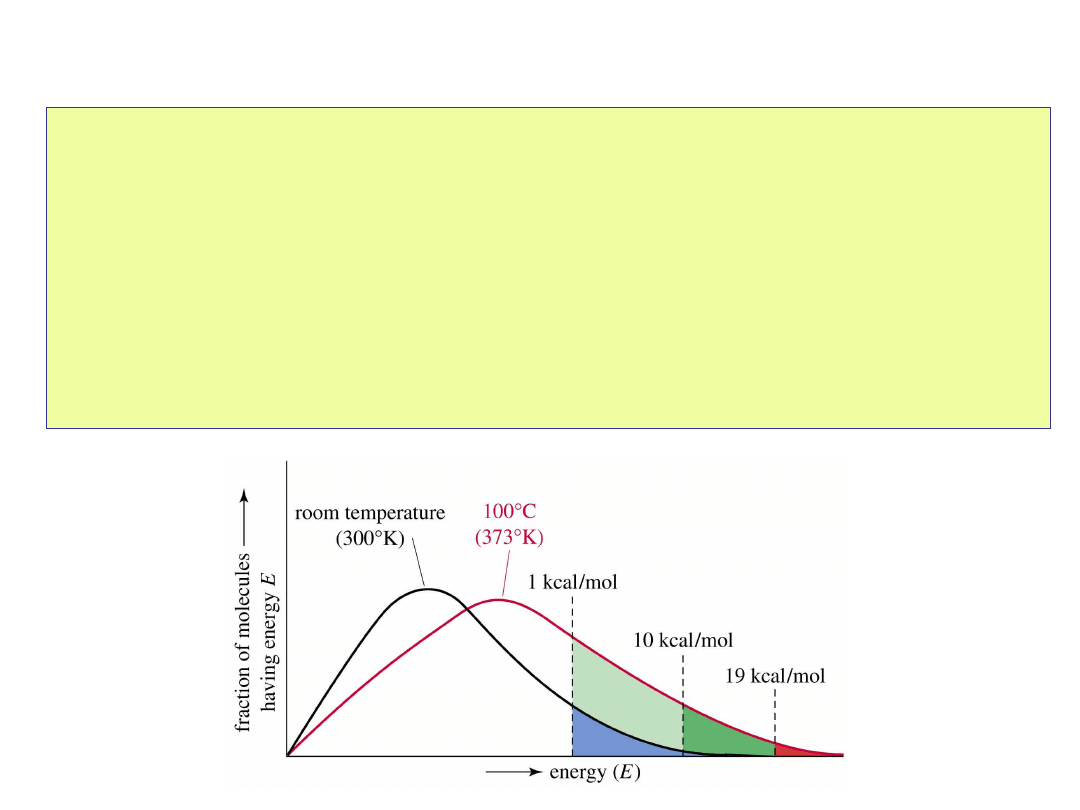
Energia
aktywacji
• Energia aktywacji
to najmniejsza ilość energii
jaką muszą mieć substraty aby osiągnąć stan
przejściowy. Zwykle oznacza się ją symbolami
E
a
lub G
‡
.
• W wyższych temperaturach więcej cząsteczek
ma odpowiednią energię aktywacji.
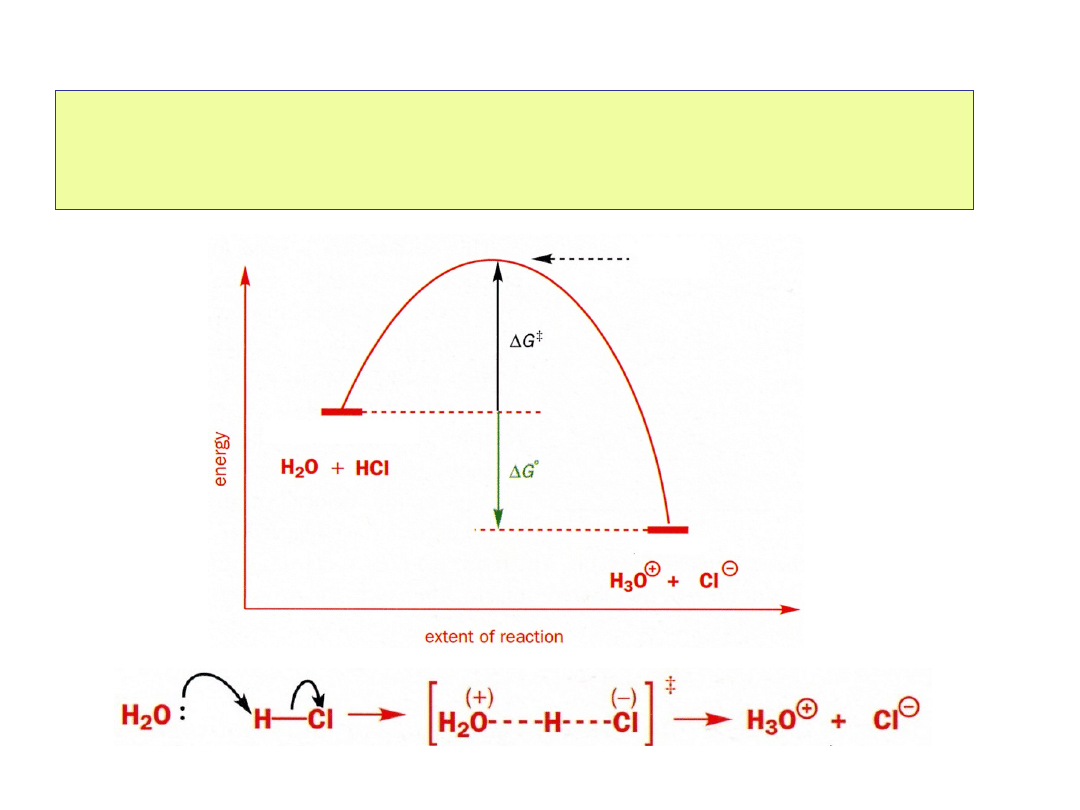
Wykres energetyczny
reakcji
• Dla reakcji jednoetapowej:
reagenty stan przejściowy produkty
reagenty
stan przejściowy
produkty
stan przejściowy
reagenty
produkty
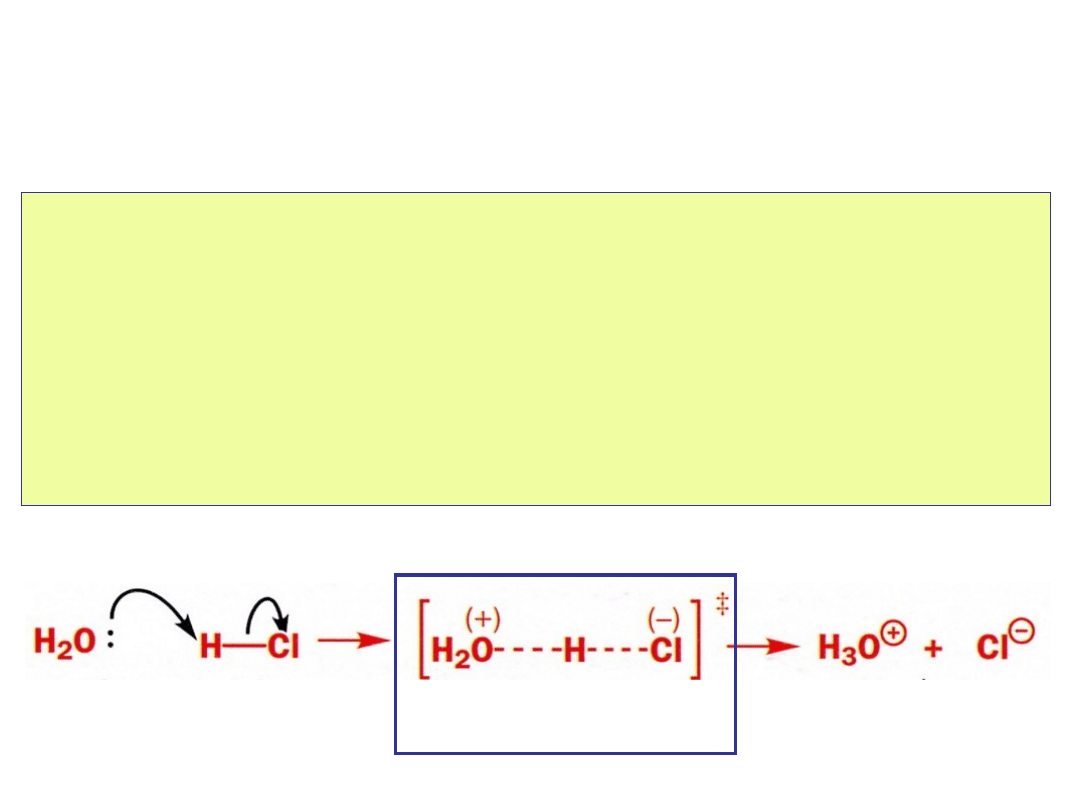
Stan przejściowy
to struktura
odpowiadająca
maksimum energii na drodze od reagentów do
produktów. Nie jest to rzeczywista cząsteczka,
ponieważ wiązania w tym stanie są w trakcie
rozrywania i tworzenia się, a dookoła centralnego
atomu może być więcej wiązań niż dozwolone przez
reguły walencyjności. Nie da się go wyizolować.
Stan przejściowy
reagenty
stan
przejściowy
produkty
Reagenty
Stan przejściowy
Związek przejściowy
Stan przejściowy
Produkt
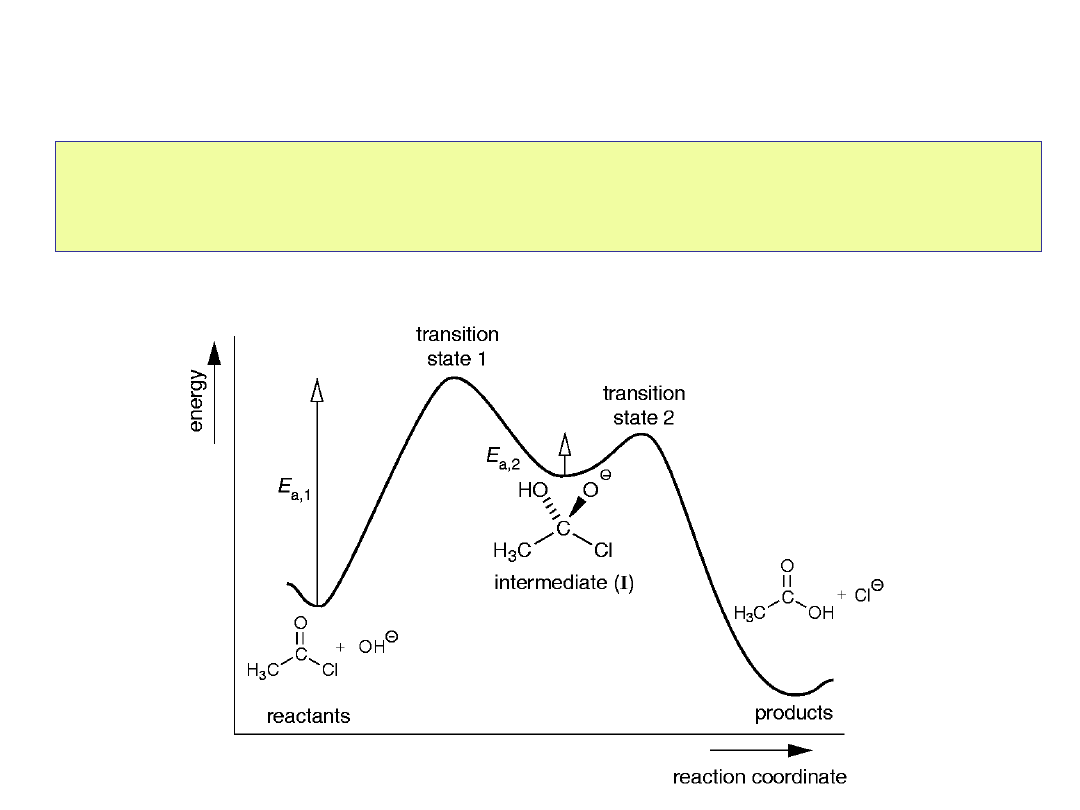
Wykres energetyczny reakcji dwuetapowej
Stan przejściowy
Energia aktywacji dla reakcji
bez katalizatora
Energia aktywacji dla
reakcji katalizowanej. Stan
przejściowy ma niższą
energię, bo jest stabilizowany
przez katalizator.
Reagent
y
Produkty
Katalizator nie zmienia
wartościG°
Katalizator przyspiesza reakcję

•
Stan przejściowy
odpowiada
maksimum energii
–
każda, nawet niewielka zmiana energii, prowadzi do
bardziej trwałego indywiduum.
•
Związek przejściowy
to cząsteczka lub jon
odpowiadająca lokalnemu
minimum energii
– aby
powstała jakaś bardziej trwała struktura, musi być
pokonana pewna bariera energetyczna. Z tego powodu
związek przejściowy można czasem wyizolować lub
wykonać dla niego pomiary spektralne.
• Etap reakcji z największą E
a
jest najwolniejszym,
decydującym o szybkości reakcji.
Związek przejściowy, a stan przejściowy

• Karbokationy
• Wolne rodniki
• Karboaniony
Związki przejściowe
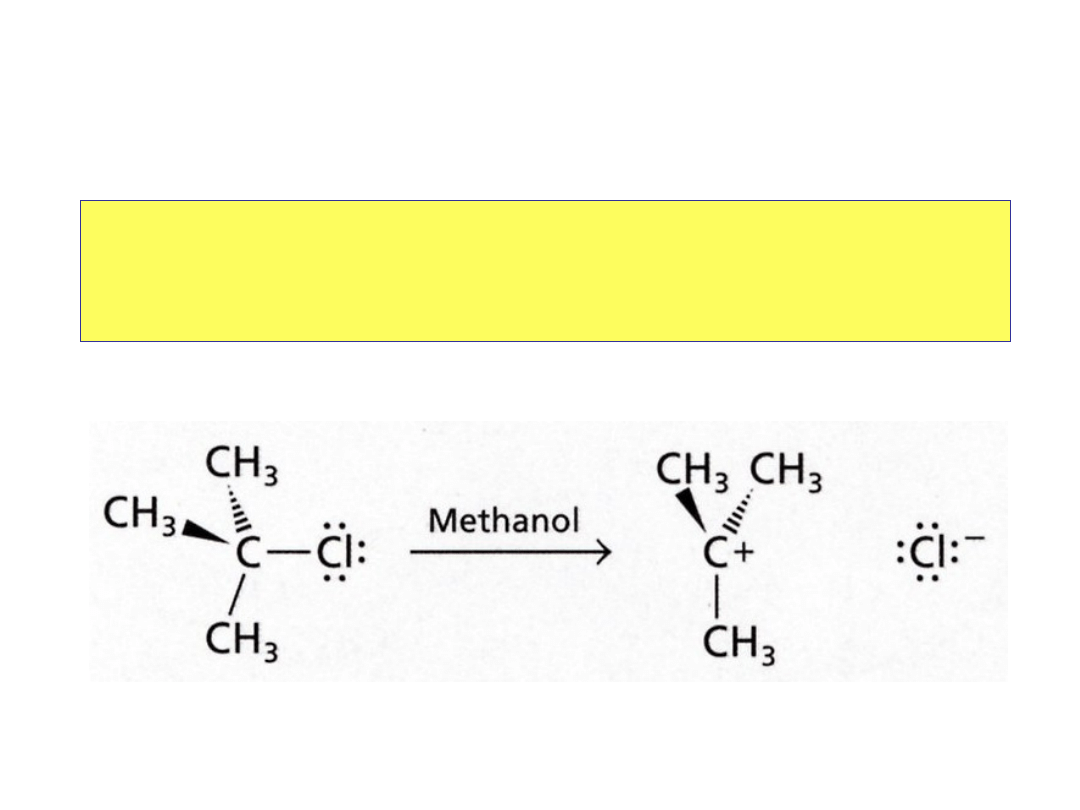
Związki przejściowe
W
heterolitycznym
rozpadzie jeden z atomów
zatrzymuje parę elektronową:
powstają
karbokationy
i
karboaniony
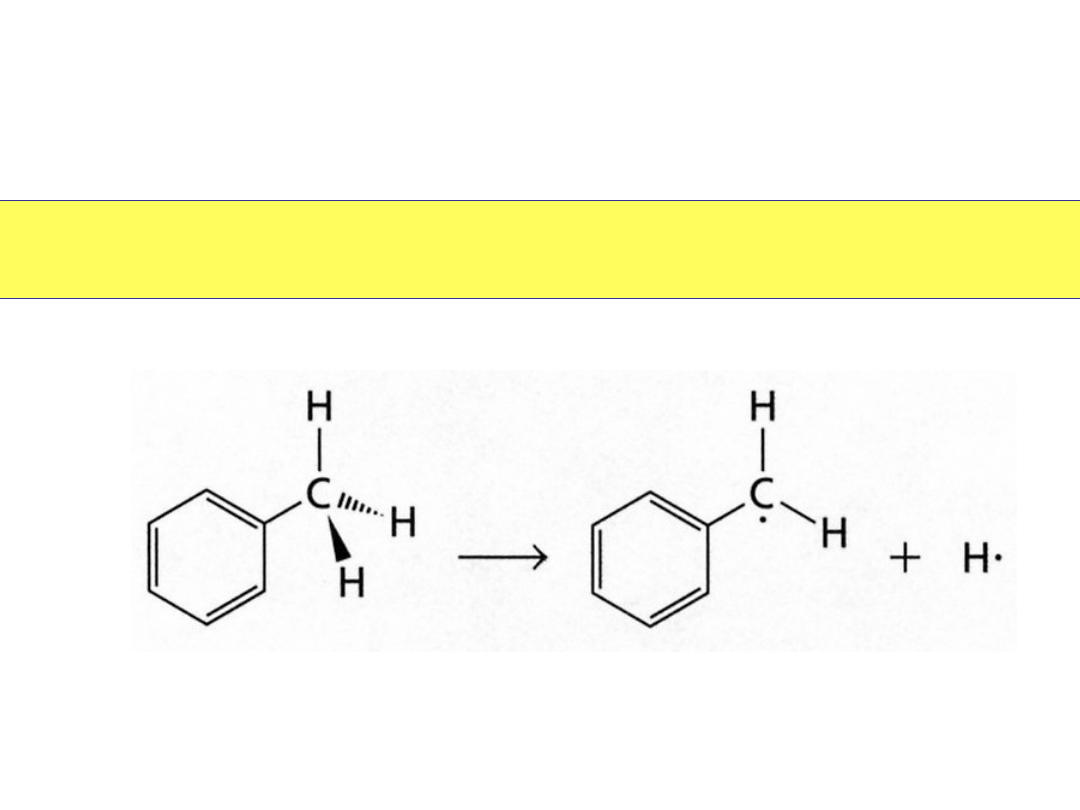
W rozpadzie
homolitycznym
każdy z atomów zatrzymuje po
jednym elektronie: powstają
rodniki
.
Związki przejściowe
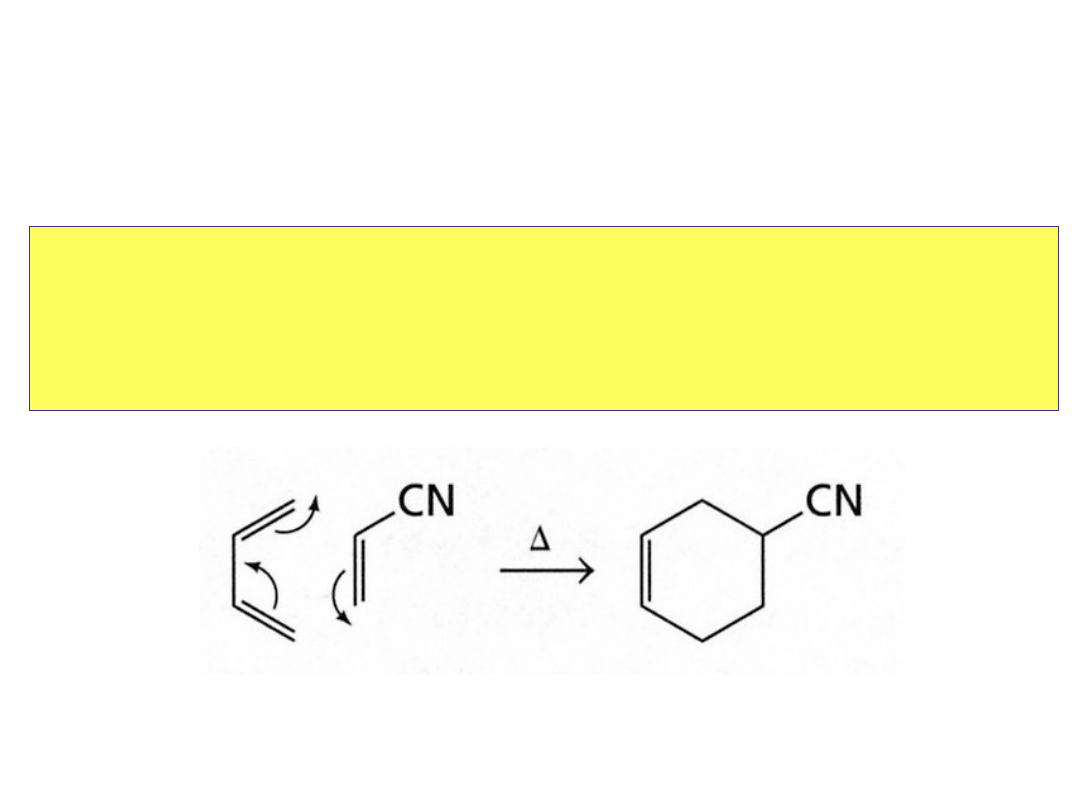
W
reakcjach
pericyklicznych
elektrony
przemieszczają się jednocześnie, co oznacza, że
wiązania zrywają się i tworzą w tym samym czasie, a
związki przejściowe nie powstają.
Reakcje pericykliczne
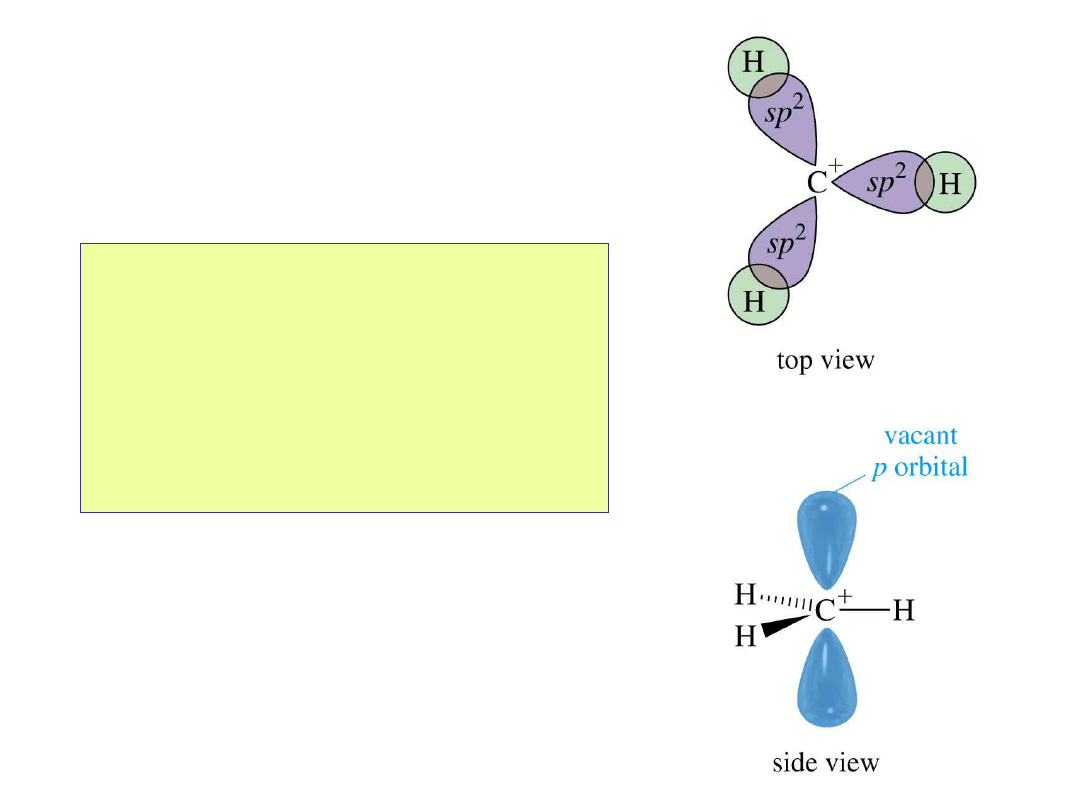
Struktura
karbokationu
• Atom węgla ma 6
elektronów i ładunek
dodatni.
• Atom węgla ma
hybrydyzację sp
2
i
pusty orbital p.
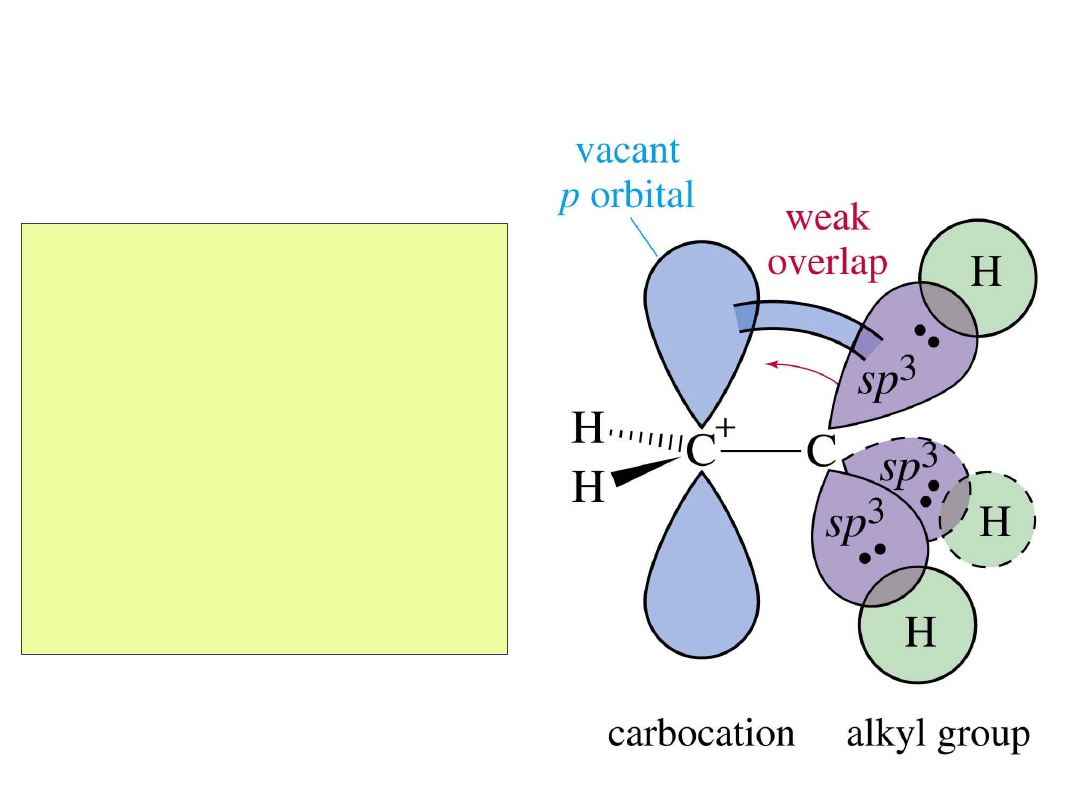
Trwałość
karbokationów
• Mogą być stabilizowane przez
podstawniki alkilowe na dwa
sposoby:
• (1) Efekt indukcyjny:
Przesunięcie gęstości
elektronowej wzdłuż wiązania
.
• (2) Hiperkoniugacja:
przesunięcie gęstości
elektronowej w wyniku
słabego nakładania się
orbitali z pustym orbitalem
p.
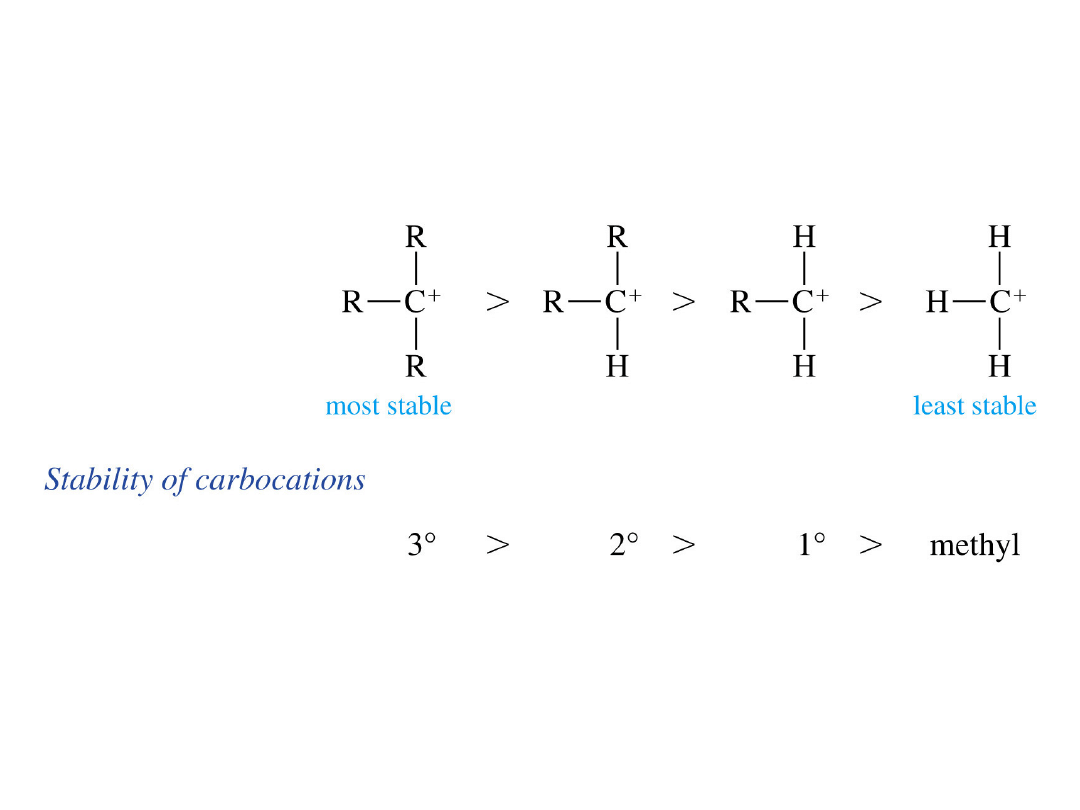
Trwałość karbokationów
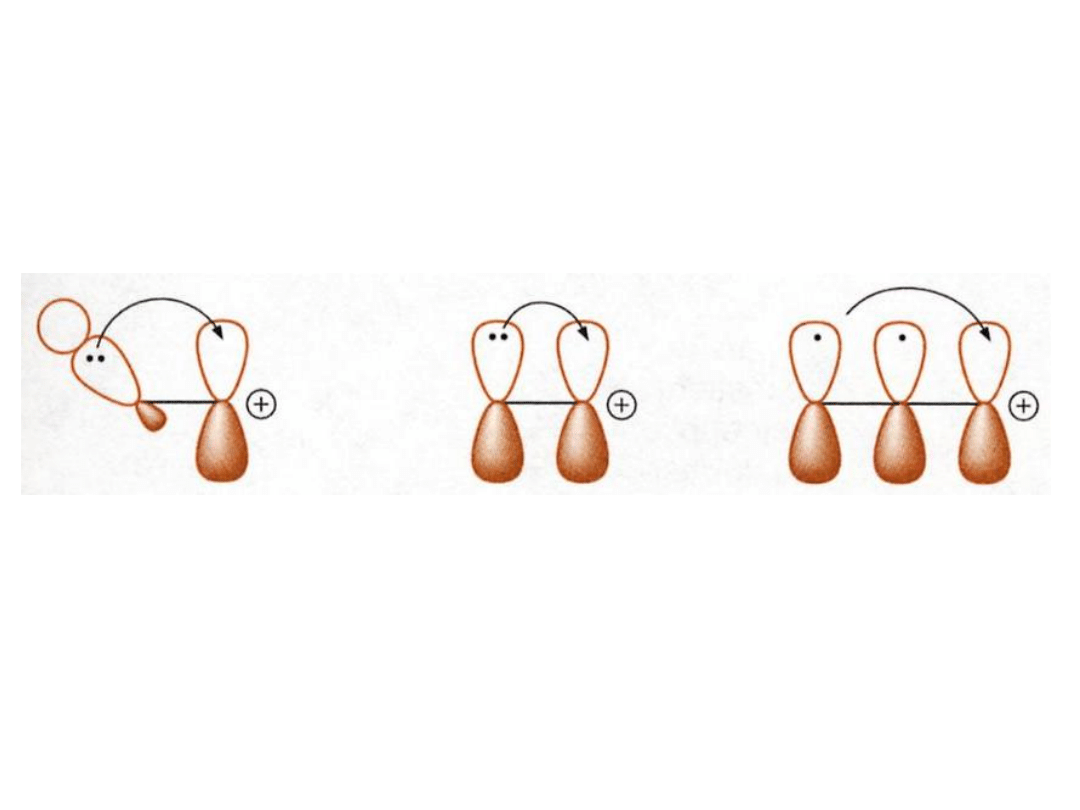
hiperkoniugacja
delokalizacja wolnej
pary elektronowej
delokalizacja
elektronów
Trwałość karbokationów
Trwałość karbokationów
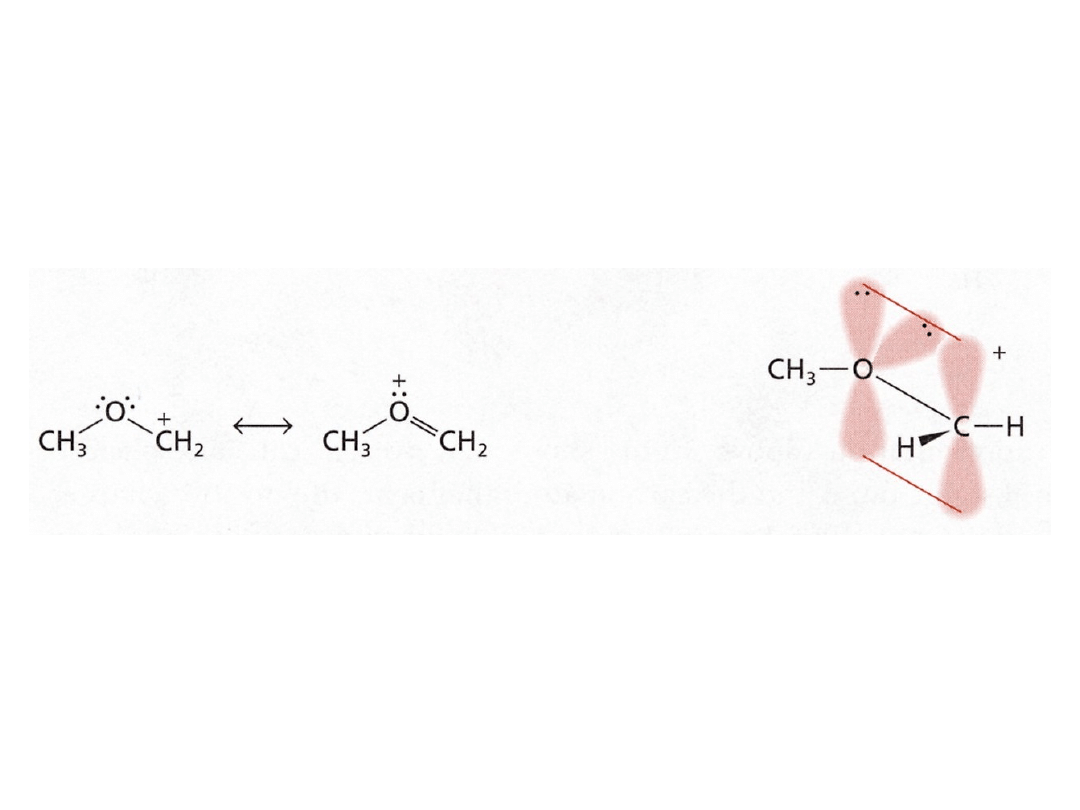
Trwałość karbokationów
Trwałość karbokationów
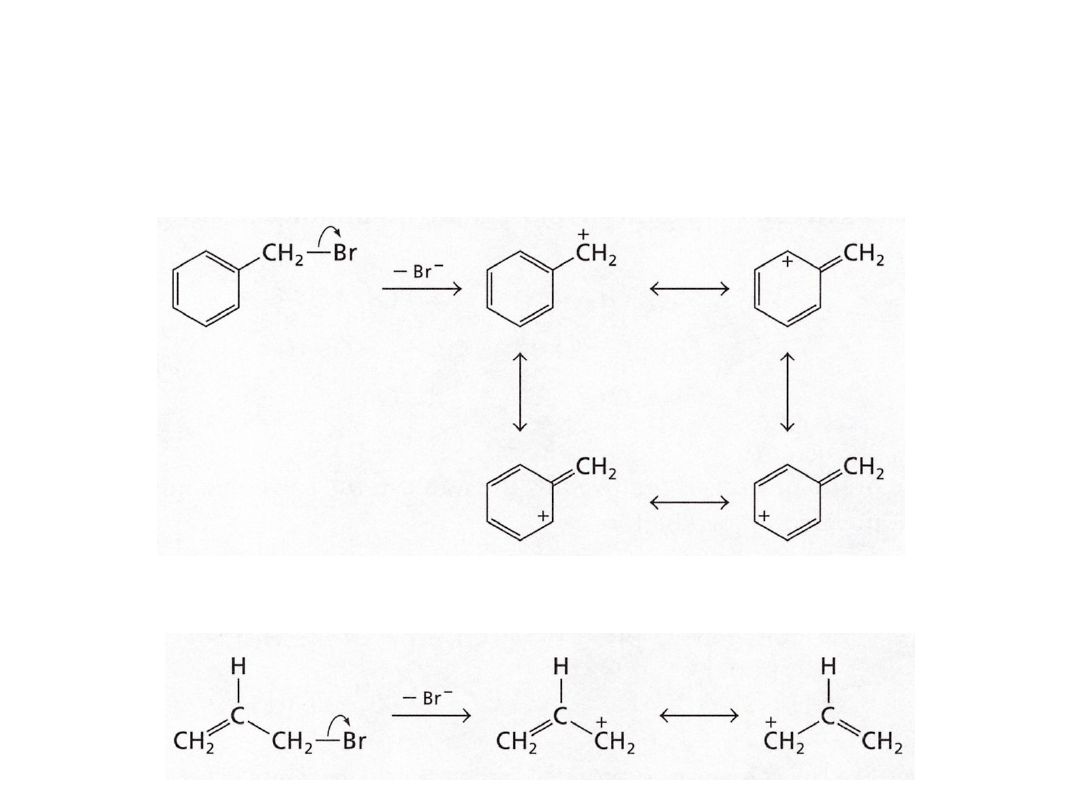
halogenek benzylowy
halogenek allilowy
Trwałość karbokationów
Trwałość karbokationów
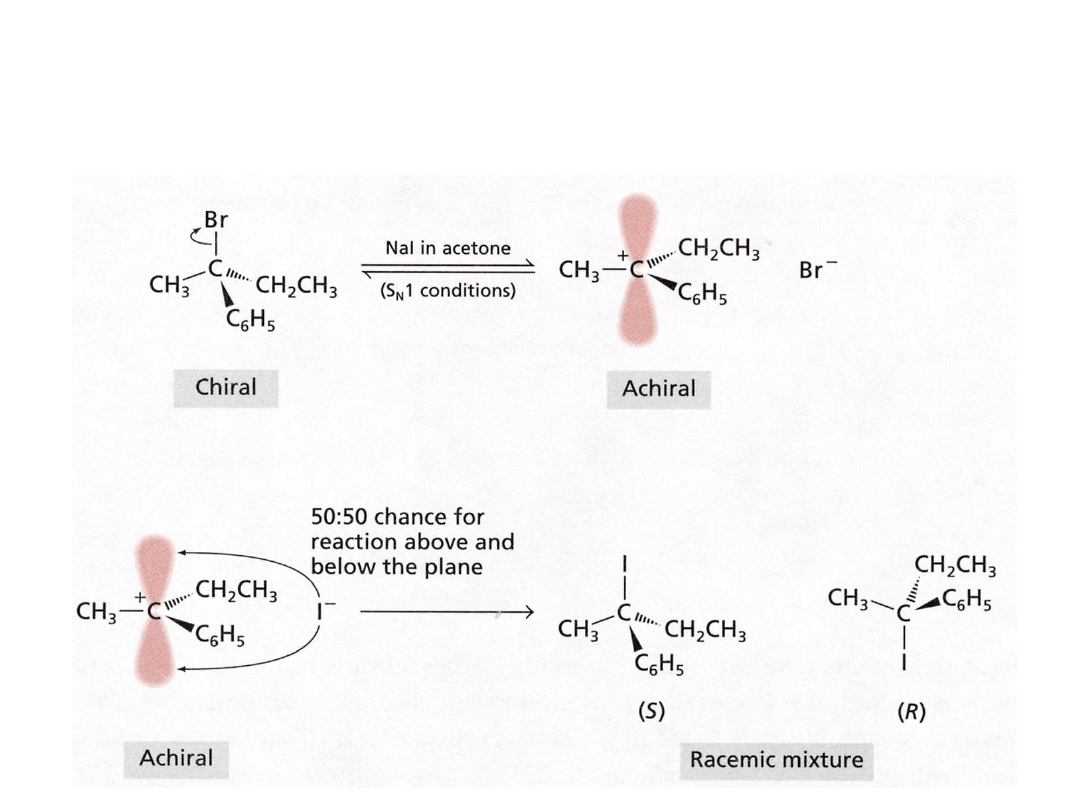
Stereochemia S
Stereochemia S
N
N
1
1
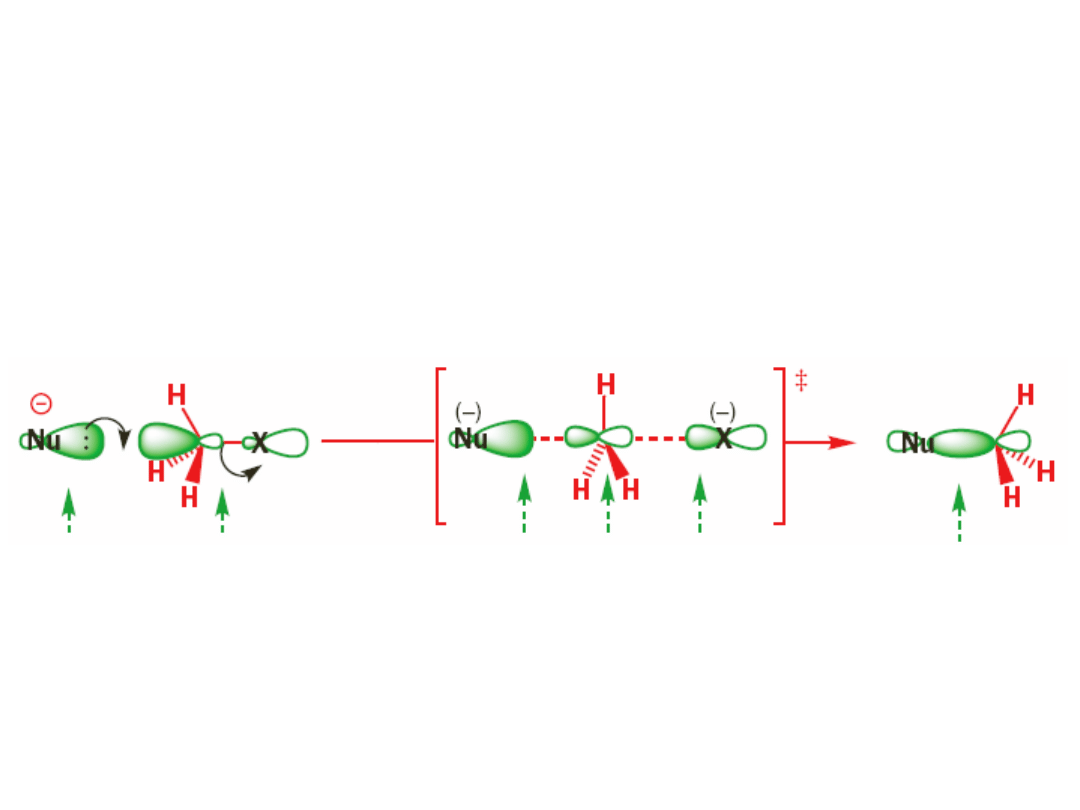
Mechanizm S
Mechanizm S
N
N
2
2
obsadzony orbital
nukleofilu (HOMO)
pusty orbital *
wiązania C-X
nowe wiązanie
w trakcie tworzenia
orbital p na
atomie Cstare wiązanie
w trakcie rozrywania
stan przejściowy
hybrydyzacja sp
2
centralnego atomu C
nowe wiązanie
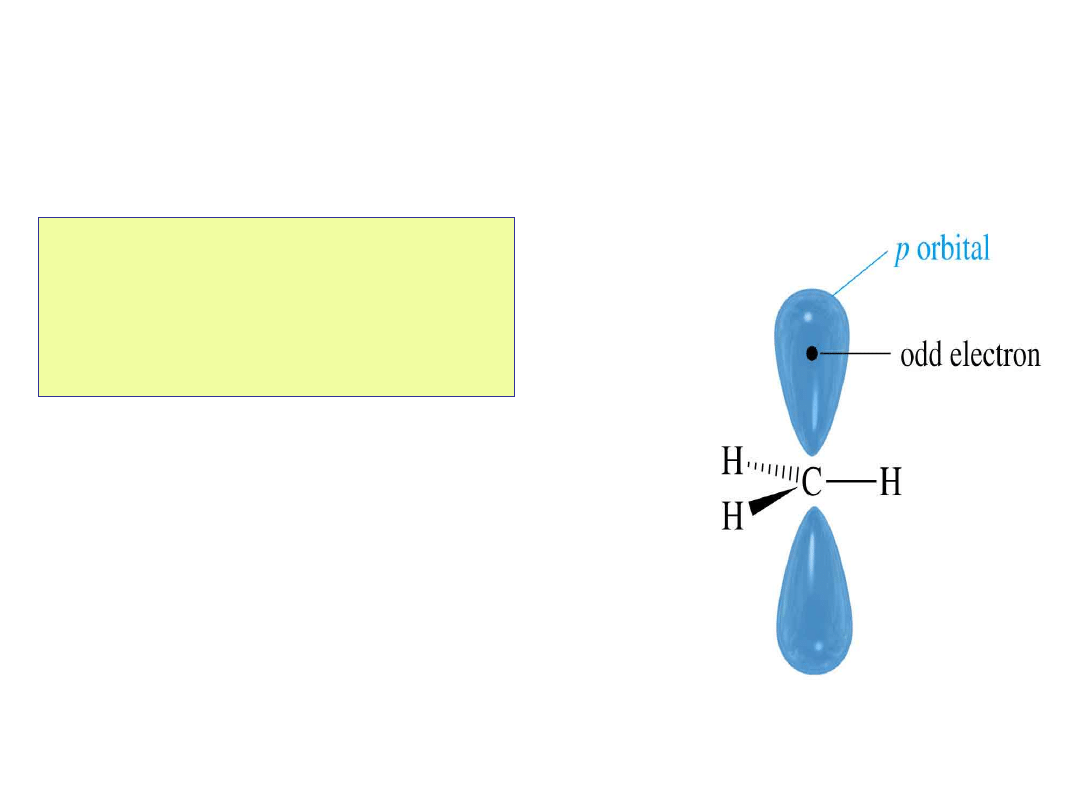
Wolne rodniki
• Mają także deficyt
elektronów
• Stabilizowane są przez
podstawniki alkilowe
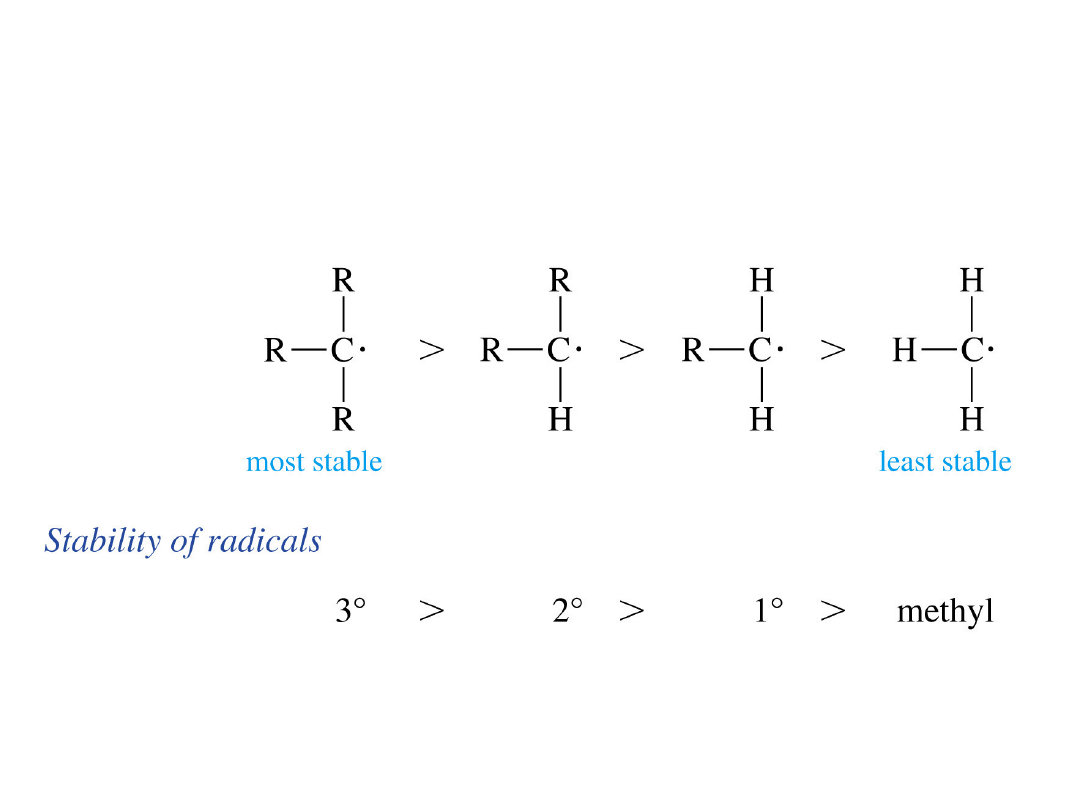
Trwałość wolnych rodników
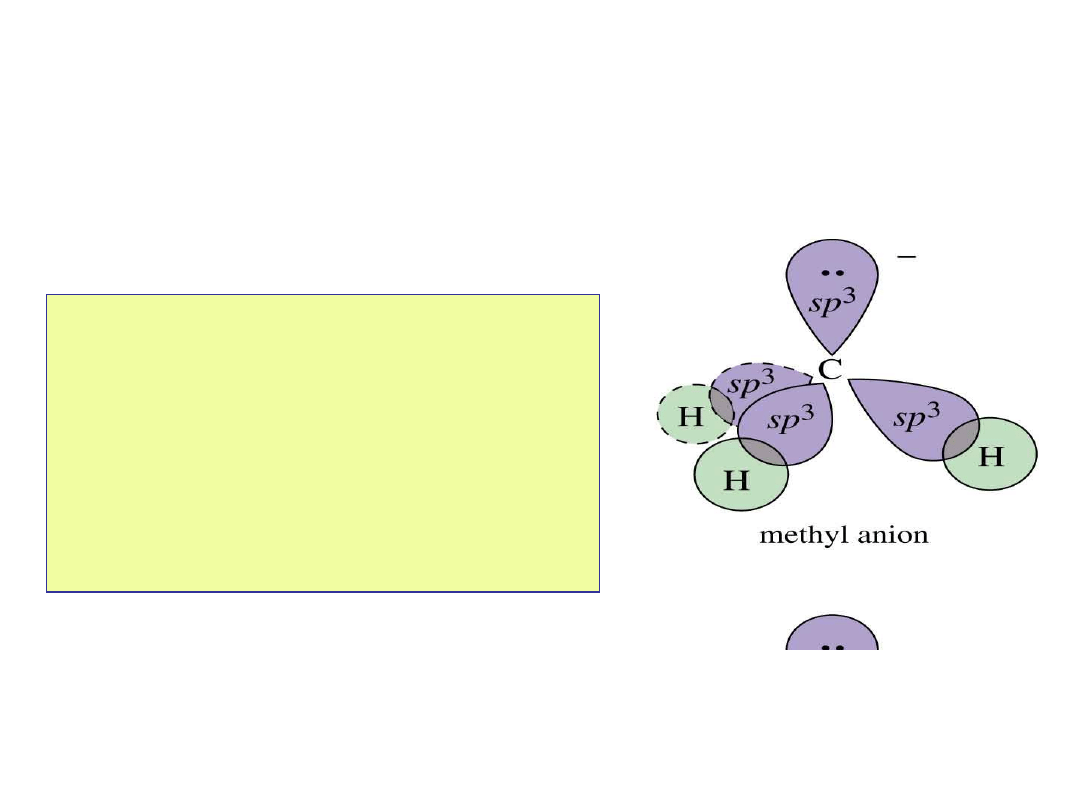
Karboanion
y
• Atom węgla ma 8 elektronów:
6 wiążących + wolna para.
• Atom węgla ma ujemny
ładunek.
• Podstawniki alkilowe
destabilizują karboaniony.
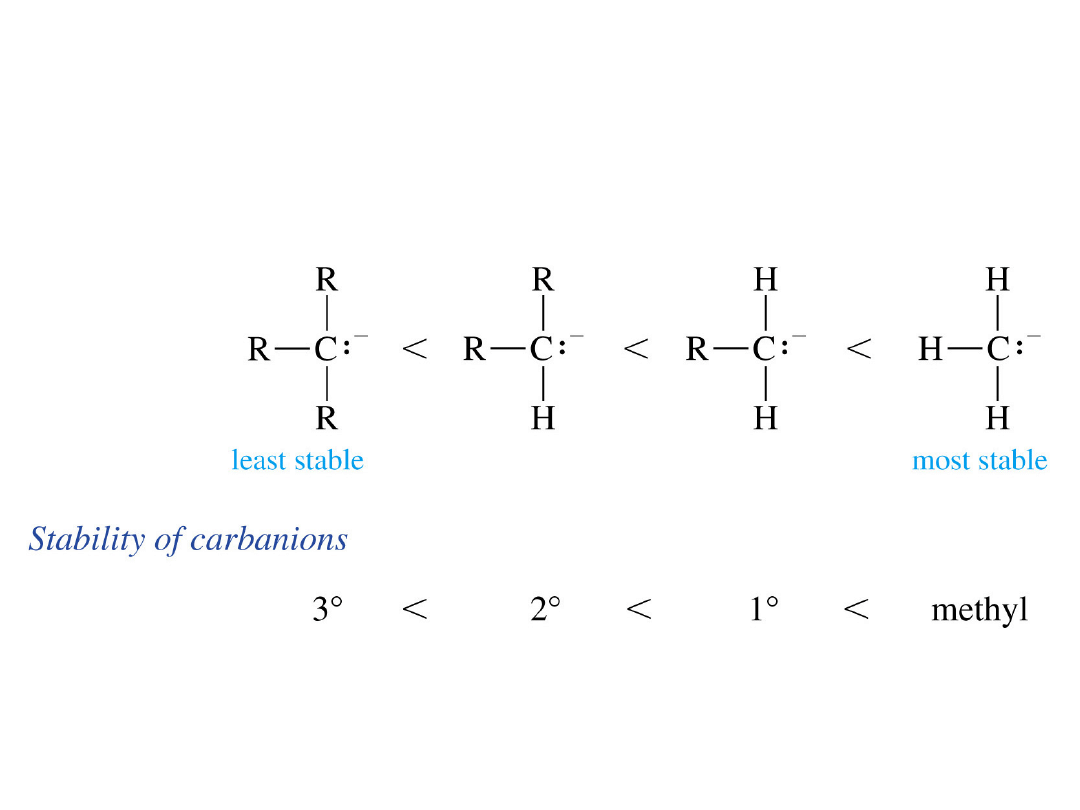
Trwałość karboanionów
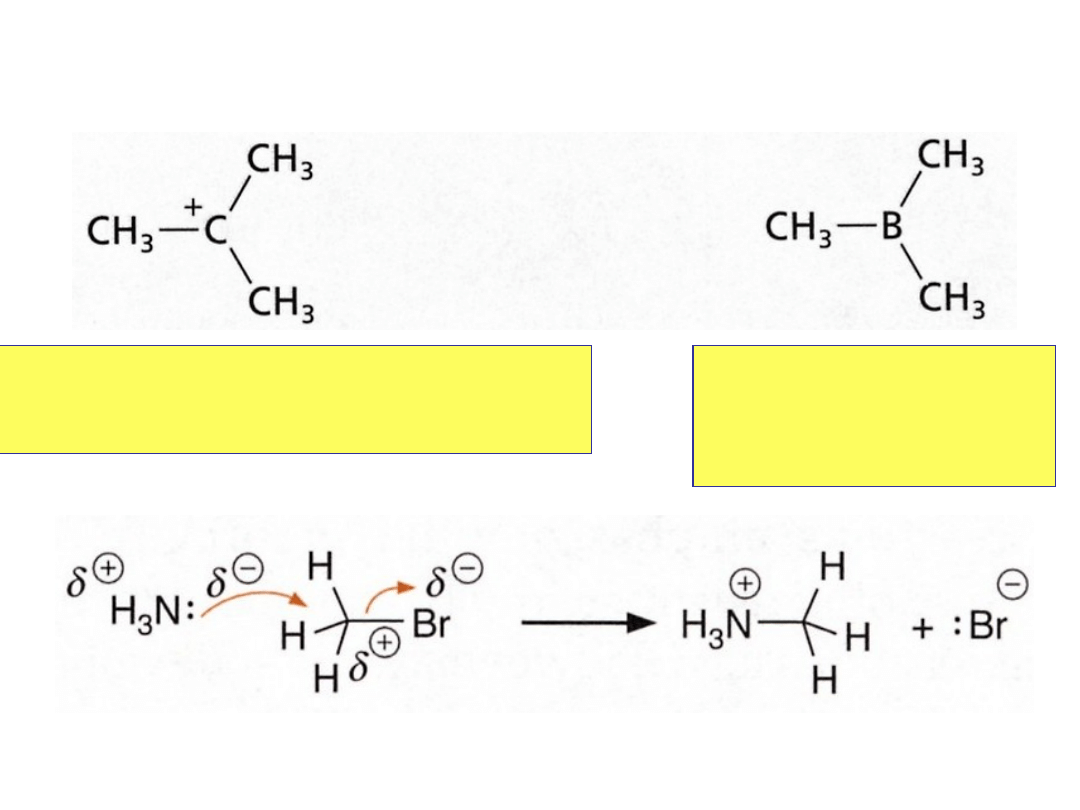
Elektrofile i Nukleofile
nukleofil
elektrofil
karbokation tert-butylowy
centralny atom ma 6 elektronów
na powłoce walencyjnej i jest elektrofilowy
trimetyloboran
atom boru ma 6
elektronów i jest
elektrofilowy
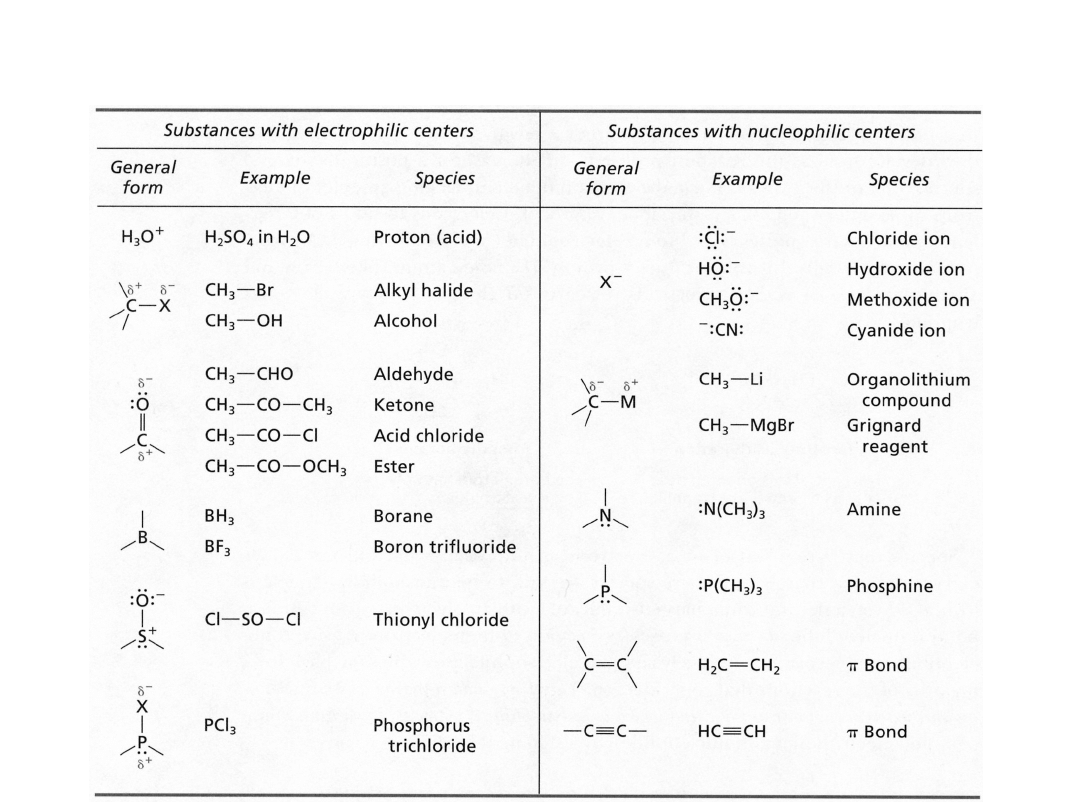
Elektrofile i Nukleofile
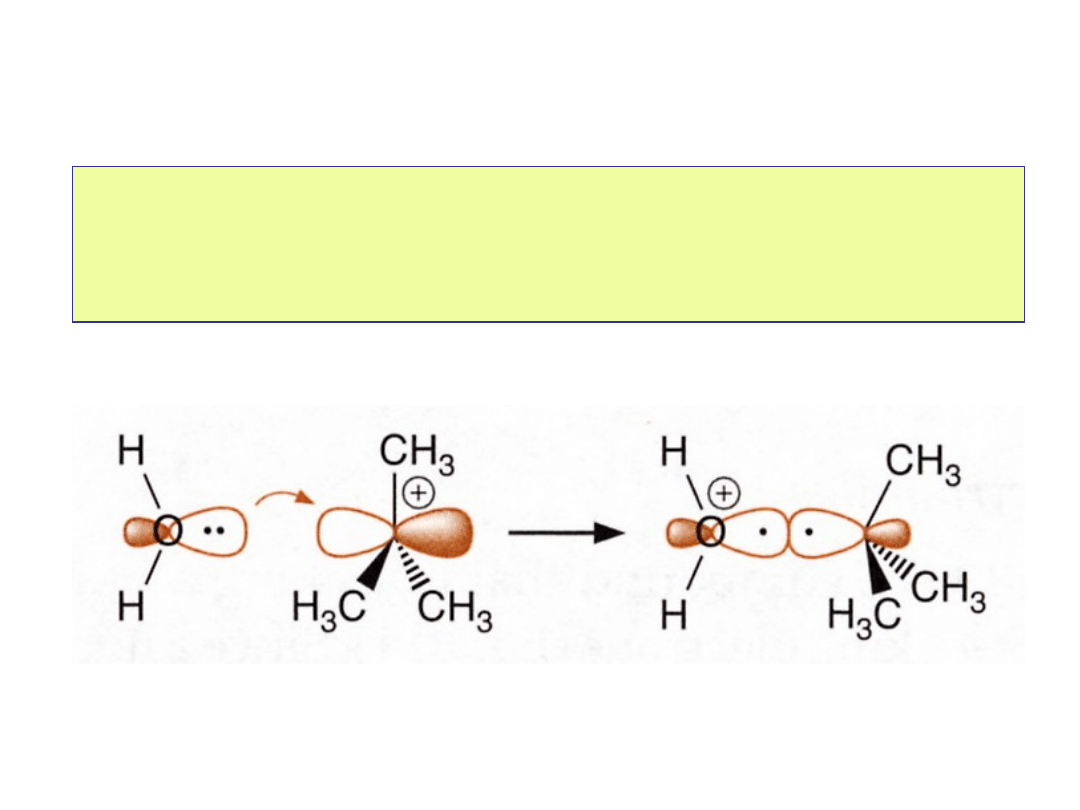
Reakcje chemiczne można rozważać jako
interakcje między
orbitalami zapełnionymi i pustymi
. Zarówno kwasy i zasady
Lewisa jak i elektrofile i nukleofile to przykłady struktur z,
odpowiednio, pustymi i zapełnionymi orbitalami.
Oddziaływania orbitalowe typu donor-
akceptor
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
Wyszukiwarka
Podobne podstrony:
Organic Reactions
Organic Chemistry 342 Reactions
Organic Chemistry 342 Reactions
9 Ch organiczna WĘGLOWODANY
organizacja i metodyka pracy sluzby bhp
Jedność budowy organizmów żywych1
Organizacja kąpieliska
Losy leków w organizmie
Zachowania w organizacji
Socjologia wyklad 12 Organizacja i zarzadzanie
Caritas Diecezji Kieleckiej organizacje ppt
4 6 Organizacja geodezji w Polsce ppt
organiz
Zasady organizowania stanowisk pracy
sroda teoria organizacji i zarzadzania
więcej podobnych podstron