
Organizacja przedmiotu i treści
kształcenia
• WYKŁAD
• Elementy termodynamiki fenomenologicznej.
Model gazu dokonałego. Równanie Van der Vaalsa.
Punkt krytyczny. I i II zasada termodynamiki.Procesy
odwracalne i nieodwracalne. Entropia. Mechanizmy
transportu energii i ciepła, przewodnictwo cieplne.
• Elektryczność i magnetyzm. Pole elektryczne.
Prawo Coulomba. Energia pola. Pojemność
elektryczna. Prąd elektryczny. Prawo Ohma i
Kirchhoffa. Elektryczne i magnetyczne właściwości
materii. Fale elektromagnetyczne, widmo fal
elektromagnetycznych.
• Elementy mechaniki kwantowej. Kwantowa natura
materii i energii. Promieniowanie ciała doskonale
czarnego. Efekt fotoelektryczny. Efekt Comptona.
Hipoteza de Broglie"a. Zasada nieoznaczoności
Heisenberga. Budowa atomu i jądra atomowego
.

Organizacja przedmiotu i treści
kształcenia
• ĆWICZENIA AUDYTORYJNE
• Podstawy mechaniki klasycznej. Elementy
hydromechaniki. Elementy termodynamiki
fenomenoogicznej. Grawitacja.
• ĆWICZENIA LABORATORYJNE
• Cwiczenia praktyczne z zakresu mechaniki
ogólnej, ciepła i termodynamiki, elektryczności i
magnetyzmu oraz optyki w tym elementy
akustyki, model pasmowy ciał stałych, poziomy
energetyczne właściwości stanów skupienia
materii, promieniotwórczość naturalna i
sztuczna, elementy fizyki jądrowej.

Efekty kształcenia
Umiejętność wykonania pomiaru
podstawowych wielkości
fizycznych. Rozumienie
podstawowych zjawisk i procesów
fizycznych występujących w
budownictwie. Wykorzystanie
praw przyrody w technice i życiu
codziennym.

Forma zaliczenia
• Jedna ocena z całego modułu na którą
składają się:
• Ocena z jednego jednogodzinnego
kolokwium z zakresu materiału
wykładowego (30%)
• Ocena z pisemnych sprawozdań z
wykonanych ćwiczeń i ustnych
sprawdzianów z zagadnień związanych z
wykonywanymi ćwiczeniami (40%)
• Ocena z dwóch jednogodzinnych kolokwiów
z zakresu materiału ćwiczeniowego (30%).

Literatura podstawowa
• Halliday D., Resnick R., Walker J. :
Podstawy fizyki PWN, Warszawa, 2003.
• 1. Jaworski B. i inni : Kurs Fizyki, tom
1,2,3 PWN, Warszawa, 1984.
• 2. Massalski, M. Massalska: Fizyka dla
inżynierów tom 1 PWN Warszawa
1978.















Podstawy
termodynamiki
fenomenologicznej

Podstawy
termodynamiki
fenomenologicznej
Termodynamika zajmuje się badaniem
energii i jej przemian.
Jest wiele różnych rodzajów energii.
Wszystkie one mogą stać się
przedmiotem rozważań
termodynamicznych.
Ogólnie rzecz biorąc, termodynamika
zajmuje się głównie dwoma rodzajami
energii:
ciepłem i pracą.

Podejście makroskopowe
-związki pomiędzy
wielkościami
makroskopowymi jak ciśnienie objętość temperatura,
energia wewnętrzna entropia
stanowię podstawę
termodynamiki fenomenologicznej.
Podejście mikroskopowe
-
przedstawienie wielkości
fizycznych takich jak: prędkość, masa, energia,
opisujących
atomy i cząsteczki czyli elementy tworzące
układ
stanowi podstawę mechaniki statystycznej
Uwagi:
Równoważność obu podejść
Wielkości makroskopowe –postrzegane przez zmysły
Wielkości mikroskopowe – nie są bezpośrednio postrzegane przez zmysły

Związki pomiędzy mechaniką
klasyczną a termodynamiką
Zagadnienia mechaniki klasycznej obejmują
takie pojęcia jak
siła, masa, odległość, czas
i
inne. Mechanika opiera się na II prawie
Newtona:
)
( v
m
dt
d
F
Do opisu zjawisk mechaniki stosuje się
ciało swobodne
na które działają wszystkie
siły zgodnie z II zasadą dynamiki.
System (układ) mechaniczny
jest
zdefiniowany przez współrzędne
przestrzenne i prędkość.

Oddziaływanie z otoczeniem jest opisane przez
działanie sił.
Stan układu
jest opisany przez współrzędne
przestrzenne, prędkość i jego zachowanie się.
Zmiana stanu układu z jednego do drugiego
jest opisany przez oddziaływanie z otoczeniem.
Układ mechaniczny nie zmienia swego stanu
bez działania siły zewnętrznej.
Podczas, gdy w mechanice zajmujemy się
wielkościami dynamicznymi, w termodynamice
zajmujemy się porcjami energii.
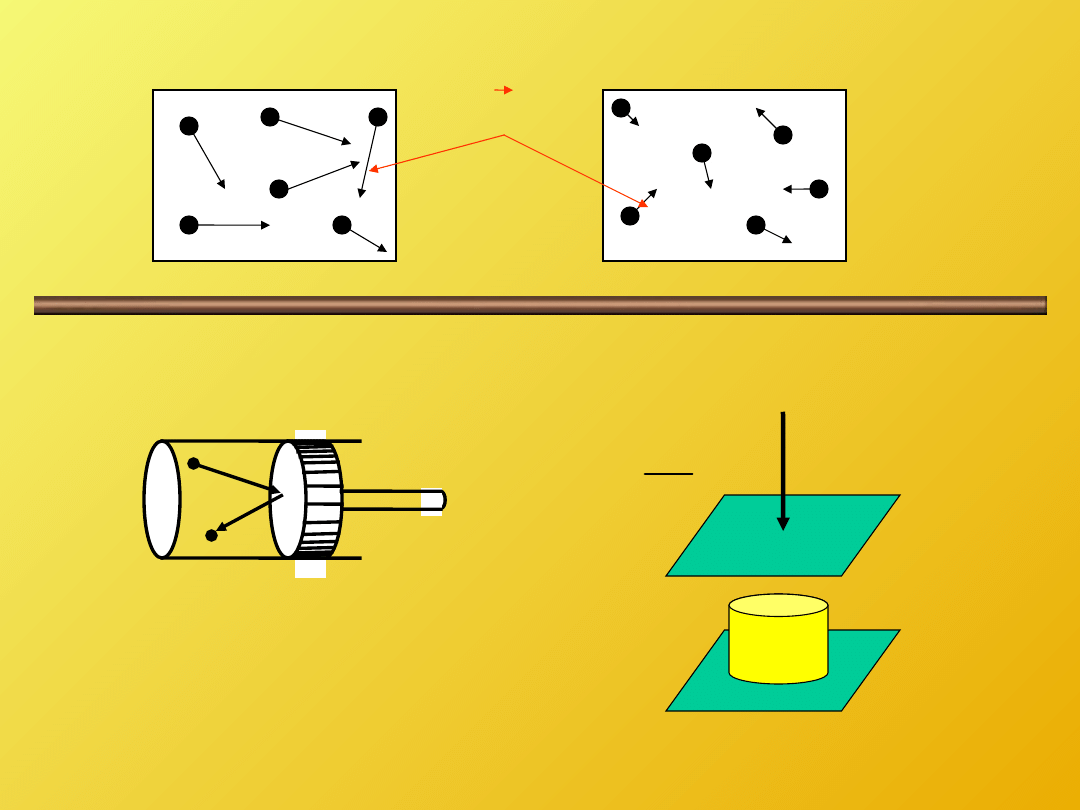
Układem w termodynamice nazywamy
wyodrębnioną ilość materii
. Materia pozostała
poza układem stanowi otoczenie a granicę
pomiędzy tymi dwoma stanami stanowi brzeg
układu.
Granice naszego układu mogą być rzeczywiste lub pozorne.
Stan układu termodynamicznego
opisany jest
przez
współrzędne termodynamiczne.
Zwykle
nie możemy na początku podać wszystkich
współrzędnych. Typowymi przykładami takich
współrzędnych są
temperatura, ciśnienie,
objętość, gęstość, energia chemiczna,ilość
substancji.
Te współrzędne zwykle nazywamy
własnościami układu.
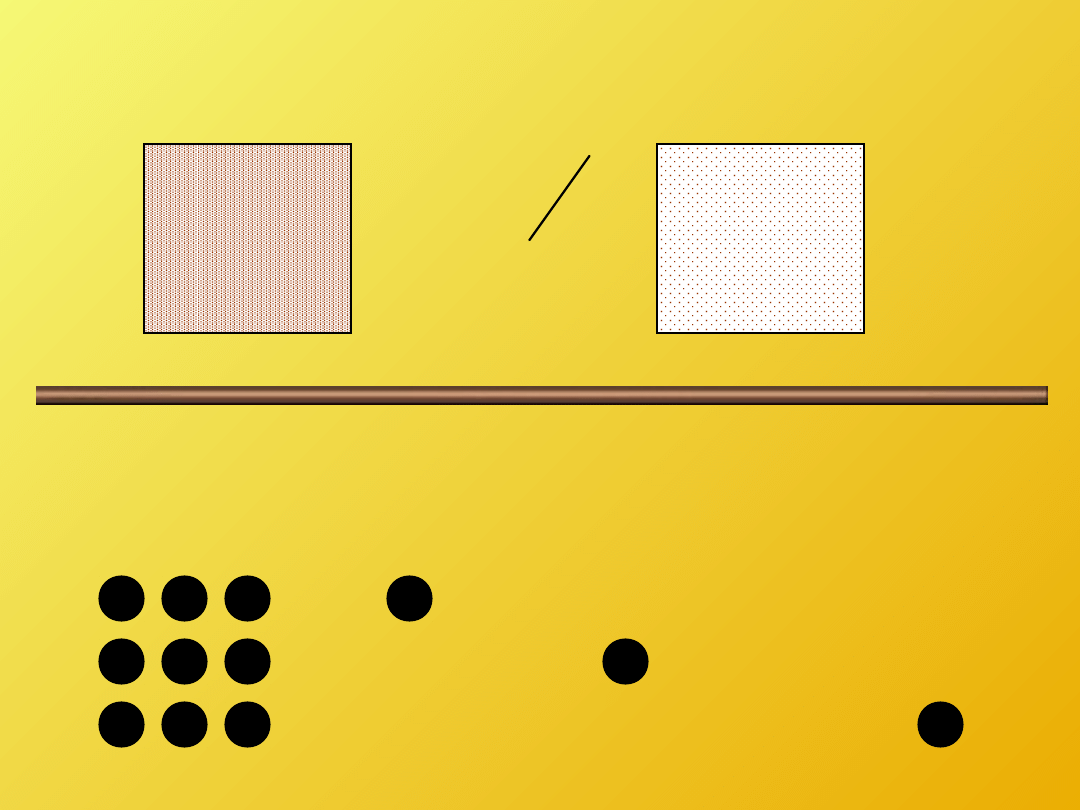
TEMPERATURA
=
“stan ciepłoty, gorąca”
Wolno poruszające się atomy lub cząsteczki
maja niską temperaturę.
Szybko poruszające się atomy lub cząsteczki
maja wysoką temperaturę.
Rozważmy krótko niektóre z podanych
„współrzędnych”
Wysoka T
Niska T
v
CIŚNIENIE
=siła działająca na
powierzchnię
zderzenie
A
F
p
F
A
cięża
r
GĘSTOŚĆ
=„masa na jednostkę
objętości”
Duża
gęstość
Mała
gęstość
V
m
…
……….
………………...
1 2 3 12
144
6.022 × 10
23
tuzin
gross
ILOŚĆ SUBSTANCJI
= „ile tego jest”
Liczba
Avogad
ry
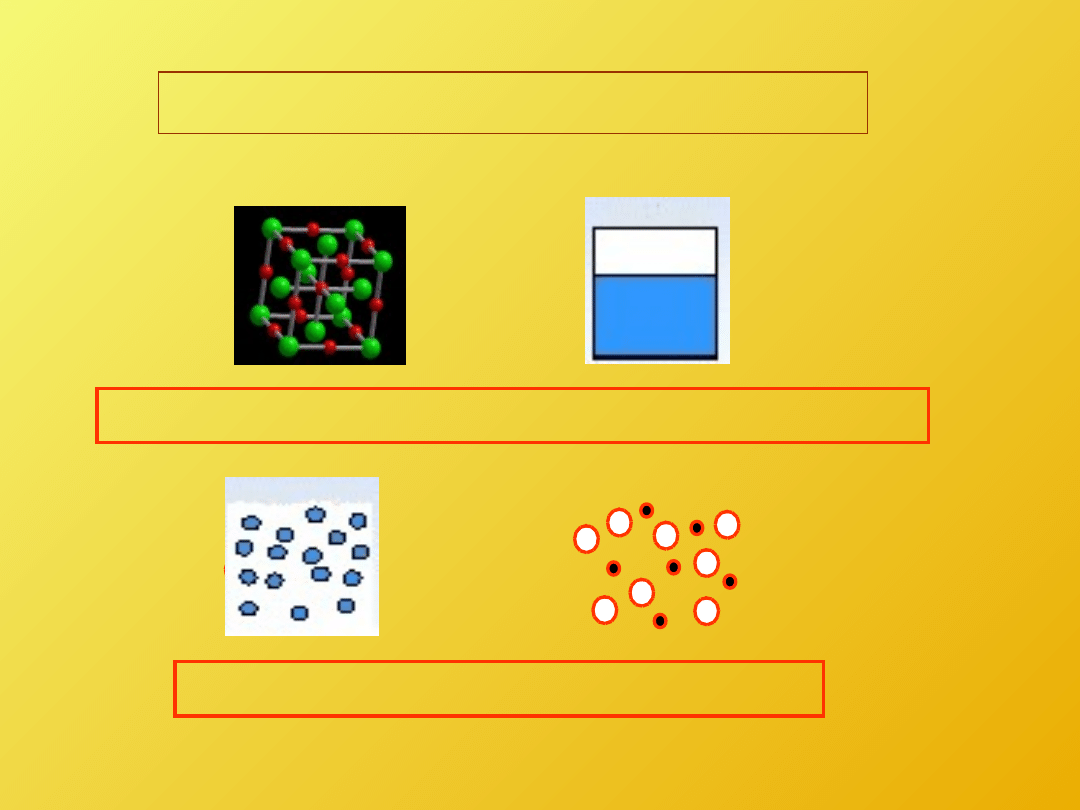
Ciało stałe
Ciecz
Gaz
Plazma
STANY SKUPIENIA

Zmiana układu termodynamicznego
polega na
zachodzeniu jakiegoś procesu przemiany.
W termodynamice interesuje nas, jakim
zmianom może podlegać układ na wskutek tych
przemian.
Jeśli chcemy opisać stan układu na każdym
etapie przemiany, musimy być w stanie
zdefiniować stan układu.
Aby to móc zrobić musimy wprowadzić
pojęcie
równowagi układu.
Układ jest w równowadze, jeśli np. jego
ciśnienie, temperatura i gęstość są
jednorodne. Definicja ta jednak nie jest pełna.
Aby móc określić współrzędne
termodynamiczne układu, musi on znajdować
się w równowadze.

Interesują nas
przemiany będące
łańcuchem stanów równowagi.
W takiej
przemianie potrafimy zdefiniować układ na
każdym etapie.
Procesy takie nazywamy
odwracalnymi
lub kwazistatycznymi.
Proces odwracalny
jest to proces który
może przebiegać w obydwie strony
nieskończenie długo bez strat.
Proces nieodwracalny
jest to taki w
którym mamy do czynienia ze stratą
energii.
Przyczynami takich strat mogą być:
Tarcie, spadki temperatury, ciśnienia i
stężenia.
Przykładem procesu nieodwracalnego jest pęknięcie
wazonu.

Temperatura, ciepło i zerowa zasada
termodynamiki
Zwykle przyjmuje się, że rozumiemy pojęcie ciepła i
temperatury. Termodynamika zajmuje się badaniami
mającymi na celu precyzyjne pojmowanie tych pojęć.
Zwykle intuicyjne pojmowanie temperatury kiedy
czegoś dotykamy wiąże się z transportem energii lub
wymianą ciepła. Można więc wywnioskować, że
pomiędzy dwoma ciałami o tej samej temperaturze
nie ma wymiany ciepła.
Równość temperatury nie pozwala nam stworzyć
bezwzględnej skali temperatur.
Pojęcie równości temperatur ujmuje tzw.
zerowa
zasada termodynamiki.
Dążenie układów do stanu
równowagi termicznej ...
A
B
ścianka
adiabatyczna
ścianka
diatermiczna
Q
A
B
Q = 0
Stan
początkowy
Stan
końcowy

Układ:
dwa dowolne podukłady A i B
rozdzielone ścianką diatermiczną i
izolowane od otoczenia ścianką
adiabatyczną
Obserwacja I:
podukłady wymieniają
między sobą energię na sposób ciepła;
szybkość tego procesu dąży do zera
podukłady A i B osiągają stan równowagi
termicznej względem siebie.
Dążenie układów do stanu
równowagi termicznej - fakty
doświadczalne ...
...Dążenie układów do stanu
równowagi termicznej
A
B
Q = 0
A
B
C
Q
Q
A
B
C
Q = 0Q = 0
Stan
początkowy
Stan końcowy
I
Stan
końcowy II

Układ:
trzy dowolne podukłady A, C i B
rozdzielone ściankami diatermiczymi i
izolowane od otoczenia ścianką
adiabatyczną; kontakt termiczny A - B
możliwy wyłącznie za pośrednictwem C
Obserwacja II:
podukłady wymieniają
między sobą energię na sposób ciepła;
szybkość tego procesu dąży do zera
podukłady A i C oraz B i C osiągają stan
równowagi termicznej względem siebie.
....
Dążenie układów do stanu
równowagi termicznej - fakty
doświadczalne ...

Obserwacja III:
jeżeli podukłady A i C
oraz B i C parami w stanie równowagi
termicznej, to po usunięciu podukładu
C i bezpośrednim zetknięciu
podukładów A i B przez ściankę
diatermiczną nie obserwuje się
wymiany energii na sposób ciepła
między nimi.
...Dążenie układów do stanu
równowagi termicznej - fakty
doświadczalne

Jeżeli układy A i B są w stanie
równowagi termicznej z układem C,
to są one również w stanie
równowagi termicznej względem
siebie.
E.A. Guggenheim, R. Fowler (1939)
Zerowa zasada termodynamiki
Zasady termodynamiki
(0 - 3)
-
zwięzłe uogólnienia faktów
doświadczalnych uznane za
aksjomaty; służą do definiowania
funkcji stanu oraz określania
związków między nimi i
parametrami mierzalnymi.

•Wspólną właściwość układów w stanie
równowagi termicznej nazywa się
temperaturą
. Każdemu ukła- dowi
przypisuje się intensywny parametr
stanu - temperaturę;
układy
pozostające w stanie równowa- gi
termicznej mają taką samą
temperaturę
.
Termometria - dział
termodynamiki poświęcony pomiarom
temperatur.
•Konsekwencja zerowej zasady
termodynamiki...

Termometr i pomiar
temperatury:
• Układ mający jeden stopień swobody
(temperatu- rę)
pozostałe
parametry stanu termometru są
funkcjami wyłącznie temperatury
• Wybrać łatwo i dokładnie mierzalny
parametr stanu termometru
parametr termometryczny
.
• Utworzyć skalę temperatur
określić
zależność funkcyjną między
parametrem termometrycznym i
temperaturą.
• Ustalić stan równowagi termicznej
między termo- metrem i badanym
układem, zmierzyć wartości
parametru termometrycznego i
obliczyć tempera- turę w przyjętej
skali.

t
c
=[(T)-
273.15]
o
C
t
c
– Temperatura w skali Celsjusza
T – Temperatura w skali Kelvina
t
c
=5/9[t
F
-
32]
o
C
t
c
– Temperatura w skali Celsjusza
t
F
– Temperatura w skali Fahrenheita
Skale
temperatur
Zero
absolutne
0K
-273.15
o
C -
459.67
o
F
Punkt potrójny
wody
273.1
5K
0.01
o
C
32.00
o
F
Skale temperatur Kelvina , Celsjusza, Fahrenheita

Najwyższa temperatura
:
10 lutego 2000r. europejskie laboratorium cząstek elementarnych
CERN pod Genewą wydało komunikat, że udało się zaobserwować
plazmę kwarkowo-gluonową, która była 100tys. razy gorętsza niż
wnętrze Słońca, co odpowiada temperaturze
10
12
K
i 20 razy bardziej
gęsta niż jądro atomu. Powstała na skutek eksperymentów z jądrami
ołowiu rozpędzanymi do bardzo dużych prędkości i doprowadzanych
do zderzeń. Taka sytuacja prawdopodobnie miała miejsce w dziejach
Wszechświata 12-15 miliardów lat temu, około 10 ms po Wielkim
Wybuchu.
Najniższa temperatura
:
Najniższa temperatura osiągnięta została w 1995r. na Uniwersytecie w
Boulder, Colorado (USA), kiedy fizycy Eric Cornell i Carl Wieman
wytworzyli nowy stan materii, przewidziany przez Einsteina i Bosego.
W swym eksperymencie schłodzili atomy rubidu to temperatury około
10
-8
K
i uzyskali kondensację Bosego-Einsteina (maksymalne możliwe
wygaszenie ruchów atomów). W celu schłodzenia atomów rubidu użyli
pułapki laserowej (światło lasera podczerwonego oddziaływało tylko z
poruszającymi się cząsteczkami i spowalniało je, a następnie
pułapkowało -- schłodzenie do 10
-5
K) i pułapki magnetycznej. Dalsze
schłodzenie uzyskali dzięki wyrzucaniu najbardziej energetycznych, a
więc "najcieplejszych" atomów poprzez proces podobny do
odparowania.

Ciepło
– to forma energii a nie substancja.
(Benjamin Thompson 1753-1814)
Pojemność cieplna
T
Q
C
Ilość ciepła potrzebna do ogrzania ciała o jeden stopień
Ciepło
właściwe
T
m
Q
c
Pojemność cieplna przypadająca na
jednostkę masy ciała

2
1
T
T
dT
c
Q
Ciepło
dostarczone do ciała o masie m i cieple właściwym c przy
Zmianie temperatury od T
1
do T
2
c - ciepło właściwe (jest funkcją temperatury)
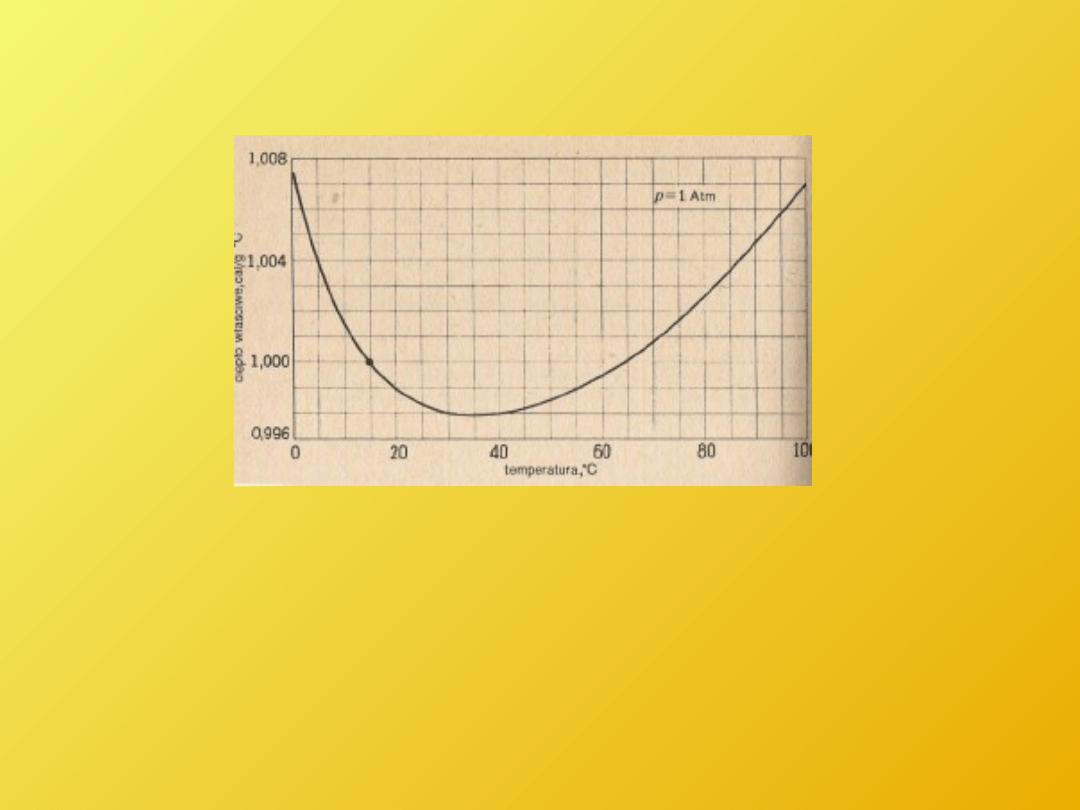
Ciepło właściwe wody w funkcji temperatury
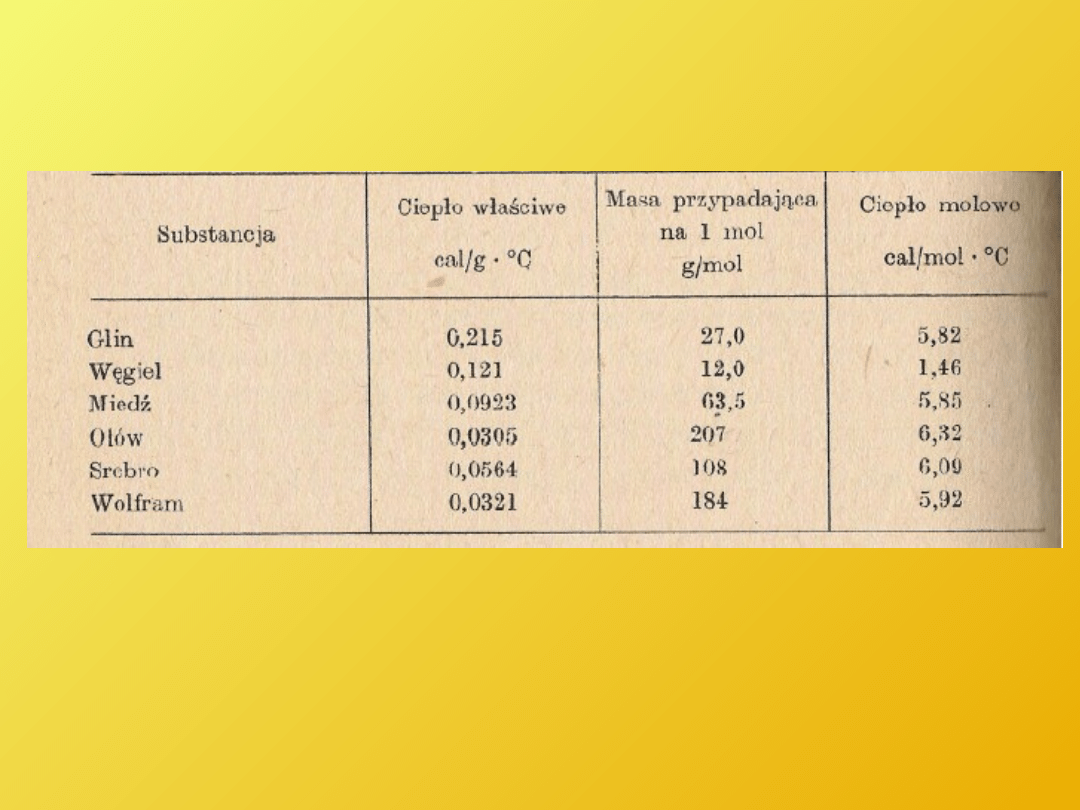
Ciepło molowe
- ilość ciepła potrzebna do ogrzania
jednego mola substancji o jeden stopień
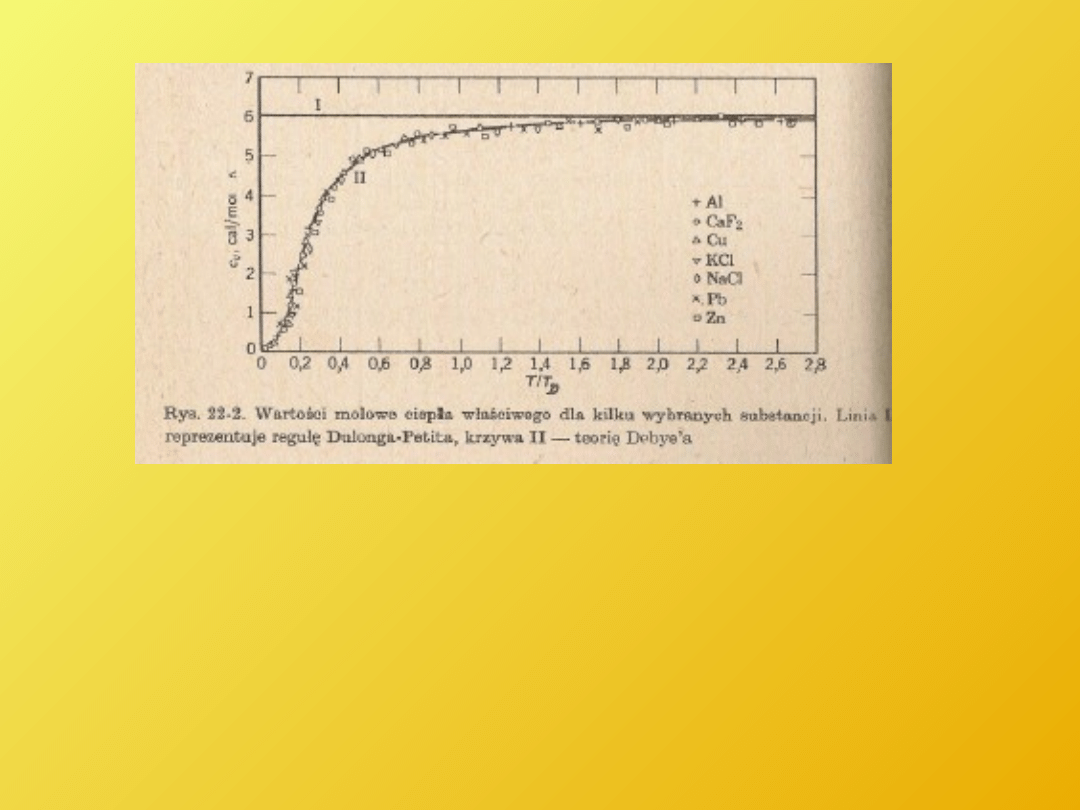
Ciepło molowe dla kilku wybranych substancji
I - reguła Dulonga Petita
(1819 r )
II – teoria Debye’a
(1912 r)

Ciepło a praca
Pierwsza zasada termodynamiki

Przykład zamiany pracy mechanicznej na ciepło
Opadający ciężarek napędza generator elektryczny ,
generator powoduje przepływ prądu przez opornik
ogrzewający wodę w której jest zanurzony.
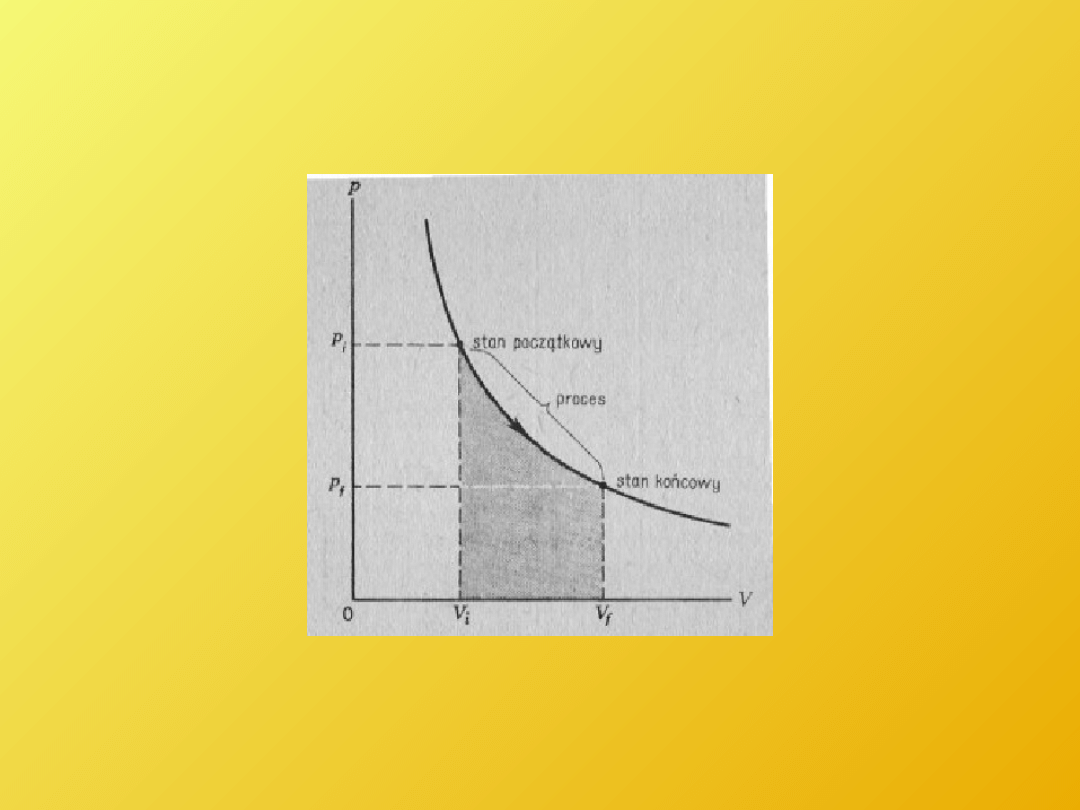
Praca wykonana przez gaz
równa jest polu powierzchni pod krzywą p, V.
2
1
V
V
pdV
dW
W

Zarówno ciepło jak i praca „zależą od obranej drogi”
Żadne z nich oddzielnie nie może samo podlegać zasadzie zachowania
Ilość ciepła tracona lub otrzymywana przez
układ
zależy nie tylko od początkowego i końcowego
stanu układu
lecz także od stanów pośrednich tj. od drogi
procesu
Stan A
Stan
B
Droga 2
Droga 3
Droga
1
3
3
2
2
1
1
W
Q
W
Q
W
Q
Różnica Q-W nie zależy od sposobu przeprowadzenia
układu ze stanu A do B

Gdy przeprowadzamy układ ze stanu początkowego do stanu końcowego
Wielkość Q-W zależy wyłącznie od stanu początkowego i końcowego
a nie zależy od drogi po jakiej dokonuje się przejście.
Istnieje więc pewna funkcja współrzędnych termodynamicznych,
której wartość końcowa minus wartość początkowa równa jest zmianie
Q-W w tym procesie.
Funkcję tę nazywamy energią wewnętrzną układu.
W
Q
U
U
U
A
B
Gdy układ podlega tylko infinitezymalnej zmianie stanu (bardzo małej)
Wtedy:
dW
dQ
dU

Pierwsza zasada termodynamiki
Każdy układ termodynamiczny w stanie równowagi
jest scharakteryzowany ustaloną wartością pewnej funkcji stanu
nazywanej energią wewnętrzną U, której zmiana dU
w różniczkowym procesie określona jest równaniem:
dW
dQ
dU
W postaci całkowej (dla całego procesu)
W
Q
U
Oznaczenia
1. Ciepło Q uważamy za dodatnie (Q0), gdy dostarczane jest z
otoczenia do układu; ciepło dostarczane z układu do otoczenia
jest ujemne (Q0),
2. Pracę W uważamy za dodatnią (W0), gdy wykonywana jest
przez układ nad otoczeniem; praca wykonywana przez
otoczenie nad układem jest ujemna (W0),

Energia wewnętrzna U
układu jest całkowitą
energią układu z wyłączeniem energii
kinetycznej układu jako całości oraz energii
potencjalnej w zewnętrznych polach.
1. Energia wewnętrzna jest funkcją stanu
układu,
2. Energia wewnętrzna sumy układów jest
sumą energii wewnętrznych układów
składowych oraz energii wzajemnego
oddziaływania między wszystkimi układami
sumy
3. Energia wewnętrzna układu może się
zmieniać w wyniku wymiany pracy lub ciepła
między układem a otoczeniem

Istotą I zasady termodynamiki jest
to że istnieje
użyteczna wielkość termodynamiczna nazywana
„energią wewnętrzną” Zasada ta daje też przepis jak
określić ilościowe zmiany tej wielkości.
Istotą zerowej zasady termodynamiki jest
stwierdzenie istnienia
użytecznej wielkości termodynamicznej jaką jest temperatura.
I zasada termodynamiki
mówi o zachowaniu energii w
każdym procesie
nie odpowiada jednak na pytanie
czy określony proces może rzeczywiście
zachodzić.
Na to pytanie odpowiada II zasada termodynamiki.

Gaz doskonały – opis makroskopowy
Dla wszystkich gazów, przy dostatecznie
małych gęstościach doświadczalnie można
stwierdzić istnienie pewnych prostych związków
pomiędzy parametrami termodynamicznymi takimi
jak p, V, T.
Dla ustalonej masy gazu
const
T
pV
nR
T
pV
Gdzie R uniwersalna stała gazowa
8,314 J/mol K
n liczba moli gazu
Gaz doskonały
to gaz spełniający powyższe równanie w
dowolnych warunkach.

Gaz doskonały – opis mikroskopowy
Podejście mikroskopowe jest realizowane w oparciu o następujące założenia
1. Gaz składa się z cząsteczek, które można traktować jak punkty materialne
2. Cząsteczki poruszają się chaotycznie i podlegają zasadom dynamiki Newtona
3. Całkowita liczba cząstek jest bardzo duża
4. Cząsteczki mają objętość własną pomijalnie małą
5. Poza momentem zderzenia na cząsteczki nie działają żadne siły
6. Zderzenia są sprężyste i trwają nieskończenie krótko

Przemiany politropowe gazu doskonałego
Równaniem przemiany
nazywamy równanie stanu gazu z
nałożonym odpowiednim warunkiem przemiany
Przemianą politropową
jest taka przemiana , w której
pojemność cieplna gazu (ciepło molowe przemiany) jest stała
(warunek przemiany: C= const)
Równanie przemiany politropowej (równanie politropy)
k= (C-C
p
)/(C-C
V
) = const
Wybrane przemiany politropowe:
k = 0 p = const przemiana izobaryczna,
k = 1 pV = const przemiana izotermiczna,
k = Cp/Cv pV
k
=const przemiana adiabatyczna,
k = V = const przemiana izochoryczna
const
pV

Definicja mikroskopowa
•
Gaz składa się z cząsteczek, które traktować można jak
punkty materialne. Łączna objętość wszystkich cząsteczek gazu
jest więc pomijalna. Zależnie od rodzaju gazu, cząsteczka może
być atomem lub związana grupą atomów. Z punktu widzenia
chemii cząsteczki gazu to cząsteczki pierwiastka lub związku
chemicznego. Wszystkie one są identyczne.
•
Cząsteczki podlegają prawom mechaniki Newtona.
•
Całkowita liczba cząsteczek jest bardzo duża. Cząsteczki
poruszają się chaotycznie we wszystkich kierunkach, zderzają ze
ściankami naczynia i ze sobą nawzajem. Niezależnie od losów
poszczególnych cząsteczek, o zachowaniu gazu w skali makro
decydują średnie wartości całego zespołu.
•
Cząsteczki zdarzają się ze sobą sprężyście, wymieniają pęd
bez strat energii.
•
Poza momentami zderzeń cząsteczki nie oddziałują ze sobą,
a czas trwania tych zderzeń jest pomijalnie mały. Zakładamy
tym samym mały - w porównaniu z rozmiarami cząsteczek - zasięg
sił oddziaływania międzycząsteczkowego. Znaczy to też że
pomiędzy zderzeniami cząsteczki poruszają się ruchem
jednostajnym prostoliniowym.
Definicja mikroskopowa określa więc gaz doskonały jako zespół
cząsteczek o szczególnych własnościach. Podane tu elementy
definicji są punktem wyjścia kinetycznej teorii gazu.
Gaz doskonały – opis
mikroskopowy

Definicja makroskopowa
(termodynamiczna)
Za gaz doskonały uważać będziemy gaz spełniający
łącznie prawa Boyle'a-Mariotte'a, Gay-Luusaca i
Charlesa, czyli gaz dla którego w stałej temperaturze
iloczyn objętość i ciśnienie są odwrotnie
proporcjonalne, dla określonej objętości ma stały
stosunek ciśnienia do temperatury jest stały, a pod
stałym ciśnieniem - proporcjonalne są objętość i
temperatura. Łącznie możemy to zapisać jedną
zależnością:
Powyższy związek, definiujący gaz doskonały w ujęciu
makroskopowym dotyczy oczywiście ustalonej ilości
materii (ustalona masa, ustalona liczba cząsteczek,
ustalona liczba moli gazu)
Definicja ta określa związek pomiędzy parametrami
termodynamicznymi gazu - a więc określa gaz
doskonały poprzez jego równanie stanu.
Gaz doskonały – opis makroskopowy

Gazy doskonałe nie istnieją
.
Model, jakim jest gaz doskonały, pozwala na proste
rachunki i sprawdza się dość dobrze w pewnych warunkach.
Jednak cierpi braki zarówno co do realizmu założeń, jak i co do
opisu zachowania się gazów. Założenia, które posłużyły do
budowy modelu gazu doskonałego w pewnych warunkach tracą
zasadność. Postulat zerowej objętości cząsteczek gazu nie daje się
obronić, podobnie jak założenie że cząsteczki nie oddziałują ze
sobą. W efekcie model gazu doskonałego nie opisuje poprawnie
rzeczywistości. Wartości doświadczalne odbiegają od
przewidywań teorii.
Co gorsza, poza niedociągnięciami ilościowymi, model ten ponosi
klęskę jakościową. Zawodzi całkowicie w tych warunkach, gdzie
objętości cząsteczek staje się porównywalna z objętością
zajmowana przez gaz (gdy na skutek koncentracji cząsteczek
odległości między nimi stają się porównywalne z ich rozmiarami).
Według równania Clapeyrona w temperaturze dążącej do zera
bezwzględnego objętość gazu pod stałym ciśnieniem malałaby do
zera. Mówimy tu o przejściach fazowych (skraplanie gazu w
niskich temperaturach i wysokich ciśnieniach), których to przejść
model wcale nie przewiduje.

Równanie Van der Waalsa
Ma ono postać
gdzie
p jest ciśnieniem gazu,
v jest objętością molową v = V/n lub po prostu objętością
jednego mola gazu,
R to uniwersalna stała gazowa,
T jest temperaturą bezwzględną (mierzoną w kelwinach),
natomiast a i b to stałe, wyznaczane na drodze
doświadczalnej dla każdego gazu.
Jak widać, do równania Clapeyrona, zapisanego przy użyciu
objętości molowej
pv = RT
wprowadzone zostały poprawki - poprawka do ciśnienia (+
a/V
2
) i poprawka do objętości (- b).
Poprawka do ciśnienia ma odzwierciedlać przyciąganie
między cząsteczkami gazu dla większych odległości.
Poprawka do objętości to próba uwzględnienia objętości
własnej cząsteczek gazu (ściślej mówiąc - sił odpychania na
małych odległościach).
RT
b
v
v
a
p
2

Wartości stałych a i b można uzyskać dopasowując
krzywe doświadczalne lub z wartości tzw. parametrów
krytycznych gazu:
c
c
p
T
R
a
64
27
2
c
c
p
RT
b
8
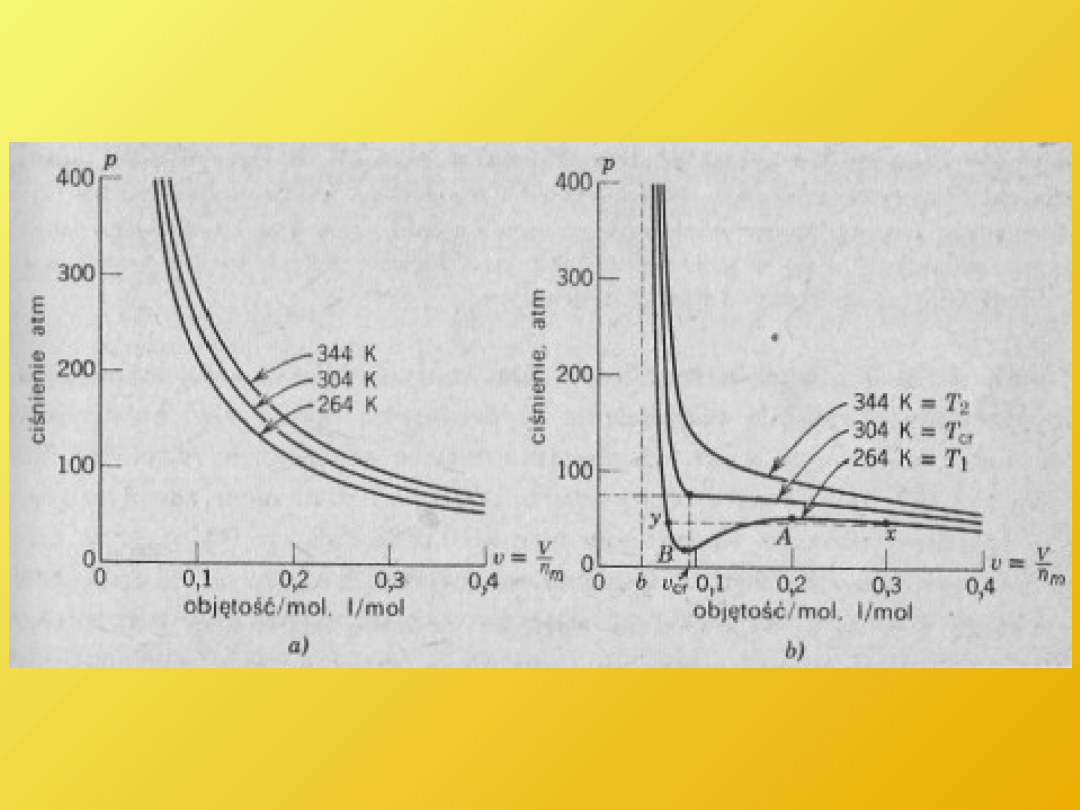
a. Izotermy gazu doskonałego
b. Izotermy gazu Van der Waalsa

Druga zasada
termodynamiki
Z doświadczenia wiemy, że są procesy
zgodne z zasadą zachowania energii, które nigdy
nie występują w przyrodzie. Na przykład, nigdy nie
obserwujemy, by kamień leżący na podłodze
spontanicznie się oziębił i wzniósł do sufitu,
uzyskując kosztem ciepła energię potencjalną. Nie
spodziewamy się też, by w słoneczny letni dzień
zamarzł staw, oddawszy energię wewnętrzną
otoczeniu.
Zadaniem drugiej zasady
termodynamiki jest włączyć do
termodynamiki takie fakty doświadczalne, jej
podstawą jest zdrowy rozsądek.

Zasada ta określa kierunek transferu i
przemiany ciepła.
Przy omawianiu I zasady termodynamiki
stwierdziliśmy, że wszystkie rodzaje energii są
równie użyteczne, żadna z nich nie jest
preferowana, tylko, że dla układu izolowanego musi
ona zostać zachowana.
Możemy jednak rozróżnić różne rodzaje energii,
np..pracę mechaniczną i energię wewnętrzną, którą
można zmienić przez pracę. Rozróżniamy również
ciepło, które definiujemy przez energię wewnętrzna
i pracę.
Z równania które mówi o zmianie energii
wewnętrznej dla

cyklu zamkniętego
0
dW
dQ
można by wyciągnąć wniosek, że dwa człony tego
równania są równoważne. II zasada termodynamiki
przyjmuje fakt, że ciepło i praca nie są równoważne
i podaje szereg relacji, które uzupełniają I zasadę w
badaniu układów termodynamicznych.
Przypomnijmy:
• Ciepło przepływa od temperatury wyższej do
temperatury niższej, a nie odwrotnie.
Czyli ciało ciepłe ochłodzi się w
kontakcie z chłodnym ciałem a nie
odwrotnie..

Pierwsze sformułowanie sprowadza się do tego, że
np. naczynie z wodą włożone do lodówki nie
zagotuje się, mimo, że z punktu widzenia zachowania
energii jest to możliwe. Przepływ ciepła odbywa się
tylko w jedną stronę, co nie jest wynikiem zasady
zachowania energii.
2.
Dwa gazy umieszczone w izolowanym naczyniu
wymieszają się jednorodnie w całym naczyniu i
nie będą w stanie
spontanicznie się rozdzielić
.
3.
Bateria rozładuje się przez opornik wydzielając
pewną ilość ciepła, przy czym proces odwrotny
jest niemożliwy.
4.
Nie jest możliwe skonstruowanie maszyny
pracującej w sposób ciągły przez pobór ciepła
z pojedynczego zbiornika i wykonującej
równoważną ilość pracy.
Przyjrzyjmy się bliżej pierwszemu i czwartemu
.

Stwierdzenie 4 mówi o niemożności zbudowania perpetuum mobile
drugiego rodzaju.
Perpetuum mobile pierwszego rodzaju byłoby urządzeniem, które
wytwarza energię bez brania pod uwagę I zasady termodynamiki.
Konkludując, możemy powiedzieć, że
II zasada
termodynamiki przyjmuje jednokierunkowy
przepływ ciepła i pewne określone typy przemiany
energii.
Będziemy chcieli sformułować II zasadę
termodynamiki przez podanie zależności
analitycznych, bazując na argumentach
makroskopowych i przyjmując czwarte
sformułowanie jako doświadczalny aksjomat.
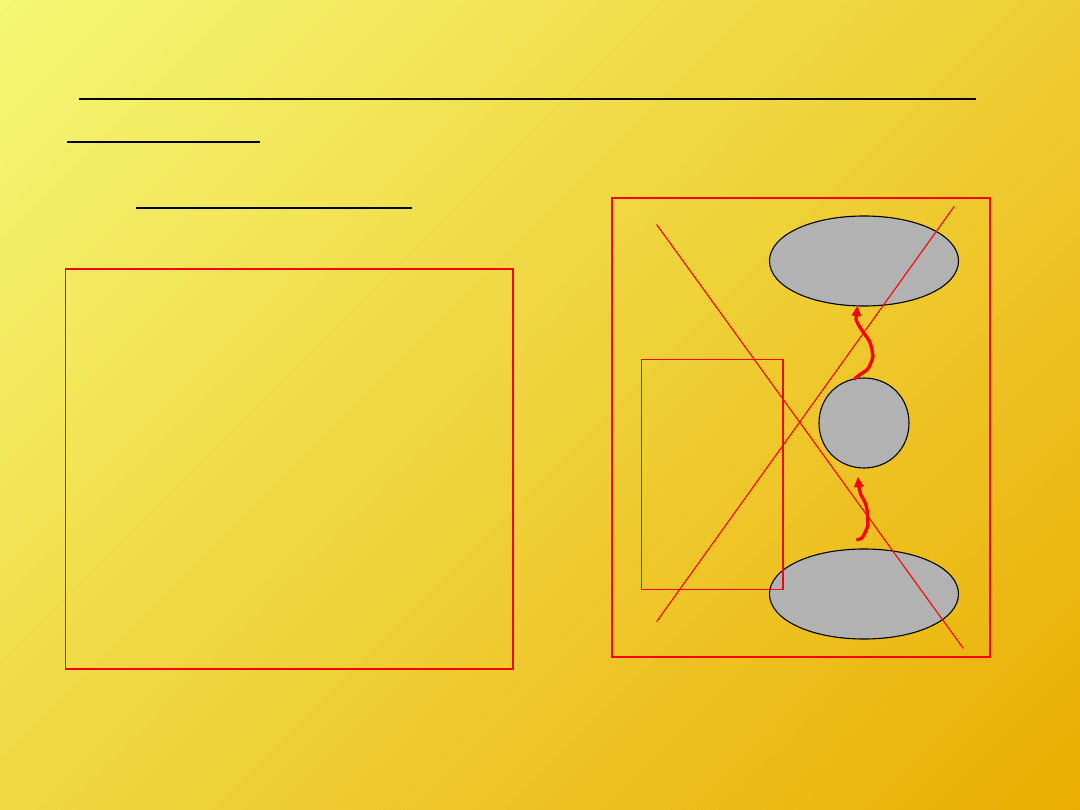
Sformułowanie Clausiusa oraz Kelvina-Plancka II
zasady
termodynamiki
T
2
T
1
Q
2
Q
1
Sformułowanie
Clausiusa:
Nie można
skonstruować
urządzenia
działającego
cyklicznie, którego
jedynym efektem
będzie transport ciepła
od ciała zimniejszego
do cieplejszego.
T
2
>
T
1
Q
1
=
Q
2
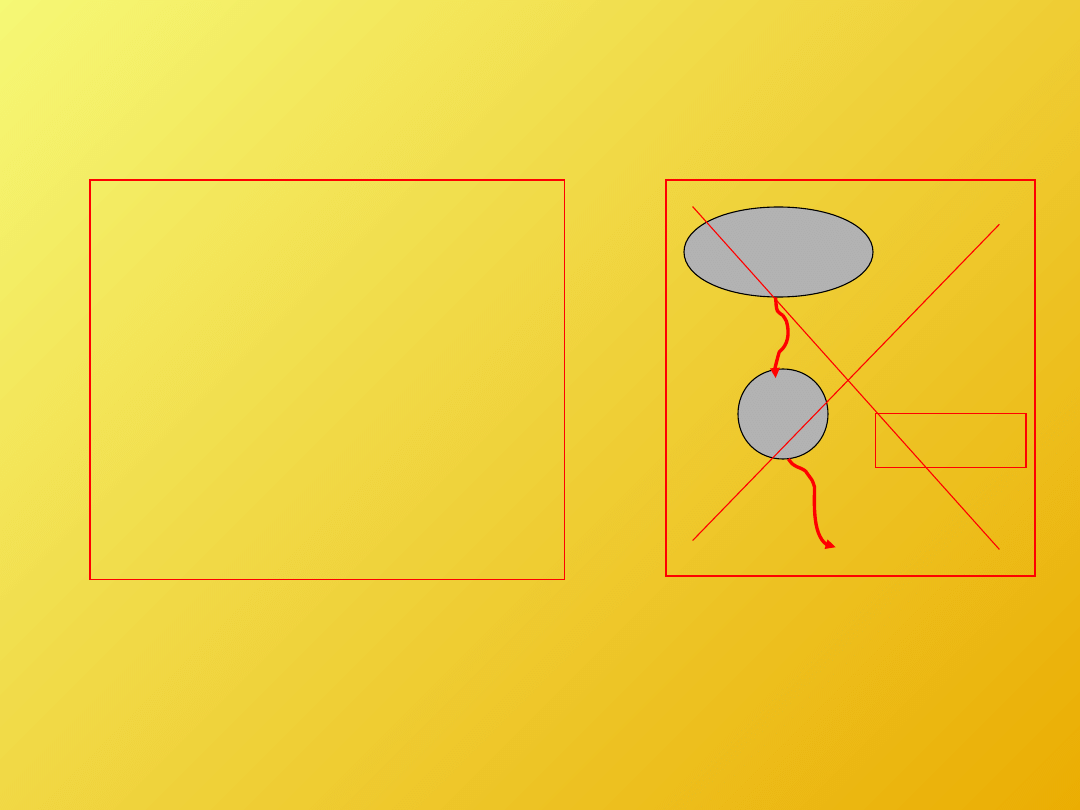
Sformułowanie Kelvina –
Plancka:
Nie można
skonstruować
urządzenia działającego
cyklicznie, którego
jedynym efektem jest
produkcja pracy i
wymiana ciepła z
pojedynczym
zbiornikiem.
T
W
Q = W

Procesy odwracalne oraz cykle
Zdefiniujmy najpierw
proces kwazistatyczny. Jest to
proces przebiegający tak wolno, że układ stale pozostaje
dowolnie blisko stanu równowagi.
Kiedy proces można nazwać odwracalnym?
Otóż jeżeli weźmiemy gaz w cylindrze, zauważymy, że
kwazistatyczne rozprężanie tego gazu związane jest z
wykonaniem pracy i oddaniem ciepła. Jeśli jesteśmy w
stanie przywrócić warunki początkowe przez dodanie
dokładnie tej samej ilości ciepła, oraz wykonanie tej
samej pracy, to gaz w cylindrze możemy sprężyć do
warunków początkowych. Można więc powiedzieć, że
proces kwasistatyczny jest procesem odwracalnym.
Inaczej mówiąc
proces odwracalny jest to taki
proces, po zajściu którego można przywrócić
warunki początkowe tylko przez narzucenie
warunku ograniczającego usuniętego na początku
procesu.

Procesem
nieodwracalnym
nazywamy proces, który nie jest
odwracalny.
Cyklem odwracalnym nazywamy ciąg
następujących po sobie procesów
odwracalnych takich, że układ w sposób
periodyczny wraca do stanu początkowego.
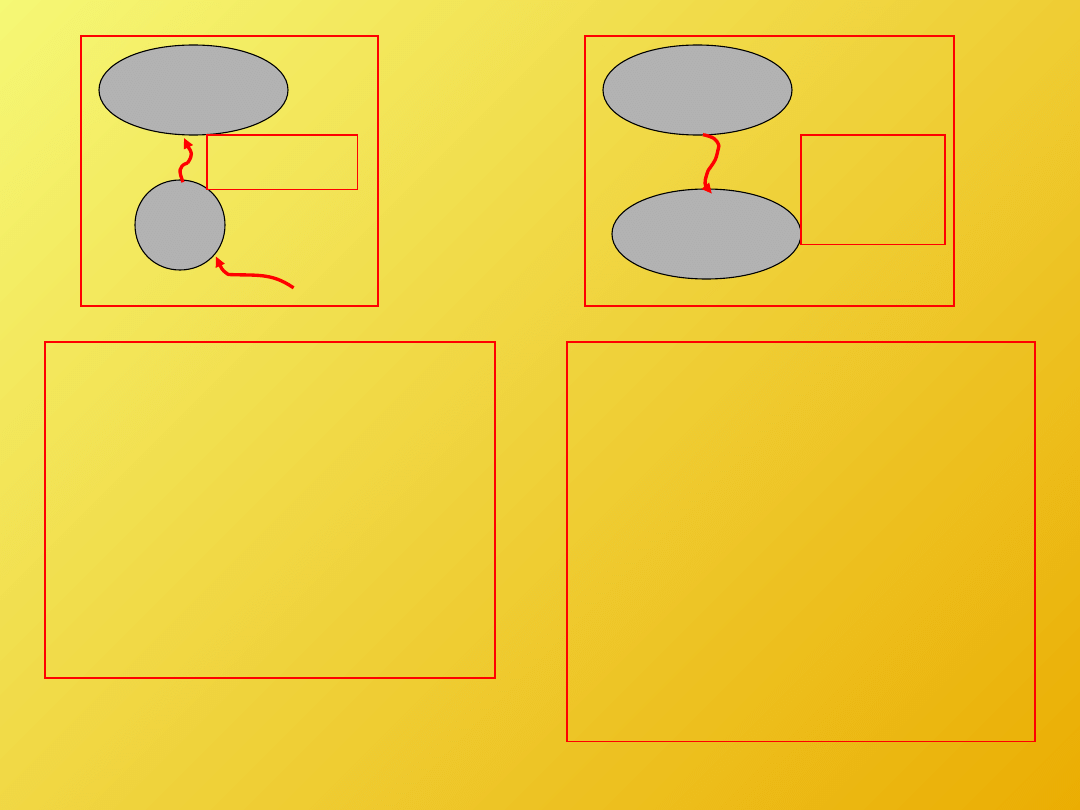
Konwersja pracy w
ciepło jest procesem
nieodwracalnym.
Sytuacja odwrotna
narusza sformułowanie
Kelvina-Plancka II
zasady termodynamiki
Transport ciepła przez
skończoną różnicę
temperatury jest
procesem
nieodwracalnym.
Sytuacja odwrotna
narusza sformułowanie
Kelvina-Plancka II
zasady termodynamiki
T
W
Q = W
T
2
T
1
Q T
2
>
T
1

Należy jeszcze zdefiniować
cykl mocy, czyli cykl
dostarczający pracę kosztem dostarczanego ciepła,
oraz
cykl chłodniczy, który kosztem dostarczanej
pracy oddaje ciepło
.
Odwracalny cykl mocy może zostać zamieniony na
odwracalny cykl chłodniczy przez odwrócenie
strumienia ciepła i pracy.
Równoważność sformułowania Clausiusa ze
sformułowaniem Kelvina-Plancka II zasady
termodynamiki możemy pokazać następująco.
Załóżmy, że jest możliwy transfer ciepła wbrew
stwierdzeniu Clausiusa, czyli bezpośrednio z
chłodnicy do zbiornika ciepła. Do tego procesu
możemy dodać odwracalny silnik taki jak na
środkowym obrazku. Wynikiem dodania takich
procesów jest powstanie silnika, który wykonuje
pracę korzystając tylko z jednego zbiornika ciepła.
A taki proces jest wykluczony przez
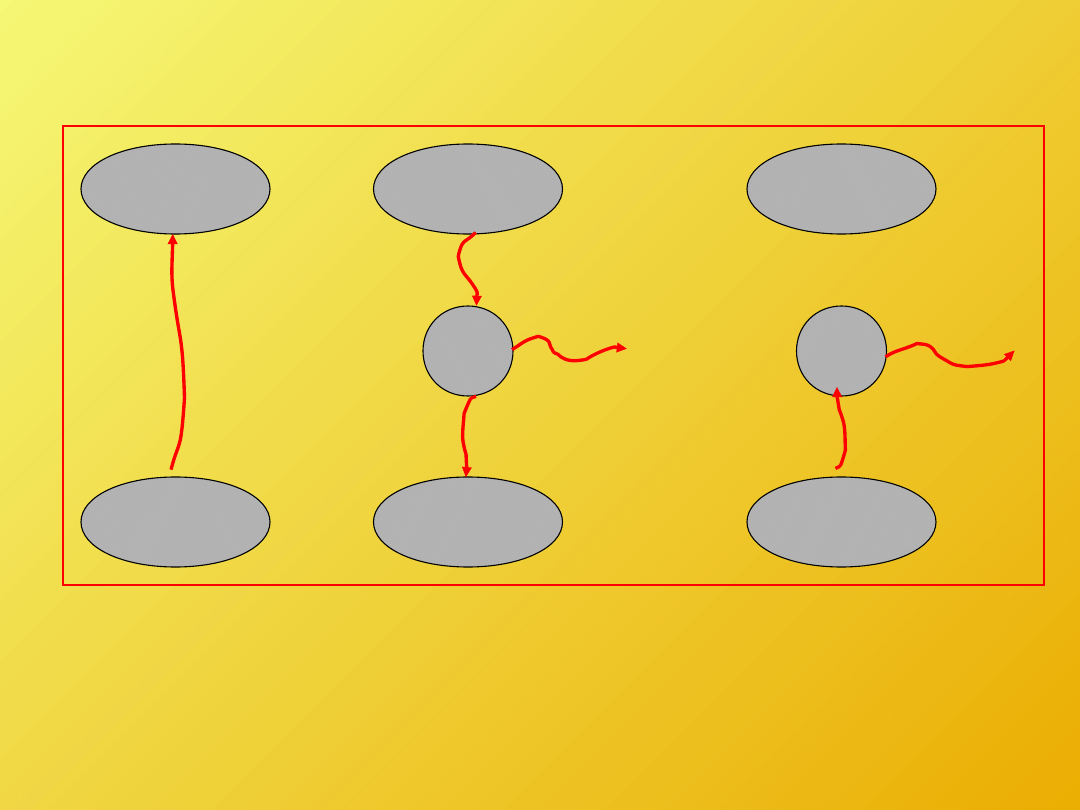
sformułowanie Kelvina-Plancka II zasady termodynamiki
T
2
T
1
Q
2
T
2
T
1
Q
2
Q
1
T
2
T
1
Q
2
-
Q
1
+
W=Q
2
-
Q
1
=
W=Q
2
-
Q
1
Pokazaliśmy więc, że złamanie sformułowania
Clausiusa II z.t. pociąga za sobą złamanie
sformułowania Kelvina – Plancka II z.t..
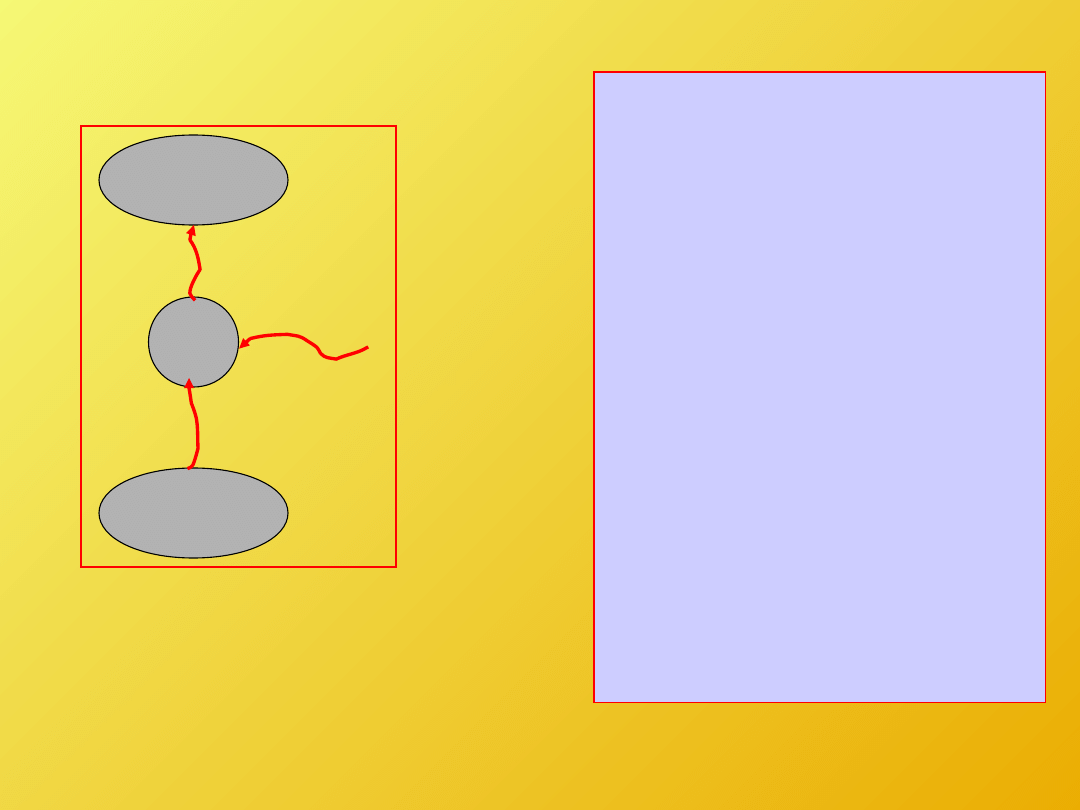
T
2
T
1
Q
1
W=Q
2
-
Q
1
Q
2
Dla kompletu
zdefiniujmy
sobie jeszcze
cykl
chłodzący
.
Jeśli chodzi o
konwencję znakową
dla ciepła i pracy
, to
mówimy:
Energia dodana do
systemu
=
Energia akumulowana
w systemie
+
Energia usunięta z
systemu
.


Wszystkie poniższe sformułowania drugiej
zasady termodynamiki są równoważne
:
Clausius (1850
): Nie istnieje proces
termodynamiczny, którego jedynym wynikiem
byłoby pobranie ciepła ze zbiornika
chłodniejszego i przekazanie go do zbiornika
cieplejszego (nie jest możliwe zbudowanie
idealnej maszyny chłodzącej)
Kelvin (1851
): Nie istnieje proces
termodynamiczny, którego jedynym wynikiem
byłoby pobranie ciepła ze zbiornika i
całkowita zamiana tego ciepła na pracę
mechaniczną.

Późniejsze od sformułowania Kelvina jest sformułowanie
podane przy pomocy pojęcia silnika termodynamicznego
Planck
: Nie możliwe jest zbudowanie silnika
termodynamicznego pracującego cyklicznie, który całe
pobrane ciepło zamieniałby na pracę (nie jest możliwe
zbudowanie idealnego silnika cieplnego – czyli
perpetuum mobile drugiego rodzaju).
Dla sprawności silnika cieplnego, z teorią których druga
zasada jest związana, oznacza to, że sprawność silników
cieplnych jest mniejsza od jedności
Druga zasada termodynamiki pozwala na zdefiniowanie
bezwzględnej skali temperatur Kelvina identycznej ze skalą
temperatury gazu doskonałego.
Pozwala ona też na wprowadzenie
użytecznej funkcji stanu
nazywanej
entropią
.
Związana jest z pojęciem procesów
odwracalnych i nieodwracalnych,z kierunkiem procesów
zachodzących samorzutnie w układach izolowanych, z
kierunkowością zjawisk w przyrodzie. Za pomocą pojęcia
entropii druga zasada termodynamiki daje się wysłowić:
Boltzmann
: Entropia układu izolowanego nie maleje.

Druga zasada termodynamiki nie jest ścisłym
prawem przyrody, ma jedynie charakter
statystyczny.
Zdarzenia sprzeczne z nią mogą w
rzeczywistości zajść, lecz są mało
prawdopodobne
. Ściślej mówiąc są tym mniej
prawdopodobne, im więcej cząstek liczy układ
termodynamiczny. II zasada termodynamiki dobrze
sprawdza się w skali makro, gorzej w skali mikro. W
zaawansowanym wykładzie mechaniki statystycznej
dowodzi się nawet, że pewne wydarzenia sprzeczne
z drugą zasadą termodynamiki z pewnością będą
miały miejsce. Jednak czas, jaki przychodzi czekać
na tego typu zajście w makroskopowym układzie,
znacznie przekracza wiek wszechświata, możemy
się więc „nie doczekać”...

Entropia
jest termodynamicznym parametrem
stanu układu. W interpretacji statystycznej, określa
ona stopień nieuporządkowania układu, albo inaczej
mówiąc, stopień jego wyjątkowości. Statystycznie
określa się ją jako:
Gdzie const jest jakąś stałą. W natomiast jest
definiowane jako liczba mikrostanów
nieodróżnialnych od naszego makrostanu. Z tego
wynika np. że wazon ma małą entropię
(nieuporządkowanie), natomiast rozbite odłamki dużą
(jest wiele możliwych realizacji rozbitego wazonu).
const
W
k
S
ln

Z punktu widzenia przemian termodynamicznych,
entropię definiuje się jako uogólnione przemieszczenie.
Dla siły i pracy można napisać zależność:
Podobne równanie można zapostulować dla całkowitego
pochłoniętego ciepła (odpowiednik pracy z powyższego
wzoru) i jednostki napędowej (temperatura), zużytej
na ,,uogólnionej drodze'' (entropii):
Można udowodnić, że entropia jest funkcją stanu. Tzn.
nie zależy ona od drogi, po jakiej się do niej doszło.
Fds
dW
TdS
dQ

W cyklu odwracalnym wielkość Q/T jest zachowywana
Stąd wielkość Q/T nie zależy od drogi, a tylko od stanu
początkowego
i końcowego układu termodynamicznego
Entropia S jest funkcją stanu układu,
S(V,T)
W procesach odwracalnych entropia jest
zachowywana
S
całkowita
= 0,
natomiast w procesach nieodwracalnych entropia
rośnie
dS
n
dQ/T
Entropią układu termodynamicznego nazywamy taką
funkcję S
tego układu, której przyrost dS w procesie odwracalnym jest
równy stosunkowi przyrostu ciepła Q pobranego przez układ
do temperatury układu (termostatu)
dS = dQ/T

Na ogół w przemianach
termodynamicznych nie interesuje nas
entropia jako taka, ale jej zmiany. Sprawa jest
podobna do energii potencjalnej: poziom zerowy
jest przyjmowany umownie. W przypadku entropii
jest on zgodnie z postulatem Plancka przyjmowany
dla doskonałych kryształów na poziomie
temperatury 0 K, co umożliwia wyzerowanie stałej,
obecnej w interpretacji statystycznej. W
temperaturze 0 K istnieje bowiem zgodnie z
zasadami fizyki kwantowej tylko jeden
mikrostan (W=1).

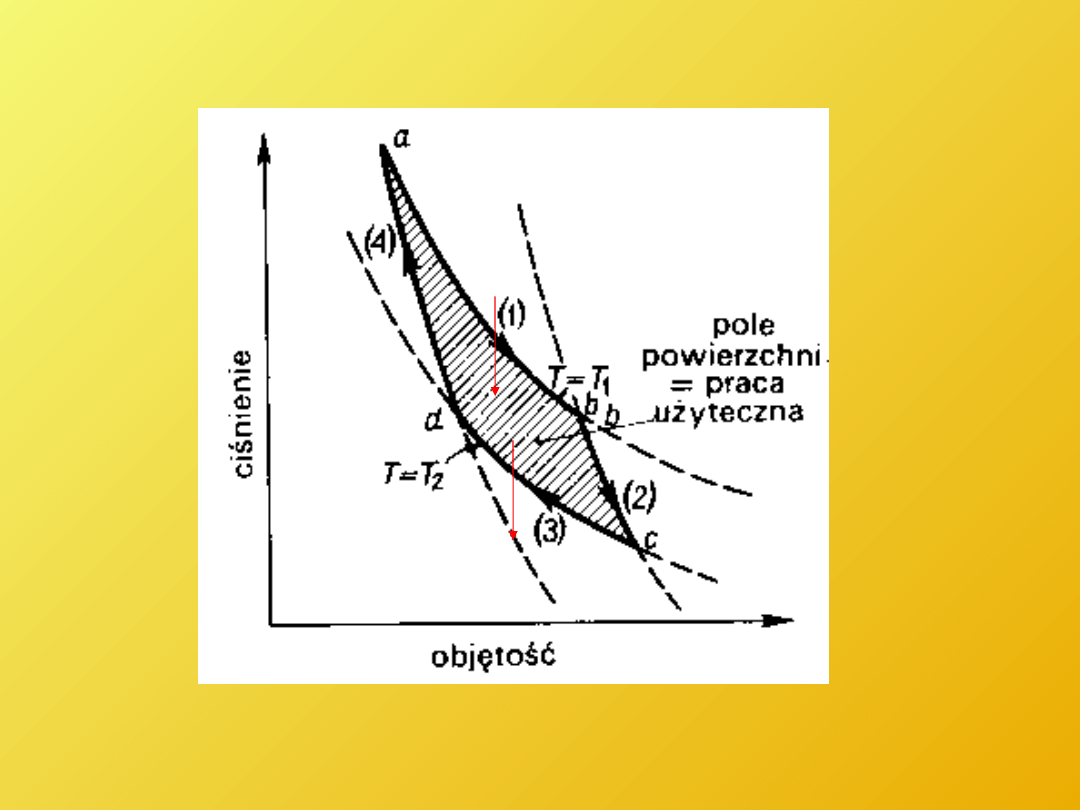
Cykl Carnota
(odwracalny
) (Nicolas Leonard Sadi Carnot 1796 - 1832)
Dla procesów kołowych odwracalnych (izotermy T
1
, T
2
, -adiabaty)
Q
1
/T
1
= Q
2
/T
2
Q
1
Q
2
W

T
T
1
T
2
S
1
S
2
S
Cykl Carnota (T, S)
Sprawność silnika cieplnego Carnota
Twierdzenie Carnota
Sprawność wszystkich odwracalnych silników
pracujących z tymi samymi termostatami jest jednakowa
1
1
2
1
1
2
1
Q
W
Q
Q
Q
T
T
T

Dla dowolnej maszyny cieplnej nieodwracalnej
(tj. dla cyklu nieodwracalnego) sprawność cyklu
nieodwracalnego
n
= 1 - (Q’
2
/Q
1
) 1 - (T
2
/T
1
) =
c
n
o
Sprawność nieodwracalnego cyklu jest
zawsze mniejsza od sprawności cyklu
Carnota pracującego między tymi
samymi termostatami

W
Q
2
Sprawność w cyklu odwrotnym
Carnota
Sprawność układu chłodzącego
Efekty Q
2
Nakłady W
Naklady
Efekty

I zasada termodynamiki (sformułowanie
klasyczne)
Nie jest możliwe perpetuum mobile I
rodzaju
, tzn. nie można zbudować ciągle
pracującego silnika, który wykonuje większą
pracę niż pobiera energii z zewnątrz.
II zasada termodynamiki (sformułowanie
klasyczne)
Nie jest możliwe perpetuum mobile II
rodzaju
, tzn. nie można zbudować ciągle
pracującego silnika, który pobrane z otoczenia
ciepło zamienia całkowicie na pracę.

Kinetyczna teoria gazów
interpretacja
ciśnienia i temperatury
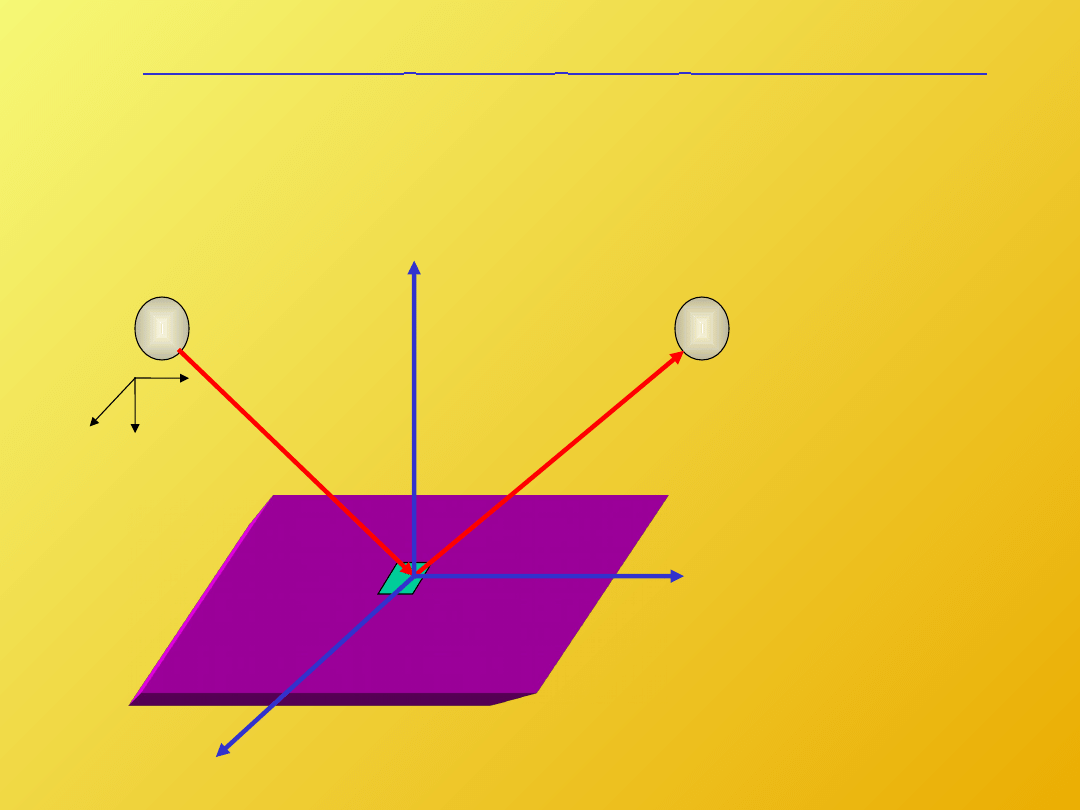
x
y
z
v
x
v
y
v
z
dA
Kinetyczna
teoria
gazu
doskonałego
Aby pokazać proste zależności pomiędzy
termodynamiką mikroskopową a makroskopową
rozważmy kinetyczną analizę
ruchu
cząsteczek
gazu.
Ciśnienie jest
zdefiniowane
jako siła
wywierana na
ściankę przez
uderzające w
nią cząsteczki.
Pęd
przekazany
ściance przez
każdą cząstkę
jest równy
:

z
cz
z
cz
z
cz
v
M
v
M
v
M
dt
F
2
)
(
(1)
Liczba molekuł uderzająca powierzchnię
dA
dana
jest przez strumień molekuł w kierunku
z
s
moleku
ł
v
dA
n
n
z
/
(2)
·
n
jest liczbą molekuł na jednostkę objętości.
Jeśli założymy przypadkowy ruch molekuł, to tylko
połowa molekuł poruszać się będzie w kierunku
–z .
z
z
v
dA
n
n
2
1
(3)
·

Z zależności pomiędzy popędem siły a zmianą pędu
znajdujemy, że całkowity pęd przekazany
powierzchni dA w czasie dt jest równy iloczynowi
dt
dA
v
n
v
M
dt
F
z
z
cz
)
2
1
(
)
2
(
Czyli ciśnienie
2
z
cz
v
n
M
p
dA
F
(4)
Wiemy,
że
2
2
2
2
z
y
x
v
v
v
v
a z przypadkowości
ruchu
wynika,
że
2
2
2
2
3
1 v
v
v
v
z
y
x
.
Otrzymu
je
my
2
3
/
1
v
M
n
p
cz
(5)
2
2
2
2
1
2
2
2
1
2
...
2
...
2
2
v
N
M
N
V
V
N
M
V
M
V
M
CZ
CZ
CZ
CZ
gdzie

We wzorze (5)
iloczyn
V
m
M
n
cz
czyli masę na
substancji na
jednostkę
objętości.
Po wstawieniu tego do równania
(5)
otrzymujemy
wyrażenie;
2
3
1
v
m
pV
(6)
Porównując to równanie z równaniem
gazu
doskonałego
otrzymujemy:
2
2
3
2
2
3
3
1
2
2
2
v
M
kT
n
v
NM
T
k
N
v
m
T
nR
cz
cz
A
(7)
Temperatura jest miarą średniej energii
kinetycznej gazu.
nRT
pV
Wynik ten zwany jest prawem Boyle’a
k
E
T ~
A
A
N
n
N
k
N
R

Żeby podany powyżej związek był zgodny z klasycznym,
termodynamicznym prawem gazów doskonałych, prawa strona
równania, związana z energią kinetyczną cząstki, musi zawierać
kinetyczną definicję temperatury bezwzględnej.
TEMPERATURA
Temperatura definiowana w ramach termodynamiki klasycznej
(makroskopowej), to parametr opisujący stan równowagi termodynam
i
cznej
układu.
W teorii kinetycznej zdefiniujemy temperaturę jako:
k
cz
E
k
v
M
k
T
3
2
2
3
2
2
gdzie
jest średnią energią kinetyczną przypadającą na 1 cząsteczkę gazu.
Współczynnik proporcjonalności w powyższej definicji zawiera wielkość
k
zwaną stałą Boltzmanna, :
K
J
k
23
10
38
,
1
Dla tak zdefiniowanej temperatury,
oba prawa gazów
doskonałych (termodynamiczne i w teorii kinetycznej) są
równoważne.
k
E
2
2
2
2
1
2
2
2
1
2
...
2
...
2
2
v
N
M
N
V
V
N
M
V
M
V
M
CZ
CZ
CZ
CZ
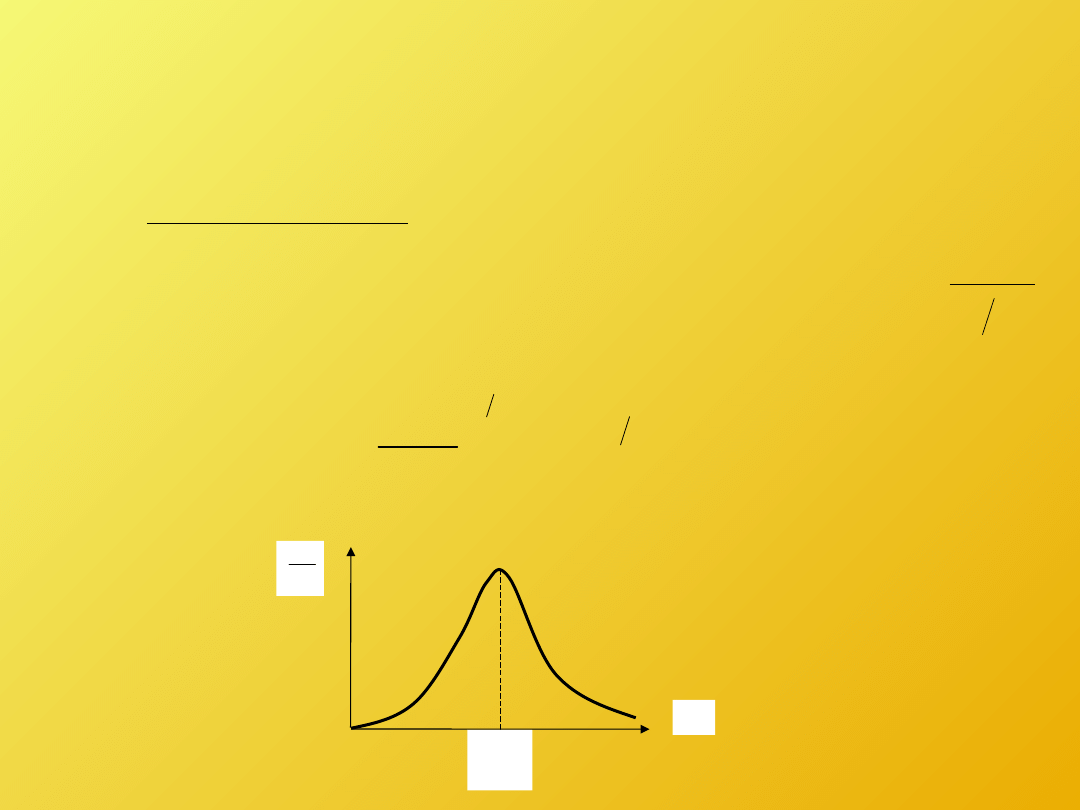
ROZKŁAD PRĘDKOŚCI CZĄSTECZEK
Wyprowadzając podstawowe równanie kinetycznej teorii gazów
wprowadziliśmy pojęcie średniej kwadratu prędkości (średniej
prędkości kwadratowej), która charakteryzowała zbiór cząsteczek jako
całość. Problemem pozostaje wyznaczenie tej średniej, czyli znalezienie
formuły rozkładu prędkości cząsteczek gazu doskonałego
.
Maxwell rozwiązał teoretycznie to zagadnienie, podając prawo
pozwalające określić, jaka liczba cząstek
dn
z całej ilości
0
n
cząstek gazu doskonałego w jednostce objętości
V
N
n
0
v
do
dv
v
:
dv
v
e
kT
M
n
dn
kT
v
M
cz
cz
2
2
2
3
0
2
2
4
ma w danej temperaturze prędkości w przedziale od
v
pr
v
dv
dn

cz
pr
M
kT
v
2
T
1
T
2
T
3
ROZKŁAD MAXWELLA
Korzystając z rozkładu Maxwella można wyliczyć:
-prędkość najbardziej prawdopodobną:
z warunku:
-prędkość średnią kwadratową:
cz
kw
M
kT
v
v
3
2
-prędkość średnią:
cz
M
kT
v
8
Wraz ze wzrostem temperatury, krzywe przedstawiające rozkład prędkości cząsteczek gazu zmieniają się:
dv
dn
v
pr
v
3
2
1
T
T
T
Maksimum krzywej przesuwa się wraz ze wzrostem temperatury w kierunku
większych prędkości – przy ogrzewaniu gazu udział cząsteczek obdarzonych małymi
prędkościami zmniejsza się.
0
dv
v
dn
o
n
vdv
v
n
v
0
)
(
o
n
dv
v
v
n
v
0
2
2
)
(
kw
pr
v
v
v

ŚREDNIA DROGA SWOBODNA
Cząsteczki gazu mają skończone wymiary i stale zderzają się ze sobą (wymieniając
się energią kinetyczną i pędami, stąd rozkład prędkości Maxwella!). Pomiędzy
dwoma kolejnymi zderzeniami cząsteczki poruszają się prostoliniowo i jednostajnie
a odległość przy tym pokonywaną nazwiemy średnią długością drogi swobodnej.
.
Korzystając z rozkładu Maxwella, można pokazać, że średnia droga swobodna
cząsteczki zależy od „wymiaru” cząsteczki
d
i liczby cząsteczek w jednostce objętości gazu
0
n
:
0
2
2
1
n
d
Przy stałej temperaturze liczba cząsteczek w objętości gazu jest wprost
proporcjonalna do ciśnienia gazu, więc średnia droga swobodna jest odwrotnie
proporcjonalna do ciśnienia. A zatem:
const
p
6
10
5
,
6
3
10
5
5
,
0
50 5000
[cm]
10
-6
10
-4
10
-2
1
760
p
[mm
Hg]

Oddziaływania międzycząsteczkowe Energia wewnętrzna
Krótkozasięgowy charakter oddziaływania
Energia wewntrzna
Ciepło molowe
nRT
NkT
U
2
3
2
3
zależna tylko od temperatury, zakładamy brak energii potencjalnej
Ciepło które trzeba dostarczyć do jednego mola gazu, aby spowodować
jednostkową zmianę temperatury.
ndT
dU
C
v
R
ndT
nRT
d
C
v
2
3
2
3
Zgodność tylko dla gazu jednoatomowych

STOPNIE SWOBODY CZĄSTECZEK
Liczba stopni swobody ciała to najmniejsza możliwa
liczba współrzędnych (liczba współrzędnych niezależnych), które
musimy podać, aby jednoznacznie określić położenie ciała w
przestrzeni.
Cząsteczki gazu jednoatomowego mają trzy stopnie
swobody – ich położenie opisują trzy współrzędne, np. x,y,z
układu kartezjańskiego.
Cząsteczki dwuatomowe mają pięć stopni swobody –
trzeba na przykład podać trzy współrzędne jednego atomu i
dwie współrzędne, określające położenie drugiego atomu
względem pierwszego (tylko dwie, bo stała odległość między
nimi da nam automatycznie trzecią współrzędną!).
Cząsteczki, zbudowane z większej ilości atomów bądź
po prostu ciała sztywne (traktowane jako układ wielu atomów, o
nie zmieniających się odległościach między nimi), maja sześć
stopni swobody.

ZASADA EKWIPARTYCJI ENERGII
Jednym z ważniejszych praw fizyki statystycznej jest prawo równomiernego
rozkładu energii między stopnie swobody: na każdy stopień swobody
cząsteczki średnio przypada jednakowa energia kinetyczna, równa
2
kT
(
zasada ekwipartycji energii
).
Jeżeli cząstka jest obdarzona
i
stopniami swobody, to jej średnia energia kinetyczna:
W przypadku gazu doskonałego jedyną energią cząstek była energia
kinetyczna. W przypadku np. ciał stałych należy
uwzględniać
również
energię potencjalną oddziaływań międzycząsteczkowych. Można
wykazać, że zasada ekwipartycji energii jest wtedy również słuszna, jeśli
tylko energia potencjalna jest funkcją kwadratów współrzędnych
cząsteczki.
.
2
kT
i
E
k
i – liczba stopni swobody
Pojedyncza cząstka
i=3
Podwójna cząsteczka
i=5
Więcej niż 2 cząstki
i=6
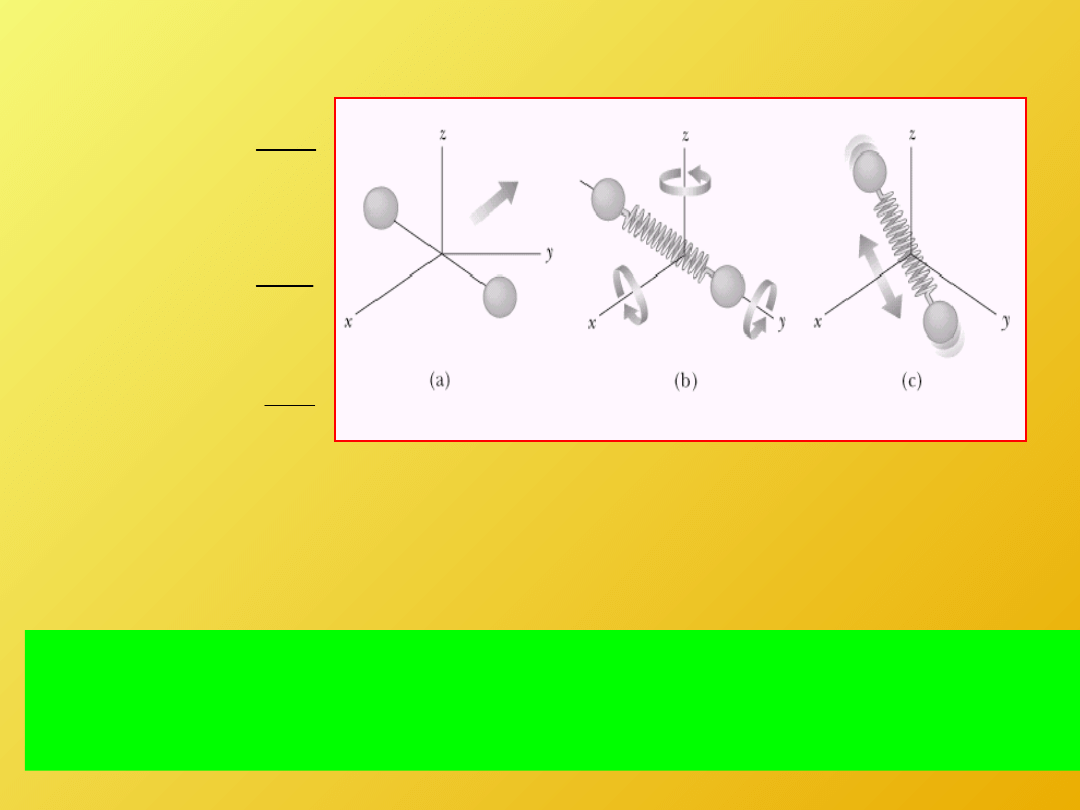
Dostępne formy ruchu dla cząstek:
-a) Ruch postępowy
-b) Ruch rotacyjny
-c) Ruch wibracyjny
2
2
mv
2
2
I
2
2
kx
Gdy liczba punktów materialnych jest bardzo duża oraz obowiązuje
mechanika Newtonowska
Powyższe formy absorpcji energii mają taką samą wartość średnią
i ta średnia wartość zależy wyłącznie od temperatury
Dostępna energia zależy wyłącznie od temperatury
i rozkłada się w równych porcjach na wszystkie
sposoby, w jakie cząsteczki mogą ją absorbować.
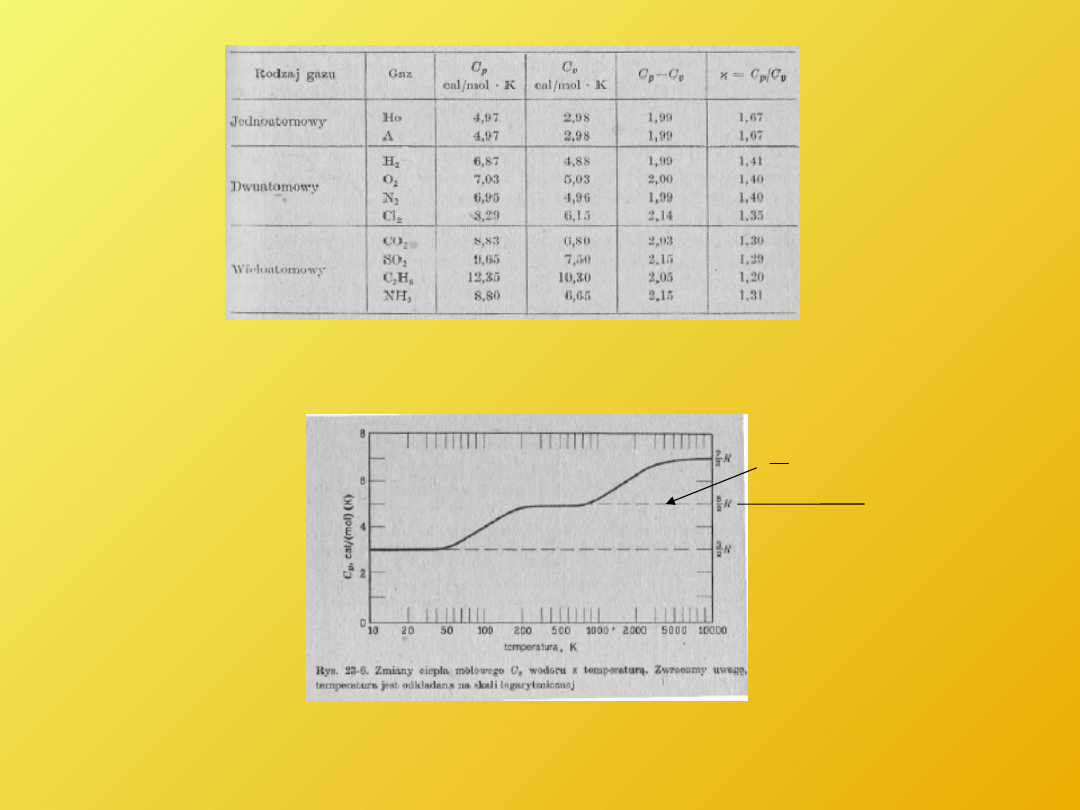
Ciepła molowe niektórych gazów wyznaczone doświadczalnie T=293K p=10
5
Pa
Ciepło molowe wodoru w funkcji temperatury (brak zgodności z mechaniką klasyczną C
v
(T))
R
2
5
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
- Slide 68
- Slide 69
- Slide 70
- Slide 71
- Slide 72
- Slide 73
- Slide 74
- Slide 75
- Slide 76
- Slide 77
- Slide 78
- Slide 79
- Slide 80
- Slide 81
- Slide 82
- Slide 83
- Slide 84
- Slide 85
- Slide 86
- Slide 87
- Slide 88
- Slide 89
- Slide 90
- Slide 91
- Slide 92
- Slide 93
- Slide 94
- Slide 95
- Slide 96
- Slide 97
- Slide 98
- Slide 99
- Slide 100
- Slide 101
- Slide 102
- Slide 103
- Slide 104
- Slide 105
- Slide 106
Wyszukiwarka
Podobne podstrony:
termo student
2010 ZMP studenci
gruźlica dla studentów2
Prezentacja 2 analiza akcji zadania dla studentow
Szkolenie BHP Nowa studenci
Student Geneza
Kosci, kregoslup 28[1][1][1] 10 06 dla studentow
higiena dla studentów 2011 dr I Kosinska
Studenci biegunka przewlekła'
WYKŁAD STUDENCI MIKULICZ
Wyklad FP II dla studenta
Inwolucja połogowa i opieka poporodowa studenci V rok wam 5
Materiały dla studentów ENDOKRYNOLOGIA
Wykład 3 powtórzenie 2010 studenci (1)
więcej podobnych podstron