
Metody badań
strukturalnych
Spektrometria masowa

Spektrometria masowa (MS – Mass
Spectrometry) to dynamicznie rozwijająca
się metoda analizy instrumentalnej
związków organicznych. Badany związek
doprowadza się do jonizacji i rozpadu na
naładowane fragmenty, które przyspiesza
się polem elektrycznym. Uzyskany
strumień jonów rozdziela się wg stosunku
ich masy do ładunku i mierzy natężenie
prądu jonowego odpowiadające
poszczególnym jonom.

Zastosowanie spektrometrii masowej:
- określanie masy atomowej związku chemicznego,
- badania strukturalne izomerów,
- badania strukturalne biopolimerów i związków
pochodzenia naturalnego
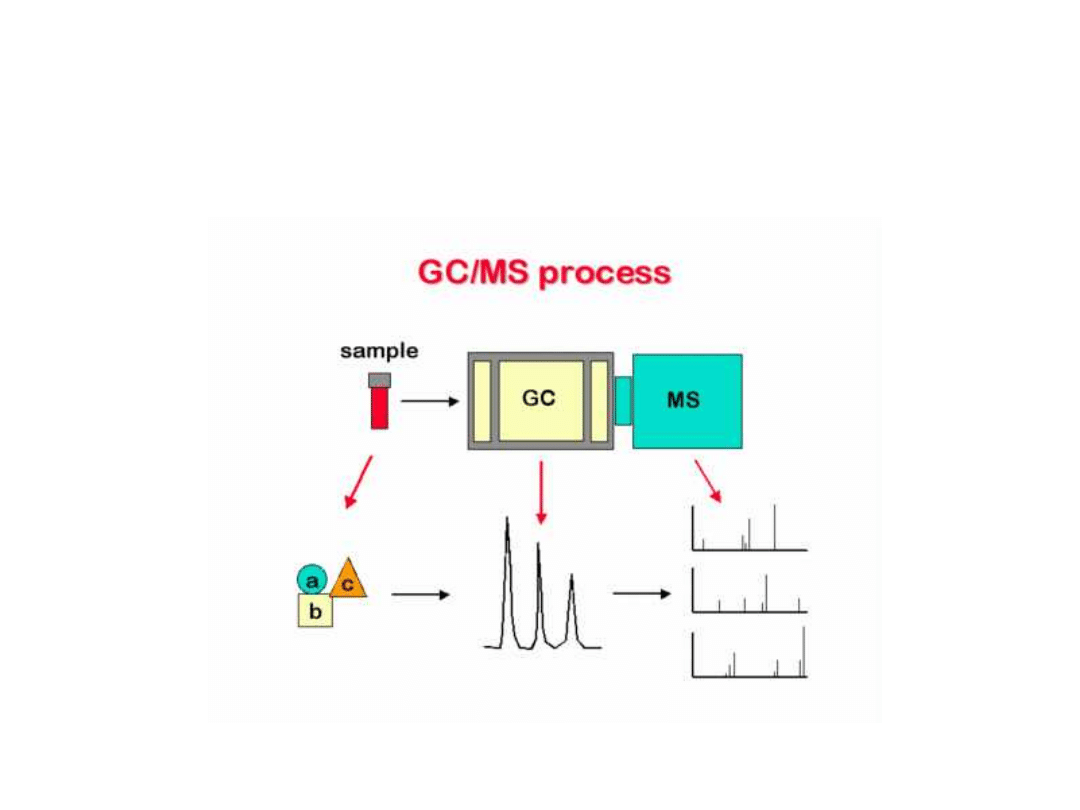
Sprzężenie z chromatografią
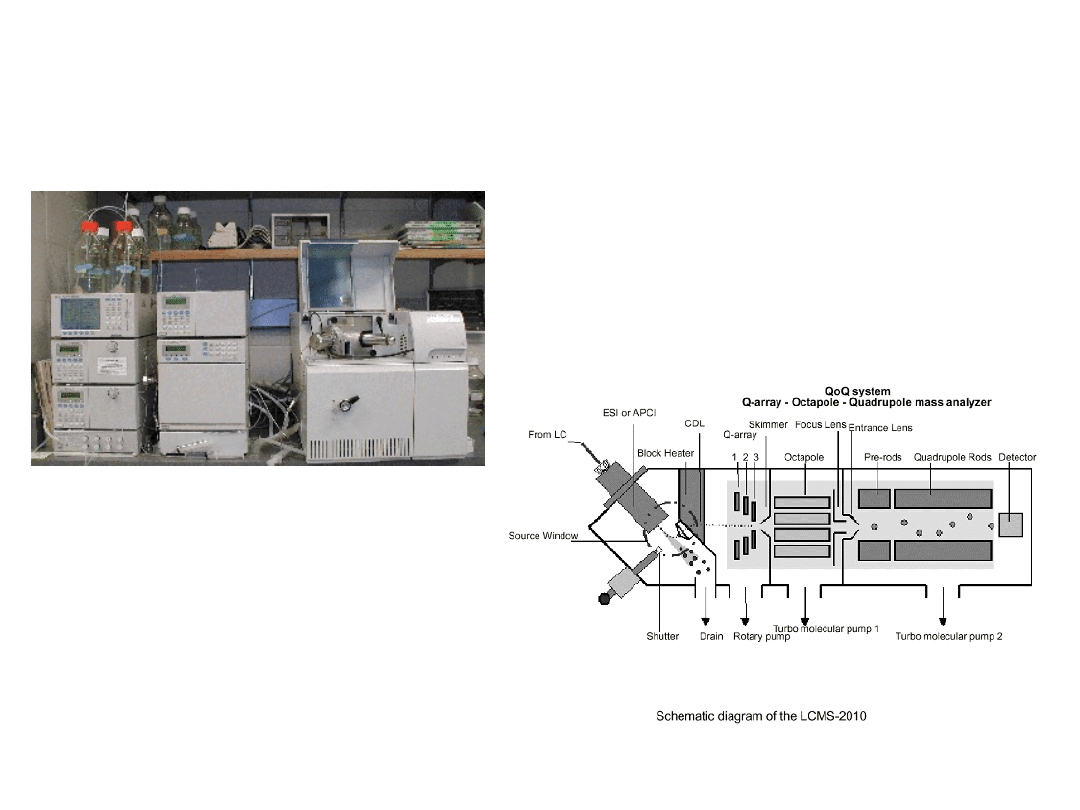
Aparatura
Metody jonizacji próbki:
- jonizacja strumieniem elektronów (EI),
- jonizacja chemiczna (CI),
- jonizacja polem (FI),
- bombardowanie szybkimi atomami (FAB)
- ESI (Elecrtospray Ionization)
- MALDI (Matrix Assisted Laser
Desorption/Ionization)
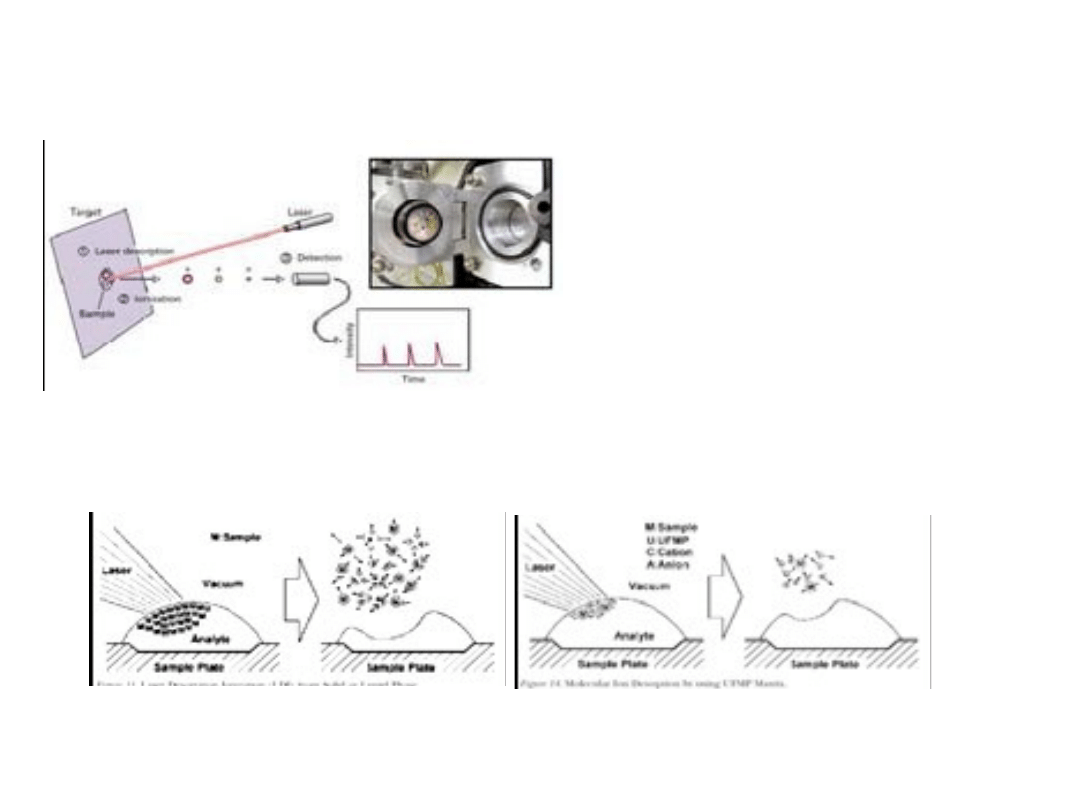
MALDI
Próbka umieszczona w
matrycy jest zdyspergowana
na powierzchni, a następnie
ulega desorpcji i jonizacji
na skutek działania laserem.
Metoda ta jest stosowana
głównie do sekwencjonowania
peptydów i określania
masy cząsteczkowej białek.
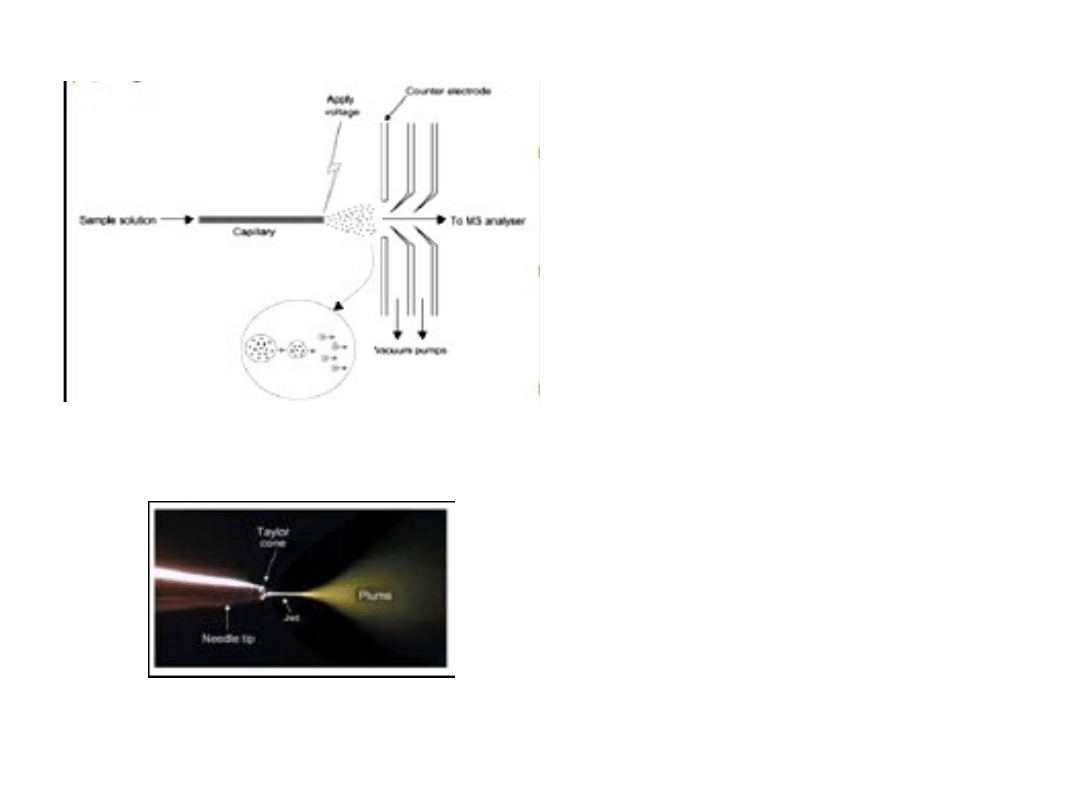
ESI
Technika stosowana do
badania rozpuszczalnych
w wodzie biomolekuł:
peptydów, białek, cukrów.
Spektrometr masowy jest
najczęściej sprzężony z LC.
Próbka jest rozpylana i
jonizowana za pomocą
przyłożonego napięcia,
rzędu kilku kV.

Analizatory stosowane w spektrometrach
masowych:
• analizatory magnetyczne,
• analizatory kwadrupolowe,
• analizatory mierzące czas przelotu jonów,
• analizatory cyklotronowego rezonansu
jonowego.
Najistotniejsze cechy analizatora to:
• rozdzielczość,
• zakres mas cząsteczkowych w których można
wykonywać pomiar,
• czułość
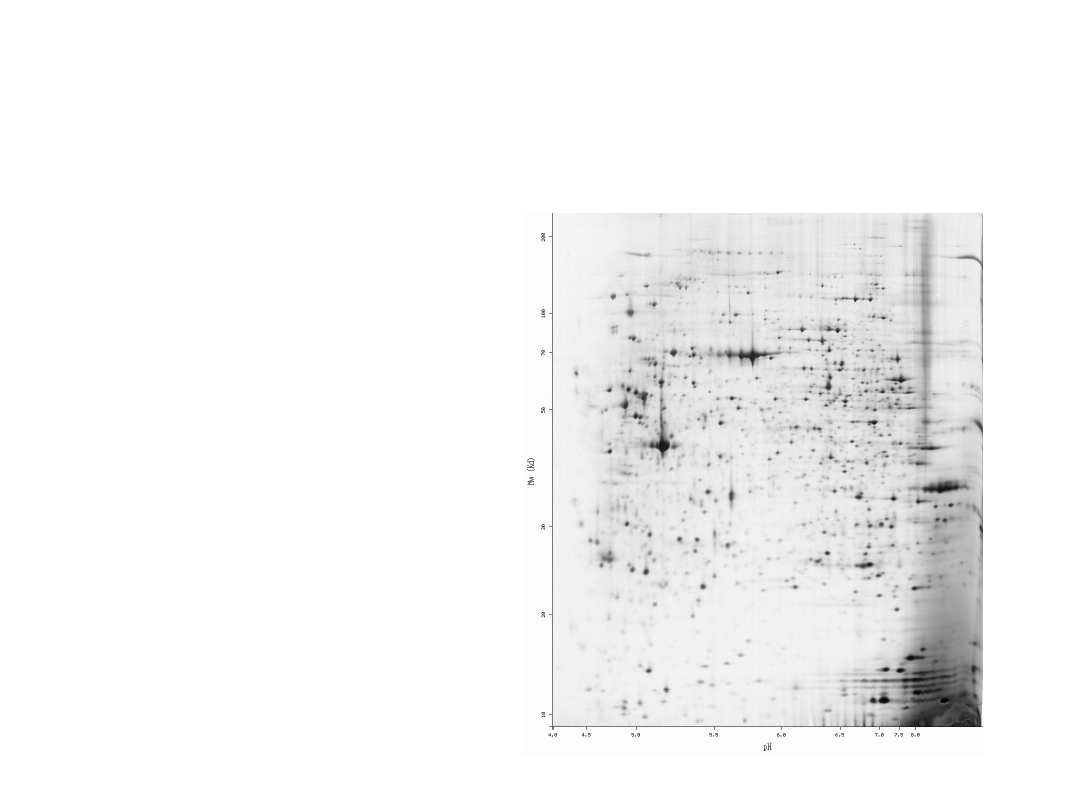
Elektroforeza 2D
• Rozdział białek pod
względem
– Masy cząsteczkowej
(Mw)
– Punktu
izoelektrycznego (pI)
• Barwienie
• Analiza uzyskanej
mapy peptydowej
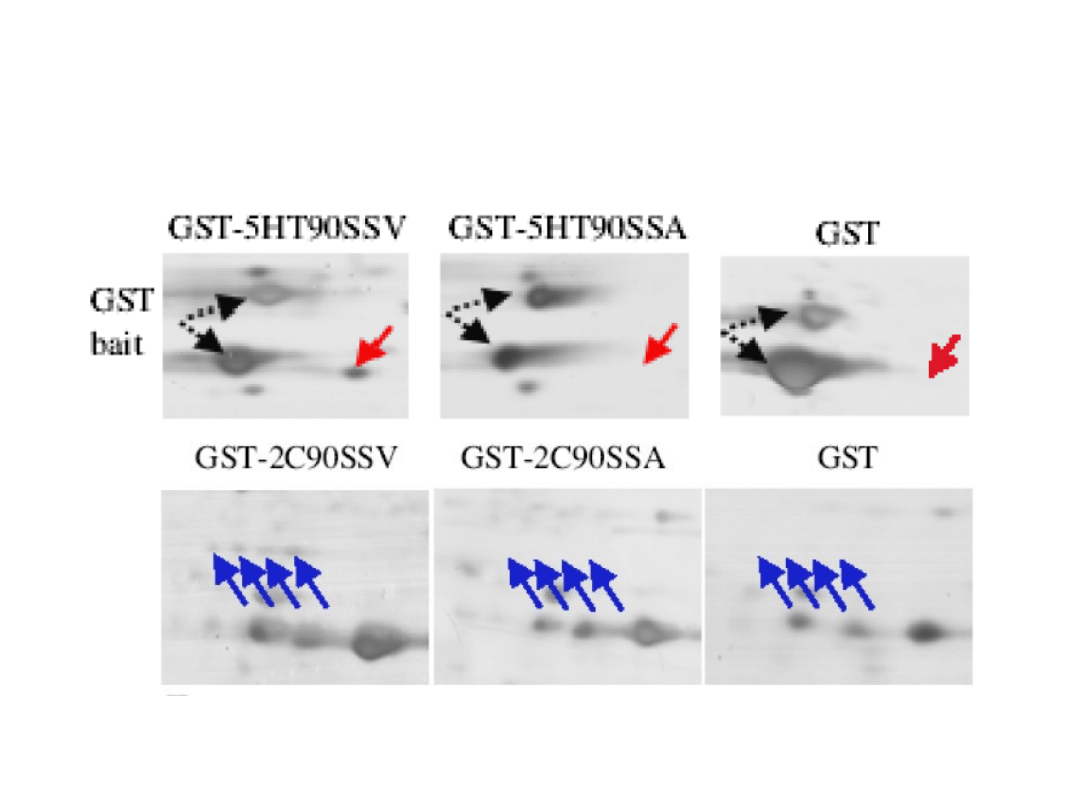
Elektroforeza 2D
Bécamel et al., Biol. Proced. Online 2002;4:94-104.
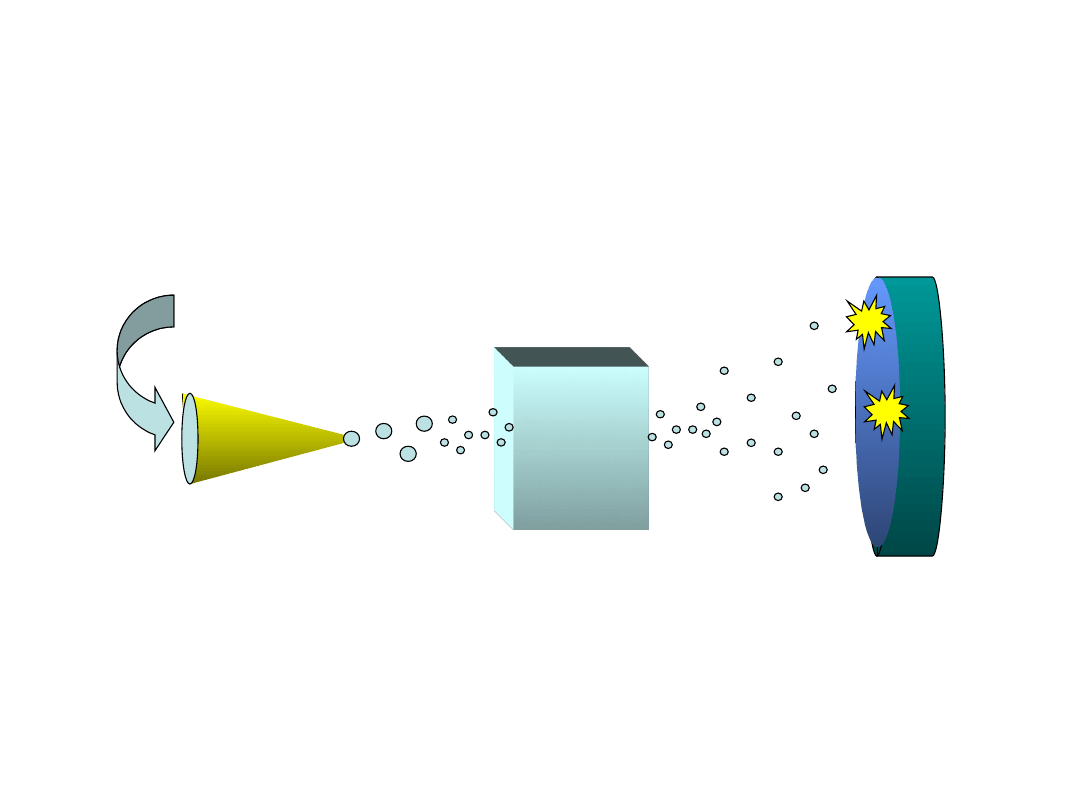
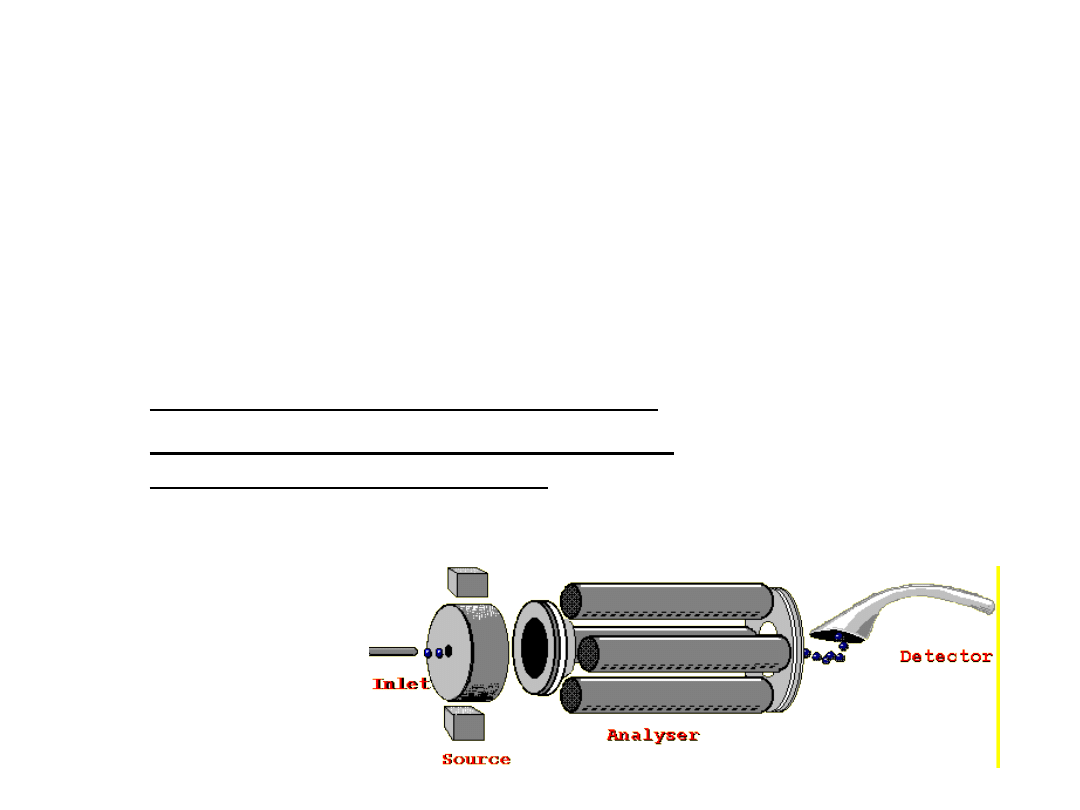
Spektrometr masowy
Jonizator
próba
+
_
Analizator masy
Detektor
•
MALDI
•
Electro-Spray
Ionization (ESI)
•
Time-Of-Flight (TOF)
•
Quadrapole
•
Ion-Trap
•
Electron
Multiplier
(EM)
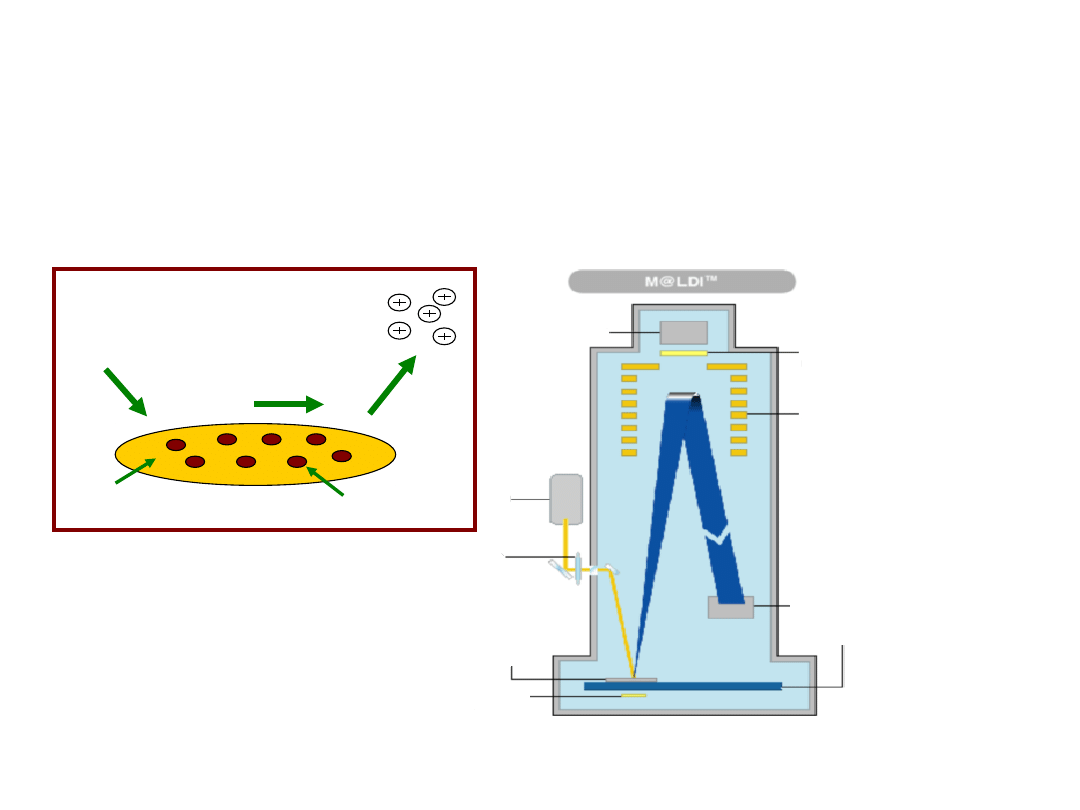
Spektrometr masowy
(MALDI-TOF)
Detector
(linear mode)
Reflectron
N
2
Laser
Lens
Detector
(reflectron mode)
Target plate
with sample
Energy transfer
from matrix to
sample
Matryca
Próba
Laser
Jonizacja
Schemat procesu MALDI
(a)
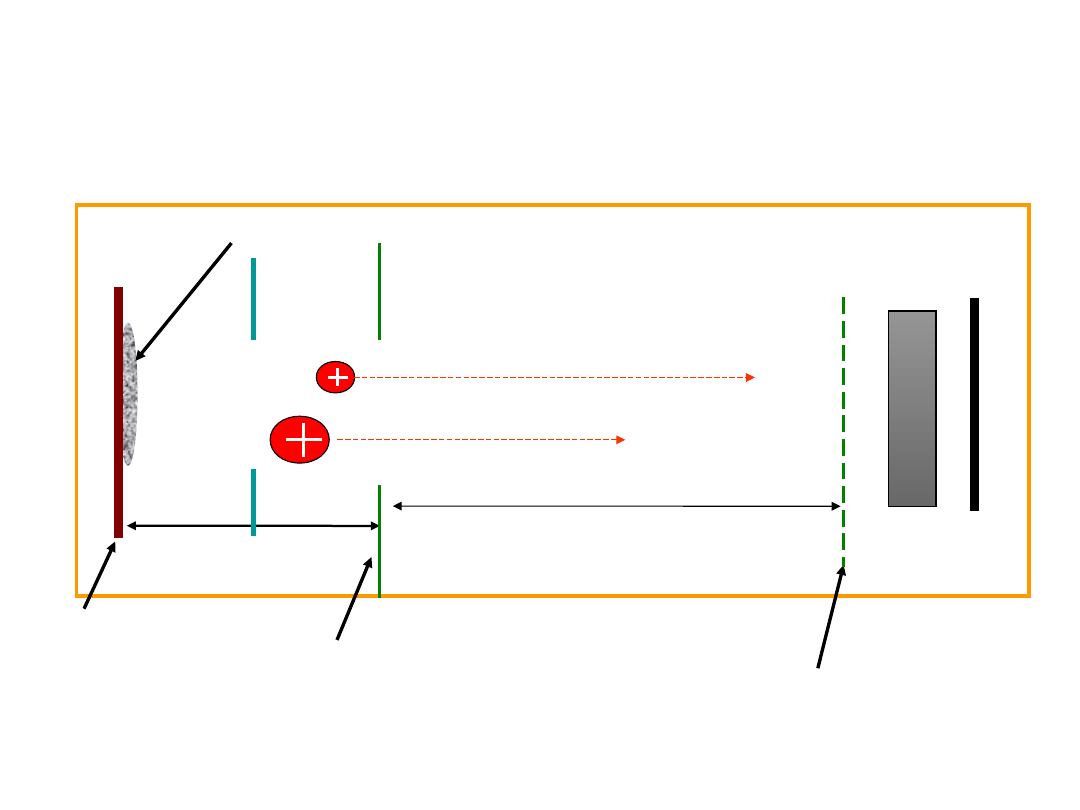
Spektrometr masowy
(MALDI-TOF)
Source
Length = s
Field-free drift zone
Length = D
E
d
= 0
Microchan
nel plate
detector
Backing plate
(grounded)
Extraction grid
(source voltage -V
s
)
UV (337
nm)
Detector grid
-V
s
Pulse
voltag
e
Analyte
/matrix
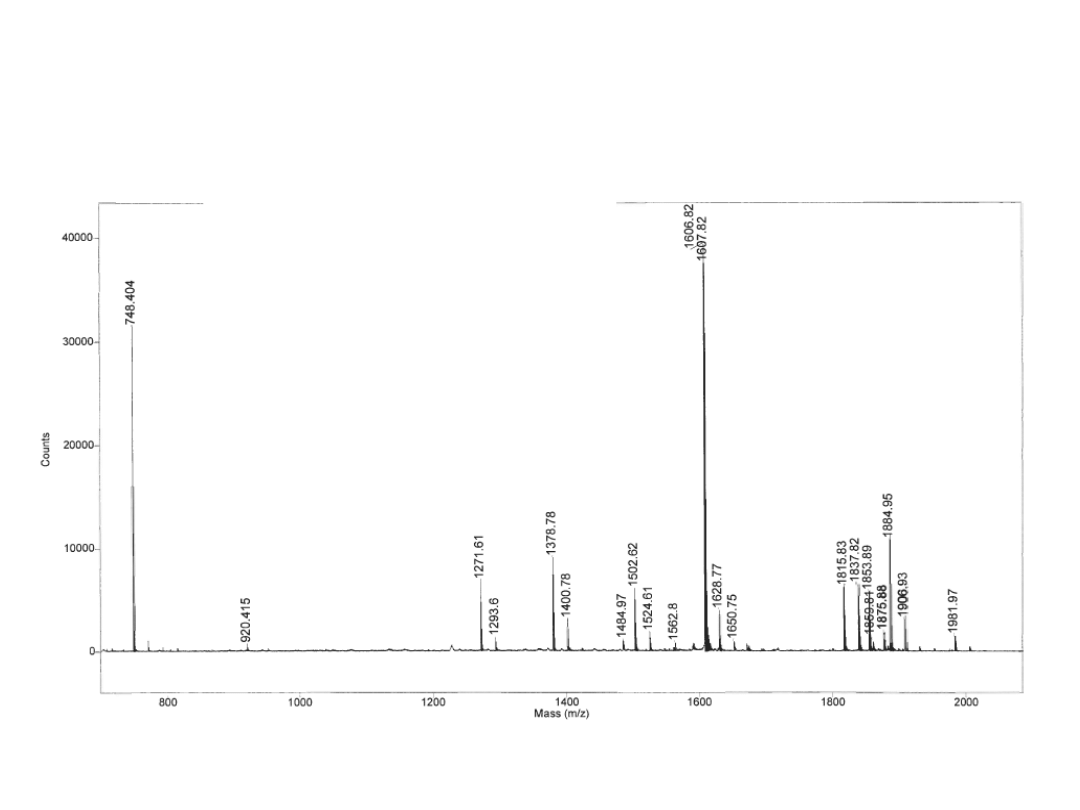
Spektrum masowe
Masa cząsteczkowa jest podstawą
analizy
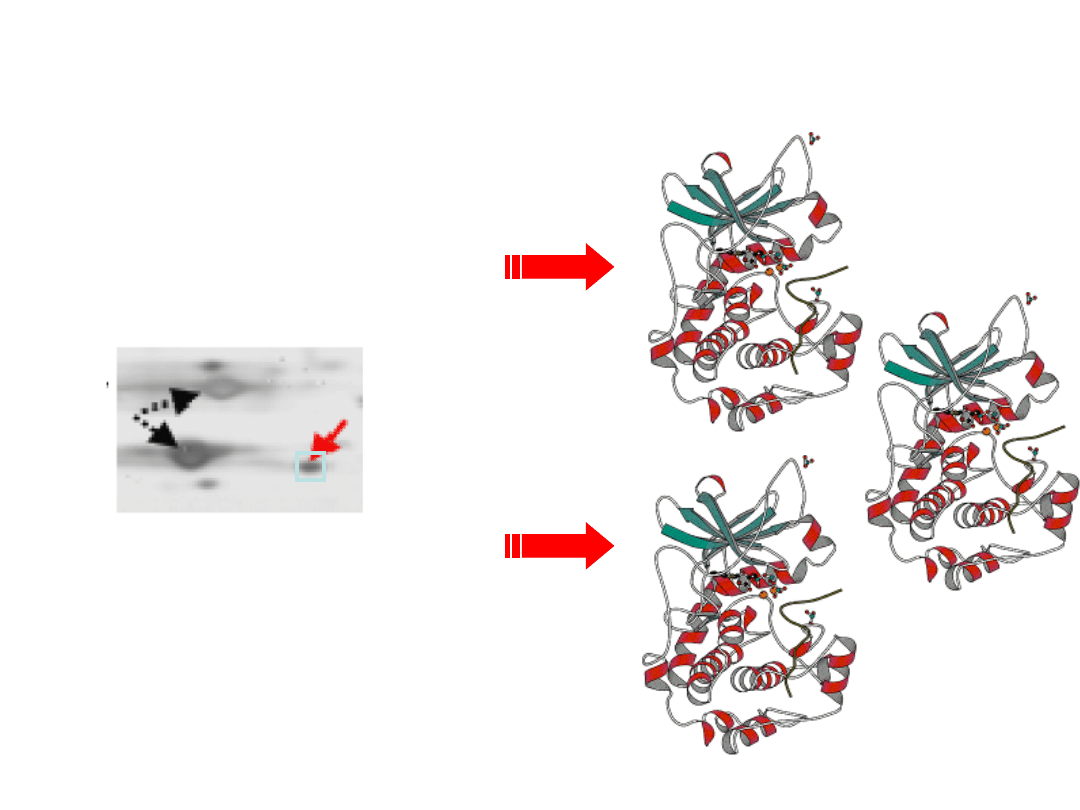
Identyfikacja białek techniką
Peptide Mass Fingerprint
Wycięcie
frakcji
z żelu 2D
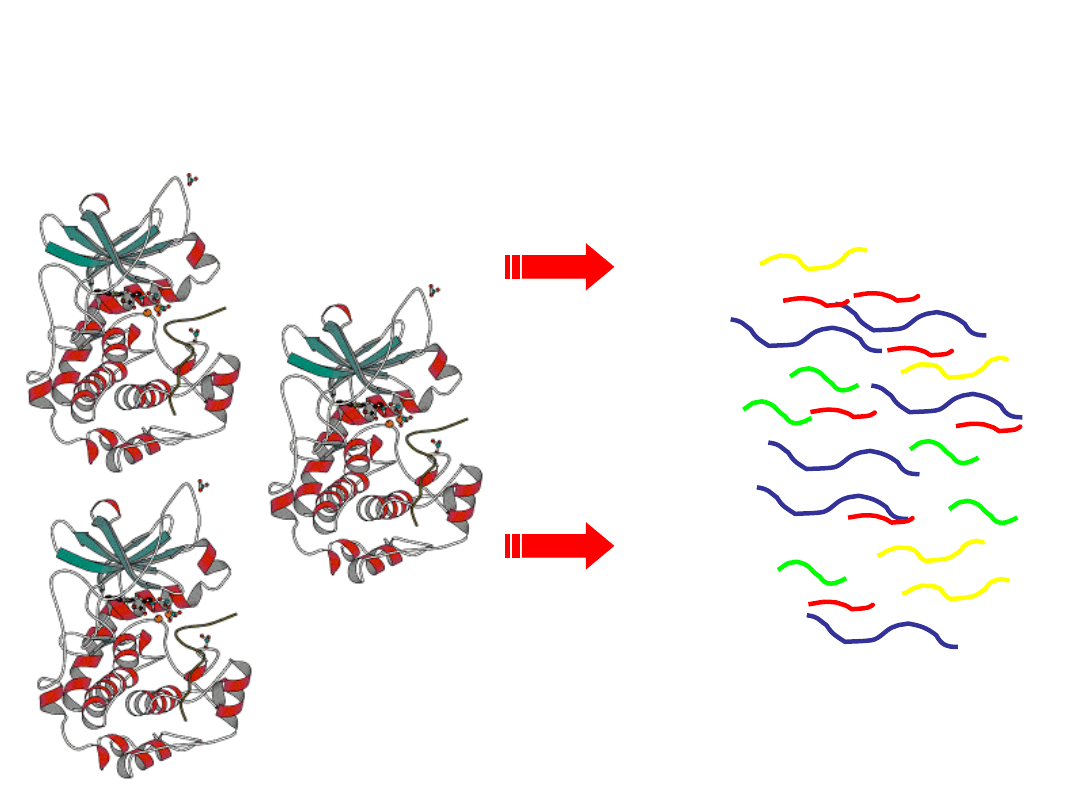
Peptide Mass Fingerprint
Trawienie
trypsyną

Spektrometria masowa
• Zalety
– Precyzyjne oznaczenie masy cząsteczkowej
– Możliwość przeprowadzenia fragmentacji
– Technologia wysoko zautomatyzowana
• Słabości
– Najlepsze wyniki wtedy, gdy mamy tylko kilka
molekuł w tym samym czasie
– Najlepsze wyniki dla małych cząsteczek
– Możliwe wyznaczenie stosunku masy do
niesionego ładunku
– Intensywność sygnału ≠ ilości badanej substancji
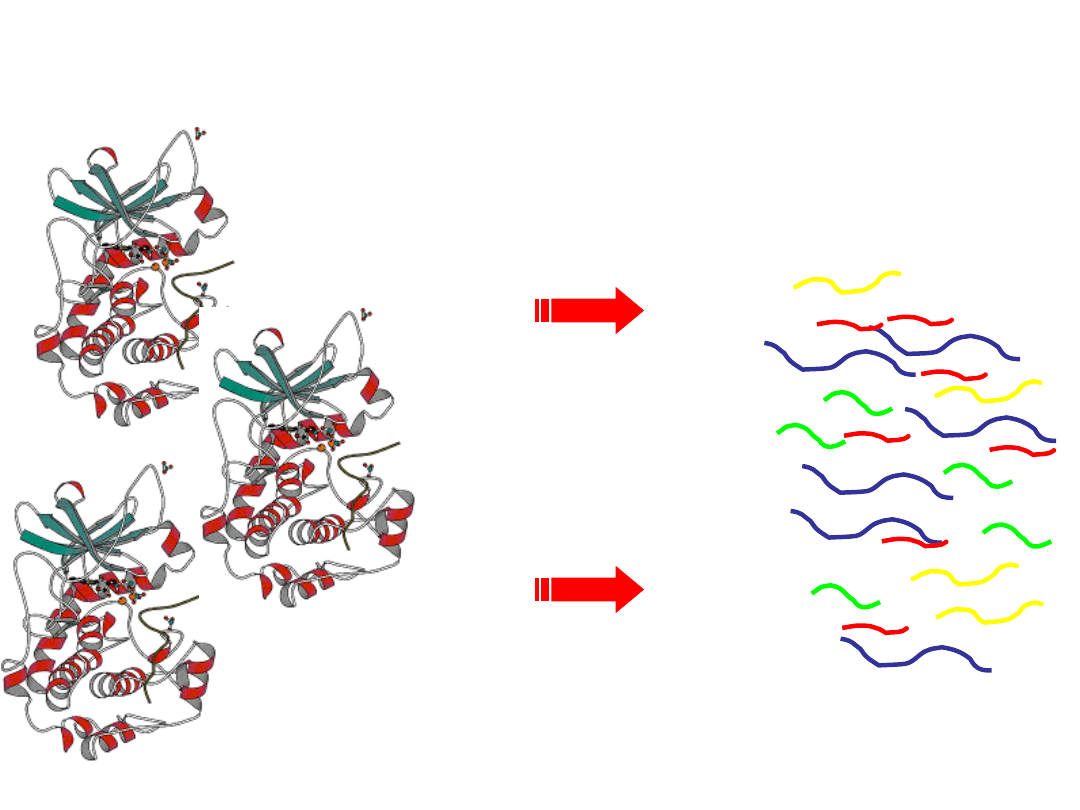
LC/MS w celu wykazania ilości
peptydów
Trawienie enzymatyczne
i frakcjonowanie
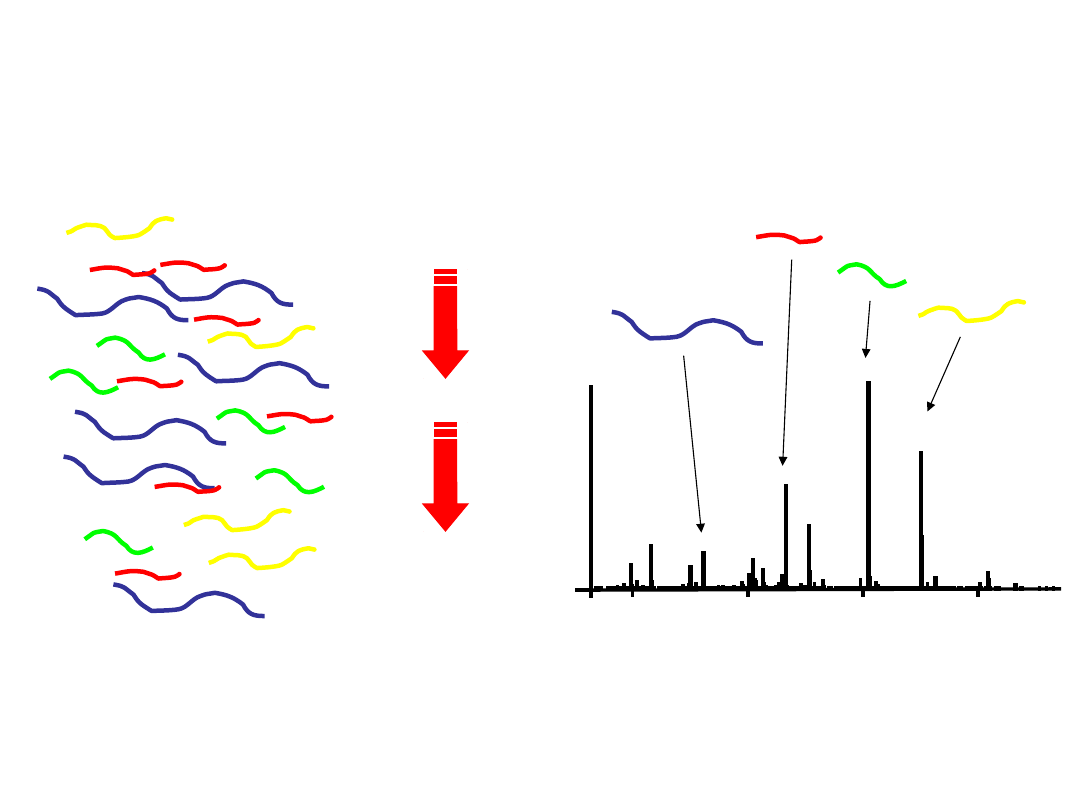
LC/MS for Peptide Abundance
LC/MS: 1 spektrum masowe co 1-2 sekundy
Spektrometria
masowa
Chromatografia cieczowa
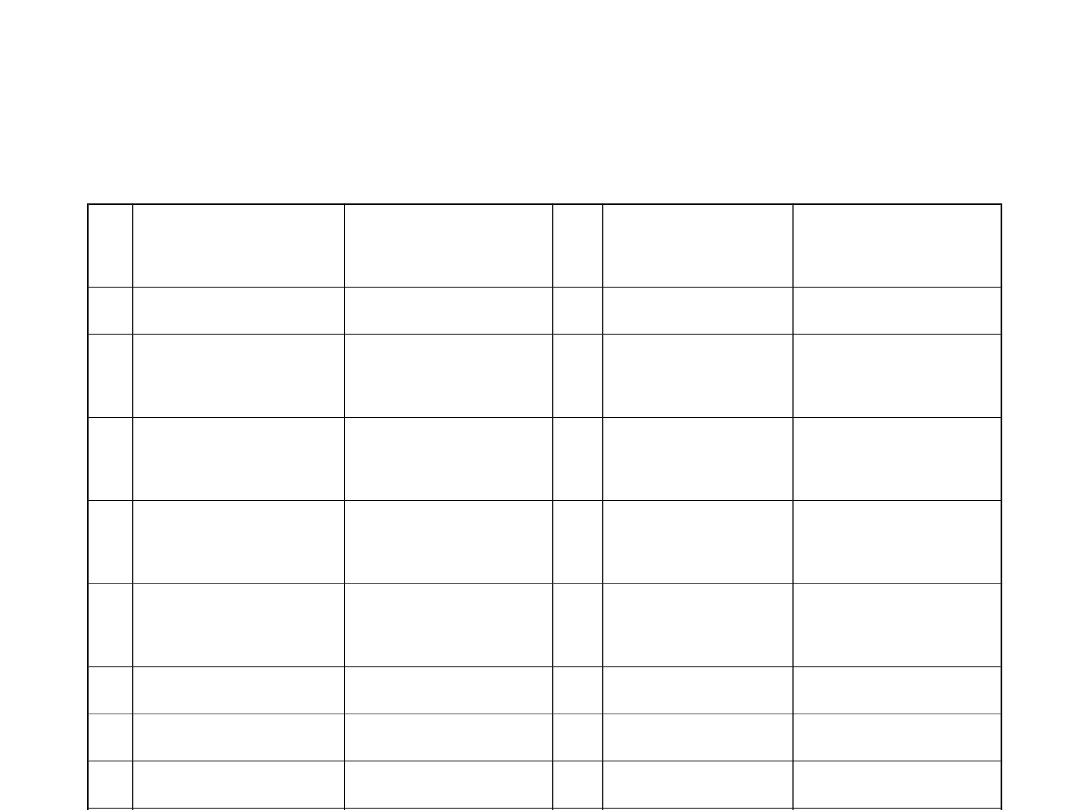
De Novo Interpretation
Amino-
Acid
Residual
MW
Amino-
Acid
Residual
MW
A Alanine
71.03712 M Methionine 131.04049
C Cysteine
103.00919 N Asparagin
e
114.04293
D Aspartic
acid
115.02695 P Proline
97.05277
E Glutamic
acid
129.04260 Q Glutamine
128.05858
F Phenylalani
ne
147.06842 R Arginine
156.10112
G Glycine
57.02147 S Serine
87.03203
H Histidine
137.05891 T Threonine
101.04768
I
Isoleucine
113.08407 V Valine
99.06842
K Lysine
128.09497 W Tryptophan
186.07932
L Leucine
113.08407 Y Tyrosine
163.06333
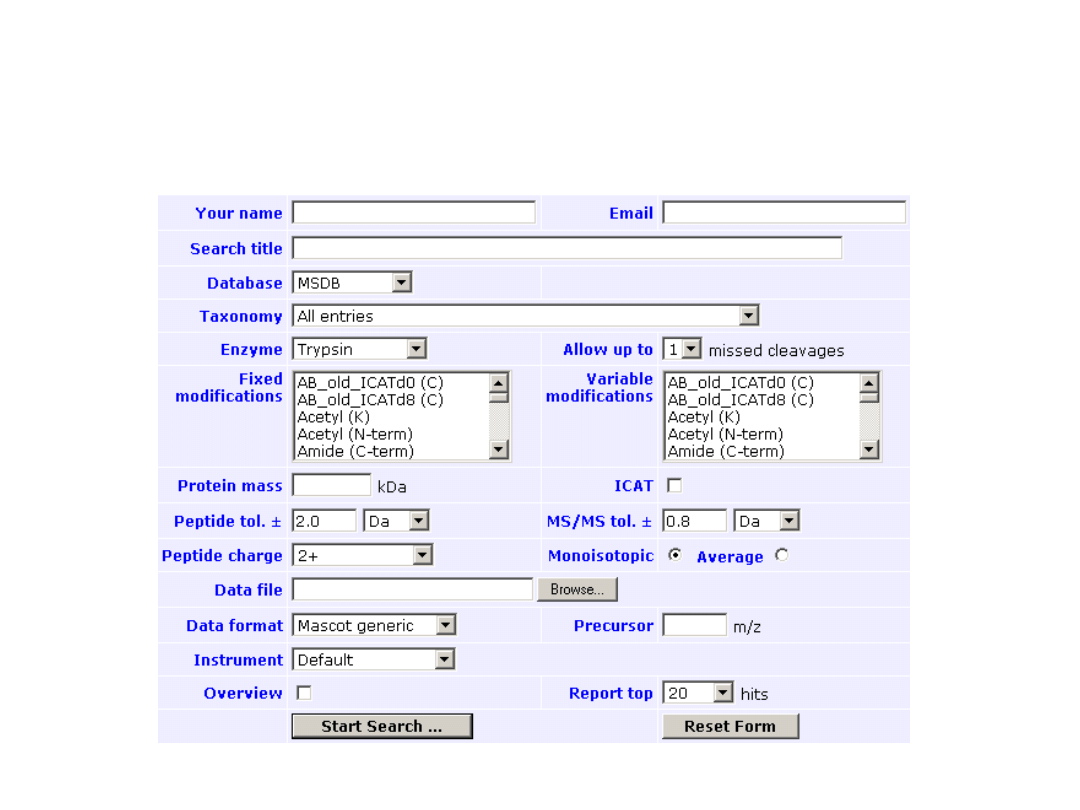
Mascot MS/MS Ions Search
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
Wyszukiwarka
Podobne podstrony:
Chromatografia gazowa Spektrometria masowa
Spektrometria masowa-ćwiczenie, Spektroskopia, spektroskopia
Cz 7 Instrumentalne metody analityczne Spektrometria masowa
Spektroskopia NMR
Kultura Masowa
SPEKTROSKOPIA ROTACYJNA
Spektrometria mas NMAZ
instr 2011 pdf, Roztw Spektrofoto
Masowa Islamizacja Europy oraz jej przygotowanie na destabilizacje Państwo Islamu w Europie
analityka podstawy spektroskopii 2012 2013
CHEMIA FIZYCZNA- spektrografia sc, Ochrona Środowiska pliki uczelniane, Chemia
spektro6, Technologia chemiczna pw, 2rok, spektra
Spektrometr-76, Studia, Fizyka, Sprawozdania, 76a
Analiza spektralna widm (2), Matematyka - Fizyka, Pracownia fizyczna, Analiza spektralna widm
SPEKTROFOTOMETRYCZNE OZNACZENIE ŻELAZA W POSTACI TIOCYJANIANU ŻELAZA, NAUKA, WIEDZA
Spektroskopia Jądrowego Rezonansu Magnetycznego
więcej podobnych podstron