
1
SPEKTROSKOPIA ROTACYJNA
2
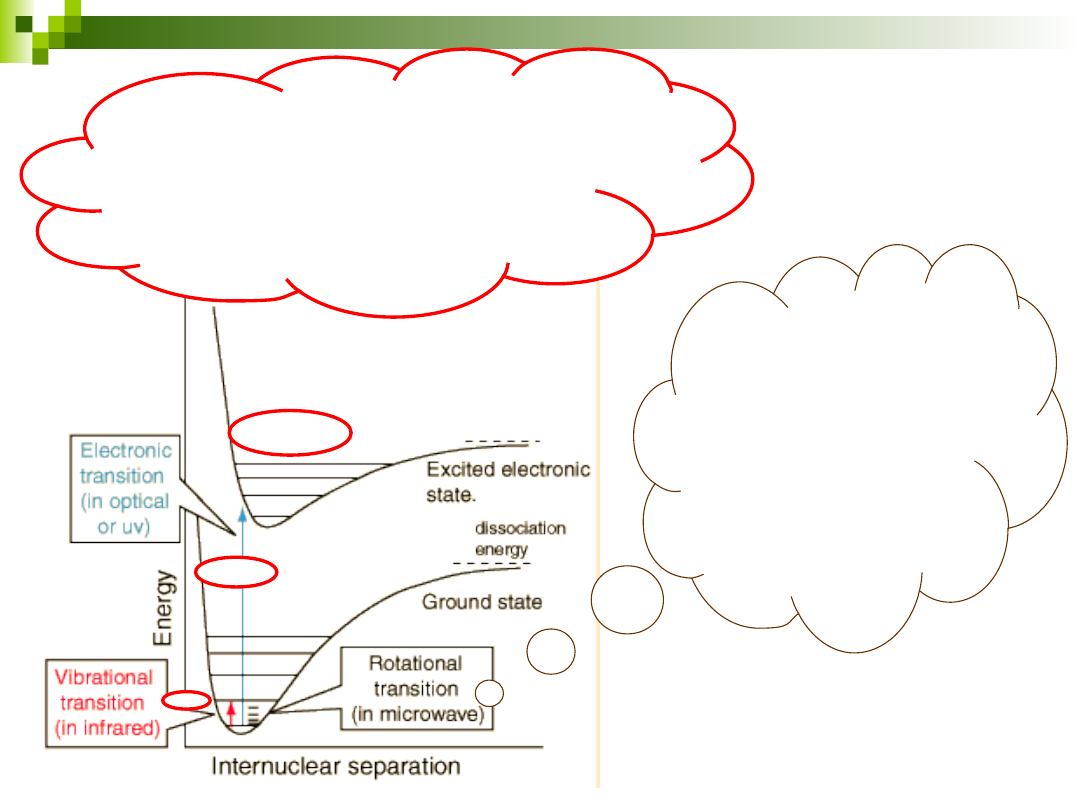
Promieniowanie
podczerwone
powoduje oscylację molekuł (ciepło)
Zdalne sterowanie sprzętu RTV,
sprzęt termowizyjny, meteorologiczne
obrazowanie satelitarne IR ,
efekt cieplarniany absorpcja IR
przez cząsteczki gazów w atmosferze
(H
2
O,
CH
4
,
N
x
O
y
,
chlorofluorowęglowodory
Mikrofale powodują
rotację molekuł (ciepła)
(temperatura jest miarą
ruchu
molekularnego!!)
Kuchenka mikrofalowa
rotacja H2O w wyniku
absorpcji mikrofal
Telefony komórkowe,
sieć bezprzewodowa
Wi-Fi (Wireless Fidelity)
emisja i odbiór
mikrofal

3
Pogoda nad Europą
(17/02/2004)
Huragan Andrew (16-
28/08/1992)
4
5
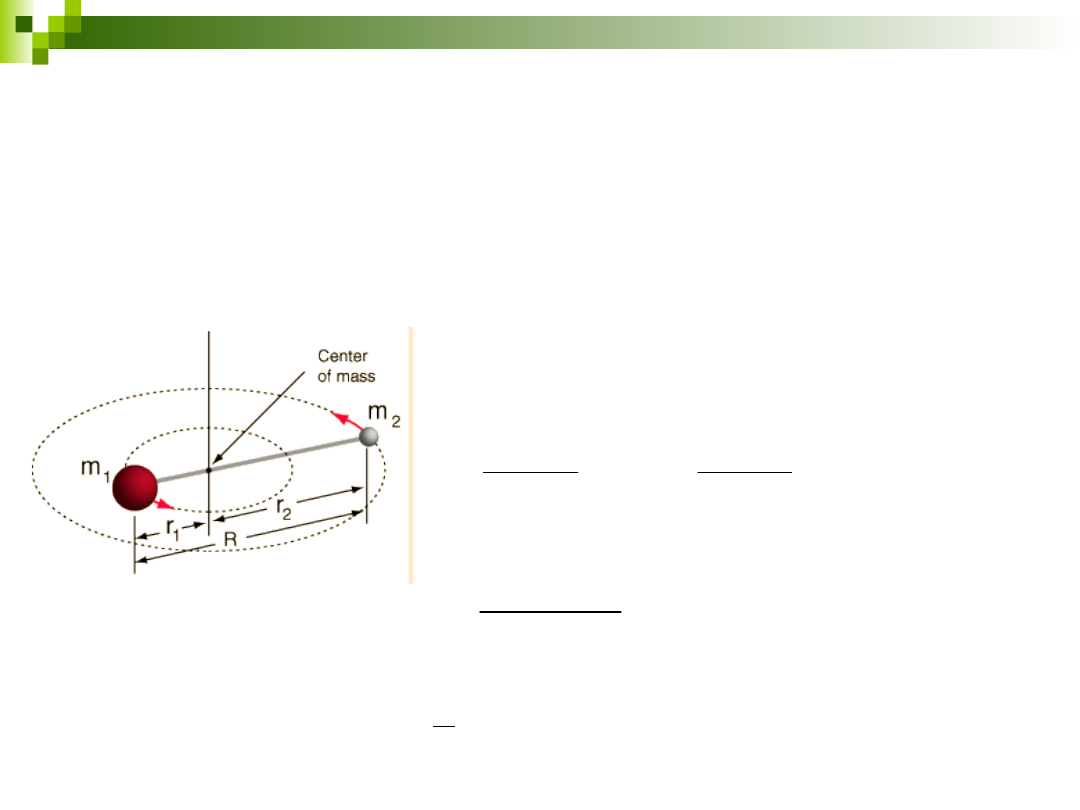
Rotator sztywny
Moment bezwładności dla 2 rotujących mas wokół ich środka ciężkości:
2
2
2
2
1
1
r
m
r
m
I
z zasady środka ciężkości:
2
2
1
1
r
m
r
m
R
r
r
2
1
R
m
m
m
r
2
1
2
1
R
m
m
m
r
2
1
1
2
2
2
2
1
2
1
R
R
m
m
m
m
I
red
red
- masa zredukowana
Jedynie energia kinetyczna - prędkość kątowa
2
2
1
I
E
k
E
k
dla rotatora makroskopowego zmienia się w sposób ciągły

6
Mechanika kwantowa przewiduje dla tego ruchu kwantowanie
Rozwiązanie równania Schrödingera rotator sztywny
E
h
red
2
2
2
)
1
(
2
2
J
J
I
E
J
rotacyjna liczba kwantowa J = 0,1,2,…
Stała rotacyjna
I
h
I
J
B
2
2
2
'
8
2
]
[
Ic
h
s
cm
c
s
J
h
J
B
cm
B
2
1
'
1
_
8
]
[
]
[
]
[
]
[
I
h
s
J
h
J
B
Hz
B
2
'
8
]
[
]
[
]
[
2
2
2
2
2
2
dz
d
dy
d
dx
d
operator energii kinetycznej

7
Różnica energii pomiędzy poziomami rotacyjnymi
)
1
(
'
J
J
B
E
J
J
-56 B’
7
-42 B’
6
-30 B’
5
-20 B’
4
-12 B’
3
-6 B’
2
-2 B’
1
-0
0
E
n
e
rg
ia
r
o
ta
c
y
jn
a
k
w
a
n
to
w
a
l
ic
zb
a
r
o
ta
c
y
jn
a
J
J = 0
J = 1
'
2
)
1
1
(
1
'
1
B
B
E
J
0
)
1
0
(
0
'
0
B
E
J
J = 2
'
6
)
1
2
(
2
'
2
B
B
E
J
)
1
(
'
2
)
1
(
'
)
1
1
)(
1
(
'
1
J
B
J
J
B
J
J
B
E
E
E
J
J
spektroskopia mikrofal (zakres GHz)
J = 0 J = 1 E = 2B’
J = 1 J = 2 E = 4B’
J = 2 J = 3 E = 6B’
ale mierzymy różnice pomiędzy poziomami, stąd

8
Problem 1
Znaleźć wartość energii rotacyjnej dla liczby kwantowej J = 0,1,2 dla
12
C
16
O,
przyjmując
R
CO
= 1,1283 Å. Wartość podać w joulach i cm
-1
.
kg
mol
mol
kg
mol
kg
mol
g
mol
g
m
m
m
m
O
C
O
C
red
26
1
23
1
3
1
3
1
1
10
1385
,
1
10
023
,
6
10
8562
,
6
10
8562
,
6
8562
,
6
995
,
15
0
,
12
995
,
15
0
,
12
2
46
2
2
10
26
10
4494
,
1
)
10
1283
,
1
(
10
1385
,
1
m
kg
m
kg
I
3. Obliczamy wartość stałej rotacyjnej
]
[
10
8365
,
3
10
4494
,
1
8
)
10
626
,
6
(
8
23
2
46
2
2
2
2
34
2
2
J
m
kg
s
J
I
h
0
0
J
E
4. Obliczamy wartość energii
]
[
10
673
,
7
23
1
J
E
J
]
[
10
301
,
2
22
2
J
E
J
5. Zmieniamy energię wyrażoną w [J] na [cm
-1
] dzieląc przez h·c
0
0
J
E
]
[
863
,
3
1
1
cm
E
J
]
[
590
,
11
1
2
cm
E
J
2
R
I
red
2. Obliczamy moment bezwładności
)
1
(
2
2
J
J
I
E
J
Rozwiązanie:
1. Korzystamy z
wzoru

9
Problem 2
Widmo mikrofalowe rodnika CN wykazuje serię linii oddalonych od
siebie o 3,797 cm
-1
. Znaleźć długość wiązania R
CN
.
1. Z warunków zadania:
1
1
_
898
,
1
797
,
3
2
cm
B
cm
B
E
2
46
1
8
1
2
34
_
2
10
474
,
1
10
3
8
,
189
8
10
626
,
6
8
m
kg
s
m
m
s
J
Bc
h
I
2. Obliczamy moment bezwładności
kg
mol
mol
g
m
m
m
m
N
C
N
C
red
26
1
23
1
10
074
,
1
10
023
,
6
1
0
,
14
0
,
12
0
,
14
0
,
12
3. Obliczamy długość wiązania
nm
m
kg
m
kg
I
R
red
117
,
0
10
17
,
1
10
074
,
1
10
474
,
1
10
26
2
46
10
E
n
e
rg
ia
J
/c
z
ą
s
te
c
z
k
a
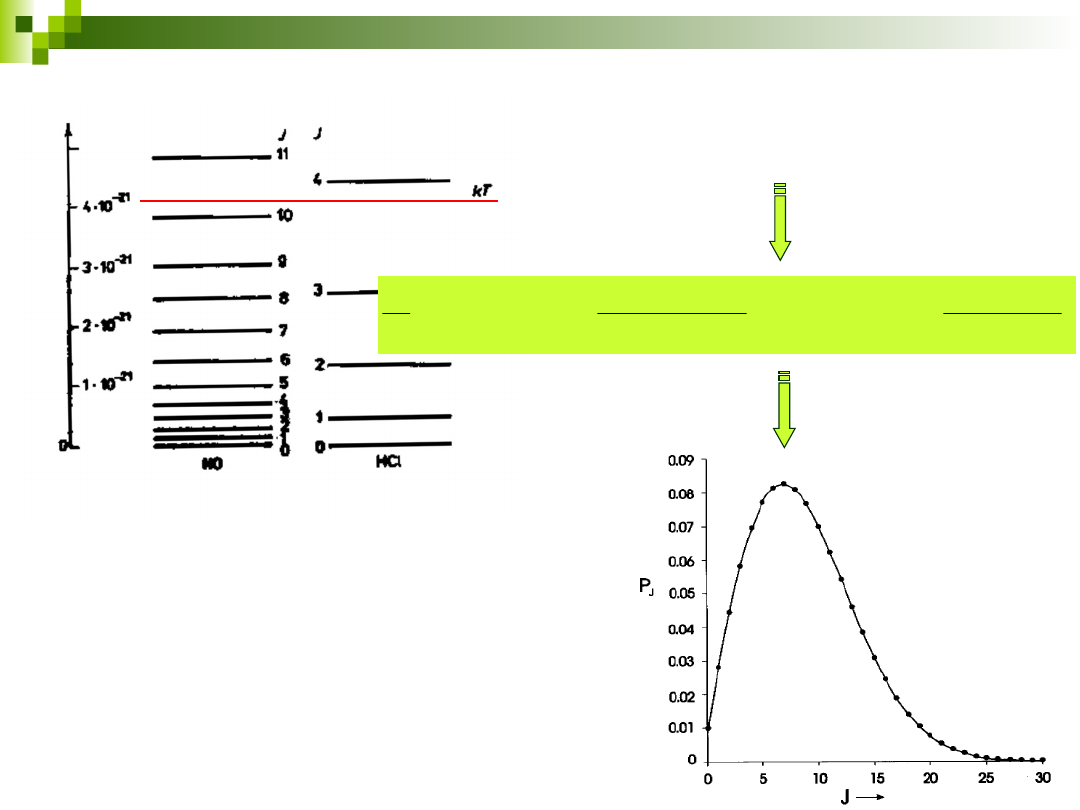
Obsadzenie poziomów
rotacyjnych
Degeneracja każdego poziomu 2J+1
wiele poziomów leży poniżej kT
wzrost J, wzrost czynnika
(2J+1)
dalszy wzrost J, dominacja
czynnika wykładniczego
I
HCl
I
NO
B
HCl
B
NO
]
)
1
(
'
exp[
)
1
2
(
)
exp(
)
1
2
(
0
0
kT
J
J
B
J
kT
E
E
E
J
n
n
J
J
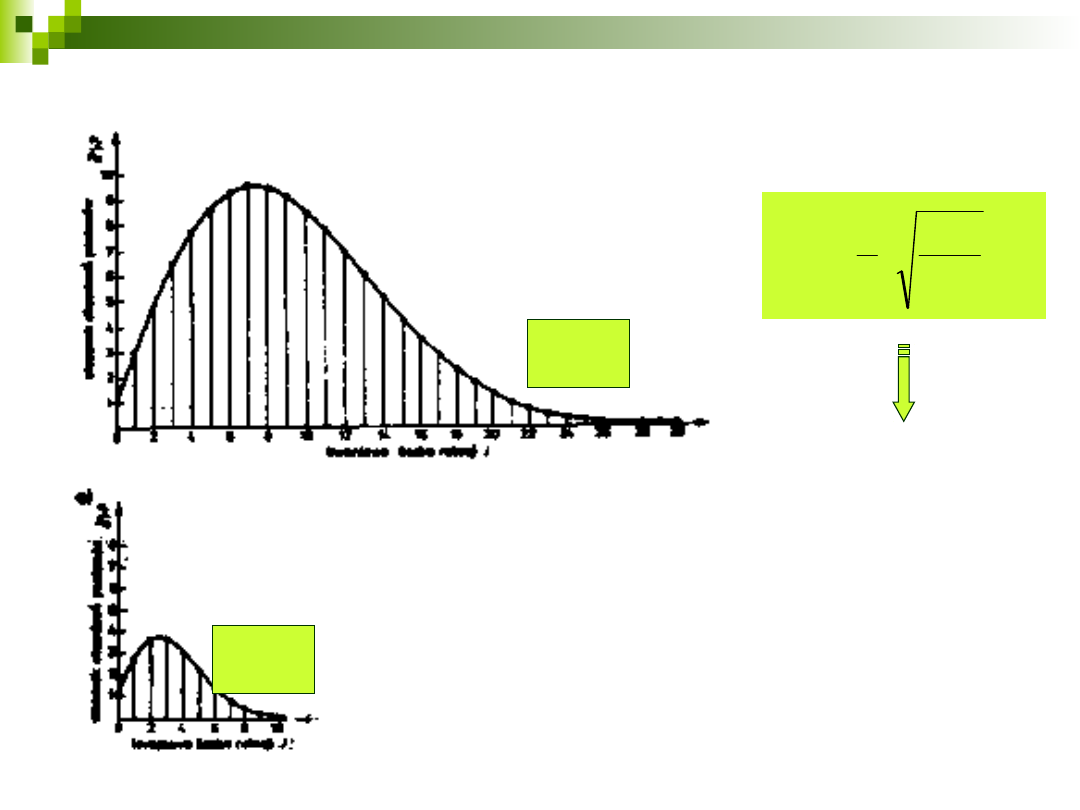
11
NO
T=25
o
C
HCl
T=25
o
C
HCl
T=1000
o
C
J
max
=7
J
max
=3
J
max
=6
1
2
2
1
_
max
B
hc
kT
J
termometr
(wnętrze pieca hutniczego,
ciała niebieskie,
zorza polarna)
I
HCl
I
NO
B
HCl
B
NO
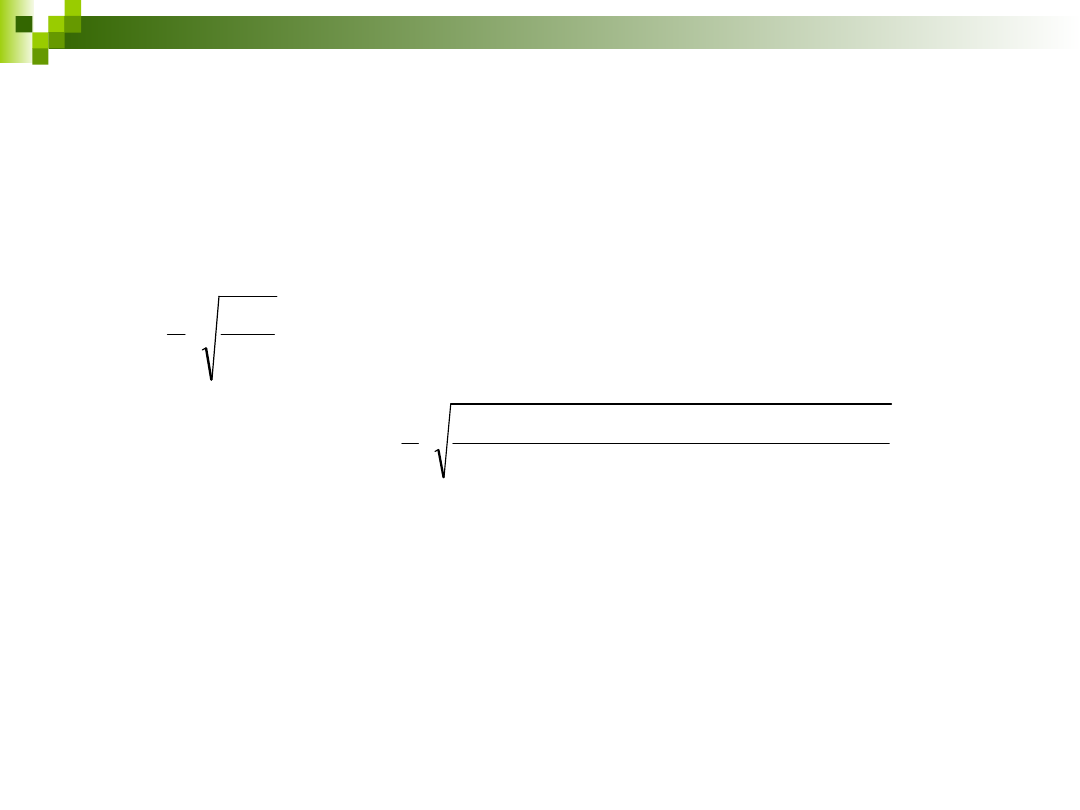
12
Problem 3
Jaka jest wartość liczby kwantowej J, dla której poziom rotacyjny jest
maksymalnie obsadzony dla cząsteczki CN w temperaturze
pokojowej i 1000 K? Przyjąć stałą rotacyjną równą 1,57 cm
-1
.
1
2
2
1
_
max
B
hc
kT
J
8
62
.
7
1
0
,
3
10
626
,
6
10
57
,
1
298
10
380
,
1
2
2
1
1
34
1
2
1
23
max
s
m
s
J
m
K
K
J
J
dla temperatury pokojowej:
dla temperatury 1000 K:
J
max
14

13
Efekt izotopowy w widmach rotacyjnych
red
red
red
red
R
c
h
R
c
h
B
B
*
2
*
2
2
2
_
*
_
8
8
Dla J = 0 1
E = 2B
1
_
8423
,
3
cm
B
1
_
*
6735
,
3
cm
B
9949
,
15
0
,
12
9949
,
15
0
,
12
9949
,
15
9949
,
15
10
6735
,
3
10
8423
,
3
13
13
2
2
C
C
A
A
Problem 4
Linia J = 0 1 w widmie mikrofalowym
12
C
16
O ma wartość 3,8423 cm
-1
,
natomiast dla
13
C
16
O liczba falowa wynosi 3,6734 cm
-1
. Wiedząc, że względne
masy atomowe wynoszą 12,000 i 15,9949 dla
12
C i
16
O – obliczyć względną
masę atomową
13
C.
0007
,
13
13
C
A
14
Problem 5
Obliczyć długość wiązania CO znając z absorpcyjnego
widma rotacyjnego położenia pasm: 3.84, 7.68 i 11.51 cm
-1
.
przejście J = 0 J = 1
= 3.84 cm
-
1
B = 1.92 cm
-
1
B =
h
8
2
cI
I =
h
8
2
cB
I = = 1.45·10
-46
(kg·m
2
)
6.62 ·10
-34
(kg·m
2
·s
-1
)
8
2
·
3·10
10
(m·s
-1
)
·1.92 (cm
-1
)
I = m
red
R
2
m
red
= = = 1.14·10
-26
kg
m
C
m
O
(0.012 · 0.016)/N
A
2
m
C
+ m
O
(0.012 + 0.016)/N
A
R
CO
=
= 0.113 nm
I
m
red

15
Rotator niesztywny (zmiana odległości między
jądrami)
działanie siły odśrodkowej na poziomach rotacyjnych J 0
E = 2B (J+1)
rotator sztywny
= 2B (J+1) – 4D (J+1)
3
D – stała odkształcenia odśrodkowego
(~1MHz dla 2-atomowych cząsteczek
o lekkich atomach; 10
-3
MHz dla wieloatomowych; znaczna dla dużych J)
sprzężenie oscylacyjno-rotacyjne
B
e
– stała rotacji odpowiadająca punktowi równowagi oscylacji
i
– stała sprzężenia oscylacyjno-rotacyjnego (rzędu 10 MHz, czyli 0,1 %wartości
B
e
, czyli ~0,002 Å w długości wiązania)
)
2
1
(
1
e
B
B

16
Oddziaływanie promieniowania z rotującymi 2-
atomowymi molekułami
absorpcja
dopasowanie energetyczne E =
h
trwały moment dipolowy (H
2
, N
2
, O
2
, CO
2
, CCl
4
, CH
4
nie dają absorpcyjnego widma rotacyjnego)
J = +1 oraz + - lub - + (symetria stanów
rotacyjnych)
rozpraszanie
anizotropia polaryzowalności
J = 0, +2 oraz + + lub - -

17
Dla podania pełnej charakterystyki
poziomów energii rotacji molekuły
konieczna jest znajomość
jej podstawowego stanu
elektronowego
własności symetrii poziomów
rotacyjnych

18
Symetria stanów
rotacyjnych
całkowita funkcja falowa po inwersji jąder i elektronów
x
1
, y
1
, z
1
-x
1
, -y
1
, -z
1
nie zmienia znaku,
stany rotacyjne dodatnie (+)
zmienia znak,
stany rotacyjne ujemne (-)
całkowita funkcja falowa po zamianie miejscami
identycznych jąder
x
1
, y
1
, z
1
x
2
, y
2
, z
2
nie zmieniona,
symetryczne stany rotacyjne (s)
zmieniona,
antysymetryczne stany rotacyjne (a)
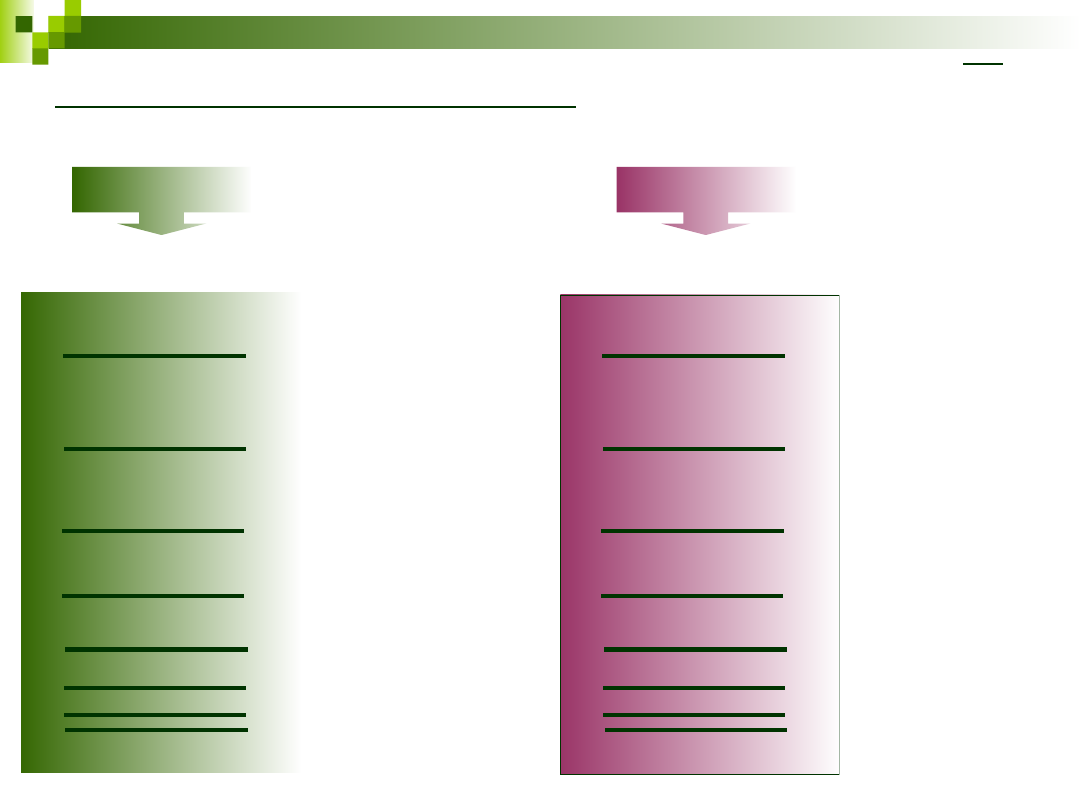
19
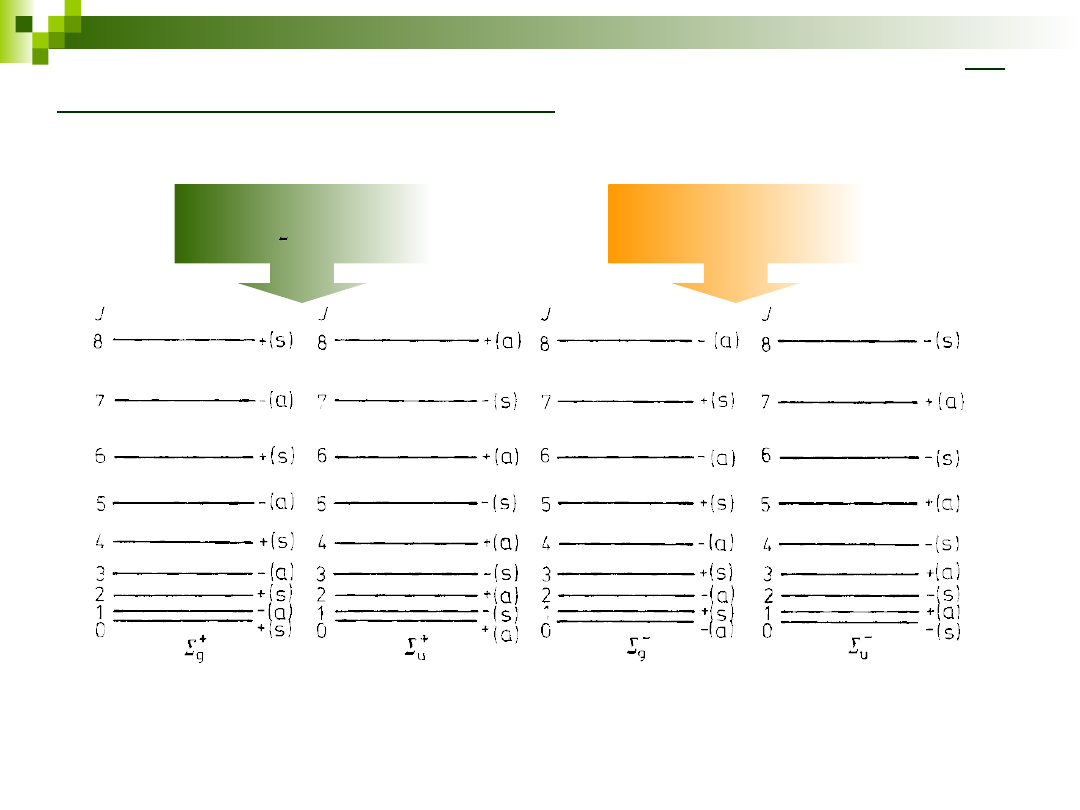
Symetria poziomów energii rotacji molekuły 2-
atomowej heterojądrowej w stanach
elektronowych
dla
+
dla
-
J
-
7
+
6
-
5
+
4
-
3
+
2
-
1
+
0
J
+
7
-
6
+
5
-
4
+
3
-
2
+
1
-
0
■
poziomy o
parzystej J
są
dodatnie
■
poziomy o
nieparzystej J
są
ujemne
■
poziomy o
parzystej J
są
ujemne
■
poziomy o
nieparzystej J
są
dodatnie
20
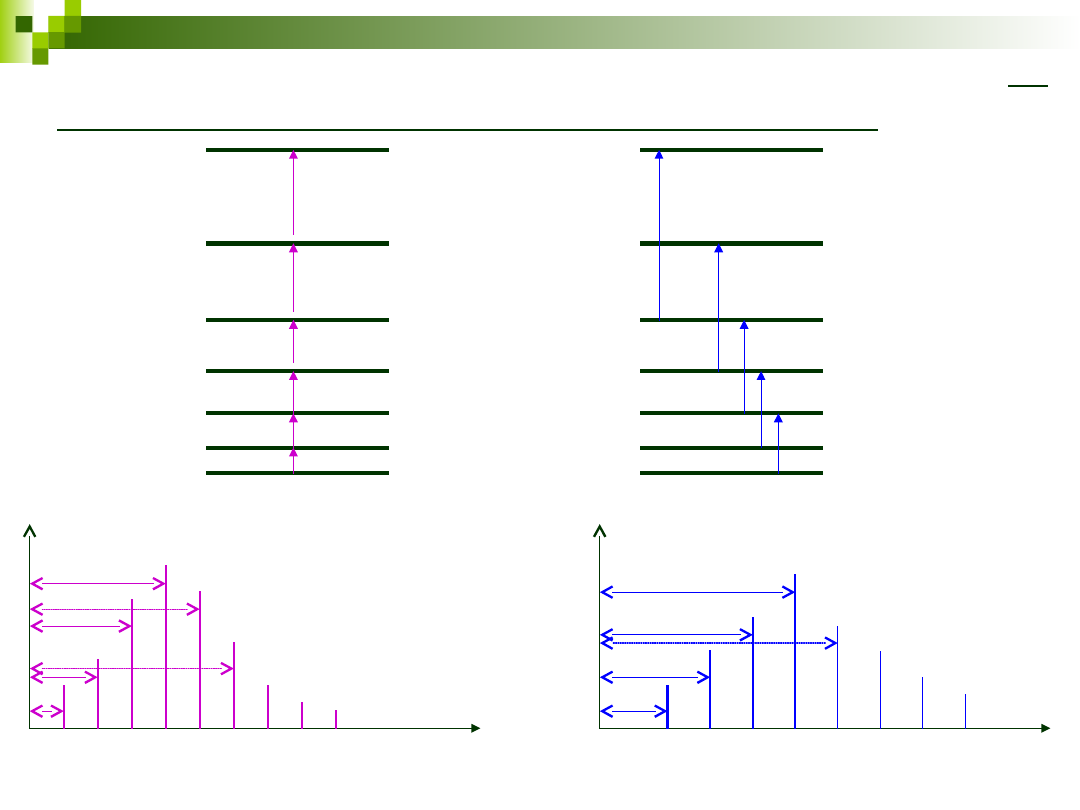
Dozwolone przejścia i widmo rotacyjne 2-
atomowych cząsteczek heterojądrowych
J=6
J=5
J=4
J=3
J=2
J=1
J=0
J=+1
E=2B(J+1)
J=+2
dla części stokesowskiej
E=2B(2J+3)
absorpcyjne
ramanowskie
A
_
I
RS
_
2B
2B
6B
6B
4B
6B
8B
10B
12B
4B
6B
8B
10B
12B
10B
14B
18B
22B
22B
10B
14B
18B

21
Widmo rotacyjne 2-atomowych cząsteczek
homojądrowych
brak absorpcyjnego widma rotacyjnego, tylko
widma ramanowskie
struktura widma rotacyjnego zależy od spinu
jądrowego: I = 0 lub I ≠ 0
22
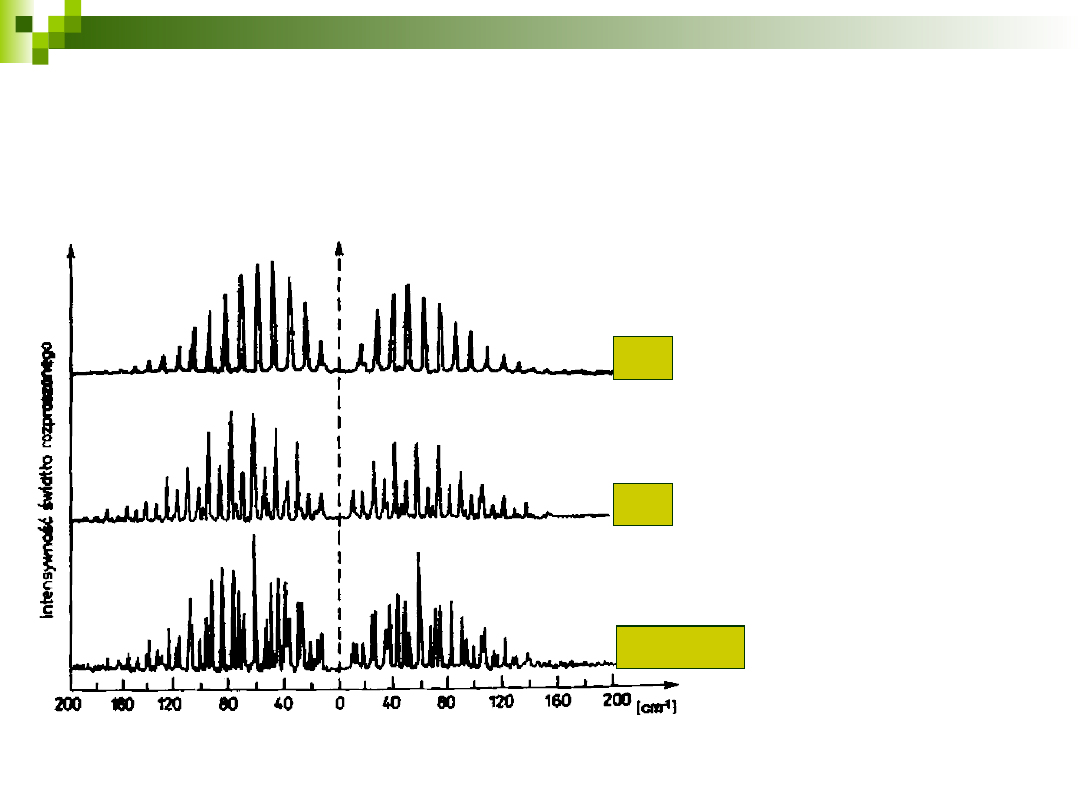
Rotacyjne widmo
ramanowskie
identyfikacja
wyznaczanie
parametrów
struktury (B, I, r)
analiza ilościowa
pomiar T
tlen
azot
powietrze
23
Symetria poziomów energii rotacji molekuły 2-
atomowej homojądrowej w stanach
elektronowych
■
dodatnie poziomy są symetryczne
■
ujemne poziomy są antysymetryczne
■
dodatnie poziomy są antysymetryczne
■
ujemne poziomy są symetryczne
dla parzystego
g
+
lub
g
-
dla nieparzystego
u
+
lub
u
-
24
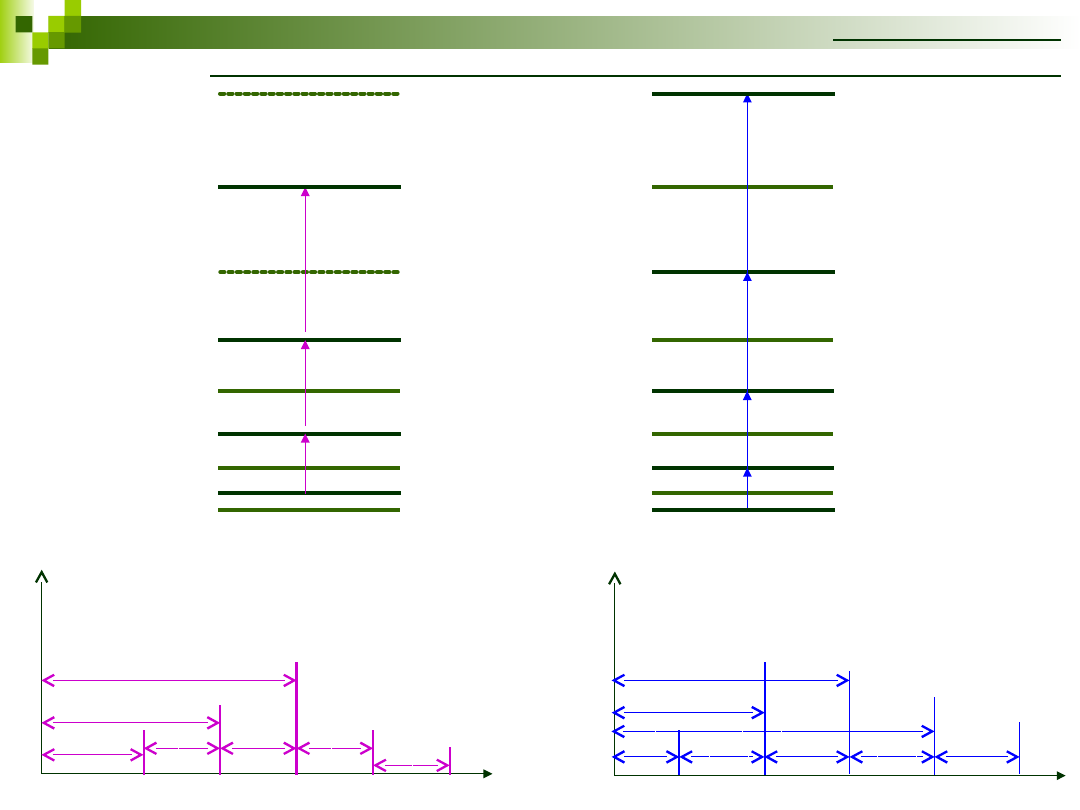
Dozwolone przejścia i widmo rotacyjne 2-atomowych
cząsteczek homojądrowych o spinie jądrowym I=0
dozwolone
są tylko
symetryczne
względem
wymiany
jąder
poziomy
rotacyjne
J=6
J=5
J=4
J=3
J=2
J=1
J=0
u
+
i
g
-
brak J parzystych
16
O
2
,
3
g
-
u
-
i
g
+
brak J nieparzystych
I
RS
_
I
RS
_
6B
6B
10B
18B
26B
10B
8B
14B
30B
14B
22B
J=7
J=8
18B
26B
8B
8B
8B
22B
8B
8B
8B
8B
30B

25
Dozwolone przejścia i widmo rotacyjne 2-
atomowych cząsteczek homojądrowych o
spinie jądrowym I0
Dla cząsteczek ze spinem połówkowym (statystyka Fermiego-
Diraca, n.p.:
1
H
2
)
– cząsteczki orto nieparzyste stany
rotacyjne (J=1,3,5,..)
– cząsteczki para parzyste stany
rotacyjne (J=0,2,4,..)
Dla cząsteczek ze spinem całkowitym (statystyka Bosego-
Einsteina, n.p.:
14
N
2
)
– cząsteczki orto parzyste stany
rotacyjne (J=0,2,4,..)
– cząsteczki para nieparzyste stany
rotacyjne (J=1,3,5,..)
I
I
I
I
I
I
N
N
para
orto
1
)
1
2
(
)
1
)(
1
2
(
1
H
2
, I=1/2, N
orto
/N
para
= 3
maksima przejść dla J nieparzystych mają
3-krotnie większą intensywność niż
przejścia dla J parzystych
2
H
2
,
14
N
2
, I=1, N
orto
/N
para
= 2
maksima przejść dla J parzystych mają 2-krotnie
większą intensywność niż przejścia dla J
nieparzystych
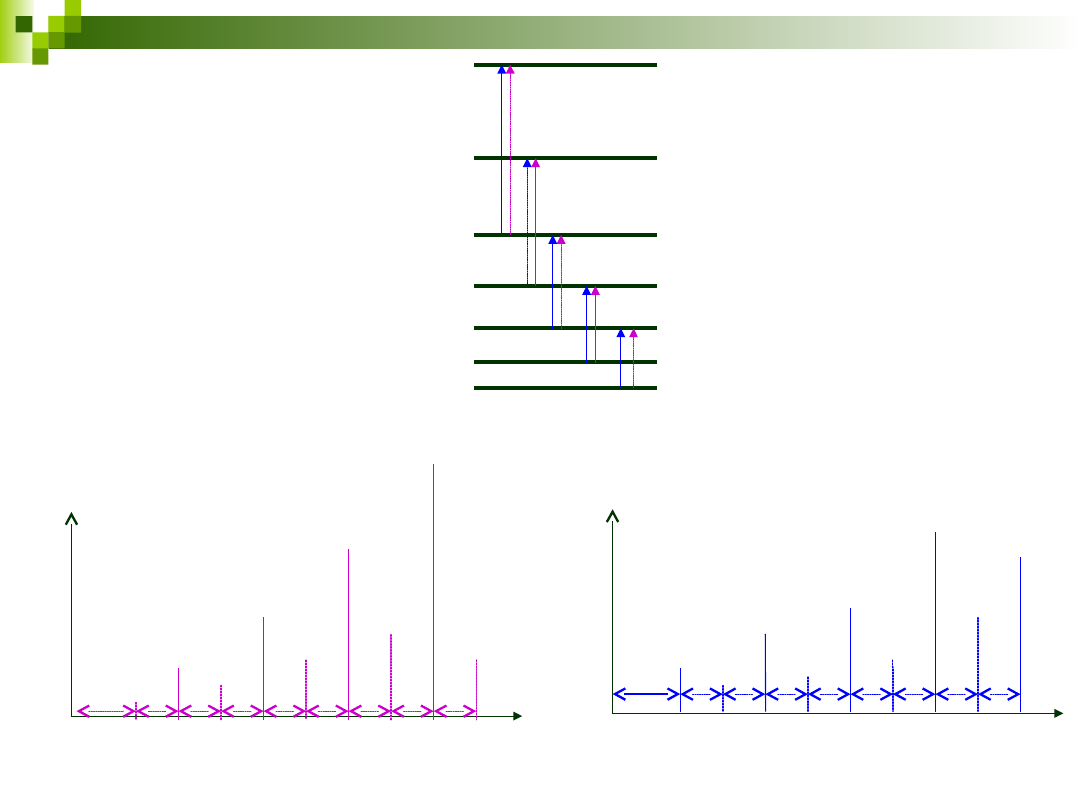
26
J=6
J=5
J=4
J=3
J=2
J=1
J=0
J=+2
dla części stokesowskiej
E=2B(2J+3)
I = 1/2
I = 1
I
RS
_
6B
6B
10B
14B
18B
I
RS
_
6B 4B 4B
4B
22B
4B
maksima przejść dla J
nieparzystych mają 3-
krotnie większą
intensywność niż
przejścia dla J
parzystych
maksima przejść dla J
parzystych mają 2-
krotnie większą
intensywność niż
przejścia dla J
nieparzystych
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
Wyszukiwarka
Podobne podstrony:
Spektroskopia NMR
Silnik rotacyjny, a silnik tłokowy
Spektrometria mas NMAZ
instr 2011 pdf, Roztw Spektrofoto
analityka podstawy spektroskopii 2012 2013
56 terapia rotacyzmu nie musi b Nieznany (2)
CHEMIA FIZYCZNA- spektrografia sc, Ochrona Środowiska pliki uczelniane, Chemia
spektro6, Technologia chemiczna pw, 2rok, spektra
Spektrometr-76, Studia, Fizyka, Sprawozdania, 76a
Analiza spektralna widm (2), Matematyka - Fizyka, Pracownia fizyczna, Analiza spektralna widm
SPEKTROFOTOMETRYCZNE OZNACZENIE ŻELAZA W POSTACI TIOCYJANIANU ŻELAZA, NAUKA, WIEDZA
Spektroskopia Jądrowego Rezonansu Magnetycznego
pwsz ioś kalisz Ćw 4 Spektrofotometria, inżynieria ochrony środowiska kalisz, a pwsz kalisz ioś, ana
Analiza Instrumentalna Miareczkowanie spektrofotometryczne Sprawozdanie 3 x
Spektro 4
73 Nw 05 Wiatrowe silniki rotacyjne
Badanie aktywności dehydrogenaz mikroorganizmów osadu czynnego metodą spektrofotometryczną z TTC
więcej podobnych podstron