
Wprowadzanie grup
funkcyjnych do białek
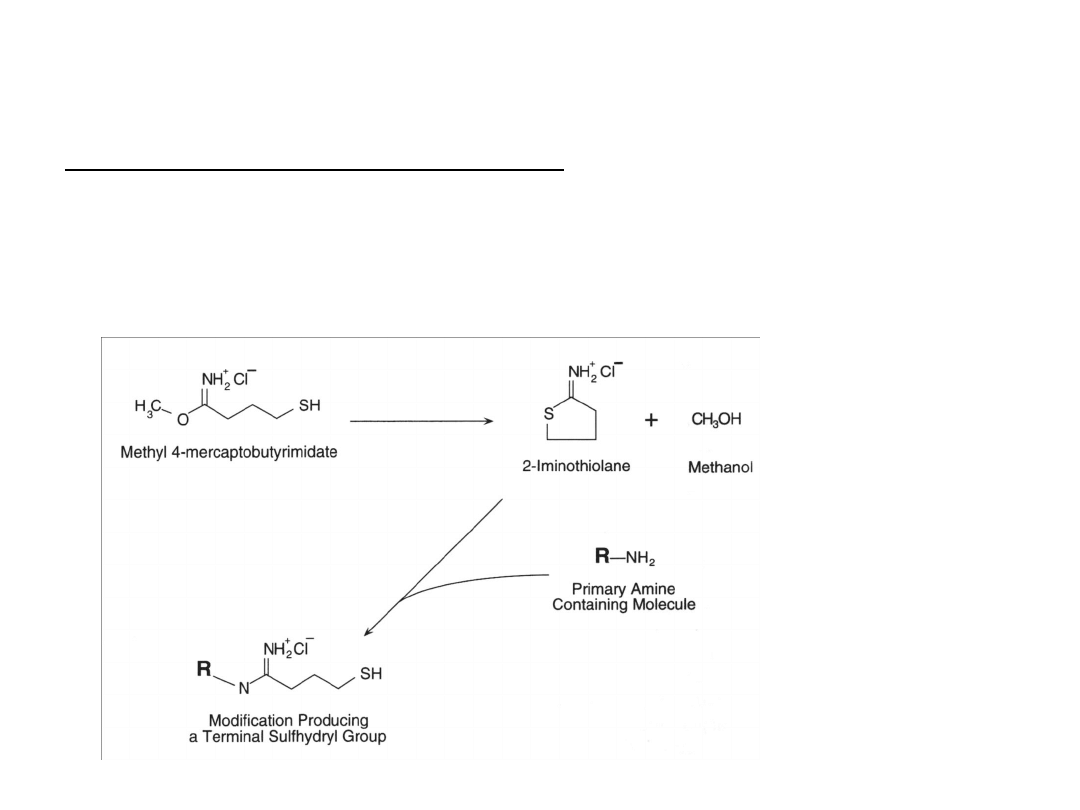
Wprowadzanie grupy
sulfhydrylowej
Odczynnik Trauta (2-imidotiolan)
Rozpuszczalny w wodzie.
Reaguje z pierwszorzędowymi aminami w zakresie pH 7 -10.
Przebieg reakcji można śledzić spektrofotometrycznie. 2-
imidotiolan absorbuje światło λ
max
= 248 nm. W wyniku
reakcji dochodzi do spadku intensywności sygnału.

Odczynnik Trauta jest często wykorzystywany do otrzymywania
immunotoksyn.
Białka modyfikowane odczynnikiem Trauta są bardzo podatne na
utlenianie i mogą tworzyć disiarczki.
Dodanie EDTA do stężenia 0.1 M znacznie obniża utlenianie zależne od
metali.
Jest grupa związków modyfikujących, które wprowadzają tzw.
„chronione” grupy sulfhydrylowe. Zmodyfikowane białko może być
dzięki temu przechowywane przez dłuższy czas.
Aktywacja grupy
sulhydrylowej zachodzi bez udziału związków redukujących
, co
pozwala na zachowanie nienaruszonych natywnych disiarczków w
białku. Jest to istotne zwłaszcza gdy disiarczki są niezbędne do
zachowania aktywności białka (np. niektóre białkowe toksyny).
SATA (N-bursztynoimidylo S-acetylotiootan)
SATA jest często używane do konstrukcji koniugatów przeciwciało-enzym.
Większość przeciwciał poliklonalnych może być modyfikowane SATA
(nawet 6 cząsteczek SATA/cząsteczkę przeciwciała) bez widocznego
spadku powinowactwa do antygenu. Niektóre przeciwciała
monoklonalne mogą być wrażliwe na modyfikację SATA.
Często wykorzystuje się SATA do koniugacji z awidyną lub streptawidyną.
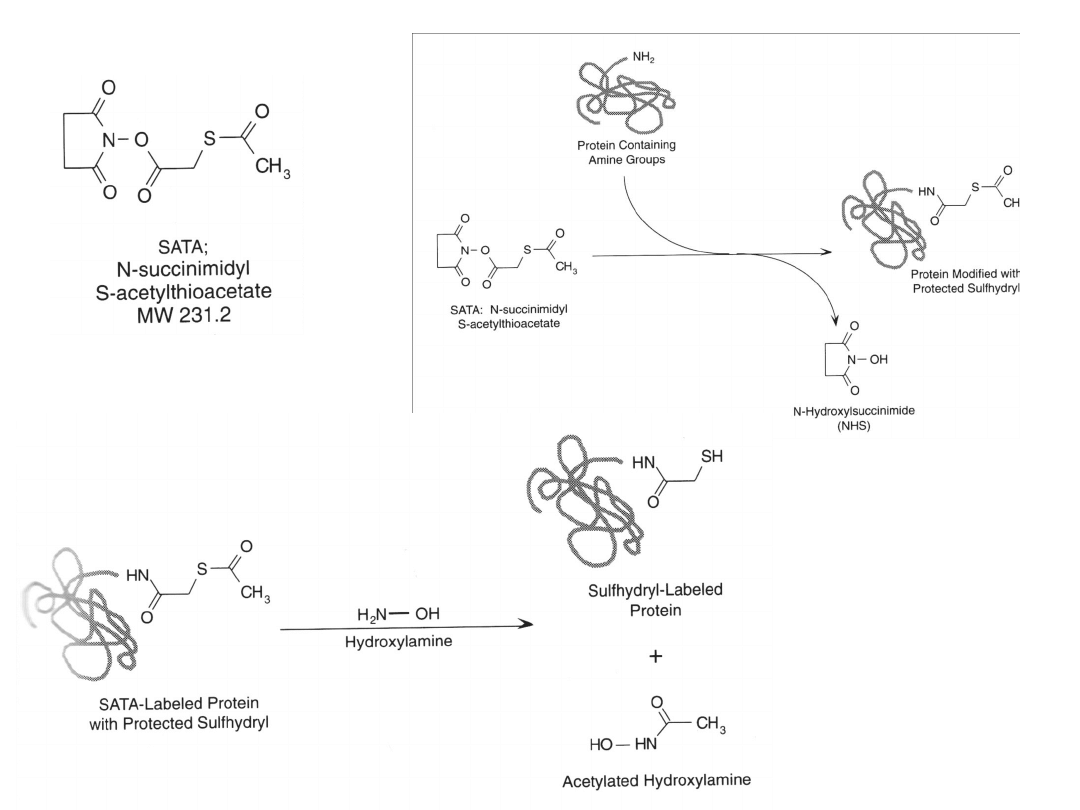
Aktywacja grup sulfhydrylowych zachodzi
w obecności nadmiaru hydroksyloaminy
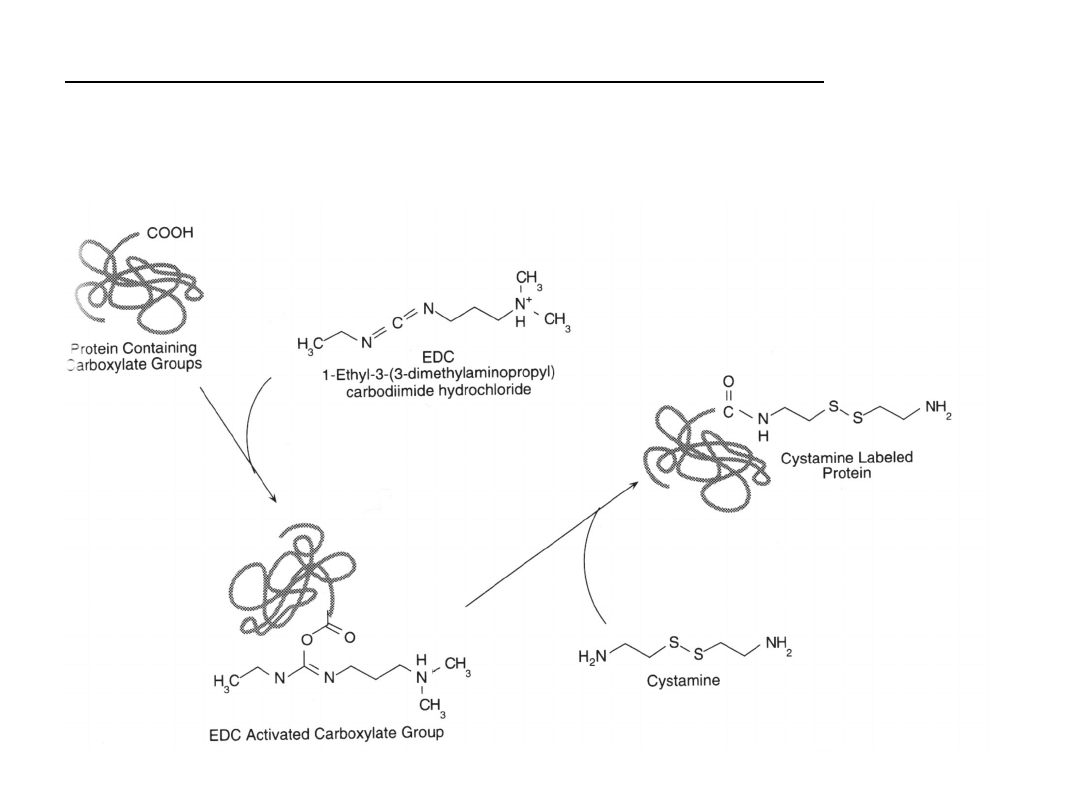
Modyfikacja grup karboksylowych cystaminą
Cystamina jest mała cząsteczką zawierającą disiarczek,
zakończoną pierwszorzędowymi aminami.
Karbodiimid najpierw aktywuje
grupę karboksylową
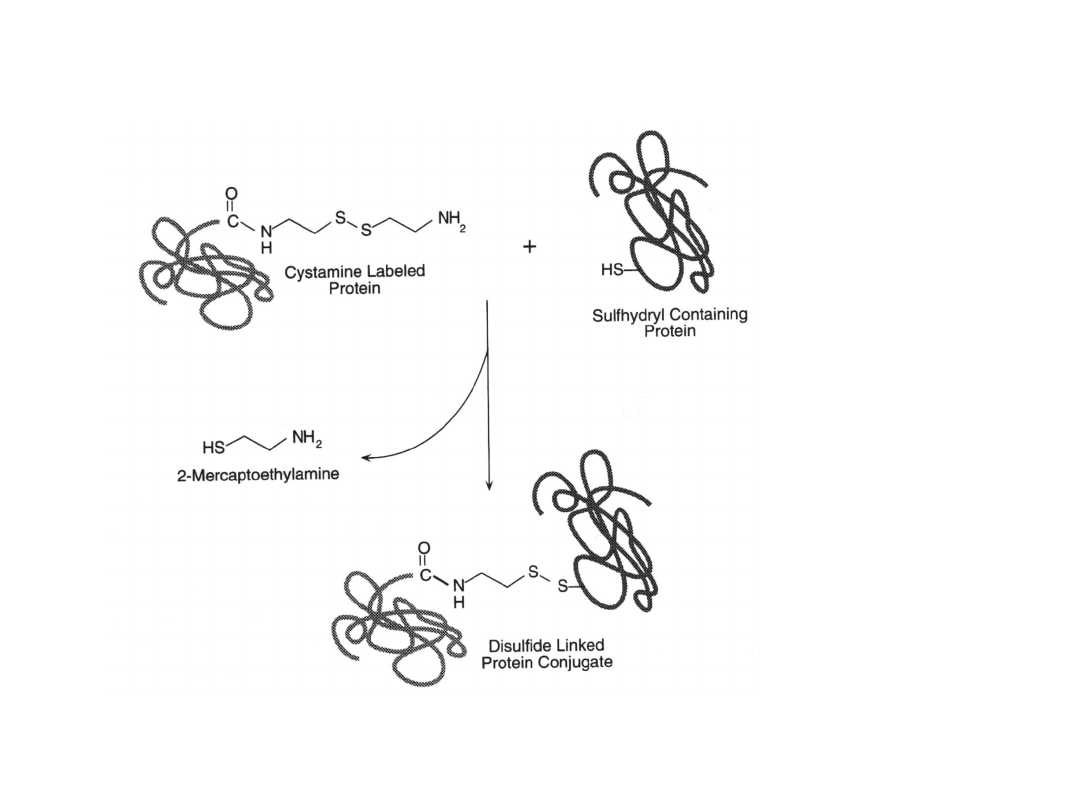
Białko wyznakowane cystaminą można połączyć z innym białkiem zawierającym grupę
sulfhydrylową w reakcji wymiany disiarczku.
Cystamina może być także wykorzystana do połączenia 2 cząsteczek za pomocą swoich
końcowych reszt aminowych. Środkowy disiarczek jest zachowany – można rozdzielić
cząsteczki związkiem redukującym.

Wprowadzanie grup
karboksylowych
Wiele grup funkcyjnych, np. grupy aminowe, sulfhydrylowe, reszty
histydyny i metioniny, może ulec modyfikacji z wytworzeniem
grupy karboksylowej.
Wprowadzenie grupy karboksylowej zmienia ładunek netto
białka : zmiana pI; często wiąże się to nawet z utratą
aktywności białka.
Bezwodniki kwasów organicznych
Reagują z pierwszorzędowymi aminami, a także z grupami OH
seryny i tyrozyny, grupami SH i pierścieniem imidazolowym
reszt His.
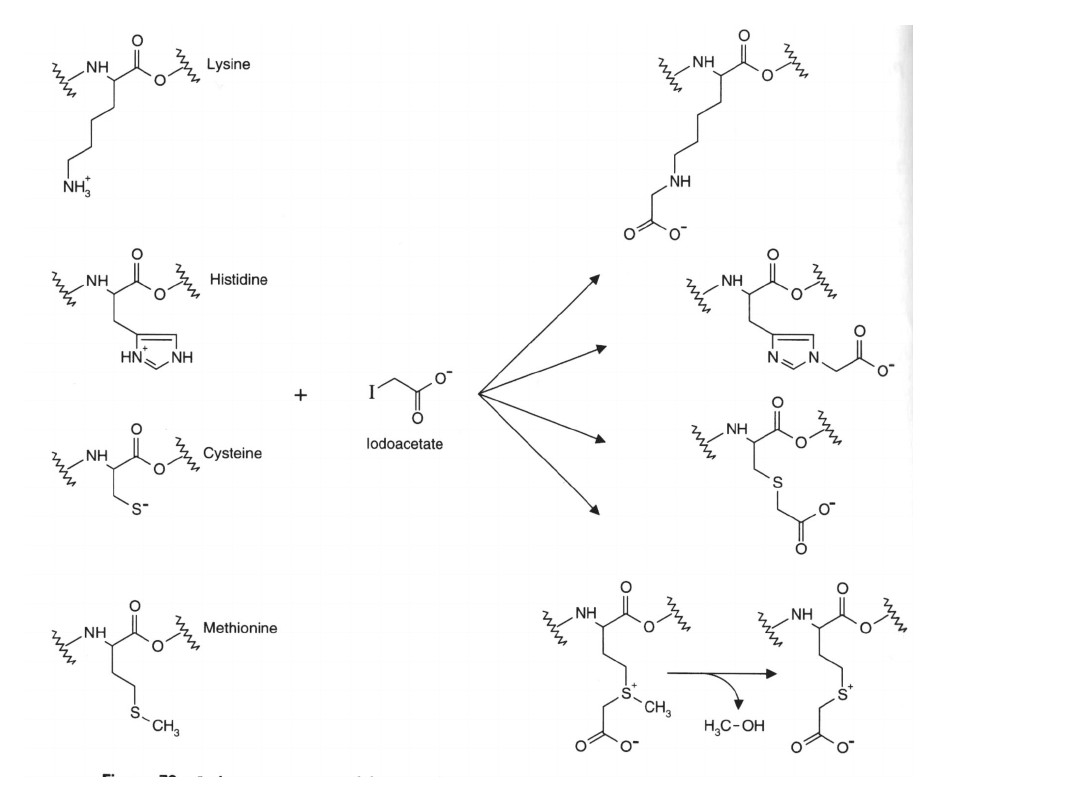
Jodooctan
Może reagować z wieloma grupami funkcyjnymi w białku: grupami
SH reszt Cys, azotem pierścienia imidazolowego reszt His,
grupą tioeterową Met i pierwszorzędowymi aminami.
Jodooctan z reguły jest używany do blokowania grup reaktywnych.

Wprowadzanie pierwszorzędowych
grup aminowych
W większości przypadków białka zawierają wystarczającą ilość
grup aminowych odpowiednich do reakcji modyfikacji lub
sprzęgania. Zdarza się jednak, że pewne peptydy oraz białka
mają zbyt mało wolnych grup aminowych.
Takim przykładem jest peroksydaza chrzanowa (HRP) – tylko 2
wolne grupy aminowe.
Wprowadzenie dodatkowych grup aminowych zwiększa
efektywność sprzęgania.
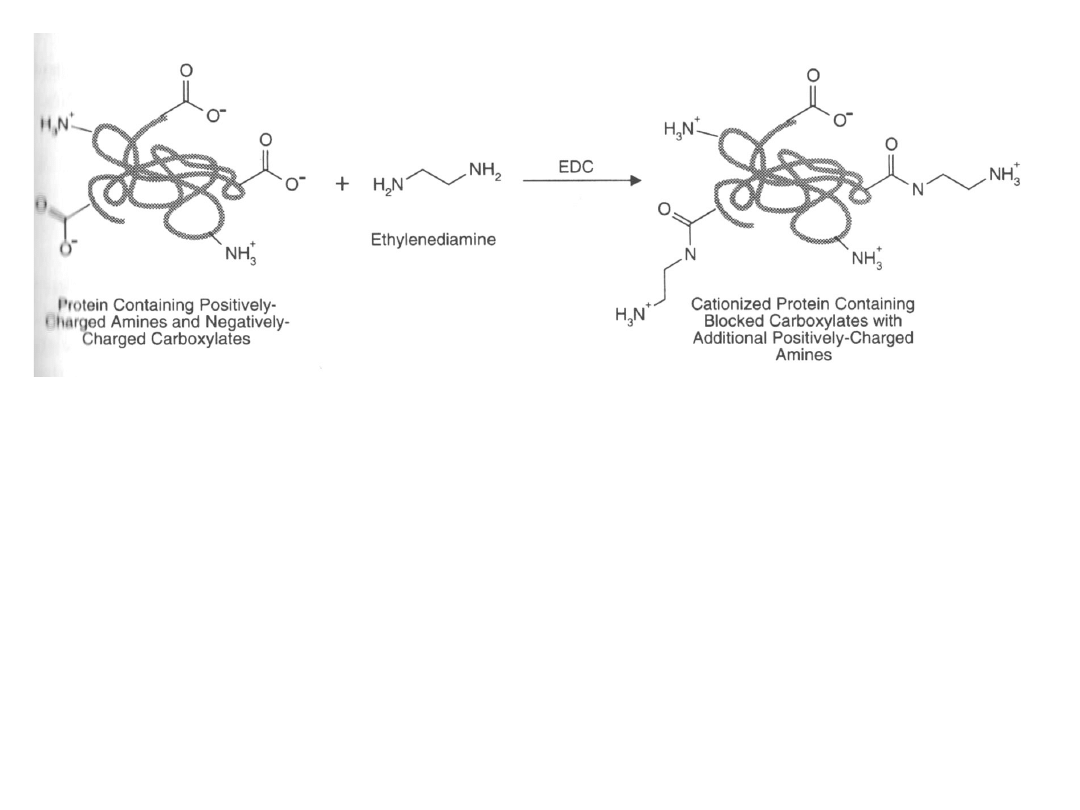
Modyfikacje grup karboksylowych diaminami
Diaminy – związki zawierające pierwszorzędowe grupy aminowe
na obu końcach cząsteczki. W reakcji z grupą karboksylową
powstaje wiązanie amidowe, na końcu – wolna grupa aminowa.
Uwaga! Modyfikacja diaminami maże mieć ogromny wpływ na
całkowity ładunek białka i zmienia pI białka. Może mieć to
istotny wpływ na aktywność białka.
Blokowanie grup funkcyjnych
Cele:
1.
Ukierunkowanie reakcji koniugacji względem konkretnej
grupy funkcyjnej
2.
Zapobieganie niekontrolowanej polimeryzacji cząsteczek
3.
Zapobieganie utlenienia grup SH
4.
Zabezpieczanie grup funkcyjnych podczas reakcji sprzęgania
bifunkcjonalnymi związkami sieciującymi
5.
Zakańczanie reakcji sprzęgania lub modyfikacji.
Blokowanie grup aminowych
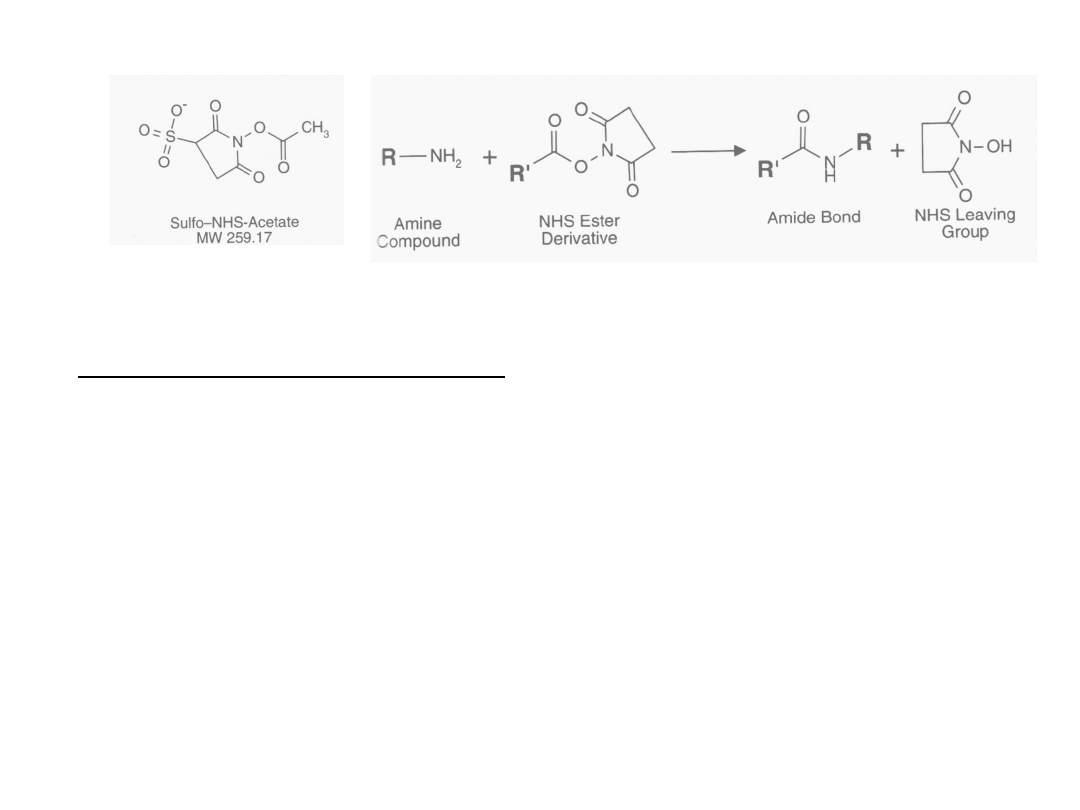
Octan sulfo-NHS
Wysoka reaktywność względem grup aminowych w pH 7-9.
prowadzi do acylacji amin; reakcja nieodwracalna.
Nie używać w buforach zawierających Tris, glicynę lub imidazol.
Zalecane bufory fosforanowe, boranowe, węglanowe.
Bezwodnik kwasu octowego
Acetylacja grupy aminowej w białku jest relatywnie
specyficzna jeżeli jest prowadzona w nasyconym roztworze
octanu sodu. W nadmiarze jonów octanowych pochodne O-
acetylotyrozyny są niestabilne. Pochodne tyrozyny
gwałtownie hydrolizują w zasadowym pH, nawet przy
braku jonów octanowych.
Dodanie hydroksyloaminy także powoduje rozpad
pochodnych O-acetylotyrozyny.
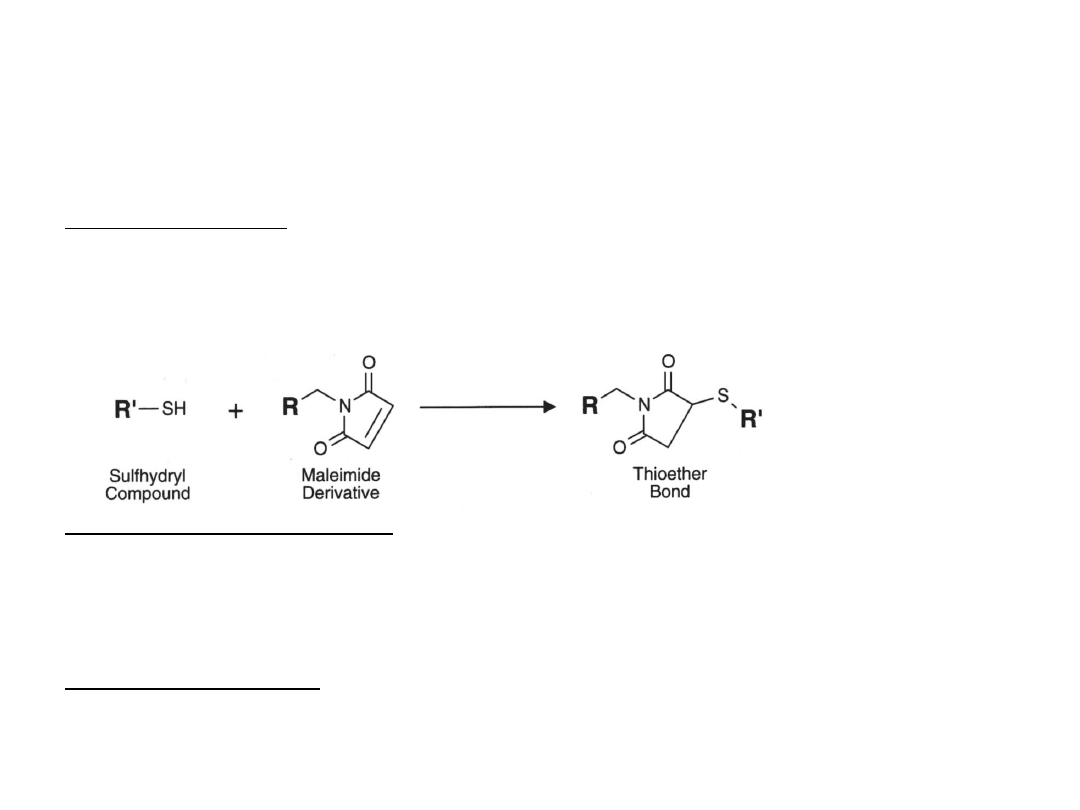
Blokowanie grup sulfhydrylowych
Są dwa typy związków blokujących: odwracalne i nieodwracalne.
Nieodwracalne prowadzą do wytworzenia wiązania tioeterowego.
Odwracalne blokują poprzez wytworzenie wiązania S-S i mogą być
usunięte odpowiednim związkiem redukującym.
N-etylomaleimid
Związek alkilujący reagujący z grupami SH – powstaje stabilne
wiązanie tioeterowe.
Reaguje specyficznie z grupami SH w pH 6.5-7.5
Pochodne jodooctanowe
Jodoacetamid – wykazuje najwyższą reaktywność względem grup SH.
Przy właściwie dobranym stosunku jodoacetamidu względem grup
SH i w lekko zasadowym pH, zachodzi wyłącznie modyfikacja
cystein.
Odczynnik Ellmana
Związek odwracalnie blokujący grupy SH.
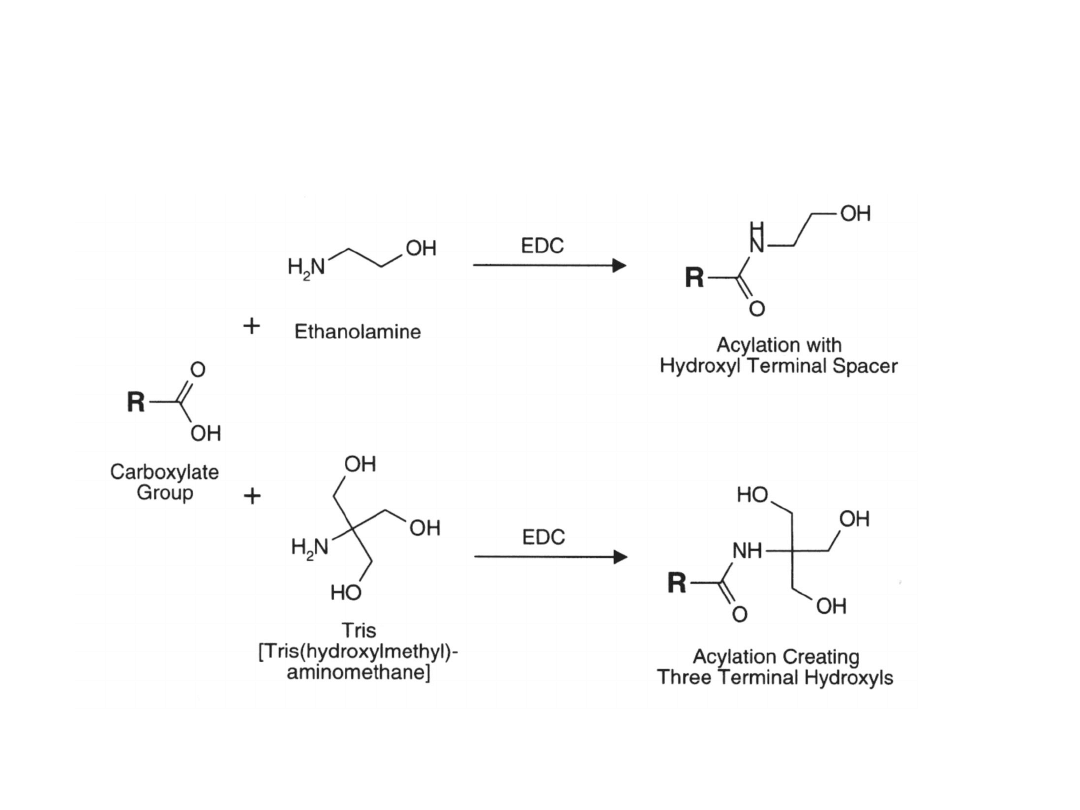
Blokowanie grup karboksylowych
Związki zawierające grupę aminową, m.in. Tris lub
etanoloamina z udziałem karbodiimidu.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
Wyszukiwarka
Podobne podstrony:
wprowadzenie do socjologii, S O C J O L O G I A , S O C J O L O G I A - nauka społeczna, której ce
Mioglobina i hemoglobina należą do białek funkcyjnych, AWF Wro, Studia 2 semestr
HEG Biofeedback wprowadza nową jakość do treningów biofeedback
STARSZEŃSTWO GRUP FUNKCYJNYCH
03 18 warunki wprowadzania nieczystości ciekłych do stac
warunk%f3w+wprowadzania+nieczysto%9cci+ciek%b3ych+do+stacji+zlewnych.
2014 03 wprowadzenie, Różne, Przygotowanie do ŚDM w Krakowie 2016 rok, Grudzień 2013 rok, Styczeń 20
monografia wprowadzenie cyfry 5 tabela do konspektu, kl. I-III
Hobbes Lewiatan Wprowadzenie, Filozofia, Materiały do zajęć, Mistrzu, Zalewski
ćwiczenie2 reakcje grup funkcyjnych
D19250867 Rozporządzenie Ministra Skarbu w porozumieniu z Ministrem Sprawiedliwości z dnia 2 grudni
POPRAWA CHARAKTERYSTYK ELEKTROMECHANICZNYCH SILNIKÓW SynRM POPRZEZ WPROWADZENIE MAGNESÓW TRWAŁYCH DO
Maryja wprowadza swe sługi do nieba
Kiedy wprowadzać nowe pokarmy do diety niemowlęcia
Oferta publiczna i warunki wprowadzania instrumentów finansowych do zorganizowanego systemu obrotu o
Wprowadzenie Teologiczno Pastoralne do Lekcjonarza Mszalnego
ustawa o ofercie publicznej i warunkach wprowadzania instrumentow finansowych do zorganizowanego sys
D19210398 Ustawa z dnia 2 lipca 1921 r wprowadzająca dodatki drożyźniane do rent, ustalonych na pod
więcej podobnych podstron