
Struktura cząsteczek
• Teoria orbitali
molekularnych
• Diagramy poziomów
energetycznych orbitali
• Polarność wiązań
• Elektroujemność
Teoria wiązań
walencyjnych
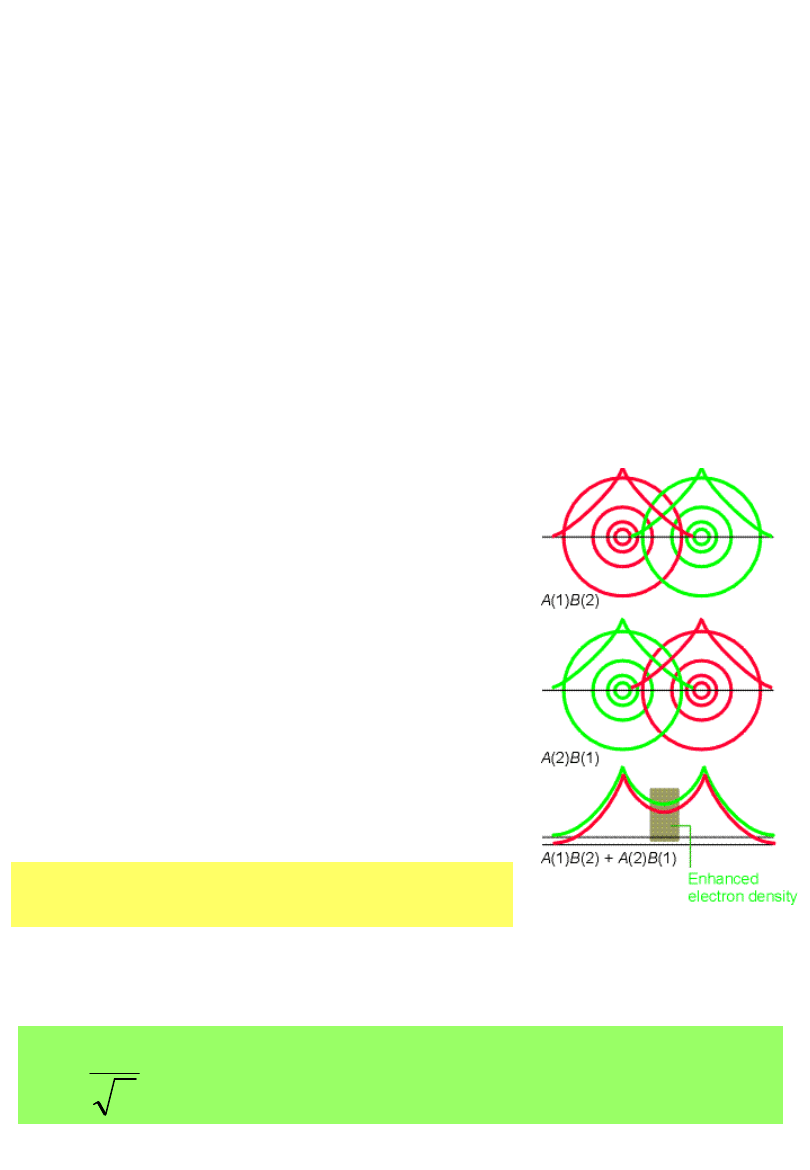
Cząsteczka H
2
)
2
(
)
1
(
)
(
)
(
2
1
1
1
B
A
r
r
sB
H
sA
H
Dla odległych od siebie
atomów:
Gdy atomy są blisko siebie:
)
1
(
)
2
(
)
2
(
)
1
(
B
A
B
A
Niższa energia dla funkcji:
)
1
(
)
2
(
)
2
(
)
1
(
B
A
B
A
Pełna funkcja:
)}
1
(
)
2
(
)
2
(
)
1
(
)]{
1
(
)
2
(
)
2
(
)
1
(
[
2
1
B
A
B
A

Teoria orbitali
molekularnych
R
e
r
e
r
e
m
H
B
A
e
0
2
1
0
2
1
0
2
2
1
2
4
4
4
2
ˆ
Cząsteczka H
2
+
Liniowa kombinacja orbitali
atomowych (LCAO):
)
(
B
A
N
d
AB
d
B
d
A
d
2
N
*
1
2
2
2
1/2
S)}
{2(1
1
N
sB
H
sA
H
1
1
B
A
1/2
3
0
/
1/2
3
0
/
)
a
(
e
B
)
a
(
e
A
0
0
a
-r
a
-r
B
A
2
1
2
2
B
}
cos
2
{
/
A
A
R
r
R
r
r
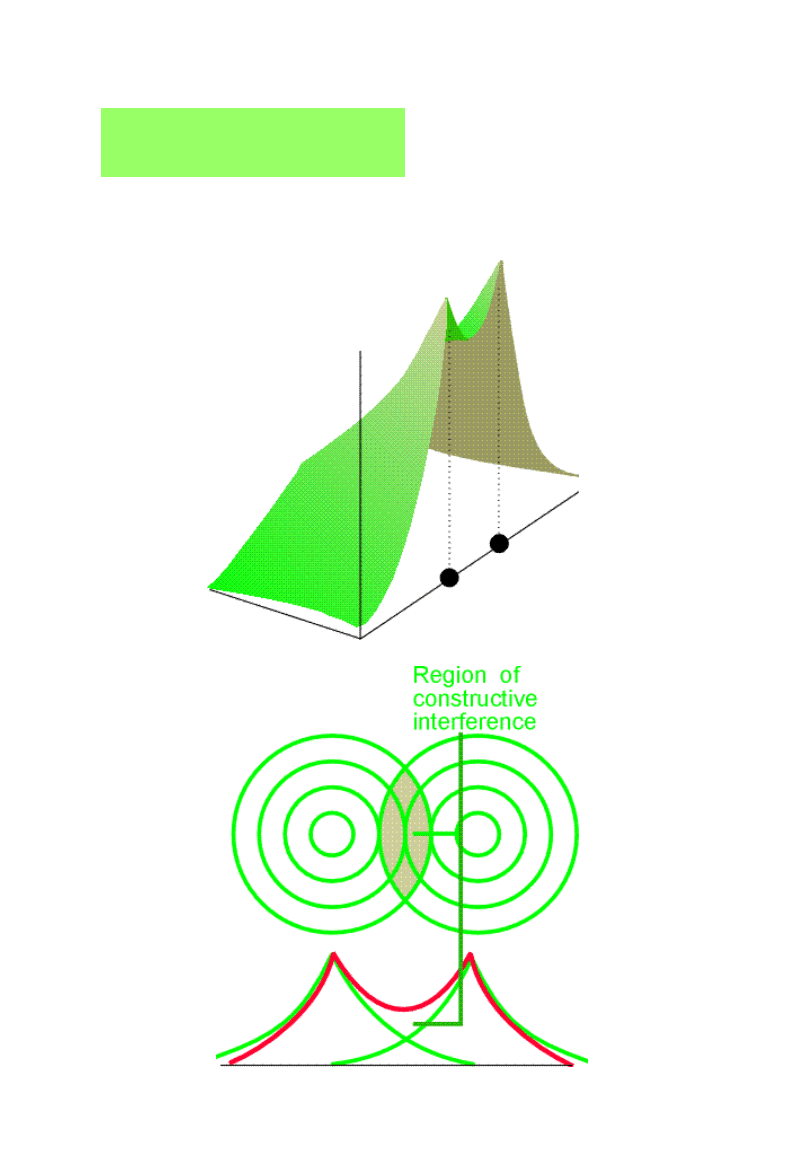
Orbital wiążący
)
2
(
2
2
2
2
AB
B
A
N
)
(
B
A
N
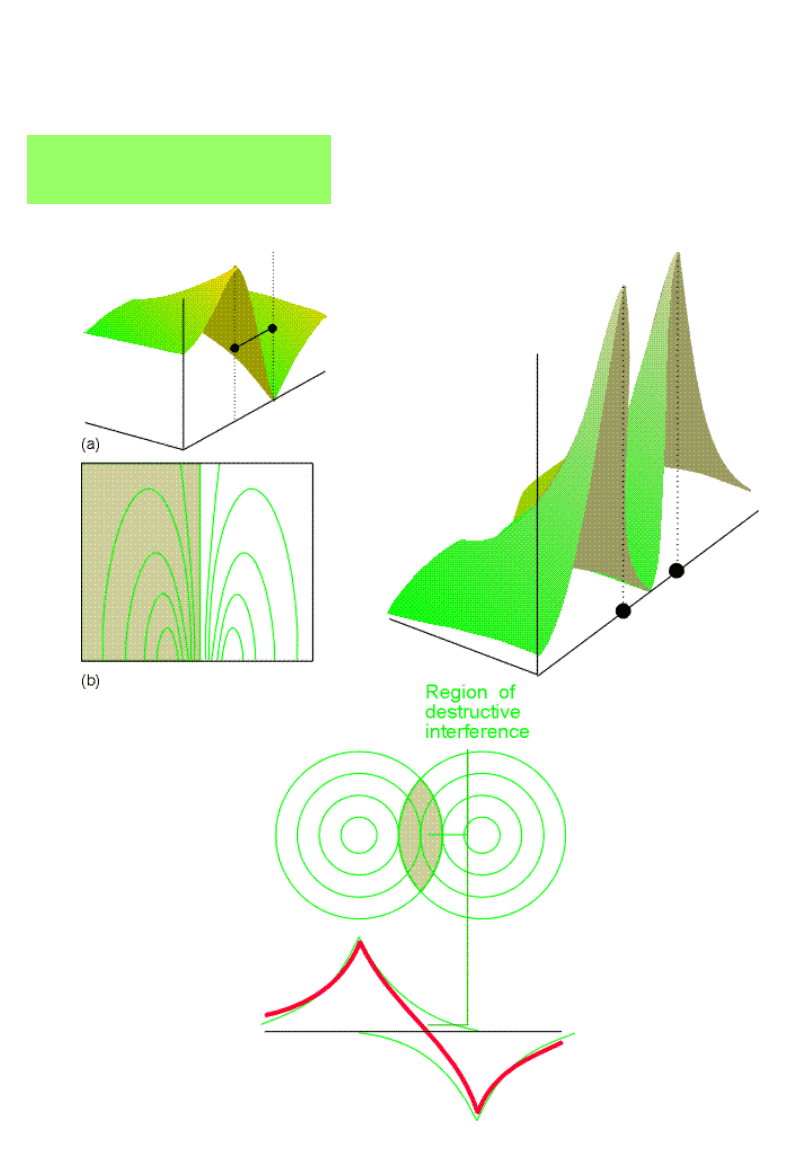
Orbital antywiążący
*
)
2
(
2
2
2
2
AB
B
A
N
)
(
B
A
N
Energie orbitali i
*
1
4
0
2
1
S
k
j
R
πε
e
E
E
s
H
4
4
0
2
2
0
2
dτ
r
AB
πε
e
k
dτ
r
A
πε
e
j
ABd
S
A
B
S, j, k - dodatnie,
malejące wykładniczo
z R
|
E
|E
|
E
|E
s
H
s
H
1
1
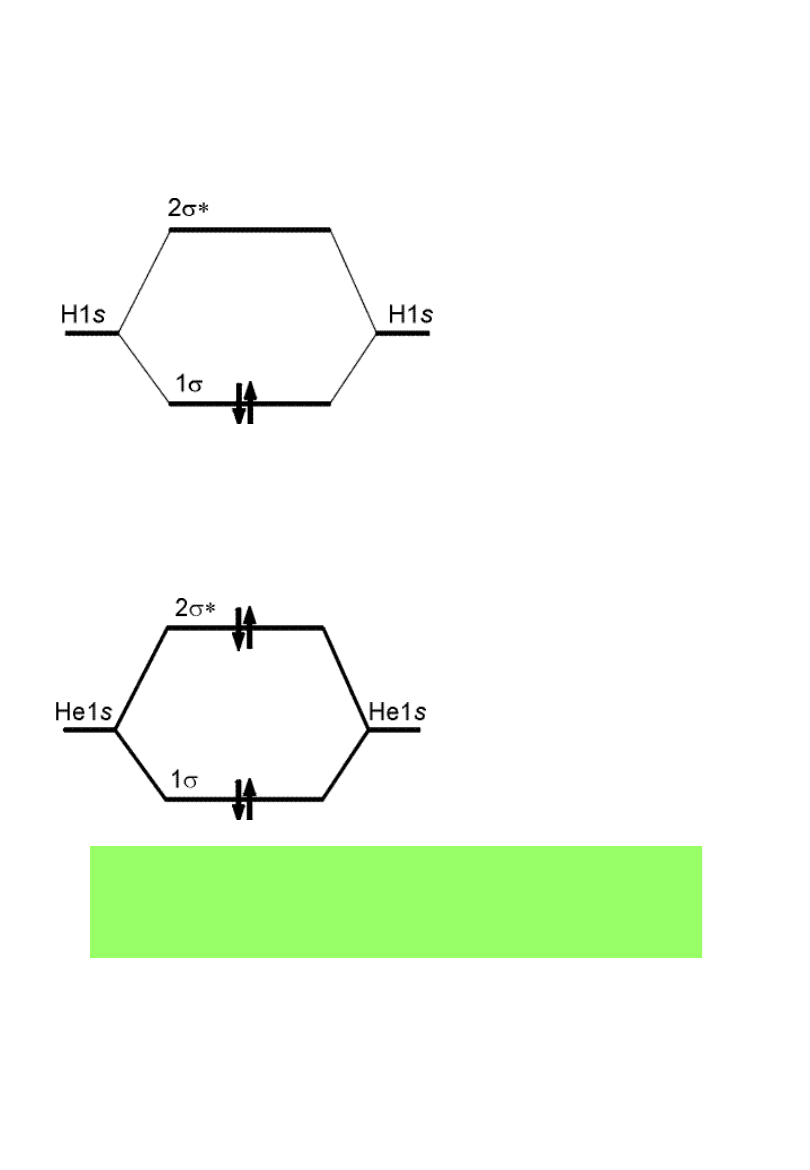
Diagramy poziomów
energetycznych orbitali
molekularnych
H
2
He
2
(hipotetyczn
a)
Rząd wiązania:
b = 1/2(n -
n*)
n - liczba elektronów na
orbitalach wiążących, n* -
na niewiążących

Długości wiązań i
energie dysocjacji
CH
1
114
CC
1
154
Wiązanie Rząd
R/pm
HH
1
74
NN
3
110
CC
2
134
CC
3
120
CH
1
435
CC
1
368
Wiązanie Rząd
R/
(kJ/mol)
HH
1
432
NN
3
942
CC
2
720
CC
3
962
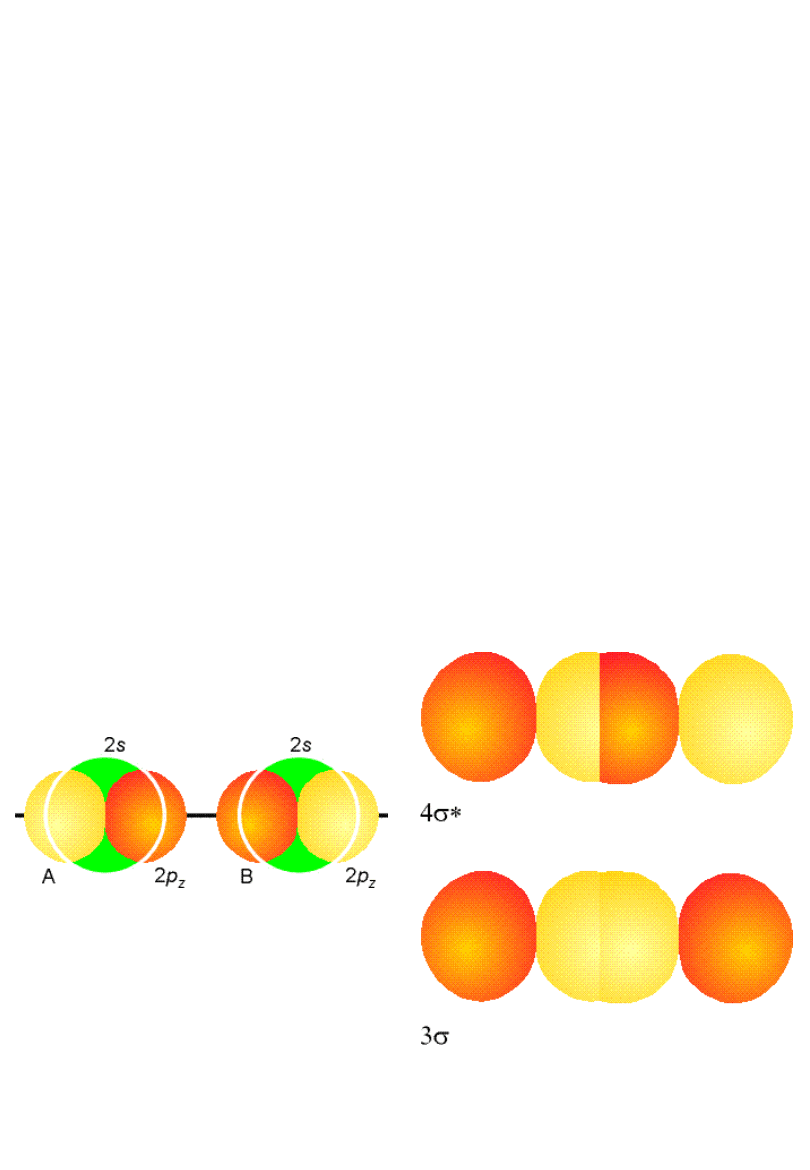
Cząsteczki
dwuatomowe
Orbitale i *
Ogólnie:
z
z
z
z
p
B
p
B
p
A
p
A
s
B
s
B
s
A
s
A
c
c
c
c
2
2
2
2
2
2
2
2
W przybliżeniu:
z
z
z
z
p
B
p
B
p
A
p
A
s
B
s
B
s
A
s
A
c
c
c
c
2
2
2
2
2
2
2
2
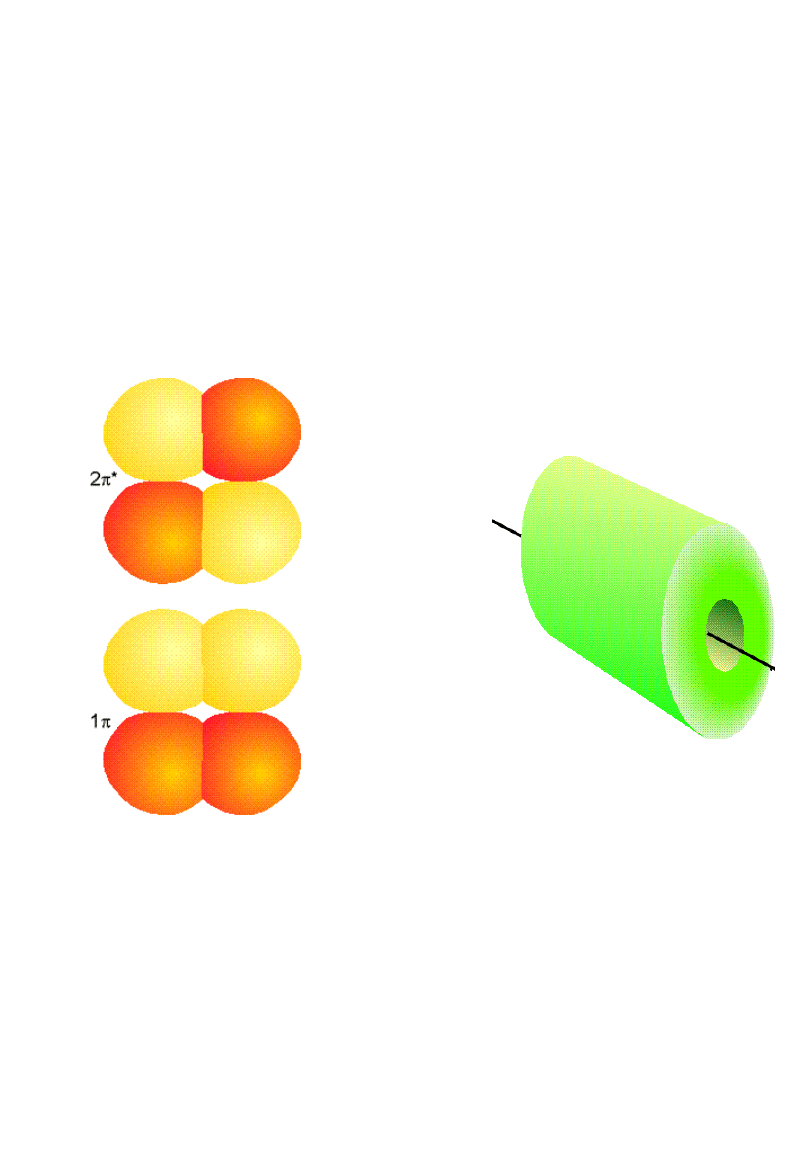
Cząsteczki
dwuatomowe
Orbitale
x
,
y ,
x
*,
y
*
(podwójnie
zdegenerowane)
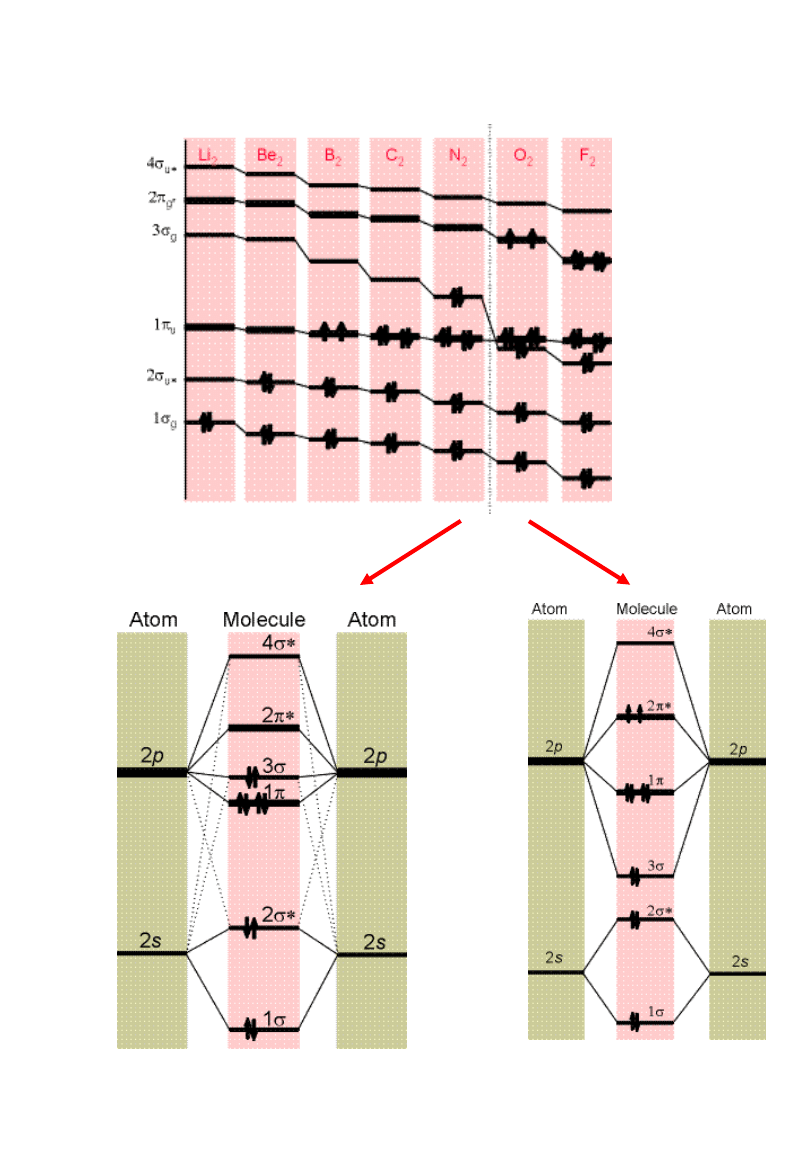
Diagramy poziomów
energetycznych

Metoda LCAO
M
l
l
kl
k
i
c
i
1
)
(
)
(
Przybliżenie
jednoelektronowe
)
(
)...
2
(
)
1
(
.
...
.
.
.
...
.
.
)
(
)...
2
(
)
1
(
)
(
)...
2
(
)
1
(
1
2
2
2
1
1
1
N
N
N
N
N
N
N
)
(
)
(
)
(
i
i
i
s
m
p
p
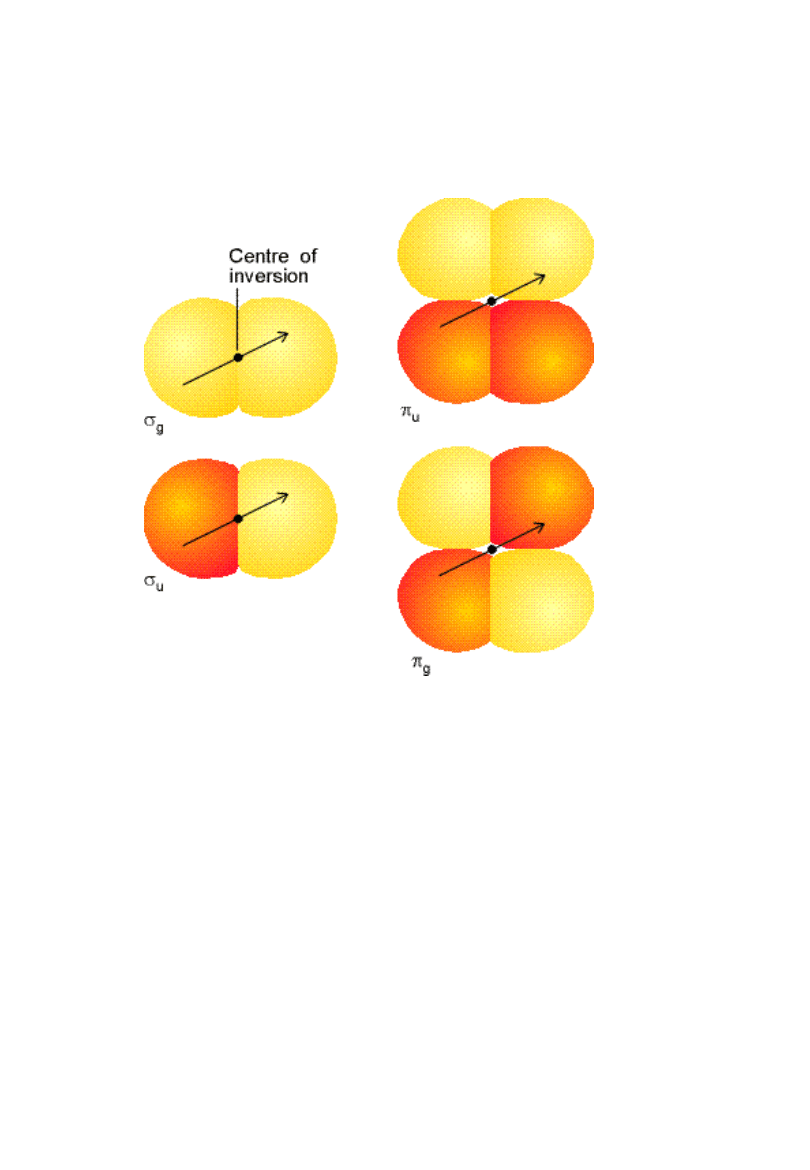
Parzystość
g, gerade - parzysty
u, ungerade -
nieparzysty
g·g = u·u = g
g·u = u
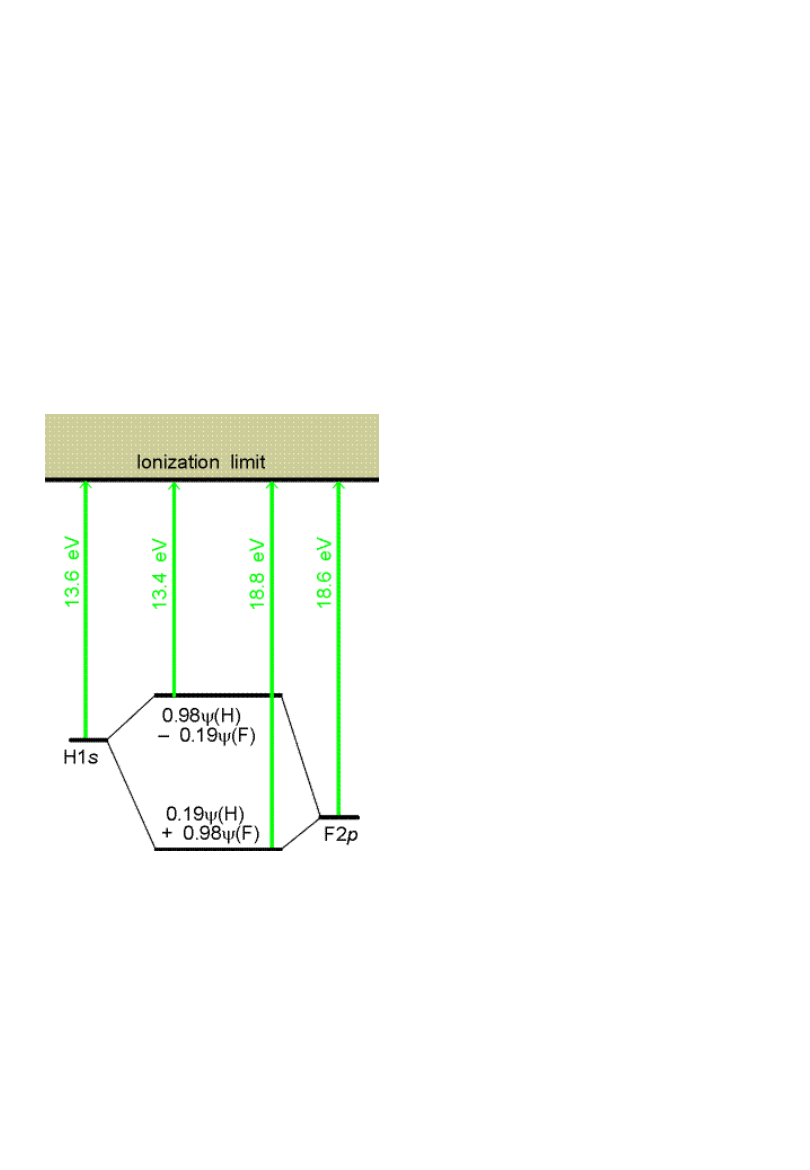
Dwuatomowe
cząsteczki
heterojądrowe
B
c
A
c
B
A
F
F
H
H
c
c
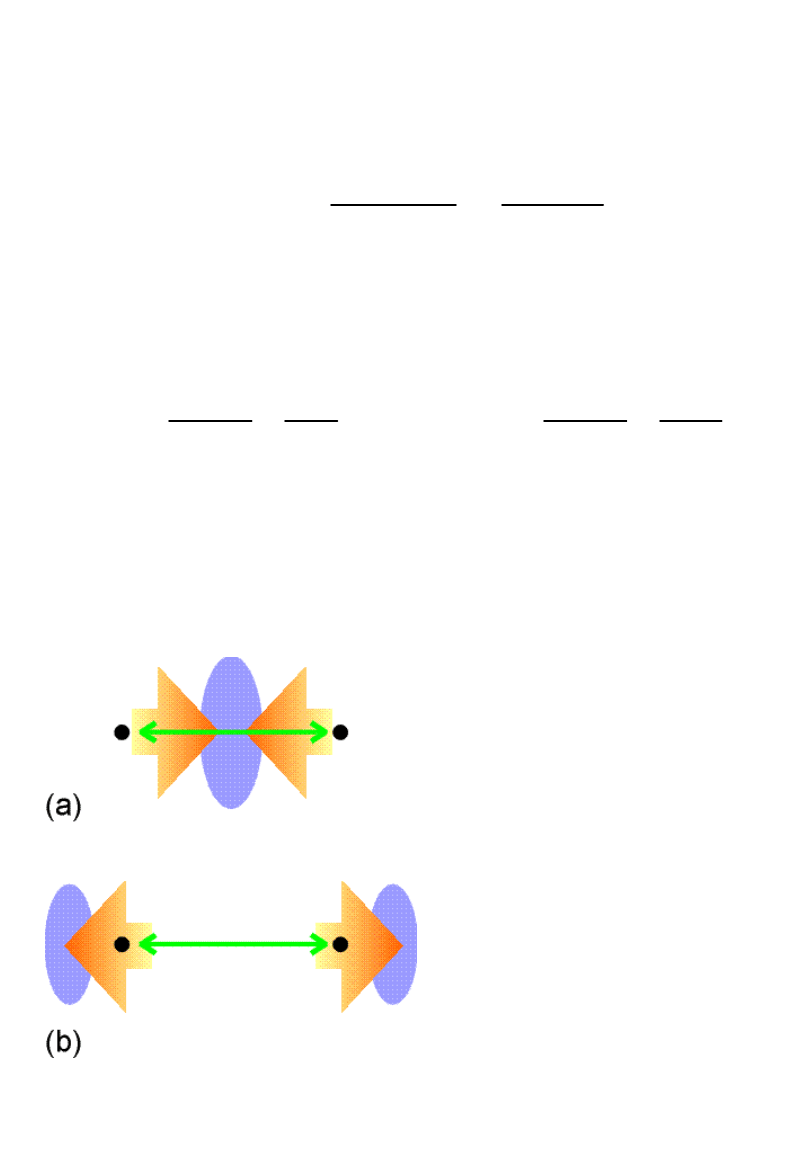
Wiązanie polarne
(spolaryzowane)

Polarność wiązań
B
c
A
c
B
A
c
A
= c
B
:
wiązanie
kowalencyjne
c
A
c
B
:
wiązanie
spolaryzowane
c
A
lub c
B
=0: wiązanie
jonowe
O
2
, N
2
, Cl
2
HBr, HCl, HF
CsJ, NaCl

Elektroujemność
Pauling:
2
1
)]}
(
)
(
[
2
1
)
(
{
102
.
0
|
|
/
B
A
B
B
D
A
A
D
B
A
D
Mulliken:
)
(
2
1
E
I
M
D - energia dysocjacji
wiązania
I - potencjał jonizacji
E - powinowactwo
elektronowe

Elektroujemność
Wartości elektroujemności wg
Paulinga
Pierwiastek
P
H
2.20
C
2.55
N
3.04
O
3.44
F
3.98
Cl
3.16
Cs
0.79
Ge
2.01
Al
1.61
Mg
1.31
Na
0.93

a) 1
2
, b=1;
b) 1
2
2*
2
, b=0;
c) 1
2
2*
2
1
4
, b=2
Podaj konfigurację elektronową
i rząd wiązania dla
następujących cząsteczek: a)
Li
2
; b) Be
2
; c) C
2
Podaj konfigurację elektronową i
rząd wiązania dla następujących
cząsteczek: a) CO; b) NO; c) CN
-
a) 1
2
2*
2
1
4
3
2
, b=3 (izoelektronowa z
N
2
);
b) 1
2
2*
2
1
4
3
2
1*
1
, b=2.5;
c) 1
2
2*
2
1
4
3
2
, b=3 (izoelektronowa z
N
2
)

Która z molekuł będzie miała
większą energię dysocjacji
wiązania: a) B
2
b) C
2
a) konfiguracja 1
2
2*
2
1
2
, b=1
b) 1
2
2*
2
1
4
, b=2; a więc większa energia
wiązania

W której z cząsteczek jest krótsze
wiązanie: NO czy w N
2
?
a) NO: 1
2
2*
2
1
4
3
2
1*
1
, b=2.5
b) 1
2
2*
2
1
4
3
2
, b=3 => dłuższe
wiązanie.
Document Outline
- Struktura cząsteczek
- Teoria wiązań walencyjnych
- Teoria orbitali molekularnych
- Orbital wiążący
- Orbital antywiążący *
- Energie orbitali i *
- Diagramy poziomów energetycznych orbitali molekularnych
- Długości wiązań i energie dysocjacji
- Cząsteczki dwuatomowe
- Slide 10
- Diagramy poziomów energetycznych
- Metoda LCAO
- Parzystość
- Dwuatomowe cząsteczki heterojądrowe
- Polarność wiązań
- Elektroujemność
- Slide 17
- Slide 18
- Slide 19
- Slide 20
Wyszukiwarka
Podobne podstrony:
Wykład Chemia kwantowa 11
Wykład Chemia kwantowa 2
Wykład Chemia kwantowa 6 6
Wykład Chemia kwantowa 3 i 4
Wykład Chemia kwantowa (2)
Wykład Chemia kwantowa 7
Wykład Chemia kwantowa 11
Wykład 9 CHEMIA ORGANICZNA
Zakres materiału obowiązujący na II kolokwium wykładowe, Chemia ogólna i nieorganiczna, giełdy
WYKŁAD 1 chemia, Chemia
wykłady chemia sem 1
Rzeczy których nie ma u piegusa wykład chemia( 02 2014
WYKŁAD chemia gips
więcej podobnych podstron