
Struktura atomów
wieloelektronowych
• Sprzężenie spin-orbita
• Wpływ pola magnetycznego
• Konfiguracje
• Termy atomowe
• Reguły Hunda

Przybliżenie
jednoelektronowe
Każdemu elektronowi
przypisujemy jego
własny orbital
s
l
s
l
m
nlm
m
nlm
Iloczyn funkcji
nlml
zależącej od
współrzędnych oraz funkcji
spinowej
ms
Spinorbital
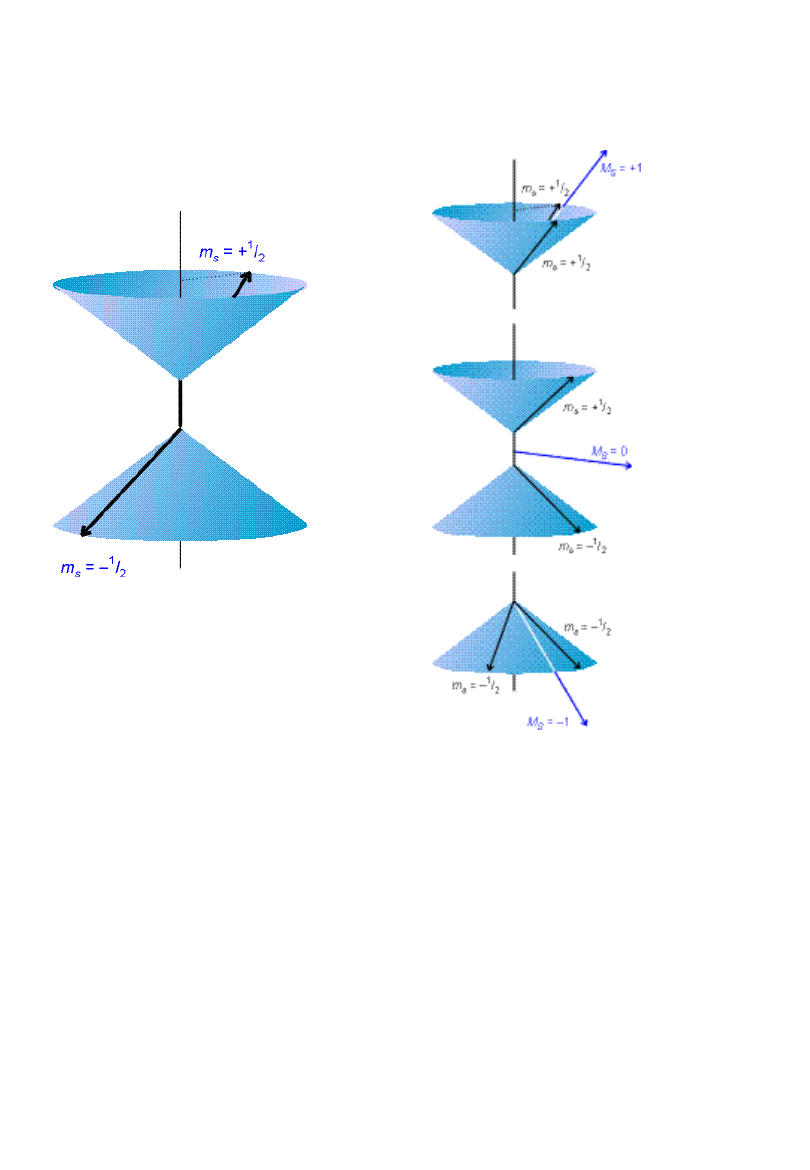
Stany singletowe i
trypletowe
Multipletowość:
2S+1

Dany orbital mogą zajmować co
najwyżej dwa elektrony o
sparowanych spinach
Konfiguracja
elektronowa
Sposób przyporządkowania
poziomów energetycznych
elektronom
Zakaz Pauliego

Okresowość
właściwości
chemicznych
Neon, Z=10 [He]2s
2
2p
6
= 2s
2
2p
6
=
[Ne]
zapełnione powłoki K i L: [Ne]
Lit, Z = 3: [He]3s
1
=
K3s
1
Sód, Z=11: [Ne]3s
1
=KL3s
1
Potas, Z = 19 [Ar]3s
1
Hel Z= 2: 1s
2
=
[He]
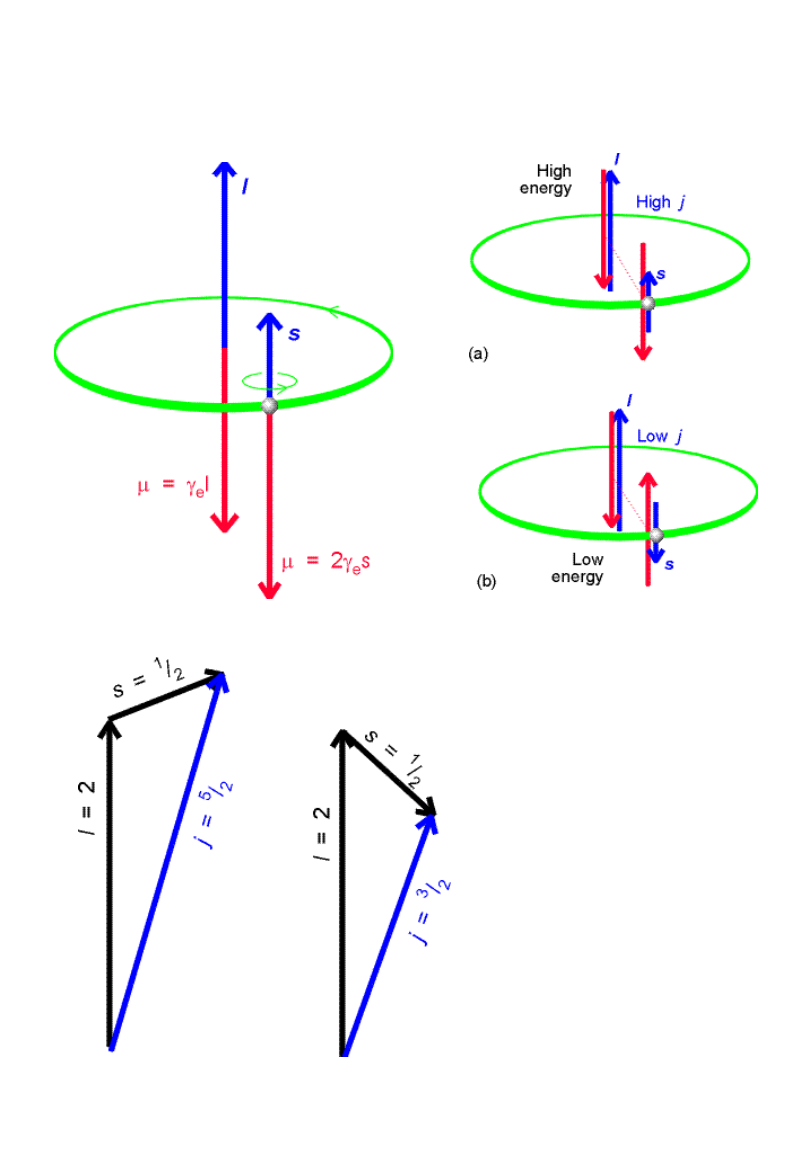
Sprzężenie spinowo-
orbitalne
Całkowit
y
moment
pędu: j
Sprzężenie spinowo-
orbitalne
Energia momentu
magnetycznego w polu B:
-· B
-· B s· l
2
2
2
2
2
2
ˆ
ˆ
ˆ
2
1
ˆ
ˆ
2
1
(
s
l
j
s
l
j
l
s
l
s
l
s
s
s
l
l
s
l
s
l
j
j
s
l
j
2
)
(
)
2
2
2
2
)}
1
(
)
1
(
)
1
(
{
2
1
,
,
ˆ
ˆ
ˆ
|
,
,
2
1
,
,
ˆ
ˆ
|
,
,
s
s
l
l
j
j
s
l
j
s
l
j
s
l
j
s
l
j
s
l
j
|
|
l
s
)}
1
(
)
1
(
)
1
(
{
2
1
,
,
s
s
l
l
j
j
hcA
E
j
s
l
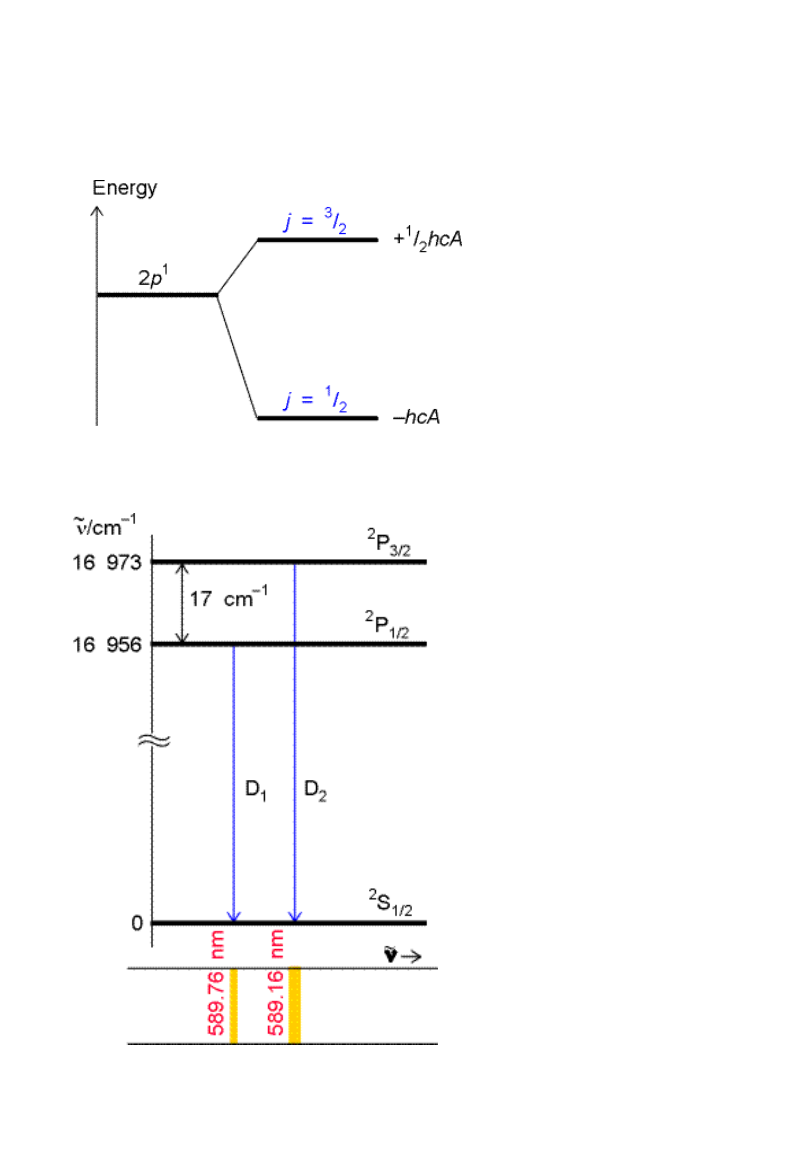
Sprzężenie spinowo-
orbitalne
Struktura
subtelna
widma:
dublet linii
sodu

Wpływ pola
magnetycznego
l
e
z
m
e
e
m
e
2
e
B
B
l
e
z
m
e
m
m
e
2
2
Energia momentu
magnetycznego w polu
magnetycznym B:
B
E
z
B
M
E
B
m
E
L
B
M
l
B
m
L
l
lub
Dla momentu spinowego:
s
e
e
z
m
g
...
002319
.
2
e
g
B
M
g
E
B
m
g
E
S
B
e
M
s
B
e
m
s
s
lub
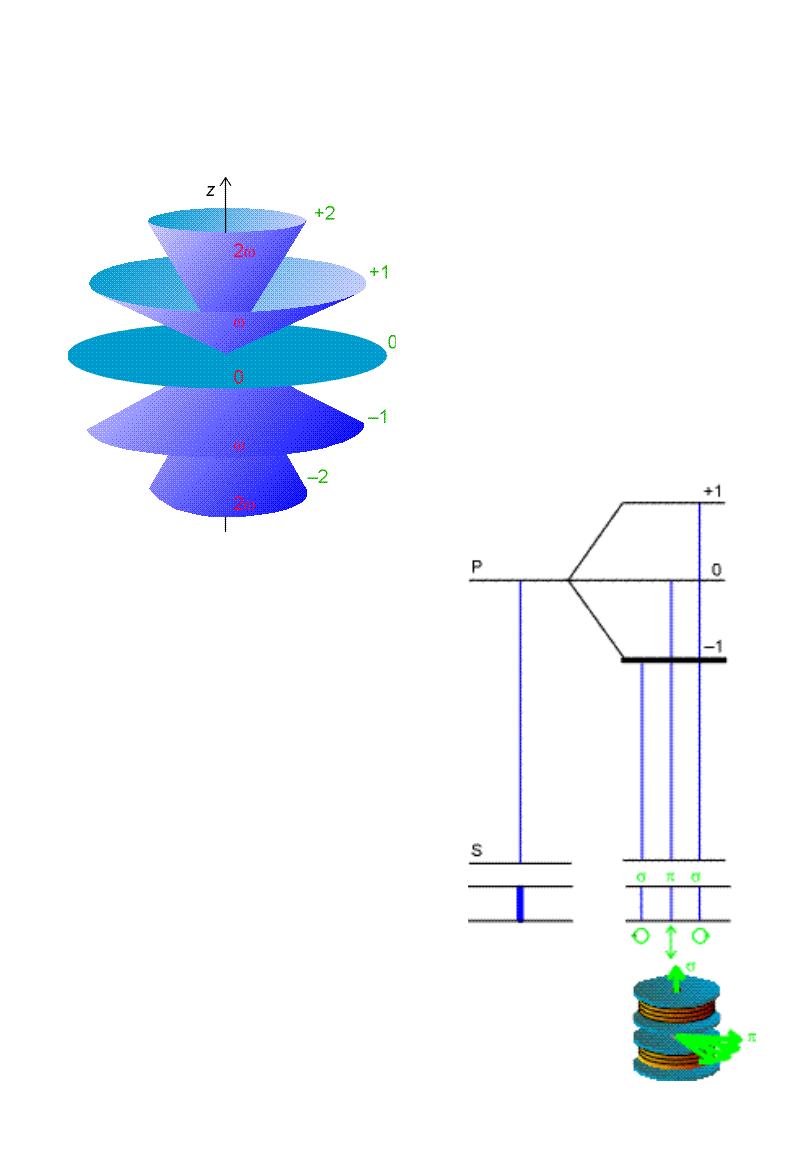
Efekt Zeemana
B
m
E
l
B
m
l

Konfiguracja
elektronowa
Przyporządkowanie elektronów
poziomom energetycznym
Be
Beryl, Z= 4: 1s
2
2s
2
=
[He]2s
2
H
Wodór, Z= 1: 1s
1
B
Bor, Z= 5: 1s
2
2s
2
2p
1
=
[He]2s
2
2p
1
Li
Lit, Z= 3: 1s
2
2s
1
=
[He]2s
1
He
Hel Z= 2: 1s
2
=
[He]
C
Węgiel, Z= 6: 1s
2
2s
2
2p
2
=
[He]2s
2
2p
2
N
Azot, Z= 7: 1s
2
2s
2
2p
3
=
[He]2s
2
2p
3
O
Tlen, Z= 8: 1s
2
2s
2
2p
4
=
[He]2s
2
2p
24
F
Fluor, Z= 9: 1s
2
2s
2
2p
5
=
[He]2s
2
2p
5
Ne
Neon, Z= 10: 1s
2
2s
2
2p
6
=
[Ne]
Na
Sód, Z= 11: 1s
2
2s
2
2p
6
3s
1
=
[Ne]3s
1
E
[eV]
Atom C
1s
2s
2p
-308.2
-19.2
-11.8
Atom N
1s
2s
2p
-425.3
-25.7
-15.4
Atom O
1s
2s
2p
-562.4
-33.9
-17.2
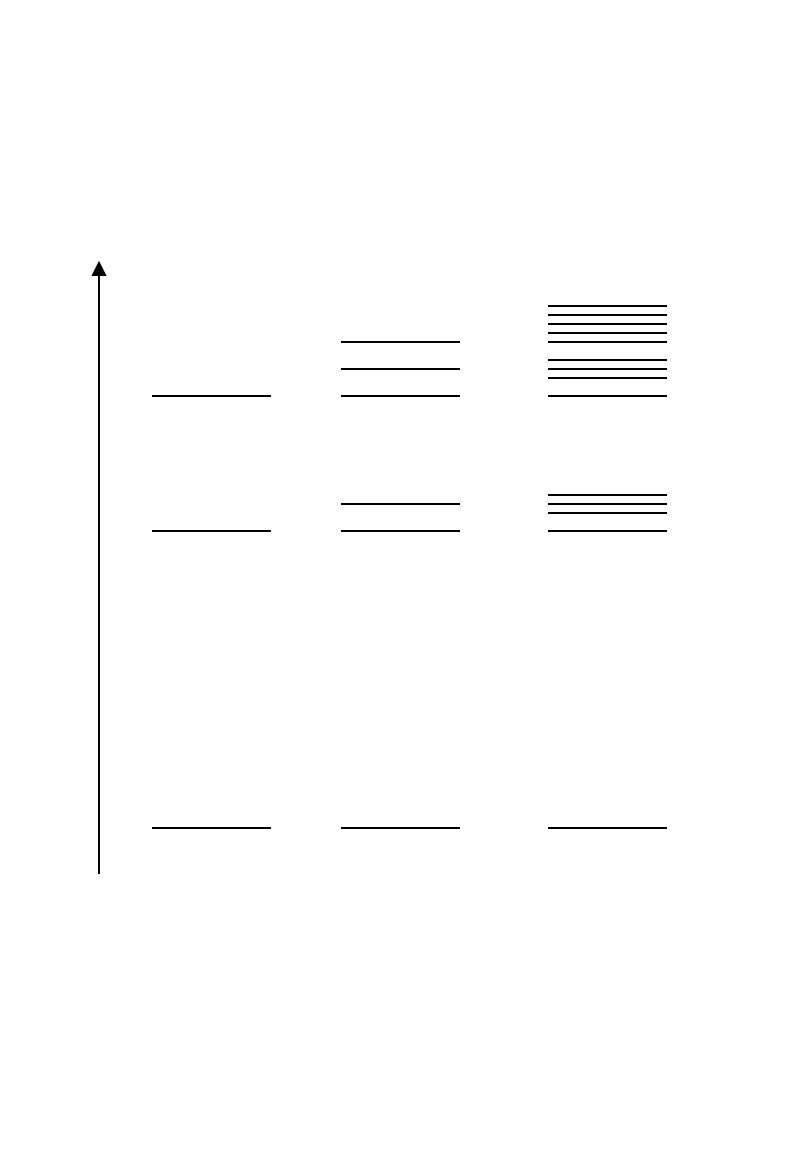
E
n = 3
n = 2
n = 1
Atom H
l = 0
l = 0
l = 1
l = 2
l = 0
l = 1
Atom
wieloel.
l = 1
l = 1
l = 2
l = 0
l = 0
l = 0
Atom
wieloel.
w polu mag.

1s
2s 2p
3s 3p 3d
4s 4p 4d 4f
5s 5p 5d 5f
6s 6p 6d
7s 7p
Schemat obsadzania poziomów
w atomie wieloelektronowym
K
Potas, Z= 19:
1s
2
2s
2
2p
6
3s
2
3p
6
4s
1
Sc
Skand, Z= 21:
1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
1
Ca
Wapń, Z= 20:
1s
2
2s
2
2p
6
3s
2
3p
6
4s
2

Energia orbitalna; suma energii
kinetycznej
oddziaływania z jądrem
oddziaływania z pozostałymi elektronami
Energia orbitalna
nie
jest równa energii całkowitej atomu
Sc
Skand, Z= 21:
1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
1
E(4s) = -0.420 j.at; E(3d) = -0.687 j.at
Dlatego: nie wszystkie orbitale obsadzone
wg rosnących energii

Atomy zamkniętopowłokowe:
Gazy szlachetne
Be (1s
2
s
2
)
C: 1s
2
2s
2
2p
2
=
[He]2s
2
2p
2
= K
2s
2
2p
2
Atomy: otwartopowłokowe
Na: 1s
2
2s
2
2p
6
3s
1
=
[Ne]3s
1
=
KL3s
1

Stan atomu wieloelektronowego - różnice
w stosunku do atomu wodoropodobnego
1. Nie ma liczby kwantowej
charakteryzującej energię
2. Możliwe różne multipletowości spinowe
Termy atomowe
Informacja o całkowitym
orbitalnym momencie pędu L,
multipletowości (2S+1), oraz
całkowitym momencie pędu J dla
danej konfiguracji elektronowej
(konfiguracja
elektronowa)
2S+1
L
J
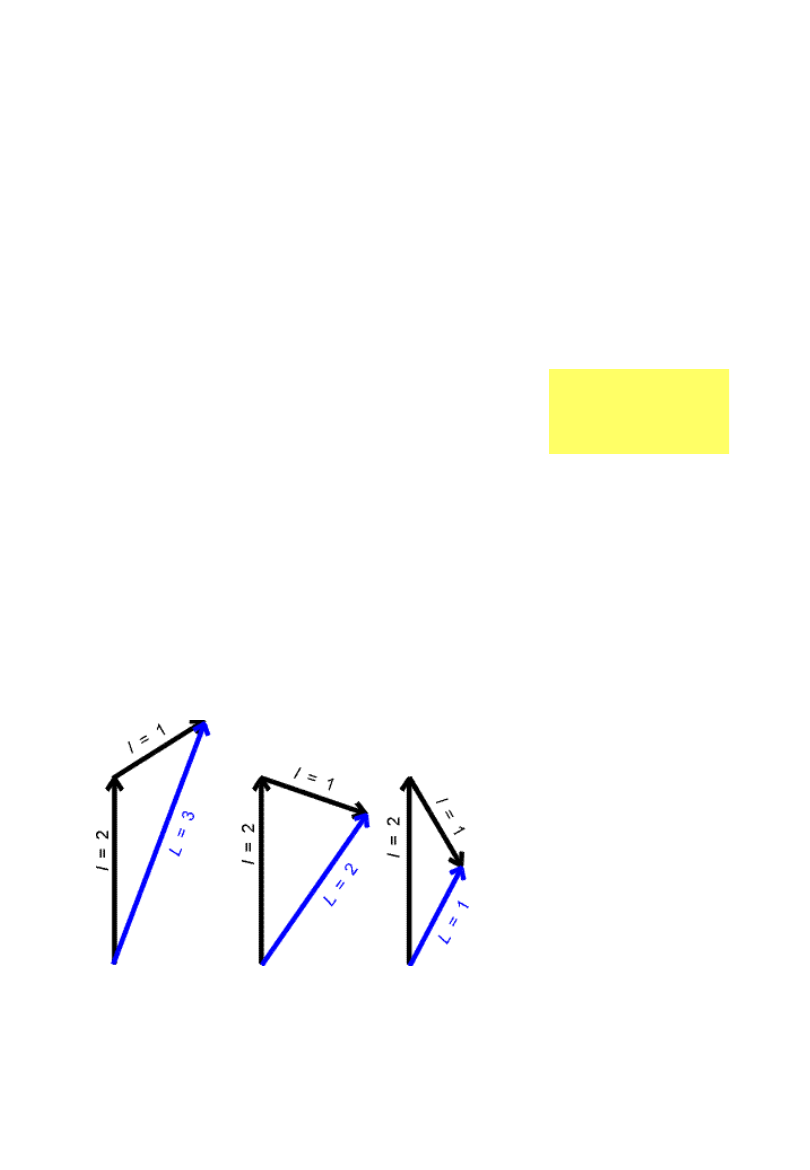
Liczba kwantowa całkowitego
orbitalnym momencie pędu L:
L = l
1
+l
2
, l
1
+l
2
-1,…,| l
1
-l
2
|L
0
S
1
P
2
D
3
F
4
G
5
H
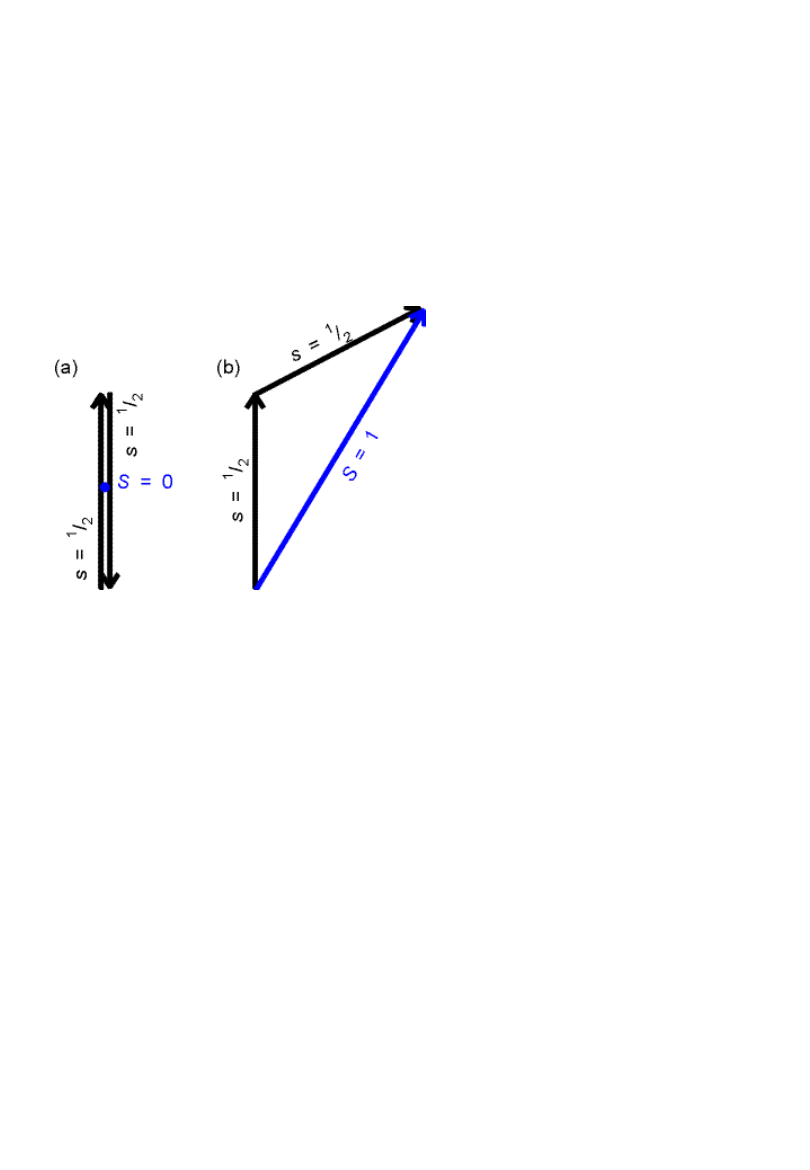
Symbole termów
Multipletowość termu ma
wartość 2S+1
S = s
1
+s
2
, s
1
+s
2
-1,…,| s
1
-s
2
|
Pojedyńczy elektron - dublet,
np [Ne]3s
1
,
[Ne]3p
1
Symbole termów
Całkowity moment pędu J:
Sprzężenie Russela-Saundersa
(L-S)
L = l
1
+l
2
, l
1
+l
2
-1,…,| l
1
-l
2
|
Dla cięższych atomów -
sprzężenie jj
0)
0
wyj.
(z
1
0,
1
1
0,
0
J
J
J
l
L
S
Reguły wyboru:

Przykłady
termów
Atom H w stanie podstawowym: 1s
1
L = l = 0, S = s = 1/2 =>
2
S
1/2
Atom He w stanie podstawowym: 1s
2
L = l = 0, S = 0 =>
1
S
0
Konfiguracja p
1
(np. Atom B)
L = 1, S = 1/2 =>
2
P
1/2
,
2
P
3/2
Dla zamkniętych powłok S = L = 0

Reguły Hunda
1. Termem podstawowym jest
term o największej
multipletowości.
2. Spośród termów o największej
multipletowości najniższy jest
term o największej wartości L.
3. Dla stanów o tych samych
wartościach L i S, dla powłoki
zapełnionej elektronami mniej
niż w połowie, termem
podstawowym jest term o
najmniejszej wartości J; jeśli
powłoka zapełniona jest więcej
niż w połowie, termem
podstawowym jest term o
największej wartości J.
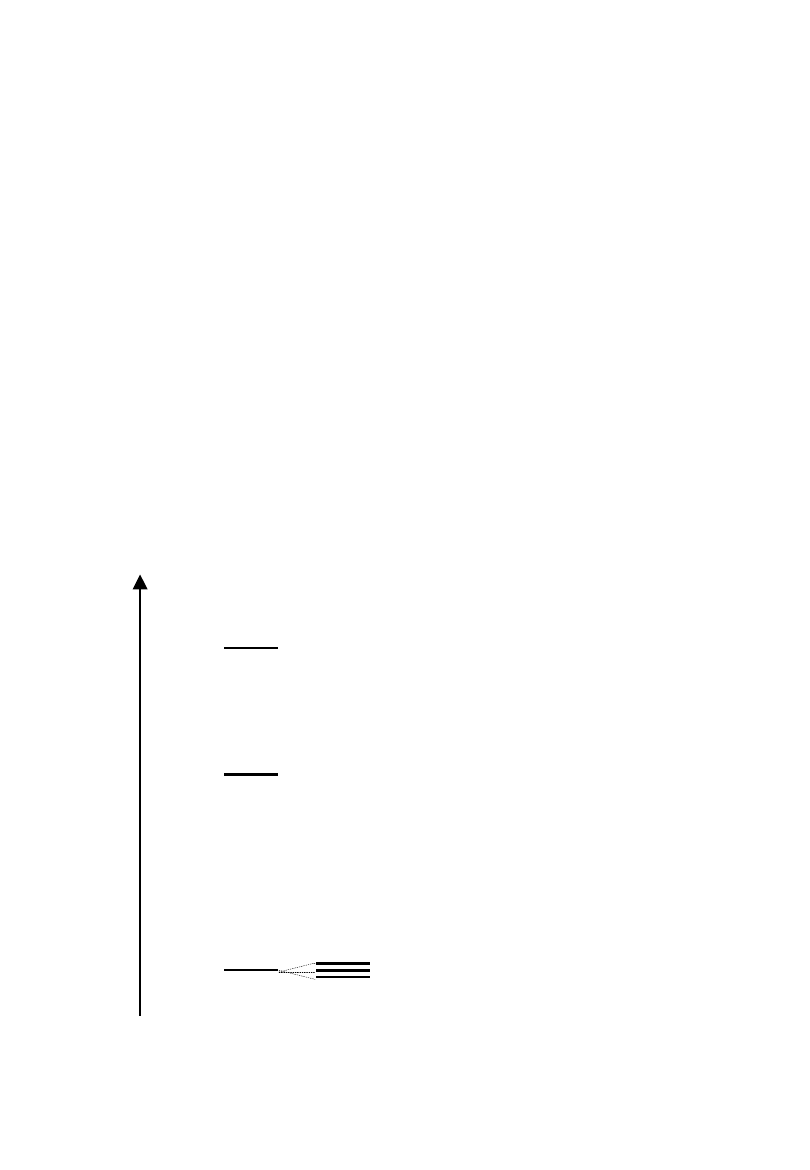
Konfiguracja p
2
(np. Atom C)
Możliwe wartości L: 2, 1,0 (Termy
D, P,S)
Możliwe wartości S: 0, 1
(multipletowość 1lub 3 (singlet lub
tryplet)
Możliwe termy:
1
D
2
3
P
2
3
P
1
3
P
0
1
S
0
E
Atom C (1s
2
2s
2
2p
2
)
1
D
2
1
S
0
3
P
0
3
P
2
3
P
1

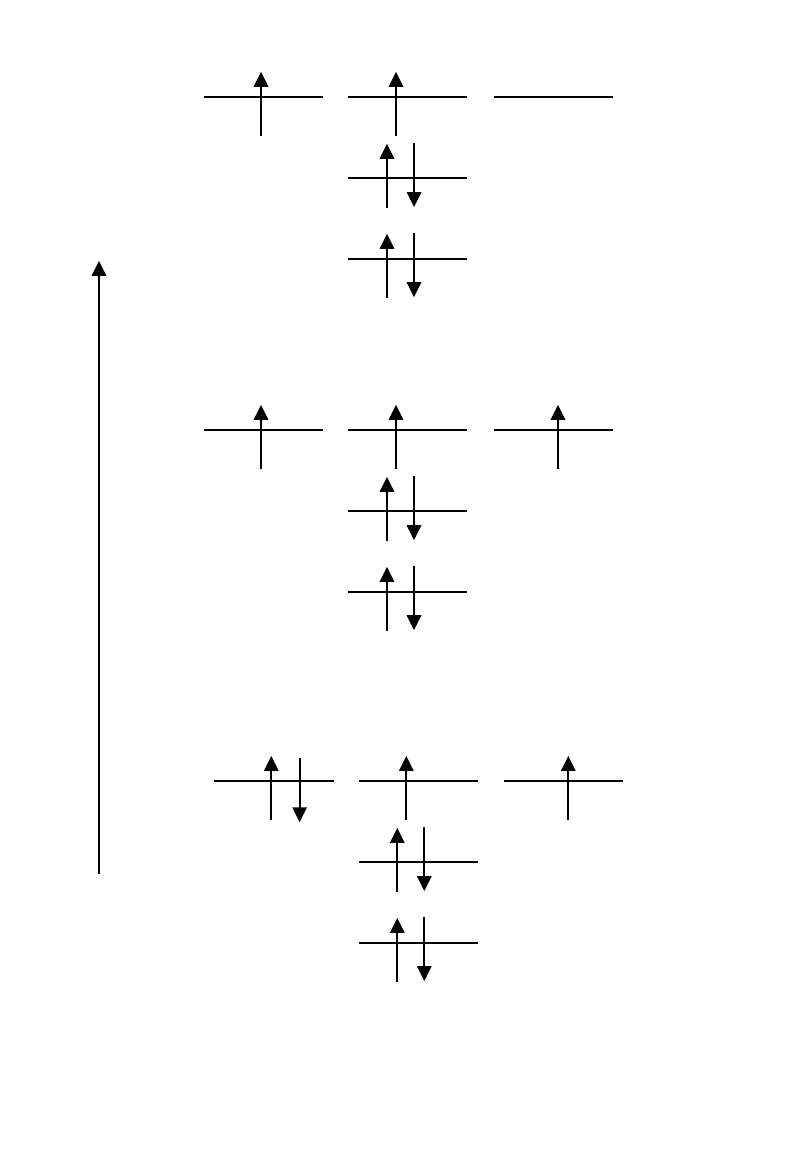
Możliwe przyporządkowania
elektronów spinorbitalom dla
konfiguracji p
2
p
1
p
0
p
-1
M
L
2 0 -2 1 0 -1 1 0 -1 1 0 -1
1 0 -1
M
S
0 0 0 1 1 1 0 0 0 -1-1 -1
0 0 0
Mamy M
L
=2 i M
S
=0.
Odpowiada to termowi
1
D
2
Temu termowi opdpowiada
pięć funkcji falowych:
M
L
2 1 0 -1 -2
M
S
0 0 0 0 0

Pozostają:
M
L
0 1 0 -1 1 0 -1 1 0 -1
M
S
0 1 1 1 -1 -1 -1 0 0 0
Mamy M
L
=1 dla której M
S
=-1, 0, 1.
Mamy więc: L=1, S=1.
Odpowiada to termowi
3
P
(
3
P
2
,
3
P
1
,
3
P
0
)
Wykreślamy dziewięć zestawów
Pozostaje jeden człon: M
L
=0,M
S
= 0.
Odpowiada to termowi
1
S
0
Document Outline
- Struktura atomów wieloelektronowych
- Przybliżenie jednoelektronowe
- Stany singletowe i trypletowe
- Slide 4
- Okresowość właściwości chemicznych
- Sprzężenie spinowo-orbitalne
- Slide 7
- Slide 8
- Wpływ pola magnetycznego
- Efekt Zeemana
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Termy atomowe
- Symbole termów
- Slide 20
- Slide 21
- Reguły Hunda
- Slide 23
- Slide 24
- Slide 25
Wyszukiwarka
Podobne podstrony:
Wykład Chemia kwantowa 11
Wykład Chemia kwantowa 2
Wykład Chemia kwantowa 6 6
Wykład Chemia kwantowa (3)
Wykład Chemia kwantowa 3 i 4
Wykład Chemia kwantowa (2)
Wykład Chemia kwantowa 11
Wykład 9 CHEMIA ORGANICZNA
Zakres materiału obowiązujący na II kolokwium wykładowe, Chemia ogólna i nieorganiczna, giełdy
WYKŁAD 1 chemia, Chemia
wykłady chemia sem 1
Rzeczy których nie ma u piegusa wykład chemia( 02 2014
WYKŁAD chemia gips
więcej podobnych podstron