
1
Druga zasada
termodynamiki
Wprowadzenie do termodynamiki
chemicznej
Wykład 3
L.
Boltzmann
S.
Carnot

2
4.1. Fakty
doświadczalne i
sformułowanie drugiej
zasady termodynamiki
Wykład 4
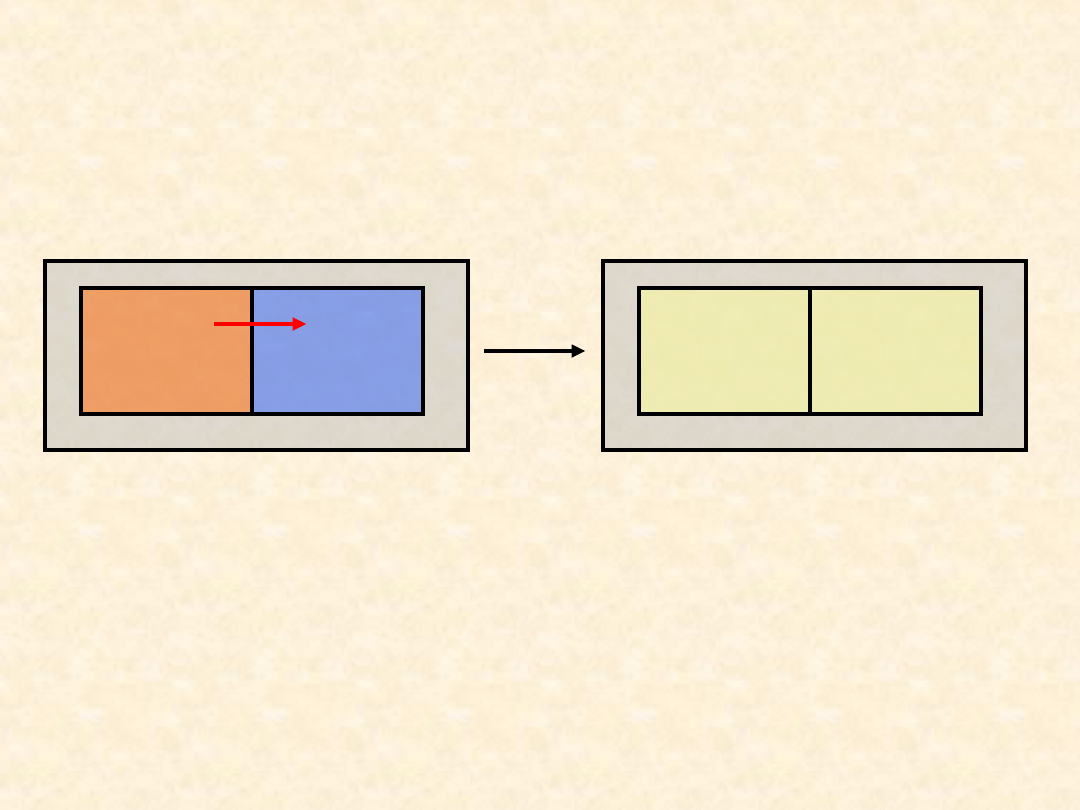
3
Wszystkie przemiany zachodzące w
przyrodzie przebiegają w określonym
kierunku...
• Wymiana energii na sposób ciepła.
T
A
T
B
<
T
A
Q
T
B
=
T
A
W wyniku wymiany energii na sposób
ciepła podukłady A i B dążą do stanu
równowagi termicznej, w którym
mają taką samą temperaturę.

4
Wszystkie przemiany zachodzące w
przyrodzie przebiegają w określonym
kierunku...
• Dyfuzja w roztworach
W wyniku dyfuzji następuje ujednolicenie
składu roztworu - powstaje faza wieloskładni
- kowa wewnętrznie zrównoważona.

5
Wszystkie przemiany zachodzące w
przyrodzie przebiegają w określonym
kierunku...
• Przemiany fazowe
Stan skupienia substancji czystej zależy
od na- rzuconych układowi wartości
temperatury i ciśnienia. Zmiana wartości
np. temperatury może spowodować
spontaniczny przebieg prze- miany
fazowej - narzucenie, po ciśnieniem at-
mosferycznym, wodzie w stałym stanie
skupie- nia temperatury wyższej niż 0
o
C
spowoduje jej stopienie.

6
Wszystkie przemiany zachodzące w
przyrodzie przebiegają w określonym
kierunku...
• Reakcje chemiczne
W każdej kompletnej bilansowo mieszaninie
reagentów kierunek reakcji jest określony
przez skład początkowy mieszaniny oraz
narzucone więzy - temperaturę i ciśnienie.

7
Wszystkie przemiany zachodzące w
przyrodzie przebiegają w określonym
kierunku...
• Wykonywanie pracy mechanicznej
przeciwko siłom tarcia.
Wykonywanie pracy mechanicznej
przeciwko siłom tarcia na układzie
izolowanym adiabatycznie powoduje
wzrost jego energii wewnętrznej.

8
Wszystkie przemiany zachodzące w
przyrodzie przebiegają w określonym
kierunku...
Betty Davies -
gwiazda
Hollywoodu.
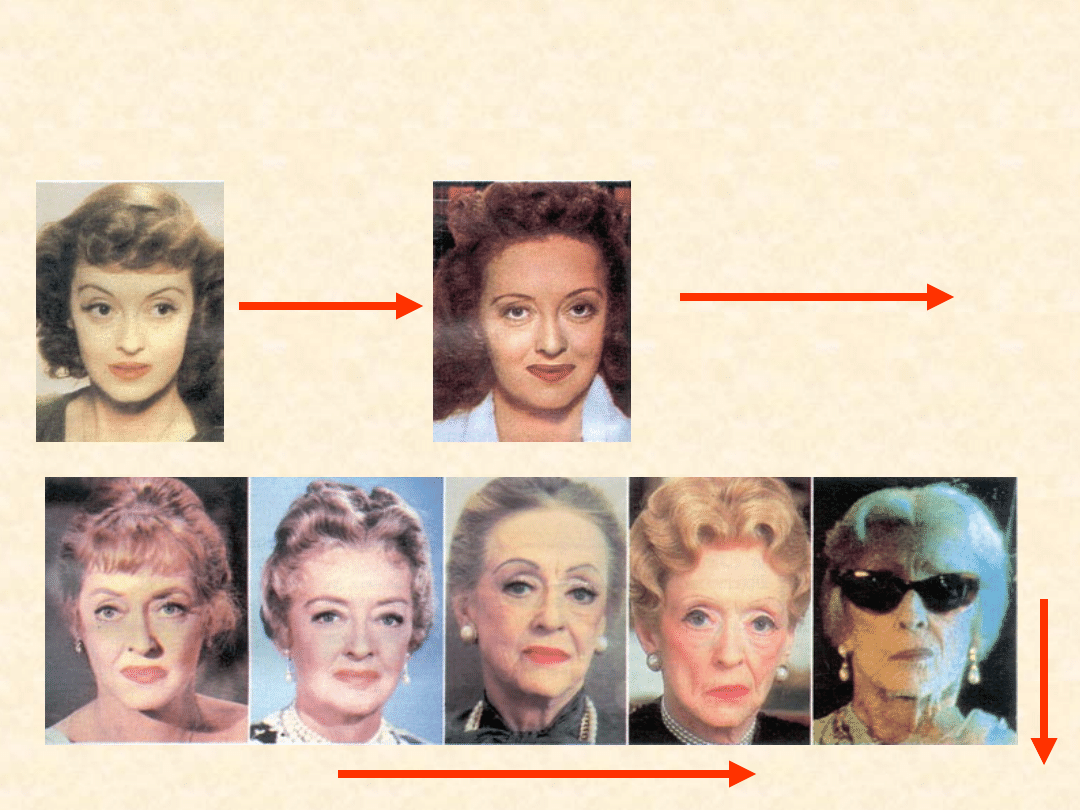
9
Wszystkie przemiany zachodzące w
przyrodzie przebiegają w określonym
kierunku...

10
Wnioski
ogólne...
• Spontaniczny przebieg jakiegokolwiek
procesu pociąga za sobą trwałe -
nieodwracalne zmiany w przyrodzie; z tego
powodu procesy przebie-gające
rzeczywiście nazywa się nieodwracal- nymi.
• Przebieg każdego procesu
nieodwracalnego wy- maga niezerowego
bodźca (gradientu tempera- tury,
stężenia...)
• ....

11
Wnioski
ogólne
• W procesie nieodwracalnym zachodzącym
ze skończoną szybkością uczestniczą fazy
wewnęt- rznie nie zrównoważone -
występują w nich różnice temperatur,
ciśnień lub stężeń.

12
Przemiana
odwracalna
• Wyobrazić sobie serię przemian
zachodzących przy coraz mniejszych
wartościach bodźców; ich granicą jest
przemiana odwracalna
- hipote- tyczny
proces przebiegający nieskończenie powoli
przy zerowych wartościach bodźców
termodynamicznych.
• uczestniczą w niej fazy wewnętrznie
zrównowa-żone, a układ i otoczenie są w
stanie równowagi
• jest to ciąg przemian elementarnych
zachodzą- cych w stanie równowagi.

13
Cel i forma uogólnienia
wniosków
• Sformułować ilościowe kryterium, na
podsta- wie którego można by
przewidywać kierunek przemian i
ewentualnie położenie stanu równo- wagi
układów.
• Rozwiązanie polega na zdefiniowaniu
kolejnej funkcji stanu -
entropii
i ujęciu
w formie pos-tulatu jej właściwości.

14
Sformułowanie II zasady
termodynamiki...
• Każdej wewnętrznie zrównoważonej fazie
przypisuje się entropię S - ekstensywną
funkcję parametrów stanu fazy
k
i
i
x
x
x
S
S
,
,
2
1
•
entropia układu jest sumą entropii faz
i
i
S
S

15
Sformułowanie II zasady
termodynamiki...
• Różniczka zupełna entropii układu jest
równa stosunkowi elementarnej ilości
ciepła wymie- nionego przez układ w
wyniku elementarnej przemiany
odwracalnej do temperatury układu
T
dQ
dS
odwr
• Zmiana entropii układu w wyniku
elementar- nego procesu spontanicznego
musi spełniać nierówność
T
dQ
dS

16
Sformułowanie II zasady
termodynamiki
•
Nierówność Clausiusa
0
T
dQ
dS
S
d
i
d
i
S - entropia wytworzona w układzie
w wyniku przebiegu elementarnej
przemiany nieodwracal- nej
• Różniczka entropii układu jest sumą udziałów
S
d
S
d
dS
i
e
T
dQ
S
d
e
Entropia przeniesiona

17
Podsumowanie II zasady
termodynamiki...
• W wyniku procesu elementarnego
entropia układu może się zmieniać z
dwóch powodów: transportu entropii
między układem i otocze- niem (d
e
S)
oraz produkcji entropii w układzie
(d
i
S).
• Produkcja entropii w wyniku przebiegu
w układzie procesu spontanicznego jest
zawsze dodatnia; proces odwracalny
nie wytwarza entropii.
• ....

18
Podsumowanie II zasady
termodynamiki...
• W przypadku układu izolowanego adiabatycz-
nie entropia przeniesiona (d
e
S) jest równa
zeru; otrzymuje się więc nierówność
0
adiab
dS
W układzie adiabatycznym możliwy jest
wyłącz- nie przebieg procesu, w wyniku
którego nastąpi wzrost jego entropii.

19
Podsumowanie II zasady
termodynamiki
• Jeżeli układ i otoczenie, określane umownie
jako "świat" uznać łącznie za izolowane adia-
batycznie, to ich sumaryczna zmiana entropii
Przebieg każdego procesu w
przyrodzie zwiększa entropię "świata".
0
otoczenie
uklad
total
dS
dS
dS

20
4.2. Molekularna
interpretacja entropii
Wykład 4

21
Energia wewnętrzna gazu
doskonałego
- suma energii
drobin
i
i
U
jadr
i
elektron
i
oscyl
i
rot
i
trans
i
i
- suma
udziałów
Każda z wymienionych form
energii drobiny jest kwantowana,
tzn. energia drobiny może mieć
jedynie wartości określane jako
kwanto- wo dozwolone poziomy
energetyczne określo- ne przez
rozwiązanie równania
Schrődingera.

22
Energia
translacji:
n
x
, n
y
, n
z
= 1,2,3, ...N - liczby kwantowe
translacji
Typowa
wartość:
Wniose
k:
2
2
2
3
2
2
8
z
y
x
trans
n
n
n
mV
h
J
10
03
1
8
40
3
2
2
,
mV
h
Typowa
wartość:
K)
(300
J
10
1
4
21
,
T
k
B
T
k
B
ij

23
Zasada ekwipartycji
energii
Jeżeli dla wszystkich, sąsiednich
poziomów energetycznych i oraz j,
spełniona jest nierów-ność
ij
<< k
B
T
to obowiązuje
zasada
ekwipartycji energii
, zgod- nie z
którą
każda składowa energii, którą
można wyrazić jako kwadratową
funkcję składowej pędu lub
położenia, wnosi do wartości
średniej energii udział równy k
B
T/2.

24
Średnia energia
translacji:
Wniose
k:
Suma trzech
składowych pędu.
T
k
B
ij
m
p
z
y
x
z
y
x
2
2
,
,
,
,
T
k
B
trans
2
3
RT
E
trans
2
3

25
Energia
rotacji:
I - moment bezwładności;
j = 1,2,3, ...N - liczba
kwantowa rotacji
Wniose
k:
Typowa
wartość:
1
1
8
2
2
j
Bj
j
j
I
h
rot
K)
(300
J
10
10
3
23
B
T
k
B
ij
Wniosek: średnia energia rotacji drobin
o budowie...
;
T
k
B
rot
RT
E
rot
liniowej
:
nieliniow
ej:
;
T
k
B
rot
2
3
RT
E
rot
2
3
26
Energia oscylacji drobiny
dwuatomowej ...
- masa zredukowana;
k - stała siłowa wiązania;
v = 0, 1, ...N - liczba kwantowa
oscylacji
Wniose
k:
Typowa
wartość:
2
1
2
v
k
h
oscyl
J
10
10
19
20
ij
K
T
T
k
B
ij
300
K
T
T
k
B
ij
2000

27
Energia oscylacji drobiny
dwuatomowej
Ponieważ energia oscylatora
harmonicznego składa się energii
kinetycznej i potencjalnej, to zgodnie z
zasadą ekwipartycji energii,
średnia
nadwyżka ener- gii oscylacji ponad
energię stanu podstawowego w
dostatecznie wysokich temperaturach
osiąga wartość
;
T
k
B
oscyl
0
RT
E
E
oscyl
0
Jeżeli
spełniona jest
nierówność
T
k
B
ij
to niemal wszystkie drobiny pozostają
w podstawo- wym stanie kwantowym
(v=0) gromadząc najmniej- szą
dozwoloną ilość energii.

28
Energia oscylacji drobiny
wieloatomowej
Jądra drobin wieloatomowych wykonują
oscylacje zmieniające zarówno długości
wiązań, jak kąty między nimi; oscylacje
drobiny n - atomowej są równoważne:
3n-5 (drobiny o budowie
liniowej)
3n-6 (drobiny o budowie
nieliniowej)
oscylacjom harmonicznym (nazywa się
je
oscylacja- mi normalnymi
). Sumuje
się udziały energetyczne wszystkich
oscylacji normalnych.

29
Energia elektronowa
drobiny
Energia elektronowa drobin jest
skwantowana za pomocą kilku liczb
kwantowych, a typowe odstępy między
sąsiednimi poziomami są rzędu 10
-19
J
(1 eV). Nawet w dosyć wysokiej
temperaturze speł- niona jest na ogół
nierówność
wskutek czego
drobiny pozostają w
podstawowym stanie elektronowym.
T
k
B
ij
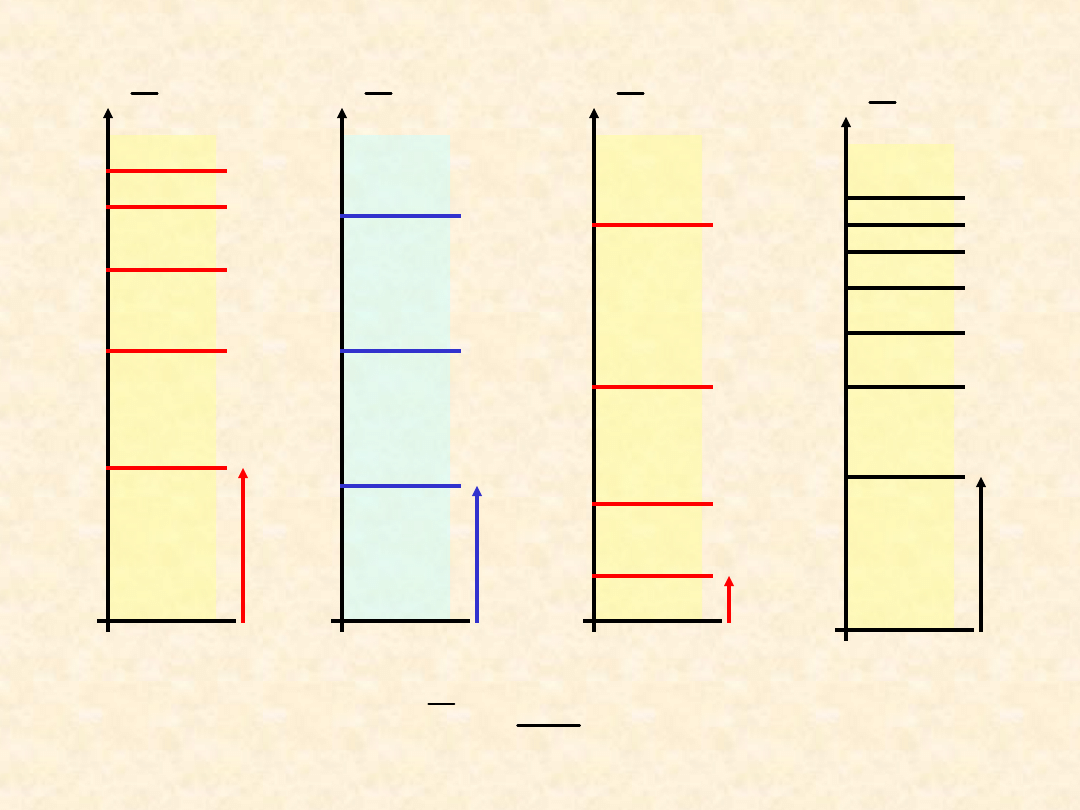
30
Schemat poziomów energetycznych drobiny dwuatomowej
~
5
0
0
0
c
m
-1
elektrono
wa
~
5
0
0
c
m
-1
oscylacyj
na
~
1
c
m
-1
rotacyjna
~
1
0
-1
7
c
m
-1
translacy
jna
hc

31
Model statystyczny
gazu
Stan kwantowy każdej drobiny jest
opisany zbiorem aktualnych wartości
liczb kwantowych (translacji, rotacji,
oscylacji i stanów elektronowych), który
ok- reśla również jej chwilowy zasób
energii. Podczas zderzeń drobiny
przekazują sobie energię; bezustan- nie
zmienia się więc stan kwantowy każdej
drobiny.
Specyfikacja chwilowych stanów
kwantowych wszy- stkich drobin
tworzących układ makroskopowy ok-
reśla chwilowy
mikrostan układu.
W
wyniku wy- miany energii między
drobinami zmienia się
również
mikrostan układu.

32
Model statystyczny gazu -
podstawowy postulat
Stan układu makroskopowego,
określony aktualny- mi wartościami
parametrów i funkcji stanu nazywa się
jego
makrostanem
. Można wykazać, że
każdy makrostan układu jest
realizowany przez wiele róż- nych
mikrostanów
Układ w stanie równowagi termicznej
może się zna- leźć z identycznym
prawdopodobieństwem w każ- dym z
dozwolonych mikrostanów.
Liczbę mikrostanów realizujących
określony makro- stan nazywa się jego
prawdopodobieństwem termo-
dynamicznym
(P) .
33
Postulat L. Boltzmanna (M. Plancka)
- związek między entropią i
prawdopodobieństwem
termodynamicznym
Entropia ma sens statystyczny - jest
miarą liczby rozróżnialnych kwantowo
sposobów podziału ener- gii między
drobinami, odpowiadających określone-
mu stanowi układu makroskopowego.
Układ izolowany dąży do stanu o
maksymalnym prawdopodobieństwie
termodynamicznym, jest on stanem
równowagi tego układu.
P
k
S
B
ln

34
4.3. Potencjały
termodynamiczne
Wykład 4

35
Procesy cykliczne
izotermiczne - problem do
rozwiązania
Dowolny układ mogący wymieniać z
otoczeniem o stałej temperaturze ciepło
(Q) oraz pracę objętościo- wą (W
obj
) i
nieobjętościową (praktycznie
elektryczną (W
elektr
) ulega wieloetapowej
przemianie cyklicznej (powraca do
stanu początkowego).
Zbadać warunki jakie muszą spełniać
sumaryczna praca i sumaryczne ciepło
wymienione między ukła- dem i
otoczeniem w wyniku izotermicznej
przemiany cyklicznej.

36
Podstawowe równanie
termodynamiczne
Połączenie nierówności Clausiusa z
bilansem energii wewnętrznej układu
daje nierówność
będącą ogólnym warunkiem który musi
spełniać każdy proces w przyrodzie
(znak równości odnosi się do
hipotetycznego procesu
odwracalnego).
0
T
dQ
dS
S
d
i
dW
dQ
dU
0
T
dW
dU
dS
(1)

37
Przekształcamy
(1)...
const
T
(5
a)
0
dW
dU
TdS
dW
TS
U
d
(2
)
Zdefiniować funkcję
stanu:
(3
)
TS
U
F
(4
)
F - energia Helmholtza; energia
swobodna
(3) + (4)
dW
dF
W
dF
F
F
F
B
A
A
B
(5b)
38
A
B
W
odwr
=
F
AB
W >
F
AB
A
C
W
2
>
F
2
B
W
3
>
F
3
W
1
>
F
1
T=con
st
Praca W przemiany
rzeczywistej...
odwr
W
W
Sumarycznie w przemianie
cyklicznej...
0
cykl
i
cykl
F
F
0
cykl
i
cykl
W
W
0
cykl
cykl
cykl
W
Q
U
0
cykl
i
cykl
Q
Q

39
Wniose
k:
W wyniku każdej rzeczywistej
izotermicznej przemiany cyklicznej
układ musi pobrać wypadko- wo
energię na sposób pracy i oddać
równoważną ilość energii na sposób
ciepła; nie jest natomiast możliwy
odwrotny kierunek przekazywania
energii.
W wyniku każdej rzeczywistej
izotermicznej cyklicznej przemiany
izotermicznej energia pobrana przez
układ na sposób pracy zostaje
nieodwracalnie przekazana otoczeniu
na sposób ciepła - zjawisko to nazywa
się obrazowo
degradacją pracy
.

40
Kryteria spontaniczności przemian -
problem do rozwiązania
Dany jest układ nie elektrochemiczny (W =
W
obj
) na który narzucono określone więzy.
Sformułować kryterium pozwalające
określić:
•Czy pomyślana przemiana od stanu A do
stanu B jest spontaniczna ?
•Jakie będą wartości parametrów w stanie
równo- wagi układu ?
Rozwiązanie polega na odpowiednim
przekształce- niu nierówności
Clausiusa (1) - ogólnego kryterium
spontaniczności przemian.

41
Przemiany izotermiczno-izochoryczne
(T,V = const)
Energia swobodna układu nie
elektrochemicznego maleje w wyniku
każdej przemiany spontanicznej
zachodzącej w warunkach T,V = const;
w stanie równowagi osiąga więc kres
dolny dostępny z zada- nych warunków
początkowych.
PdV
dW
dW
obj
dW
dF
(5a
)
PdV
dF
(6
)
const
V
0
dF
(7
)

42
Przemiany izotermiczno-izobaryczne
(T,P = const) ...
(6
)
VdP
dG
(8
)
const
P
0
dG
(9
)
Zdefiniować funkcję
stanu:
TS
H
G
G - energia Gibbsa; entalpia
swobodna
PV
F
TS
PV
U
G
VdP
PdV
dG
dF
PdV
dF
(10
)

43
Przemiany izotermiczno-izobaryczne
(T,P = const) ...
Entalpia swobodna układu nie
elektrochemicznego maleje w wyniku
każdej przemiany spontanicznej
zachodzącej w warunkach T,P = const;
w stanie równowagi osiąga więc kres
dolny dostępny z zada- nych warunków
początkowych.
Analogiczni
e:
S,V =
const.
S,P =
const.
0
dH
0
dU

44
W ięz y
P o ten cjał term o d y n am i c zn y
( fu n k c ja ch arak tery sty c z n a)
W aru n ek
sp o n tan ic z n ośc i
T , V = c o n st.
F = U - T S
d F < 0
T , P = c o n st.
G = H - T S
d G < 0
S , V = co n st.
U
d U < 0
S , P = c o n st.
H
d H < 0
Funkcje których wartość maleje w wyniku
spontanicz- nej przemiany układu przy
narzuconych mu więzach (x,y = const) i w
stanie równowagi osiąga kres dolny
nazywa się
potencjałami
termodynamicznymi
lub
funkcjami
charakterystycznymi zmiennych x, y.
45
Zastosowanie potencjałów
termodynamicznych jako kryterium
spontaniczności przemiany
Np. więzy T,P =
const.
Hipotetyczna
przemiana
odwracalna w
stanie równowagi
G=G
B
- G
A
< 0
A
B
G
B
G
A
G
A
>
G
B
G=G
B
- G
A
= 0
A
B
G
B
G
A
G
A
=
G
B
Przemiana
spontanicz
na

46
4.4. Związki między
funkcjami
termodynamicznymi
Wykład 4

47
Elementarna przemiana odwracalna
fazy o stałym składzie (substancja
czysta lub roztwór)
Zadanie:
Znaleźć ogólne relacje matematyczne wiążące
zdefiniowane funkcje stanu (U, H, S, G, F)
oraz ich pierwsze i drugie pochodne
cząstkowe)
pdV
dW
TdS
dQ
Y
X
f
Z
,
patrz W_01 (reguła Duhema)

48
U = U(S,V)
dV
V
U
dS
S
U
V
S
dU
S
V
,
PdV
TdS
dW
dQ
V
S
dU
,
V
S
S
V
V
U
S
S
U
V
P
V
U
S
T
S
U
V
V
S
S
P
V
T
(13)
(12
)
(1
1)
49
H = H(S,P)
dP
P
H
dS
S
H
P
S
dH
S
P
,
VdP
TdS
PV
d
dU
P
S
dH
,
P
S
S
P
P
H
S
S
H
P
V
P
H
S
T
S
H
P
P
S
S
V
P
T
(16)
(15)
(14)

50
F = F(T,V)
dV
V
F
dT
T
F
V
T
dF
T
V
,
PdV
SdT
TS
d
dU
V
T
dF
,
V
T
T
V
V
F
T
T
F
V
P
V
F
T
S
T
F
V
V
T
T
P
V
S
(19)
(18)
(17)
51
G = G(T,P)
dP
P
G
dT
T
G
P
T
dG
T
P
,
VdP
SdT
PV
d
dF
P
T
dG
,
P
T
T
P
P
G
T
T
G
P
V
P
G
T
S
T
G
P
P
T
T
V
P
S
(22)
(21)
(20)
52
F
T
V
S
P
H
G
U
Kwadrat
termodynamiczny
53
Relacje Maxwella -
zestawienie
S
V
T
V
P
S
V
T
T
P
V
S
S
P
T
P
V
S
P
T
T
V
P
S

54
Równania Gibbsa -
Helmholtza
(23
)
V
T
F
T
U
F
TS
U
F
TS
H
G
P
T
G
T
H
G
(24
)
55
Termodynamiczne równania
stanu (I/II)
(26
)
TS
U
F
T
T
T
V
S
T
V
F
V
U
V
T
T
P
T
P
V
U
(25
)
TS
H
G
T
T
T
P
S
T
P
G
P
H
P
T
T
V
T
V
P
H
56
Entropia
V
V
V
T
U
U
S
T
S
P
P
P
T
H
H
S
T
S
T
C
T
S
V
V
T
C
T
S
P
P
(27
)
(28
)

57
Pojemność cieplna
(29
)
(30
)
P
T
T
P
T
P
P
H
T
T
H
P
P
C
P
P
P
T
P
T
V
T
T
V
T
V
T
P
C
2
2
V
T
T
V
T
V
V
U
T
T
UH
V
V
C
V
V
V
T
V
T
P
T
T
P
T
P
T
V
C
2
2
58
P
P
H
A
C
B
P
V
B’
B
A
V
B’
V
A/B
P
B
P
A
H
V
H
p
H
T
Równanie Mayera (C
P
- C
V
)...

59
Równanie Mayera...
(31
)
T
P
V
dH
dH
dH
VdP
dT
C
VdP
dU
dH
V
V
V
dT
C
dH
P
P
dP
T
V
T
V
dP
P
H
dH
P
T
T
dP
T
V
T
dT
C
C
P
V
P
V
P
V
P
T
P
T
V
T
C
C

60
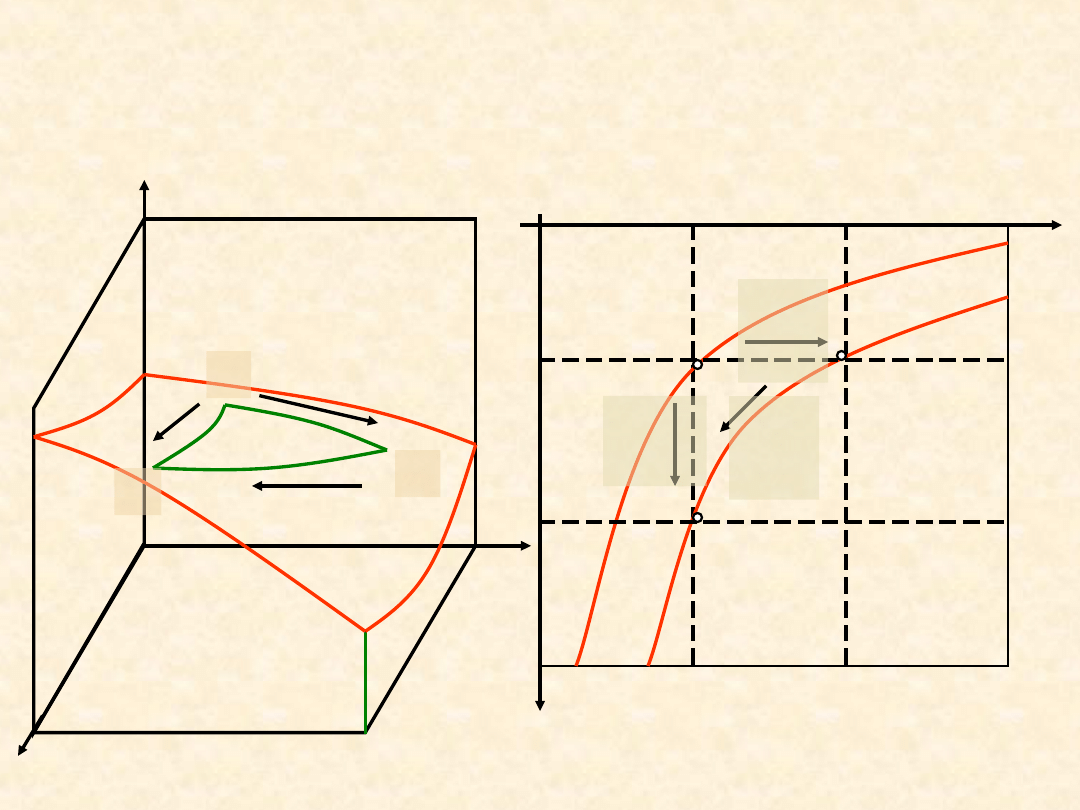
Druga zasada termodynamiki –
pierwsze prawo wszystkich
Nauk.
A. Einstein, (1879 –1955),
fizyk niemiecki
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
Wyszukiwarka
Podobne podstrony:
Pierwsza i druga zasada termodynamiki (entropia, zjawiska odwracalne)
Ściągi z fizyki-2003 r, Druga zasada dynamiki Newtona
2 4 druga zasada termodynamiki
druga zasada id 142854 Nieznany
03 Druga zasada dynamiki & Rown Nieznany (2)
Druga zasada dynamiki Newtona i Nieznany
Pierwsza i druga zasada termodynamiki (entropia, zjawiska odwracalne)
Wykład z temodynamiki druga zasada
Druga zasada termodynamiki
Pierwsza i druga zasada termodynamiki (entropia, zjawiska odwracalne)
Wyklad 14 druga zasada termodynamiki
zasada termodynamiki druga
zasada termodynamiki(druga)
5 DRUGA I TRZECIA ZASADA TERMODYNAMIKI
więcej podobnych podstron