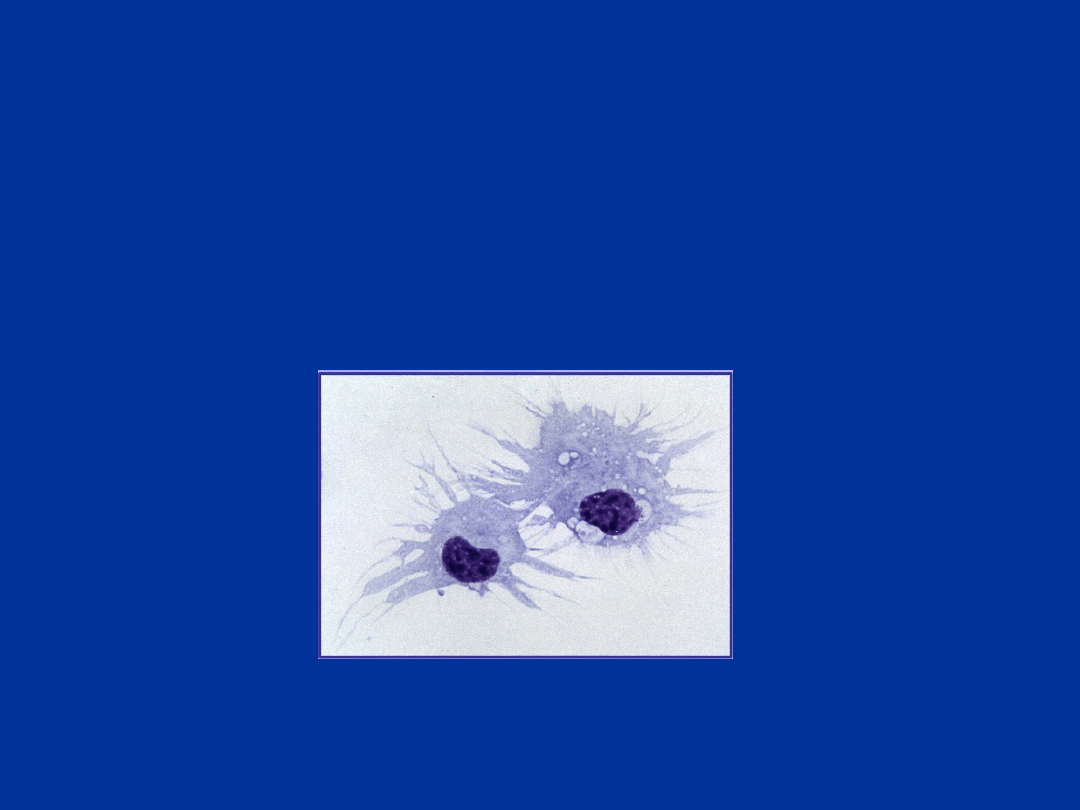
Komórki dendrytyczne –
subpopulacje i
oznaczanie za pomoca
cytometrii przepływowej
dr n. med. Jacek Tabarkiewicz
(tabar@mp.pl)

KOMÓRKI
DENDRYTYCZNE
Profesjonalne komórki prezentujące antygen,
rozmieszczone
w większości tkanek organizmu
Zaangażowane w większość oddziaływań
miedzykomórkowych
• rozpoczynają odpowiedź komórkową, stymulując
limfocyty T pomocnicze i cytotoksyczne
• pobudzają odpowiedź humoralną i produkcję
przeciwciał
• wspomagają funkcję komórek odporności nieswoistej
• zapewniają tolerancję immunologiczną
Scharakteryzowane na podstawie kształtu,
lokalizacji,
panelu antygenów powierzchniowych oraz cech
funkcjonalnych,
Odkryte w 1868 r. przez Langerhansa na podstawie
reakcji z solami złota

WĘDRÓWKA KOMÓREK DENDRYTYCZNYCH W
LUDZKIM ORGANIZMIE
SZPIK
KOSTNY
PREKURSORY
TKANKI
NIEDOJRZAŁE DCs - „wartownicy
spokoju immunologicznego”
NACZYNIA
LIMFATYCZNE
DOPROWADZAJĄCE
DOJRZEWAJĄCE DCs
po kontakcie z antygenem
NARZĄDY LIMFATYCZNE
DOJRZAŁE DCs
KRĄŻENIE
KREW
PREKURSORY -
NIEDOJRZAŁE
MIELO-
I LIMFOIDALNE
DCs
SZPIK
KOSTNY
HSC
(HEMATOPOETYCZNA
KOMÓRKA PNIA)
CMP
(common mieloid
progenitor)
CLP
(common lymphoid
progenitor)
CD34, CD45RA, CD10,
IL7R
CD34, CD33, CD11c
MIELOIDALNE
DCs
LIMFOIDALNE
DCs
KRĄŻENIE

CD1c -
CD4 +
CD11c -
CD33 -
CD45RA +
CD123(IL-3R)
+
BDCA2 +
BDCA4 +
BDCA3 –
CMRF58 –
CD1c -
CD4 +/-
CD11c +/-
CD33 +/-
CD45RA -
CD123(IL-3R) -
BDCA2 –
BDCA4 –
BDCA3 +
CMRF58 +
CD1c +
CD4 +/-
CD11c +
CD33 +
CD45RA -
CD123(IL-3R) -
BDCA2 –
BDCA4 –
BDCA3 –
CMRF58 –
Immunofenoty
p
Limfoidalne/
plazmocytoidal
ne
Mieloidalne
Mieloidalne
Immunology Today Vol.21 No. 9 Sep. 2000
Subpopulacje a
immunofenotyp komórek
dendrytycznych

Subpopulacje a immunofenotyp
komórek dendrytycznych
wydzielanie IL-12++++
wydzielanie IL-10 +/-
stymulacja CD4 ++++
stymulacja CD8 ++++
interakcja z limfocytami B +
Wydzielanie IL-12++++
wydzielanie IL-10++++
stymulacja CD4 ++++
stymulacja CD8 +++
interakcja z limfocytami B ++++
wydzielanie IL-12 +/-
wydzielanie IL-10 -
stymulacja CD4 ++
stymulacja CD8 ++
interakcja z limfocytami B ?
Funkcja
strefy grasiczozależne węzłów
chłonnych,
prekursory we krwi,
niedojrzałe komórki w
epithelium
w narządach limfatycznych w obszarach
zajmowanych przez limfocyty T i ośrodkach
rozmnażania (GCDCs),
prekusory we krwi,
niedojrzałe komórki w miąższu różnych
narządów (płuca, serce, nerki)
w narządach limfatycznych w
obszarach zajmowanych przez
limfocyty T,
prekusory we krwi
Lokalizacja
CD11c+
IL3R-
MHC-II+
CD11b+
CD13+
CD33+
CD4+
CD1a+
CD86+
CD40+
DC-LAMP+
ziarnistości Birbecka+
langeryna+
CD11c+
IL3R-
MHC-II+
CD11b+
CD13+
CD33+
CD4+
CD1a-
CD86+
CD40+
DC-LAMP+
Ziarnistości Birbecka-
langeryna-
CD11c-
IL3R+
MHC-II+
CD11b-
CD13-
CD33-
CD4++
CD1a-
CD86+
CD40+
DC-LAMP+
ziarnistości Birbecka-
langeryna-
Fenotyp dojrzałych
komórek
dendrytycznych
-
-
++++
Produkcja IFNα
przez krążące
prekursory
CD11c+,CD1a+, IL3R-
CD11c+CD1a+IL3R-
CD11c-CD1a-IL3R+(CD123+)
Fenotyp krążących
komórek
prekursorowych
Pochodzące z LC
Intersticjalne
Mieloidalne komórki dendrytyczne
Limfoidalne
komórki
dendrytyczne
TRENDS in Immunology Vol.22 No. 1 jan. 2001

PREKURSOR
Y SZPIKOWE
NIEDOJRZAŁE
DCs
FcγRI
FcγRII
CD68
CCR1
CCR4
CCR5
CXCR4
WELONOWATE
DCs
CD80
CD83
CD86
CCR7
DOJRZAŁE
DCs
CD54, CD58
CD80, CD86
CD83, CD40L
DC-LAMP
CCR7
ZMIANA FENOTYPU KOMÓREK
DENDRYTYCZNYCH W TRAKCIE DOJRZEWANIA

Metoda oznaczanie komórek
dendrytycznych jako komórki
Lin-/CD11c+/HLA-DR+
lub
Lin-/CD123+/HLA-DR+
• Stosujemy koktajl następujących przeciwciał
sprzężonych z FITC: CD3, CD14, CD16, CD19,
CD20, CD56 – które znakują nam limfocyty,
monocyty, neutrofile i eozynofile – komórki
Lin+
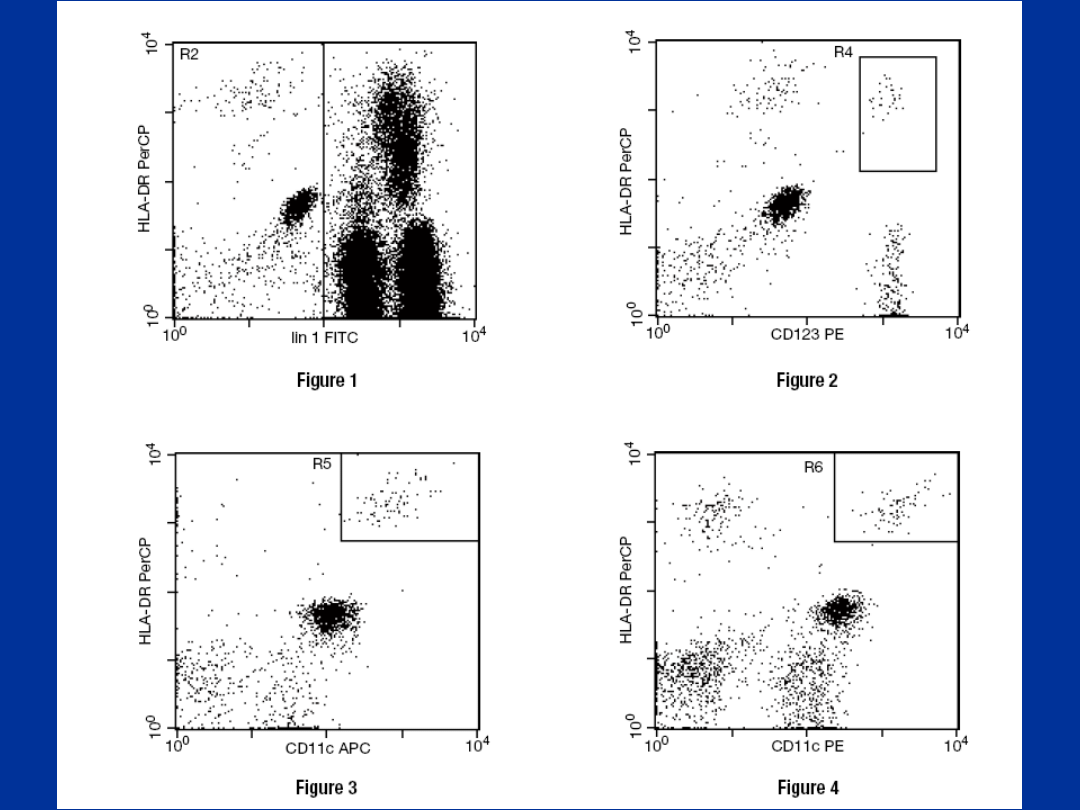

Metoda z użyciem koktajlu przeciwciał
monoklonalnych
• 1. Dla oznaczenia mieloidalnych DC używa się
przeciwciał monoklonalnych: anty-CD14, anty-
CD16 FITC, anty-CD33 PE oraz anty-HLA-DR
CyChrome. Za mieloidalne komórki dendrytyczne
uznaje się komórki o immunofenotypie CD14-,
CD16-/CD33+, HLA-DR+.
• 2. Dla oznaczenia limfoidalnych DC używa się
przeciwciał monoklonalnych: anty-CD3, anty-
CD11c, anty-CD14, anty-CD16, anty-CD19 FITC,
anty-CD4 PE oraz anty-HLA-DR CyChrome. Za
limfoidalne DC uznaje się komórki o
immunofenotypie CD3-, CD11c-, CD14-, CD16-,
CD19-/CD4+, HLA-DR+
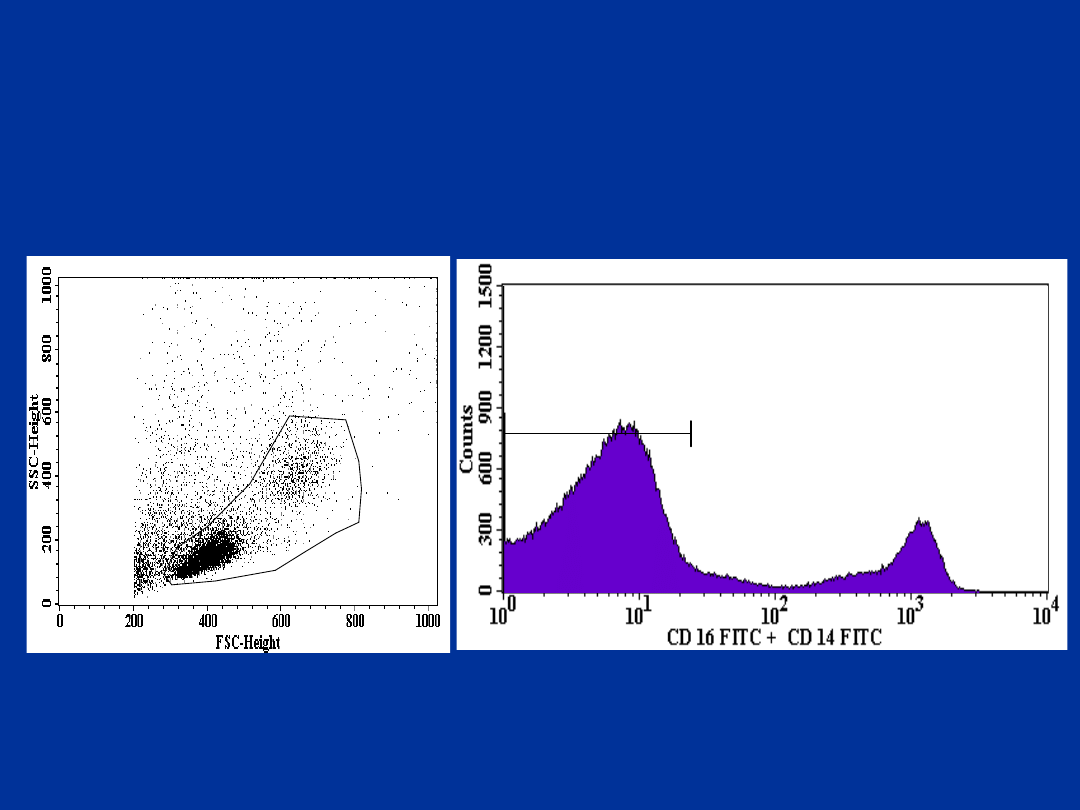
Mieloidalne DC:
CD16-,CD14-/CD33+,HLA-DR+
R1
R2
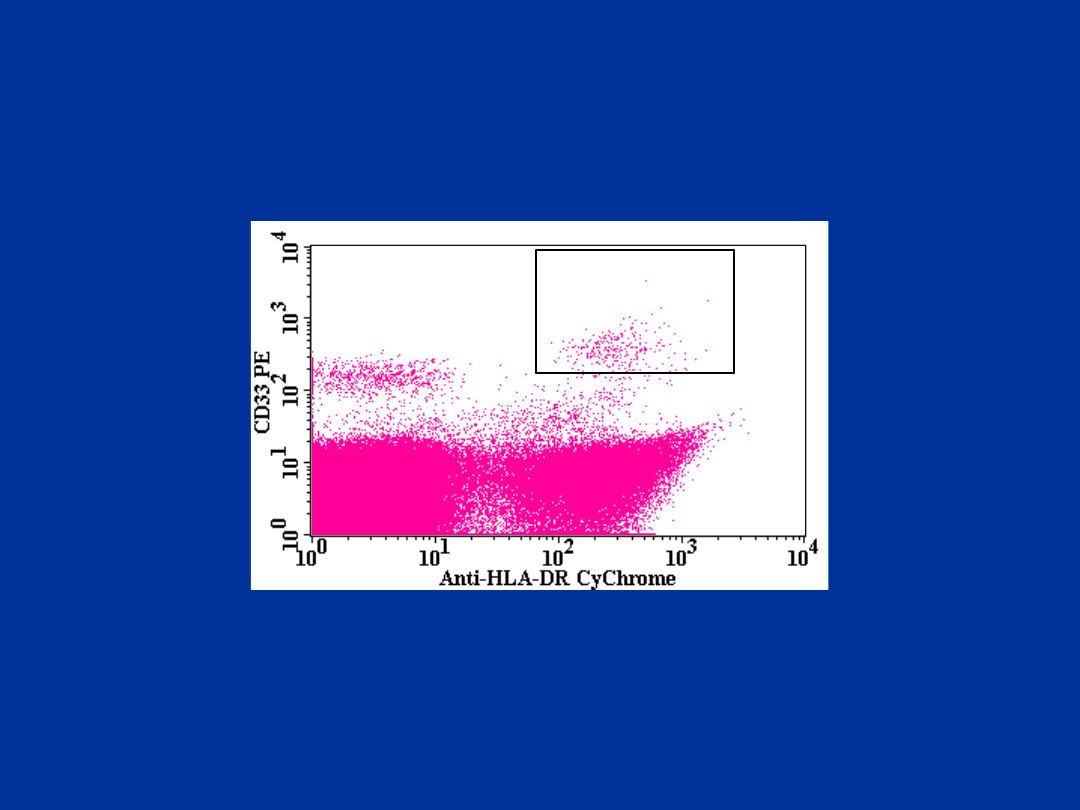
Mieloidalne DC:
CD16-,CD14-/CD33+/HLA-DR+
R3
R3=0.18%
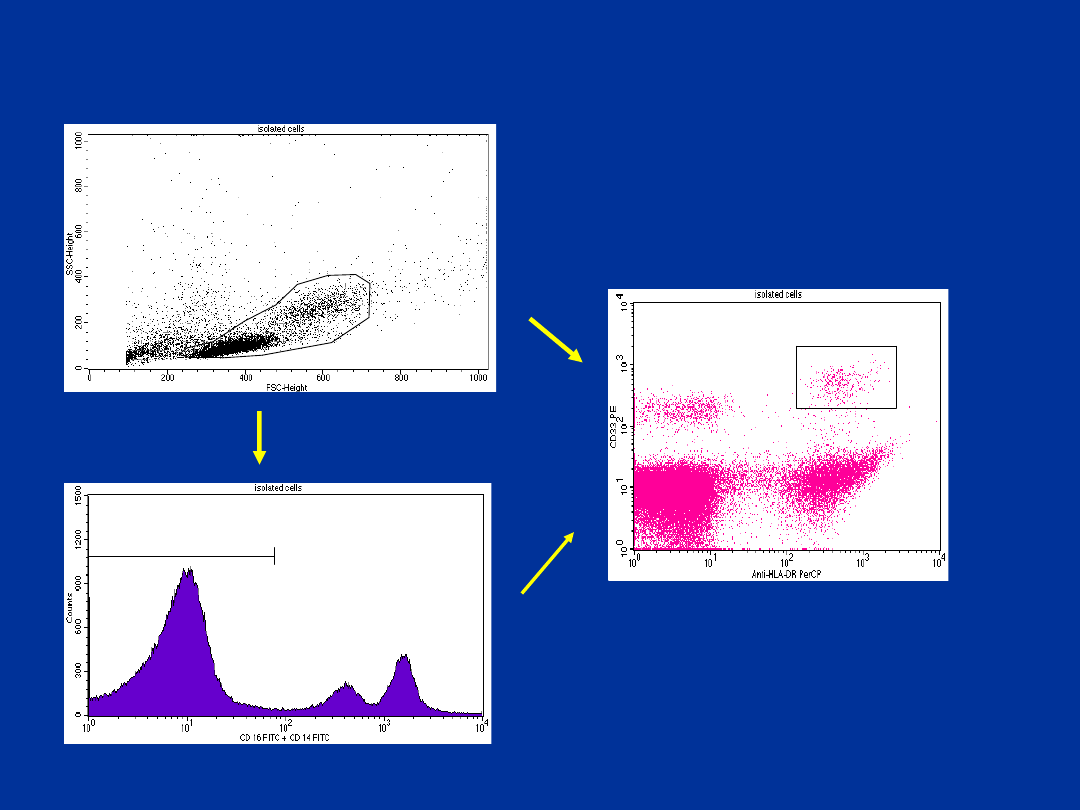
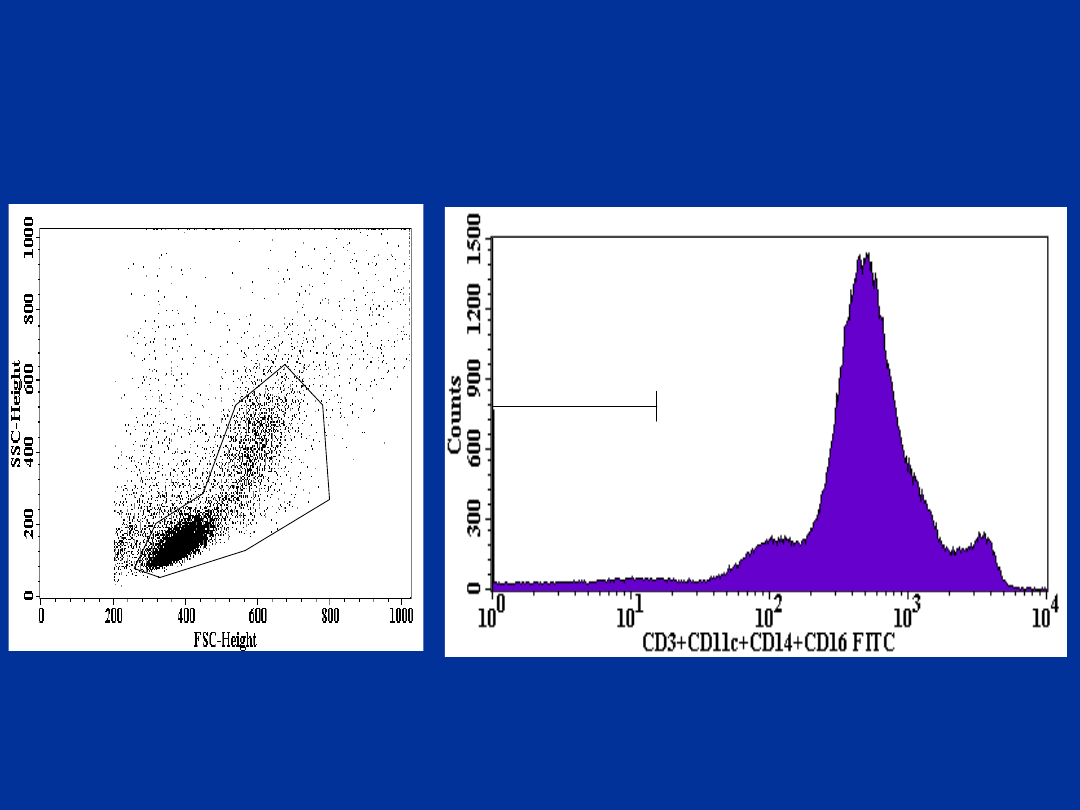
R1
R2
R3
Limfoidalne DC:
CD3-,CD11c-,CD14-,CD16-,CD19-/CD4+/HLA-
DR+
R1
R2
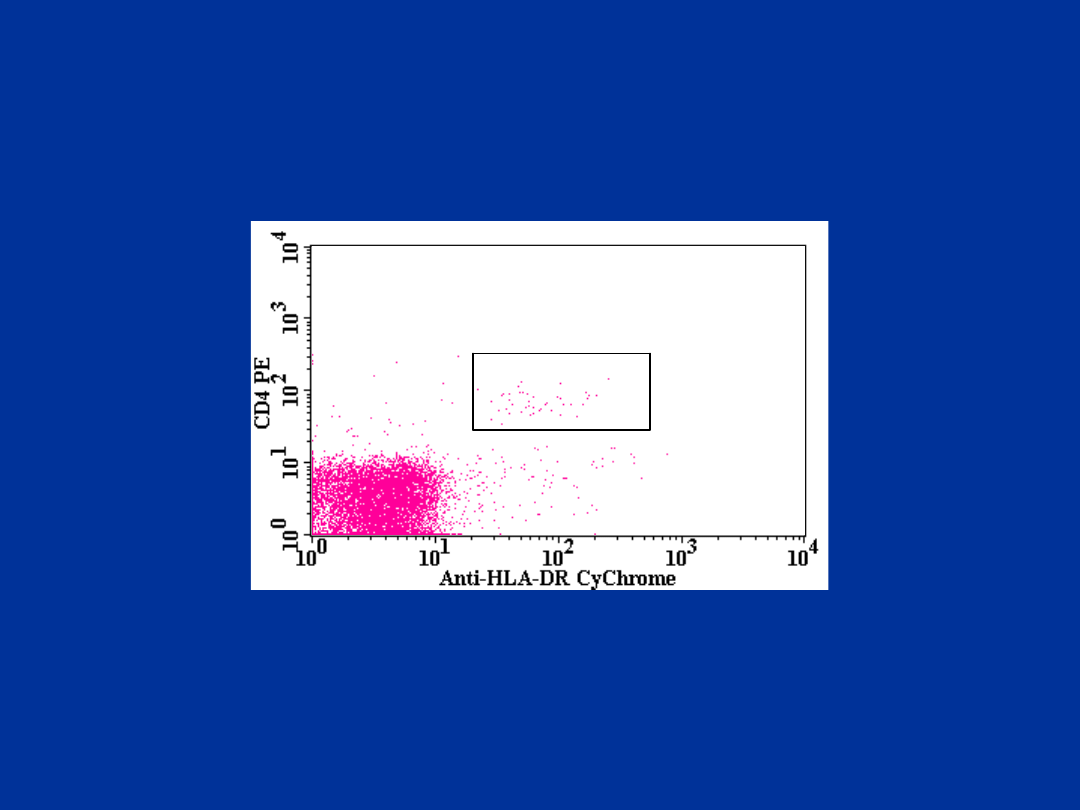
Limfoidalne DC:
CD3-,CD11c-,CD14-,CD16-,CD19-/CD4+,HLA-
DR+
R3
R3=0.10%

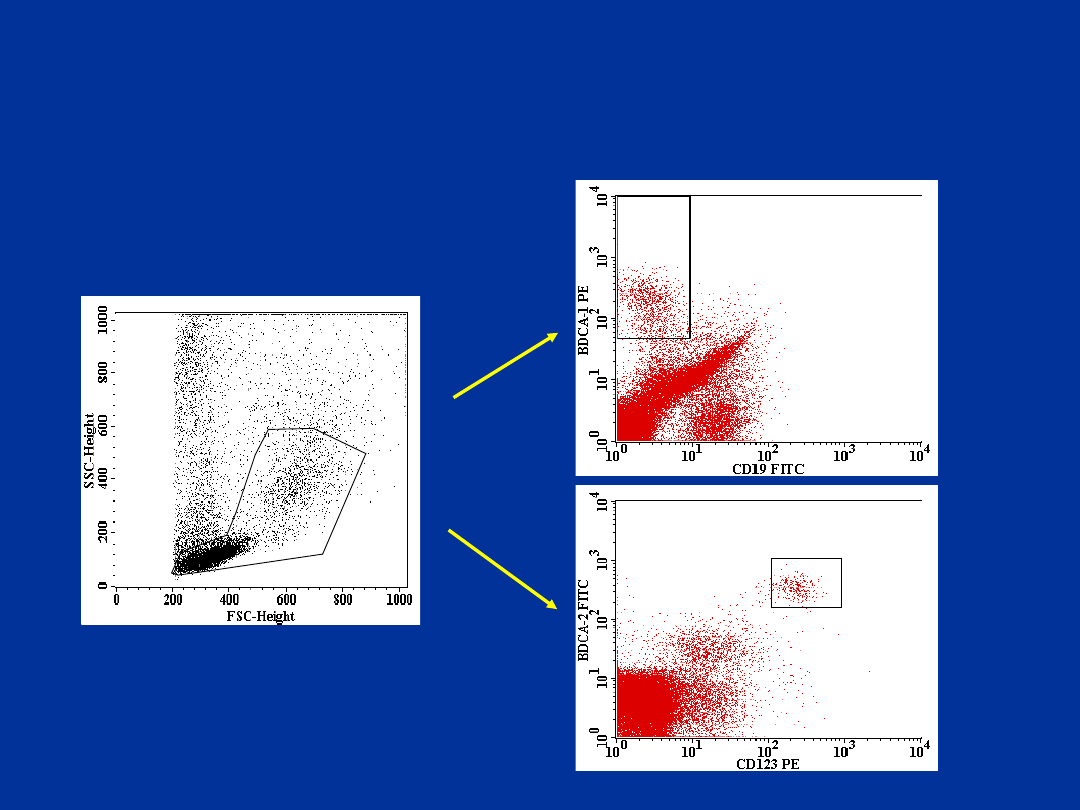
Oznaczanie krążących komórek
dendrytycznych za pomocą przeciwciał
anty-BDCA
firmy Miltenyi Biotec
Do
oznaczenia
komórek
dendrytycznych
lini
mieloidalnej używa się przeciwciał anty-CD19 i anty-
BDCA-1 (CD1c). Komórki o immunofenotypie
CD19- i BDCA-1+ odpowiadają mieloidalnym DC.
Komórki
BDCA-1+
wykazujà
ekspresję
nastepujących antygenów: CD4+, Lin-, CD11c
bright
,
CD123
dim
, CD45RO+, CD2+, CD13+, CD33+, CD32+,
CD64+ oraz HLA-DR+.
Stanowią średnio ok. 0,3% leukocytów krwi
obwodowej.

Oznaczanie krążących komórek
dendrytycznych za pomocą przeciwciał
anty-BDCA
firmy Miltenyi Biotec
Do oznaczenia komórek dendrytycznych linii
limfoidalnej/plazmacytoidalnej
używa
się
przeciwciał anty BDCA-2 (CD303) i CD123.
Limfoidalnym
DC
odpowiadają
komórki
o
immunofenotypie BDCA-2+ i CD123+. Komórki
BDCA-2+ wykazują ekspresję CD4+, Lin-, CD11c-,
CD123
bright
, CD45RA+, CD2-,CD13-, CD33-, CD32-,
CD64- oraz HLA-DR+
Stanowią średnio ok. 0,4% leukocytów krwi
obwodowej.

Oznaczanie krążących komórek
dendrytycznych za pomocą przeciwciał
anty-BDCA
firmy Miltenyi Biotec
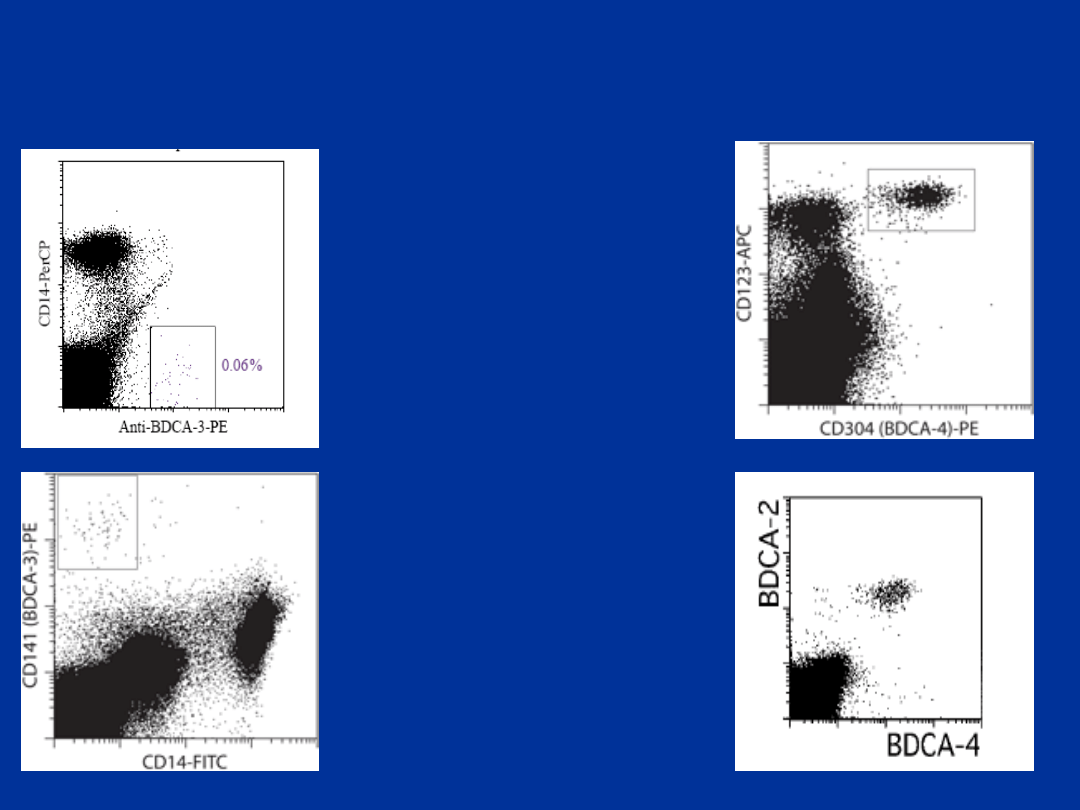
Do oznaczenia kolejnej subpopulacji komórek
dendrytycznych linii mieloidalnej można użyć
przeciwciał anty BDCA-3 i CD14 PE. Komórki te
wykazują następujący immunofenotyp CD4+, Lin-,
CD11c dim, CD123-, CD45RO+ and CD2-, CD13,
CD33. Nie wykazują ekspresji receptorów Fc:
CD32, CD64 i FcεRI.
BDCA-3 może występować w niskiej ekspresji na
monocytach, plazmocytoidalnych DC: BDCA-2+
BDCA-4+ i także komórkach CD1c (BDCA-1)+.
Stanowią średnio ok. 0,02% leukocytów krwi
obwodowej.

Oznaczanie krążących komórek
dendrytycznych za pomocą przeciwciał
anty-BDCA
firmy Miltenyi Biotec
Do oznaczenia kolejnej subpopulacji komórek
dendrytycznych linii limfoidalnej można użyć
przeciwciał anty BDCA-4 (CD304/Neuropilin-1)
FITC i CD123 PE. Odpowiadają komórki o
immunofenotypie BDCA-4+ i CD123+. Komórki
BDCA-4+ wykazują immunofenotyp: CD4+, Lin-,
CD11c-, CD123bright, CD45RA+, CD2-, łańcuch α
pre-TCR i BDCA-2+.
Ich ilość we krwi obwodowej jest zbliżona do
komórek BDCA-2+ (CD303)+.
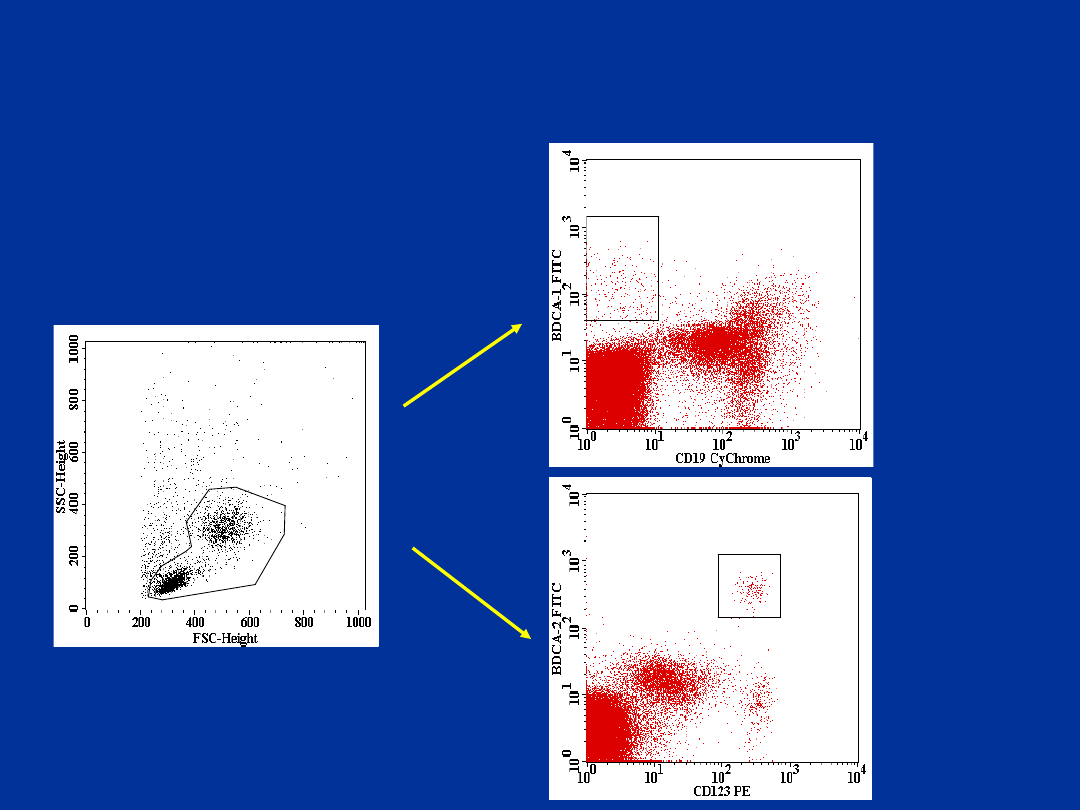
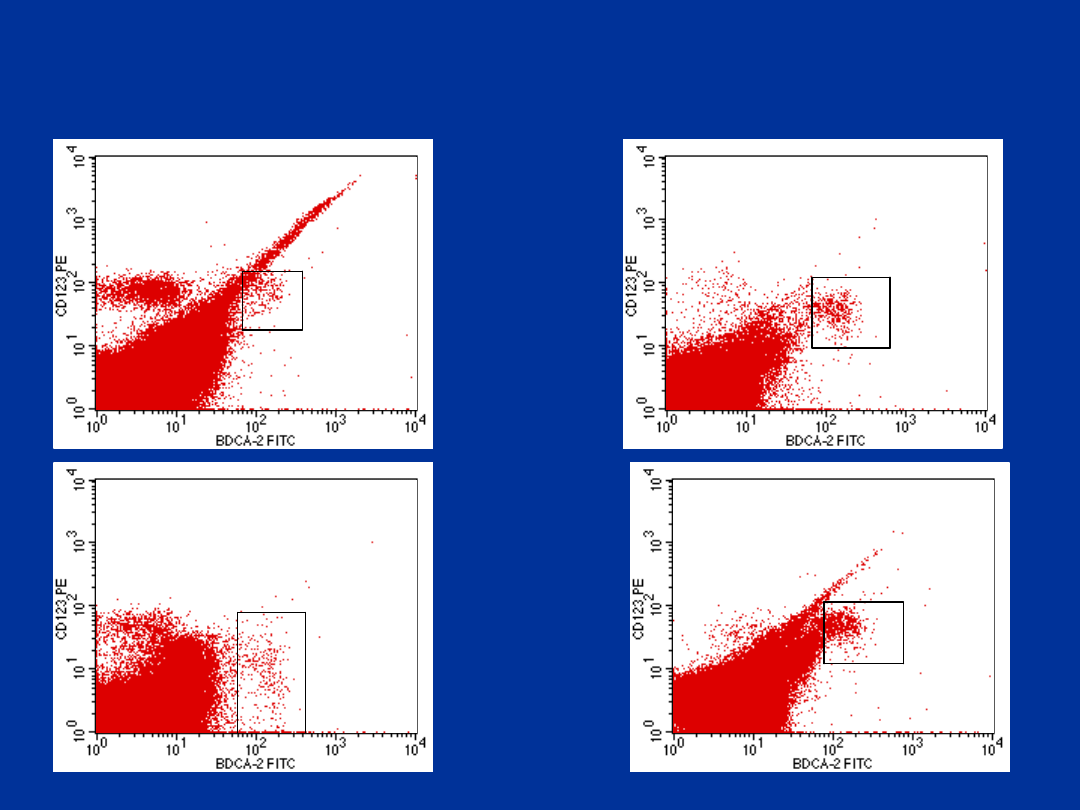
BDCA1+\CD19- i BDCA-2+\CD123+
komórki dendrytyczne – krew
obwodowa
R1
R2
R2
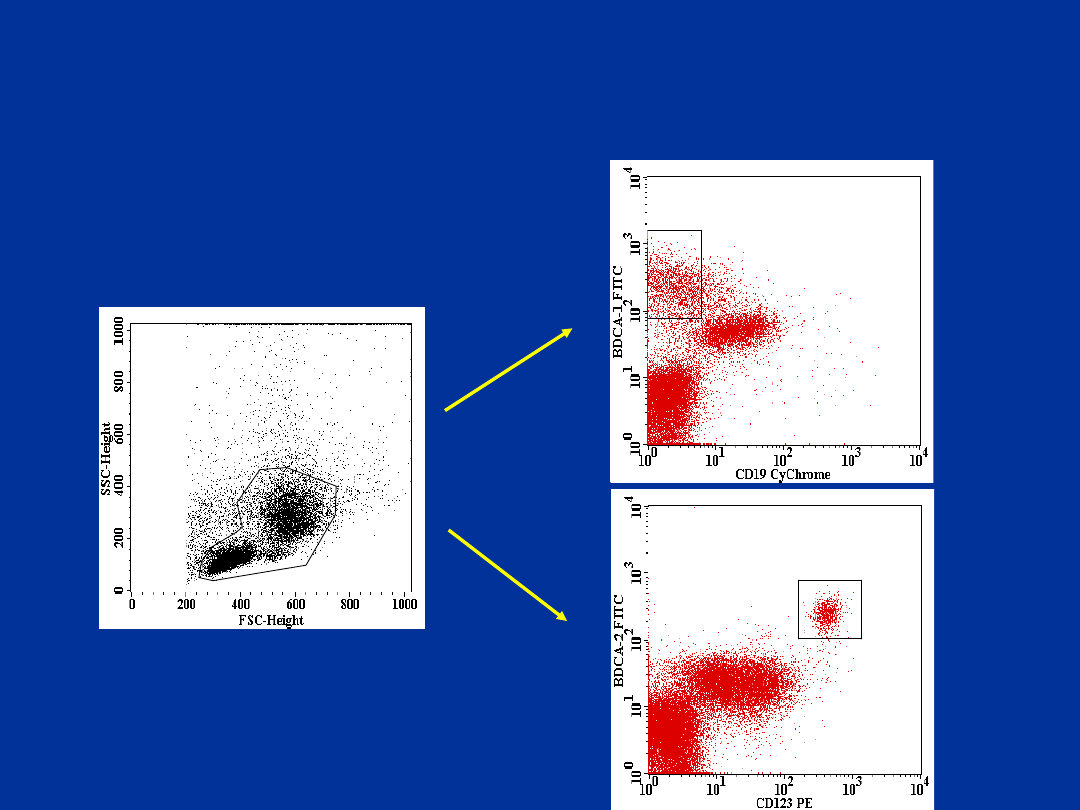
R1
R2
R2
BDCA1+\CD19- i BDCA-2+\CD123+
komórki dendrytyczne – zapalny płyn
stawowy (MIZS)
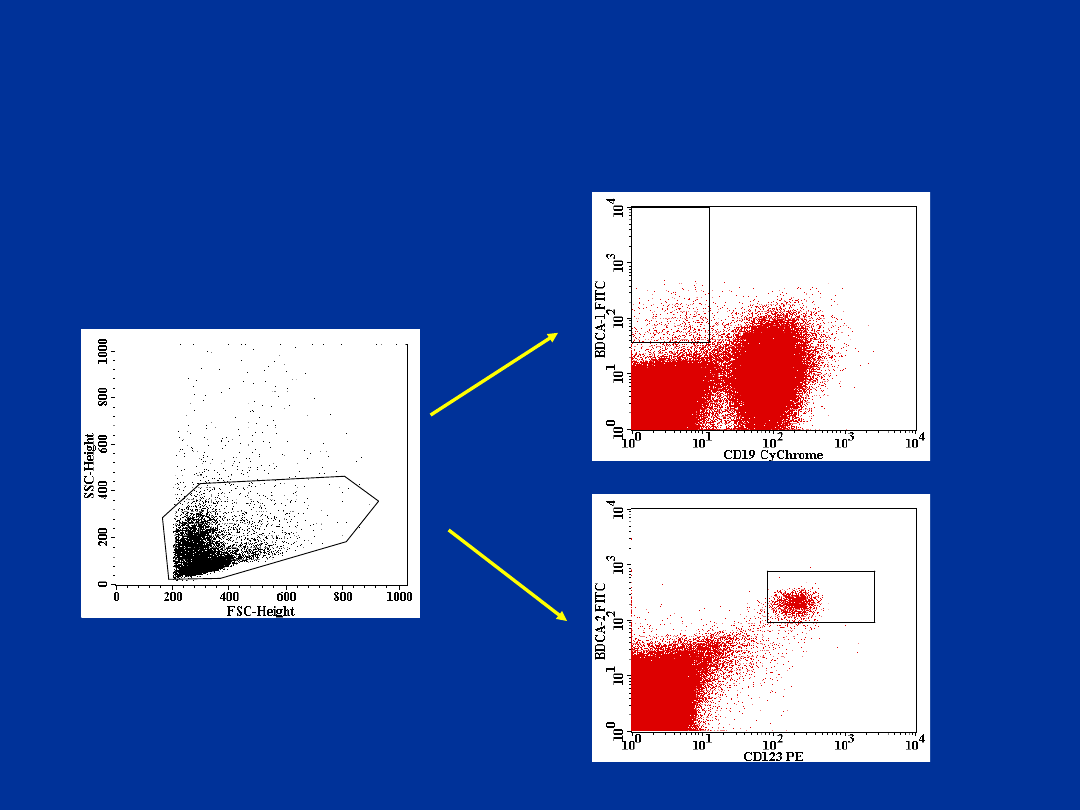
BDCA1+\CD19- i BDCA-2+\CD123+
komórki dendrytyczne – przerzutowe węzły
chlonne (rak płuca)
R1
R2
R2
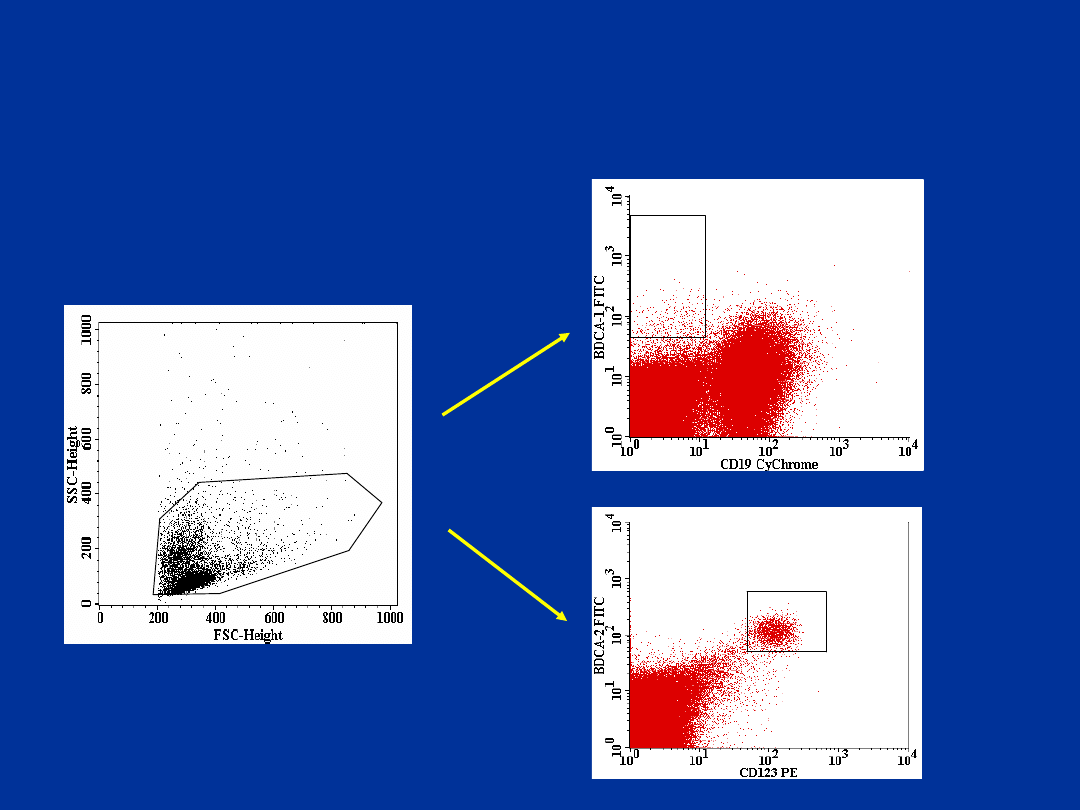
BDCA1+\CD19- i BDCA-2+\CD123+
komórki dendrytyczne – tkanka
nowotworowa
(rak płuca)
R1
R2
R2
BDCA1+\CD19- i BDCA-2+\CD123+
komórki dendrytyczne – płyn opłucnowy
(rak płuca z przerzutami do opłucnej)
R1
R2
R2
BDCA3+\CD14- i BDCA-4+\CD123+ komórki
dendrytyczne krew obwodowa
R2
R2
R2
R2
Problemy z interpretacją wyników

Kliniczne zastosowanie szczepionek z
DCs
Nowotwór Ilość prób klinicznych
Chłoniak
2
Szpiczak
9
Białaczki
8
Czerniak
21
R. piersi
12
R. jajowodu
1
R. pęcherza
1
R. pęcherza
26
R. nerki
18
Guzy z ekspresją CEA 1
R. przytarczyc
1
R. tarczycy
3
R. przełyku
1
R. żołądka
2
R. j. cienkiego
2
R. j. grubego
10
R. wątroby
4
R. płuca
7
R. trzustki
8
Nowotwory U.N.
11
R. Nosogardzieli
1
Różne
2
HIV
4
HBV
1

Wykorzystanie szczepionek z
DCs w innych schorzeniach
Choroby autoimmunizacyjne
Infekcje wirusowe
Infekcje bakteryjne
Choroby pasożytnicze
Choroby alergiczne

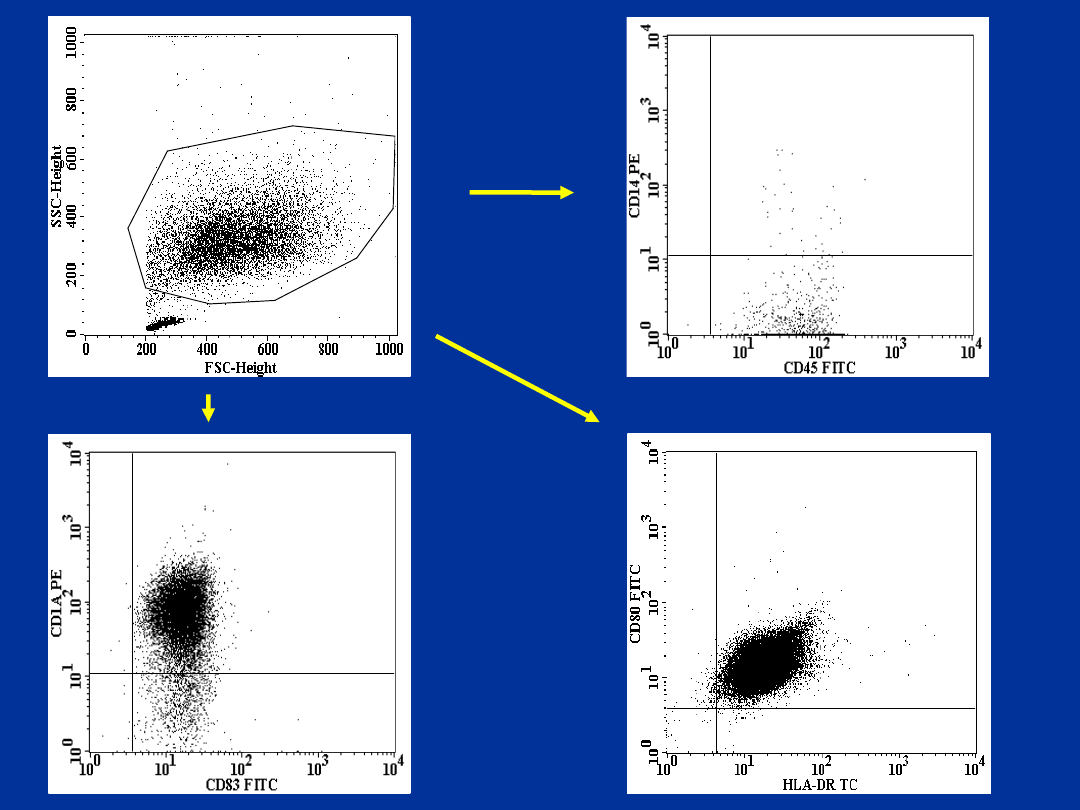
W immunoterapii używamy najczęściej
komórek dendrytycznych wygenerowanych
z monocytów krwi obwodowej.
Do ich immunofenotypowania używamy
najczęściej przeciwciał anty: CD14, CD45,
CD1a, CD83, CD80, CD86, HLA-DR.
R2
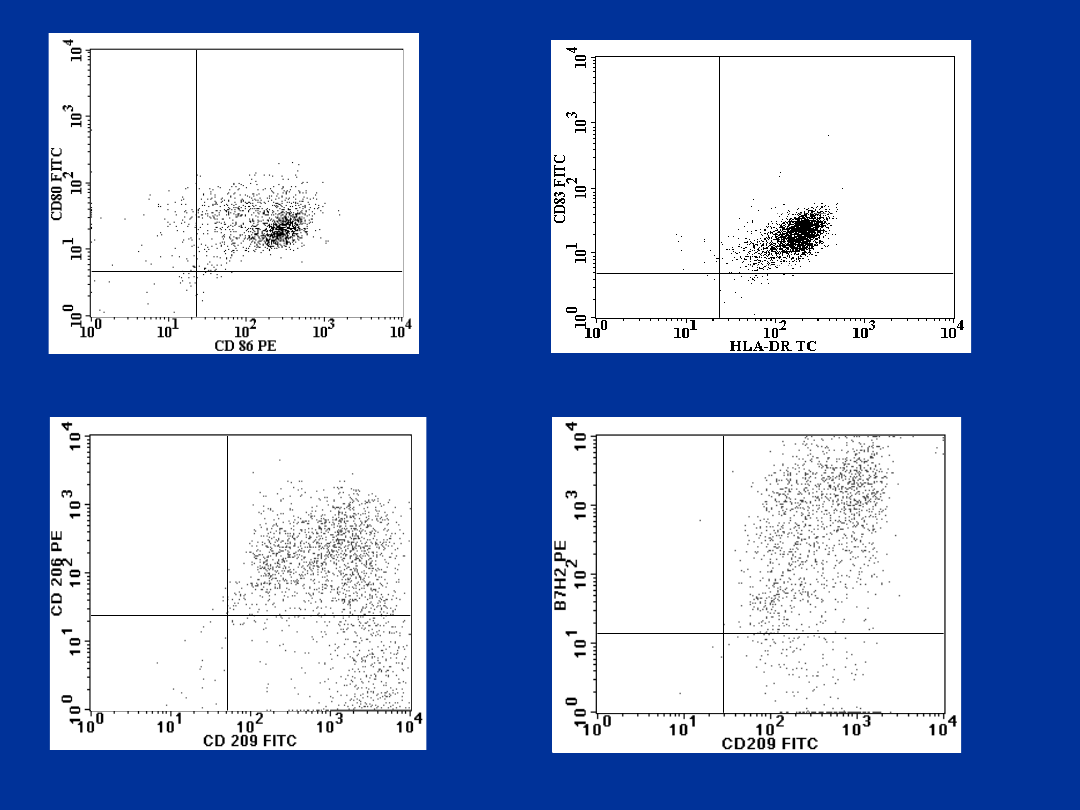


CZĘŚĆ PRAKTYCZNA
• W całej procedurze używamy buforu
do DC składającego się z PBS (bez
jonów Ca
2+
i Mg
2+)
wzbogaconego
0,5% BSA i 2mM EDTA
.
• Używamy chłodnego buforu, a
inkubację i płukanie
przeprowadzamy w 4C

• Zawieszamy 10x10
7
komórek
w 80l buforu
• Dodajemy 20l FcR Blocking
Reagent
• Dodajemy 10l przeciwciał anty-
BDCA-1 lub anty BDCA-2
• Przeprowadzamy 10 min
inkubacje w 4C
• Dodajemy odpowiednie ilości
pozostałych przeciwciał
• Dodajemy 1-2ml buforu na każde
10x107 komórek i wirujemy
przez 10 min. z przyśpieszeniem
300xg w temperaturze 4C
• Zlewamy supernatant i
przeprowadzamy analizę
cytometryczną

Do powstania prezentacji
przyczynili się:
• mgr Sebastian Radej
• dr n. med. Agata Surdacka
• mgr Magdalena Wasiuk
• mgr paulina Wdowiak
• dr n. med.. Kamila Wojas-
Krawczyk
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
Wyszukiwarka
Podobne podstrony:
K 2 Oznaczanie za pomoca penetrometru i scinarki, Gruntoznawstwo, konspekty II
Podstawy cytometrii przeplywowej oznaczanie subpopulacji komorek
Podstawy cytometrii przeplywowej oznaczanie subpopulacji komorek
57. Pomiar widm absorpcji i oznaczanie stężenia ryboflawiny w roztworach wodnych za pomocą spektrofo
57. Pomiar widm absorpcji i oznaczanie stężenia ryboflawiny w roztworach wodnych za pomocą spektrofo
MG3.DOC, TEMAT: Oznaczanie kąta tarcia wewnętrznego i spójności gruntu za pomocą aparatu trójosioweg
Obliczanie pól za pomocą całki oznaczonej, Finanse SGGW, Matematyka
Sprawozdanie 7 Oznaczanie pierwiastków za pomoca widma liniowegoE
Oznaczanie współczynnika filtracji za pomocą aparatu G, Oznaczanie współczynnika filtracji za pomocą
57. Pomiar widm absorpcji i oznaczanie stężenia ryboflawiny w roztworach wodnych za pomocą spektrofo
tranzystor, Tranzystory są urządzeniami półprzewodnikowymi umożliwiającymi sterowanie przepływem duż
Ćwiczenie 3 Oznaczanie współczynnika filtracji za pomocą aparatu typu ITB ZW K2
Okreslenie wydatku za pomoca pomiaru rozkladu predkosci dla przeplywu osiowo symetrycznego[1]
Wyznaczanie zakresu wprost proporcjonalnego przyrostu trojfenyloformazanu podczas oznaczania aktywno
pomiar widm absorpcji i oznaczanie stężenia ryboflawiny w roztworach wodnych za pomocą spektofotomet
Kontrola umysłu Polaków przez CIA i Mossad za pomocą sieci telefonii komórkowej
T4 Zasady rysowania i oznaczania sprężyn za pomocą symboli graficznych
więcej podobnych podstron