
Przemiany fazowe
• Przemianę fazową stanowi każda zmiana
stanu skupienia; topnienie, kondensacja,
krzepnięcie, parowanie, sublimacja,
resublimacja., przemiany alotropowe i
poliformiczne, przejście z fazy ciągłej do
rozproszonej.
• Każdej przemianie towarzyszy zmiana
energii wewnętrznej układu.
• Stan układu określają parametry stanu:
temperatura T, ciśnienie p, jakość i liczba
składników s, liczba faz f oraz stężenia
składników w danej fazie c
i
.

• Układ znajduje się w stanie równowagi
termodynamicznej, jeśli dowolnie długo
nie występują żadne zmiany.
• Wymaga to spełnienia trzech równowag
cząstkowych:
- Równowagi termicznej- w całym układzie
ani między układami nie występują
różnice temperatury
- Równowagi chemicznej- wszystkie
reakcje chemiczne zachodzące w
układzie zostały zakończone- skład
chemiczny nie ulega zmianie.
- Równowaga mechaniczna- siły działające
w układzie i między układem, a
otoczeniem zostały zrównoważone

Reguła faz Gibbsa
• Dopuszczalną zmienność układu
określa liczba stopni swobody z – to
jest liczbę parametrów, które można
zmienić w pewnych granicach
zachowując strukturę układu, bez
wywołania przemian fazowych.
• Liczbę tę określa reguła faz Gibbsa
z= s - f - r +2
s- liczba składników układu, f – liczba
faz, r- liczba przebiegających reakcji.

• Równowagi fazowe układów
jednoskładnikowych są
przedstawione na wykresie T-p, a
układy dwu składnikowe na
wykresie T-c.
• W punkcie potrójnym każda
zmiana parametru powoduje
zmianę fazową

Podział reakcji chemicznych
CECHA
RODZAJ REAKCJI
Typ reakcji
Analiza, synteza, wymiana
Rodzaj reagujących
cząsteczek
jonowa, cząsteczkowa, wolnorodnikowa
Liczba cząsteczek
substratu biorących
udział w reakcji
Jedno-, dwu- i więcej cząsteczkowa
Kierunek przebiegu
reakcji
nieodwracalna-biegnąca tylko w kierunku
tworzenia produktów
odwracalna- biegnąca w obu kierunkach, w
mieszaninie zawsze są obecne substraty
Efekt cieplny
endotermiczna- z pobraniem ciepła,
egzotermiczna - z wydzieleniem ciepła
Liczba faz
homogeniczna - zachodząca w obrębie
jednej fazy
heterogeniczna - zachodząca na granicy
dwóch faz
Sposób przeprowadzenia
reakcji
izochoryczna - w stałej objętości
izobaryczna - pod stałym ciśnieniem

CZYNNIKI DECYDUJĄCE O SZYBKOŚCI REAKCJI
CHEMICZNEJ:
•rodzaj i stężenie reagujących substancji lub ciśnienie
gazów
(jeżeli reakcja przebiega w fazie gazowej)
•temperatura
•obecność katalizatorów
•wpływ promieniowania.
Ilościowo szybkość reakcji określa się jako zmianę
molowego stężenia substratu lub produktu w jednostce
czasu.
Jeżeli mamy równanie reakcji chemicznej
A →B + C + ....,
to szybkość reakcji opisuje równanie:
lub
gdzie: c
A
, c
B
, c
C
- stężenia molowe substancji A, B, C,..., t - czas, dc
A
/dt -
ubytek stężenia substratu w jednostce czasu,
dc
C
/dt - przyrost stężenia produktów w jednostce czasu, k -
współczynnik proporcjonalności (stała szybkości).
dt
dc
dt
dc
v
c
k
dt
dc
v
C
B
A
A

Wpływ stężenia reagujących substancji
Szybkość reakcji jest wprost proporcjonalna do
iloczynu stężeń substratów.
Ze wzrostem stężenia rośnie liczba efektywnych zderzeń
Jeżeli mamy równanie reakcji chemicznej
aA + bB + cC → dD,
to szybkość reakcji opisuje równanie;
v = k[A]
a
• [B]
b
•
[C]
c
gdzie: k - stała szybkości reakcji, (a, b, c) - wykładnik potęgi, do
której należy podnieść stężenie, odpowiednio [A], [B], [C].
W przypadku reakcji gazowych często w równaniach kinetycznych
zamiast stężeń molowych stosuje się ciśnienia cząstkowe.
Wykładniki a, b i c są zazwyczaj liczbami całkowitymi, ale
zastosowane w równaniu mogą być niekiedy ułamkami, równać się
0 lub być liczbami ujemnymi

Rząd reakcji
Współczynniki potęgowe (a, b, c) przy stężeniach
poszczególnych substratów określają rząd reakcji, który
może być cząstkowy lub sumaryczny.
Cząstkowy rząd reakcji
Jeżeli a = 1, to reakcja jest pierwszego rzędu względem A;
jeżeli a = 2, to reakcja jest drugiego rzędu względem
A itp.
Cząstkowe rzędy reakcji, tylko wyjątkowo - np. dla reakcji
elementarnych - przyjmują wartości równe współczynnikom
stechiometrycznym tych reagentów.
Sumaryczny rząd reakcji
Sumaryczny rząd reakcji chemicznej - jest to suma
wykładników potęgowych w równaniu szybkości reakcji
chemicznej
( rząd reakcji = a + b + c + .....).

Cząsteczkowość reakcji
CZĄSTECZKOWOŚĆ REAKCJI - liczba cząsteczek biorących udział w
najwolniejszym stadium reakcji.
Cząsteczkowość jest zwykle równa rzędowości reakcji, natomiast nie jest
słuszne stwierdzenie odwrotne.Cząsteczkowość i rząd reakcji wyznacza się
tylko eksperymentalnie, nie można obliczyć ich teoretycznie.
Przykład
2Br
-
+ 2H
+
+ H
2
O
2
→ Br
2
+ H
2
O
Gdyby reakcja przebiegała w jednym etapie, to musiałoby nastąpić spotkanie
pięciu cząsteczek: dwóch jonów Br
-
, dwóch jonów H
+
i cząsteczki nadtlenku
wodoru. W rzeczywistości mechanizm tej reakcji obejmuje dwa etapy.
H
+
+ Br
-
+ H
2
O
2
→
HOBr + H
2
O /wolno/
HOBr + H
+
+ Br
-
→
Br
2
+ H
2
O /szybko/
Szybkość reakcji określa pierwsza wolna reakcja.
v = k[H
+
][Br
-
][H
2
O
2
]
Jest to zatem reakcja trójcząsteczkowa (trzeciorzędowa).
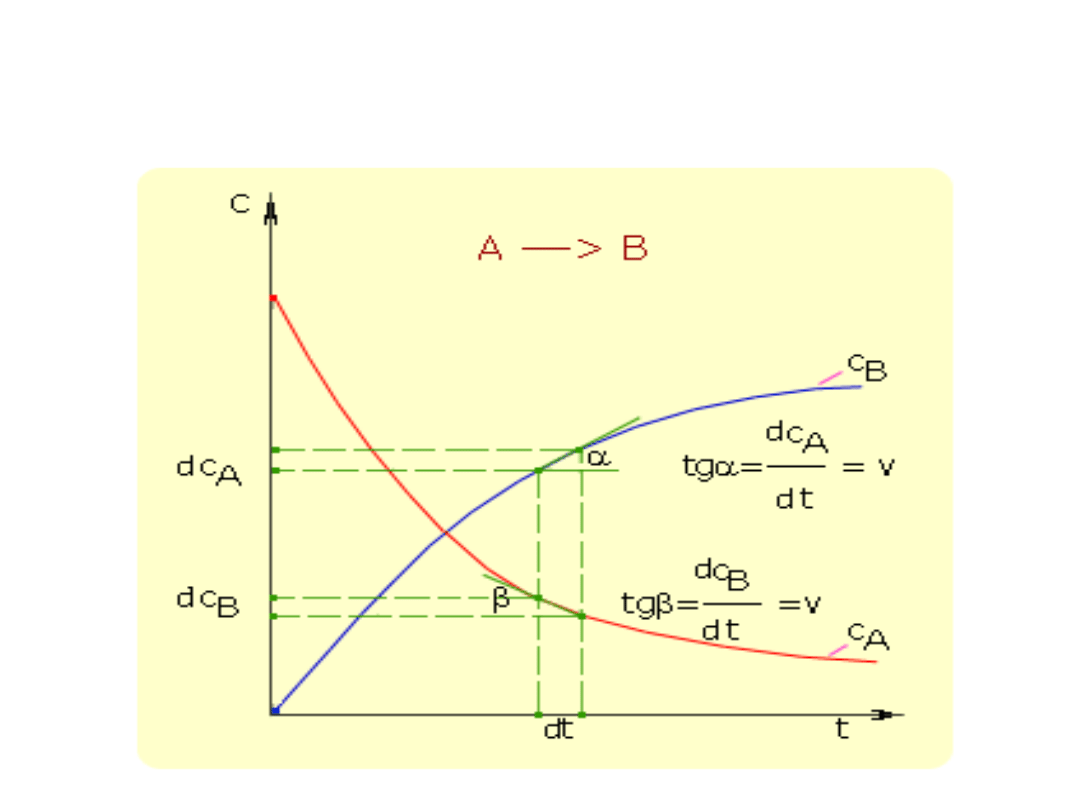
Szybkość reakcji

Wpływ temperatury
Wzrost szybkości w zależności od temperatury ma charakter
wykładniczy.
Podwyższenie temperatury o 10
o
C podwaja w przybliżeniu szybkość
reakcji.
W 1889 r Svant Arrhenius sformułował zależność zmian stałej
szybkości reakcji k, od zmiany temperatury.
gdzie: E
a
- energia aktywacji, A - współczynnik
Stała E
a
nazywa się energią aktywacji i charakteryzuje energię
jaką muszą mieć cząsteczki (atomy) aby zderzenia między nimi
były efektywne
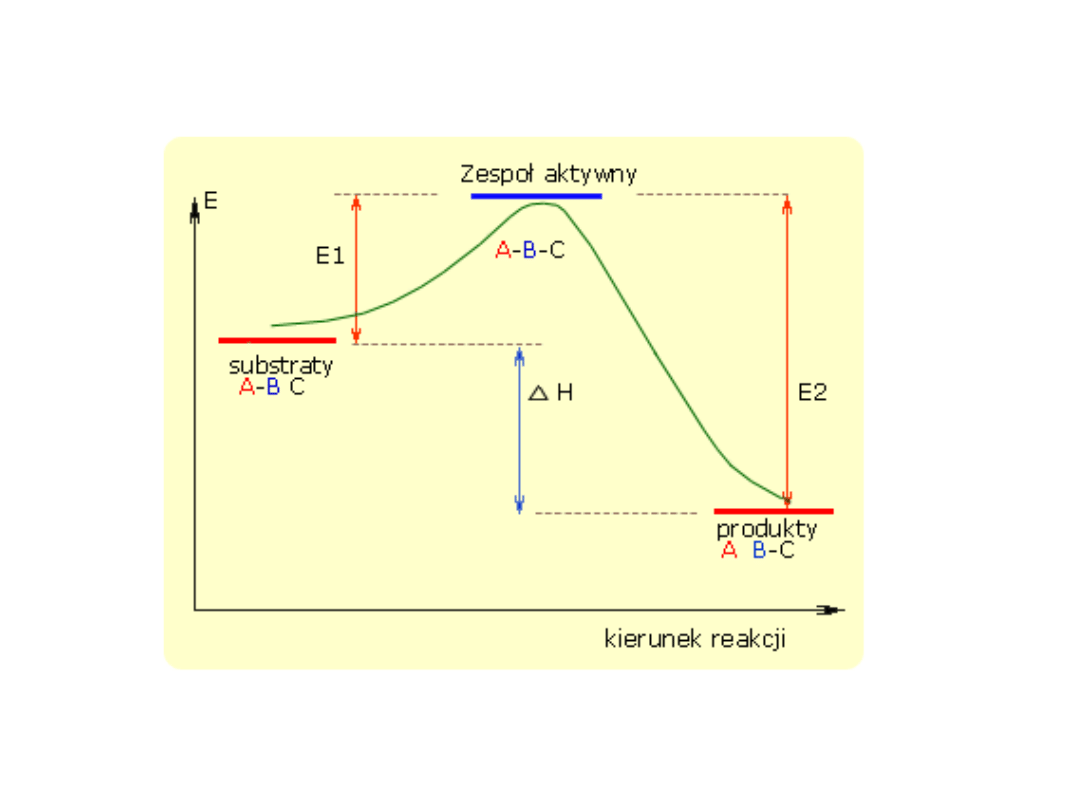
Przebieg reakcji chemicznej można zilustrować na przykładzie, gdzie
substratami reakcji są,
A
-
B
i
C
a produktami
A
i
B
-
C
Przebieg reakcji
A
-
B
+
C
→
A
+
B
-
C
Stwierdzono, że w czasie reakcji powstaje przejściowy zespół
A
...
B
...
C
i
to tylko wtedy kiedy pokonana zostanie bariera energetyczna równa
energii aktywacji. Zespół reakcyjny aktywny ulega rozpadowi, w
wyniku którego powstają produkty reakcji
RT
E
a
A
k
exp
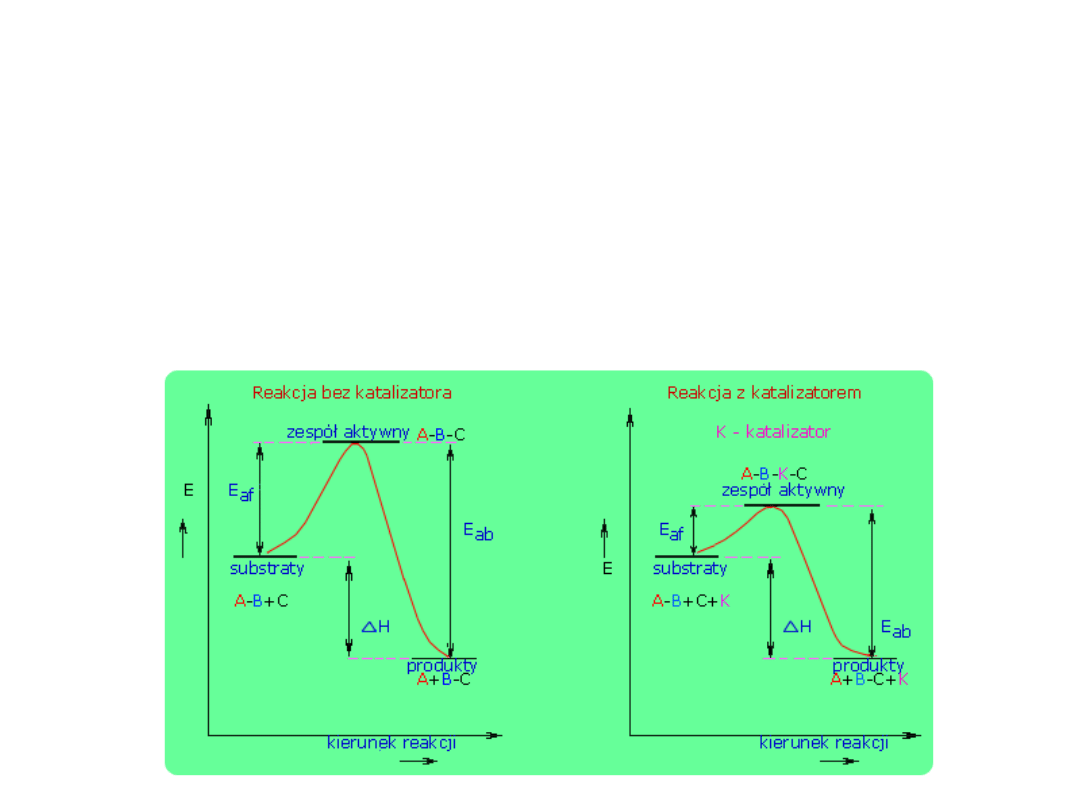
Wpływ katalizatorów
Katalizatorem nazywamy substancję, która wprowadzona do układu
reagującego zwiększa lub zmniejsza szybkość reakcji, nie ulegając przy
tym zmianie.
Zjawisko przyspieszania bądź opóźniania przebiegu reakcji nosi nazwę
katalizy.
Wpływ katalizatora ogranicza się wyłącznie do zmiany szybkości reakcji. W
reakcjach odwracalnych katalizator w jednakowym stopniu zmienia szybkość
reakcji właściwej, jak i reakcji odwrotnej. Jednakowa zmiana szybkości reakcji
wprost i reakcji odwrotnej wywołana obecnością katalizatora sprawia, że iloraz
stałych, tj. wartość stałej równowagi chemicznej pozostaje nie zmienione.
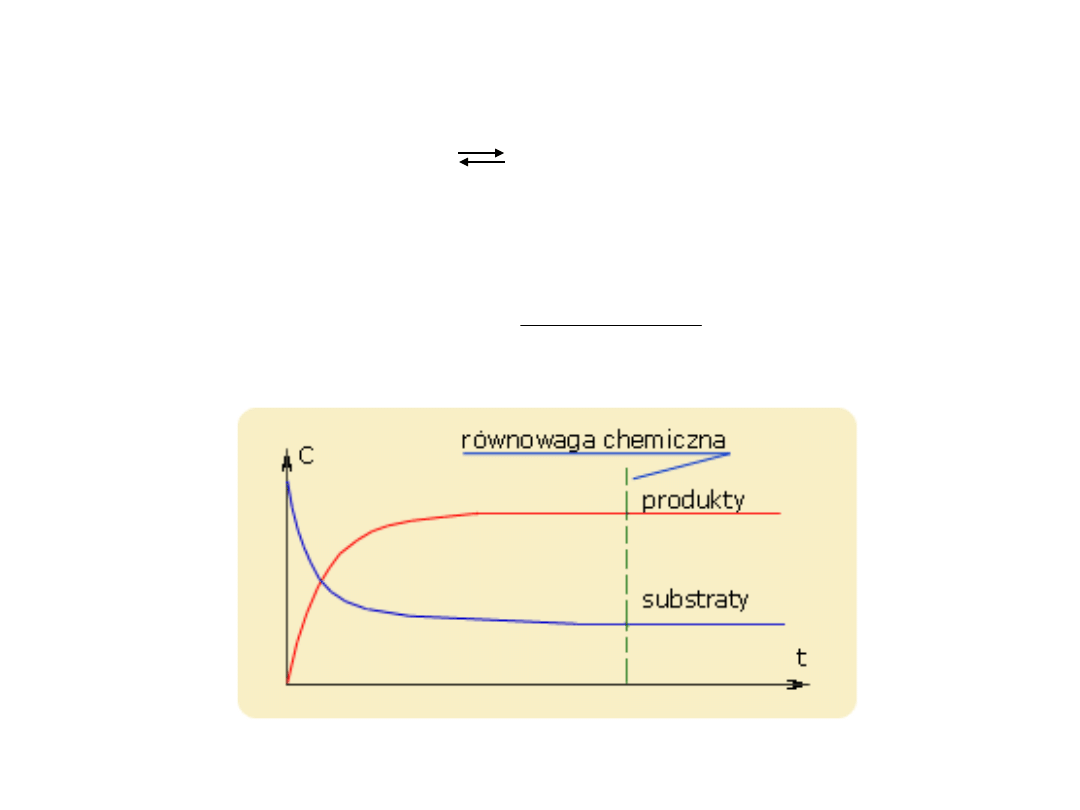
RÓWNOWAGA CHEMICZNA
aA + bB cC + dD
Stężeniowa stała równowagi K
C
jest określona
wzorem:
b
a
d
c
c
B
A
D
C
K
]
[
]
[
]
[
]
[

4NH
3(g)
+ 5O
2(g)
→4NO
(g)
+ 6H
2
O
©
Stała równowagi K
c
jest cechą danej reakcji i
temperatury.
Ze wzrostem temperatury rośnie w reakcjach
endotermicznych, maleje w reakcjach
egzotermicznych
5
2
4
3
4
]
[
]
[
]
[
O
NH
NO
K
c

Reguła przekory
reguła Le Chateliera-Brauna
,
• jeżeli układ będący w stanie równowagi zastanie
zakłócony, w układzie rozpocznie się taka
przemiana, która będzie przeciwdziałać
zakłóceniom, prowadząc do ponownego
osiągnięcia stanu równowagi
Reguła przekory pozwala przewidzieć wpływ zmian stężenia
jednej z substancji uczestniczącej w reakcji na stan równowagi
chemicznej układu.
• Wprowadzenie pewnej ilości reagentu
Jeżeli do układu w stanie równowagi dodatkowo wprowadzimy
pewną ilość reagentu (substratu lub produktu) to stan
równowagi przesunie się w kierunku zmniejszenia jego wartości
w układzie. Podobnie, jeżeli z układu usuniemy pewną ilość
jednego składnika, to zajdą przemiany, które zmniejszą jego
ubytek.
• Wpływ temperatury
Jeżeli czynnikiem naruszającym równowagę chemiczną jest zmiana
temperatury, to w zależności od efektu cieplnego danej reakcji
należy oczekiwać dwojakiego rodzaju skutków.
Podwyższenie temperatury w układzie przesunie stan
równowagi na korzyść reakcji endotermicznej, której
towarzyszy pochłanianie ciepła, natomiast obniżenie
temperatury układu przesunie równowagę w kierunku
reakcji egzotermicznej, której towarzyszy wydzielanie ciepła.
Należy jednak podkreślić, że podwyższenie temperatury zawsze
wywiera korzystny wpływ na szybkość reakcji, a więc i na
szybkość ustalania się równowagi, co nie jest sprzeczne z regułą
przekory
• Wpływ ciśnienia
Zmiany ciśnienia wpływają na położenie stanu równowagi
dla reakcji chemicznych przebiegających w fazie gazowej,
gdzie następuje zmiana objętości.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
Wyszukiwarka
Podobne podstrony:
(5 1) Określenie wpływu stężenia reagentów i temp na szybkość reakcji chem(1)
BADANIE WP YWU ST ENIA NA SZYBKO REAKCJI CHEMICZNYCH
zjawisko fiz a reakcja chem, dydaktyka, konspekty
zaleznosc stalej szybkosci reakcji od temp
A 1 szybkość reakcji zadania
Stała szybkości reakcji jodowania acetonu, Magdalena Jabłońska
pytania z katalizy, Poda˙ wymiar sta˙ych szybko˙ci reakcji w r˙wnaniu szybko˙ci:
chemia, SZYBKO~1, Szybkość reakcji można zdefiniować jako stosunek ubytku stężenia substratu lub jak
szybkość reakcji
Szybkość reakcji, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Wpływ aktywatorów i inhibitorów na szybkość reakcji enzymatycznej
zaliczenie wyk-adu 1, Poda˙ wymiar sta˙ych szybko˙ci reakcji w r˙wnaniu szybko˙ci:
zadania3-wplyw temperatury na szybkosc reakcji
SZYBKOŚĆ REAKCJI JONOWYCH W ZALEŻNOŚCIOD SIŁY JONOWEJ s jonowe
05 Szybkośc reakcji chemicznych instrukcja
05 Szybkośc reakcji chemicznych II sprawozdanie
5.Badanie wpływu stężenia substancji reagujących na szybkość reakcji chemicznej., Państwowa Wyższa S
WPŁYW TEMPERATURY NA SZYBKOŚĆ REAKCJI, NAUKA, chemia, lab
więcej podobnych podstron