
Modyfikacje potranslacyjne
I.Proteoliza ograniczona
Obróbka proteolityczna odbywa się przy pomocy enzymów
zwanych peptydazami, które są odpowiedzialne za cięcie
łańcuchów polipeptydowych na końcu łańcucha (egzopeptydazy)
lub w jego środku (endopeptydazy). Większość tych enzymów jest
bardzo specyficzna - rozpoznają one miejsce cięcia na podstawie
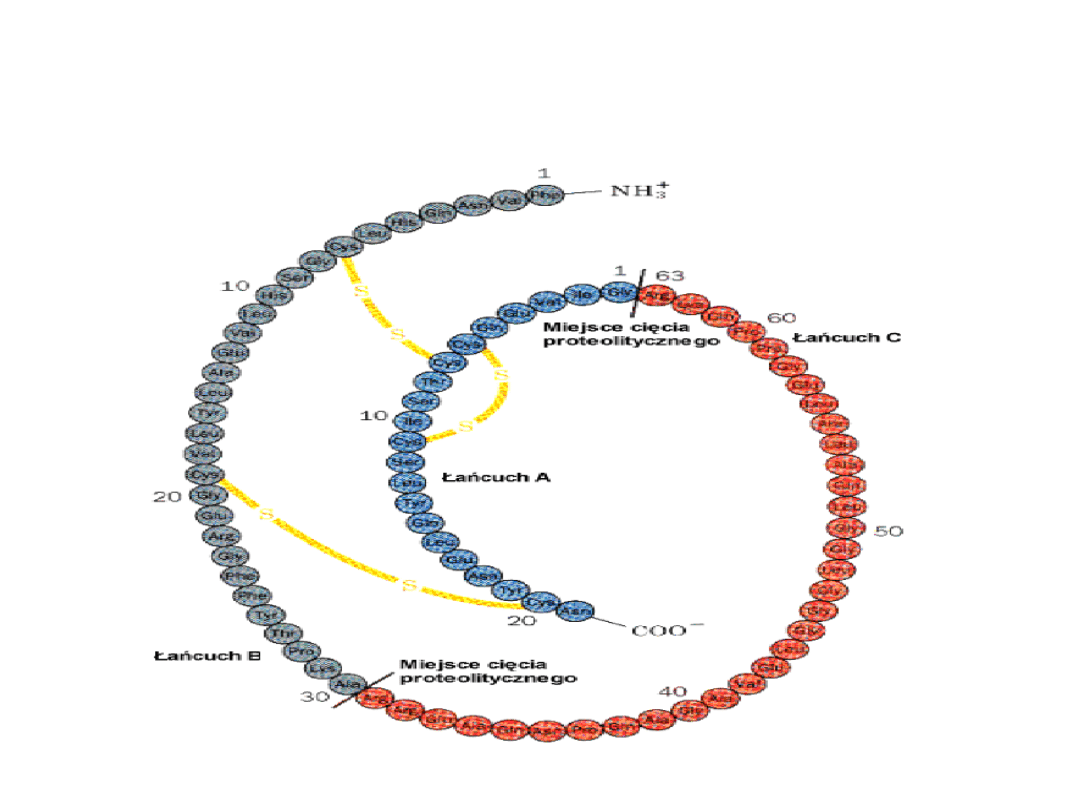
sekwencji aminokwasowej. Dobrym przykładem może być
proinsulina, której pierwotny łańcuch polipeptydowy jest
przecinany w określonych miejscach, następnie dwa produkty są
łączone za pomocą "mostków" dwusiarczkowych.
Aktywacja proinsuliny

Istnieje kilka innych przykładów obróbek proteolitycznych:
- aktywacja białka, poprzez wycięcie niepotrzebnego
fragmentu łańcucha polipeptydowego
-
usunięcie
sekwencji liderowych (fragmentów
łańcucha
, które
kierują białko do odpowiedniego przedziału komórkowego)
- w przypadku polipeptydów płaszcza niektórych wirusów -
pocięcie na fragmenty, aktywuje każdy z otrzymanych
fragmentów
- rzadko występujący splicing polipeptydowy (podobnie jak
obróbka preRNA) - wycinanie fragmentów ze środka
łańcucha polipeptydowego
- usuwanie pierwszego aminokwasu (metioniny lub
formylometioniny) występujące u 50% wszystkich białek

II.
N-acetylacja , N-formylacja, N-
metylacja są rodzajami modyfikacji
potranslacyjnych białek, w których
następuje przyłączenie do N-końca
łańcucha polipeptydowego grup
acetylowych (acetylacja),
metylowych (metylacja) lub
metioniny (formylacja).
III.
Glikozylacja - w tym procesie następuje dołączenie reszt
cukrowcowych do białek (Np.: białek błonowych).

IV.
Hydroksylacja - w przypadku
aminokwasów proliny i lizyny - dołączenie
grupy -OH
V.
Poli (ADP)-rybozylacja - dołączanie
reszt adeninowych.
VI.
Fosforylacja - aktywacja białka poprzez
dołączenie reszty fosforanowej przez
specyficzne enzymy - kinazy. Bardzo
powszechnie występujące wśród białek
(np. czynniki transkrypcyjne).

VII.
Defosforylacja - deaktywacja białka
przez usunięcie reszty fosforanowej przez
specyficzne enzymy - fosfatazy.
VII.
Ubikwitynacja - (u organizmów
Eukariotycznych) dołączenie innego białka
- ubikwityny powoduje, że białko jest
przeznaczone do degradacji. W procesie
ubikwitynacji są usuwane (degradowane)
białka źle sfałdowane, wadliwe oraz takie
których "życie" dobiegło końca. Czas
półtrwania białka jest zależny od rodzajów
aminokwasów występujących na jego N-
końcu.
Document Outline
Wyszukiwarka
Podobne podstrony:
potranslacyjna modyfikacja białek s
potranslacyjna modyfikacja białek s
07 Modyfikacje struktury enzymówid 7062 ppt
modyfikacje epigenetyczne
modyfikacje tytanu id 306036 Nieznany
KOAGULANTY PIX i PAX modyfikowa Nieznany
ŻELIWO MODYFIKOWANE
Modyfikacja i sferoidyzacja żeliwa kolokwium
Modyfikujace przyjecie oferty
4? modyfikacje
Modyfikowanie?tonow domieszkami
Nowe modyfikacje, Mod Rodzina, Rodzina
Współczesne modyfikacje ciała
modyfikowanie i tworzenie?zy?nych
cwiczenia, Modyfikacja danych rozwiazania, Tworzenie tabel
Modyfikacje, Zdrowie i higiena, Zdrowie i higiena
Modyfikacje, Zdrowie i higiena, Zdrowie i higiena
11 analiza treci modyfikacja waciwaid 12365 ppt
więcej podobnych podstron