
Podstawy równowagi kwasowo-
zasadowej
Fizjologia
Instytut Ochrony Zdrowia
Państwowa Wyższa Szkoła Zawodowa w Pile
2008/09
Równowaga kwasowo-zasadowa
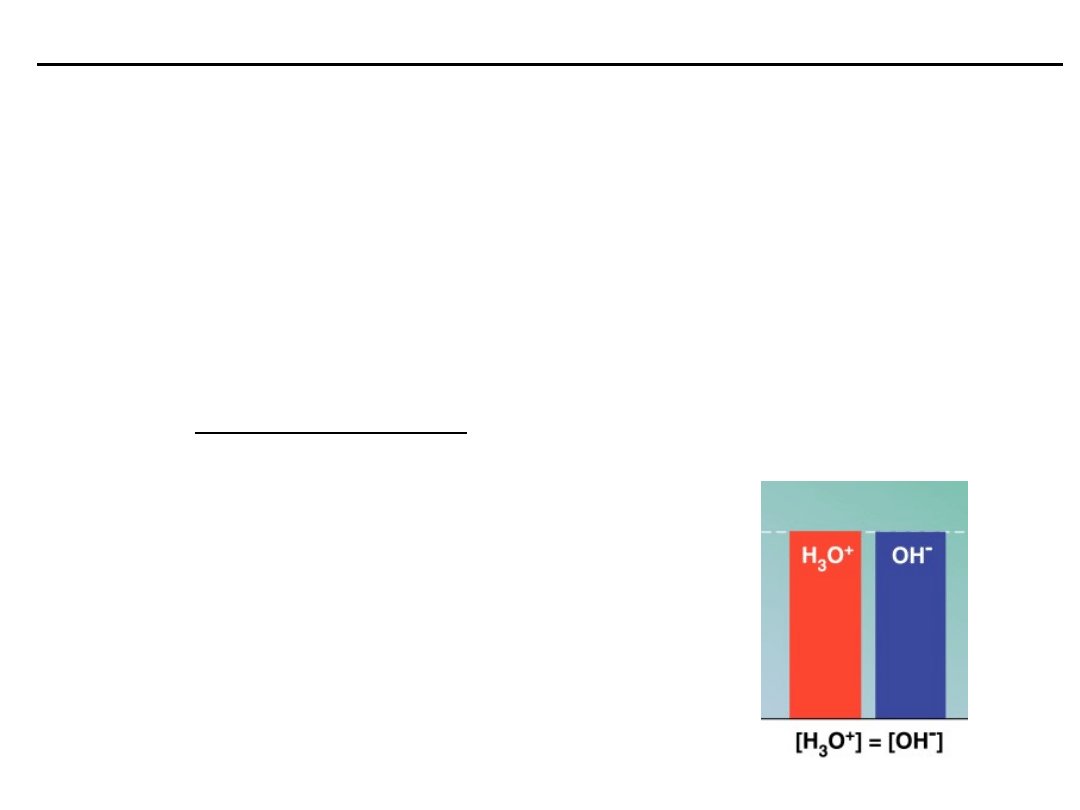
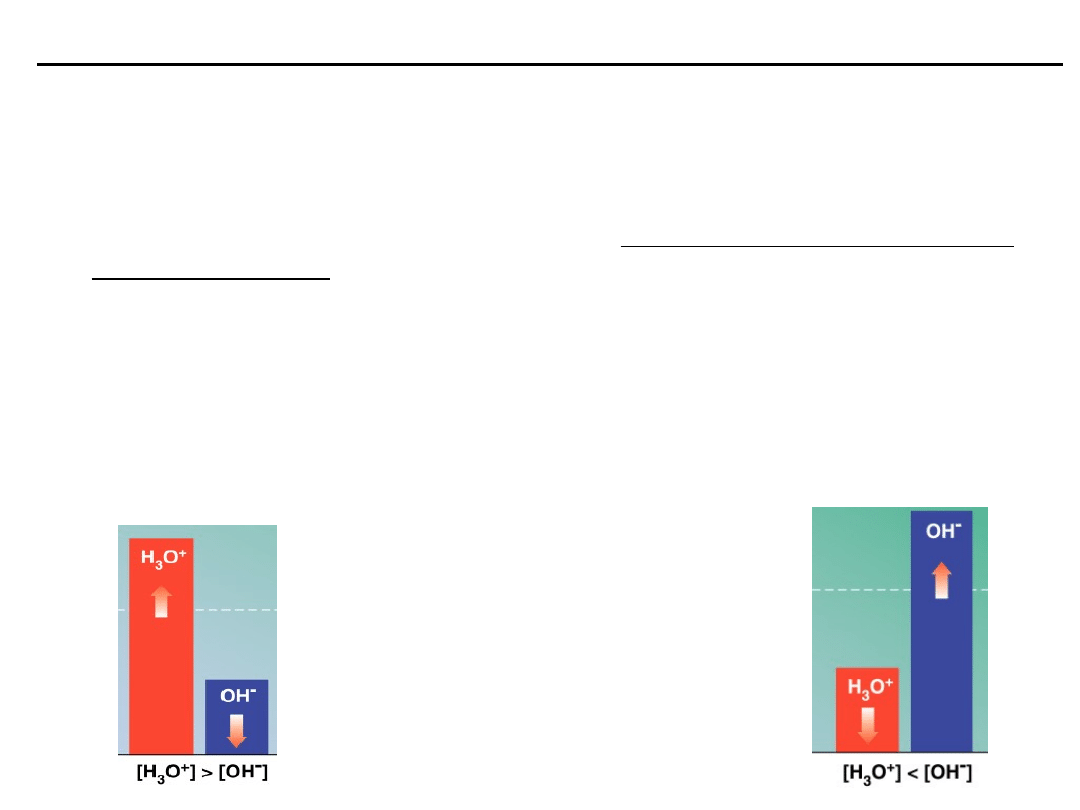
ILOCZYN JONOWY WODY
Iloczyn jonowy wody określa zależność między stężeniami jonów
wodorowych i wodorotle-nowych w wodnych roztworach elektrolitów.
K
w
jest to iloczyn jonowy wody, który w temperaturze około 25
0
C wynosi
10
-14
:
[H
+
] [OH
-
] = 10
-14
= K
w
Równowaga kwasowo-zasadowa
pH
Posługiwanie się wartościami liczbowymi o ujemnych
potęgach jest dość niewygodne, Sörensen wprowadził więc
inny sposób wyrażania [H+], tzw. wykładnik stężenia jonów
wodorowych pH:
pH = - log [H
+
]
[H
+
] = 10
-pH
Wykładnikiem wodorowym, lub krótko pH, nazywa się
ujemny logarytm dziesiętny ze stężenia jonów wodorowych.
Zależność [H
+
] [OH
-
] = 10
-14
przybiera wówczas postać:
pH + pOH = 14

Równowaga kwasowo-zasadowa
Pomiar pH

Równowaga kwasowo-zasadowa
RÓWNOWAGA KWASOWO – ZASADOWA
Równowaga kwasowo-zasadowa jest to ogół mechanizmów
odpowiedzialnych
za
utrzymanie optymalnego stężenia jonów wodorowych w
przestrzeniach
wewnątrz-
i zewnątrzkomórkowych. W warunkach prawidłowych stężenie
to
w
komórkach
wynosi przeciętnie 100 nmol/l (pH =7), a w płynie
pozakomórkowym
40
5
nmol/l
(pH = ok. 7,4).
Na zachowanie równowagi kwasowo-zasadowej organizmu
wpływają
przemiany
wewnątrz- i zewnatrzkomórkowe, w których uczestniczą:
• odpowiednie bufory, głównie bufory krwi,
• czynność płuc (wydalanie CO
2
)
• czynność nerek (produkcja HCO
3
-
, NH
4
+
i H
2
PO
4
-
).

Równowaga kwasowo-zasadowa
Roztwory buforowe
Roztwory buforowe (bufory) są to mieszaniny zawierające
następujące składniki:
• słaby kwas i jego sól z mocną zasadą,
• słabą zasadę i jej sól z mocnym kwasem,
• sole kwasu wieloprotonowego o różnej rzędowości.
Właściwością buforów jest zdolność utrzymywania względnie
stałego stężenia jonów wodorowych mimo wprowadzenia do
nich pewnej objętości mocnego kwasu, mocnej zasady lub ich
rozcieńczenia.
Roztwory buforowe odgrywają ważną rolę w organizmach
żywych utrzymując pH płynów ustrojowych w określonych
granicach,
niezależnie
od
zachodzących
prze-mian
metabolicznych.

Równowaga kwasowo-zasadowa
HA H
+
+ A
-
[H
+
] [A
-
]
[HA]
K =
Działanie buforów wynika z równoczesnej obecności w roztworze
wodnym słabego kwasu (HA) i sprzężonej z nim zasady Brönsteda (A
-
),
czyli składników stanowiących układ buforujący. Słaby kwas obecny w
układzie buforującym dysocjuje wg równania:
Stała jego dysocjacji ma
postać:

Równowaga kwasowo-zasadowa
Wobec tego:
[HA]
[H+] = K ———
[A-]
Po logarytmowaniu i zmianie znaku:
[HA]
- log [H+] = -log K - log ———
[A-]
równanie przyjmuje postać:
[A-]
pH = pK + log ———
[HA]
Jest to ogólna postać równania Hendersona-Hasselbalcha na
obliczanie pH układu buforowego zawierającego słaby kwas i
sprzężoną z nim zasadę Brönsteda, przy czym jony A- w
układzie buforowym nie pochodzą tylko z dysocjacji słabego
kwasu, lecz przede wszystkim z obecnej w roztworze sprzężonej
z nim zasady buforowej A-.

Równowaga kwasowo-zasadowa
Przykładem buforu opartego na słabej zasadzie i jej soli jest bufor
amoniakalny zawierający:
• wodorotlenek amonu NH
4
OH i
i
• chlorek amonu, będący źródłem sprzężonego kwasu NH
4
+
Działanie tego buforu przedstawiają następujące reakcje:
NH
4
OH + H
+
→ NH
4
+
+ H
2
O (po dodaniu kwasu)
NH
4
+
+ OH
-
→ NH
4
OH (po dodaniu zasady)

Równowaga kwasowo-zasadowa
Wielkością charakteryzującą bufor jest jego pojemność buforowa.
Określa ona stosunek dodanej do buforu ilości kwasu lub zasady do
osiągniętej przez to zmiany pH.
Roztwór buforowy posiada pojemność równą 1, jeżeli dodanie 1 mola
jonów
H
+
lub
OH
-
do 1 litra buforu spowoduje zmianę pH o 1.
Oblicza się ją ze wzoru:
= C
pH
gdzie ∆C oznacza liczbę moli jonów H
+
lub OH
-
dodanych do roztworu
w
przeliczeniu
na
1 litr buforu.
Pojemność buforowa jest największa, gdy pH=pK, czyli wtedy, gdy
[HA]=[A
-
]. Przyjmuje się, że roztwory buforowe spełniają swoją funkcję
w zakresie pH=pK1
.
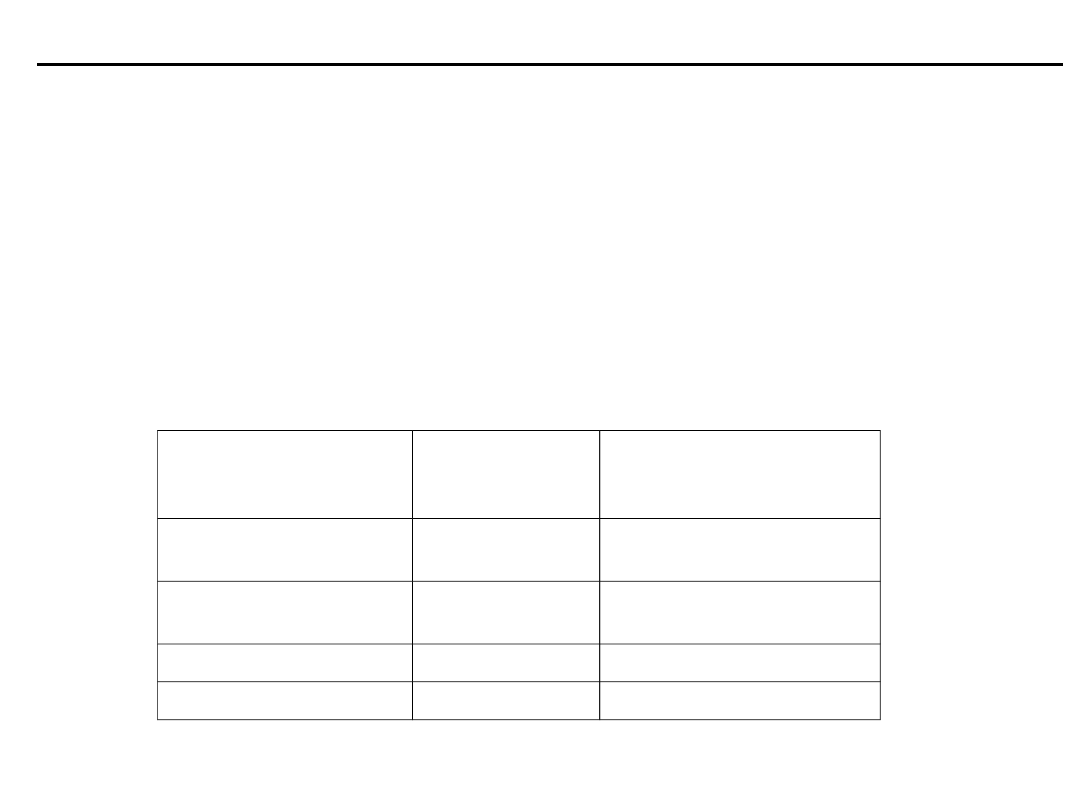
Równowaga kwasowo-zasadowa
Działanie podstawowych buforów przestrzeni zewnątrz- (PZK)
i wewnątrzkomórkowej (PWK)
Podstawowymi buforami organizmu człowieka są:
wodorowęglanowy
hemoglobinianowy
fosforanowy
białczanowy
Ich rozmieszczenie i udział w zabezpieczeniu pojemności buforowej
krwi są następujące:
Bufor
Działanie
w przestrzeni
Udział
-owy w
pojemności buforowej
krwi
Wodorowęglanowy
PZK, PWK
70
Hemoglobinianowy
PWK
21
Białczanowy
PZK, PWK
6
Fosforanowy
PWK, PZK
3
(pogrubione skróty wskazują na przewagę działania buforu w danej
przestrzeni)

Równowaga kwasowo-zasadowa
Działanie buforu wodorowęglanowego
(wiązanie jonów kwasowych i zasadowych)
- składnik kwasowy - sprzężona z
nim zasada buforowa
CO
2
+H
2
O H
2
CO
3
H
+
+ HCO
3
-
HCO
3
-
H
2
O + CO
2
+ OH
-
H
2
O
+ H
+
lub H
2
CO
3
+ OH
-
HCO
3
-
+H
2
O
[800]
[1]
[0,03] [0,03]
Liczby umieszczone w nawiasach kwadratowych nad reakcją odzwierciedlają
proporcje, w jakich poszczególne związki lub jony występują w stanie
równowagi w roztworze wodnym (przy założeniu, że stężenie H2CO3 wynosi
1). Jak wynika z ich wartości, równowaga tej reakcji przesunięta jest bardzo
silnie w lewo.

Równowaga kwasowo-zasadowa
W organizmie człowieka zachodzi wiązanie jonów H
+
pochodzenia
metabolicznego z jonami HCO
3
-
.
Ponieważ organizm człowieka nie produkuje jonów OH
-
, działanie
składnika kwasowego tego buforu polega na wiązaniu innych jonów o
charakterze zasadowym w sensie teorii Brönsteda.
Równanie Hendersona-Hasselbalcha dla buforu wodorowęglanowego
przyjmuje postać:
pH = 6,1 + log[HCO
3
-
]
[CO
2
]
gdzie 6,1 jest wartością pK (ujemny logarytm z iloczynu stałych obydwu
równowag zachodzących w składniku kwasowym tego buforu) w warunkach
fizjologicznych w temperaturze 37
0
C.

Równowaga kwasowo-zasadowa
W krwi tętniczej w temperaturze 37
o
C stężenie jonów H
+
waha się w
granicach 35-45 nmol/l, co odpowiada zakresowi pH 7,45-7,35. W
stanie równowagi stałe pH utrzymywane jest dzięki zachowaniu
odpowiedniego stosunku stężeń molowych kwasu węglowego (właściwie
CO
2
)
i stężenia jonu HCO
3
-
, wynoszącego 1:20, a więc:
pH = 6,1 + log 20
pH = 6,1 + 1,3
pH = 7,4
l
Gdy ten stosunek stężeń jest zachowany, pH krwi utrzymuje się w
zakresie normy.
W płynach biologicznych nie dokonuje się pomiaru stężenia CO
2
, lecz
jego prężności (pCO
2
).
Zgodnie z prawem Henry'ego (prawo o rozpuszczalności gazów nie
wchodzących w reakcje z cieczą w stałej temperaturze) stężenie gazu
rozpuszczonego w cieczy jest proporcjonalne do prężności gazu nad
cieczą. Stężenie CO
2
rozpuszcznego we krwi wyraża się więc jako
prężność oznaczającą ciśnienie gazowego CO
2
, z którym CO
2
rozpuszczony we krwi pozostaje w równowadze.
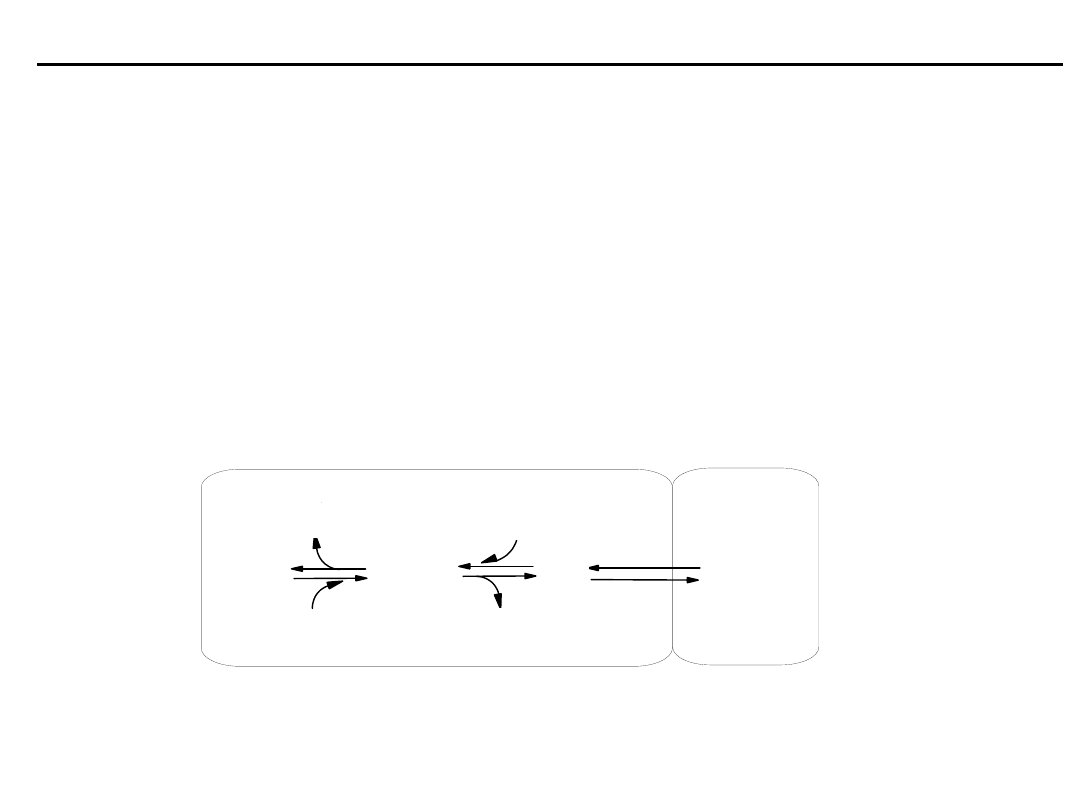
Równowaga kwasowo-zasadowa
W warunkach fizjologicznych przy prężności pCO
2
w powietrzu
pęcherzykowym
równej
5,32 kPa (40 mmHg), stężenia CO
2
i HCO
3
-
we krwi prawidłowej
wynoszą odpowiednio:
[CO
2rozp
]=40 mmHg
0,030=1,2 mmol/l
[HCO
3
-
]=26 mmol/l
Wewnątrzkomórkowe procesy metaboliczne (katabolizm białek i
aminokwasów, przemiany kwasów tłuszczowych i węglowodanów) są
odpowiedzialne za dobową biosyntezę produktów kwasowych rzędu 50-
100 mmol H
+
.
Podczas działania buforu wodorowęglanowego jony H
+
wiązane są
przez HCO
3
-
, a nadmiar powstającego CO
2
zostaje przetransportowany
przez krew i wydalony z organizmu przez płuca.
HCO
3
H
2
CO
3
H
H
H
2
O
H
2
O
+
-
CO
2
CO
2
+
(gazowy)
(rozp. we krwi)
Krew Płuca
Schemat działania buforu wodorowęglanowego
Równowaga kwasowo-zasadowa
H
2
PO
4
-
HPO
4
2-
OH
-
H
+
HPO
4
2-
+ H
2
O H
2
PO
4
-
kwas buforowy zasada buforowa
+
+
Działanie buforu fosforanowego
Bufor fosforanowy jest mieszaniną jonów H
2
PO
4
-
i HPO
4
2-
pozostających
w równowadze z jonami Na
+
. W sprzężonej parze buforowej rolę kwasu
pełni jon H
2
PO
4
-
, a zasadą buforową jest jon HPO
4
2-
. Mechanizm
działania tego buforu w zależności od środowiska przedstawiają
reakcje:
Stosunek ilościowy obu składników w osoczu i przesączu kłębkowym w
kanalikach bliższych wynosi 1:4. W przesączu kłębkowym w
kanalikach dalszych i w moczu osiąga wartość 4:1, która może dojść
nawet do 20:1. Największą skuteczność buforu fosforanowego
stwierdza się przy prawidłowych wartościach pH moczu.
Równowaga kwasowo-zasadowa
H-Hb + O
2
H-HbO
2
HbO
2
-
+ H
+
Rola hemoglobiny w regulacji równowagi kwasowo-
zasadowej
Główną funkcją hemoglobiny (Hb) jest transport O
2
z płuc do tkanek i
CO
2
z tkanek do płuc. Procesy te ściśle wiążą się ze zdolnością
hemoglobiny do oddawania i przyłączania jonów H
+
. Hemoglobina
wiążąc O
2
oddaje jony H
+
i zachowuje się jak kwas. Tracąc O
2
przyłącza
jednocześnie jony H
+
, wykazując właściwości zasady buforowej:
Hemoglobina składa się z czterech podjednostek białkowych i wiąże
4 czasteczki O
2
uwalniając jednocześnie 2H
+
, jednak dla
uproszczenia przyjęto powyższy zapis reakcji.
Ogniwem umożliwiającym hemoglobinie udział w buforowaniu krwi
jest bufor wodoro-węglanowy, gdyż jego składniki swobodnie
przenikają
przez
błonę
krwinki
czerwonej
i pozostają w dynamicznej równowadze z hemoglobiną.
Powstający kwas węglowy ulega następnie dysocjacji:
CO
2
+ H
2
O H
2
CO
3
HCO
3
-
+ H
+
Równowaga kwasowo-zasadowa
HbO
2
-
+ H
+
H-Hb + O
2
O
2
CO
2
+ H
2
O H
2
CO
3
H
+
+ HCO
3
-
Cl
-
HCO
3
-
CO
2
Cl
-
do tkanek
z tkanek
anhydraza
węglanowa
przesunięcie
chlorkowe
H-Hb + O
2
HbO
2
-
+ H
+
O
2
HCO
3
-
+ H
+
H
2
CO
3
H
2
O + CO
2
HCO
3
-
CO
2
Cl
-
anhydraza
węglanowa
z płuc
Cl
-
wydychany
Udział erytrocytów w regulacji
równowagi
kwasowo-zasadowej
krwi:
A - reakcje w kapilarach
tkanek
B - reakcje w płucach

Równowaga kwasowo-zasadowa
Nerki
Regulacja metaboliczna równowagi kwasowo-zasadowej w nerkach
sprowadza się głównie do:
• zapewnienia prawidłowego stężenia zasady buforującej
(HCO
3
-
),
• wydalaniu jonów H
+
.
Prawidłowe stężenie jonów HCO
3
-
we krwi tętniczej, wynoszące 22-26
mmol/l, utrzymywane jest dzięki:
• odpowiedniemu wytwarzaniu w krwinkach czerwonych i
komórkach
kanalików
nerkowych,
• wchłanianiu zwrotnemu w kanalikach nerkowych,
• wydalaniu nadmiaru.
Nerka wpływa na równowagę kwasowo-zasadową, gdyż wydala nielotne
kwasy, takie jak mlekowy, acetooctowy, -hydroksymasłowy, siarkowy
(powstający w przemianie białkowej) oraz fosforowy (wytwarzanyw
przemianie fosfolipidów). Kwasy te w postaci soli, głównie sodowych,
usuwane są przez filtrację kłębkową, a kationy Na+ odzyskiwane są w
kanalikach
na drodze wymiany na jony H+ dzięki wchłanianiu zwrotnemu.

Równowaga kwasowo-zasadowa
Rola wątroby w regulacji równowagi kwasowo-
zasadowej
Wątroba i nerki stanowią dwa ważne ogniwa regulacji homeostazy
stężenia HCO
3
-
i NH
4
+
.
W warunkach fizjologicznych katabolizm 100 g białek jest źródłem
około 1000 mmol NH
4
+
i 1000 mmol HCO
3
-
. Uwzględniając objętość
wydalanego w ciągu doby moczu, wynoszącą średnio 1,5 litra,
usuwanie przez nerki tak dużej ilości powstającego HCO
3
-
jest
niemożliwe. Jednak dzięki odbywającej się w wątrobie syntezie
mocznika, w której zużyciu ulegają równoważnikowe ilości NH
4
+
i
HCO
3
-
, powstałe w procesie katabolizmu białek duże ilości jonów
HCO
3
-
ulegają eliminacji.
Nasilenie procesu usuwania HCO
3
-
zależne jest od stężenia H
+
we
krwi, tworzy się bowiem układ sprzężenia zwrotnego, tj. im większe
stężenie H
+
lub im większy spadek stężenia HCO
3
-
we krwi (im
większa kwasica), tym mniej HCO
3
-
ulega przekształceniu
w mocznik i odwrotnie.
Nie zużyty w kwasicy NH
4
+
wykorzystany jest do syntezy glutaminy, co
stanowi istotne ogniwo w procesie amoniogenezy. Skuteczność tego
mechanizmu jest duża, bowiem zahamowanie syntezy mocznika o
zaledwie 10% dostarcza organizmowi około 100 mmol HCO
3
-
na dobę.

Równowaga kwasowo-zasadowa
Zaburzenia równowagi kwasowo-zasadowej
Organizm człowieka ma znaczne możliwości kompensacji zaburzeń
równowagi kwasowo-zasadowej, zmiany pH krwi są więc na ogół
nieznaczne. Jest to istotne, ponieważ przesunięcie pH poniżej 7,0 i
powyżej 7,7 ([H
+
] = 20 - 80 mmol/l) mogą być bezpośrednim
zagrożeniem dla życia.
Wyróżnia się cztery typy zaburzeń równowagi kwasowo-zasadowej:
pH
[HCO
3
-
]
pCO
2
Kwasica
metaboliczna
↓
↓
Kwasica
oddechowa
↓
↑
Zasadowica
metaboliczna
↑
↑
Zasadowica
oddechowa
↑
↓
(pogrubienie strzałki oznacza zmianę pierwotną, strzałka normalna – mechanizm
obronny)

Równowaga kwasowo-zasadowa
Zaburzenie równowagi pochodzące od zmian stężenia CO
2
we krwi
uważa się za spowodowane zaburzeniami w oddychaniu, gdyż jego
stężenie zależy od pCO
2
, które jest kontrolowane przez narządy
oddechowe.
Kwasica oddechowa występuje w warunkach nagromadzenia CO
2
w
krwi, zaś zasadowica oddechowa wtedy, gdy CO
2
wydala się zbyt szybko.
Wyrównania stosunku stężeń w obu przypadkach mogą dokonać nerki
drogą zmiany stężenia wodorowęglanów.
Zaburzenia równowagi kwasowo-zasadowej wywołane zmianami
stężenia HCO
3
-
są pochodzenia metabolicznego. Niedobór HCO
3
-
powoduje kwasicę metaboliczną, a nadmiar - zasadowicę metaboliczną.
Kompensacja może nastąpić drogą zmiany prężności CO
2
(pCO
2
).

Równowaga kwasowo-zasadowa
Kwasica metaboliczna powstaje w wyniku nagromadzenia się kwasów
lub utraty jonów HCO
3
-
z płynu pozakomórkowego. Głównym źródłem
kwasów nielotnych są białka zawierające aminokwasy siarkowe,
enzymatyczna hydroliza fosfolipidów, ketokwasy oraz kwasy D- i L-
mlekowy.
Zmiana stężenia jonów HCO
3
-
następuje w wyniku wydalania przez
przewód
pokarmowy,
z moczem oraz zmienione ich wytwarzanie. Spadek pCO
2
powoduje
wzrost stężenia jonów H
+
i normalizację
pH.
Kwasica oddechową zostaje wywołana przez nadmierne stężenie CO
2
w
wyniku upośledzonego wydalania przez płuca. Organizm reaguje na
wzrost pCO
2
uruchomieniem mechanizmów obronnych w postaci:
• zwiększonej produkcji HCO
3
-
w nerkach i następnie we krwi;
jednocześnie zwiększa się wydalanie jonów H
+
w postaci jonów
H
2
PO
4
-
i NH
4
+
,
• buforowania CO
2
we krwi i tkankach.

Równowaga kwasowo-zasadowa
Zasadowica metaboliczna może być spowodowana nadmiernym
gromadzeniem zasad buforowych lub utratą nielotnych kwasów.
Powodem
może
być
przesunięcie
jonów
H
+
z przestrzeni pozakomórkowej do wewnątrzkomórkowej.
Zasadowica oddechowa powstaje w wyniku obniżenia pCO
2
krwi
tętniczej
poniżej
4,6
kPa
(35 mmHg). Nerki reagują na to obniżenie w dwojaki sposób:
• zmniejsza się wchłanianie jonów HCO
3
-
głównie w kanaliku
proksymalnym,
przy
równoczesnym wzroście wchłaniania jonów Cl
-
,
• maleje lub zanika wydalanie jonów H
+
, tym samym ustaje
wytwarzanie
jonów
HCO
3
-
przez nerki, czemu towarzyszy spadek produkcji
amoniaku.

Równowaga kwasowo-zasadowa
Wartości prawidłowe homeostazy kwasowo-
zasadowej
Krew tętnicza
[H
+
] = 35-45 nmol/l
pH = 7,35 - 7,45
pCO
2
= 4,5 - 6,0 kPa (35 - 45mmHg)
[HCO
3
-
] = 22 - 26 mmol/l
całkowity zasób zasad buforujących = 44 - 48 mmol/l
nadmiar lub niedobór zasad = -2,5 do 2,5 mmol/l
pO
2
= 8,7 - 13,3 kPa (65 - 100 mmHg)
Mocz
pH = 5,0 - 8,5
[H
+
]
wyd.
= {[NH
4
+
]
wyd.
+ [H
2
PO
4
-
]} - [HCO
3
-
]
wyd.
[NH
4
+
]
wyd.
= 30 - 50 mmol/dobę
[H
2
PO
4
-
] = 10 - 30 mmol/dobę
Równowaga kwasowo-zasadowa
W organizmie woda wypełnia dwie przestrzenie wodne: przestrzeń
wewnątrzkomórkową (PWK) i pozakomórkową (PZK). Na przestrzeń
pozakomórkową składają się:
• przestrzeń wodna wewnątrznaczyniowa
• przestrzeń wodna pozanaczyniowa.
Ilościowe rozmieszczenie wody w obydwu przestrzeniach jest
następujące:
Przestrzeń wodna
Objętoś
ć
[ l ]
% masy
ciała
% wody
całkowit
ej
PWK
28
40
65
PZK
14
20
35
a)
wewnątrznaczyniowa
3
5
10
b) pozanaczyniowa
11
15
25

Równowaga kwasowo-zasadowa
Człowiek dorosły traci około 1,5–2,0 litrów wody na dobę, jego organizm
musi więc być w nią zaopatrywany. Dobowe spożycie wody wynosi 0,5-2,5
l
i
tyle
wody
wydala
się
na
zewnątrz,
w większości z moczem.
Bilans wody w organizmie jest następujący:
Pobór wody (ml)
Wydalanie wody (ml)
Płyny
1 500
Mocz
1 600
Woda z pokarmu
800
Skóra i płuca
900
Woda z przemian
300
Kał
100
RAZEM
2 600
RAZEM
2600
Szybkość wydalania moczu może wynosić 0,5 - 5,0 ml/min i zależy głównie
od ilości spożytych płynów. Regulacja objętości wody w organizmie
następuje poprzez zwiększenie lub zmniejszenie reabsorpcji wody w
nerkach.
Wydalanie wody z kałem jest wynikiem procesów wchłaniania i
wydzielania elektrolitów w prze-wodzie pokarmowym. Zaburzenia tych
procesów prowadzą do nadmiernej utraty elektrolitów.
Utrata wody z potem i powietrzem wydychanym nie ulega regulacji i
dobowe straty wynoszą około 1 l wody i 30 mmol Na
+
.
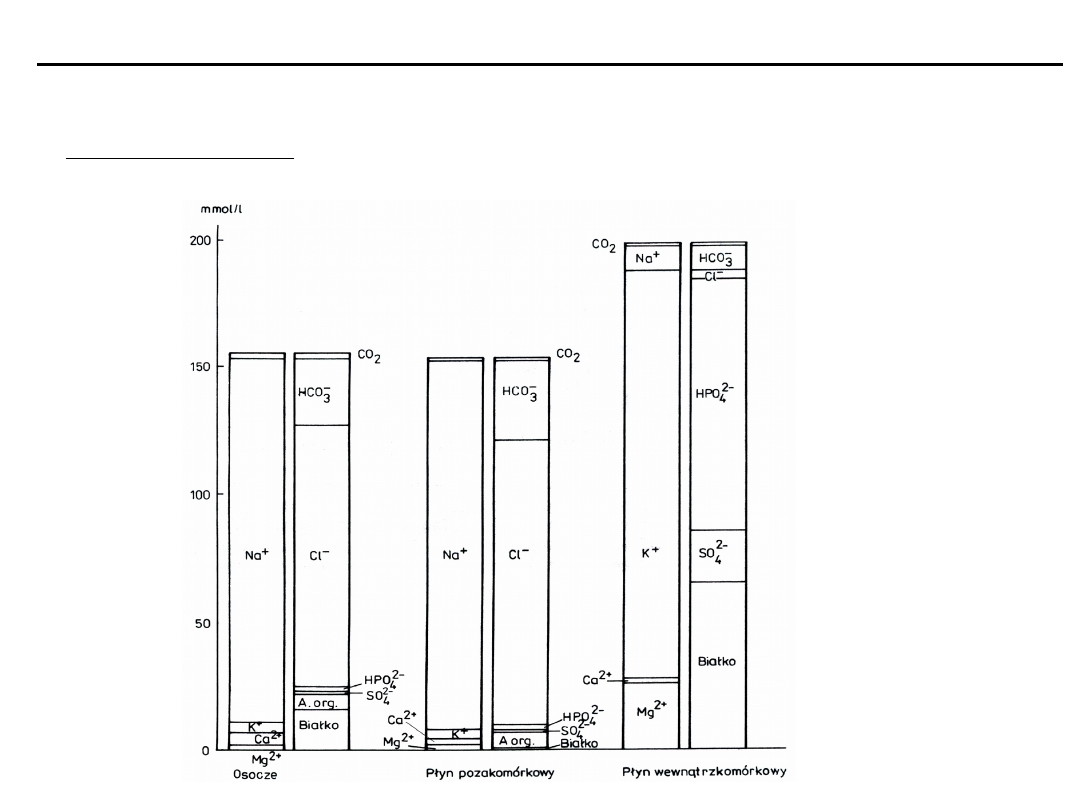
Równowaga kwasowo-zasadowa
Elektrolity płynów wewnątrz- i pozakomórkowych – stężenia
Osmolalność
Skład elektrolitowy płynu wewnątrz- i pozakomórkowego oraz osocza
przedstawia
jonogram Gambla
(zawiera wartości
średnie stężeń)

Równowaga kwasowo-zasadowa
W każdym płynie biologicznym suma stężeń kationów jest równa
sumie stężeń anionów:
Kationy
[mmol/l]
Aniony
[mmol/l]
Na
+
142
Cl
-
101
K
+
4
HCO
3
-
26
Ca
2+
5
białczanowy
26
Mg
2+
2
resztkowe
10
RAZEM
153
RAZEM
153
Do anionów resztkowych należą fosforany, siarczany oraz aniony
kwasów organicznych, takie jak mleczan, pirogronian, cytrynian,
acetooctan, -hydroksymaślan i oksyglutaran, będące metabolitami
przemian.
W zaburzeniach gospodarki wodno-elektrolitowej, gdy dochodzi do
zwiększenia
stężenia
anionów
metabolicznych,
zmniejsza
się
odpowiednio stężenie HCO
3
-
.
Odwrotnie,
zmniejszenie
stężenia
jonów
Cl
-
w
osoczu
jest
kompensowane
przez
dostarczenie
jonów
HCO
3
-
.
Właściwości
fizykochemiczne jonów HCO
3
-
są inne i nie mogą one zastąpić funkcji
fizjologicznych jonów Cl
-
.
Mimo zachowania zależności
[kationy]
=
[aniony]
, a tym samym prawa
elektroobojętności,
dochodzi
do
zaburzeń
metabolicznych
w
organizmie.

Równowaga kwasowo-zasadowa
Gospodarka wodno-elektrolitowa jest ściśle związana z tzw.
osmolalnością
płynów
w przestrzeniach wodnych.
Osmolalność
wyraża liczbę moli danego związku rozpuszczonych w 1
kg rozpuszczalnika (jest to jednocześnie definicja stężenia
molalnego).
Jednostką jest Osmol – jest to ciśnienie osmotyczne związku
osmotycznie
czynnego,
jakie
wywiera
1
molalny
roztwór
niedysocjujący.
W temp. 0C:
molalność = c · n · p
c - stężenie związku w mol/kg H
2
O
n - liczba produktów dysocjacji
p - współczynnik aktywności osmotycznej

Równowaga kwasowo-zasadowa
Ciśnienie osomotyczne
jest ciśnieniem wewnątrz przestrzeni zamkniętej
błoną półprzepuszczalną, przez którą przechodzi woda, a nie elektrolit.
W warunkach homeostazy ciśnienia osmotyczne w obu przestrzeniach
wodnych są wyrównane.
Wielkość ciśnienia osmotycznego uwarunkowana jest stężeniem
substancji osmotycznie czynnych (jony, substancje małocząsteczkowe).
Osmolalność osocza u dorosłych wynosi 275 - 290 mOsm/kg H
2
O.
W płynach pozakomórkowych, a więc również w osoczu, jego wartość
zależy głównie od stężenia jonów Na
+
. Dla celów diagnostycznych
uwzględnia się stężenie jonów Na
+
i odpowiadających mu anionów oraz
stężenie glukozy i mocznika:
osmolalność osocza = 2 [Na
+
] + [glukoza] + [mocznik]
W stanie prawidłowym:
osmolalność osocza = 2 · 140 + 5 + 4 = 289 mmol/l

Równowaga kwasowo-zasadowa
Krótka charakterystyka gospodarki wodno-elektrolitowej
Gospodarka wodno-elektrolitowa stanowi ważny element homeostazy
ogólnoustrojowej.
Jej ocenę umożliwia oznaczenie stężeń podstawowych elektrolitów:
jonów Na
+
, K
+
i Cl
-
oraz pomiar objętości płynów ustrojowych.
Regulacja gospodarki wodno-elektrolitowej ma na celu utrzymanie:
• izowolemii (prawidłowa wielkość przestrzeni wodnych),
• izotonii (prawidłowe ciśnienie osmotyczne),
• izojonii (prawidłowy skład elektrolitów).
Jest to możliwe dzięki temu, że:
• woda swobodnie przemieszcza się przez błony plazmatyczne
komórek,
• rozmieszcza się równomiernie we wszystkich przedziałach
płynowych organizmu,

Równowaga kwasowo-zasadowa
Gospodarka wodno-elektrolitowa:
• przedziały płynowe organizmu są izoosmolalne względem siebie;
woda
przenikając
swobodnie przez błony plazmatyczne zapobiega powstawaniu
różnic
osmolalności
płynów,
• jony Na
+
nie przemieszczają się swobodnie przez błony, a ich
stężenie
po
obu
stronach
błony utrzymuje się dzięki aktywności pompy sodowo-potasowej
(Na
+
/K
+
-ATPaza),
• zawartość jonów Na
+
w organizmie warunkuje objętość płynu
pozakomórkowego;
woda
przemieszcza się do lub z płynu pozakomórkowego dopóki stężenie
jonów
Na
+
nie
osiągnie izoosmolalności,
• ciśnienie osmotyczne białek osocza determinuje względną
objętość
płynu
wewnątrzkomórkowego i śródmiąższowego.

Mikroelementy
Sód, potas, chlor, siarka
Funkcje sodu, potasu i chloru są ze sobą ściśle powiązane.
Znajdują się we wszystkich płynach ustrojowych i tkankach
organizmu człowieka.
Sód i chlor występują głównie w płynie pozakomórkowym i osoczu
krwi, a potas w płynie wewnątrzkomórkowym.
Pierwiastki te biorą udział w regulacji następujących funkcji
organizmu:
• gospodarki wodno-elektrolitowej,
• równowagi kwasowo-zasadowej,
• utrzymania ciśnienia osmotycznego,
• zapewnienia prawidłowej pobudliwości nerwowo-mięśniowej
(utrzymanie
różnicy
potencjałów między neuronami i komórkami mięśni).
Sód i potas są składnikami Na
+
,K
+
-ATPazy, ich metabolizm jest
kontrolowany przez aldosteron, ulegają szybkiemu wchłanianiu,
wydalanie odbywa się przez nerki.
Pierwiastki te występują obficie w żywności i niedobory
spowodowane nieprawidłowym żywieniem nie występują.
Siarka jest składnikiem aminokwasów (cysteina, metionina), białek
włosów
(keratyna),
a także insuliny i glutationu. Nadmiar siarki usuwany jest w moczu
głównie w postaci siarczanów.

Równowaga kwasowo-zasadowa
SÓD
Zawartość jonów Na
+
w organizmie wynosi ok. 60 mmol/kg masy
ciała, z czego około 98% znajduje się w przestrzeni pozakomórkowej.
Dobowa dostawa waha się w granicach 75-250 mmol i jest
równoważona wydalaniem przez nerki, ściśle powiązanym z
wydalaniem
wody.
W
normalnych
warunkach
ponad
99%
przefiltrowanej ilości jonów Na
+
ulega wchłanianiu zwrotnemu, a
mniej niż 1% wydaleniu. Resorpcja sodu przez kanaliki nerkowe
regulowana jest przez aldosteron, hormon steroidowy z klasy
mineralokortykoidów.
Dzienne spożycie soli kuchennej wynosi 10-15 g. Sód nie rozkłada się
w organizmie i nie ulega przemianom.
Sok żołądkowy zawiera 60 mmol/l Na
+
, treść jelitowa około 125
mmol/l, pot do 60 mmol/l.
Stężenie jonów Na
+
w osoczu lub surowicy krwi wynosi 135-145
mmol/l. Zmniejszenie poniżej 135 mmol/l określane jest jako
hiponatremia
,
która
z
reguły
wiąże
się
z hipoosmolalnością płynu pozakomórkowego i przewodnieniem
przestrzeni wewnątrz-komórkowej. Stężenie jonów Na
+
w osoczu
powyżej 148 mmol/l jest traktowane jako
hipernatremia
, której zwykle
towarzyszy odwodnienie.

Równowaga kwasowo-zasadowa
POTAS
Zawartość jonów K
+
w organizmie wynosi około 54 mmol/kg masy
ciała, z tego około 90% przypada na tzw. potas zjonizowany (frakcja
wymienialna),
który
w
98%
umiejscowiony
jest
w
płynie
wewnątrzkomórkowym osiągając stężenie 130-150 mmol/l, a tylko
około
w
2%
w płynie pozakomórkowym. Jego stężenie ma decydujące znaczenie dla
utrzymania odpowiedniego potencjału błonowego, warunkującego
prawidłową pracę mięśnia sercowego, mięśni szkieletowych i mózgu.
Dobowa dostawa potasu wynosi około 60-80 mmol i pokrywa jego
utratę z moczem i kałem. Wchłaniany rozprzestrzenia się bardzo
szybko
w
całym
organizmie
i
stąd
jego
stężenie
w osoczu jest bardzo stałe.
Stężenie w surowicy lub osoczu mieści się w granicach 3,5-5,0 mmol/l.
Może ono ulegać zmianie niezależnie od stężenia Na
+
lub
równocześnie z nim, a także zachowywać się przeciwstawnie.
Wydalanie potasu odbywa się głównie (90%) z moczem (0,5-12,0
mol/dobę), a mniej niż 10% z kałem. Tylko nerki mają zdolność
regulacji wydalania potasu (kanały potasowe). Głównymi czynnikami
regulującymi gospodarkę potasową są insulina, aminy katecholowe
i aldosteron.
Hipokalemia
może być spowodowana zmniejszonym dowozem jonów
K+ (brak w poży-wieniu, choroby wyniszczające) lub zwiększoną ich
utratą (wymioty, biegunki, na drodze nerkowej).
Hiperkalemia
czyli zwiększone stężenie jonów K+ występuje dość
rzadko.

Równowaga kwasowo-zasadowa
CHLOR
Prawidłowe stężenie
jonów chlorkowych
w surowicy lub osoczu waha
się
w
granicach
98-108 mmol/l.
Z wyjątkiem niektórych stanów patologicznych stężenie K
+
zmienia
się
równocześnie
ze stężeniem jonów Na
+
.
Stężenie jonów Cl
-
jest ściśle powiązane z równowagą kwasowo-
zasadową, w której zaburzeniach zmiany stężenia Cl
-
równoważą
zmiany stężenia HCO
3
-
. Stężenie Cl
-
zwiększa się w kwasicach
metabolicznych i zasadowicach oddechowych, a zmniejsza w
zasadowicach metabolicznych i kwasicach oddechowych.
Zmniejszenie stężenia jonów Cl
-
obserwuje się w uporczywych
wymiotach, a zwiększone w niektórych postaciach zasadowicy
hiperchloremicznej.
Znajomość stężenia jonów Cl
-
służy, wraz ze stężeniem jonów HCO
3
-
,
Na
+
i K
+
, do obliczania tzw. luki anionowej:
LA = { [Na
+
] + [K
+
] } - { [HCO
3
-
] + [Cl
-
] }
W warunkach prawidłowych LA wynosi 15-20 mmol/l. Zwiększa się w
kwasicach metabolicznych (poza hiperchloremiczną); jej spadek nie
ma znaczenia fizjologicznego.

Równowaga kwasowo-zasadowa
WAPŃ
Zawartość wapnia w organizmie
dorosłego człowieka wynosi około
1,00-1,25
kg,
z czego aż 99% stanowi wapń tkanki kostnej i zębów w postaci
hydroksyapatytu.
Z pozostałego 1% (postać jonowa) 0,9% jest istotnym składnikiem
płynów zewnątrzkomórkowych, a tylko około 0,1% występuje w płynie
wewnątrzkomórkowym.
Wapń występuje w surowicy krwi w trzech formach pozostających w
równowadze:
- frakcja niedyfundująca związana z albuminą i globulinami (około
45% Ca),
- frakcja dyfundująca - obejmuje połączenia jonów Ca
2+
z
mleczanami,
wodoro-
węglanami, fosforanami, siarczanami, cytrynianami i
innymi
anionami
(około
5% Ca),
- fizjologicznie aktywna forma jonów zjonizowanych (około 50%
Ca).
Znaczenie jonów Ca
2+
wynika głównie z ich udziału w przekazywaniu
bodźców nerwowych w mięśniach szkieletowych i mięśniu sercowym,
działaniu hormonów, udziału w procesach krzepnięcia krwi oraz
aktywacji wielu enzymów.
Stężenie Ca w osoczu zawiera się w przedziale 2,2-2,7 mmol/l (8,8-
10,8
mg/dl),
z
czego
45-50% stanowi wapń zjonizowany. Zwiększenie stężenia jonów Ca
2+
w
osoczu
powyżej
2,75 mmol/l jest wyrazem
hiperkalcemii
, ale częściej spotyka się
hipokalcemię
, której główną przyczyną są niedobory witaminy D3.

Równowaga kwasowo-zasadowa
MAGNEZ
Około 50%
magnezu
znajduje się w tkance kostnej, pozostała część
występuje
głównie
w płynach wewnątrzkomórkowych; w płynach zewnątrzkomórkowych jest
go tylko około 1%.
Przestrzeń zewnatrzkomórkowa stanowi wraz z kośćcem łatwo
wymienialną pulę, stabilną nawet przy znacznych zmianach stężenia Mg
w surowicy.
Stężenie Mg w osoczu wynosi 0,75-1,25 mmol/l (1,8 - 2,6 mg/dl), z czego
20-25%
związane
jest
z białkami. Biologicznie aktywną frakcją jest pula wolnych jonów Mg 2+
.
Około 32% magnezu związane jest z białkiem, 13% z anionami
organicznymi i nieorga-ganicznymi, a około 55% stanowią wolne jony
Mg
2+
.
Znaczenie pozakomórkowego jonu Mg
2+
wynika, podobnie jak Ca
2+
, z ich
roli w przewod-nictwie nerwowym. Mg jest antagonistą Ca, działa
paraliżująco na układ mięśniowy.
Mg jest niezbędny dla przebiegu wielu enzymatycznych reakcji,
zwłaszcza tych, w których uczestniczy ATP, bierze udział w reakcjach
fosforylacji zależnych od ATP.
PTH zwiększa, zaś aldosteron reabsorpcję Mg w nerkach i wzmaga jego
wydalanie z moczem.

Mikroelementy
FOSFOR
W organizmie człowieka:
- 80% fosforu w organizmie człowieka obecne jest w kośćcu i
zębach,
- pozostała część obecna jest w związkach organicznych (estry
fosforanowe,
kwasy
nukleinowe, nukleozydy (ATP), fosfolipidy błonowe,
fosforany węglowodanów.
Homeostaza Ca i P regulowana jest przez dietę, witaminę D i jej
metabolity,
PTH
i kalcytoninę.

Równowaga kwasowo-zasadowa
Główne wskaźniki gospodarki wodno-
elektrolitowej
Osocze/surowica:
[Na
+
] = 135-145 mmol/l
[K
+
] = 3,8-5,0 mmol/l
[Cl
-
] = 98-108 mmol/l
osmolalność: 280-300 mOsmol/kgH
2
O(M); 275-295
mOsmol/kg H
2
O(K)
[Ca
2+
] = 2,2-2,7 mmol/l
[Mg
2+
] = 0,7-1,1 mmol
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
Wyszukiwarka
Podobne podstrony:
WYKŁAD 10 równowaga kwasowo zasadowa
ZABURZENIA RÓWNOWAGI KWASOWO-ZASADOWEJ, Wykłady
Równowaga kwasowo zasadowa fizjot3
Równowaga kwasowo zasadowa fizjot3
Fizjologia kolo RKZ, II rok, II rok CM UMK, Giełdy, od Joe, FIZJOLOGIA, KOLOKWIA, RÓWNOWAGA KWASOWO-
woda jako składnik żywności oraz równowagi kwasowo- zasadowe w żywności, żywienie człowieka i ocena
01 rownowaga kwasowo zasadowa
SPEKTROFOTOMETRYCZNE?DANIE RÓWNOWAG KWASOWO ZASADOWYCH W ROZTWORACH WODNYCH sprawozdanie równowag
10 GOSPODARKA WODNO ELEKTROLITOWA I RÓWNOWAGA KWASOWO ZASADOWAid 10549 ppt
wyklad 16 Kataliza kwasowo zasadowa
więcej podobnych podstron