
„Zwiększenie liczby wysoko wykwalifikowanych absolwentów kierunków ścisłych Uniwersytetu Jagiellońskiego”
POKL.04.01.02-00-097/09-00
Projekt współfinansowany przez Unię Europejską w ramach Europejskiego Funduszu Społecznego
Wykład dla III roku Chemii UJ
„Zwiększenie liczby wysoko wykwalifikowanych absolwentów kierunków ścisłych Uniwersytetu Jagiellońskiego”
POKL.04.01.02-00-097/09-00
dr hab. Marek Mac
Kataliza kwasowo-zasadowa

2
Kataliza heterogeniczna
Kataliza homogeniczna- np. kataliza kwasowo-zasadowa
2H
2
O
2
(aq)
2H
2
O+O
2
(g) (katalizator Br
-
)
H
3
O
+
+H
2
O
2
H
3
O
2
+
+H
2
O
H
3
O
2
+
+Br
-
HOBr+H
2
O
HOBr+H
2
O
2
H
3
O
+
+O
2
+Br
-
k
ef
k
1
k
-1
k
2
k
3
Kataliza homogeniczna
]
][
[
]
[
2
2
3
2
3
O
H
O
H
O
H
K
]
][
[
2
3
2
Br
O
H
k
v
]
][
[
2
2
HBr
O
H
k
v
ef
reakcji
2
Kk
k
ef

3
Reakcja
Rodzaj
katalizatora
Proces
przemysłowy
kondensacji,
odwodnienia,
hydrolizy;
chlorowcowanie
wodne roztwory
kwasów, zasad,
fenol,
produkcja bisfenolu
fenol + aceton
bisfenol
(kondensacja)
kondensacja estrów
do poliestrów
alkilacja,
kraking,
hydrogenoliza,
izomeryzacja,
dysproporcjonowanie/meta
teza,
oligomeryzacja
kwasy
Broensteda
i
Lewisa takie jak
HF, H
2
SO
4
, AlCl
3
,
SbF
5
;
stężony HF
alkilacja olefin do
izo parafin (izo-
oktan)
Reakcje katalizowane przez kwasy i zasady
4
A-
A-
HA
HA
OH-
OH
H
H
c
k
c
k
c
k
c
k
k
k
0
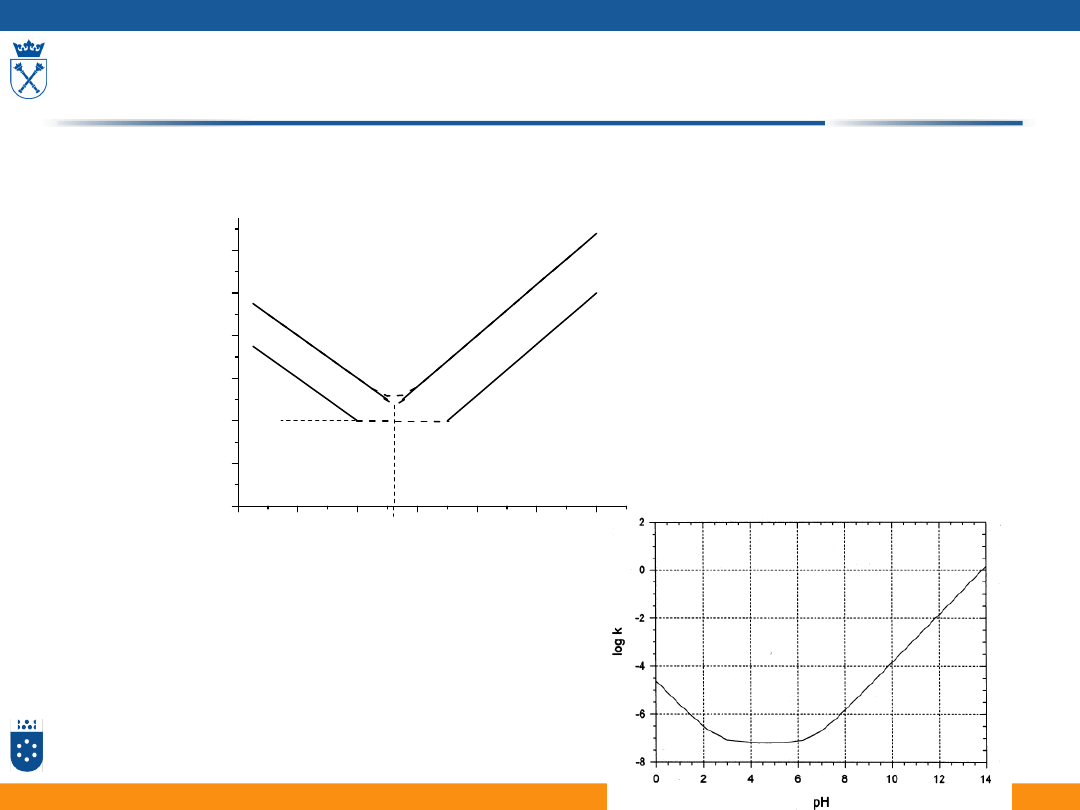
Ogólne równanie katalityczne
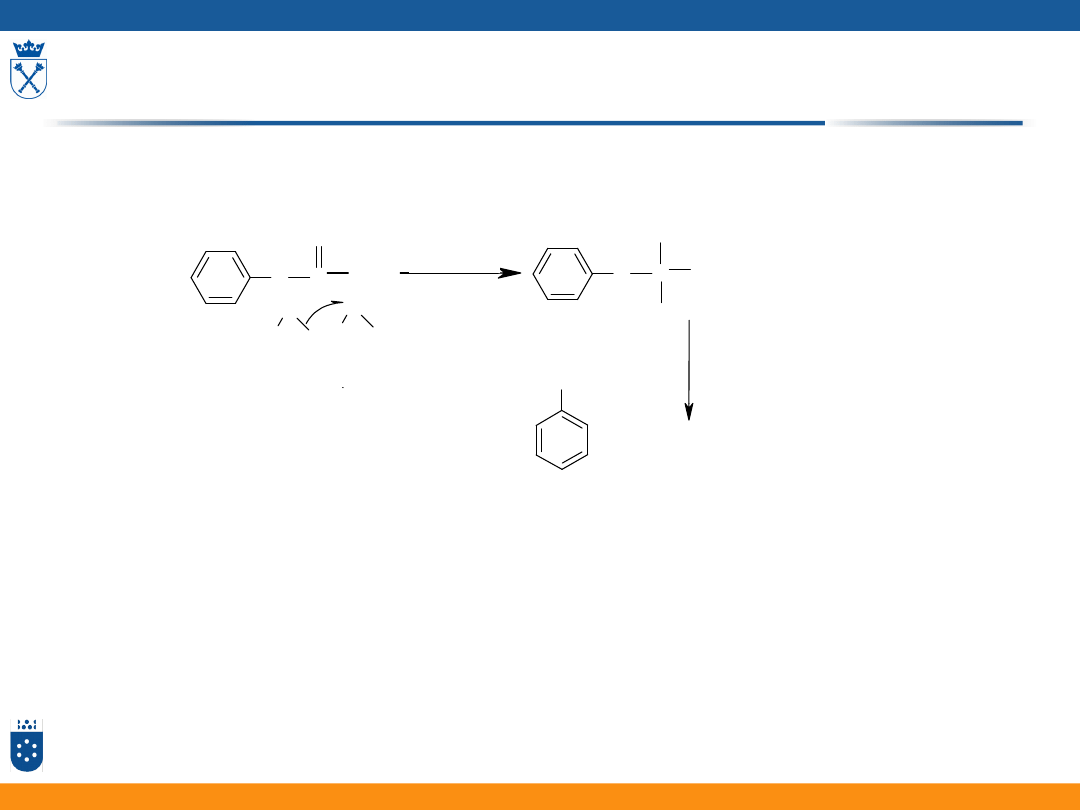
Hydroliza octanu fenylowego
0
2
4
6
8
10
12
0
1
2
3
4
5
6
kataliza zasadowa
lo
g(
k)
pH
kataliza kwasowa
pH
min
k
0
5
O
C
O
CH
3
H
O
H H
O
H
O
C
O
CH
3
OH
OH
3
+
OH
CH
3
COOH
-
etap wolny
+
etap
szybki
k
obs
= k
0
=6.03x10
-8
s
-1
Hydroliza octanu fenylowego
6
O
C
O
CH
3
O
C
O
CH
3
OH
2
OH
CH
3
COOH
H
3
O+
H
O
C
O
CH
3
H
OH
2
OH
2
OH
2
O
C
O
CH
3
H
OH
H
H
3
O+
OH
OH+
CH
3
O
H
C
OH
2
+
+
+
+
+
+
+
+
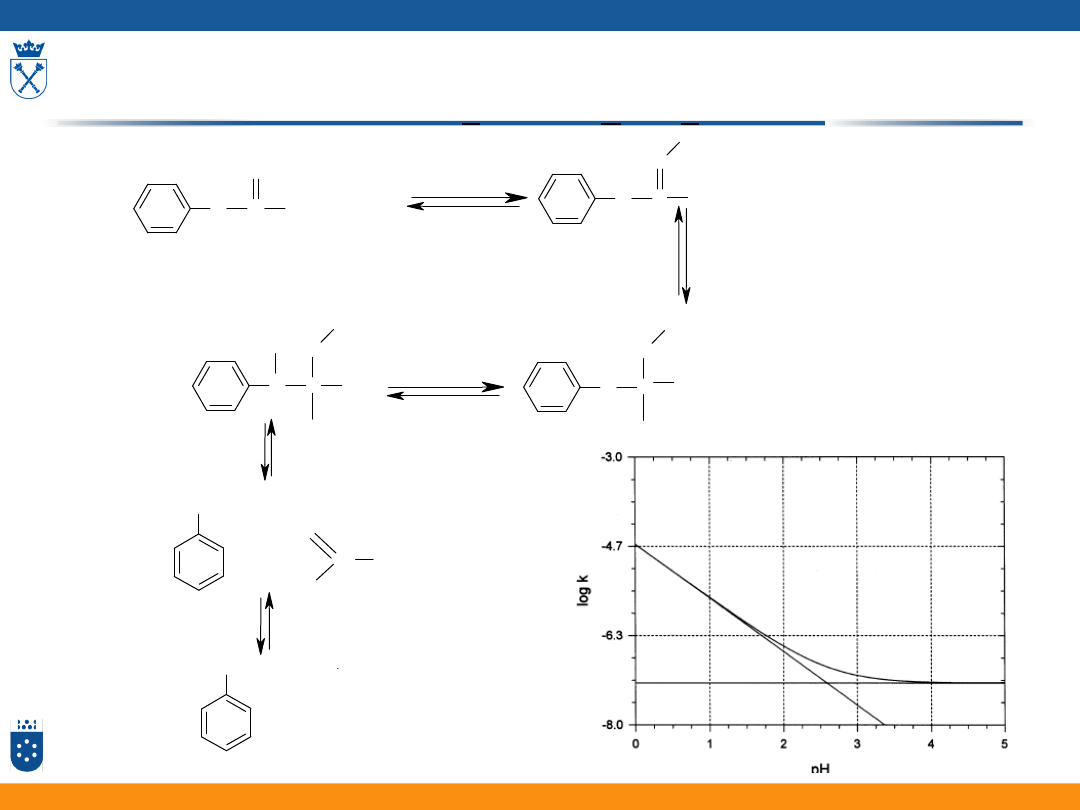
Reakcja katalizowana przez kwas [H
3
O
+
] (specyficzna
kataliza kwasowa – specific acid catalysis SAC)
pH
k
k
O
H
k
k
H
H
log
log
]
[
3
7
O
C
O
CH
3
O
C
O
CH
3
OH
O
CH
3
O
H
C
OH-
OH-
O
CH
3
O
C
O
+
+
+
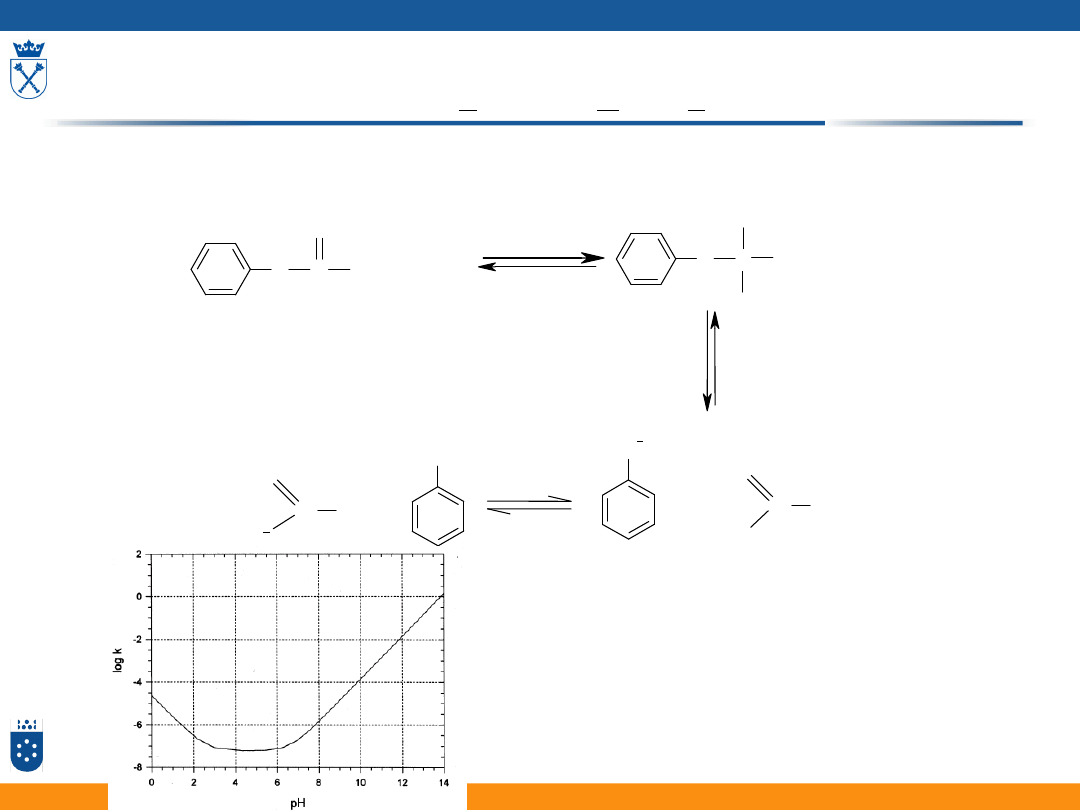
Reakcja katalizowana przez zasadę [OH
-
] (specyficzna
kataliza zasadowa – specific base catalysis SBC)
pH
k
k
OH
k
k
OH
OH
14
log
log
]
[
8
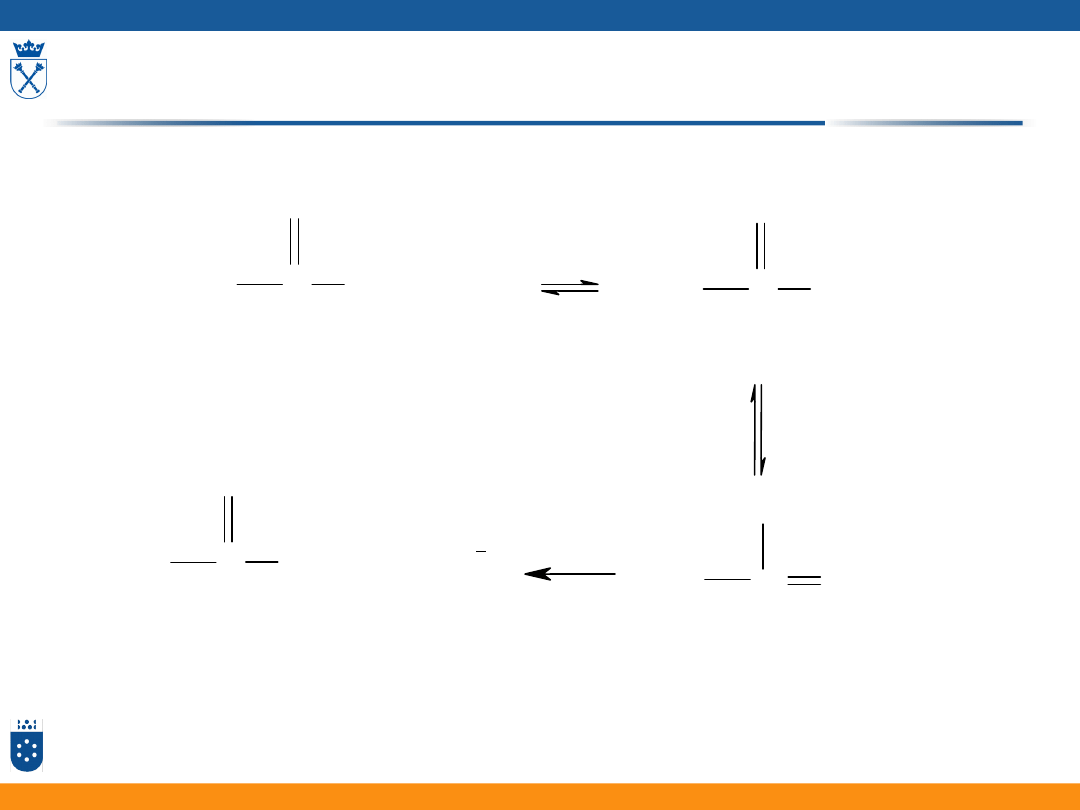
Reakcja katalizowana przez kwas [HZ] (ogólna
kataliza kwasowa – general acid catalysis GAC
)
S + HZ
SH
+
+ Z
-
PH
+
+ Z
-
P+HZ
k
1
k
-1
k
2
k
3
2
1
2
1
]
[
]
][
[
k
Z
k
HZ
S
k
k
v
gdy
2
1
]
[
k
Z
k
]
][
[
1
HZ
S
k
v
gdy
2
1
]
[
k
Z
k
K
H
k
k
Z
k
HZ
S
k
k
v
]
[
]
[
]
][
[
2
1
1
2
1
gdzie K jest stałą dysocjacji kwasu HZ
9
R
O
R1
HA
R
O
R1
OH
2
R
R1
OH
H
2
O+
A
HA
R
R1
OH
O
H
HA
+
+
+
rds
rds- rate determining step
Ogólna kataliza kwasowa
ketal hydrat ketonu
10
SH + Z
-
S
-
+ HZ
P
-
+ HZ
PH + Z
-
k
1
k
-1
k
2
k
3
Reakcja katalizowana przez zasadę [Z
-
] (ogólna
kataliza zasadowa – general base catalysis GBC)
]
][
[
]
[
3
HZ
P
k
dt
PH
d
v
]
][
[
]
[
]
[
3
2
HZ
P
k
S
k
dt
P
d
]
[
]
][
[
]
][
[
]
[
2
1
1
S
k
HZ
S
k
Z
SH
k
dt
S
d
2
1
2
1
]
[
]
][
[
k
HZ
k
Z
SH
k
k
v

11
2
1
]
[
k
HZ
k
gdy
]
][
[
1
Z
SH
k
v
2
1
]
[
k
HZ
k
gdy
K
k
OH
SH
k
k
HZ
k
Z
SH
k
k
v
1
2
1
1
2
1
]
][
[
]
[
]
][
[
HZ + OH
-
Z
-
+ H
2
O
gdzie K jest stałą równowagi reakcji
(GBC)
SBC
np. hydroliza estrów
R
O
OEt
B
OH
2
R
OH
OEt
O
R
O
OH
R
O
O
EtOH
+
+
EtO
-
-HB
-B
-
Ogólna kataliza zasadowa

12
Reakcje Broensteda
a
a
a
c
K
k
log
log
b
BH
b
c
K
k
log
log
Gdzie k
a
i k
b
są stałymi szybkości reakcji katalizowanymi
przez kwas a i zasadę b, K
a
i K
BH+
są stałymi dysocjacji kwasu A
i BH
+
,
,
,c
a
i c
b
są stałymi
13
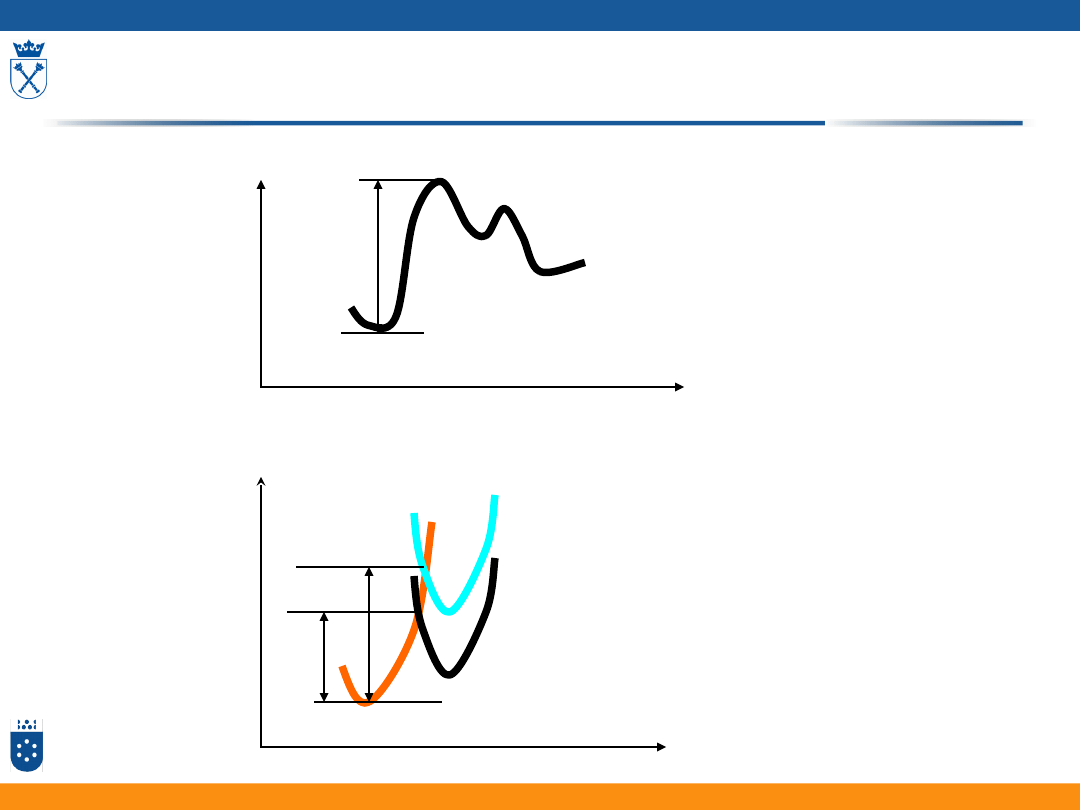
RH+
B
0
R
-
+B
0
H
+
G
#
wsp. reakcji
G
rozciąganie R-H
rozciąganie B-H
+
G
#
G
0
#
wsp. reakcji
G
Relacje Broensteda
produkty
zasada B
0
słabsza zasada B’
0
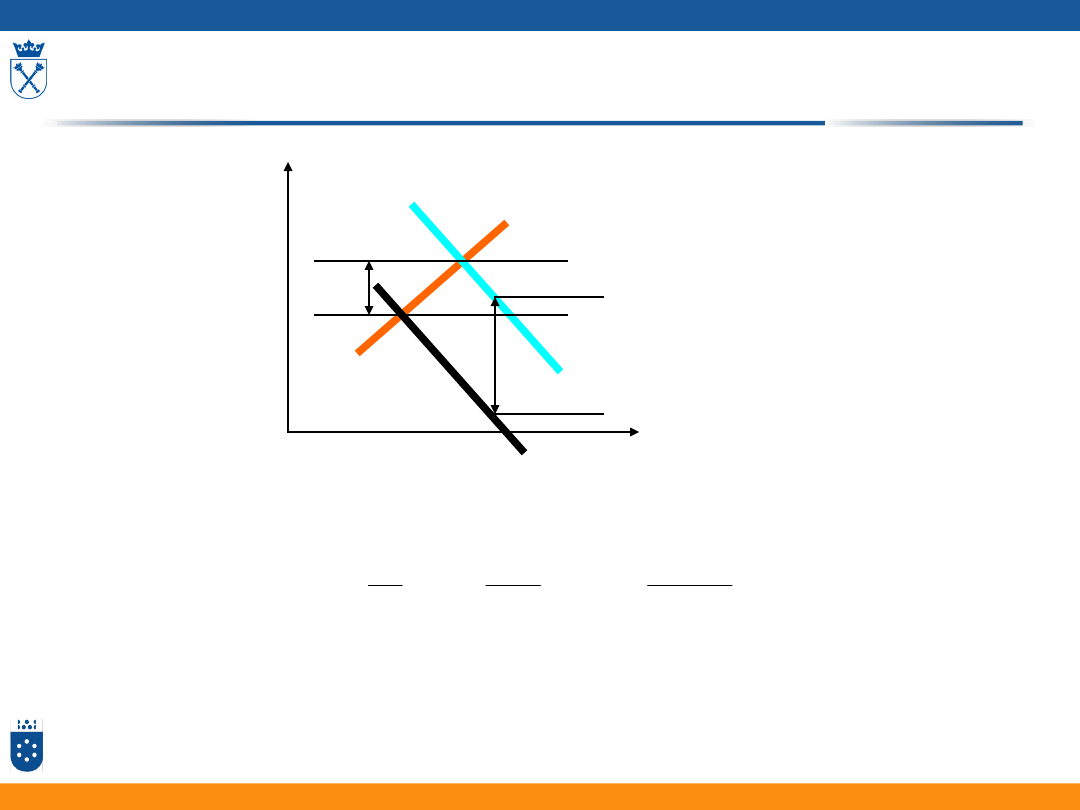
14
G
#
G
G
const
G
#
H
B
BH
b
b
b
K
K
K
K
k
k
0
log
log
log
0
0
Relacje Broensteda
)
log
(log
log
log
0
0
b
b
b
K
k
K
k
a
a
a
c
K
k
log
log
rozciąganie R-H
rozciąganie B-H
+
15
Jodowanie acetonu
CH
3
C
CH
3
O
CH
3
C
CH
3
O
OH
2
CH
3
C
O
CH
2
H
H
3
O+
I
2
CH
3
C
CH
2
I
O
H
+
I
k
1
k-
1
k
2
+ H
+
[
]
H
+
+
+ +
K
aceton
jon
enol
jodoaceton

16
]
[
]
[
]
][
][
[
2
2
1
2
2
1
I
k
H
k
I
H
aceton
K
k
k
v
]
[
]
[
2
2
1
I
k
H
k
gdy:
]
][
[
1
H
aceton
K
k
v
w środowisku zasadowym:
3I
2
+ 3OH
−
→ 3IO
−
+ 3I
−
I
II
III
IV
R-CO-CH
3
+ 3 OI
-
→ R-CO-CI
3
+
3 OH
-
R-CO-CI
3
+ OH
−
→ RCOOH+
−
CI
3
RCOOH+-CI
3
→ RCOO
-
+ CHI
3
Jodowanie acetonu
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
Wyszukiwarka
Podobne podstrony:
WYKŁAD 10 równowaga kwasowo zasadowa
Wykład X Podstawy równowagi kwasowo zasadowej
ZABURZENIA RÓWNOWAGI KWASOWO-ZASADOWEJ, Wykłady
Biofizyka-wyklad rwnowaga kwasowo-zasadowa, Fizjoterapia, Biofizyka
Równowaga kwasowo zasadowa fizjot3
Rˇwnowaga kwasowo zasadowa
Wykład 16 1
Równowaga kwasowo zasadowa fizjot3
Wskaźniki kwasowo zasadowe
Negocjacje i sztuka porozumiewania się, NEGOCJACJE I SZTUKA POROZUMIEWANIA SIĘ WYKŁAD 4( 16 06 2013)
Mechanizm wodno elektrolitowy i kwasowo zasadowy
Fizjologia kolo RKZ, II rok, II rok CM UMK, Giełdy, od Joe, FIZJOLOGIA, KOLOKWIA, RÓWNOWAGA KWASOWO-
woda jako składnik żywności oraz równowagi kwasowo- zasadowe w żywności, żywienie człowieka i ocena
01 rownowaga kwasowo zasadowa
Analiza Wykład 6 (16 11 10) ogarnijtemat com
więcej podobnych podstron