
Preparatyka katalizatorów
Preparatyka katalizatorów
Celem preparatyki katalizatorów przemysłowych -
uzyskanie produktu o wysokiej aktywności,
selektywności oraz stabilności.
Katalizatory przemysłowe:
pierścienie, kulki, tabletki, itp.
Produkcja katalizatorów : liczne
etapy fizyczne i chemiczne.
Warunki każdego z etapów
wpływają na właściwości
katalityczne.
Katalizatory muszą być
produkowane w ściśle
określonych i dokładnie
kontrolowanych warunkach.
1

Preparatyka katalizatorów
Preparatyka katalizatorów
Skład chemiczny i fazowy wnętrza i powierzchni
oraz tekstura katalizatora
zależą, często w
sposób decydujący, od metody otrzymywania
katalizatora oraz od jej parametrów zmiennych,
takich jak np. temperatura, stężenie czy pH
roztworu.
Zależnie od struktury i metody produkcji
katalizatory można podzielić na:
•bulk catalysts
•impregnated catalyst
•shell catalysts
•Immobilizowane
2

Preparatyka katalizatorów.
Preparatyka katalizatorów. Katalizatory
strąceniowe
„
Bulk catalysts
” są produkowane, gdy składniki aktywne są
tanie.
Preferowana metoda produkcji: wytrącanie z roztworów;
stąd nazwa
katalizatory
strąceniowe.
Metodami strąceniowymi otrzymuje się katalizatory
tlenkowe.
Strącenie wykorzystuje się do otrzymywania czystych
nośników.
Jeden lub więcej składników roztworu wodnego miesza się
w celu wytrącenia odpowiednich prekursorów.
Czynniki strącające: wodorotlenki alkaliczne, amoniak
węglany sodu, potasu i amonu. Wybór zależy od
dostępności, ceny oraz rozpuszczalności w stosowanym
rozpuszczalniku (najczęściej wodzie).
3

Preparatyka katalizatorów.
Preparatyka katalizatorów. Katalizatory
strąceniowe
Amoniak, związki amonowe, azotany i sole organiczne
rozkładają się na związki lotne przy dalszej obróbce
termicznej prekursora.
Użycie alkaliów powoduje konieczność starannego przemycia
osadów w celu usunięcia kationów litowców.
Poza wyjątkowymi sytuacjami chlorki to typowe trucizny
katalizatorów i ich obecność jest niepożądana. Podobnie
siarczany, które mogą być redukowane do siarczków w
ostatnim etapie aktywacji katalizatora.
4

Preparatyka katalizatorów.
Preparatyka katalizatorów. Katalizatory
strąceniowe
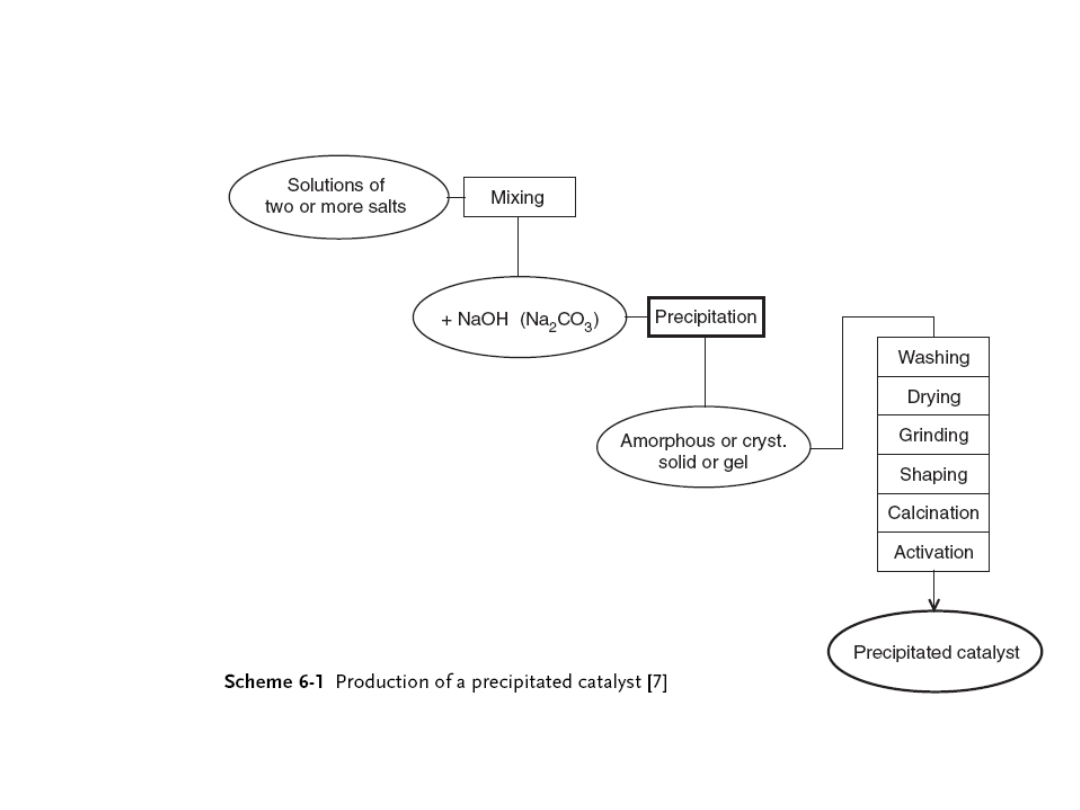
Wytrącony osad poddaje się starzeniu i oddzieleniu
od roztworu poprzez sączenie lub odparowanie.
Amorficzne lub krystaliczne osady lub żele, po
przemyciu od soli, suszy się, a następnie poddaje
się dalszej obróbce termicznej. I ewentualnej
dodatkowej aktywacji.
Na etapie formowania sproszkowany katalizator jest
plastyfikowany przez „zagniatanie” i formowany do
pożądanej postaci przez wytłaczanie i
sprasowywanie. Czynności te wpływają na
wytrzymałość mechaniczną katalizatora.
Strącanie jest pożądanym sposobem preparaty
katalizatorów tlenkowych oraz katalizatorów
metalicznych na nośnikach z zawartością metalu
wyższą niż 10-15%.
5

Struktura i tekstura katalizatorów
Struktura i tekstura katalizatorów
otrzymywanych metodami strąceniowymi
otrzymywanych metodami strąceniowymi
zależy:
zależy:
stężenia substancji wyjściowych w roztworze
temperatury strącania
pH roztworu
szybkość strącania
kolejności dodawania roztworów
czasu starzenia osadu
sposobu oddzielenia osadu od roztworu
macierzystego
6
Preparatyka katalizatorów.
Preparatyka katalizatorów. Katalizatory
strąceniowe
Warunki produkcji mogą wpływać
na takie właściwości
katalizatorów jak krystaliczność,
wielkość cząstek, porowatość i
skład chemiczny.
7

Preparatyka katalizatorów.
Preparatyka katalizatorów. Katalizatory
strąceniowe
8

Przykłady katalizatorów strąceniowych
Tlenek żelaza dla wysokotemperaturowej
konwersji CO (Fe
2
O
3
z dodatkiem Cr
2
O
3
)
Katalizator odwodornienia etylobenzenu do styrenu
(Fe
3
O
4
)
Przykłady prekursorów:
Cu(OH)NH
4
CrO
4
dla chrominu miedziowego
(katalizator Adkins’a)
Ni
6
Al
2
(OH)
16
CO
3
4H
2
O dla Ni/Al
2
O
3
9

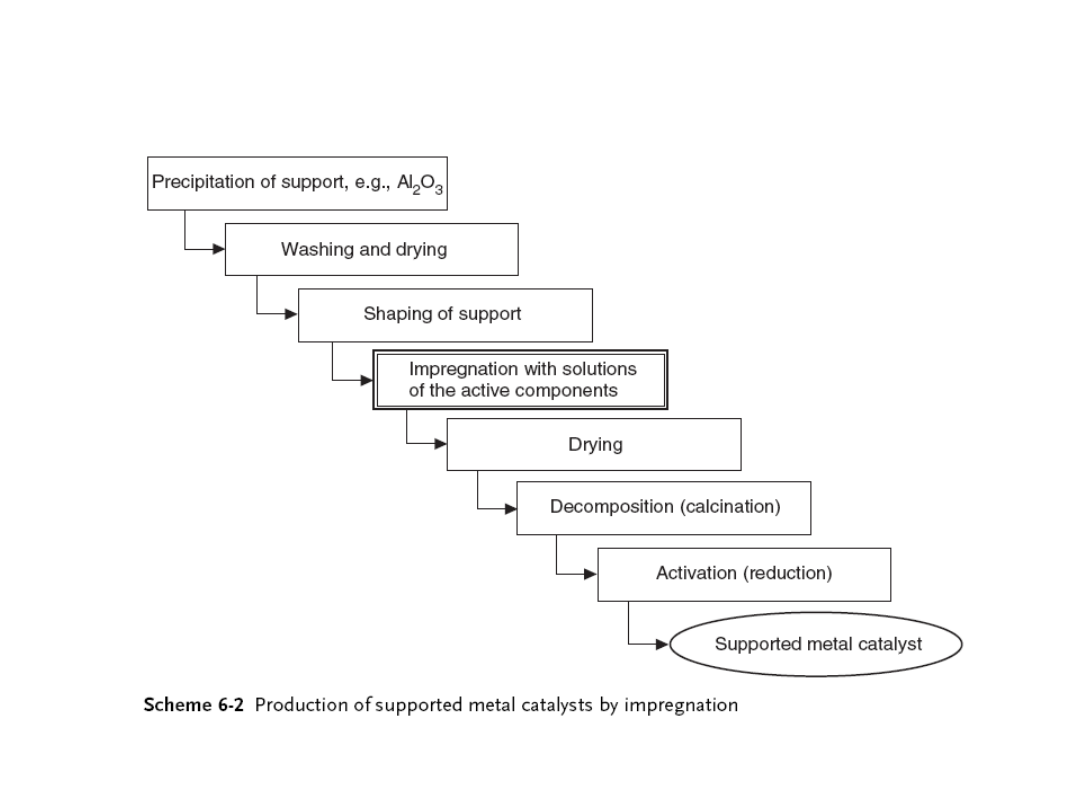
Preparatyka katalizatorów. Impregnacja
Impregnacja materiałów porowatych roztworem składnika
aktywnego jest
jedną z najlepiej opanowanych metod
produkcji katalizatorów.
Preferowana do otrzymywania metali szlachetnych na
nośnikach.
Najbardziej rozpowszechniony nośnik - Al
2
O
3
.
Po impregnacji katalizatory są suszone, sole metali
rozkładane pod wpływem temperatury do odpowiednich
tlenków. Dlatego stosuje się sole zawierające niestabilne
termicznie aniony (np. azotany, octany, węglany) oraz
także wodorotlenki).
10
Preparatyka katalizatorów. Impregnacja
11

Preparatyka katalizatorów. Impregnacja
Podczas impregnacji nośnik jest zanurzany w roztworze
składnika aktywnego w ściśle określonych warunkach
(stężenia, mieszania, temperatury, czasu, pH).
Selektywna sorpcja składnika aktywnego, zależnie od
warunków procesowych, zachodzi na powierzchni lub
wewnątrz nośnika. W efekcie uzyskuje się niejednolity
rozdział prekursora.
Żeby osiągnąć jak najlepszą impregnację usuwa się
powietrze z porów nośnika pod zmniejszonym ciśnieniem
lub traktuje nośnik gazami, np. CO
2
lub NH
3
przed
impregnacją.
Po impregnacji katalizator suszy się i kalcynuje.
12
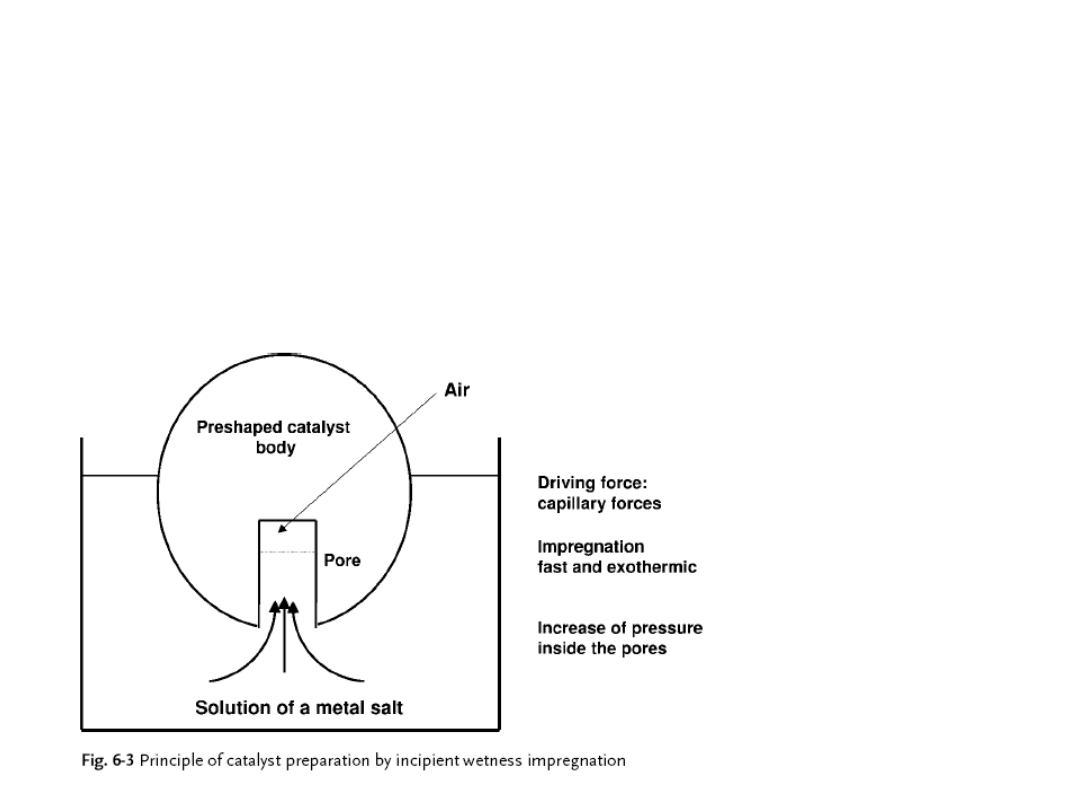
Preparatyka katalizatorów. Impregnacja
Impregnacja na sucho,
zwana też kapilarną; z ang. incipient
wetness impregnation or pore volume, or dry or capillary
impregnation (stanowi najkorzystniejszą metodą impregnacji
na duża skalę produkcji).
Polega na kontaktowaniu nośnika z roztworem prekursora
wziętym w ilości odpowiadającej całkowitej objętości porów.
13

Preparatyka katalizatorów. Impregnacja
Gdy otrzymywany jest katalizator o dużej zawartości
składnika aktywnego mogą wystąpić problemy z
rozpuszczalnością prekursora. Stosuje się wówczas
kilkukrotną impregnację.
Impregnacja kapilarna gwarantuje depozyt prekursora (po
usunięciu rozpuszczalnika w trakcie suszenia) również w
wypadku braku oddziaływań związków prekursora z
nośnikiem.
Szybkość suszenia zależy od temperatury i przepływu gazu.
Wpływa na dystrybucję metalu w ziarnie otrzymywanego
katalizatora
14
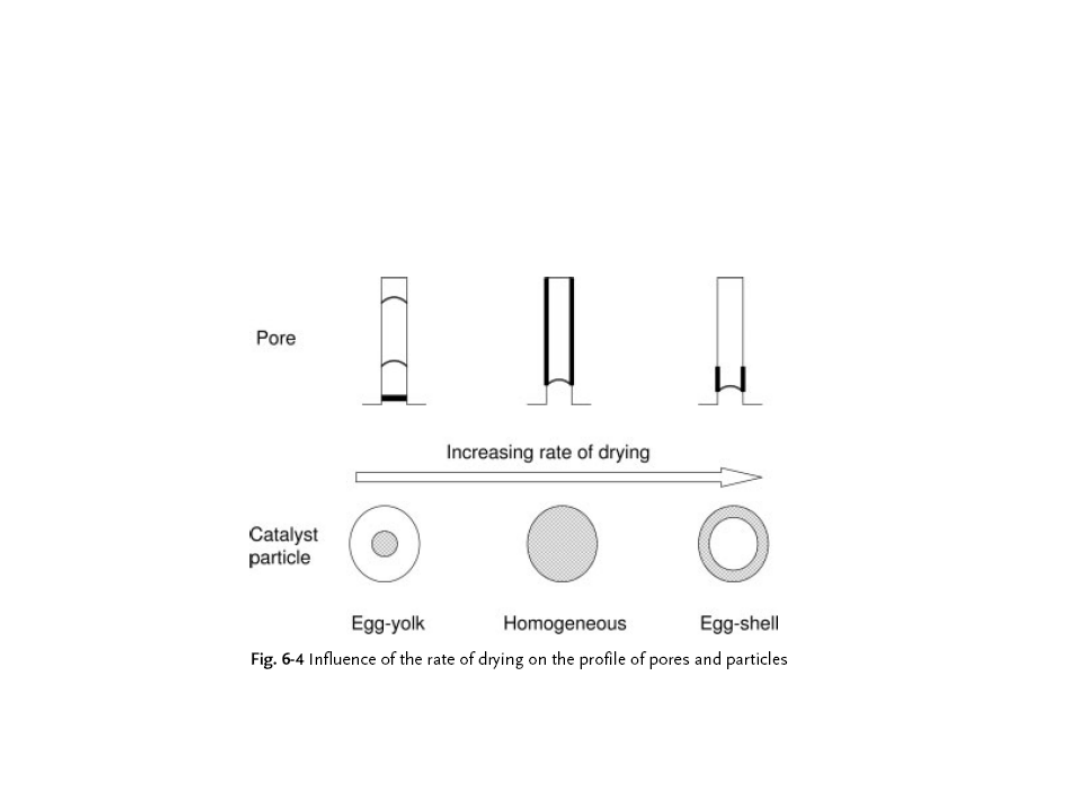
Preparatyka katalizatorów. Impregnacja
Różne formy dystrybucji prekursora na nośniku
15

Suszenie i kalcynacja
Suszenie i kalcynacja
Suszenie - usunięcie wody związanej fizycznie z
prekursorem katalizatora; zachodzi w temperaturze
80-200
o
C.
Kalcynacja – proces obróbki cieplnej w atmosferze
utleniającej w temperaturze nieco wyższej od
temperatury pracy katalizatora.
16

Procesy zachodzące podczas kalcynacji
Procesy zachodzące podczas kalcynacji
usunięcie obcych materiałów (np. smarów),
które
były
użyte
podczas
operacji
kształtowania
nośnika
(wyciskania,
tabletkowania).
rozkład
prekursorów
z
wytworzeniem
właściwej fazy aktywnej katalizatora, np.
rozkład
wodorotlenków
lub
soli
do
odpowiednich tlenków albo kompleksów
metali do czystych metali.
procesy krystalizacji faz amorficznych,
spiekanie fazy aktywnej polegające na
powstawaniu
większych
krystalitów
z
mikrokryształów,
17

Procesy zachodzące podczas kalcynacji
Procesy zachodzące podczas kalcynacji
-
-
c.d.
c.d.
reakcje w fazie stałej między składnikami fazy
aktywnej katalizatora lub fazą aktywną i
nośnikiem,
segregacja powierzchniowa składników.
lotne składniki prekursorów wydzielające się w
czasie rozkładu (np. NH
3
, H
2
O, CO
2
, NO
x
)
powodują
rozwinięcie
powierzchni
fazy
aktywnej i mogą wpływać na jej dyspersję.
18

Przy otrzymywaniu katalizatorów metalicznych stosuje
się prażenie w atmosferze wodoru (rozcieńczonego
azotem) lub redukcja (do metalu) CO, lub innym
łagodnym czynnikiem (np. parami alkoholu).
Redukcja
Redukcja
Często katalizatory redukuje się do formy metalicznej
w czasie wytwarzania, a następnie stabilizuje lub
poddaje pasywacji przed transportem przez utlenienie
cienkiego filmu metalu (za pomocą mieszaniny
utleniającej zawierającej 1-2% O
2
w N
2
) i ponownie
aktywuje bezpośrednio w reaktorze.
19

Cechy katalizatorów „impregnowanych”
Cechy katalizatorów „impregnowanych”
Struktura porów i powierzchnia właściwa są determinowane
przez nośnik
Odpowiedni dobór nośnika (wielkości powierzchni właściwej,
porowatości, kształtu i rozmiaru porów, mechanicznej
stabilności) decyduje o warunkach transportu masy .
W indywidualnych przypadkach możliwa jest praktycznie
molekularna dystrybucja składnika aktywnego; z reguły są to
krystality o średnicy 2–200 nm.
Aktywność katalityczna ograniczana jest procentową
zawartością składnika aktywnego na nośniku. Ze względów
ekonomicznych stosuje się 0,05–0,5 % dla metali
szlachetnych i 5–15 % dla innych metali.
20

Przykłady katalizatorów przemysłowych
Przykłady katalizatorów przemysłowych
Ethylene oxide catalysts in which a solution of a silver
salt is applied to Al
2
O
3
Catalysts in the primary reformer of ammonia
synthesis, with 10–20 % Ni on Al
2
O
3
Catalysts for the synthesis of vinyl chloride from
acetylene and HCl: HgCl
2
/ activated carbon; HgCl2 is
applied from aqueous solution
21

Preparatyka katalizatorów. Shell catalyst
Preparatyka katalizatorów. Shell catalyst
Tzw. „shell catalysts” zawierają nośnik w postaci
sferycznych cząstek lub pierścieni oraz fazę
aktywną w postaci cienkiej warstwy (0,1–0,3 mm)
w warstwie zewnętrznej nośnika. Skraca to drogę
dyfuzji reagentów i uniezależnia szybkość procesu
od struktury porów nośnika. Polepszenie transportu
ciepła w warstwie katalizatora
Otrzymywanie:
Krótkotrwałe zanurzanie silnie adsorbującego
nośnika w roztworze prekursora - najlepiej poznana
metoda preparatyki tzw. shell catalyst. W ten
sposób można otrzymać katalizatory zawierające
niewielkie ilość platyny o dużym stopniu dyspersji.
22
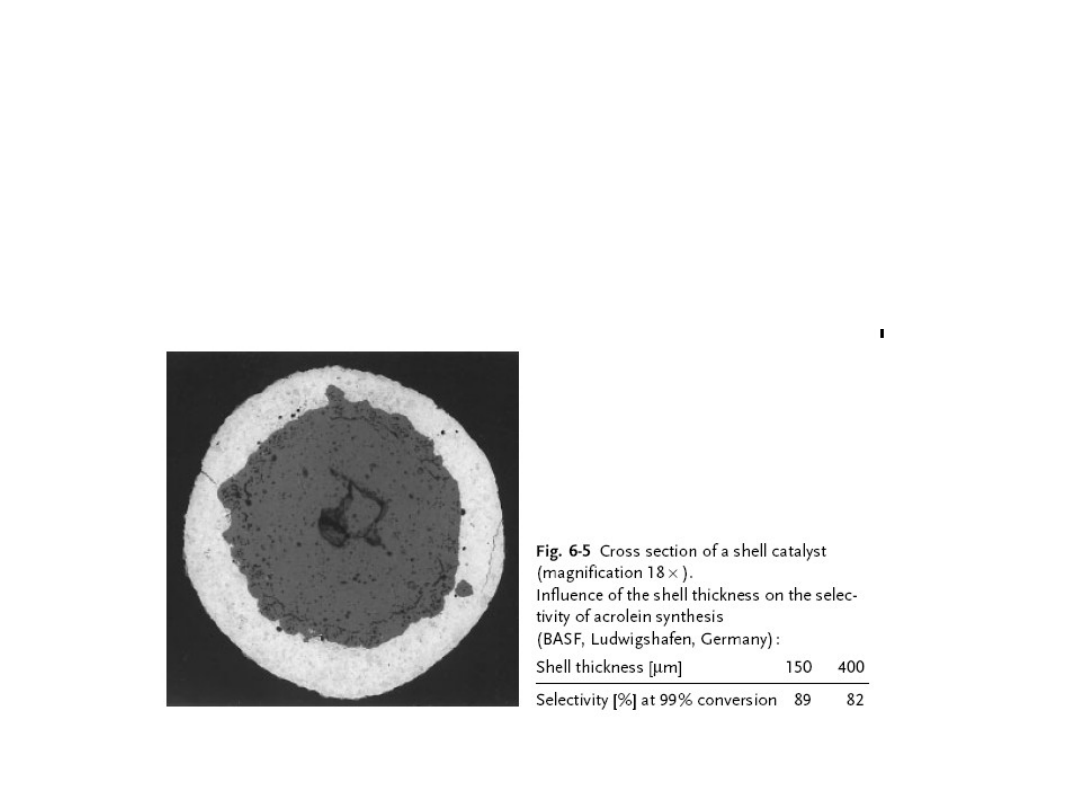
Preparatyka katalizatorów. Shell type
Preparatyka katalizatorów. Shell type
catalyst
catalyst
Grubość warstwy aktywnej ma to znaczenie w reakcjach
utlenienia, np. w syntezie akroleiny odpowiednia grubość
warstwy aktywnej ogranicza przebieg następczego
utlenienia produktu.
23
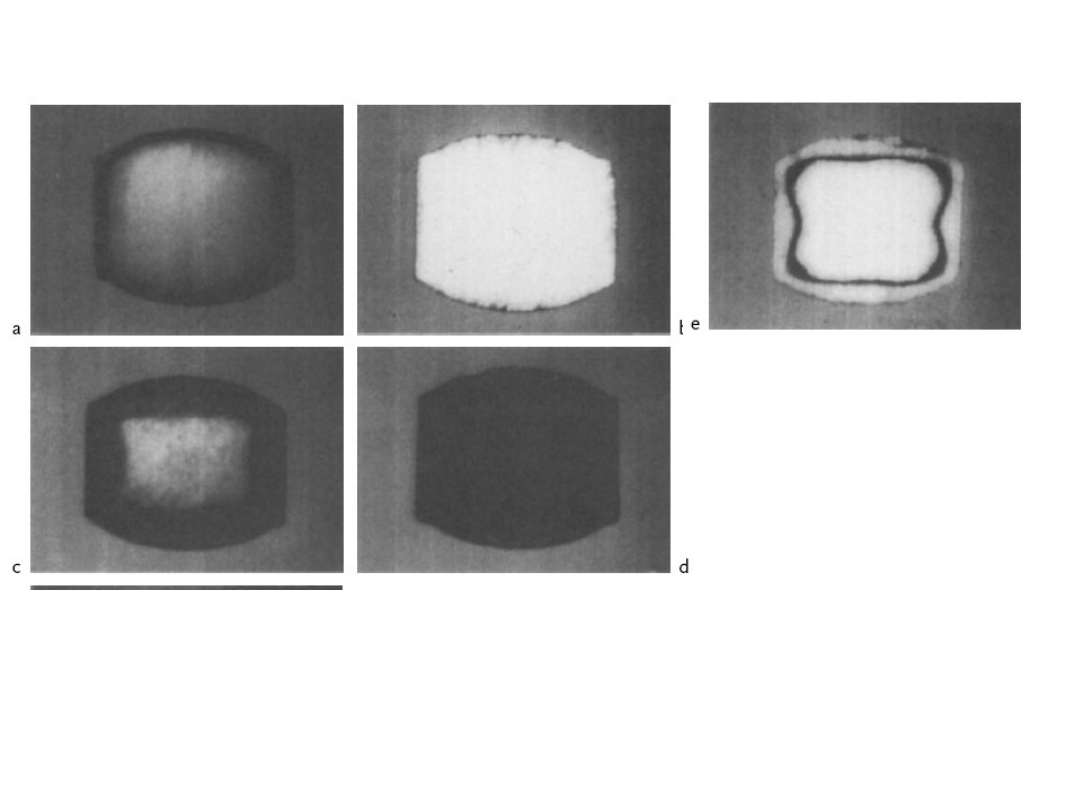
Fig. 6-6 Different metal distributions in pellets of diameter 6 mm
consisting of a metal on a support (Degussa, Hanau-Wolfgang,
Germany)
a) Shell catalyst with normal shell thickness; b) Shell catalyst with
an extremely thin shell
c) Shell catalyst with a thick shell ;d) Impregnated catalyst
e) Catalyst with ring distribution
24

Przykłady zastosowania katalizatorów
Przykłady zastosowania katalizatorów
„warstwowych”
„warstwowych”
Selective oxidation reactions, e. g., production of
acrolein from propene and of phthalic anhydride
from o-xylene
Purification of automobile exhaust gases
Selective oxidation of benzene to maleic
anhydride: vanadium molybdenum oxide on fused
corundum (catalytically inactive support without
pores)
Autothermal decomposition of liquid hydrocarbons
on NiO/-Al
2
O
3
shell catalysts (high selectivity for
lower alkenes
25

Osadzanie
Osadzanie
Strącanie
wodorotlenku
lub
węglanu
na
cząstkach rozdrobnionego nośnika.
Strącanie powinno następować wewnątrz porów
nośnika.
Powinno następować powoli, aby zarodkowanie i
wzrost na powierzchni skutkowały jednorodnym
rozmieszczeniem cząstek prekursora na nośniku.
Najlepsza zasada – mocznik, który dodany w
temperaturze pokojowej stopniowo hydrolizuje do
wodorotlenku amonu wraz z ogrzewaniem do
temperatury 90
o
C.
26

Wymiana jonowa
Wymiana jonowa
Tlenki nieorganiczne, takie jak Al
2
O
3
, SiO
2
, TiO
2
,
MgO, wykorzystywane jako nośniki są polaryzowane
i zewnętrznie jonizowane poprzez zanurzenie w
roztworze.
Ładunek zależy od rodzaju nośnika i pH roztworu.
W
roztworze
kwaśnym
miejsca
aktywne
pokrywane są przez aniony, zaś w zasadowym
przez kationy.
M-OH + H
+
A
-
M-OH
2
+
A
-
M-OH + OH
-
M-O
-
+ H
2
A
27

Punkt izoelektryczny (P.I) tlenków (
Punkt izoelektryczny (P.I) tlenków (punkt zerowego
ładunku)
Tlenek w kontakcie z roztworem, którego pH jest
poniżej P.I. polaryzuje się dodatnio i otacza się
kompensującymi ten ładunek anionami, a w
kontakcie z roztworem o pH wyższym od P. I.
polaryzuje się ujemnie, adsorbując kationy.
Znając
wartości
P.I.
można
określić
w
przybliżeniu,
jaki
typ
kompleksu
metalu,
anionowy lub kationowy, należy wybrać dla
danego tlenku-nośnika, jak również jaki zakres
pH należy stosować przy nanoszeniu.
28

Punkt izoelektryczny – c.d.
Punkt izoelektryczny – c.d.
Przykład: adsorpcja kompleksów platyny typu
kationowego [Pt(NH
3
)
4
]
2+
lub anionowego [PtCl
6
]
2-
na : SiO
2
i -Al
2
0
3
SiO
2
(P.I. 1,5-3,0) – pH roztworu powinno być wyższe
od 3, a użyty prekursor powinien mieć charakter
kationu
brak
adsorpcji
[PtCl
6
]
2-
z
kwasu
chloroplatynowego; słaba absorpcja [Pt(NH
3
)
4
]
2+
z
roztworu
chlorku
tetraaminaplatyny(II),
[Pt(NH
3
)
4
]Cl
2
(zbyt niskie pH); dobra absorpcja
[Pt(NH
3
)
4
]
2+
z roztworu [Pt(NH
3
)
4
](OH)
2
-Al
2
0
3
(P.I. 8) - warunkiem adsorpcji jest anionowy
prekursor o pH niższym od 8 lub kationowy o pH
wyższym od ok. 8.
dobra absorpcja prekursora zarówno z roztworów
kwasu chloroplatynowego(II), jak i chlorku lub
wodorotlenku tetraaminaplatyny(II).
29

Inne przykłady „szczepienia” prekursora na
Inne przykłady „szczepienia” prekursora na
katalizatorach tlenkowych wyniku reakcji z
katalizatorach tlenkowych wyniku reakcji z
grupami hydroksylowymi
grupami hydroksylowymi
Katalizatory na osnowie V
2
O
5
, MoO
3
, Cr
2
O
3
w
formie monowarstwy na powierzchni SiO
2
i
TiO
4
.
Substancje wyjściowe – chlorki i oksochlorki
metali, np. MoCl
5
, VOCl
3
, CrO
2
Cl
2
lub kompleksy
tych metali.
Hydroliza prowadzi do połączeń typu
–Si-O-
VO(OH)
2
, które po prażeniu w powietrzu dają
warstwę tlenku wanadu(V).
Si-OH + VOCl
3
Si-OVOCl
2
+ HCl
Si-OH
Si-OH
+ VOCl
3
VOCl
O
O
Si
Si
30
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
Wyszukiwarka
Podobne podstrony:
katalizatory heterogeniczne cz 1 2009
modelowanie DFT w katalizie heterogenicznej
Oczyszczanie gazow odlotowych cz[1] 1 2009
Zielona kataliza heterogeniczna w ochronie środowiska(1)
odp cz I(4)2009
Podst rachunk zad cz 1 2009
modelowanie DFT w katalizie heterogenicznej
Morfina u terminalnie chorych Cz 2009
Chemia fizyczna Ćw 12 Kataliza heterogeniczna 1
Chemia fizyczna Ćw 12 Kataliza heterogeniczna 1
Chemia fizyczna Ćw 12 Kataliza heterogeniczna
dla klas dwujęzycznych cz 1 2009
Wzorniki cz 3 typy serii 2008 2009
MTR 2009 Wstep do mechatr cz 3 (2)
arkusz 2009 x cz 2
2009 egzamin zawodowy, cz praktyczna z komentarzem
więcej podobnych podstron