
Kinetyczno – molekularny model gazu doskonałego
(przełom XIX i XX w. – J.W. Gibbs, L. Boltzmann)
Założenia:
-cząsteczki gazu są to punkty materialne,
-poruszają się ruchem chaotycznym,
-drogę między zderzeniami (fragment prostej) nazywamy drogą
swobodną.
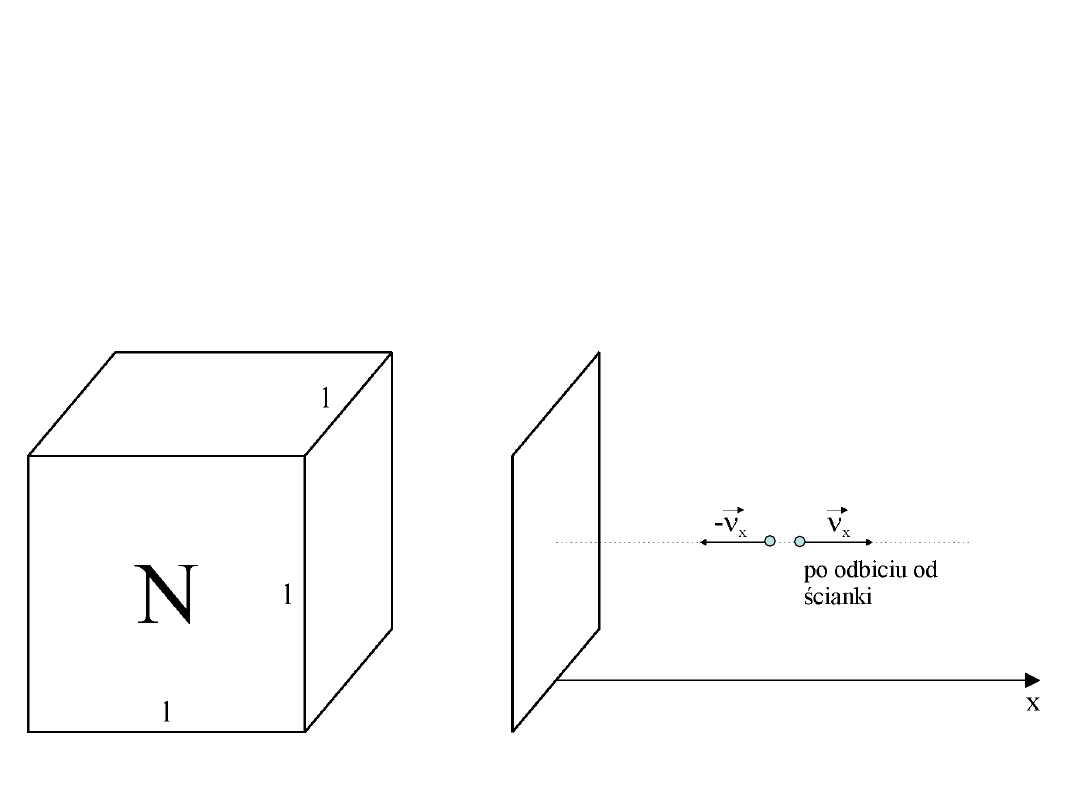
Równanie gazu doskonałego, jako wniosek z teorii kinetyczno – molekularnej
W sześciennym naczyniu o krawędzi l znajduje się N cząsteczek gazu.
m – masa cząsteczki
x
– składowa prędkości cząsteczki w kierunku osi x

Zmiana pędu cząstki przy jednym zderzeniu ze ścianką naczynia:
(
) 2
x
x
x
m
m
m
n
n
n
- -
=
Ile zderzeń następuje w czasie 1 s ?
Czas przelotu cząstki między ścianką lewą i prawą i z powrotem wynosi:
2
x
l
t
n
=
Liczba zderzeń jest równa odwrotności tego czasu (np. jeśli czas wynosi
0,2 s to liczba zderzeń n = 5
1
/s, czyli 5 zderzeń w czasie 1 s).
Zatem liczba zderzeń cząsteczki ze ścianką w czasie 1 s wynosi:
1
2
x
n
t
l
n
= =
Zmiana pędu przy tej samej liczbie zderzeń wynosi:
{
{
{
2
zmiana pędu
liczba
zmiana pędu w
przy jednym zderzeń
czasie 1s dla
zderzeniu
jednej cząstki
2
2
x
x
x
m
m
l
l
n
n
n � =
Zmiana pędu w czasie 1s w przypadku N cząsteczek:
1
2
2
2
2
2
2
2
1
2
(
...
)
...
N
N
x
x
x
x
x
x
m
m
m
m
l
l
l
l
n
n
n
n
n
n
+
+ +
+
+ +
=
Wyrażenie to pomnóżmy i podzielmy przez N
2
2
2
1
2
2
(
...
)
N
x
x
x
x
Nm
m
N
Nl
l
n
n
n
n
+
+ +
=
Ponieważ żaden z kierunków nie jest wyróżniony możemy zapisać:
2
2
1
3
x
n
n
=
Zmiana pędu w czasie 1s N cząsteczek równa się:
2
1
3
m
N
l
n
Z II zasady dynamiki
sr
p
F
t
D
=
D

Oznaczamy:
P – ciśnienie na ściankę
S – powierzchnia ścianki
l
3
– objętość naczynia
Zmiana pędu p spowodowana jest siłą F
śr
(W czasie 1s siła ulega fluktuacji, bierzemy więc F
śr
).
2
1
3
śr
m
F
N
l
n
=
2
2
2
3
1
3
3
śr
F
m
m
P
N
N
S
l l
l
n
n
=
=
=
�
2
2
3
2
m
PV
N
n
=
2
3
k
PV
Ne
=
k
e
równanie gazu doskonałego
-
średnia energia kinetyczna
cząsteczki

Eksperymenty:
1.Robert Boyle (1627 – 1691) – fizyk angielski
Edme Mariotte (1620 – 1684) – fizyk francuski
Prawo Boyle i Mariotte’a:
PV const
=
m = const
T = const
2.Jacques A. Charles (1746 – 1823) – fizyk francuski
Prawo
Charlesa:
P
const
T
=
m = const
V=const
3.Joseph L. Gay-Lussac (1778 – 1850) – fizyk francuski
Prawo Gay-
Lussac’a:
V
const
T
=
m = const
P = const
4.Benoit P. Clapeyron (1799 – 1864) – fizyk francuski
Równanie
Clapeyrona:
PV nRT
=
R = 8,31432
mol
J
K
�
�
�
�
�
�
�
Porównanie wyników eksperymentów z wnioskami z modelu
2
3
A K
PV RT
PV
N e
=
�
�
�
=
�
�
dla 1 mola gazu n = 1, N = N
A
stąd
2
3
3
2
A K
K
A
N
RT
R
T
N
e
e
=
=
A
R
k
N
=
k – stała
Boltzmanna
k = 1,38 * 10
-23
J
K
N
A
- liczba Avogadra
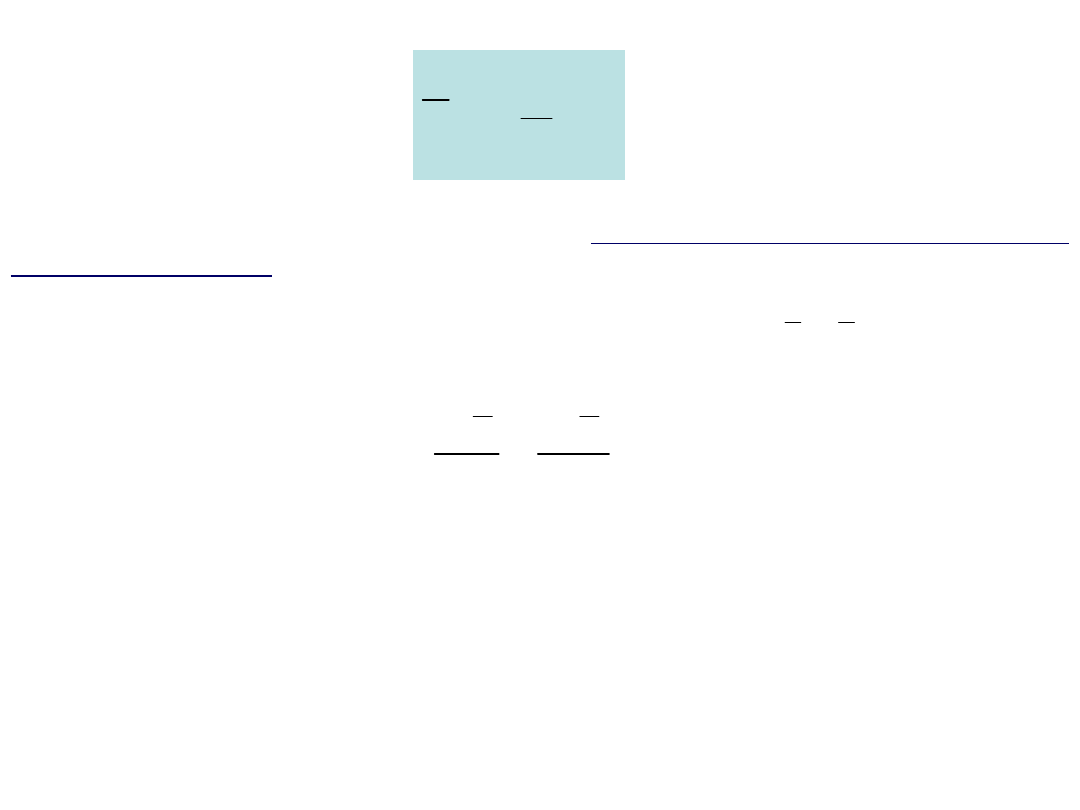
3
2
K
kT
e =
Powyższy wzór pozwala na interpretację temperatury jako miary średniej
energii kinetycznej ruchu postępowego cząsteczek.
Jeśli mamy dwa gazy w tej samej temperaturze, przy czym m
2
> m
1
to
1
2
n n
>
, ponieważ
W tej samej temperaturze atomy gazu cięższego poruszają się wolniej niż
lżejszego (gaz cięższy dyfunduje wolniej niż lżejszy).
1 1
2 2
2
2
m
m
n
n
=
2
2

Energia wewnętrzna
Przy założeniu, ze cząsteczki gazu są punktami materialnymi całkowita
energia gazu jest energią ruchu postępowego cząsteczek.
Nazywamy ją
energią wewnętrzną U.
Zatem
2
3
PV
U
=
Traktując cząsteczki jako układy złożone energią wewnętrzną nazywamy
sumę wszystkich rodzajów energii: kinetycznej ruchu postępowego i
obrotowego, oscylacyjnego, energii potencjalnej oddziaływania atomów,
elektronów, energii wewnątrz-jądrowej, związanej z masą cząstek.
2
m
U N
n
=
2
Energia wewnętrzna układ cząstek gazu wzrasta, gdy nad układem
zostanie wykonana praca sił zewnętrznych.
0
0
zewn
zewn
W
U W
U
>
D =
D >
Przy założeniu, że W
zewn
= 0 energia wewnętrzna układu może wzrastać
na sposób ciepła (w procesie cieplnym).
U Q
D =
Ogólnie:
zewn
U W
Q
D =
+
I zasada termodynamiki
1. W układzie odosobnionym W
zewn
= 0
U Q
D =
2. W układzie izolowanym adiabatycznie Q = 0
zewn
U W
D =
(sprężanie)
(Q – ilość ciepła)
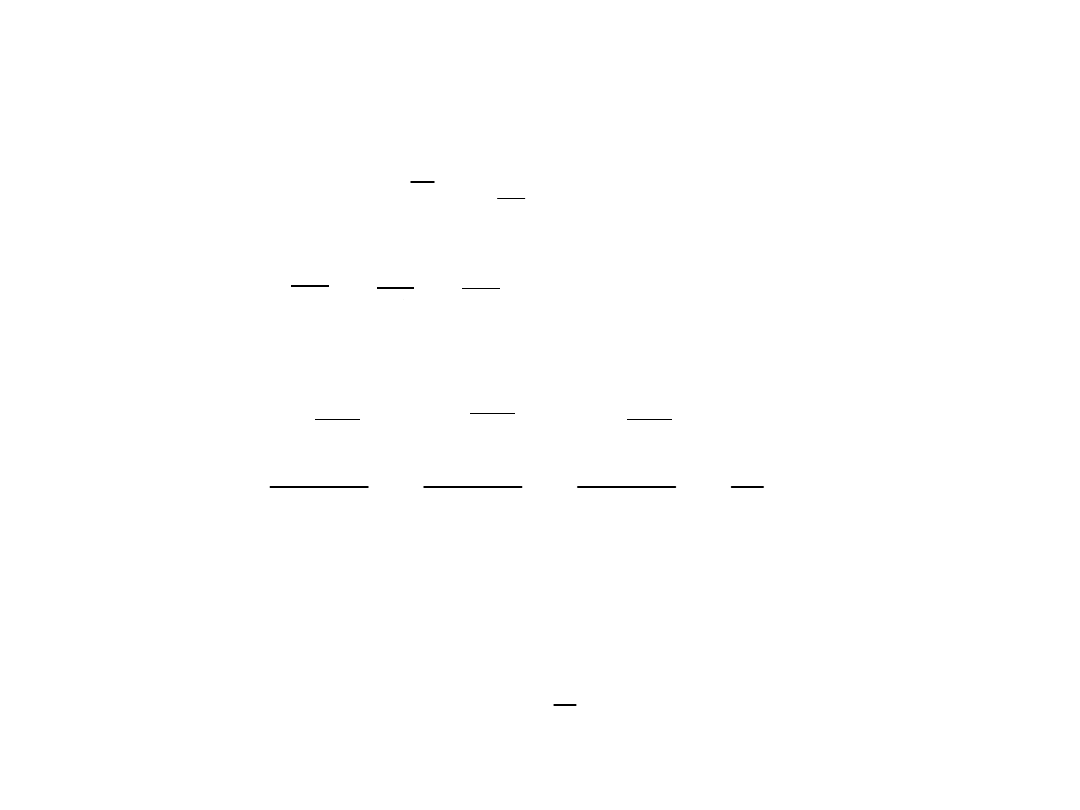
Zasada ekwipartycji energii
3
2
K
kT
e =
Ponieważ
2
2
2
x
y
z
n
n
n
= =
2
2
2
1
2
2
2
2
y
x
z
m
m
m
kT
n
n
n
=
=
=
Energia kinetyczna rozkłada się na trzy niezależne ruchy w kierunkach
wzajemnie prostopadłych – na trzy stopnie swobody.
Na każdy stopień przypada energia równa
1
2
kT
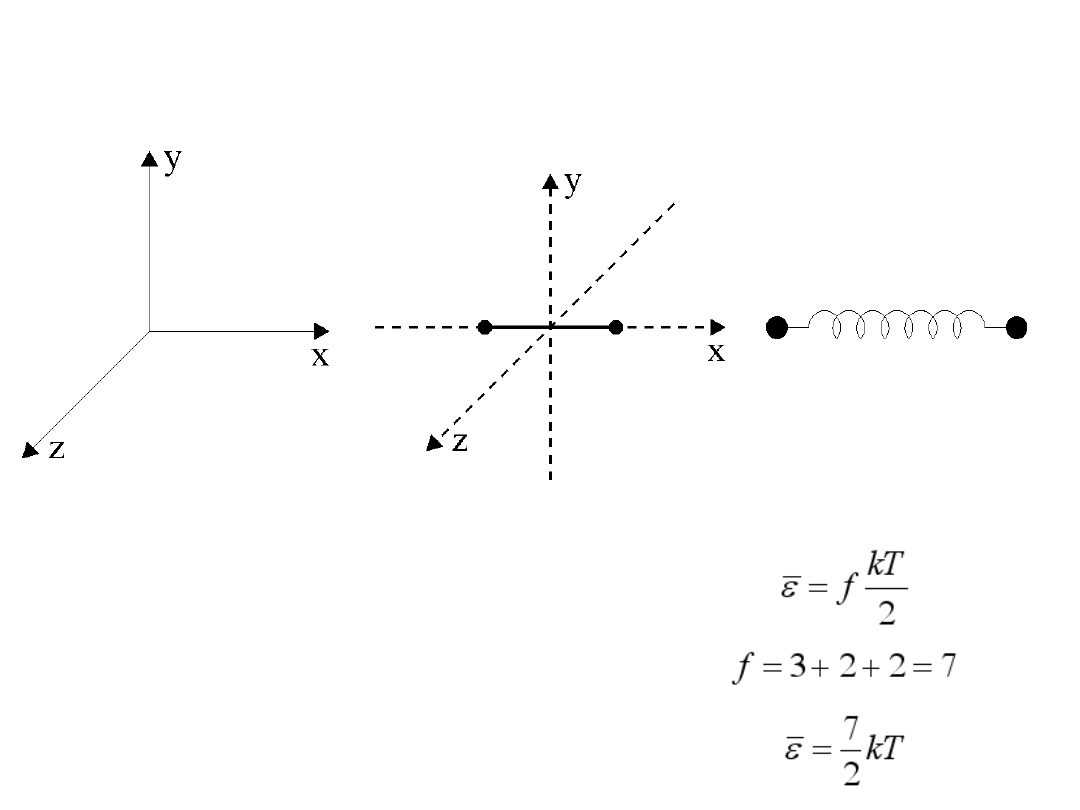
Cząsteczka dwuatomowa ma dodatkowe dwa stopnie swobody na energię
ruchu obrotowego wokół dwóch niezależnych osi obrotu oraz ponadto dwa
stopnie swobody na energie kinetyczną i potencjalną ruchu oscylacyjnego.
ruch postępowy f
1
= 3
ruch obrotowy f
2
= 2
ruch oscylacyjny f
3
= 2
Całkowita średnia energia jaką
ma ta cząsteczka w temperaturze
T wynosi:
Liczbę niezależnych od siebie sposobów
„magazynowania” energii nazywamy liczbą
stopni swobody f

Energia wewnętrzna jednego mola gazu wynosi:
2
2
A
kT
U N f
const
RT
U
f
const
=
+
=
+
Ciepło właściwe gazu (molowe)
Doprowadzanie do 1 mola gazu ciepła o ilości dQ powoduje
wzrost temperatury o dT (V = const).
Ciepłem właściwym nazywamy stosunek
dQ
C
dT
=
Ale
dQ dU
=
zaś
2
RdT
dU
f
=
Zatem
2
RdT
C f
dT
=
2
R
C f
=

2
R
C f
=
W przypadku gazów jednoatomowych (f = 3)
12,47
mol
J
C
K
=
�
W przypadku molekuł dwuatomowych liczba stopni swobody może wynosić 3, 5 lub 7.
Np. dla H2 w temperaturach
poniżej 100 K
12,5
mol
J
C
K
=
�
f=3, ruch postępowy
do 400 K
20,9
mol
J
C
K
=
�
+ rotacja
powyżej 3500 K
29,3
mol
J
C
K
=
�
+ oscylacja
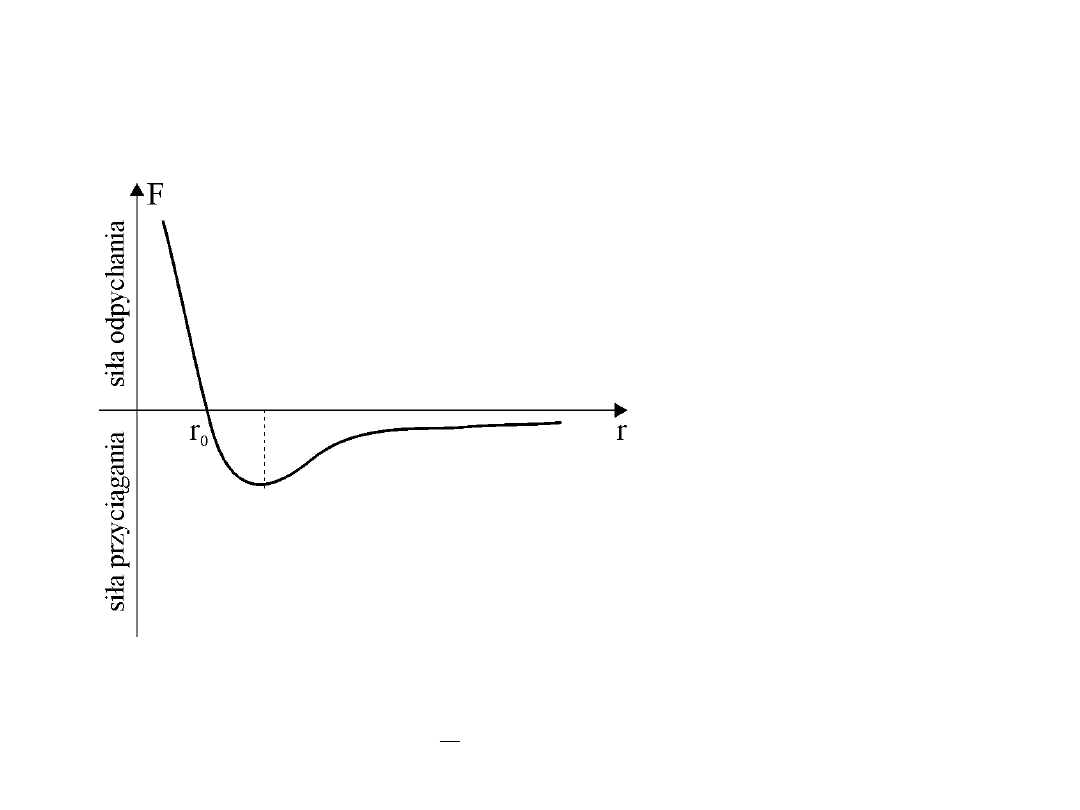
Gazy rzeczywiste
1. Między molekułami gazu rzeczywistego istnieją siły wzajemnego
oddziaływania
(siły międzycząsteczkowe).
r
o
– położenie równowagi
2. Molekuły nie są punktami. Można je traktować jako doskonale
sprężyste kulki
o promieniu r
k
i objętości
3
4
3
k
k
V
r
p
=
Uwzględnienie skończonych wymiarów cząsteczek oraz ich wzajemnego
oddziaływania pozwoliło fizykowi holenderskiemu J. Van der Waalsowi
otrzymanie równania dobrze opisującego właściwości gazów
rzeczywistych.
(
)
2
a
P
V b
RT
V
�
�
+
-
=
�
�
�
�
równanie Van der Waalsa
gdzie:
P – ciśnienie
V – objętość
T – temperatura
gazu
a
4
2
Nm
mol
�
�
�
�
�
�
�
�
b
3
m
mol
�
�
�
�
�
�
�
�
ciało w stanie
lotnym
wodór
0,0032
23,4 * 10
-6
tlen
0,1360
31,9 * 10
-6
para wodna
0,5480
30,6 * 10
-6
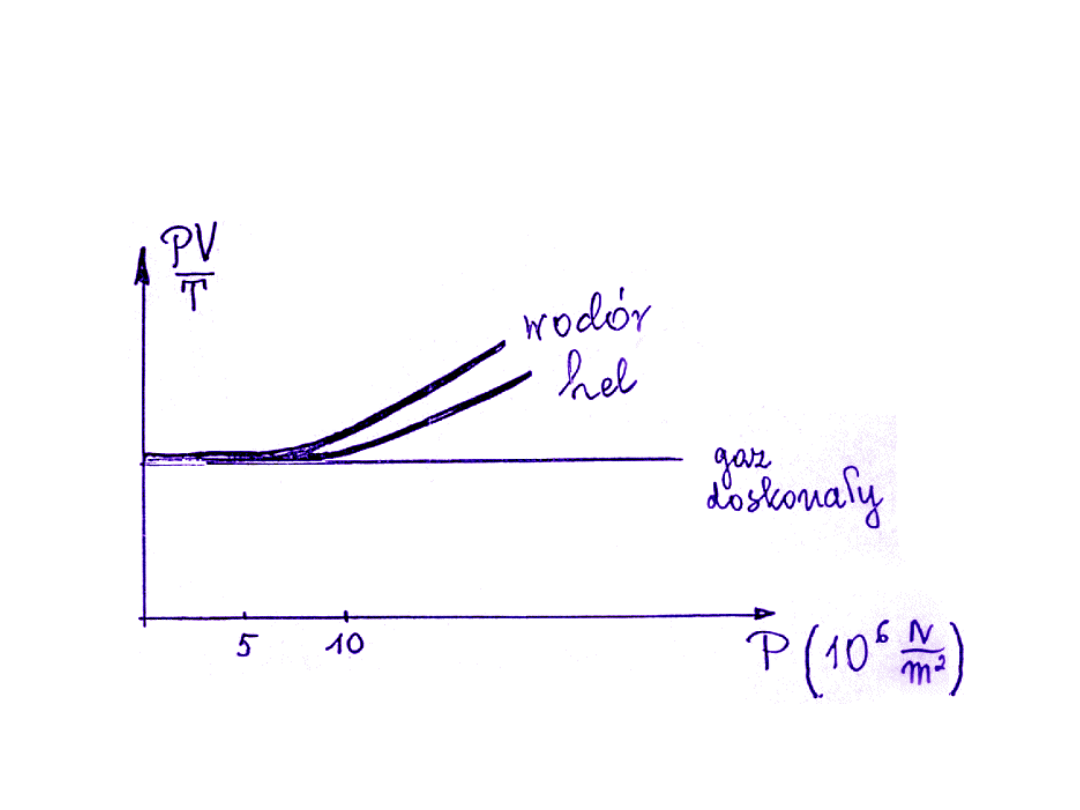
W wysokich temperaturach i przy niskich ciśnieniach gazy
rzeczywiste stosują się do równania Clapeyrona.
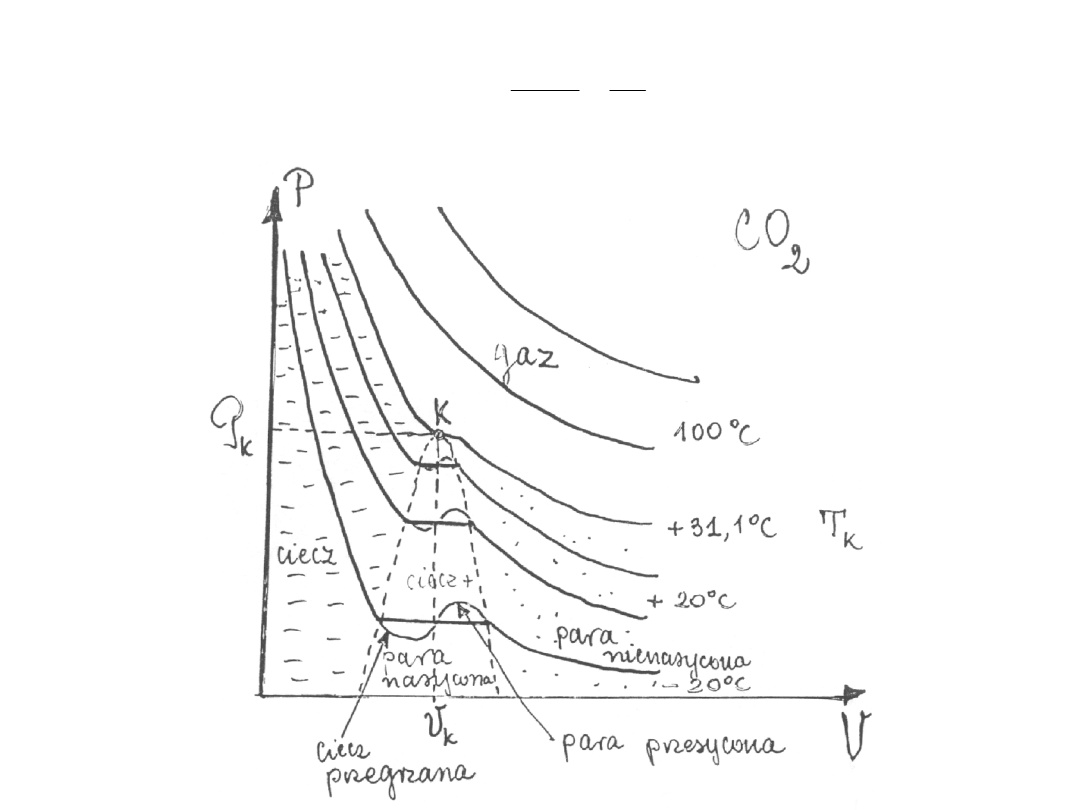
Przy założeniu: T = const
2
RT
a
P
V b V
=
-
-
równanie izotermy
Van der Waalsa
gdzie:
P
k
– ciśnienie krytyczne
V
k
– objętość krytyczna
T
k
– temperatura krytyczna
T
k
[ ]
C
o
P
k
5
2
10
N
m
�
�
�
�
�
�
V
k
4
3
10 m
-
�
�
�
�
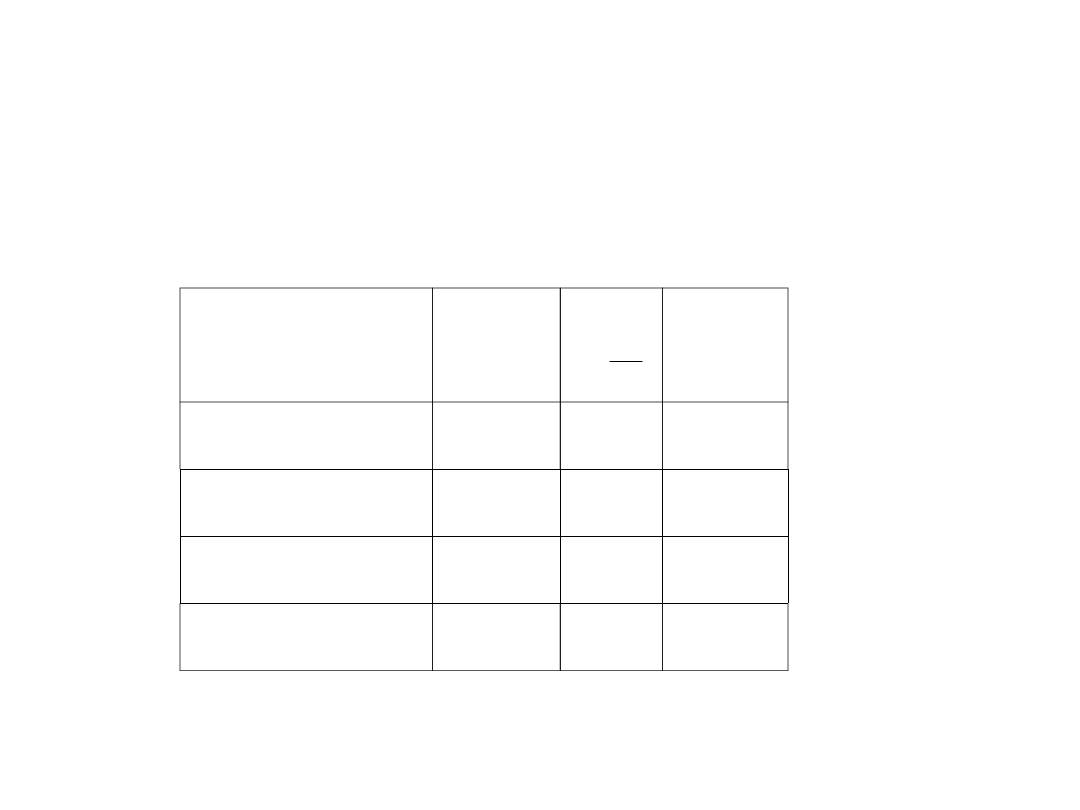
Substancja
Azot
-147
34
90,3
Hel
-268
2,3
61,5
Wodór
-240
34
70
CO
2
+ 31
74
98,2
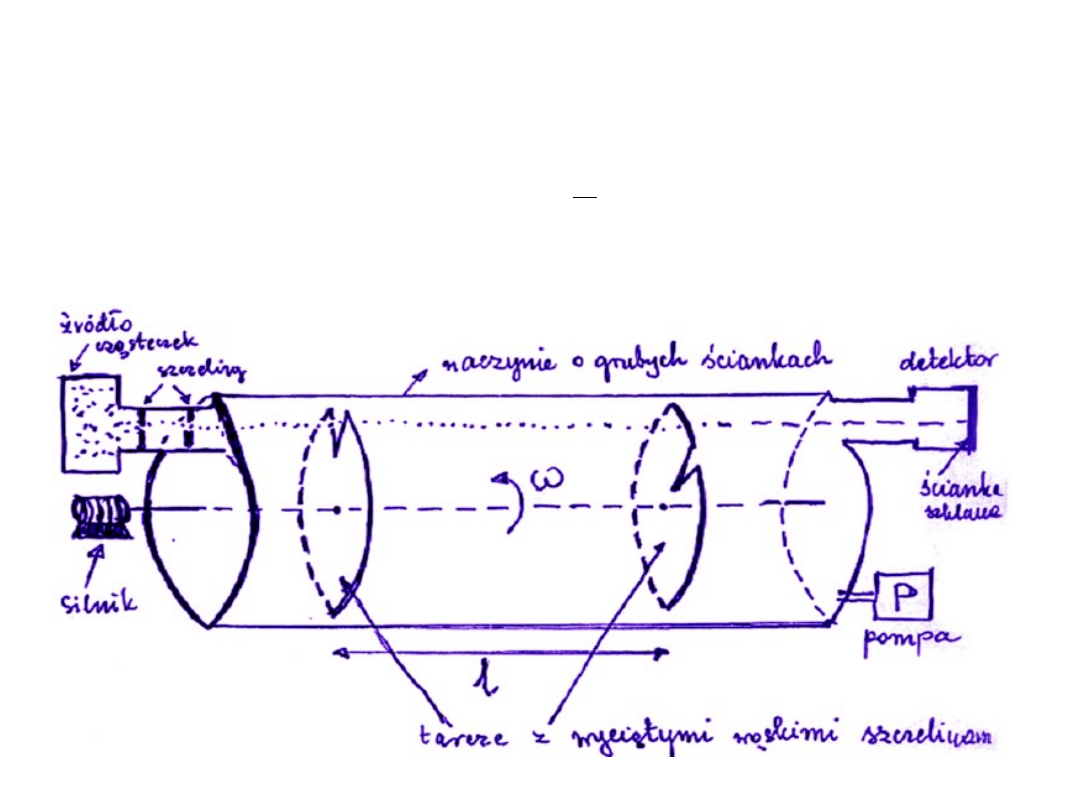
Rozkład prędkości cząsteczek
1.Doświadczenie Lammerta (1929 r.)
2.Równanie Maxwella (rozkład Maxwella)
3.Prędkości charakterystyczne: v
p
,
v
,
v
*
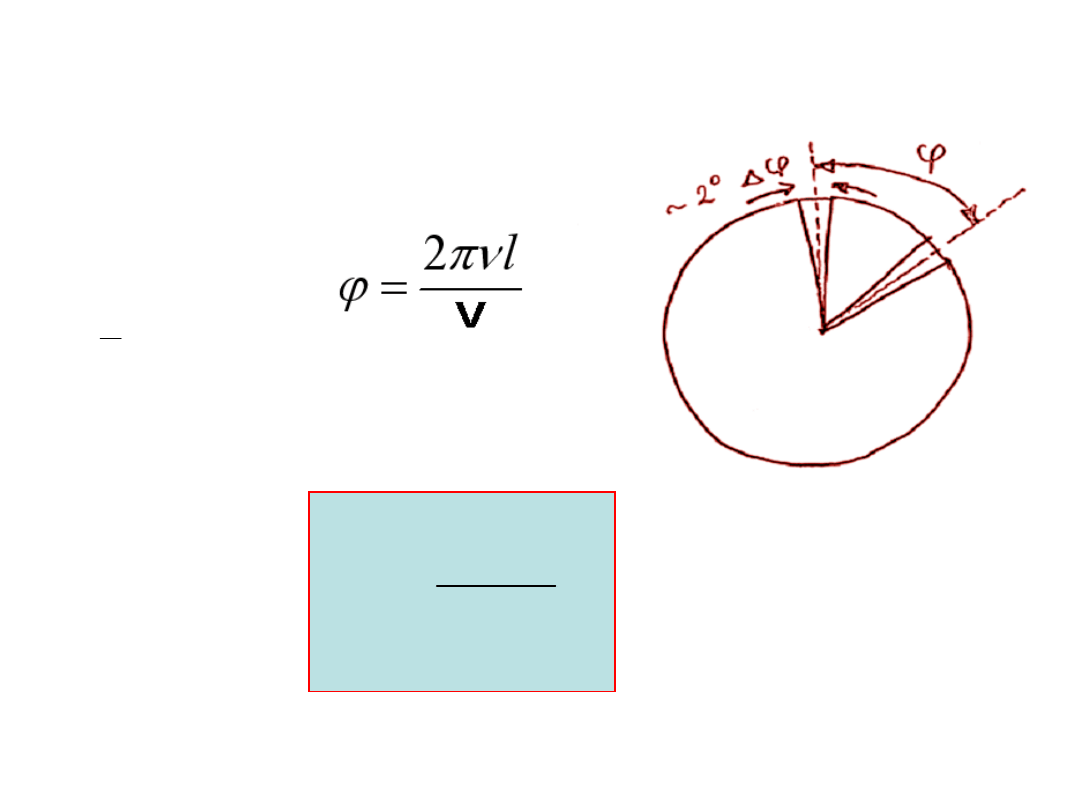
Im większa liczba cząsteczek o
prędkości v,
tym krótszy czas na otrzymanie
dostrzegalnego osadu na ściance
detektora.
�
2
t
l
t
v
j
w
w
pn
=
=
=
V
2 l
v
pn
j
=
V
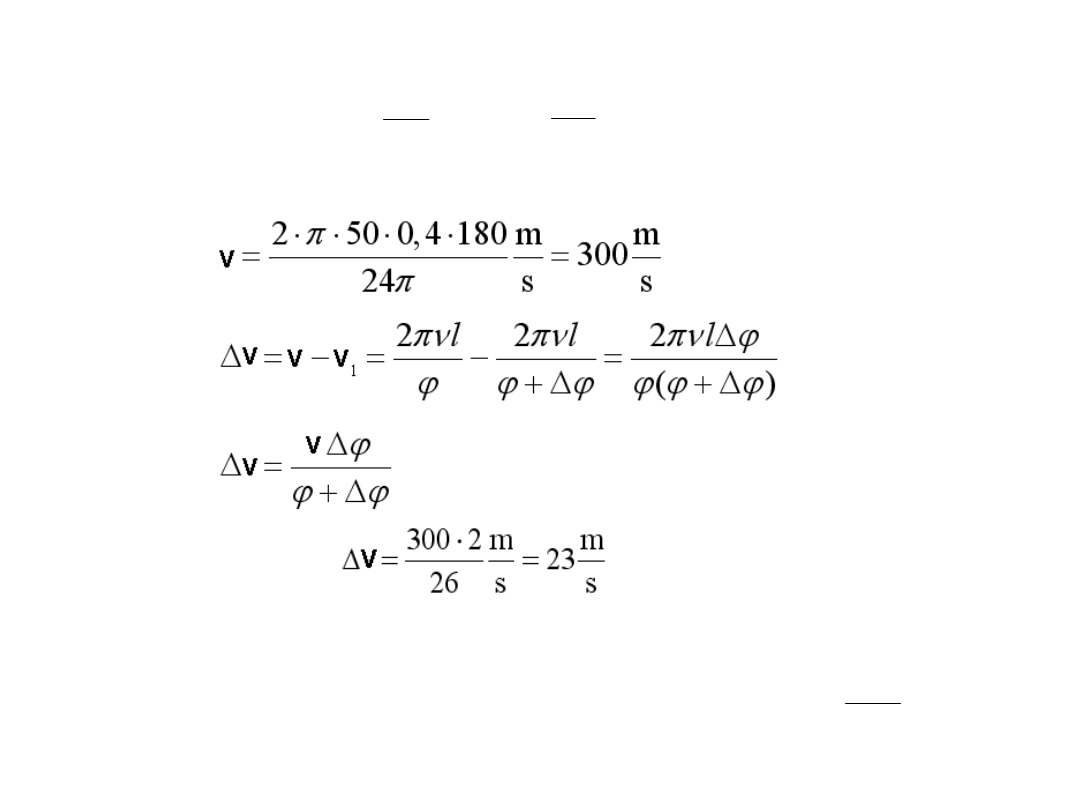
Jeśli
2
j
D =
o
, to
W doświadczeniu Lammerta można było wyznaczyć względną liczbę
cząsteczek, których prędkości leżały w przedziale od v do v+v
tzn. wielkość
N
N t
D
D
Przykład:
l = 0,40 m
24 24
180
p
j =
=
o
obr
50
s
n =

.
N
N t
D
D
N
N t
D
D
N
N t
D
D
Przedział
prędkości
Przedział
prędkości
Przedział
prędkości
60
90
32
270
300
368
480
510
161
90
120
137
300
330
361
510
540
127
120
150
195
330
360
342
540
600
100
150
180
251
360
390
313
600
660
46
180
210
300
390
420
278
660
720
22
210
240
338
420
450
237
720
840
9
240
270
361
450
480
190
840
960
W 1860 r. „rozkład prędkości” został wyprowadzony przez Maxwella.
N
liczba cząsteczek zamkniętych w naczyniu
d
N
liczba cząsteczek, których prędkości
zawierają się w przedziale: v+v
- względna liczba cząsteczek, których prędkości leżą w przedziale v+v
dN
N
2
3
2
2
2
4
2
mv
kT
dN
m
v e
dv
N
kT
p
p
-
�
�
=
�
�
�
�
�
Na wartość funkcji
dN
N
wpływają: prędkość v i temperatura T.
2
3
2
2
2
( )
4
2
mv
kT
dN
m
f v
v e
Ndv
kT
p
p
-
�
�
=
=
�
�
�
�
�
Maksimum tej funkcji obliczmy:
1
2
( )
0
1,414
p
df v
dv
kT
v
m
=
� �
=
� �
� �
Dla tej prędkości funkcja osiąga maksimum. Prędkość tą nazywamy
prędkością najbardziej prawdopodobną v
p
.
Z taką prędkością porusza się największa liczba cząsteczek (w danej
temp. T).
stąd
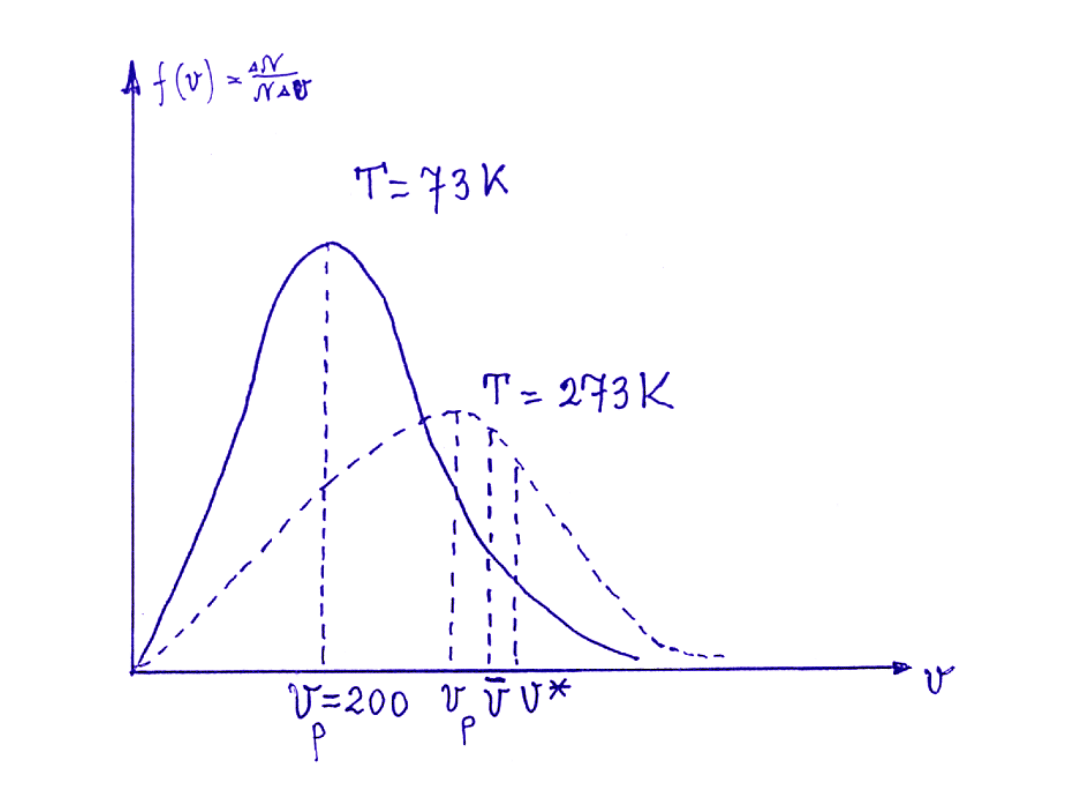
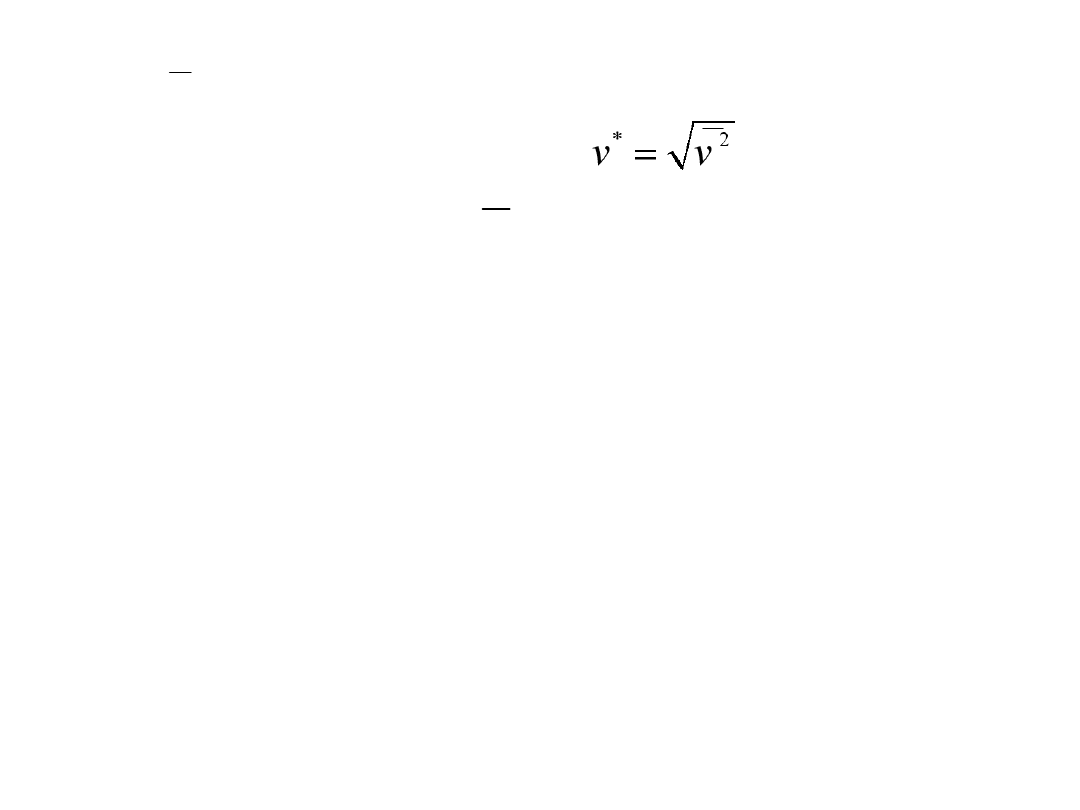
gdzie:
v
prędkość średnia
*
v
prędkość średnia kwadratowa;
*
p
v
v v
< <
Cząsteczki O
2
T = 100 K
v
p
= 229 m/s
T = 300 K
v
p
= 394 m/s
T = 1000 K
v
p
= 721 m/s
Cząsteczki H
2
v
p
= 1510 m/s
v
p
= 1765 m/s
Pary Hg
C
o
T = 0
C
o
T = 100
T = 0
T = 100
C
o
C
o
v
p
= 151 m/s
v
p
= 176,5 m/s
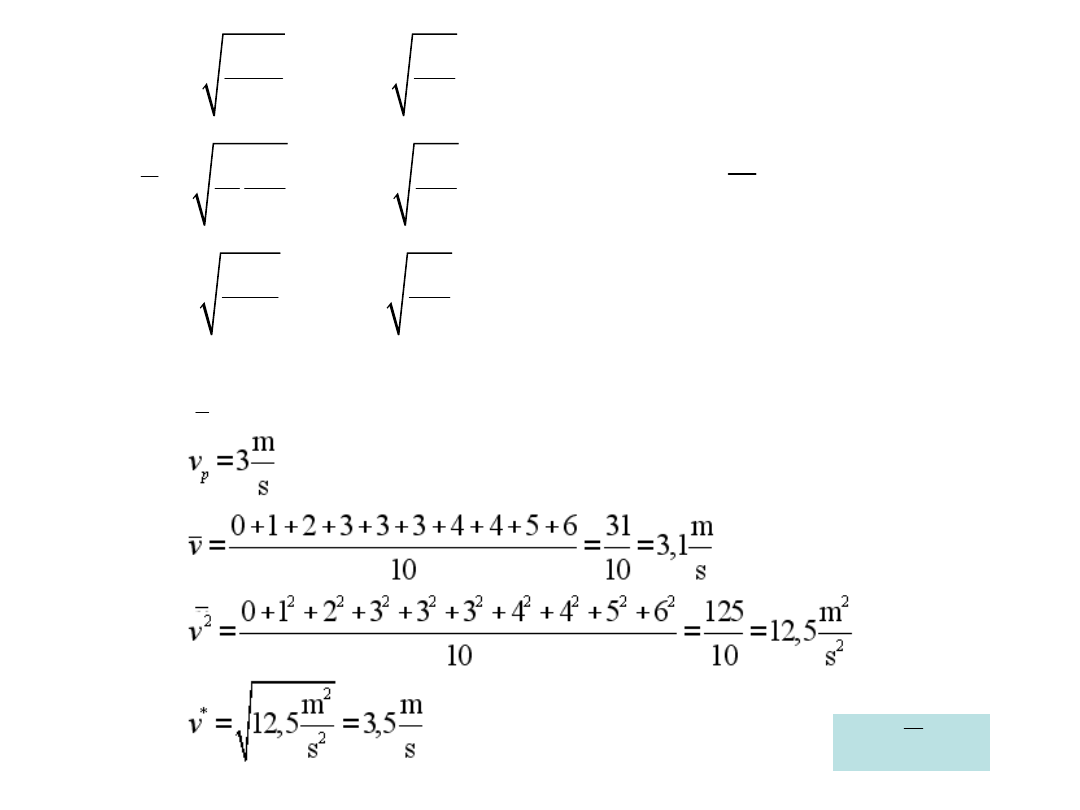
*
2
1,414
8
1,596
3
1,732
p
kT
kT
v
m
m
kT
kT
v
m
m
kT
kT
v
m
m
p
=
=
=
=
=
=
Przykład:
10 drobin, których prędkości wynoszą: 0, 1, 2, 3, 3, 3, 4, 4, 5, 6 [m/s]
Znaleźć: v
p
,
v
v
*
*
p
v
v v
< <
*
p
v
v v
< <
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
Wyszukiwarka
Podobne podstrony:
15 - Gaz, Politechnika Lubelska, Studia, Studia, FIZA
15 Polska ma gaz łupkowy na 300 lat
wyklad 14 15 2010
wyklad badania mediow 15 i 16
15 ROE
15 Sieć Następnej Generacjiid 16074 ppt
wyklad 15 chemiczne zanieczyszczenia wod 2
Wykład 1 15
15 Uklady PLL i t s
Ćwiczenia i seminarium 1 IV rok 2014 15 druk
15 Fizjologiczne funkcje nerek
więcej podobnych podstron