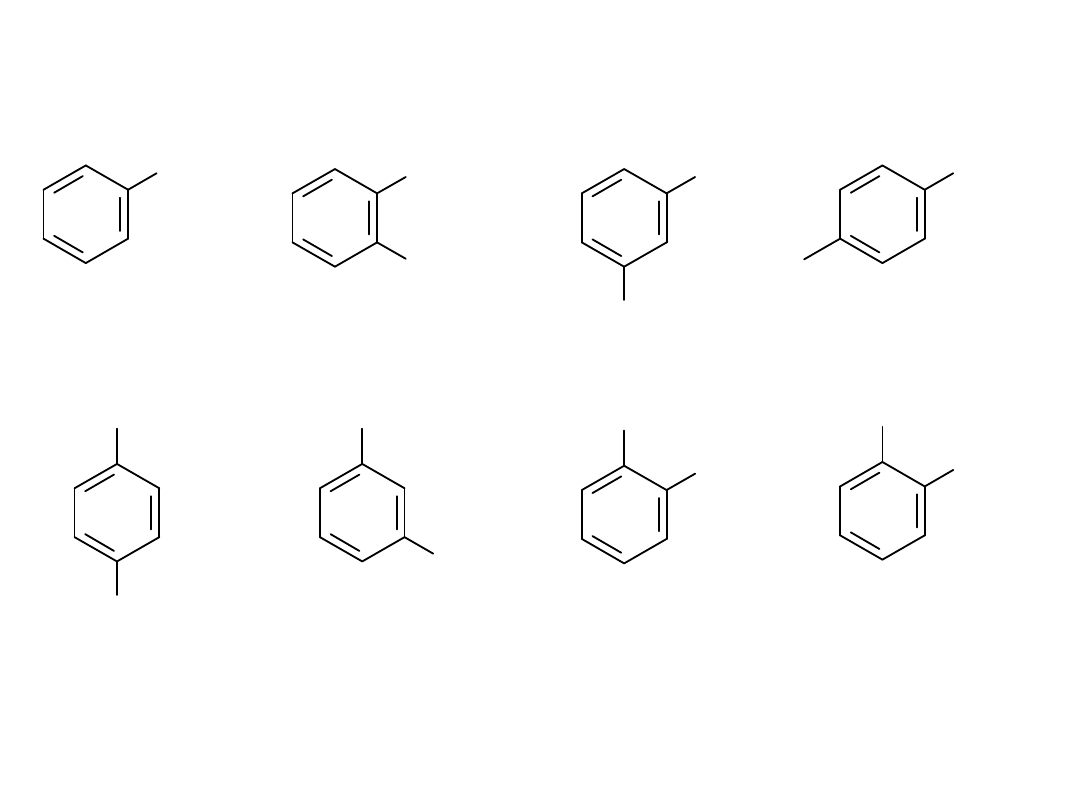
FENOLE
OH
OH
CH
3
OH
Cl
OH
NH
2
fenol 2-metylofenol
(o-krezol)
3-chlorofenol
4-aminofenol
OH
OH
OH
OH
OH
OH
COOH
OH
benzeno-1,4-diol
hydrochinon
benzeno-1,3-diol
rezorcynol
benzeno-1,2-diol
pirokatechol
kwas o-hydroksy-
benzoesowy
kwas salicylowy
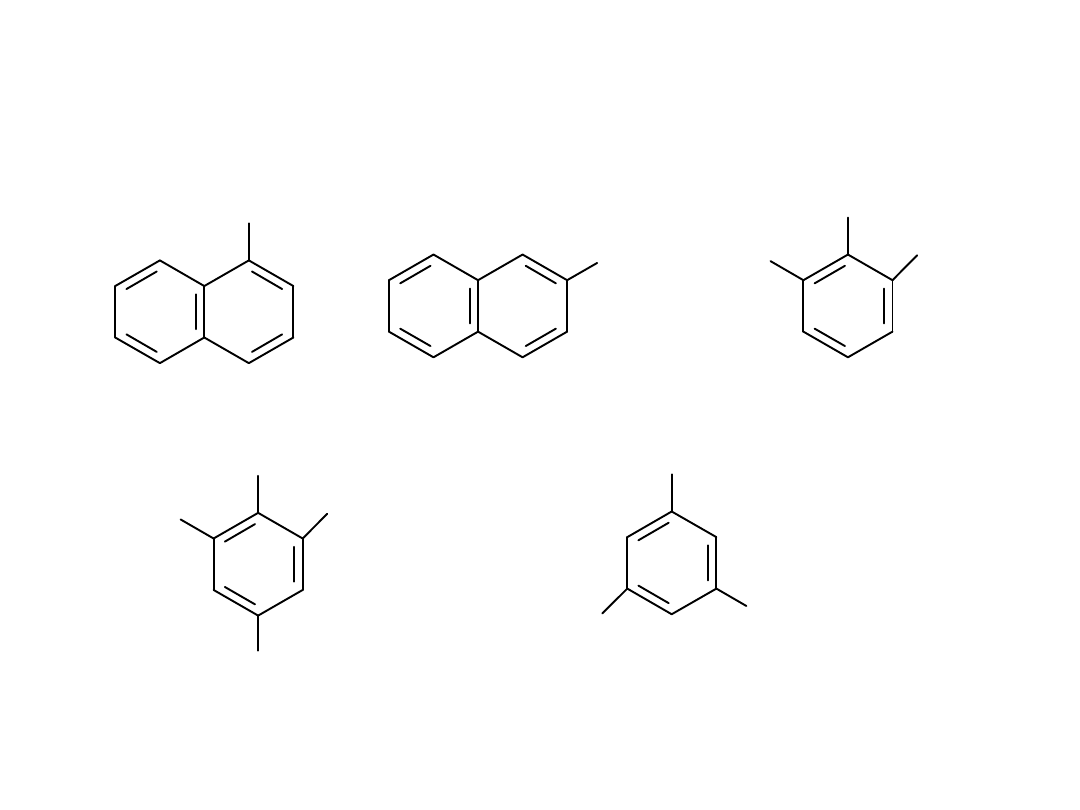
OH
OH
OH
OH
OH
OH
OH
OH
COOH
1-naftol
2-naftol
benzeno-1,2,3-triol
pirogalol
kwas 3,4,5-trihydroksy-
benzoesowy
kwas galusowy
OH
OH
OH
benzeno-1,3,5-triol
floroglucyna
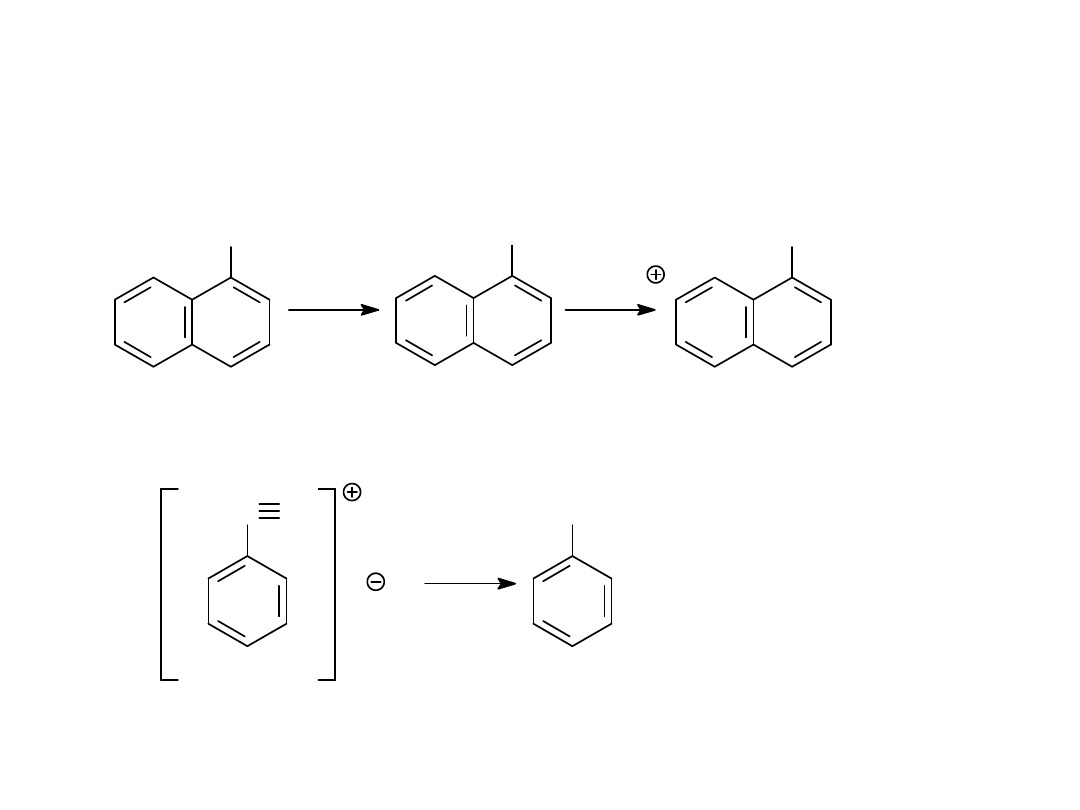
Metody otrzymywania fenoli
1.
Stapianie sulfonianów z zasadami
2.
Hydroliza soli diazoniowych
SO
3
H
KOH
temp.
OK
H
2
O/H
OH
N N
Cl
H
2
O
OH
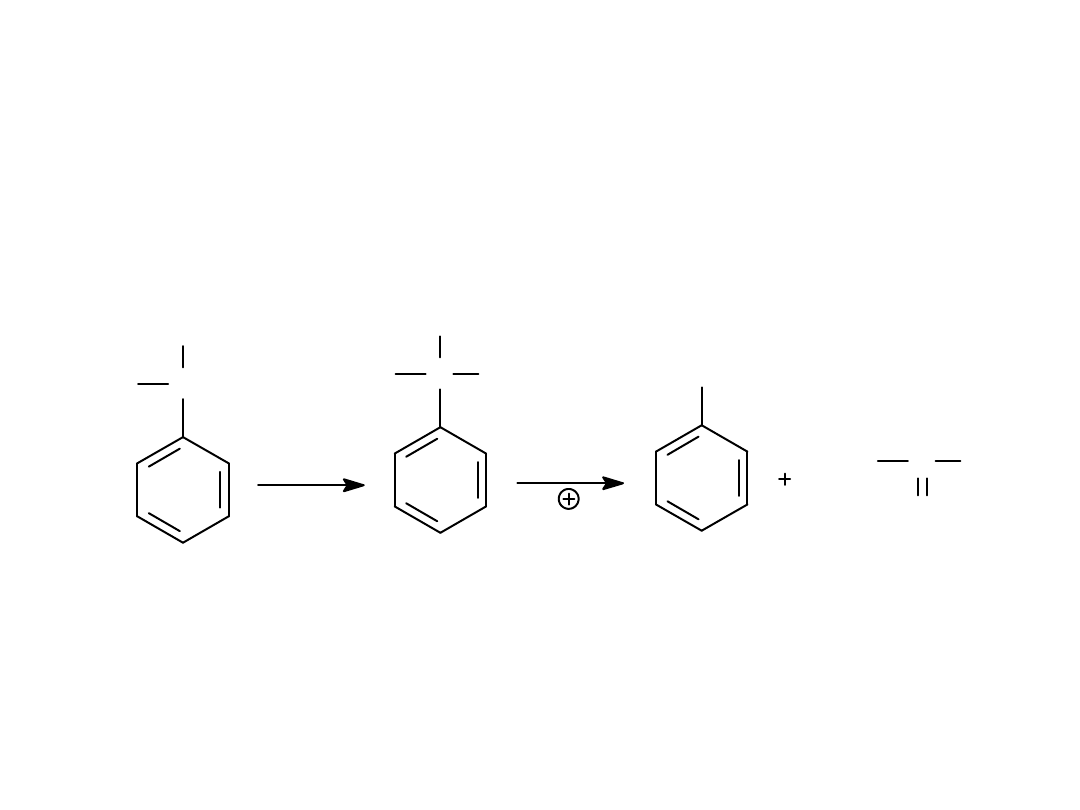
3
. Metody przemysłowe
CH
CH
3
CH
3
O
2
C
CH
3
CH
3
OOH
H
2
O
H
OH
CH
3
C CH
3
O

Właściwości fenoli
(CH
3
)
2
CHOH
CH
3
CH
2
OH
H
2
O
CH
3
OH
CF
3
CH
2
OH
p-aminofenol
p-metoksyfenol
p-metylofenol
fenol
p-chlorofenol
p-bromofenol
p-nitrofenol
2,4,6-trinitrofenol
słabszy kwas
silniejszy kwas
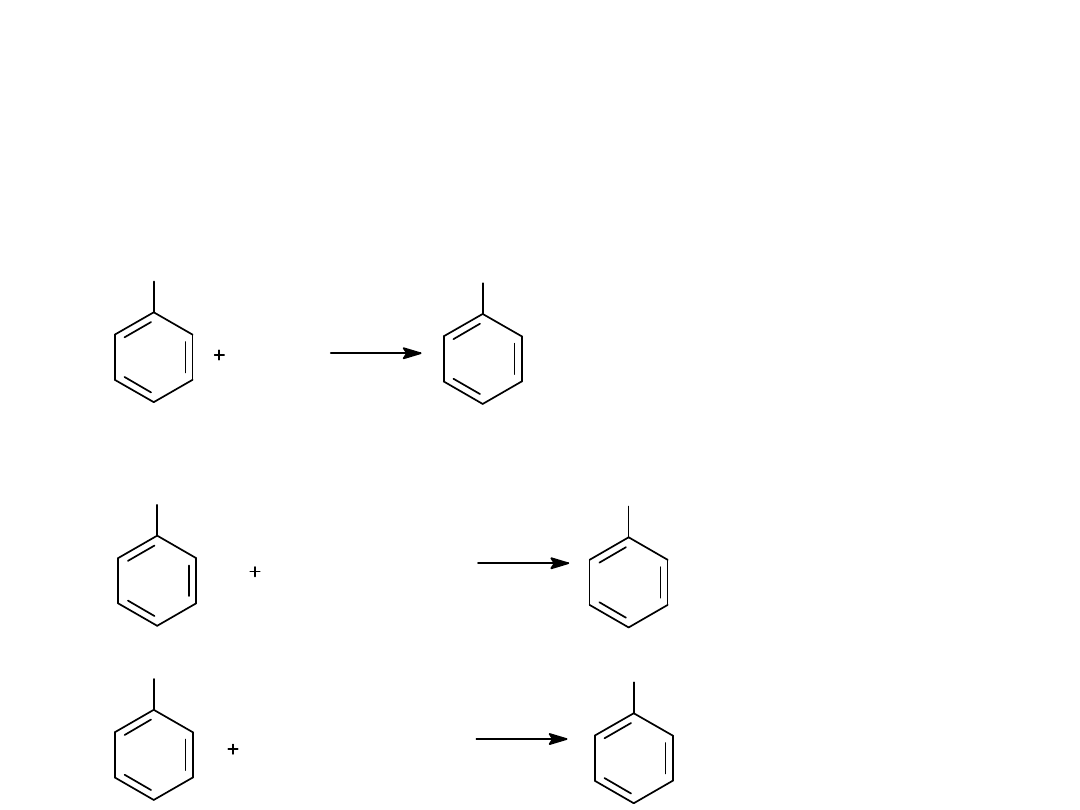
Reakcje fenoli
1.Kwasowość. Tworzenie soli
2. Tworzenie eterów
OH
NaOH
ONa
ONa
CH
3
I
lub (CH
3
)
2
SO
4
OCH
3
ONa
CH
3
CH
2
I
lub (CH
3
CH
2
)
2
SO
4
OCH
2
CH
3
anizol
fenetol
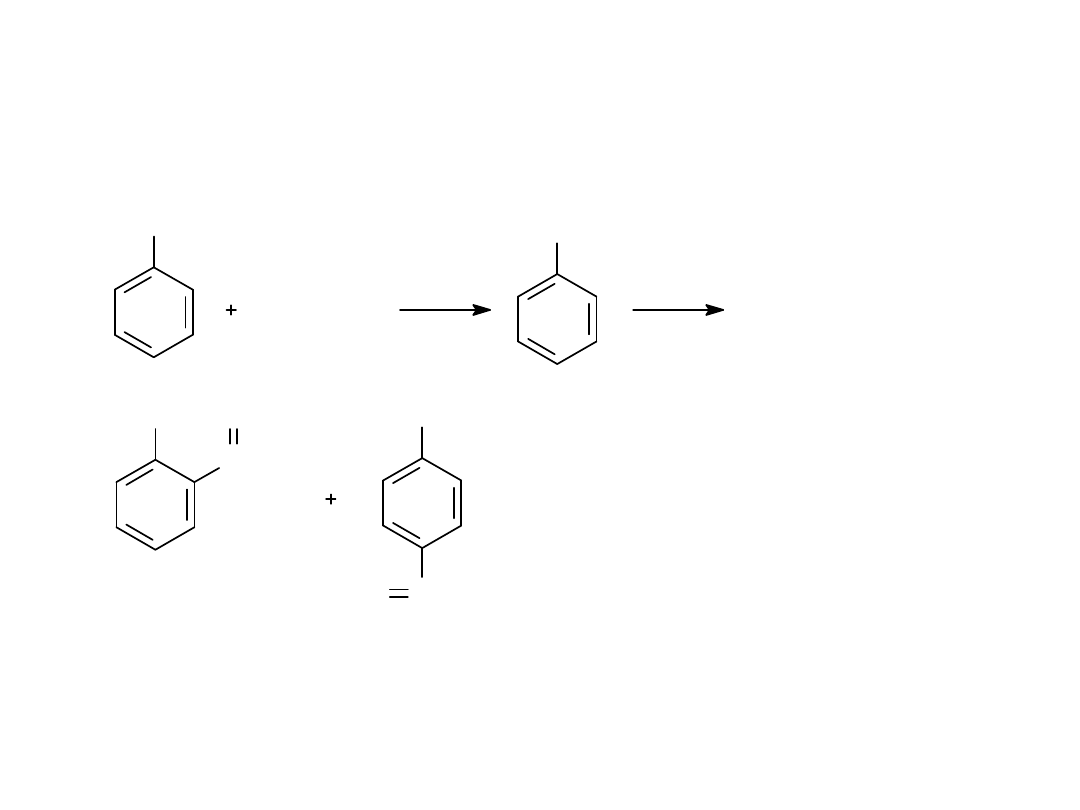
3.Tworzenie estrów
OH
CH
3
COCl
OCOCH
3
lub (CH
3
CO)
2
O
AlCl
3
OH
CCH
3
O
OH
CCH
3
O
octan fenylu
o-hydroksy-
acetofenon
p-hydroksy-
acetofenon
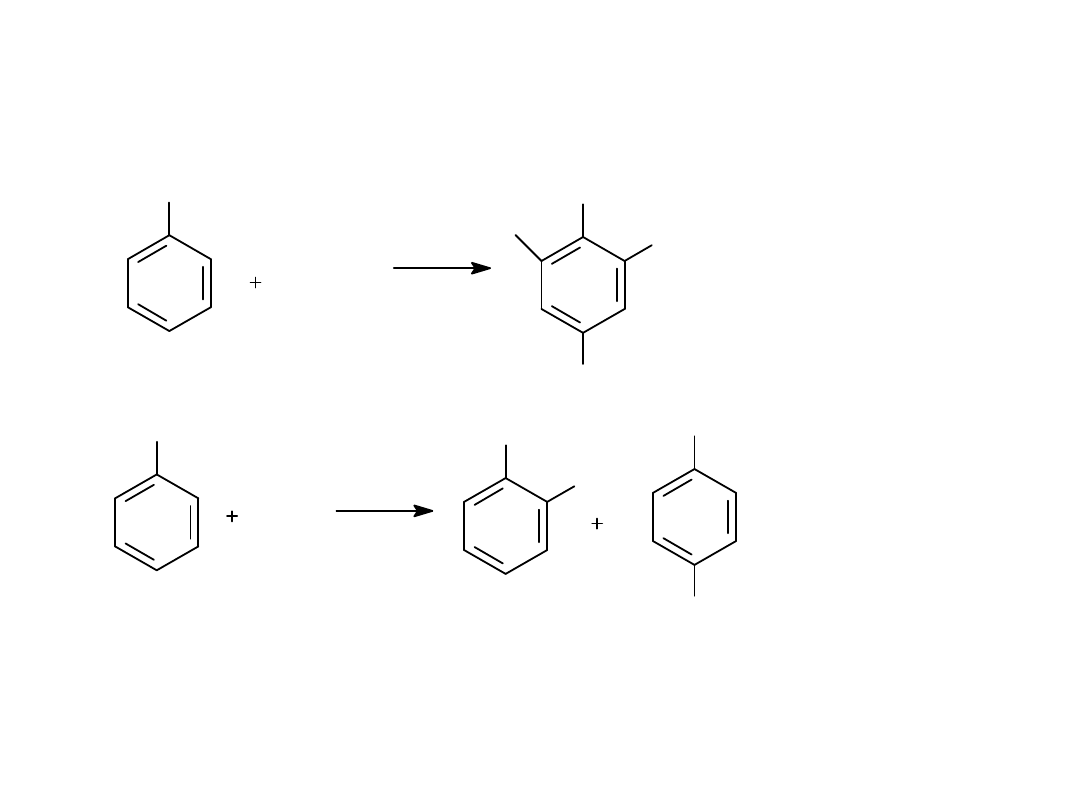
4. Halogenowanie
OH
Br
2
ag.
3
OH
Br
Br
Br
OH
Br
OH
Br
2
CS
2
OH
Br

5. Nitrowanie
6. Sprzęganie ze związkami diazoniowymi
7.Fenole identyfikuje się za pomocą soli żelaza(III) (FeCl
3
)
barwy pomarańczowej. W wyniku reakcji powstaje
kompleks o barwie fioletowej (ciemnogranatowej).
Document Outline
Wyszukiwarka
Podobne podstrony:
Aminy analityka
3 ANALITYCZNE METODY OBLICZANIA PŁYWÓW
Węglowodory analityka
AT kurs analityka giełdowego 3
Cw 8 Analityka
poprawki analityczna
geometria analityczna
Materialy IV Analityka 2012 Bol leki nienarkot
material obowiazujacy do kolokwiow z chemii analitycznej iiwf 2014
II, rzis analityczny 1A Likpol
LM Pracuj spec Analityk finansowy
Geometria analityczna przyklady
analityka podstawy spektroskopii 2012 2013
więcej podobnych podstron