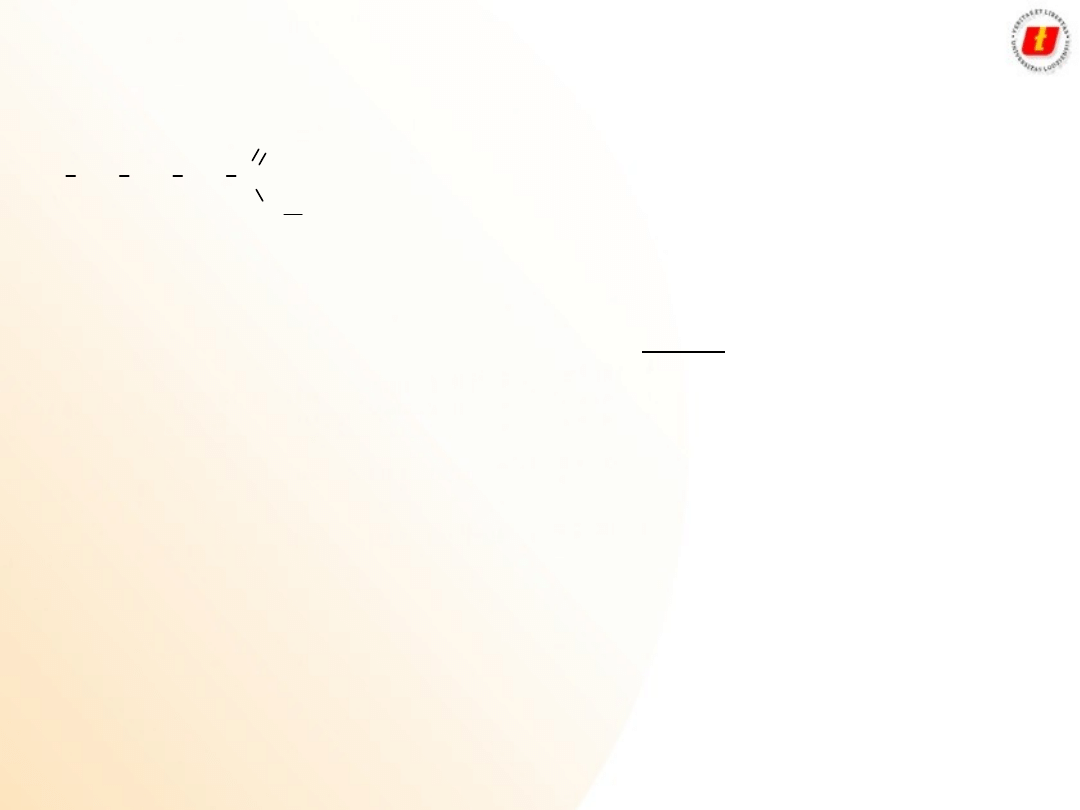
1
CH
3
CH
2
CH
2
CH
2
C
O
O
H
Kwasy karboksylowe -
nazewnictwo
Nazwę kwasu tworzymy:
dodając do nazwy odpowiedniego węglowodoru końcówkę owy, a
przed nazwą dodajemy słowo kwas: Alkan+owy, (atom węgla w grupie
karboksylowej jest wtedy atomem nr 1)
traktując grupę jako podstawnik, do nazwy alkanu z końcówką
karboksylowy dodajemy słowo kwas (pierwszym atomem węgla jest
atom połączony z grupą karboksylową)
Nazwę grupy acylowej tworzymy od nazwy systematycznej kwasu
zamieniając końcówkę –owy na –oil, lub do rdzenia łacińskiej nazwy
dodajemy końcówkę -ylu
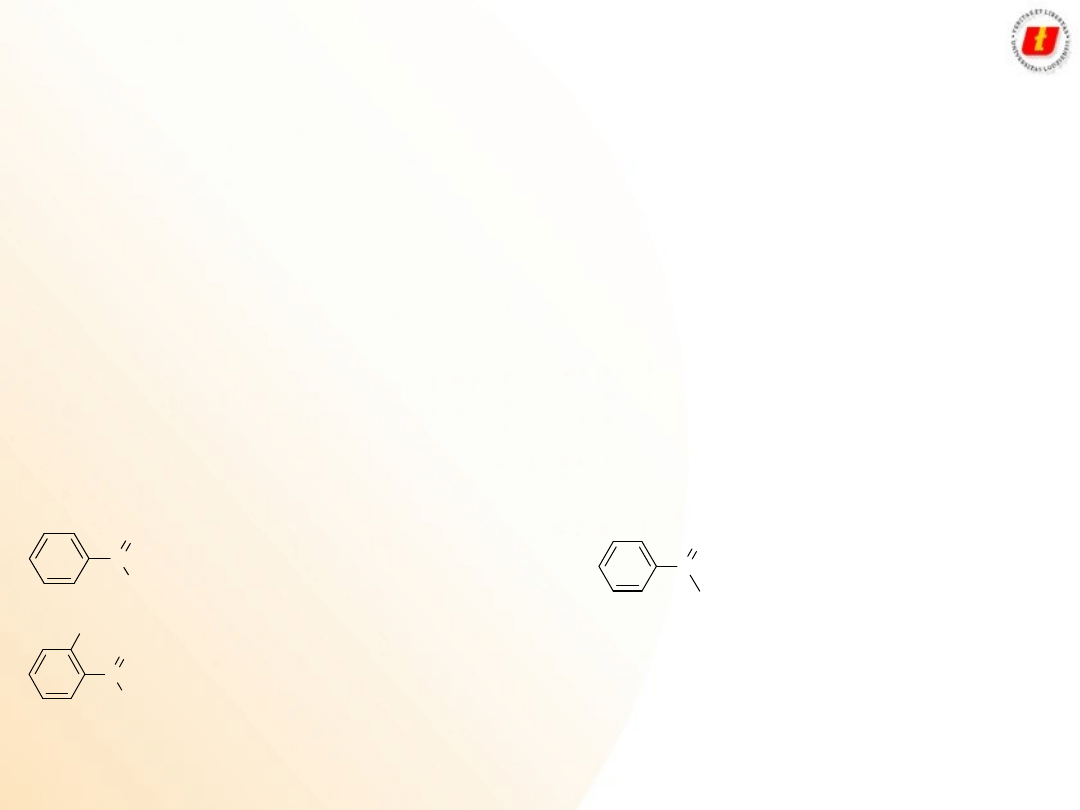
2
Najczęściej spotykane kwasy karboksylowe:
Wzór kwasu
Nazwa kwasu Wzór grupy acylowej Nazwa grupy acylowej
H-COOH
metanowy (mrówkowy) H-CO-
formyl
CH
3
-COOH
etanowy, (octowy)
CH
3
CO-
acetyl
C
2
H
5
COOH
propanowy, (propionowy) CH
3
CH
2
CO-
propionyl
CH3CH2CH2COOHbutanowy, (masłowy) CH3CH2CH2CO-
butyryl
C
OH
O
C
O
benzenokarboksylowy
(benzoesowy)
benzoil
C
OH
O
OH
2-hydroksybenzenokarboksylowy
(salicylowy)
Kwasy karboksylowe -
nazewnictwo
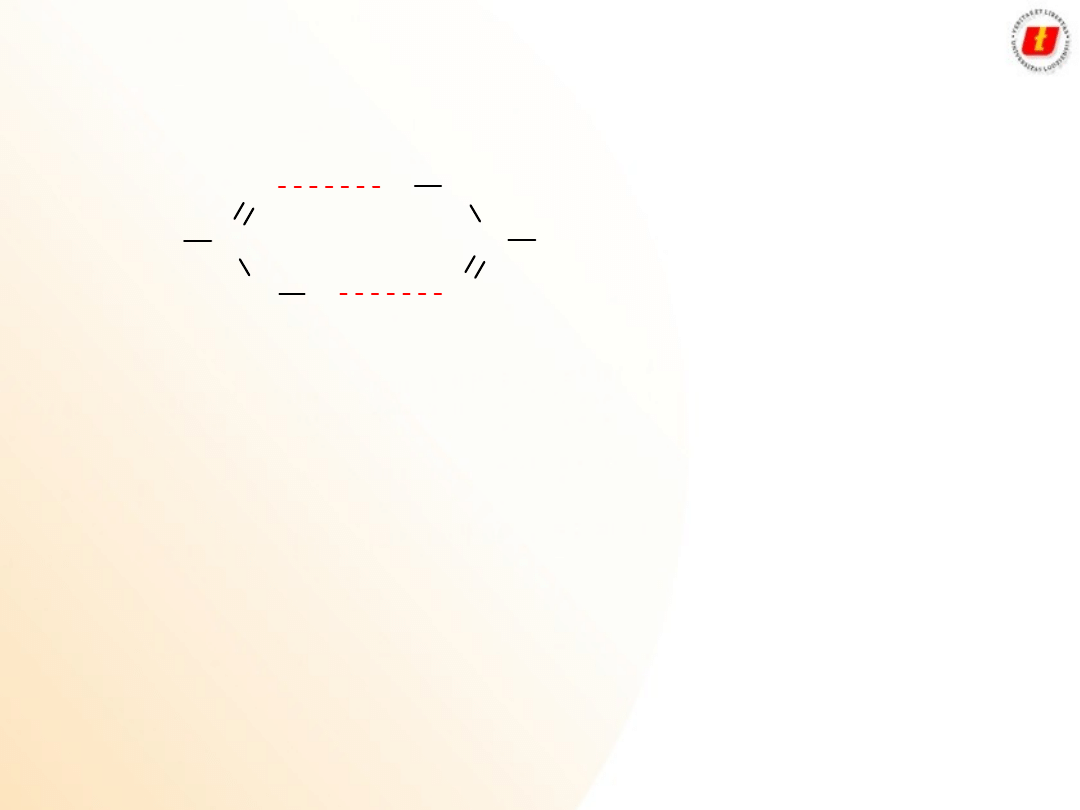
3
Kwasy karboksylowe –
właściwości
fizyczne
R
C
O
H
R C
O
O
H
O
Wiązania wodorowe powodują, że kwasy karboksylowe mają
wysokie temperatury wrzenia

4
R C
OH
O
R C
Cl
O
R C
O-R'
O
R C
O
R C
O
O
R C
O Me
O
-
+
R C
N
R C
NH
2
O
R C
NH
O
R'
R C
N
O
R'
R"
I
o
II
o
III
o
w
zr
o
st
a
kt
y
w
n
o
sc
i
chlorek
kwasowy,
chlorek –
(owy)oilu
bezwodnik kwasowy
bezwodnik kwasu …
ester
–(owy)(i)an + nazwa reszty
R’
amid
-(owy)oamid
nazwa grupy acylowej +
amid
sól
–(owy)(i)an + nazwa metalu
(aminy)
nitryl
nazwa wglowodoru + nitryl
(nazwa weglowodoru R +
karbonitryl)
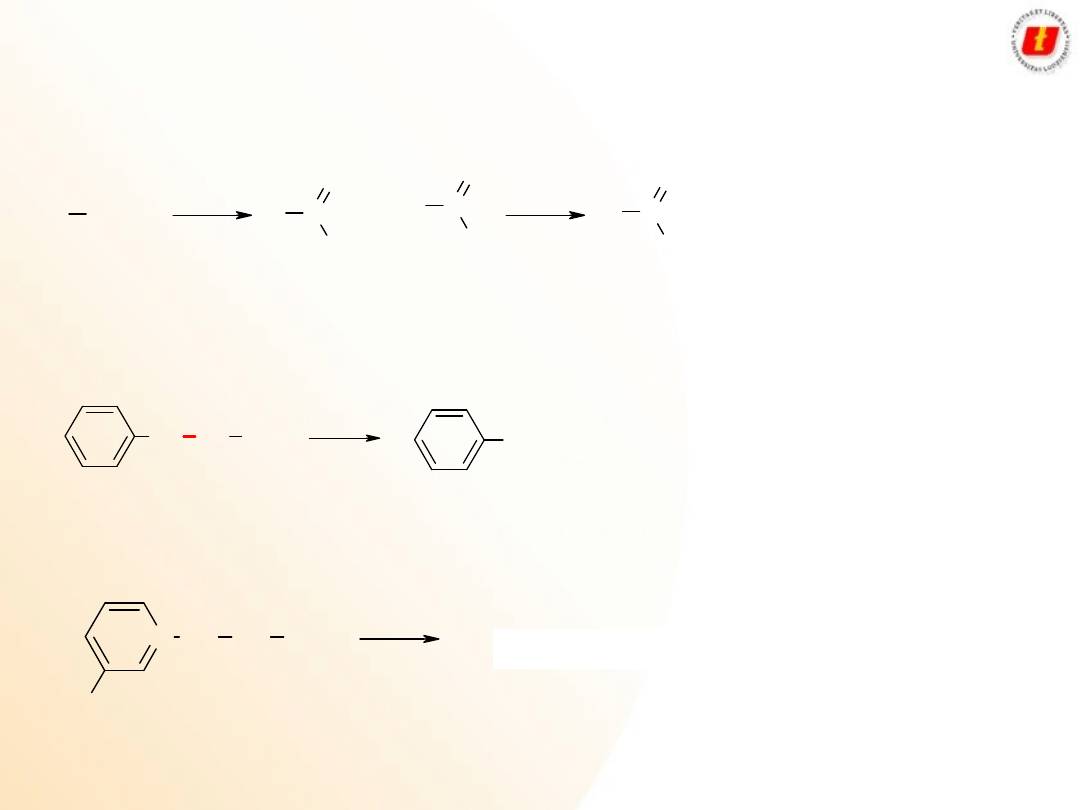
5
Kwasy karboksylowe –
metody
syntezy
R CH
2
OH
R C
OH
O
R C
OH
O
R C
OH
O
[O]
[O]
;
Utlenianie I
o
alkoholi lub aldehydów:
Utlenianie prowadzi się najczęściej dwuchromianem w środowisku kwaśnym
Utlenianie alkiloarenów:
CH
2
CH
2
R
COOH
Na
2
Cr
2
O
7
/H
+
+ R-COOH
W przypadku gdy w pierścieniu znajduje się podstawnik elektrodonorowy, wtedy
utlenieniu ulega pierścień:
C
CH
2
CH
2
R
O
H
Na
2
Cr
2
O
7
/H
+
R-CH
2
-CH
2
-COOH + CO
2
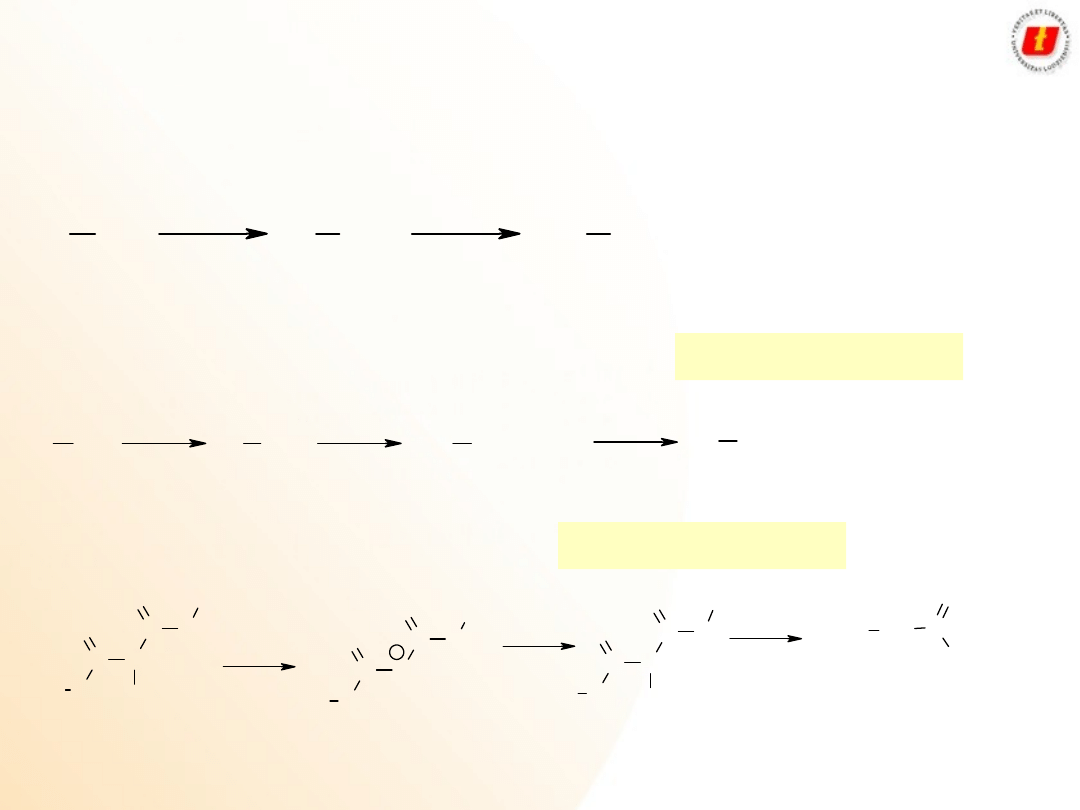
6
Kwasy karboksylowe –
metody
syntezy
R X
CN
-
R CN
H
+
, lub OH
-
R COOH
Hydroliza nitryli:
Jeżeli odpowiednie nitryle są łatwo dostępne
R X
R MgX
R COOMgX
R COOH
Mg
CO
2
H
2
O/H
+
W reakcji związków metaloorganicznych z CO
2
:
C CH
O
O
C
H
3
C O
O
CH
3
H
C CH
O
O
C
H
3
C O
O
CH
3
-
C CH
O
O
C
H
3
C O
O
CH
3
R'
CH
2
C
R'
OH
O
R-O
-
..
R'-X
H
+
+ CO
2
Wykorzystanie estrów malonowych:
Wodory a w estrze malonowym są kwaśne, łatwo je oderwać, zwłaszcza silną zasadą
Dla chętnych – nie obowiązuje w
szkole średniej
Dla chętnych – nie obowiązuje w
szkole średniej
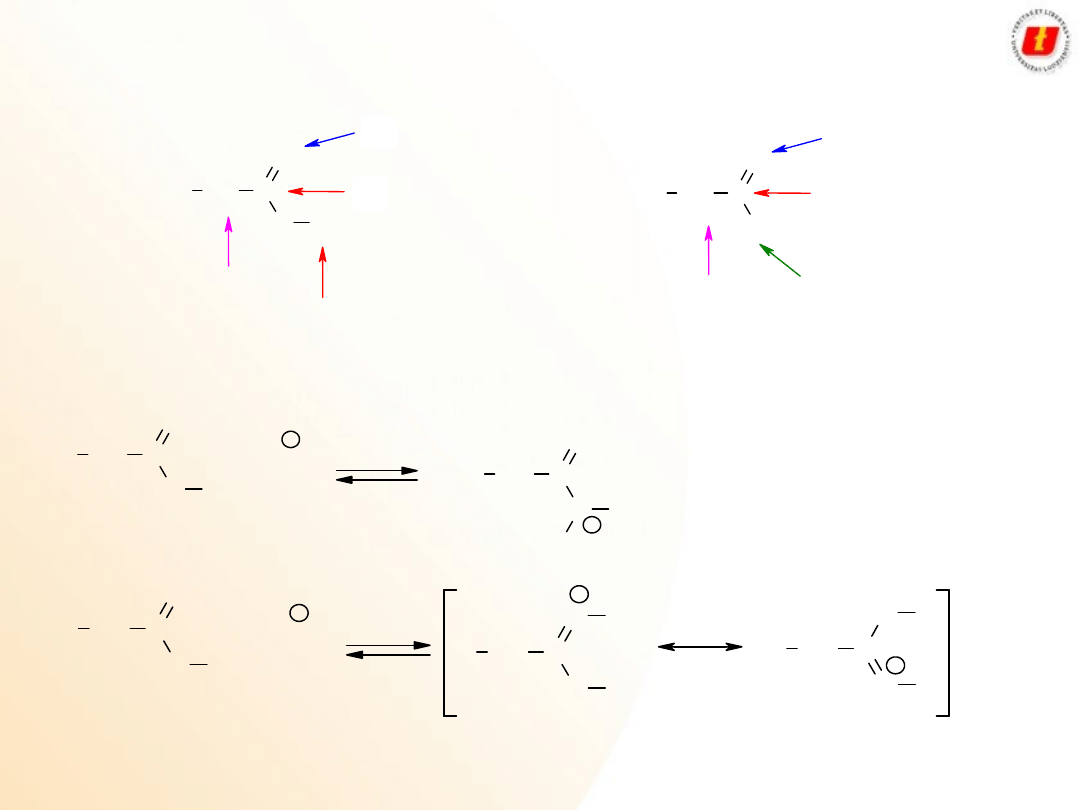
7
CH
2
C
O
O
H
R
CH
2
C
Y
O
R
c.n
c.e
atom wodoru o
charakterze kwasowe
atom wodoru
podatny na S
R
lub S
E
Y=: X, OCOR, OR', NH
2
, OH
atom wodoru
podatny na S
R
lub S
E
c.e
c.n
grupa odchodząca
Kwasy karboksylowe –
właściwości
chemiczne
CH
2
C
O
O
H
R
+
CH
2
C
O
O
H
R
H
+
+ H
..
..
..
CH
2
C
O
O
H
R
+
CH
2
C
O
O
H
R
H
CH
2
C
O
O
H
R
H
+
+
+ H
..
..
..
..
: :
:
..
..
:
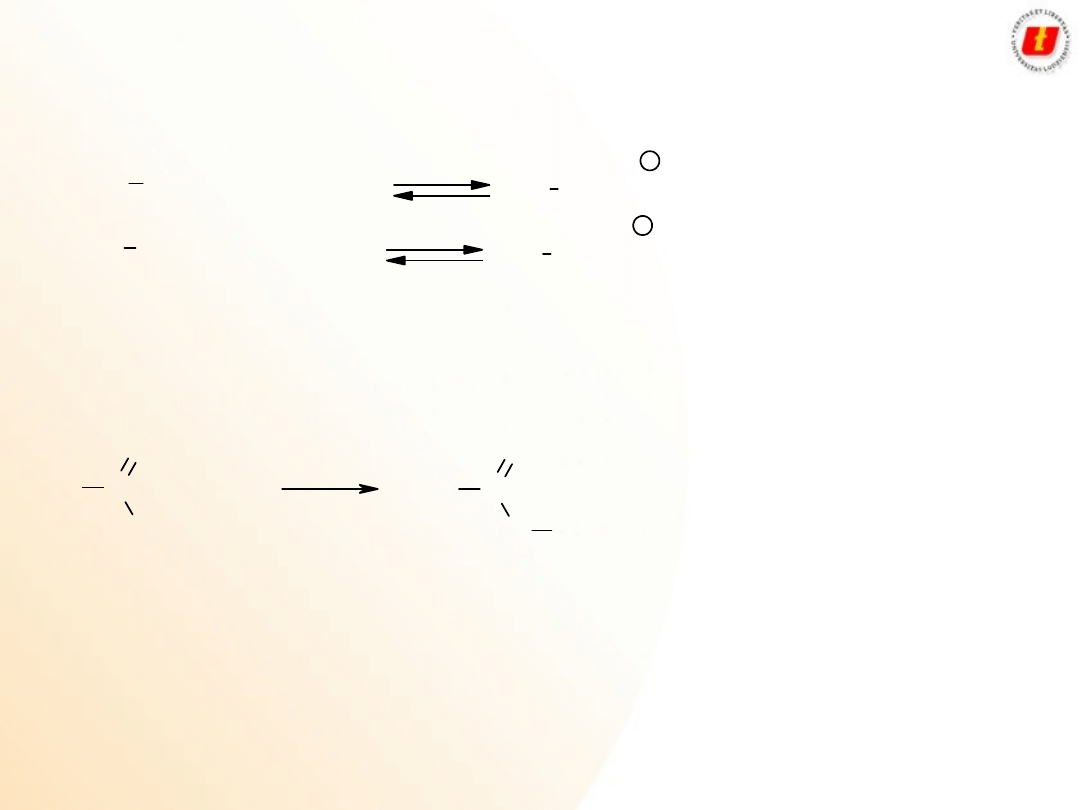
8
R COOH
R COO
-
H
3
N-R'
+
R COOH
R COO
-
Na + H
2
O
+
+ H
2
N-R'
+ NaOH
Reakcje na grupie karboksylowej:
Kwasy karboksylowe –
właściwości
chemiczne
Kwasy karboksylowe z odczynnikami o charakterze kwasowym i z zasadami
reagują w klasyczny sposób
R C
O
O
-
R C
O
O
R'
+ R'-X
+ X
-
Reszta kwasu karboksylowego wykazuje właściwości nukleofilowe (jest to dość silny nukleofil)
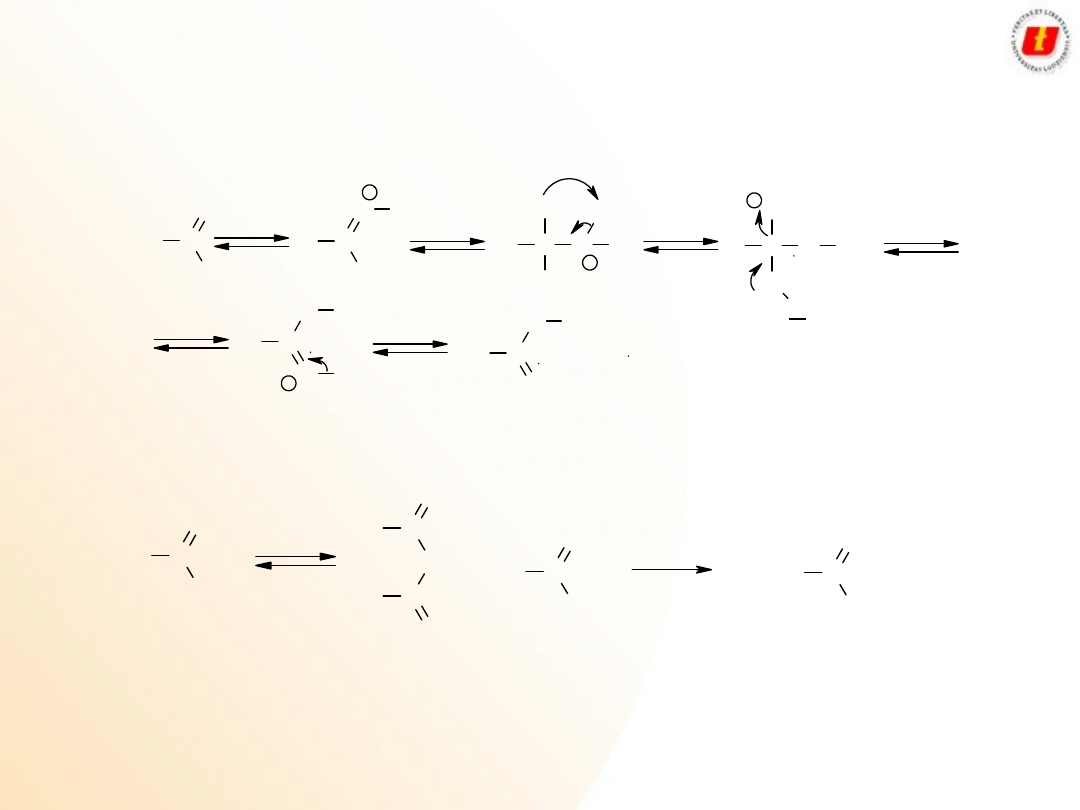
9
Kwasy karboksylowe –
właściwości
chemiczne
R C
OH
O
R C
OH
O H
+
R C
O
O R'
H
R C
O
O R'
R C
OH
OH
O R'
H
+
R C
O
OH
2
O R'
H
+
+
H-O-R'
+ H
+
- H
2
O
- H
+
..
:
..
.. :
R C
OH
O
R C
O
O
C
O
R
R C
OH
O
R C
Cl
O
2
-H
2
O
PCl
3
lub SOCl
2
;
Estryfikacja kwasów karboksylowych, kwaśna hydroliza estrów
przebiega wg identycznego mechanizmu. Każdy etap reakcji
jest odwracalny
Reakcje polegające na wymianie grupy –OH na inną grupę
Synteza bezwodników i chlorków kwasowych
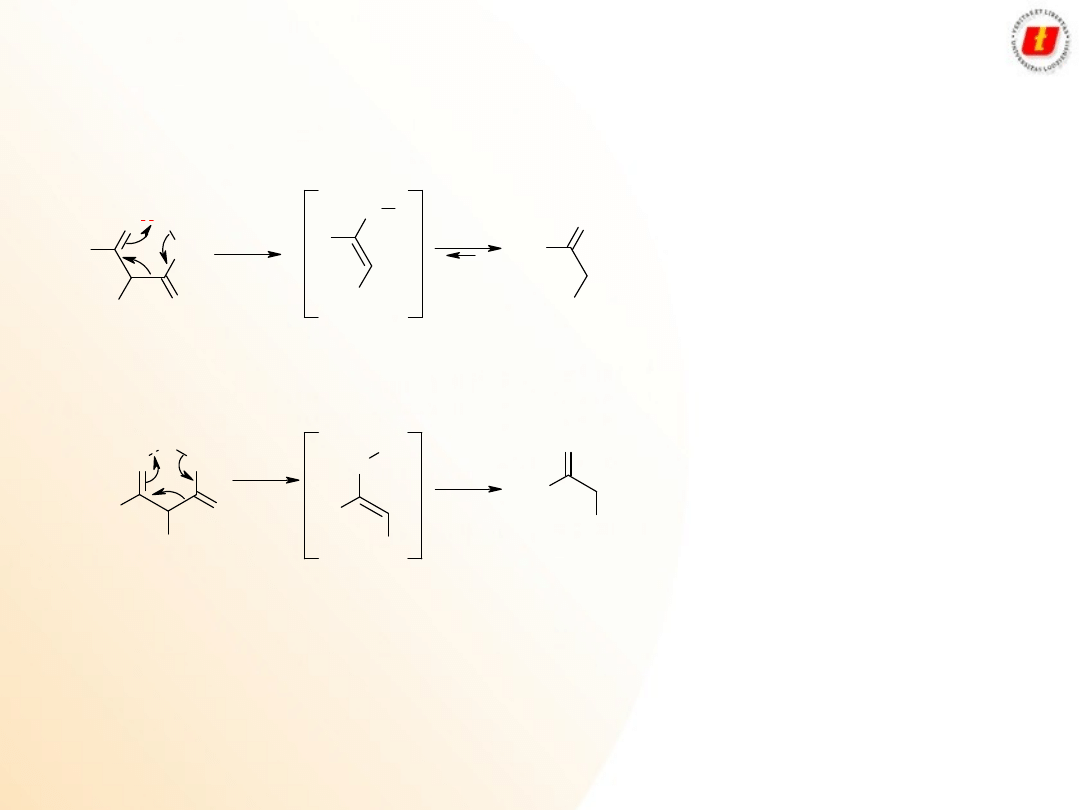
10
R
O
R'
O
O
H
R
O
R'
H
R
O
R'
R
O
O
O
O
H
H
R
O
O
H
H
R
O
H
O
-CO
2
-CO
2
Reakcje dekarboksylacji:
Kwasy karboksylowe –
właściwości
chemiczne
kwasy propanodiowe oraz 3-oksoalkanowe bardzo łatwo ulegają dekarboksylacji

11

12

13
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
Wyszukiwarka
Podobne podstrony:
Kwasy żółciowe i ich rola w diagnostyce chorób
kwasy nukleinowe
Kwasy fenolowe i depsydy
Wyższe kwasy tłuszczowe
KWASY KARBOKSYLOWEreaktyw 1
istan Kwasy
13 Kwasy nukleinowe
KWASY KARBOKSYLOWE id 256009 Nieznany
Kwasy i ich pochodne polecenai, Szkoła, Biologia
KARBOKSYLOWE KWASY, Nieorganiczna, chemia, chemia - liceum, chemia - liceum, lekcja
Kwasy karboksyl, Szkoła
Kwasy beta, Szkoła PSWIS, Kosmetologia, Semestr I, Peelingi, PEELINGI
W08s-Slabe kwasy i zasady wieloprotonowe, chemia, szkolka
kwasy beztlenowe hcl i h2s, dydaktyka, konspekty
Kwasy
więcej podobnych podstron