
11
Zagadnienia...
• W jaki sposób zachodzi dyfuzja?
• Dlaczego odgrywa tak dużą rolę?
• Jak można przewidzieć szybkość dyfuzji
w niektórych prostych przypadkach?
• Jak dyfuzja zależy od temperatury?
Dyfuzja w ciałach stałych

22
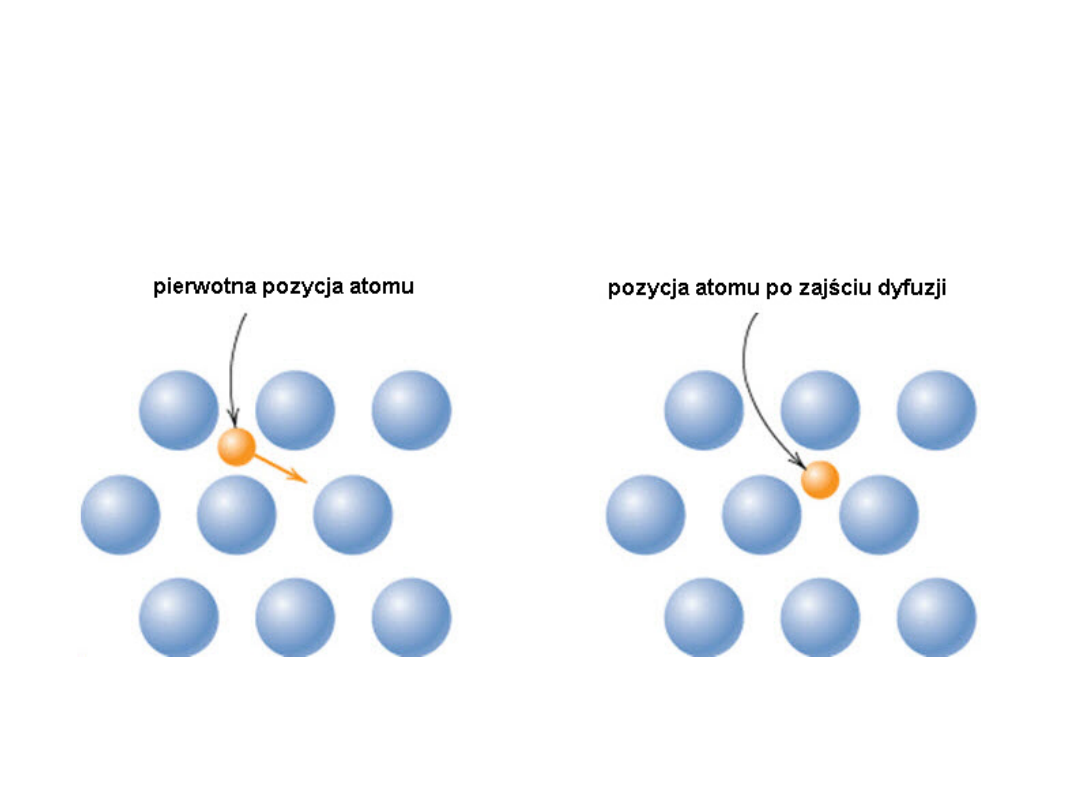
Dyfuzja
Dyfuzja -
proces samorzutnego rozprzestrzeniania się
atomów lub cząsteczek w ośrodku (np. w gazie, cieczy lub
ciele stałym), będący konsekwencją chaotycznych zderzeń
atomów (cząsteczek) dyfundującej substancji między sobą
i z atomami (cząsteczkami) otaczającego ośrodka
Dyfuzja prowadzi do
ujednorodnienia
się stężeń składników
Mechanizmy
• Gazy i ciecze – ruchy Browna (przypadkowe)
• Ciała stałe – mechanizm wakancyjny lub międzywęzłowy
najszybciej zachodzi dyfuzja w gazach:
2
1
Ponieważ struktury krystaliczne są
na ogół zwarte, migracja atomów
lub jonów w krystalicznych ciałach
stałych jest utrudniona.
Energia konieczna do
przemieszczenia atomu w zwartej
strukturze krystalicznej jest na tyle
wysoka, że niekiedy czyni dyfuzję
prawie niemożliwą.
33
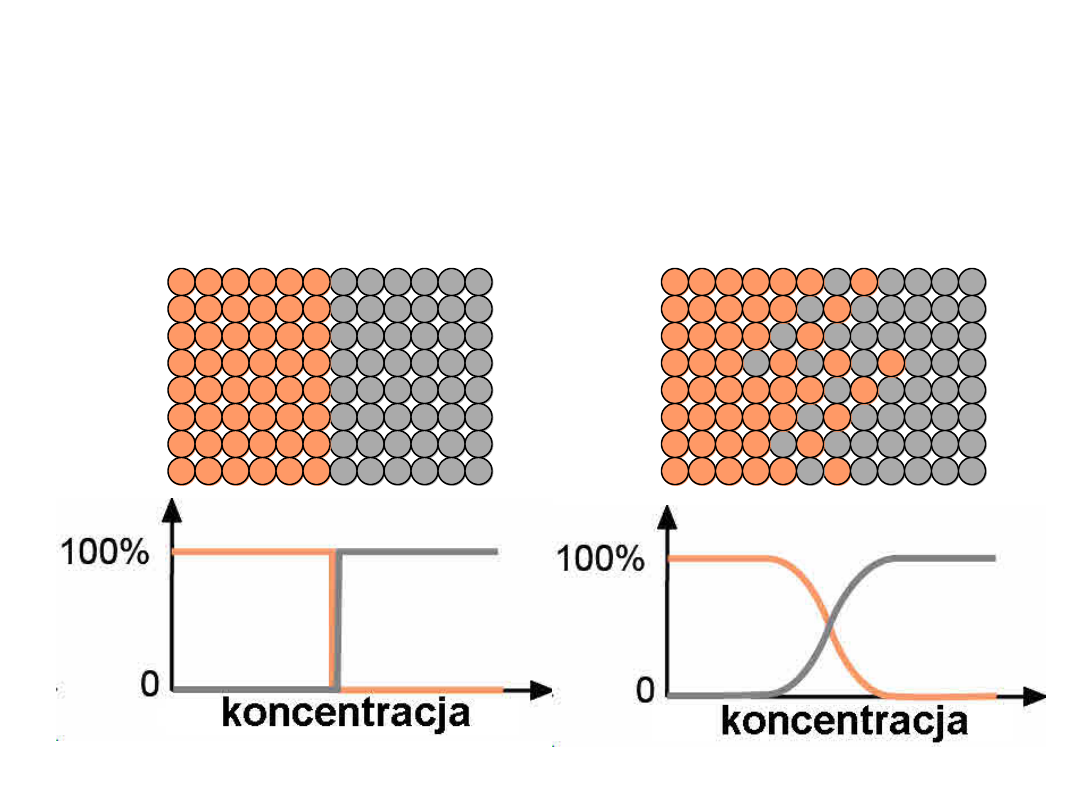
• W stopach atomy mają tendencje do przemieszczania się
z obszarów o większej do obszarów omniejszej koncentracji
Początkowo
Dyfuzja wzajemna
Po pewnym czasie
para
dyfuzyjn
a
44
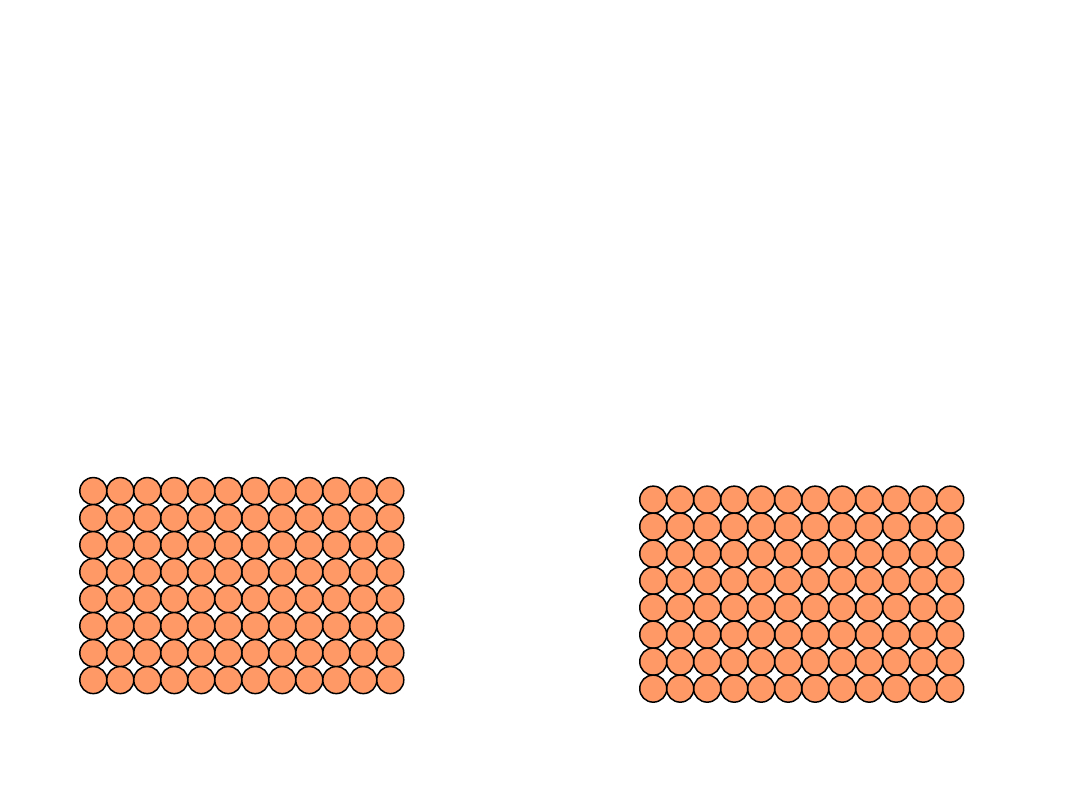
•
Samodyfuzja
:
W czystych ciałach stałych atomy też migrują
Oznaczmy kilka atomów
Po pewnym czasie
Samodyfuzja
A
B
C
D
A
B
C
D
Samodyfuzja (autodyfuzja),
proces dyfuzji, w
której biorą udział tylko atomy (cząstki) danej
substancji. Samodyfuzja prowadzi m.in. do
wyrównania składu izotopowego pierwiastków
występujących w przyrodzie.
55
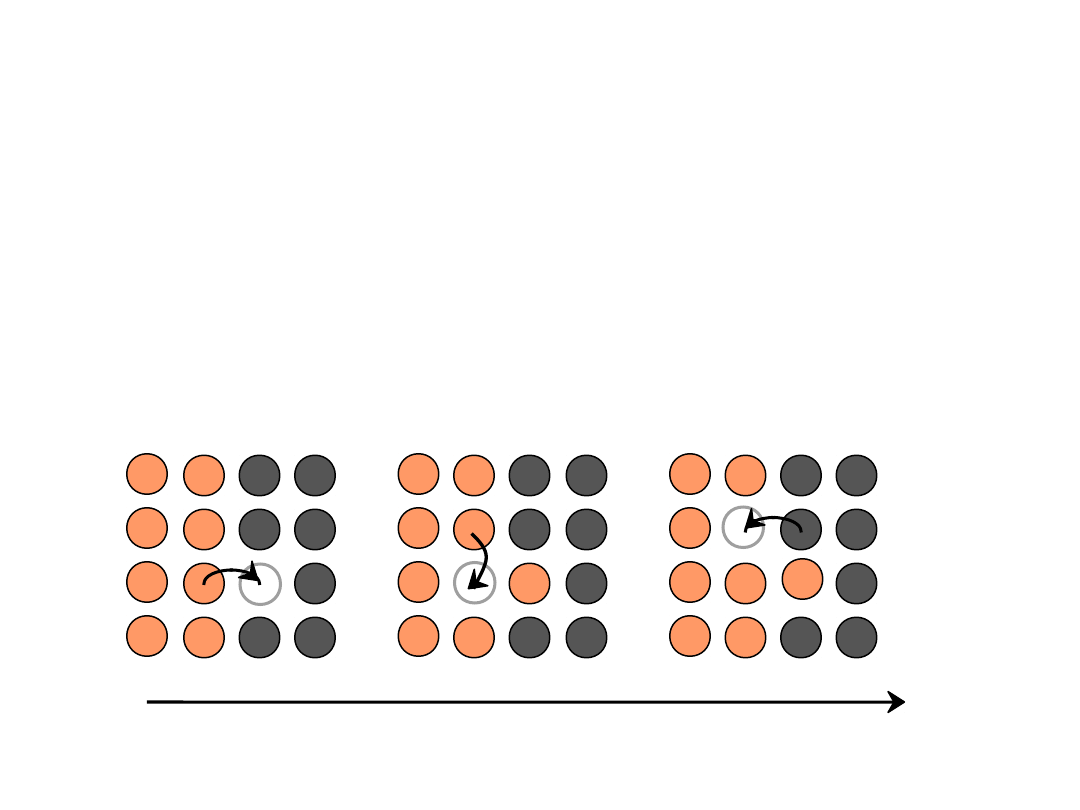
Mechanizmy Dyfuzji
Mechanizm
wakancyjny
:
•
atomy wymieniają się miejscami z wakancjami
• zachodzi w roztworach substytucyjnych
• szybkość dyfuzji zależy od:
- liczby wakancji
- energii aktyacji wymiany: wakancja - atom.
czas
kierunek przemieszczania atomów jest przeciwny do
strumienia wakancji
66
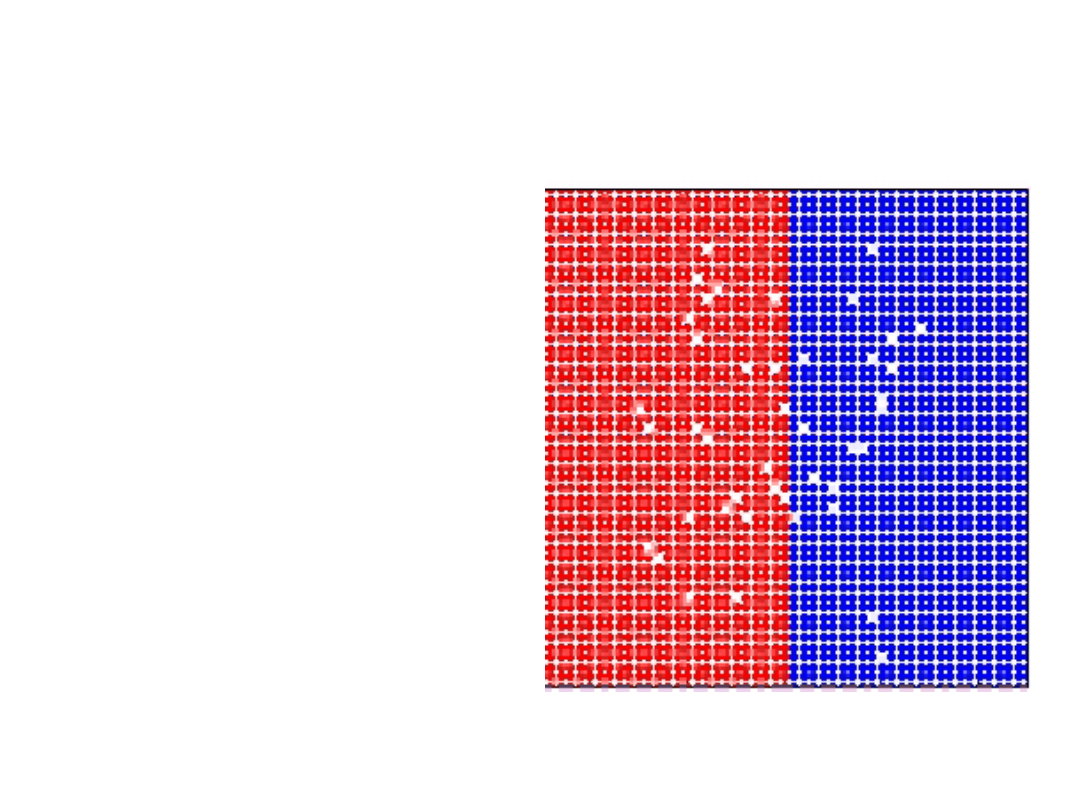
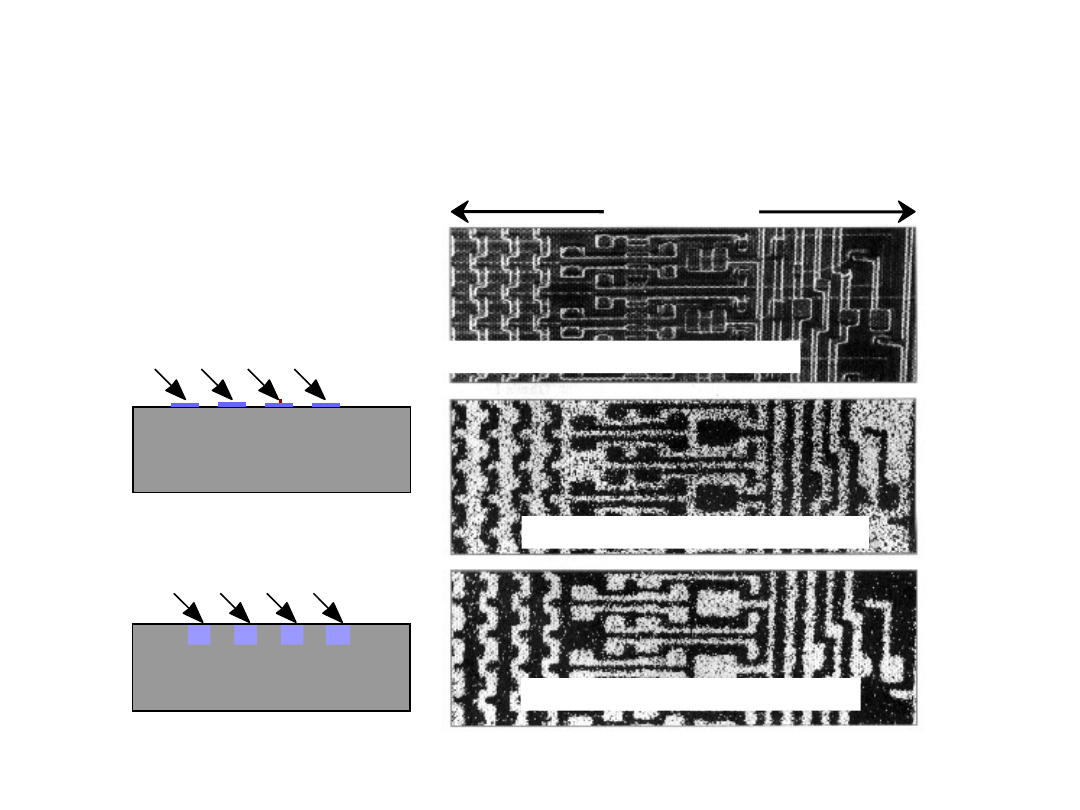
Symulacja dyfuzji na
granicy dwóch
ośrodków:
Szybkość dyfuzji atomów
substytucyjnych zależy od:
- koncentracji wakancji,
- częstotliwości
przeskoków.
Symulacja dyfuzji
77
Mechanizmy dyfuzji
• Dyfuzja międzywęzłowa
– mniejsze atomy
mogą dyfundować pomiędzy atomami
osnowy
Dyfuzja międzywęzłowa jest szybsza niż
dyfuzja mechanizmem wakancyjnym

88
Nawęglanie
:
Dyfuzja atomów węgla do
osnowy stalowej o mniejszej
zawartości węgla
Obecność węgla sprawia, że
stal staje się twardsza i
bardziej odporna na ścieranie
Przykład:
koła zębate w
skrzyniach biegów
Procesy wykorzystujące
dyfuzję
Inne obróbki powierzchniowe związane z dyfuzją:
azotowanie, cyjanowanie, borowanie
(od boru – pierwiastka)
99
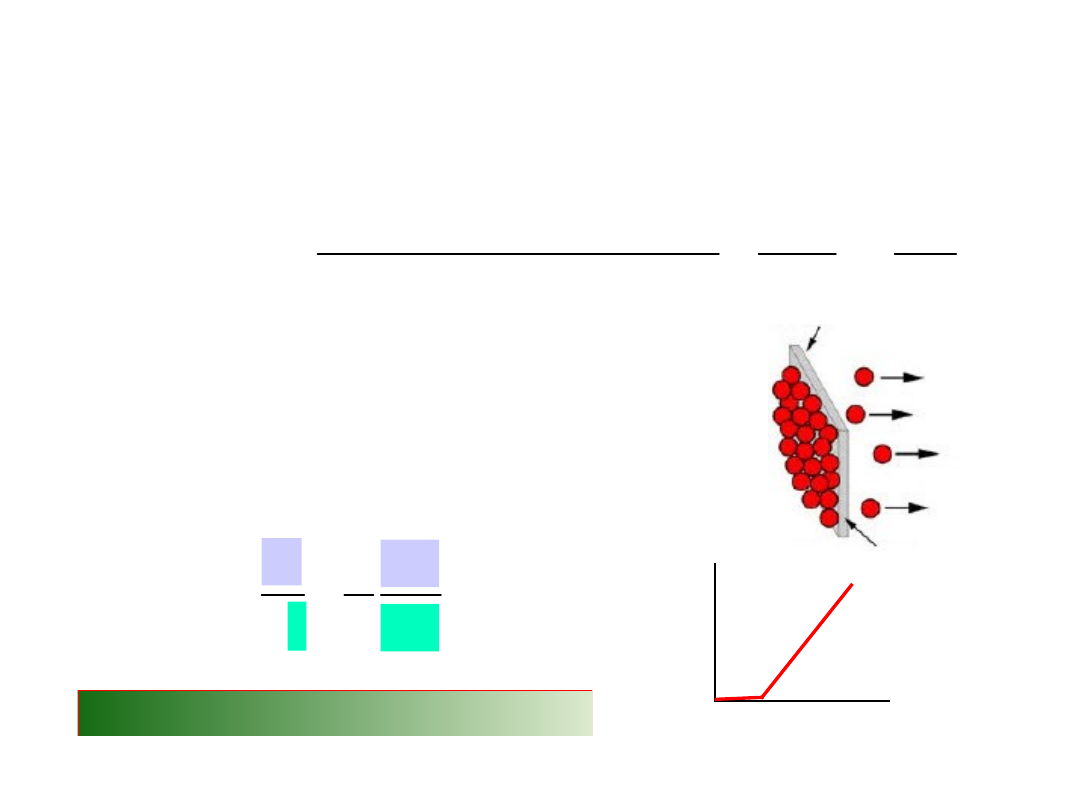
•
Domieszkowanie
krzemu atomami Al w układach
scalonych
• Proces:
krzem
Procesy wykorzystujące
dyfuzję
powiększony obraz chipu
0.5
mm
jasne obszary: atomy Si
jasne obszary: atomy Al
2. Podgrzanie
1.
Umieszczenie warstwy
bogatej w aluminium na
powierzchni krzemu.
krzem
Chapter 18, Callister 7e.
SEM
1010
Dyfuzja – opis ilościowy
• Pomiar empiryczny
– Membrana o znanej powierzchni
– Gradient koncentracji
– Pomiar szybkości dyfuzji przez membranę
s
m
kg
lub
s
cm
mol
czas
ia
powierzchn
masa)
(lub
moli
dyf.
liczba
Strumie
ń
2
2
J
dt
dM
A
At
M
J
1
M
=
m
a
sa
czas
J wsp. kier.
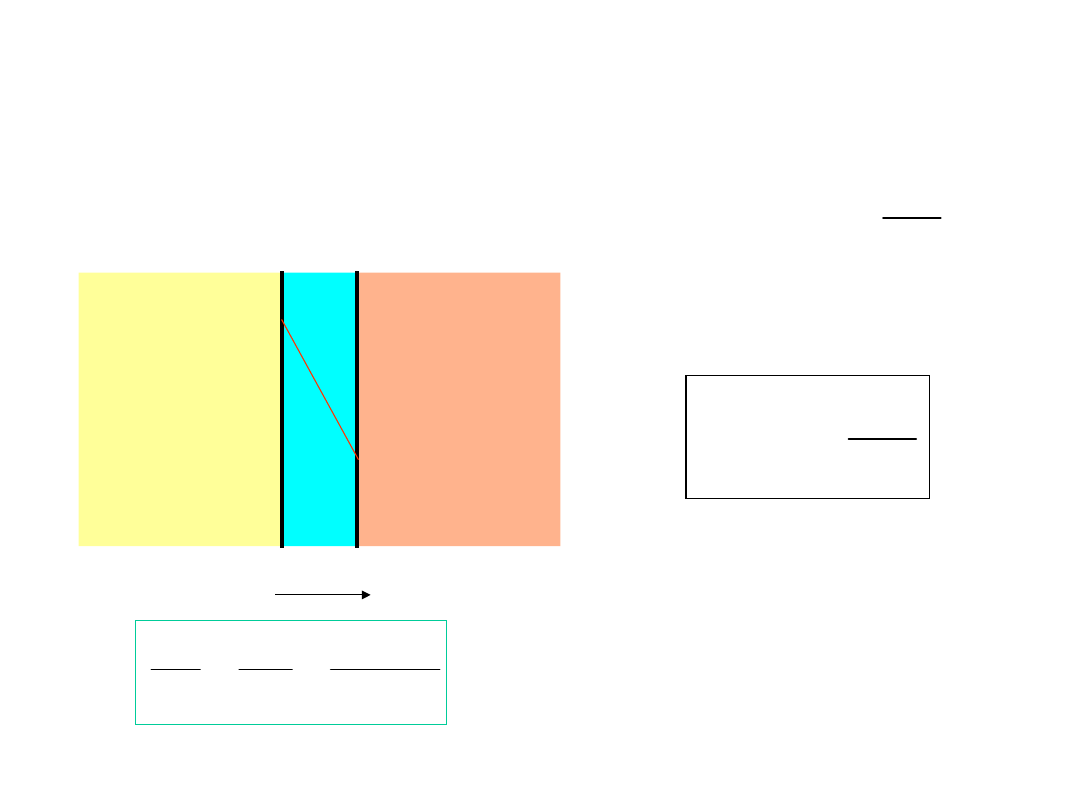
Jak ilościowo opisać dyfuzję?
x
gradient koncentracji
A
membrana
duże
stężeni
e
małe
stężeni
e
1111
Dyfuzja w Stanie Ustalonym
dx
dC
D
J
Pierwsze prawo
Ficka:
C
1
C
2
x
C
1
C
2
x
1
x
2
D współczynnik dyfuzji
Szybkość dyfuzji jest niezależna od czasu
Strumień jest proporcjonalny do
gradientukoncentracji
=
dx
dC
1
2
1
2
x
x
C
C
x
C
dx
dC
1212
Przykład: Rękawice ochronne
• Używając rozpuszczalnika farb należy używać rekawiczek
ochronnych, aby rozpuszczalnik nie był absorbowany przez
skórę.
• Jeżeli używamy rękawiczek gumowych o grubości 0.04 cm,
to jaki jest strumień cząsteczek rozpuszczalnika
przenikającego przez gumę?
• Dane:
– współczynnik dyfuzji rozpuszczalnika w gumie:
D = 110 x10
-8
cm
2
/s
– stężenia powierzchniowe:
C
2
= 0.02 g/cm
3
C
1
= 0.44 g/cm
3
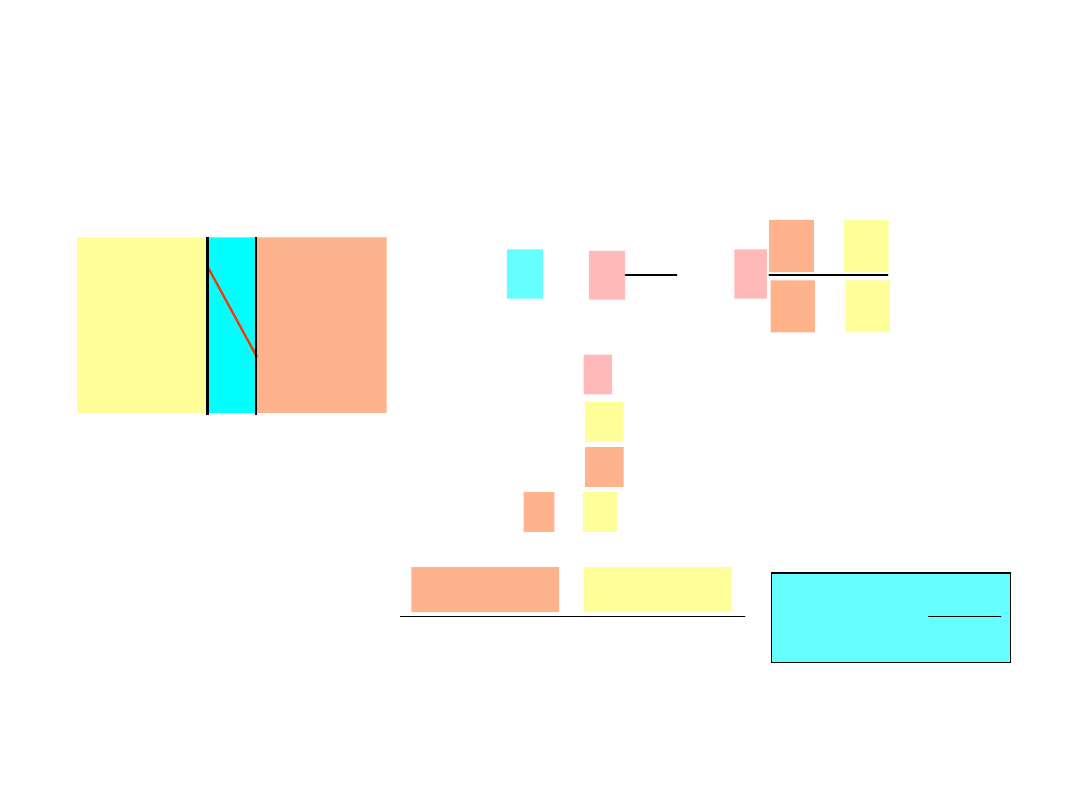
1313
s
cm
g
10
x
16
.
1
cm)
04
.
0
(
)
g/cm
44
.
0
g/cm
02
.
0
(
/s)
cm
10
x
110
(
2
5
-
3
3
2
8
-
J
Przykład - rozwiązanie
1
2
1
2
-
x
x
C
C
D
dx
dC
D
J
D
t
b
6
2
rę
ka
w
ic
zk
a
C
1
C
2
skóra
ro
zp
u
sz
cz
a
ln
ik
x
1
x
2
Rozwiązanie
– zakładamy liniowy gradient koncentracji
D = 110
x
10
-8
cm
2
/s
C
2
= 0.02 g/cm
3
C
1
= 0.44 g/cm
3
x
2
– x
1
= 0.04 cm
Data:
1414
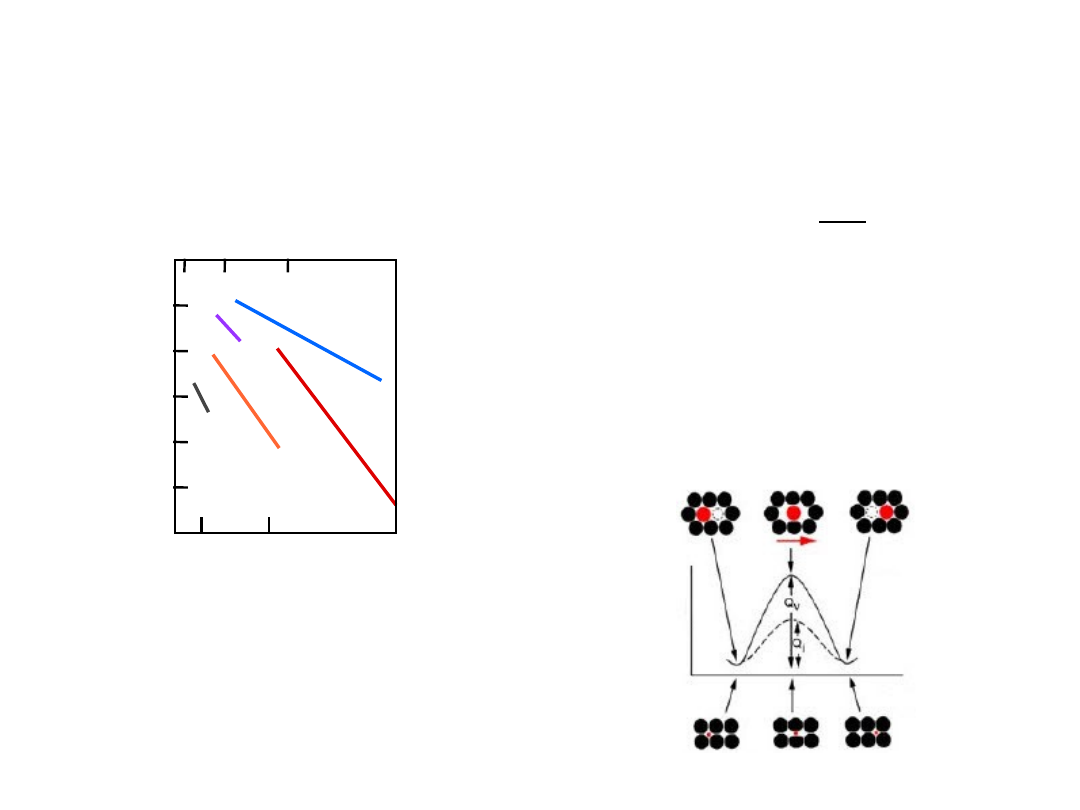
Dyfuzja i temperatura
Zależność D od temperatury T ma charakter
wykładniczy
D
D
o
exp
Q
d
R
T
D
o
= stała [m
2
/s]
D = współczynnik dyfuzji [m
2
/s]
Q
d
= energia aktywacji [J/mol or eV/atom]
R = stała gazowa [8.314 J/mol-K]
T = temperatura bezwzględna [K]
1000 K/T
lnD
C w
-Fe
C w
-F
e
Al
w
A
l
Fe
w
-
Fe
Fe
w
-F
e
0.5
1.0
1.5
10
-20
10
-14
10
-8
T(C)
1
5
0
0
1
0
0
0
6
0
0
3
0
0
D
międzywęzł.
>> D
subst.
C w -Fe
C w -Fe
Al w Al
Fe w -Fe
Fe w -Fe
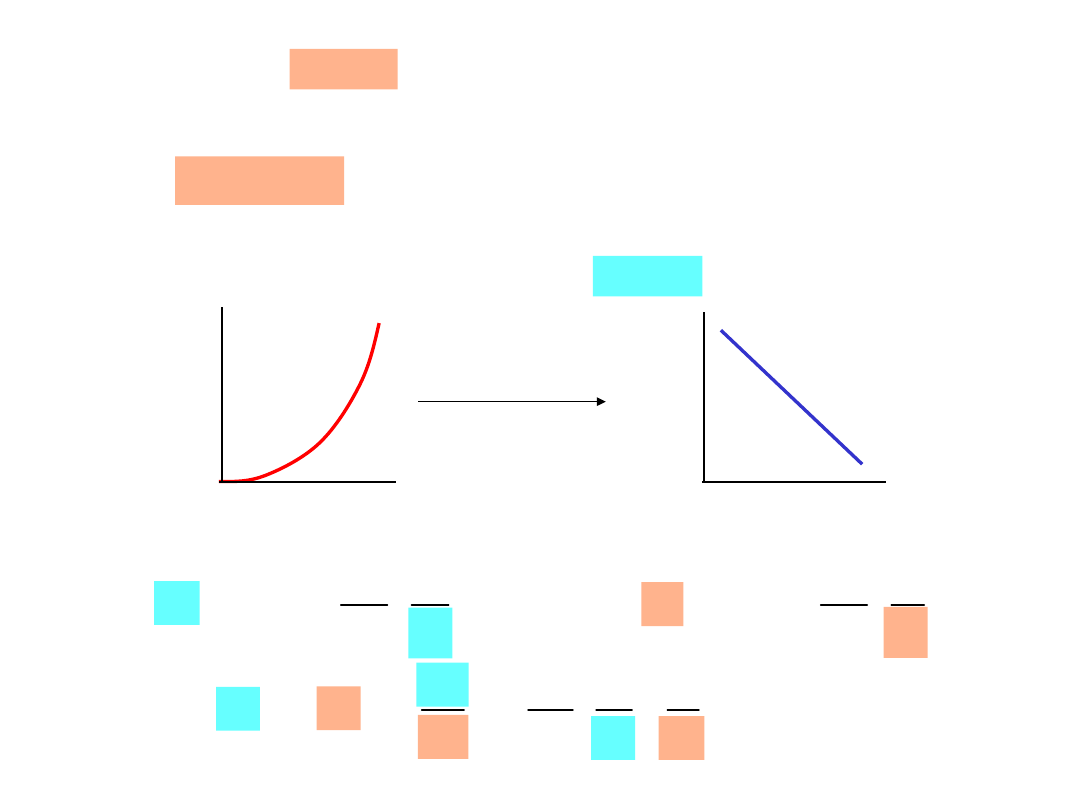
1515
Przykład: W 300ºC współczynnik dyfuzji oraz
energia aktywacji Cu i Si wynoszą:
D(300ºC) = 7.8 x 10
-11
m
2
/s
Q
d
= 41.5 kJ/mol
Jaki jest współczynnik dyfuzji w 350ºC?
1
0
1
2
0
2
1
ln
ln
and
1
ln
ln
T
R
Q
D
D
T
R
Q
D
D
d
d
1
2
1
2
1
2
1
1
ln
ln
ln
T
T
R
Q
D
D
D
D
d
przekształcen
ie
D
Temp = T
ln D
1/T
1616
Przykład (cd.)
K
573
1
K
623
1
K
-
J/mol
314
.
8
J/mol
500
,
41
exp
/s)
m
10
x
8
.
7
(
2
11
2
D
1
2
1
2
1
1
exp
T
T
R
Q
D
D
d
T
1
= 273 + 300 = 573
K
T
2
= 273 + 350 = 623
K
D
2
= 15.7 x 10
-11
m
2
/s
2
2
x
C
D
t
C
1717
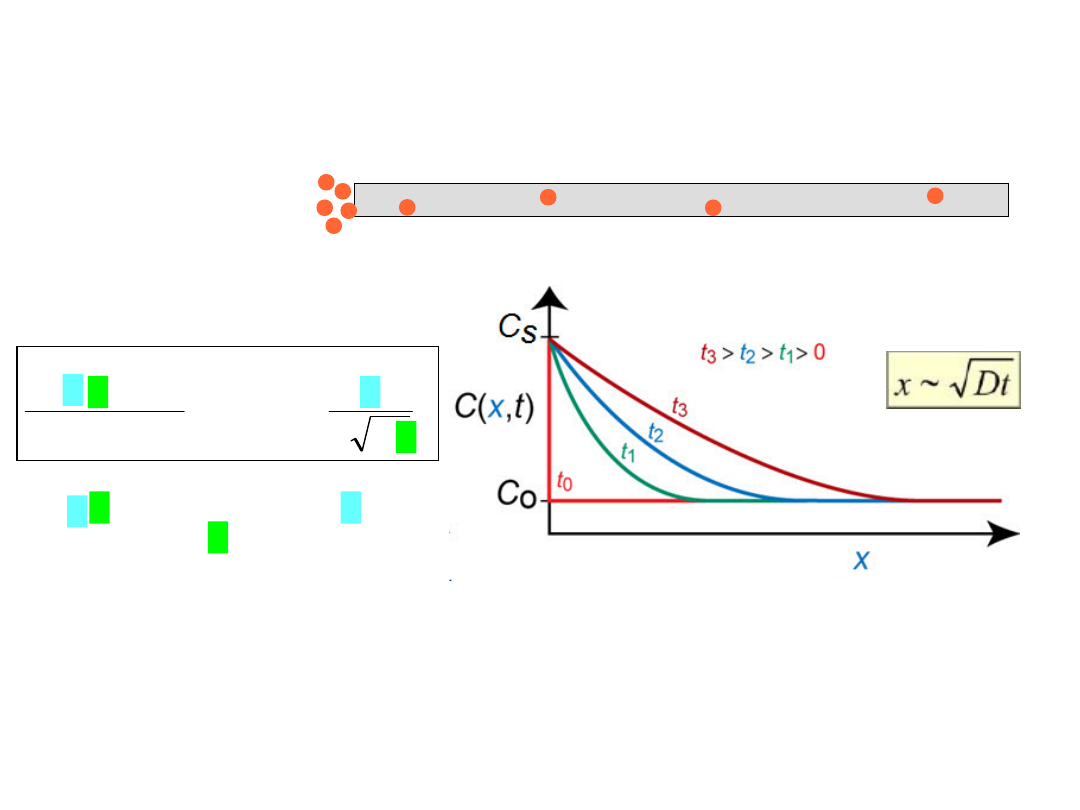
Dyfuzja w stanie
niestacjonarnym
• Koncentracja dyfundującej substancji jest funkcją zarówno czasu, jak i temperatury C = C(x,t)
• W takim przypadku obowiązuje
II Prawo Ficka
Rozwiązanie tego równania jest warunkowane
narzuconymi przez konkretną sytuację warunkami
brzegowymi
Dt
x
C
C
C
t
,
x
C
o
s
o
2
erf
1
dy
e
y
z
2
0
2
erf (z)
C(x,t) = Konc. w punkcie x po
czasie t
erf (z) = funkcja błędów
erf (z) = funkcja błędów
1818
Dyfuzja w stanie
niestacjonarnym
dla t = 0, C = C
o
dla 0
x
dla t > 0, C = C
S
dla
x
= 0 (konc. na pow.
const.)
C = C
o
dla
x
=
• Cu dyfunduje w pręcie Al
konc. początkowa Cu w pręcie – C
o
Konc. na pow. c
s
,
pręt
Dt
x
C
C
C
t
,
x
C
o
s
o
2
erf
1
C(x,t) = Konc. w punkcie
x po czasie t
wartości erf(z)
są podane w
tabelach
1919
Dyfuzja w stanie niestacjonarnym -
przykład
• Przykład:
żelazo (struktura RSC) zawierające
początkowo
0.20 %
C (%mas.) jest nawęglane w
podwyższonej temperaturze i w atmosferze, która
wytwarza na powierzchni stałą koncentrację węgla
1.0%
(mas.). Jeżeli po
49.5 h
koncentracja węgla wynosi
0.35%
w warstwie leżącej
4.0 mm
poniżej powierzchni,
to w jakiej temperaturze prowadzono ten proces? .
• Rozwiązanie:
Dt
x
C
C
C
t
x
C
o
s
o
2
erf
1
)
,
(
t = 49.5 h
x = 4 x 10
-3
m
C
x
= 0.35 wt%
C
s
= 1.0 wt%
C
o
= 0.20 wt%
)
(
erf
1
2
erf
1
20
.
0
0
.
1
20
.
0
35
.
0
)
,
(
z
Dt
x
C
C
C
t
x
C
o
s
o
erf(z) =
0.8125
2020
Rozwiązanie c.d.:
Najpierw musimy znaleźć (z tabeli) wartość z, dla której
funkcja błędów wynosi 0.8125. Należy dokonać
interpolacji:
z
erf(z)
0.90
0.7970
z
0.8125
0.95
0.8209
7970
.
0
8209
.
0
7970
.
0
8125
.
0
90
.
0
95
.
0
90
.
0
z
z 0.93
Teraz
rozwiązać
względem D
Dt
x
z
2
t
z
x
D
2
2
4
/s
m
10
x
6
.
2
s
3600
h
1
h)
5
.
49
(
)
93
.
0
(
)
4
(
m)
10
x
4
(
4
2
11
2
2
3
2
2
t
z
x
D
2121
Aby znaleźć temperaturę, w której D ma powyższą
wartość, należy przekształcić równanie:
)
ln
ln
(
D
D
R
Q
T
o
d
Dla dyfuzji C w Fe-
dane stabelaryzowane
D
o
= 2.3 x 10
-5
m
2
/s Q
d
= 148,000 J/mol
/s)
m
10
x
6
.
2
ln
/s
m
10
x
3
.
2
K)(ln
-
J/mol
314
.
8
(
J/mol
000
,
148
2
11
2
5
T
Rozwiązanie
c.d.:
T = 1300 K = 1027°C
1
ln
ln
0
T
R
Q
D
D
d

2222
Szybsza
dyfuzja gdy.....
• luźno ułożone struktury
• materiały ze słabszymi
wiązaniami (np. wtórnymi)
• mniejsze atomy
dyfundujące
• materiały o mniejszej
gęstości
Wolniejsza
dyfuzja
gdy.......
• gęsto ułożone struktury
• materiały z mocnymi
wiązaniami (np.
kowalencyjnymi)
• większe atomy
dyfundujące
• materiały o większej
gęstości
Podsumowanie
Document Outline
- Dyfuzja w ciałach stałych
- Dyfuzja
- Dyfuzja wzajemna
- Samodyfuzja
- Mechanizmy Dyfuzji
- Symulacja dyfuzji
- Mechanizmy dyfuzji
- Procesy wykorzystujące dyfuzję
- Slide 9
- Dyfuzja – opis ilościowy
- Dyfuzja w Stanie Ustalonym
- Przykład: Rękawice ochronne
- Przykład - rozwiązanie
- Dyfuzja i temperatura
- Slide 15
- Przykład (cd.)
- Dyfuzja w stanie niestacjonarnym
- Slide 18
- Dyfuzja w stanie niestacjonarnym - przykład
- Rozwiązanie c.d.:
- Slide 21
- Podsumowanie
Wyszukiwarka
Podobne podstrony:
ŚrodkiTransportu Dalekiego wykład 5a
Wyklad 5a Unia niezawodność
wykład 5A
Wyklad 5a niezawodność
wyklad 5a Wnioskowanie statystyczne
Psychologia osobowości dr Kofta wykład 5a Psychodynamiczne podejście do osobowości
wyklad 5a
bf wyklad 5a
Socjologia makrostruktury społeczne wykład 5a, Temat: Teorie wyjaśniające zmiany społeczne
ŚrodkiTransportu Dalekiego wykład 5a
Historia myśli socjologicznej wykład 5a
Wyklad 5a Unia niezawodność
więcej podobnych podstron