
Mikrobiologia ćw. 3
Charakterystyka niektórych
grzybów i wirusów

Grzyby
• Materiały do badania mikrobiologicznego
– Płyny ustrojowe
– Wymazy z ran
– Kał
– Materiały śródoperacyjne, cewniki
– Wymazy z górnych dróg oddechowych
– Wyskrobiny ze skóry i paznokci
• Przechowywanie materiału klinicznego
– Należy jak najszybciej przetransportować do
laboratorium
– Temp. 4° C
– Transportować w zamkniętych pojemnikach w
statywie

Grzyby– podział ze wzg.
klinicznych
• Dermatofity– skóra, włosy, paznokcie
– Microsporum, Trichophyton
• Grzyby dymorficzne– dwie postacie
morfologiczne w zależności od temp. 35-37°
C– drożdże,*> 37° C– Pleśń
– Histoplasma, Blastomyces
• Drożdże
– Tryptococus, Geotrichun
• Nitkowate– pleśnie
– Mucor
– Rhizocus
• Ciemne
– Cladosporium
• Hialinowe
– Aspergillus

Grzyby– preparat
bezpośredni
• W sterylnej foli
• Po odwirowaniu materiałów płynnych
• W plwocinie, BAL-u i ropie poszukujemy
grudek, ziaren, pasemek
• Materiały kliniczne na wymaz wyskrobujemy
na szkiełko z 0,9% NaCl
• Preparaty z wycinków tkankowych
(dermatofity) wykonujemy z 10% KOH– usuwa
materiały tkankowe zostawiając
nienaruszonego grzyba
• Niekiedy robi się preparaty barwione metodą
Grama- preparat barwi się wówczas na
niebiesko

Grzyby– metody
barwienia
• Gomori-Grocat
– Drożdżopodobne
• Fiolet krezolowy
– Gromada Zygomota
• Mucykarin
– Cryptococus
• Pozytywno negatywna– tusz kreślarski
• Strzępki, zarodniki- przyśpieszają diagnostykę
oraz umożliwiają wcześniejsze leczenie
• Rozpoznanie potwierdza się wzrostem w
posiewie grzybów

Grzyby– podłoża
• Podłoże Sabourauda
– Cyklonheksamid– hamuje wzrost grzybów pleśniowych
– Chloramfenikol- hamuje wzrost bakterii
– Inkubacja 10 dni w temp. 30° C (37° C)
– Przegląd hodowli po 24h- wstępna diagnostyka
• Gdy stwierdzi się obecność grzyba jedną płytkę
inkubujemy w temp. 37° C
– Przegląd hodowli po 48h identyfikuje się wrażliwość
na leki
• Podłoże Czepek-Doxa
– Cechy wzrostu podobne jak w podłożu Sabourauda.
Inne antybiotyki
• Podłoże Christiansena
– Cechy wzrostu podobne jak w podłożu Sabourauda.
Inne antybiotyki

Grzyby typy wzrostu
• T. Rubrum
– Kolonie czerwone
• T. Violacum
– Kolonie fioetowe
• E. Flocusum
– Wzrasta na oliwkowo
• M. Frufur
– Kolor kremowy, gładkie, miękkie
• A. Niger
– Czarne, „puszyste” ,postrzępione brzegi
• C.albicans
– Kolor kremowy lub biały

Grzyby– mikrohodowla
•
Szkiełko podstawowe, agar, grzyb (wymaz)
–
Tak przygotowany preparat ustawiamy na płytce
Petriego (wilgotna bibułka w środku)
•
Dermatofity
–
Barwienie błękitem metylowym
•
Pleśnie
–
Podbarwienie laktofenolem
•
Ocena mikroskopowa morfologii hodowli
grzybów
•
Identyfikacja
–
Dermatofity
•
Wygląd mikrokonidi i makrokonidi (zarodniki)
•
Oraz obecność i wygląd zarodników szczątkowych
–
Pleśniowe
•
Wygląd owocników

Grzyby– testy
• Test filamentacji
inaczej „germ tubes”
• Zdolność do
wytwarzania
charakterystycznych
wypustek
(filamentów) w
surowicy czy innych
płynach ustrojowych
w temp. 37° C przez
2 do 3h
Candida
albicans
Candida tropicalis

Grzyby– testy
• Test na ureazę
– Stosujemy podłoże z mocznikiem
– W ciągu 7 dni barwa podłoża powinna zmienić się z
żółtej na różową
• Trichophyton rubrum –
• Trichophyton mentagophytes +
• Test perforacji włosa
– Zdolność poprzecznego perforowania jałowego włosa
– Włosy wyjaławiamy i dodajemy ekstrakt drożdżowy
preparat umieszczamy na płytce Petriego (szkiełko z
nawilżoną bibułką)
– Preparat inkubujemy przez 2 tygodnie, a następnie
umieszczamy pod mikroskopem
• Dodatni wynik daje Trichophyton mentagophytes +
• Ujemny wynik daje Trichophyton rubrum –

Grzyby– testy
• Auksanogram węglowodanowy
– Zdolność do przyswajania węgla z cukrów
• Auksanogram azotowy
– Zdolność do przyswajania azotu ze związków
azotowych
• Zymogram
• Zdolność do fermentacji cukrów
• Test API
– miniprobówki + klucz
• Test ID
– Wgłębienia + komputer
• Metody serologiczne – dla grzybów
– Aglutynacja lateksowa
• Z płynu mózgowo – rdzeniowego
• Surowicy krwi

Grzyby– testy
• Serologiczne c.d.n
– OWD
– Precypitacja
• Serologiczne z zastosowaniem znaczników
– Immunoenzymatyczne
– Immunoradilogiczne
• Genetyczne
– Polimeraza łańcuchowa PCR
– Metody sond genetycznych– hybrydyzacji
• Wysoka czułość i swoistość
• Szybkie wykrywanie i identyfikacja w materiale
klinicznym

Grzyby – testy
• Antymikotyki – ocena lekowrażliwości
– Fungitest
• Metoda półilościowa oparta na metodzie
rozcieńczeniowej
• Na leki przeciwgrzybiczne
– Mikokonazol
– Ketokonazol
– Flukokonazol
– ATP- fungus INT
• Metoda ilościowa
– Ocena MIC
• Najmniejsze stężenie leku chamujące wzrost
kolonii grzybiczej

Podejrzenia grzybicy
• Skoki gorączki
• Zmiany w płucach przypominające gruźlicę
• Stwierdzenie obecności grzyba w materiale
klinicznym
• Brak efektów antybiotykoterapii

Grzyby– sposób zarażenia
• Przenoszenie dermatofitów
– Człowiek– człowiek
• Kontakt bezpośreni lub pośredni
• Antropofilne
• Gleba
– Geofilne
• Zwierzę
– Zoofilne
– Kontakt z chorym zwierzęciem
– Gleba
• Naskórek, który zostawiły podczas tarzania

Grzyby– choroby
•
Kandydoza – układowa
– Candida albicans
• Wchodzi w skład fizjologicznej flory górnych dróg
oddechowych (40- 80%), przewodu pokarmowego i
żeńskich dróg rodnych
– Candida tropicalis
– Candida krusei
– Zakażenia
• Skóry
• Układu pokarmowego, oddechowego, kostnostawowego
• Zapalenie oka, wsierdzia, OUN
• Posocznica
• Układu moczowego i rodnego
– Diagnostyka
• Wytwarzanie wypustek( test filamentacji)
• Wytwarzanie clamydospor („przetrwalników)

Grzyby – choroby
• Kryptokokoza – układowa
– Cryptococus Neoformans
• Kryptokokowe zapalenie opon mózgowych
– Cryptokokus pączkujący ma najczęściej otoczkę
polisacharydową
– Zakażenie
• Drogą kropelkową
• Odchody zwierząt
– Ptaków
– Drobiu
– Diagnostyka
• Uwidocznienie otoczki grzyba

Grzyby – choroby
• Aspargilioza – układowa
– Atakuje gł. układ oddechowy
• Postać alergiczna
• Postać inwazyjna
– Grzyb nacieka na miąższ płucny
• Grzybiak kropidlakowy
– Zmiany widoczne na zdjęciach RTG
– Najczęściej po gruźlicy
• Skórne
• Posocznica
– Zakażenia po przeszczepie szpiku, skóry, oka
– Zakażenie drogą kropelkową
– Leczenie
• Amfotrecyna B
– Postać inwazyjna
• Leczenie chirurgiczne
– Grzybniak kropidlakowy

Wirusy
• Są pasożytami wewnątrzkomórkowymi
• Posiadają DNA lub RNA
• Posiadają białka wiążące białka na powierzchni
komórek
• Materiały do badania mikrobiologicznego
– Surowica
• Jeśli jest pobierana strzykawką, a nie do probówki
należy przed przelaniem zdjąć igłę (zapobiega to
hemolizie krwinek)
– Wymazy
• Szybki energetyczny ruch do probówki z podłożem
transportowym
– Płyn z pęcherzyków płucnych
• Preparat bezpośredni
– Kał
• Suche, jałowe pojemniki
– Krew – 5 – 10 ml

Wirusy – pobieranie
• Zakażenia układu oddechowego
– Wymazy z gardła, nosa, popłuczyny z gardła
• Zakażenia układu pokarmowego
– Kał
• Wysypka pęcherzykowa
– Płyn z pęcherzyków
– Wymaz z gardła
– Kał
• Zapalenie wątroby
– Surowica
– Kał
• Zakażenie OUN
– Płyn mózgowo-rdzeniowy
• AIDS
– Nieskrzepnięta krew

Wirusy – pobieranie
uwagi
• Materiały powinny być pobrane z miejsca gdzie
obserwowany jest proces chorobowy
• Większość wirusów wnika przez drogi
oddechowe lub pokarmowe, gdzie wstępnie
mogą być namnożone, ale podstawowe objawy
kliniczne występują w narządach dalej
położonych
– Należy pobrać próbki z kilku miejsc, niezależnie od
miejsca chorobowego
• Jeśli trudno jest uzyskać próbkę z narządu
wewnętrznego lub wirus jest trudny w izolacji
– Również pobiera się próbki z kilku miejsc

Wirusy– przechowywanie i
transportowanie
• Zamknięta i odpowiednio oznaczona torba
– Wirusy mają dużą lotność
• Przechowywanie w temp. 4°C
– Podłoże transportowe z antybiottykami
– W termostatach
• Jeśli dłużej to w temp. -70° – -20°C
– W nieprawidłowo utrzymywanym materiale
produkty rozpadu komórek lub namnażające się
bakterie mogą uszkodzić wirusa
• Wirusy są bardzo wrażliwe na czynniki
środowiskowe taki jak temperatura czy
wilgotność, czy pH
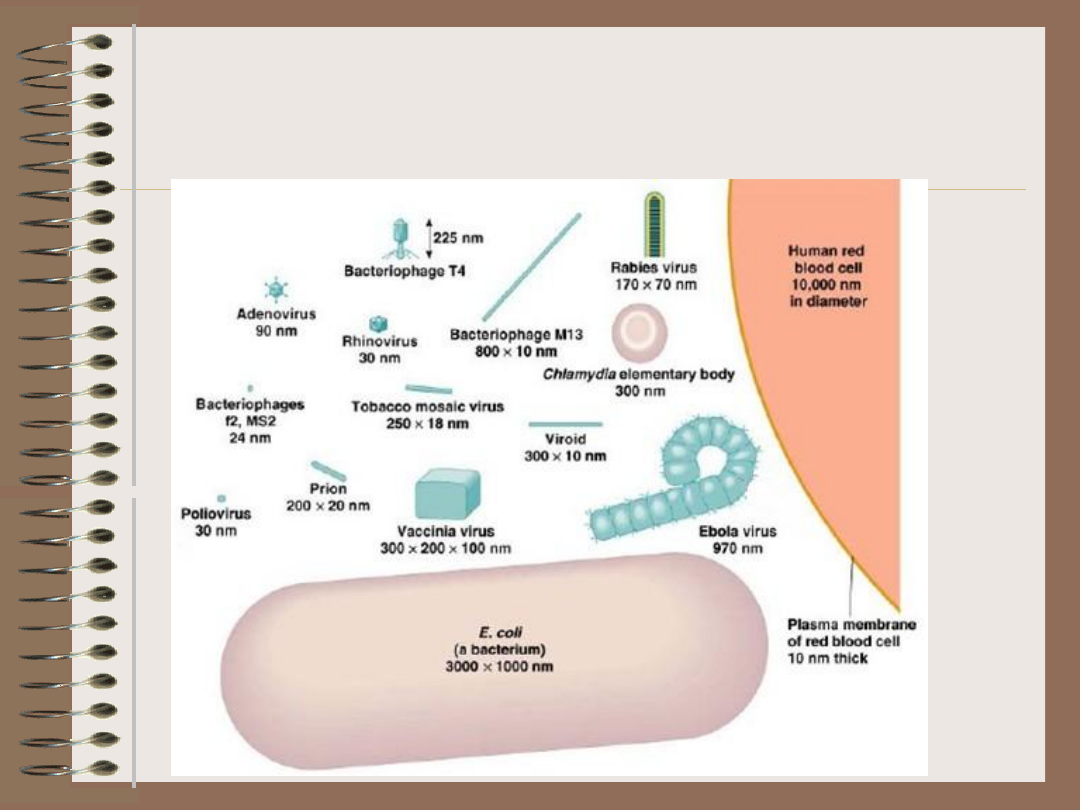
Wirusy – wielkości

Wirusy – budowa
• Pojedyncza cząsteczka wirusa wydostająca się
z jednej komórki, a następnie zakażająca
kolejną, nosi nazwę wirionu.
• W skład wirionu danego wirusa wchodzi
zawsze tylko jeden rodzaj kwasu
nukleinowego, stanowiący materiał genetyczny
wirusa. Kwasy te w wirusach nigdy nie
występują razem. Są nimi:
– DNA
– RNA
• Dlatego wyróżniamy
– DNA wirusy
– RNA wirusy
– Retrowirusy

Wirusy – budowa
• Kwas nukleinowy może występować w postaci
– Jednoniciowego RNA
– Dwuniciowego RNA
– Jednoniciowego DNA
• Liniowego
• Kolistego
– Dwuniciowego DNA
• Liniowego
• Kolistego
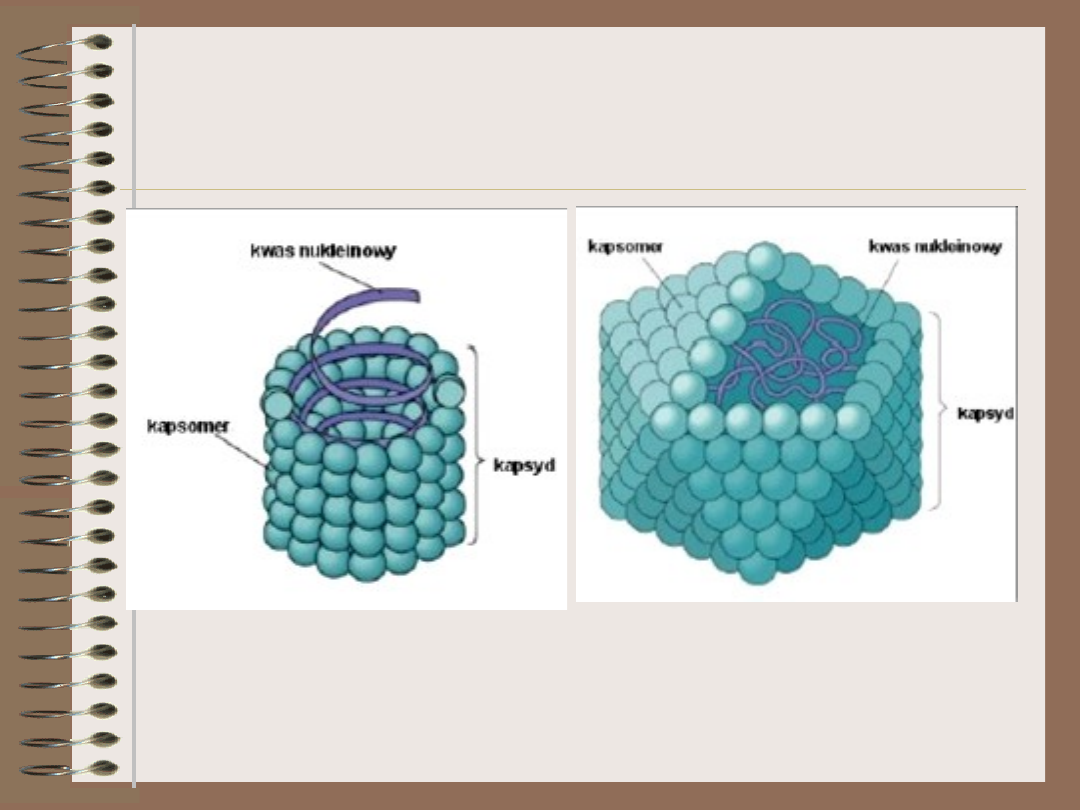
• Materiał genetyczny wirusa jest osłonięty
białkową otoczką, zwaną kapsydem
– Zbudowany z kapsomerów, pojedyńczych jednostek
• Wirusy, które opuszczają komórkę gospodarza
przez pączkowanie, otoczone są dodatkowo
błoną lipidową pochodzącą z komórki
gospodarza
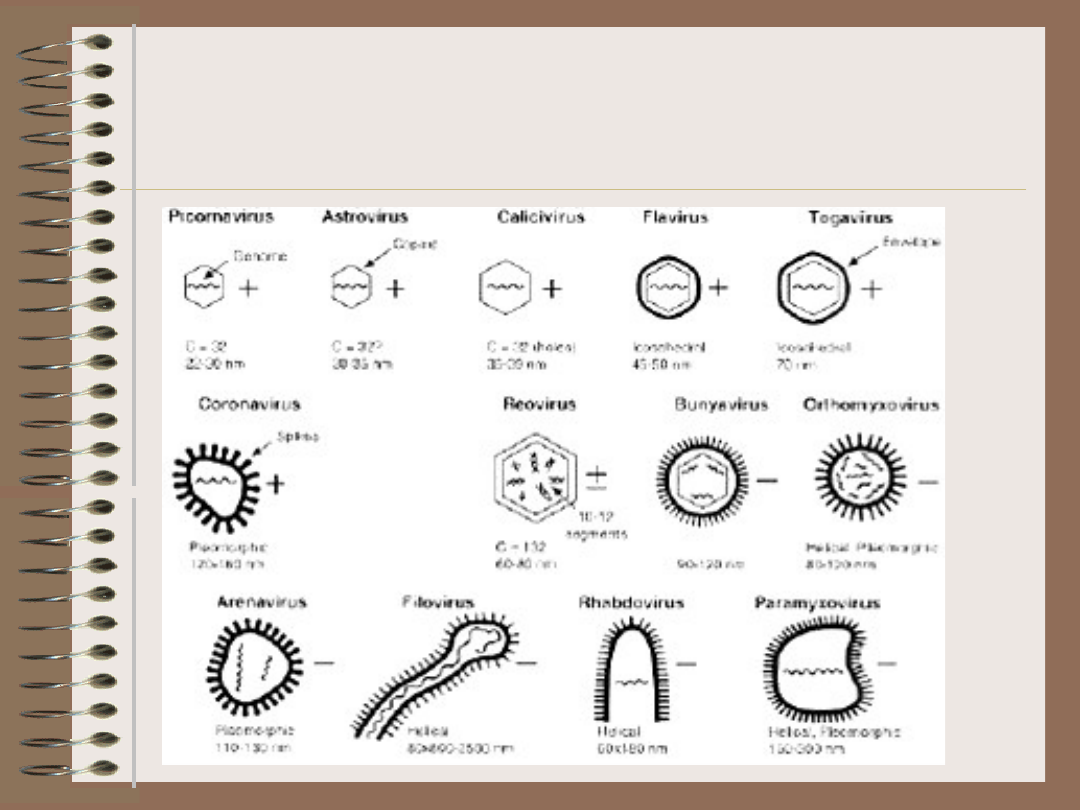
Wirusy – RNA
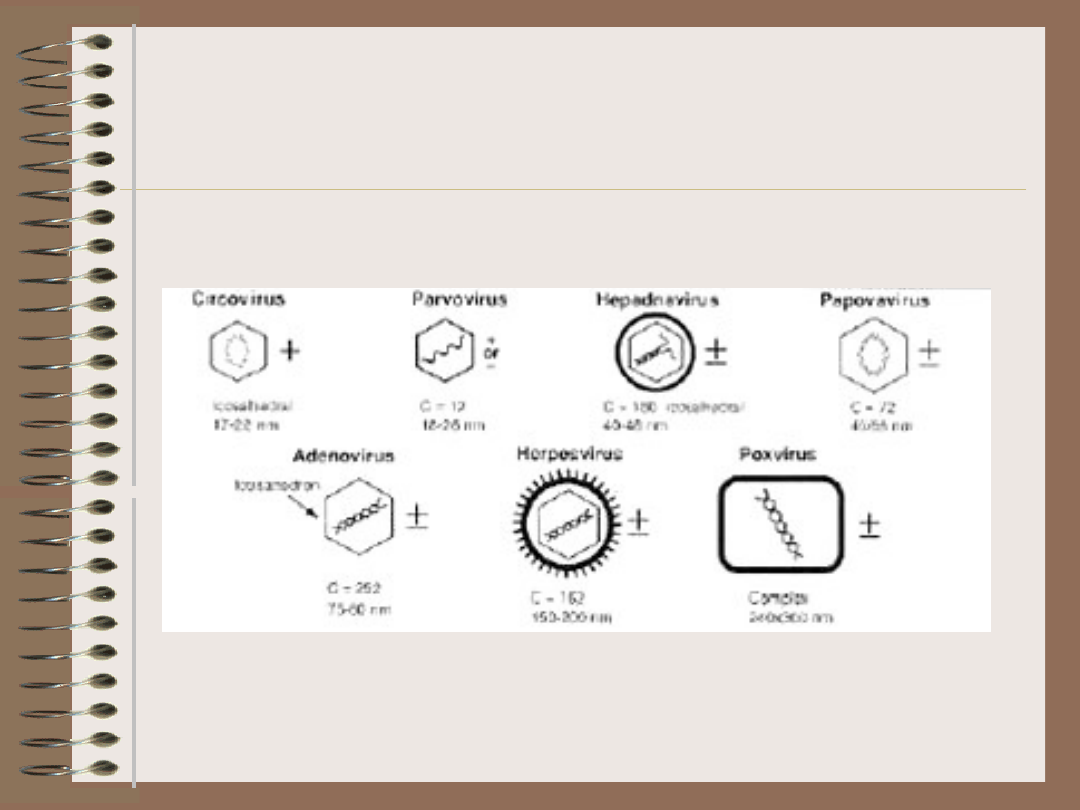
Wirusy – DNA
Wirusy – symetria
• Symetria helikalna;
– Wirus mozaiki
tytoniowej
• Dwudziestościan
– Najwydatniejszy układ
podjednostek w
zamkniętej osłonie
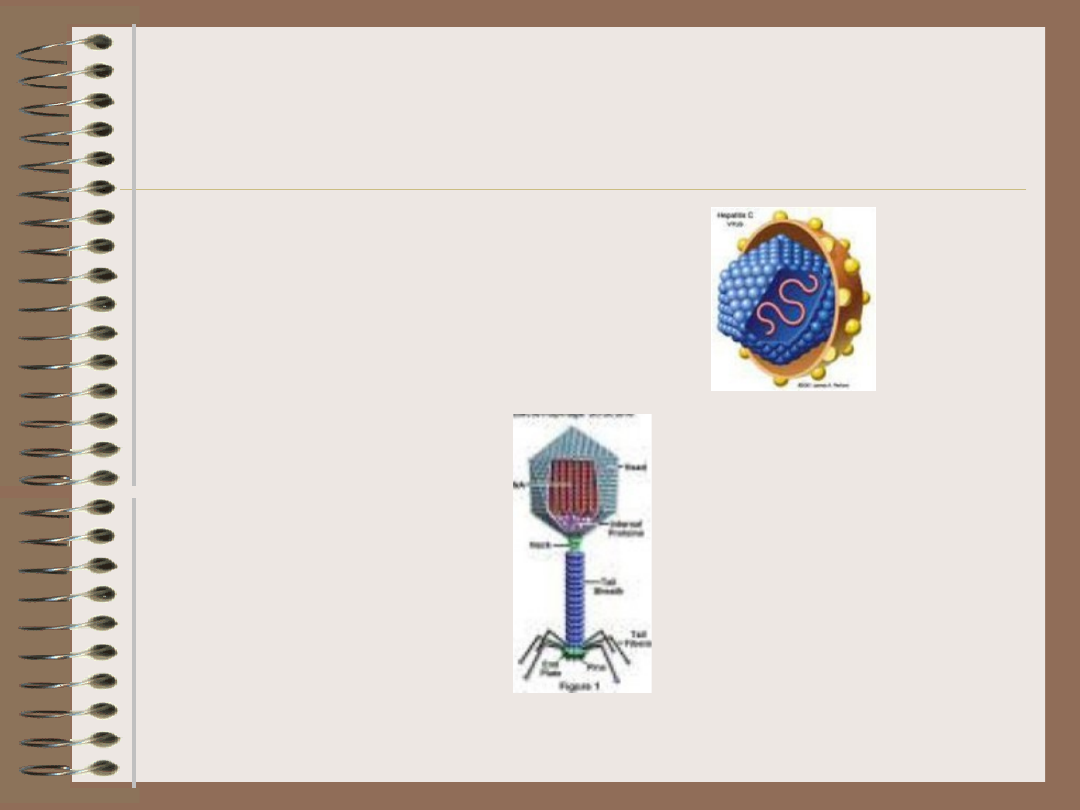
Wirusy – symetria
• Wirusy z płaszczem
– Płaszcz zawiera podwójną warstwę
tłuszczową z glikoproteinami
przytwierdzonymi do niej.
– Jej symetria przypomina
nukleokapsyd
• Wirusy złożone
– Bakteriofagi
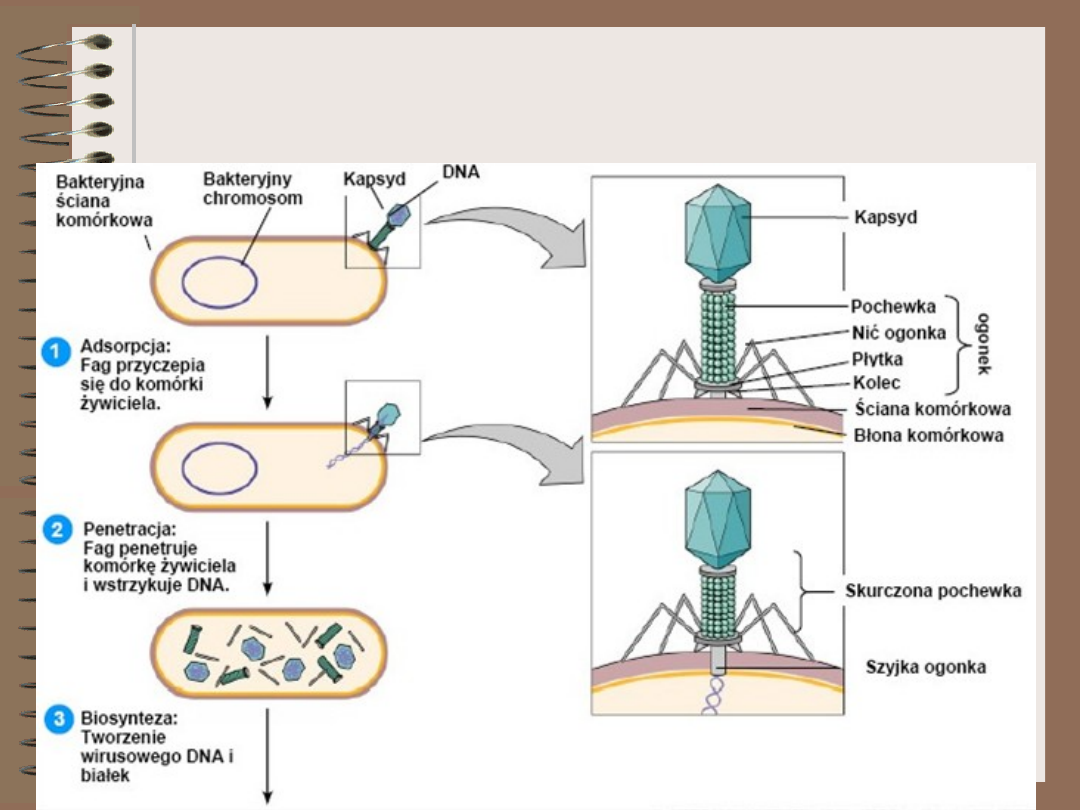
Wirusy – cykl lityczny (1)
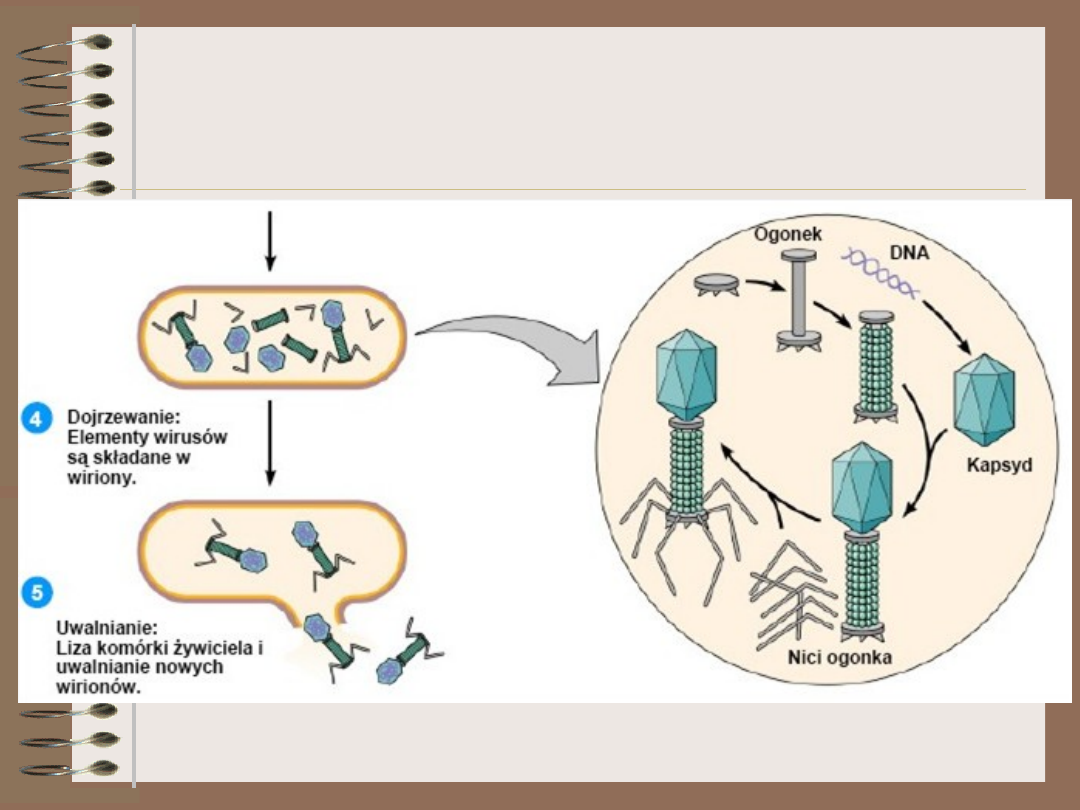
Wirusy – cykl lityczny (2)
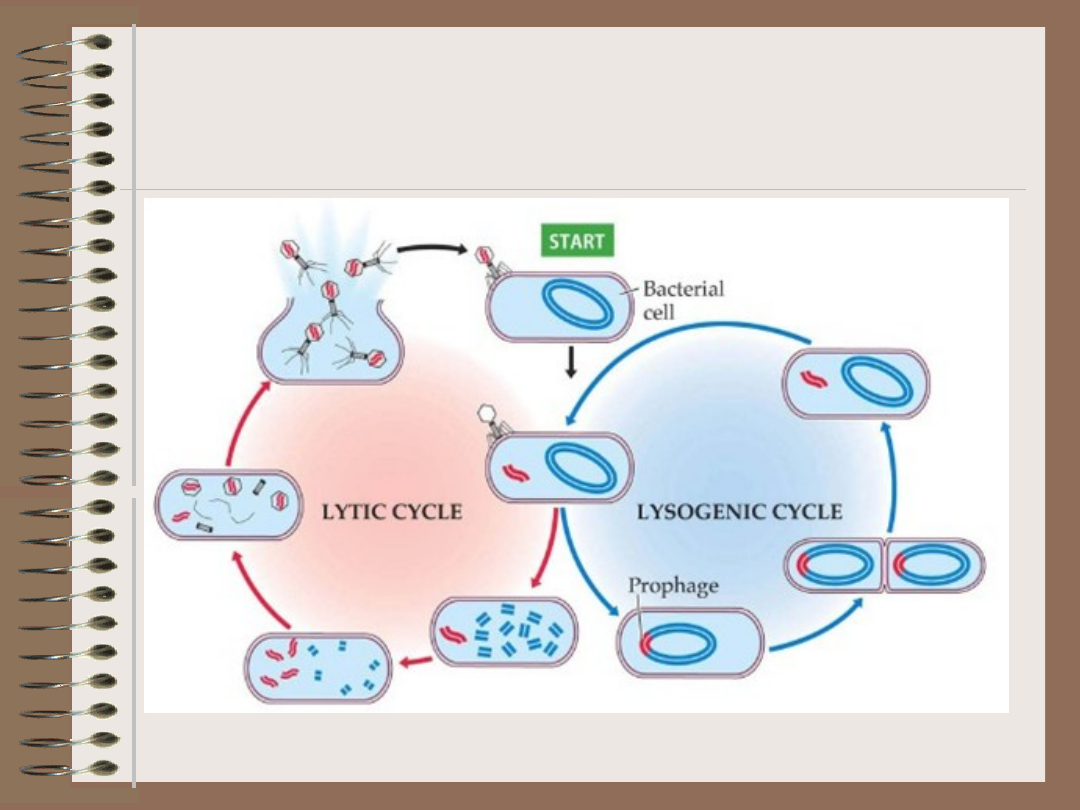
Wirusy – cykl lizogeniczny
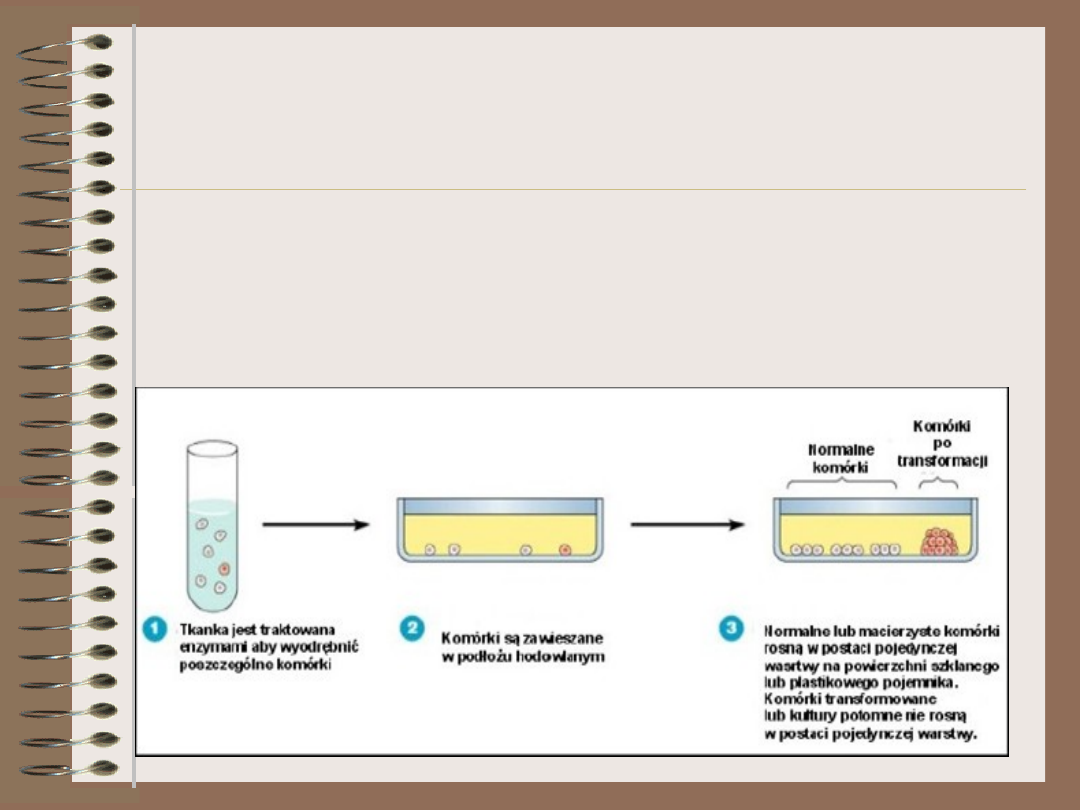
Wirusy – hodowla
• Wirusy zwierzęce i roślinne są hodowane w
kulturach komórkowych
– Ciągła linia komórkowa może być utrzymana przez
określony czas

Wirusy – identyfikacja i
hodowla
• Zwierzęta
– Najczęściej zarodki mysie
– Coxackie, wścieklizna, herpes simplex, arbowirusy
(kleszczowe zapalenie mózgu)
– Po wystąpieniu objawów/ śmierci zwierzęcia
wykonuje się dodatkowe oznaczenia
• Metoda IF
– Pozwalająca na umiejscowienie wirusa lub jego Ag
w komórkach różnych narządów różnych zwierząt
– Przeniesienie do hodowli in vitro
– Zastosowanie metod molekularnych

Wirusy – identyfikacja i
hodowla
• Zarodki ptasie
– Najczęściej 7– 13 dniowe zarodki kurze
– Izolacja herpes, końskiego zapalenia mózgu, orto- i
paramyksowirusów, poksowirusów ( ospa, krowianka,
ospa krowia)
– Zakażone zarodki obumierają
– Lub na ich błonach płodowych pojawiają się
charakterystyczne zmiany
– Przy braku zmian obecność wirusa można stwierdzić
metodą
• Hemoaglutynacji wirusowej
• IF
• Lub zakażając treścią zarodków wrażliwe hodowle
komórkowe lub wrażliwe zwierzęta
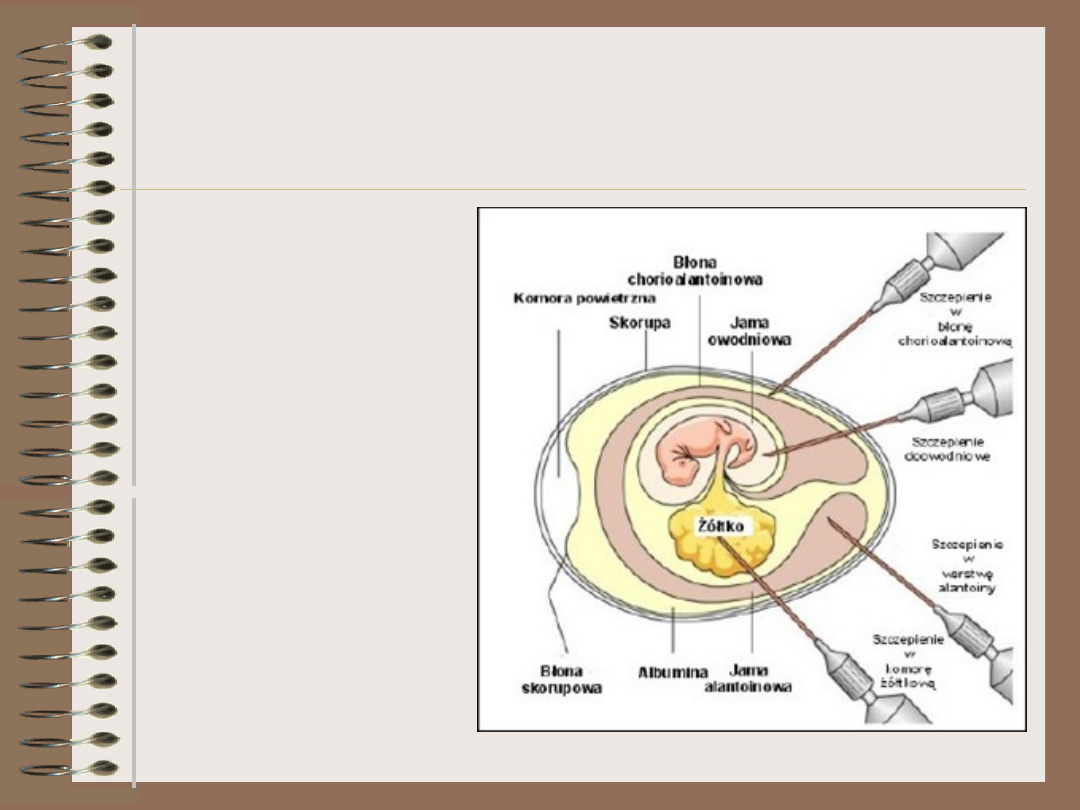
Wirusy – hodowla
• Można je też
hodować
metodą
biologiczną
• Najczęściej są
to zarodki
ptaków lub
noworodki
myszy
– Zdrowy
organizm zakaża
się wirusem i
obserwuje
rozwój choroby

Wirusy – hodowla in vitro
• Hodowle
in vitro
in vitro
– Hodowle pierwotne
• Są przygotowywane każdorazowo
• Jak hodowle nerek małp, świń, lub chomików oraz
zarodków kurzych
• Nie mogą być pasażowane
• Należy je wykorzystać w ciągu 2-3 tygodni
– Hodowle linii ciągłych
• Pochodzą z rozmaitych narządów i gatunków
zwierzęcych
• Mogą być używane w ograniczonej liczbie pasaży
(hodowle diploidalne)
• Lub nie pasażowane (hodowle heteroploidalne)
– Często używa się tkanki HLa z nowotworu
nabłonkowego szyjki macicy, KB z nowotworu
nabłonkowego jamy ustnej i języka i innych

Wirusy – hodowla in vitro
• Hodowle organowe
– Do celów bieżącej diagnostyki są stosowane
nieliczne (na ogół 2-3) linie komórkowe
– W wyniku zakażenia dochodzi do rozwoju
określonych zmian cytopatologicznych (efekt
cytopatyczny), widocznych w bezpośredniej
obserwacji mikroskopowej lub po barwieniu
zakażonych komórek
– Przy braku objawów testy
• IF
• DIF
• Test interferencji
• Metody molekularne

Wirusy – hodowla in vitro
• Przed wprowadzeniem badanego materiału do
systemu hodowli należy
– Pozbawić materiał substancji balastowych za
pomocą krótkotrwałego wirowania, przy niskich
obrotach
– Do płynu znad osadu dodaje się antybiotyki
• Penicylina
• Streptomecyna
• Czasem antymikotyki
– W niektórych przypadkach bada się też osad
• Np.. Mocz wirusy herpes i cytomegalii
• Wady metody izolacji
– Zróżnicowanie wymagań wirusów pod względem
zakażenia i patogenności dla określonych
gospodarzy, jaj czy linii komórkowych
– Występowanie wielu wirusów zakażających dane
komórki lub wywołujące podobne objawy –
konieczna dalsza identyfikacja

Wirusy
diagnostyka mikroskopowa
• Mikroskop świetlny
– Pozwala na obserwację różnych zmian
charakterystycznych dla wirusa zakażającego
• Rozmaz badanego materiału
• Preparat odbitkowy (oba utrwala się alkoholem)
• Barwienie metodą Giemzy, hematoksyliną i eozyną
– Podstawowa droga do obserwacji zmian
cytoplazmatycznych
• Zmiany degeneracyjne
• Powstanie komórek wielojądrzastych w hodowli

Wirusy
diagnostyka mikroskopowa
• Mikroskopia elektronowa
– Możliwość badania
• Materiałów powierzchniowych
• Wewnątrzkomórkowegoo umiejscowienia wirusów
(różnicowanie na podstawie morfologii tylko
czasami)
– Do uwidocznienia kompleksów antygen-przeciwciało
• Możliwość bezpośredniego typowania serologicznego
– Stosowana głównie do badań poznawczych i w
szczególnie groźnych sytuacjach epidemiologicznych
• Wysoka cena mikroskopu i jego eksploatacji

Wirusy
diagnostyka mikroskopowa
• Mikroskopia immunofluorescencyjna
– Powszechnie stosowana w diagnostyce zarażeń
wścieklizną
– Do identyfikacji określonej klasy przeciwciał klasy
Ig i o określonej aktywności przeciwwirusowej
zwłaszcza w bezpośrednich badaniach materiałów
diagnostycznych np.
• IgM, IgG– zakażenia różyczką, cytomegalią,
Epsteina-Barr
– Do wykazania obecności Ag wirusowego np..
• W wymazach z jamy nosowo-gardłowej w
przypadkach zakażenia wirusami
– Grypy
– Paragrypy
• Z osadu komórek moczu
– Cytomegalia

Wirusy
diagnostyka serologiczna
• Potwierdzenie zakażenia wirusowego ma miejsce
wówczas gdy:
– Wykazywane są swoiste przeciwciała IgM
• Przejściowe ich występowanie u noworodków i
niemowląt wskazuje na zakażenie wrodzone lub
okołoporodowe
• U dorosłych wykazują kontakt pierwotny z Ag lub
reaktywację zakażenia bezobjawowego (letalnego)
– Obserwowana jest serkokonwersja (wzrost 4-krotny lub >
w kolejnym badaniu) dla przeciwciał IgG, IgA
• Wskazuje na przebyte zakażenie, bez możliwości
określenia czasu
• Wartość diagnostyczną mają wielokrotne badania
serologiczne, minumum 2 próbek surowic, w odstępie
2-3 tygodni
– W fazie ostrej choroby
– W okresie rekonwalescencji

Wirusy – diagnostyka
• Metody radioimmunologiczne
– Przydatne dla szerokiego zakresu zakażeń wirusowych
• Wykrywanie wirusów lub ich przeciwciał
– Zalety
• Bardzo czułe
• Swoiste
• Dają odtwarzalne wyniki
– Wady
• Nie są powszechne ze względu na sprzęt i ochronę
środowiska
• Odczyn wiązania dopełniacza
– Wykonywany w licznych zakażeniach wirusowych
– Pozwala na określenie przyrostu przeciwciał
– Wady
• Niska czułość
• Brak różnicowania klas IgG
– Metoda odniesiona do innych metod

Wirusy – diagnostyka
• Metody immunoenzymatyczne
– Do wykrywania obecności antygenów, przeciwciał
wirusowych oraz ustalania miana
– Do wykrywania aktywności w określonych klasach Ig
– Teoretycznie mogą być wykorzystywane we
wszystkich zakażeniach wirusowych
– Zalety
• Szybki wynik
• Bezpieczeństwo wykonania
• Prostota odczynu i interpretacji
• Możliwość pełnej automatyzacji

Wirusy – diagnostyka
• Metoda neutralizacji
– Stosowana do wykrywania przeciwciał i do
identyfikacji izolowanych wirusów
– Rzeczywista ocena uodpornienia
– Polega na zobojętnieniu zakaźności wirusa przez
przeciwciała oraz na wykryciu pozostałości wirusa
zobojętnionego
• Po inkubacji mieszamy wirus-przeciwciało, zakaża
się nową hodowlę i obserwuje brak zmian
cytoplazmatycznych
– Ważny test odniesienia w stosunku do innych metod
– Zalety
• Duża czułoś
• Duża swoistość
– Wady
• Długotrwałość wykonania

Wirusy – diagnostyka
• Metody hemoaglutynacji, zahamoania
henoaglutynacji i hemadsorpcji
– Oparte na zjawisku zlepiania komórek i hamowania tego
procesu służą do identyfikacji wirusów i przeciwciał
– Wiele wirusów ma zdolność aglutynowania krwinek
czerwonych
• Hemaglutynacja
– Jeśli w komórkach zakażonych występuje wirus, to po
uwolnieniu się do pożywki hodowlanej z zawiesiną
erytrocytów powoduje aglutynację
• Odczyn hamowania hemaglutynacji
– Jeśli w badanej surowicy są przeciwciała dla określonej
hemaglutyniny wirusowej, to po dodaniu odpowiednich
krwinek czerwonych nie dochodzi do aglutynowania
przez wirusy

Wirusy – diagnostyka
• Hemadsorpcja
– Po 3-5 dniach od zakażenia hodowli komórkowej
materiałem diagnostycznym dodaje się zawiesinę
krwinek czerwonych; jeśli wirus jest zdolny do
hemadsorpcji, erytrocyty za pośrednictwem jego
hemaglutynin są absorbowane do powierzchni
komórek
• Kiść winogron
• Metoda zahamowania hemadsorpcji
– Jeśli w surowicy są przeciwciała swoiste dla danego
wirusa, to wprowadzone do hodowli komórkowej
blokują receptory dla krwine komórek zakażonych
wirusami
• Po dodaniu krwinek nie dochodzi do hemadsorpcji

Wirusy – diagnostyka
• Metody biologii molekularnej
– Coraz częściej stosowane
• Łątwe w użyciu
• Bardzo czułe bezpieczne
– Analiza elektroforetyczna genomów wirusowych
pozwala na charakterystykę DNA wirusów, posługując
się określonymi restrykcyjnymi endonukleazami
– Hybrydyzacja kwasów nukleinowych
• Do wykrywania swoistych dla danego wirusa
sekwencji w komórkach badanego materiału
• Swoistość testu jest wprost proporcjonalna do
długości nici komplementarnej
– Mapowanie peptydów i ustalenie sekwencji
aminokwasów
– Metody PCR
• Zwiększają czułość hybrydyzacj DNA przez
zwielokrotnienie ilości wirusowego DNA zawartego
w próbce pobranej od pacjenta

Wirusy – wykrywanie
• Mikroskopia elektronowa
– Preparaty bezpośrednie
• Testy immunologiczne – wykrywają białka
wirusowe lub przeciwciała
– ELISA
• Hemoaglutynacja (metoda serologiczna)
• Testy biologiczne
– Wykrywają cytopatologiczne efekty (CPE)
działalności wirusów na komórki
– Hodowla w zwierzętach
• Genetyczne
– PCR
– RFLPs

DZIĘKUJĘ !!!
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
Wyszukiwarka
Podobne podstrony:
Dz U 02 142 1194 obowiązek dostarczania karty charakterystyki niektórych preparatów niezaklasyfi
Krótka charakterystyka niektórych odmian miodu, DIETETYKA, DIETETYKA
Charakterystyka niektórych metod pracy pedagogicznej
Charakterystyka i budowa wirusow, Mikrobiologia
Dz U 02 142 1194 obowiązek dostarczania karty charakterystyki niektórych preparatów niezaklasyfi
CHARAKTERYSTYKA NIEKTÓRYCH RAS
CHARAKTERYSTYKA NIEKTÓRYCH RAS(1)
Charakterystyka wirusow wg Burneta
Fitopatologia, Wirusy ĆW 2, LIŚCIOZWÓJ ZIEMNIAKA- należy do grupy wirusów ciężkich i powoduje duże s
MIKROBIOLOGIA CHARAKTERYSTYKA WIRUSÓW
Charakterystyka grzybów
D19240131 Rozporządzenie Rady Ministrów z dnia 28 grudnia 1923 r w przedmiocie uznania niektórych u
charakterystyka kuchni słowackiej
Najbardziej charakterystyczne odchylenia od stanu prawidłowego w badaniu
Charakterystyka rozwoju motorycznego
więcej podobnych podstron