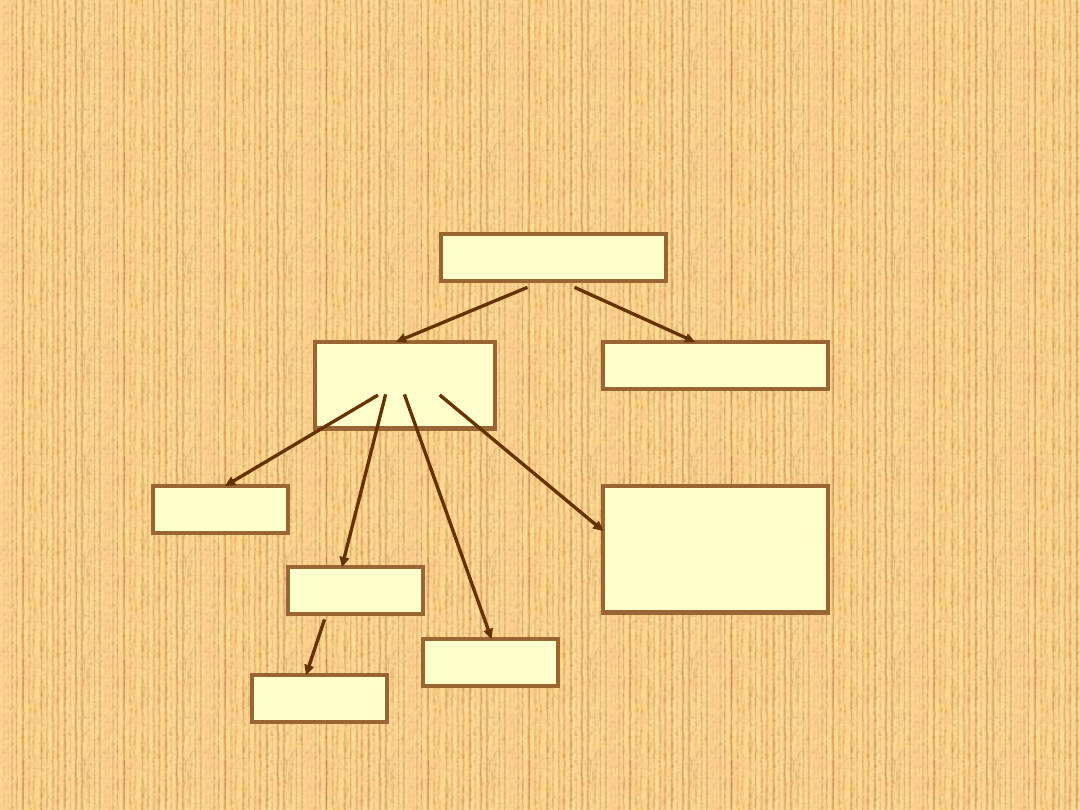
Podział węglowodorów
węglowodory
alifatyczn
e
aromatyczne
alkany
alkeny
alkiny
cykliczne
węglowodory
alifatyczne
dieny
Nazewnictwo węglowodorów wg
IUPAC
System ten zakłada stosowanie w znacznym stopniu takiego samego schematu dla wszystkich
klas związków organicznych. Dlatego omawiany jest dokładnie dla alkanów.
1.
Jako strukturę podstawową związku wybieramy najdłuższy ciągły łańcuch, a następnie
rozpatrujemy związek jako pochodną tej struktury, uzyskaną przez zastąpienie atomów
wodoru grupami alkilowymi.
2.
Gdy jest to konieczne, jak w przypadku izomerycznych metylopentanów, oznacza się
kolejnym numerem atom węgla, do którego przyłączona jest grupa alkilowa.
3.
Atomy
węgla
w
łańcuchu
podstawowym
numeruje się tak, by atom węgla, przy którym
znajduje się podstawnik, oznaczony był możliwie
jak
najniższą
liczbą.
Dlatego
piszemy
2-metylopentan, a nie 4-metylopentan.
4.
Jeżeli takie same łańcuchy alkilowe występują w
cząsteczce kilka razy jako łańcuchy boczne, to
liczbę tych grup określa się przedrostkiem di-,
tri-, tetra-…
5.
Jeżeli do łańcucha podstawowego dołączonych jest kilka grup alkilowych, to
wymienia się je kolejno w porządku alfabetycznym.
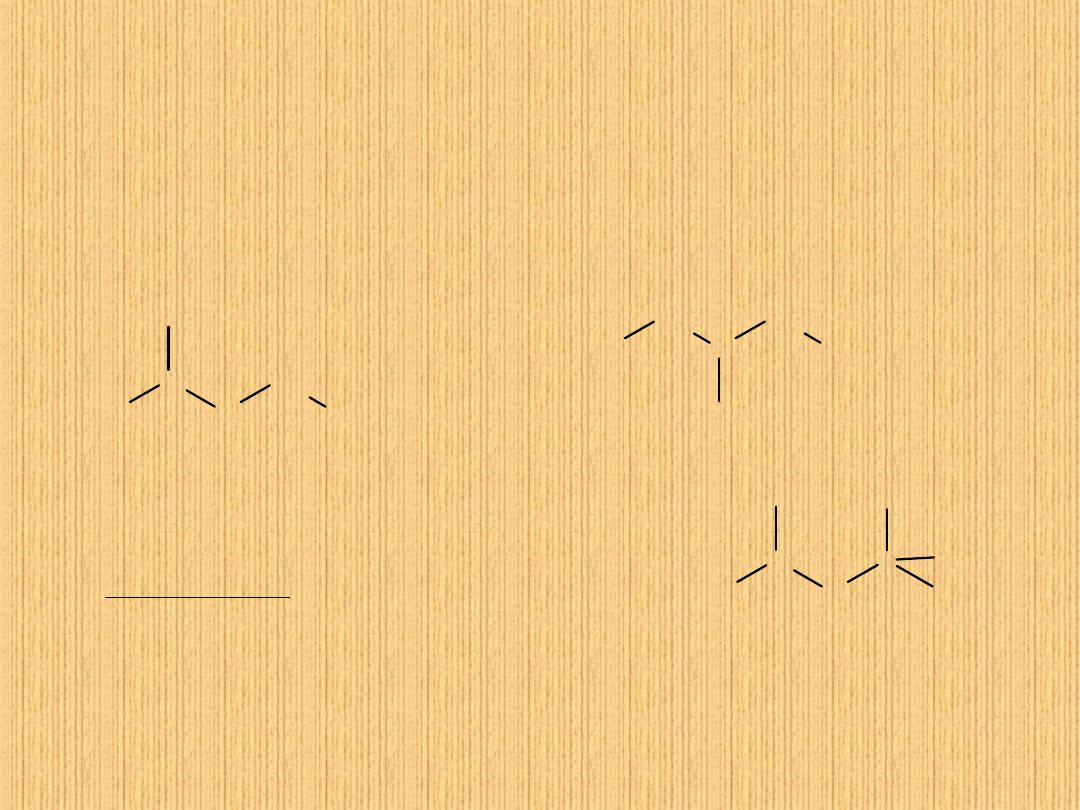
CH
3
CH
CH
2
CH
2
CH
3
CH
3
1
2
3
4
5
2-
metylopent
an
CH
3
CH
2
CH
CH
2
CH
3
CH
3
1
2
3
4
5
3-
metylopent
an
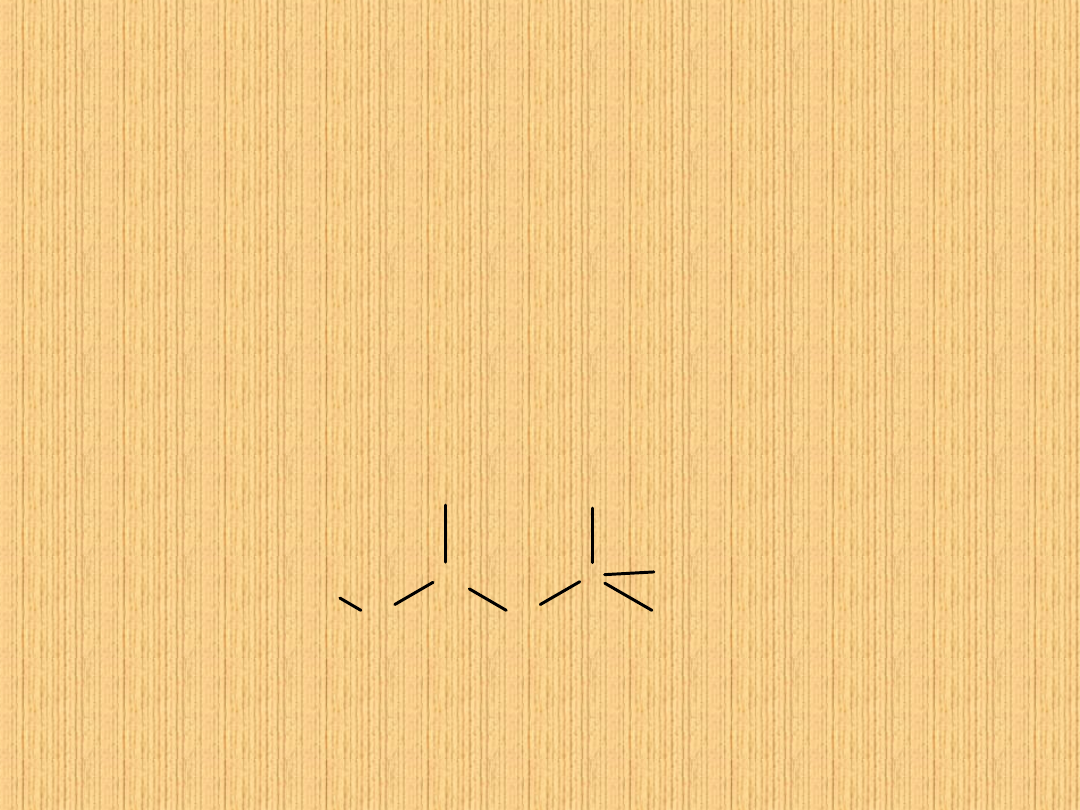
CH
3
CH
3
CH
3
CH
CH
2
C
CH
3
CH
3
1
2
3
4
5
2,2,4-
trimetylopentan
Rzędowość atomów węgla i wodoru
Pierwszorzędowy (1°) atom węgla jest połączony z jednym
atomem węgla
Drugorzędowy (2°) atom węgla jest połączony z dwoma
atomami węgla
Trzeciorzędowy (3°) atom węgla jest połączony z trzema
atomami węgla
Czwartorzędowy (4°) atom węgla jest połączony z czterema
atomami węgla
CH
3
CH
3
CH
3
CH
2
CH
CH
2
C
CH
3
CH
3
1°
1°
1°
1°
1°
2°
2°
3°
4°

Alkany (parafiny)
Otrzymywanie (przemysł)
Metoda Fischera – Tropscha
CO + H
2
→ CH
4
+ H
2
O (kat., ∆T)
Wyższe alkany (C2-C4) spotykamy również w gazie ziemnym.
Alkany ciekłe są głównymi składnikami ropy naftowej, a alkany
stałe-wosku ziemneg towarzyszącego złożom ropy naftowej.
Wzór ogólny C
n
H
2n+2
; końcówka nazwy: -an
Ułożone są w szeregu homologicznym, różniącym się o stały element
–CH
2
–.

Otrzymywanie alkanów
(laboratorium)
1. Uwodornienie alkenów
C
n
H
2n
+ H
2
→ C
n
H
2n+2
2. Reakcja Wurtza
2 R–X + 2 Na → R–R + 2 NaX
R = alkil (CH
3
–, C
2
H
5
–, …)
X = chlorowiec (Cl, Br…)
3. Redukcja halogenków alkilów poprzez związki
metaloorganiczne
(odczynniki Grignarda)
R–X + Mg → R–MgX
R–MgX + H
2
O → R–H + Mg(OH)X
R–X + R’–X + 2 Na → R–R’ + 2 NaX
R’ = alkil (CH
3
-, C
2
H
5
-, …) różny od R
Reakcje alkanów
1. Halogenowanie – najważniejsza reakcja alkanów, ma charakter
rodnikowy.
Promieniowanie ultrafioletowe dostarcza w niej energii niezbędnej
do
rozerwania wiązań.
X = chlorowiec. Reaktywność Cl
2
> Br
2
> J
2
.
Łatwość tworzenia rodników 3°>2°>1°
Cl
2
h
2 Cl•
inicjacja
propagacja
Cl• + CH
4
CH
3
Cl + H•
H• + Cl
2
HCl + Cl•
CH
4
+ Cl
2
CH
3
Cl + HCl
2. Utlenianie
Np. metanu:
CH
4
+ O
2
→ CO
2
+ 2H
2
O

Alkeny(olefiny)
Węglowodory zawierające podwójne lub potrójne wiązanie w cząsteczce są to
węglowodory nienasycone. Węglowodory z wiązaniem podwójnym nazywamy
alkenami.
Wzór ogólny alkenów C
n
H
2n
(identyczny wzór mają również cykloalkany).
Słownictwo:
Podstawowy łańcuch węglowy zawiera zawsze wiązanie podwójne oznaczone
przyrostkiem –en
Lokant określający położenie podwójnego wiązania winien być najniższy.
CH
3
–CH–CH
2
–CH=CH–CH
3
(2-heksen , heks-2-en)
Wiązanie podwójne ma pierwszeństwo przed potrójnym. Gdy jest kilka wiązań
podwójnych
stosujemy
końcówkę -dien, -trien.
CH
2
=CH–C≡C–CH=CH
2
heksa-1,5-dien-3-yn (1,5-heksadien-3-yn)
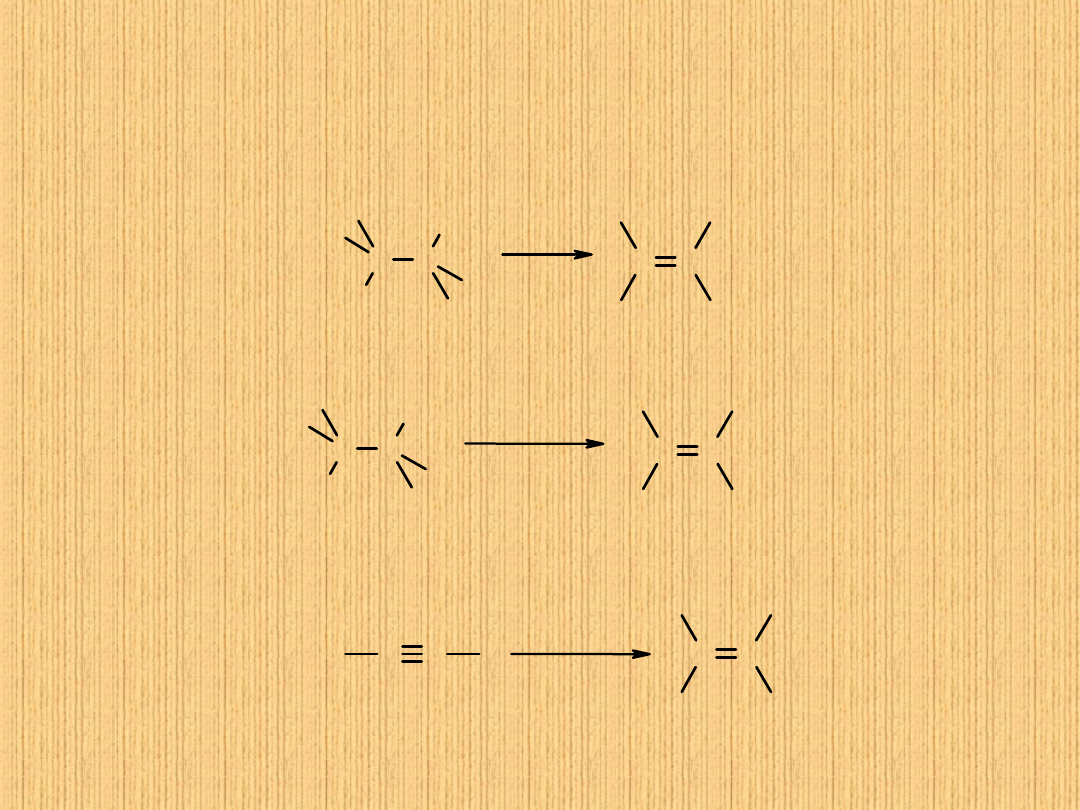
Otrzymywanie alkenów
1. Eliminacja halogenków alkanów (E 2) (X-
chlorowiec):
C C
C C
X
H
KOH
etanol
HX
+
C C
C C
H
OH
H
2
O
+
T
katalizator
C C
C C
Pd lub Ni
H
2
2. Odwodnienie alkoholi:
3. Redukcja alkinów:

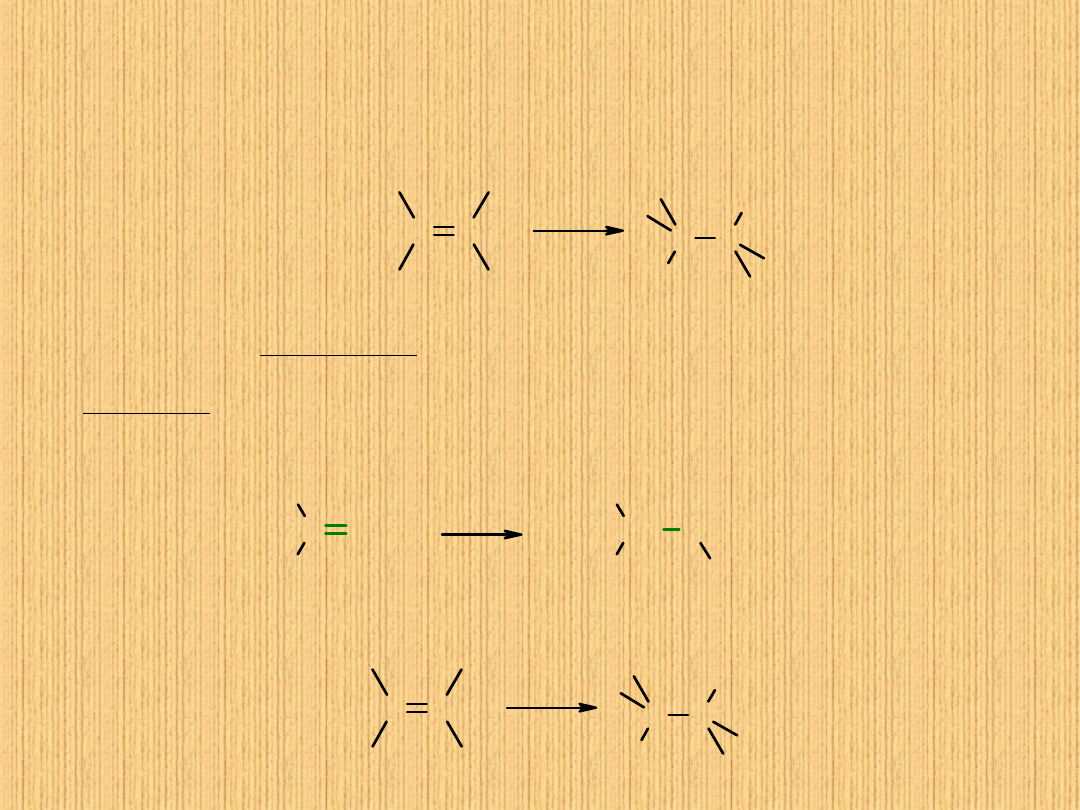
Reakcje alkenów
Najbardziej charakterystyczna dla alkenów jest reakcja
addycji
elektrofilowej.
Przebiega ona wg schematu:
C C
C
+
C
H
C C
X
H
H
+
X
W pierwszym etapie reakcji następuje przyłączenie do alkenu czynnika
elektrofilowego (protonu). Chmura elektronowa z wiązania podwójnego jest łatwo
dostępna. W wyniku tego wytworzone zostaje wiązanie CH.
Atom węgla, w którym występuje niedobór elektronów uzyskuje ładunek
dodatni – powstaje tzw. karbokation.
Jest to cząsteczka reaktywna, mało stabilna, w następnym etapie reakcji łatwo
przyłączalna. Łatwiej tworzą się karbokationy o wyższej rzędowości. Znalazło to
potwierdzenie w empirycznej regule Markownikowa.
W reakcjach jonowej addycji do podwójnych wiązań węgiel-węgiel alkenów, atom
wodoru przyłącza się do tego atomu węgla, z którym związana jest większa
liczba atomów wodoru.

Reakcje alkenów
Reguła Markownikowa
W reakcjach jonowej addycji do podwójnych wiązań węgiel-węgiel alkenów, atom
wodoru przyłącza się do tego atomu węgla, z którym związana jest większa
liczba atomów wodoru.
CH CH
2
C
H
3
HCl
CH CH
3
C
H
3
Cl
C CH
2
C
H
3
C
H
3
HBr
C CH
3
CH
3
Br
C
H
3
C CH
C
H
3
C
H
3
CH
3
HCl
CH
3
C CH
2
Cl
C
H
3
CH
3
Reakcje alkenów
Występują też odstępstwa od reguły Markownikowa.
Przy addycji związków HX, gdy reakcja katalizowana jest przez
nadtlenki (reakcja Kharascha), przyłączenie ma charakter
rodnikowy, a nie jonowy.
Dominuje przyłączenie przy pierwszym węglu alkenu.
C CH
2
C
H
3
C
H
3
HBr
RO•
C
H
3
CH CH
2
C
H
3
Br
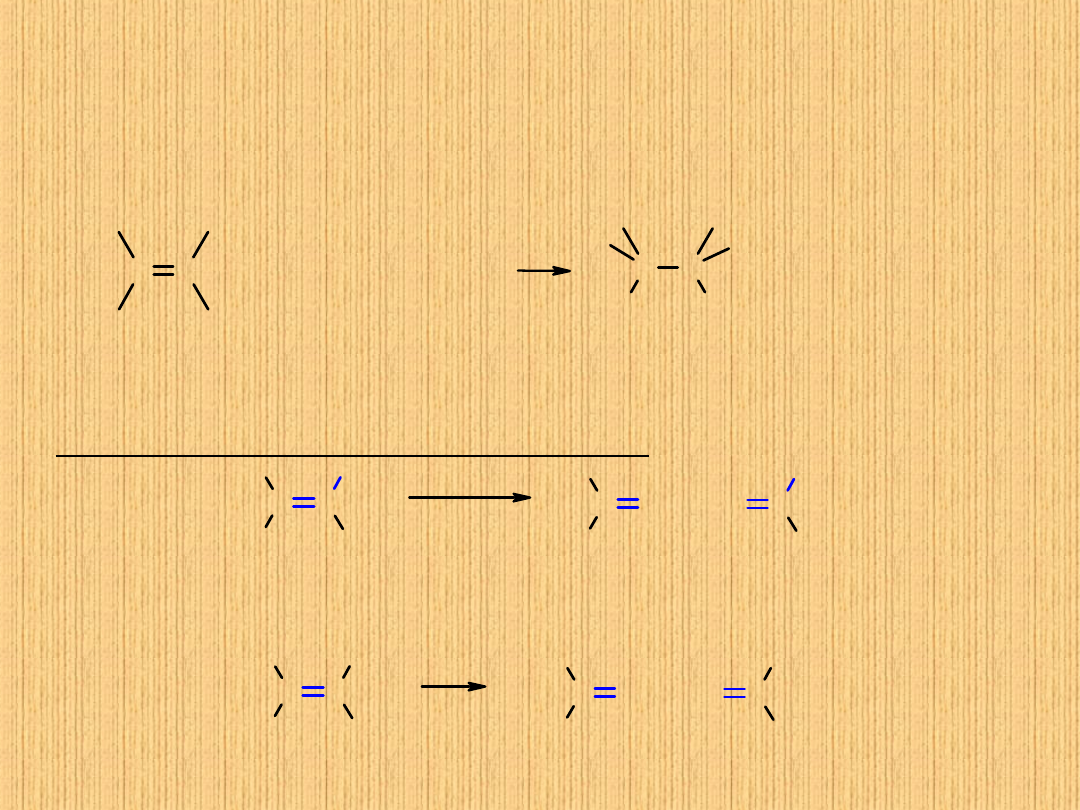
Przyłączenie wody:
Przyłączenie halogenu
(chlorowca):
C C
C C
X
X
X
2
C C
C C
H
OH
H
2
O
H
+
Reakcje utlenienia i redukcji
W wyniku reakcji uwodornienia powstają
alkany.
Reakcja utlenienia alkenów prowadzi do różnych produktów w zależności
od zastosowanych odczynników.
Do reakcji utlenienia zaliczamy również proces ozonolizy.
C C
C C
O
H
OH
KMnO
4
H
2
O
KOH
MnO
2
+
+
+
+
3
2
3
2
2
4
Reakcja ta służy w analizie organicznej do wykrywania związków z
wielokrotnymi wiązaniami (tzw. test Bayera – odbarwienie roztworu KMnO
4
pod
wpływem
alkenów).
Dalsze utlenianie prowadzi do rozpadu cząsteczki:
C C
C
H
3
C
H
3
CH
3
H
KMnO
4
C O
C
H
3
C
H
3
O C
CH
3
OH
+
C C
C
H
3
C
H
3
CH
3
H
O
3
C O
C
H
3
C
H
3
O C
CH
3
H
+

Izomeria
Podstawowe rodzaje izomerii to:
1. Izomeria strukturalna
• Izomeria łańcuchowa, polegająca na różnym ukształtowaniu szkieletów
węglowych w cząsteczce
• Izomeria położenia podwójnego wiązania
2. Stereoizomeria (izomeria przestrzenna), tzw. izomeria cis-trans
Izomerią nazywamy zjawisko występowania związków, które
mimo identycznego składu pierwiastkowego i identycznej masy
cząsteczkowej różnią się właściwościami fizycznymi,
chemicznymi i biologicznymi.
C C
H
C
H
3
H
CH
3
C C
H
C
H
3
CH
3
H
cis (Z)
trans (E)
Ma to miejsce w przypadku, gdy każdy z atomów węgla tworzących
podwójne wiązanie połączony jest z dwoma różniącymi się od siebie
podstawnikami.
Wówczas dla każdej pary podstawników (związanych z tym samym
atomem węgla) wybieramy podstawnik preferowany, zgodnie z
regułami Cohna, Ingolda, Preloga.
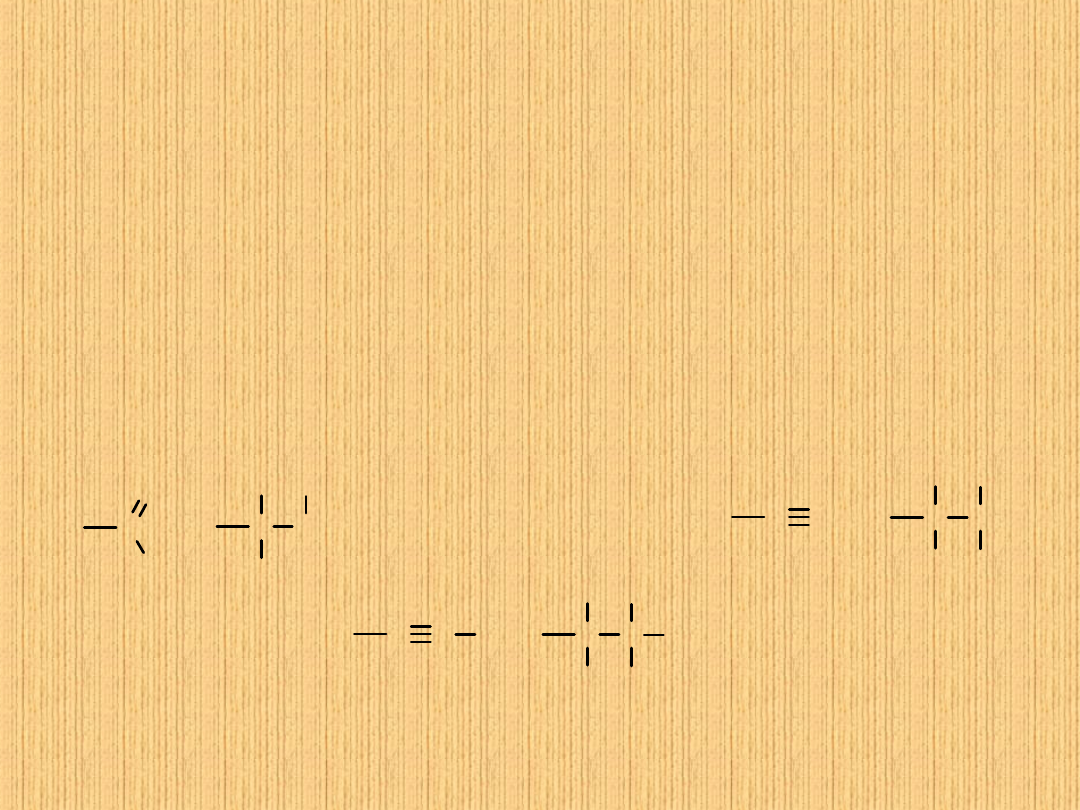
Stereoizomeria
Reguły Cohna, Ingolda,
Preloga
Jeśli atomy podstawników połączone z węglami wiązania podwójnego
różnią się masą atomową, pierwszeństwo ma ten o większej masie:
I > Br > Cl > S > O > N > C > H
COOH > CH=O > CH
2
OH > C
N > CH
2
NH
2
> C
CH > CH=CH
2
>
CH
2
CH
3
C
O
H
C O
O
H
C
C C H
C C H
C
C
C
C
C N
C N
N
N
C
C
Jeśli atomy podstawników połączone z węglami wiązania podwójnego są
identyczne, rozpatruje się kolejno dalsze sąsiedztwo:
CH
2
Br > CHCl
2
> CH
2
OH > CH
2
NH
2
> C(CH
3
)
3
> CH(CH
3
)
2
> CH
2
CH
3
>
CH
3
Wiązanie podwójne traktujemy w świetle reguł pierwszeństwa jako dwa
wiązania pojedyncze C–C:
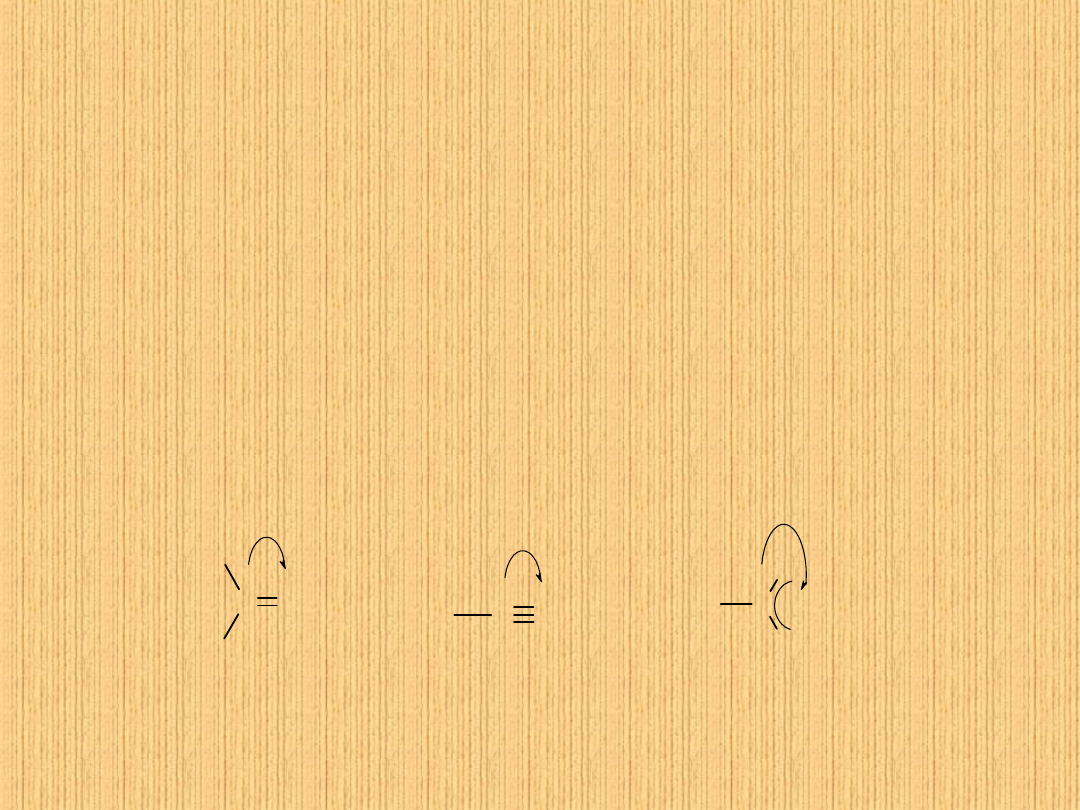
Typy odczynników chemicznych
odczynnik elektrofilowy - odczynnik, który w reakcji chemicznej pobiera
elektrony z zewnątrz lub tworzy wiązanie kowalencyjne z atomem kosztem
pary elektronów tego atomu. Odczynnik elektrofilowy może być:
a) anionem, który w reakcji chemicznej pobiera jeden lub dwa elektrony z
zewnątrz
S
2
O
8
2–
+ 2e
–
2SO
4
2–
[Fe(CN)
6
]
3–
+ e
–
[Fe(CN)
6
]
4–
C O
–
+
C N
–
+
O
N
O
–
+
b) elektrycznie obojętną cząsteczką, posiadającą na jakimś atomie lukę
elektronową (typowy kwas Lewisa) np.:AlCl
3
, FeBr
3
, BF
3
c) elektrycznie obojętną, spolaryzowaną cząsteczką, przy czym
centrum elektrofilowe tej cząsteczki stanowi dodatnio naładowany koniec
dipola. Są to związki zawierające w cząsteczce spolaryzowanej wiązanie
wielokrotne.
d) kationem może być proton H
+
lub kation metalu np.: Ag
+
, Li
+
ewentualnie jon kilkuatomowy np.: jon nitoniowy NO
2
+
ArH + NO
2
+
Ar–NO
2
+ H
+
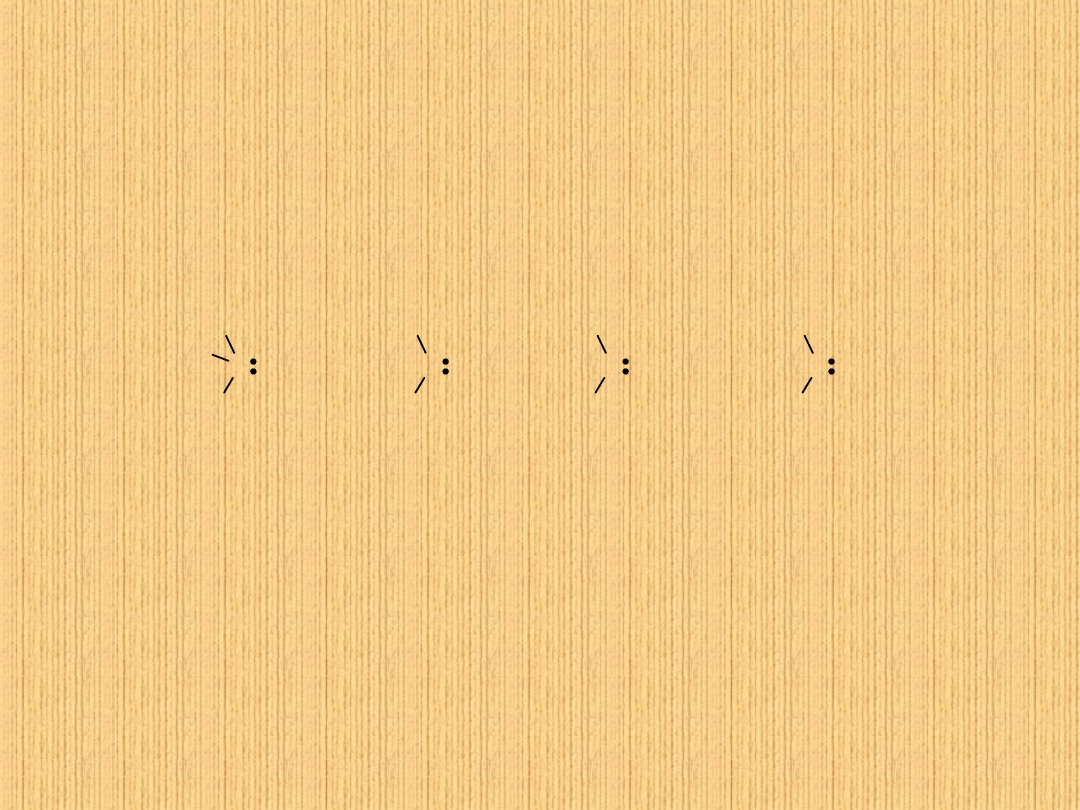
Typy odczynników chemicznych
odczynnik nukleofilowy - odczynnik, który w reakcji chemicznej oddaje
elektrony do centrum atakowanego lub tworzy z tym centrum wiązanie
kowalencyjne kosztem własnych elektronów.
a) cząsteczki, w których atomy piątej lub szóstej grupy układu okresowego
posiadają wolne pary elektronów, takie jak np.: aminy, fosfiny, alkohole,
etery i merkaptany
R
H
N
H
R
H
O
R
R
O
R
H
S
b) jony ujemne, np.: X
–
, OH
–
, RO
–
, S
2–
, karboaniony
c) cząsteczki, w których orbitale cząsteczkowe typu [
] tworzą wiązanie
wielokrotne pomiędzy atomami węgla np.: alkeny, alkiny, węglowodory
aromatyczne.
Polimeryzacja alkenów
Polimeryzacją-nazywamy łączenie się ze sobą wielu (100 i więcej)
cząsteczek monomerów z utworzeniem makrocząsteczki polimeru.
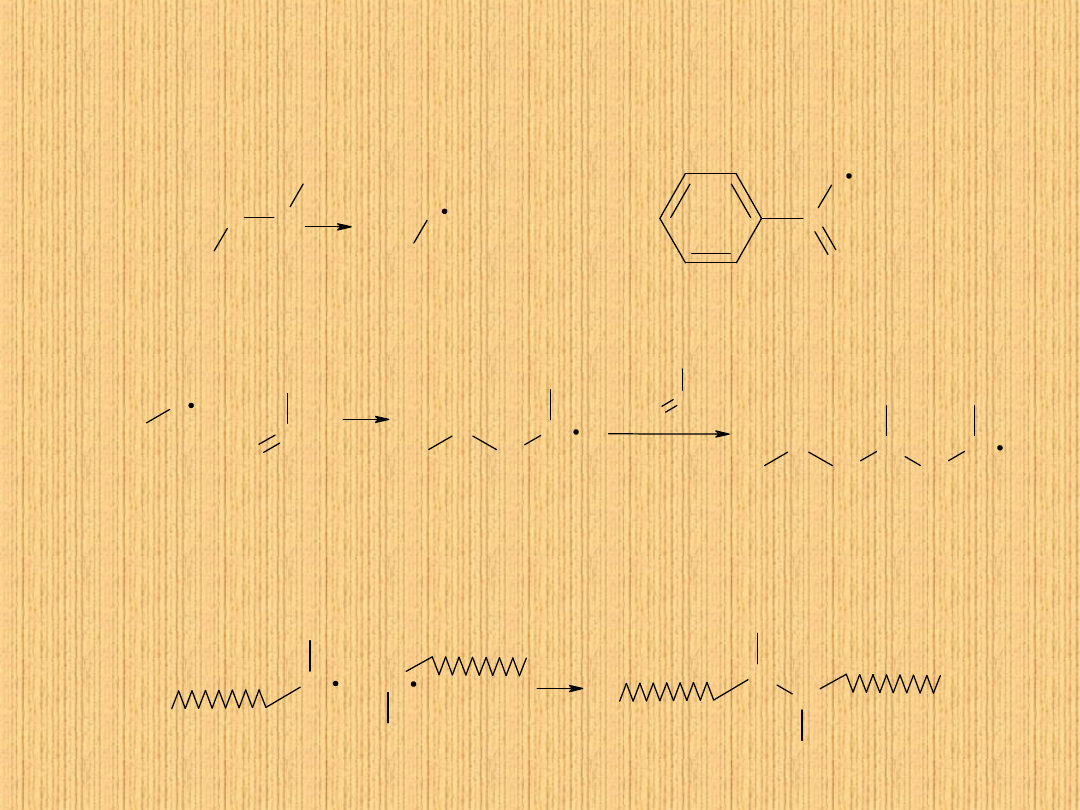
Polimeryzacja
winylowa
jest
najczęściej
procesem
rodnikowym, inicjowanym przez termiczny rozkład
nadtlenków organicznych lub związków azowych
CH CH
2
A
C CH
2
A
B
Procesy polimeryzacji dzielimy na:
-polimeryzację addycyjną- polegająca na łączeniu się bez reszty
n cząsteczek monomeru z utworzeniem polimeru.
-polimeryzację kondensacyjną-w której polimer tworzy się z
wydzieleniem n cząsteczek prostych związków, np..wody
,amoniaku itp.
Polimeryzacja addycyjna zwana winylową ulegają jej monomery
typu winylowego o strukturze.
A = B lub A
B
Mechanizm rodnikowej polimeryzacji
winylowej
Inicjacja
R
O
R
O
CH
2
CH
CH
3
CH
2
CH
CH
3
CH
CH
R
O
CH
2
CH
3
CH
2
CH
3
CH
2
CH
CH
3
+
+
Propagacja (wzrost łańcucha)
Terminacja (zakończenie wzrostu długości łańcucha)
Np.; Połączenie dwóch rosnących rodników (koligacja)
O
O
R
R
O
R
2
CH
CH
3
CH
CH
3
CH
CH
CH
3
CH
3
+
O
C
O
np.
:
Właściwości polimerów mogą zależeć od sposobu
polimeryzacji
Polimeryzacji koordynacyjnej-katalizatory Zieglera-Natty
np.:TiCl
4
+R
3
Al
Polimeryzacja kationowa- katalizatory kwasy Lewisa
Polimeryzacja anionowa-katalizatory anionowe np.;Bu Li
Przykłady polimeryzacji
*
CH
2
CH
2
*
n
CH
2
CH
2
n
polietyle
n
*
CH
CH
2
*
n
CN
CH
2
CH
CN
n
poliakrylonitryl
CH
2
CH
O
C
CH
3
O
O
C
CH
3
O
*
CH
CH
2
*
n
n
poli(octan
winylu)
*
CH
2
*
n
CH
CH
2
CH
n
polistyren
C
CH
2
C
O
CH
3
O
CH
3
C
O
O
CH
3
*
C
CH
2
*
n
CH
3
n
poli(metakrylan
metylu)
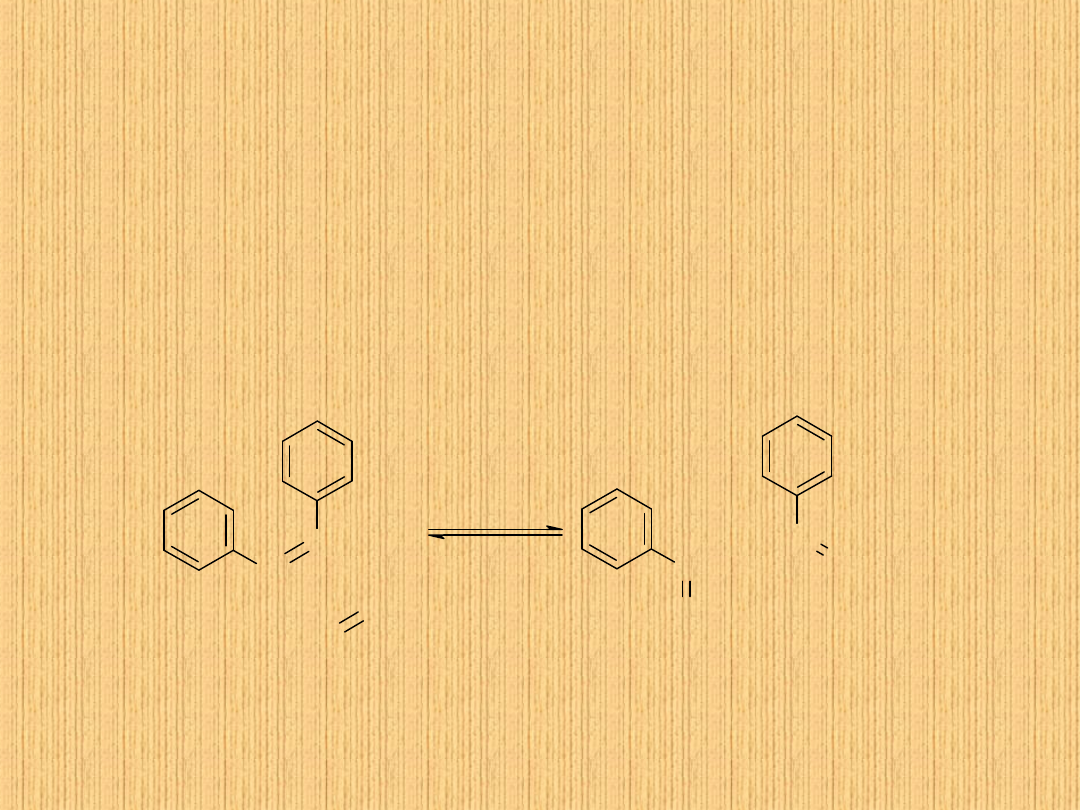
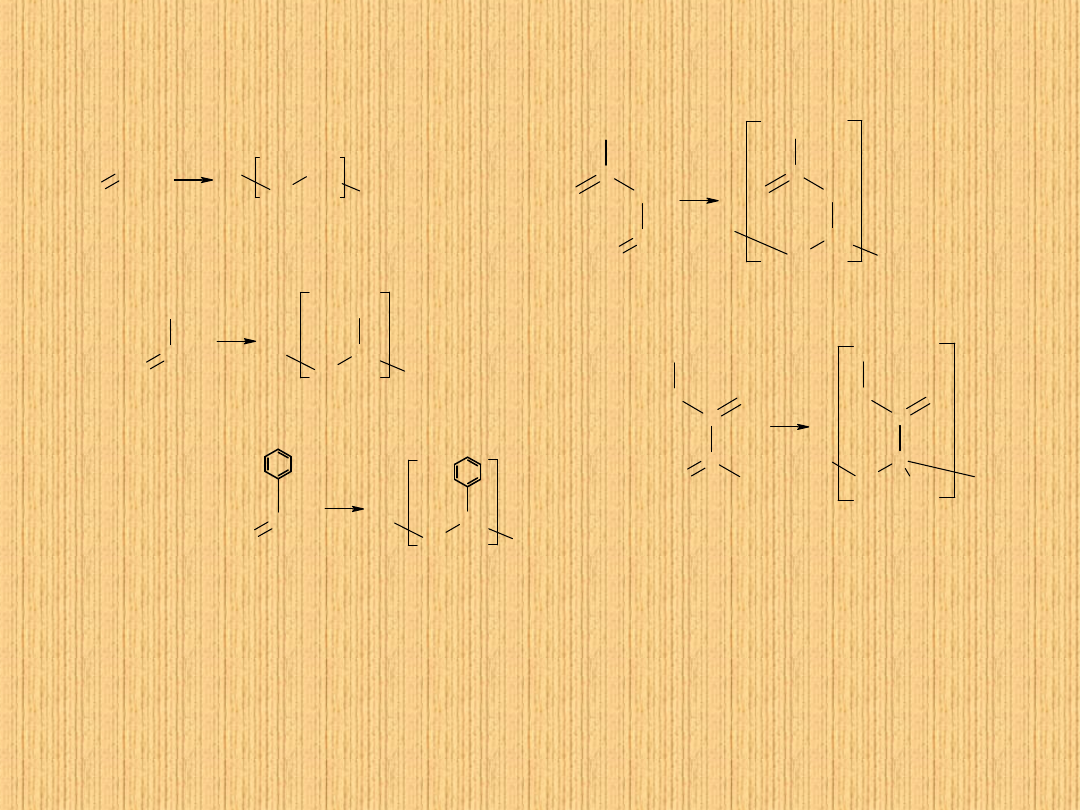
Metateza
Yves Chauvin (Institut Francais du Petrole)
Robert H. Grubbs (California Institute of Technology)
Richard R. Schrock (Massachusetts Institute of Technology)
Nagroda Nobla z chemii w 2005 roku za:
„Taniec odbijany dwóch cząsteczek chemicznych”
CH
CH
CH
2
CH
2
CH
CH
2
CH
CH
2
+
+
katalizator
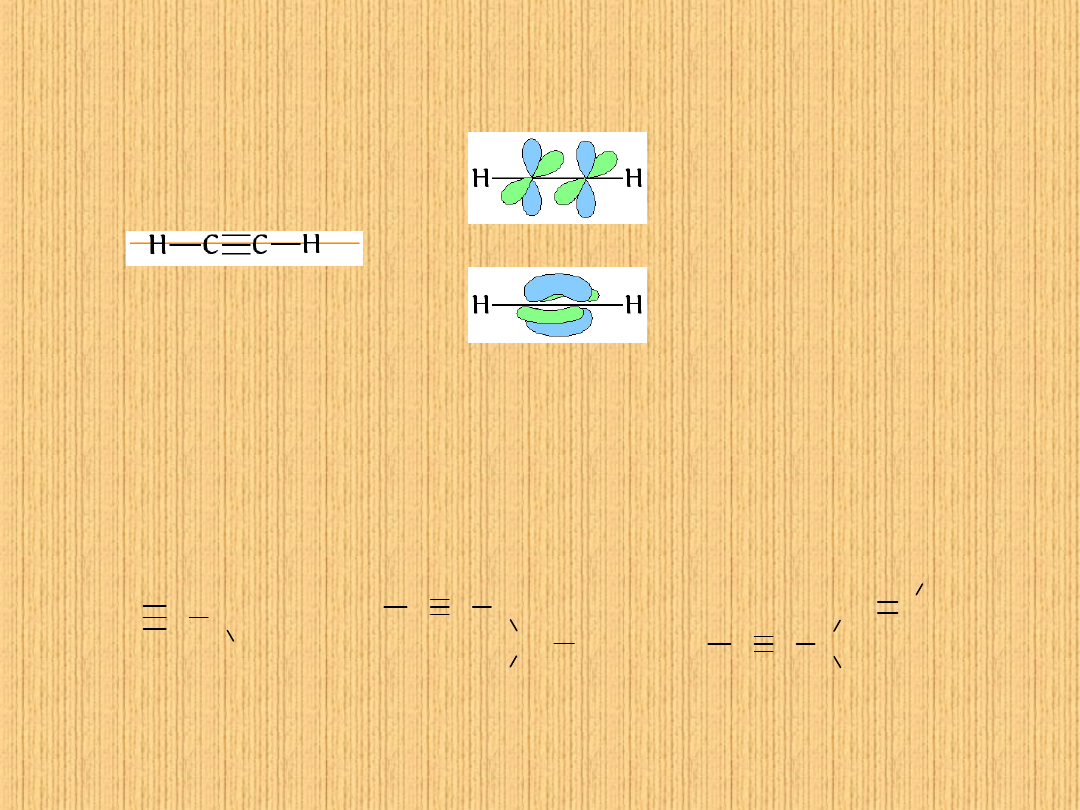
Alkiny
acetyl
en
hybrydyzacja
sp
cząsteczka
liniowa
Słownictwo
-podstawowy łańcuch węglowy zawierający wiązanie potrójne oznaczamy
przyrostkiem –yn
-położenie wiązań określamy najniższym lokantem
-w przypadku gdy istnieje możliwość wyboru,położenie wiązania podwójnego
określa się niższym lokantem
przykłady
CH C CH
2
CH
3
1-butyn
(but-1-yn)
C C CH
2
CH CH
3
CH
3
CH
3
5-metylo-2-
heksyn
(5-metyloheks-2-
yn)
C C CH
CH
3
CH CH
CH
3
CH
3
4-metylo-2-hepten-5-
yn
(4-metylohept-2-en-
5-yn)

Otrzymywanie Alkinów
Otrzymywanie przemyslowe
1)Przez kontrolowane utlenianie CH
4
6CH
4
+ O
2
2 C
2
H
2
+2 CO + 10H
2
(temperatura 1500°C)
2)Przez działanie wody na karbid
CaO + 3C CaC
2
+ CO
CaC
2
+ 2 H
2
O HCCH
+ Ca (OH)
2
Otrzymywanie laboratoryjne
1) Dehydrohalogenacja dihalogenoalkilów
C C
C
H
3
Na
+
CH
2
CH
CH
3
CH
3
Cl
CH
2
CH
CH
3
CH
3
C
C
C
H
3
+
C
H
3
C
C
CH
3
Cl
H
H
Cl
C
H
3
C
C
CH
3
Cl
H
C C
C
H
3
CH
3
KOH
NaNH
2
C
H
3
C
C
CH
3
Br
Br
Br
Br
C C
C
H
3
CH
3
Zn
2) Dehalogenacja tetrahalogenoalkilów
3) Reakcje acetylenków sodowych z pierwszorzędowymi halogenkami alkilów
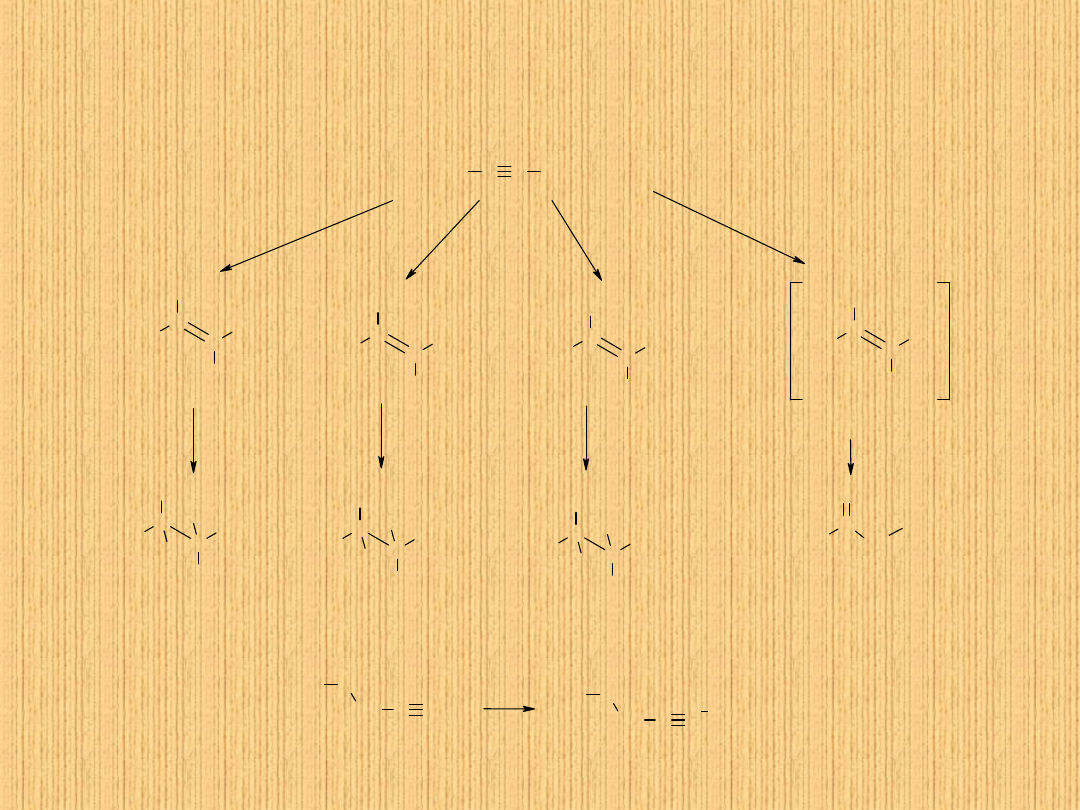
Reakcje alkinów
O właściwościach chemicznych alkinów decyduje
1) potrójne wiązanie
C C
C
H
3
CH
3
C
H
3
C
C
CH
3
H
H
H
H
C
H
3
C
C
CH
3
H
H
H
2
H
2
C
H
3
C
C
CH
3
Br
Br
C
H
3
C
C
CH
3
Br
Br
Br
Br
Br
2
Br
2
C
H
3
C
C
CH
3
Cl
H
C
H
3
C
C
CH
3
Cl
Cl
H
H
HCl
HCl
C
H
3
C
C
CH
3
OH
H
C
H
3
C
CH
2
CH
3
O
H
2
O
forma enolowa
forma ketonowa
2) podwyższona kwasowość atomów wodoru związanych z węglem
C CH
CH
2
CH
2
C
H
3
Ag
+
C C
CH
2
CH
2
C
H
3
Ag
+

Alkadieny
Alkadieny- są węglowodorami nienasyconymi o wzorze ogólnym C
n
H
2n-2
zawierającymi w cząsteczce dwa wiązania C=C.
CH
2
C
CH
CH
2
CH
3
CH
2
CH
CH
CH
CH
3
CH
2
CH
CH
2
CH
CH
2
Słownictwo –reguły identyczne jak dla alkenów,przy czym przyrostek –en
zamieniamy na –dien który poprzedzamy dwoma lokantami
CH
2
CH
CH
CH
2
1,3-
butadien
(but-1,3-
dien)
CH
2
C
CH
CH
2
CH
3
2-metylo-
1,3-
butadien
(izopren)
CH
3
CH
C
CH
2
C
CH
2
CH
3
C
H
3
3-etylo-2-metylo-1,3-
pentadien
Podział
-uklady skumulowane
-układy sprzężone
-uklady izolowane

Otrzymywanie alkadienów
Synteza izoprenu
Synteza butadienu
-w procesie krakingowym
-poprzez dehydratację alkoholu zawierającego w cząsteczce dwie grupy
wodorotlenowe
C
H
2
CH
CH
CH
2
O
H
CH
2
CH
2
CH
2
CH
2
OH
– 2 H
2
O
C
H
CH
C
H
C K
+
O C
CH
3
CH
3
C
CH
3
CH
3
OH
C
C
H
C
CH
3
CH
3
OH
CH
CH
2
C
CH
2
CH
3
CH
CH
2
KOH
H
2
kat.
Al
2
O
3
T

Rezonans w dienach sprzężonych
Struktura butadienu
CH
CH
2
CH
CH
2
+
CH
CH
2
CH
CH
2
CH
CH
2
+
CH
CH
2
(I)
(II)
(III)
Udział struktury(1)w opisie stanu elektronowego hybrydy rezonansowej jest
największy , ale dzięki pewnemu udziałowi również struktur(2) i (3) wiązanie
C2-C3 jest skrócone i ma częściowy charakter wiązania podwójnego.
Analogiczna ,jak w przypadku butadienu delokalizacja wiązań podwójnych
jest przyczyną stabilizacji wszystkich dienów sprzężonych

Addycja elektrofilowa do dienów sprzężonych
Elektrofilowej addycji
do dienów sprzężonych ulegają te same
oddczynniki, które przyłączają się do alkenów:H
2
/kat, X
2
,HX (X=Cl,Br,J )
Addycja prowadzi zawsze do utworzenia mieszanin
1,2-adduktów i
1,4-
adduktów
CH
CH
2
CH
CH
2
CH
CH
2
CH
CH
2
Br
Br
CH
CH
2
CH
CH
2
Br
Br
Br
2
+
CH
CH
2
CH
CH
2
CH
CH
2
CH
CH
3
Cl
CH
CH
2
CH
CH
3
Cl
HCl
+
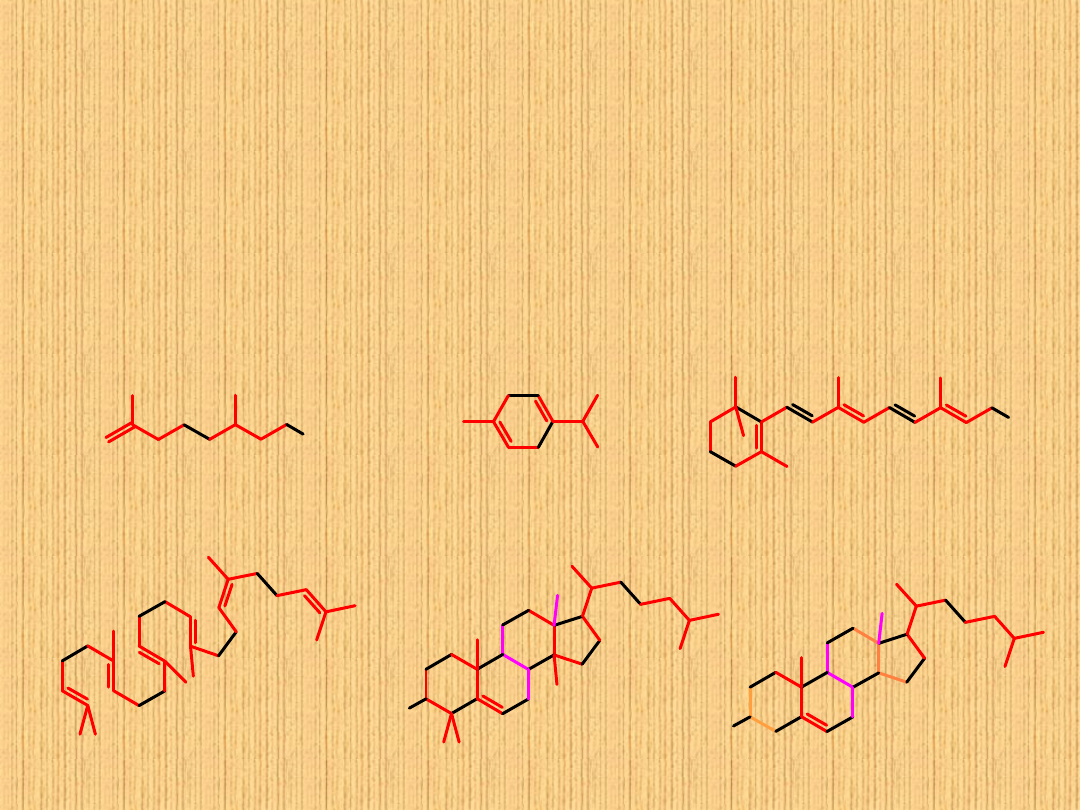
Izopren a reguła izoprenowa
Jednostka izoprenowa jest jedną z ulubionych przez przyrodę „cegiełek
budowlanych” występuje ona nie tylko w kauczuku ,lecz także w wielu
związkach wyodrębnionych z materiałow roślinnych.
Na przykład prawie wszystkie TERPENY (wykryte w olejkach eterycznych
wielu roślin) mają szkielety węglowe zbudowane z jednostek izoprenowych
połączonych w regularny sposób –”głowa do ogona”.
Poznanie tej zależności,zwanej
Regułą izoprenową,
w znacznej mierze
ułatwiło ustalenie struktury terpenów.
OH
cytronelol
(w olejku geraniowym)
-terpinen
(w olejku kolendrowym)
OH
witamina A
skwalen
O
H
lanosterol
O
H
cholesterol
Cykloalkany
Odrębną grupę węglowodorów nasyconych stanowią związki cykliczne,
tzw
.cykloalkany
,o wzorze ogólnym C
n
H
2n
.
Nazwy związków jednopierścieniowych tworzy się z nazw
odpowiednich alkanów przez dodanie przedrostka cyklo-.
CH
2
CH
2
CH
2
CH
CH
3
CH
2
CH
2
Br
Br
Zn
CH
2
CH
CH
2
CH
2
CH
2
CH
2
CH
3
H
H
H
H
H
H
C
C
CH
3
H
H
C
C
H
C
H
H
C
H
CH
3
H
H
H
H
H
C
C
H
H
C
C
H
C
H
H
C
konformacja łódkowa
konformacja krzesełkowa
metylocykloheksan
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
Wyszukiwarka
Podobne podstrony:
Porównanie węglowodorów alifatycznych
WYKLAD5.DOC, Nitrowanie węglowodorów alifatycznych (alkanów)
Węglowodory alifatyczne
Ćwiczenia – węglowodory alifatyczne, Studia, Biotechnologia, Chemia, Chemia organiczna, Wykłady II
Węglowodory alifatyczne, Chemia
Referat Chemia- Węglowodory alifatyczn i inne, chemia, chemia organiczna
Węglowodory alifatyczne (1), Chemia
Węglowodory alifatyczne charakterystyka
14b Węglowodory alifatyczne alkany i cykloalkany
Porównanie węglowodorów alifatycznych
Węglowodory alifatyczne
chemia, Alkeny, Alkeny są to alifatyczne węglowodory, które zawierają jedno wiązanie podwójne C=C
~$1 RODZAJE WEGLOWODORÓW IZOMERIE W ALIFATYCZNE
9 Ch organiczna WĘGLOWODANY
Rozpuszczalniki organiczne pochodne alifatyczne (oprócz metanolu
W08 Patofizjologia zaburzeń gospodarki węglowodanowej
więcej podobnych podstron