
Chemia stosowana II
chemia organiczna

• E.Białecka-Florjańczyk, J.Włostowska,
Podstawy chemii organicznej, SGGW, Warszawa
1999
• E.Białecka-Florjańczyk, J.Włostowska,
Ćwiczenia laboratoryjne z chemii organicznej, Wyd.
SGGW Warszawa 2003
• T.Drapała
Chemia organiczna
• R.T.Morrison, R.N.Boyd
Chemia organiczna, PWN Warszawa 1994
• R.Brewster
Podstawy chemii organicznej PWN Warszwa1967
• D.Krutul
Ćwiczenia z chemii drewna oraz wybranych
zagadnień chemii
organicznej, SGGW Warszawa
2003.
Literatura
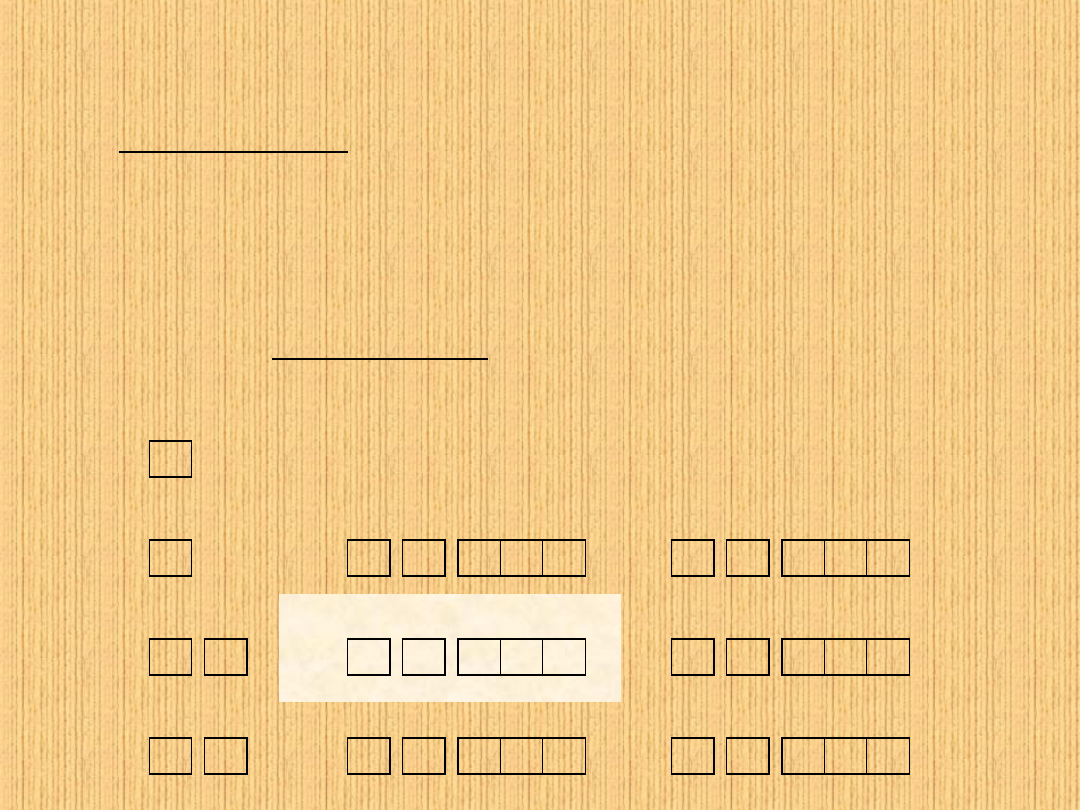
Zakaz Pauliego:
Dwa elektrony nie mogą mieć identycznych wartości
wszystkich czterech liczb kwantowych: n, l, m, m
s
.
Jeden orbital mogą zajmować co najwyżej dwa elektrony, o
przeciwnych spinach - elektrony sparowane.
Reguła Hunda:
Orbitale tego samego poziomu (podpowłoki)
zapełniane są tak aby jak najwięcej elektronów było
niesparowanych.
1s 2s 2p
Ne
1s 2s 2p
F
1s 2s 2p
O
1s 2s 2p
N
1s 2s 2p
C
1s 2s 2p
B
1s 2s
Be
1s 2s
Li
1s
He
1s
H
Budowa sfery elektronowej w atomach
wieloelektronowych

Budowa atomu węgla
Z konfiguracji elektronowej zewnętrznej (walencyjnej) powłoki
atomu węgla w stanie podstawowym wynika, że atom ten
posiada 2 niesparowane elektrony, a więc jest dwuwiązalny
(C
podst
1s
2
2s
2
p
2
)
Doświadczenie wykazuje jednak, że atomy węgla w związkach
organicznych są czterowiązalne. Następuje rozbicie pary
elektronowej 2s
2
na 2 niesparowane elektrony, czyli atom węgla
ze stanu podstawowego przechodzi w stan wzbudzony (C
wzbudzony
1s
2
2s
1
2p
3
).
Niesparowane elektrony ulegają hybrydyzacji typu sp
3
, co
tłumaczy czterowartościowość atomów węgla w związkach
organicznych.
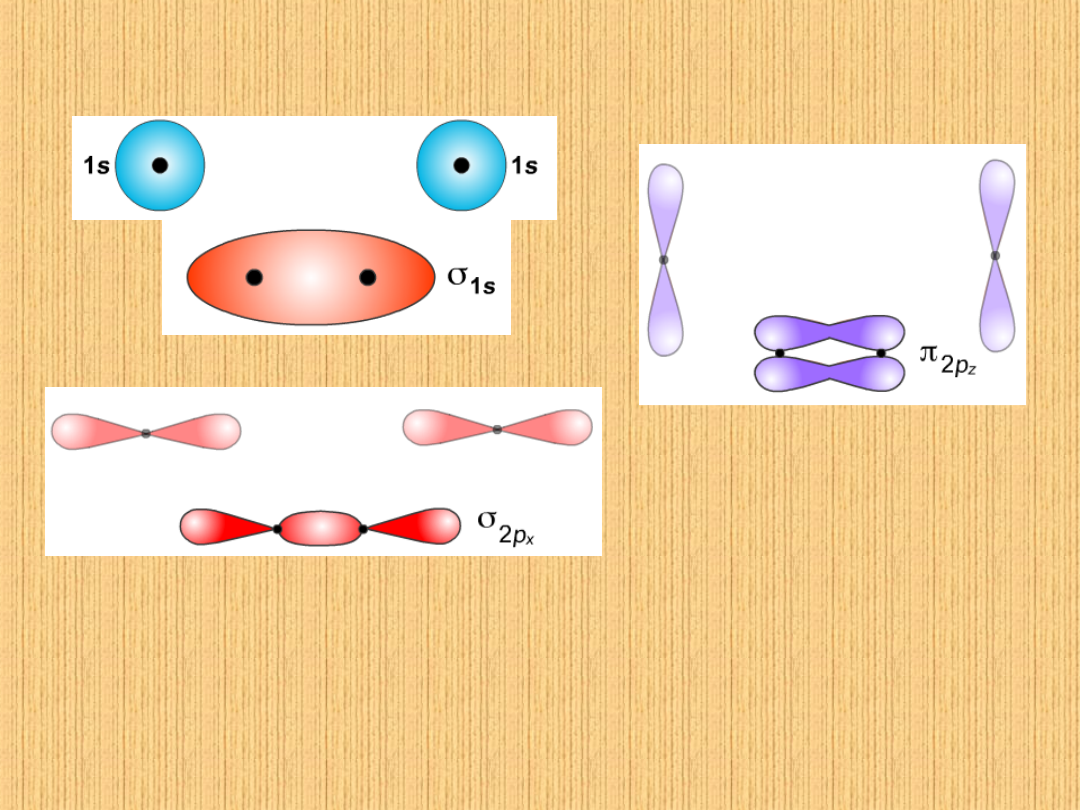
Orbitale molekularne
Gdy osie orbitali wiążących się
atomów leżą na prostej łączącej
jądra tych atomów wówczas
chmury elektronowe nakładają się
tworząc wiązania typu .
Wiązanie powstaje
przez poprzeczne
nałożenie się chmur
elektronowych nie
zhybrydyzowanych
orbitali p .Osie nie leżą
na prostej łączącej
jądra.
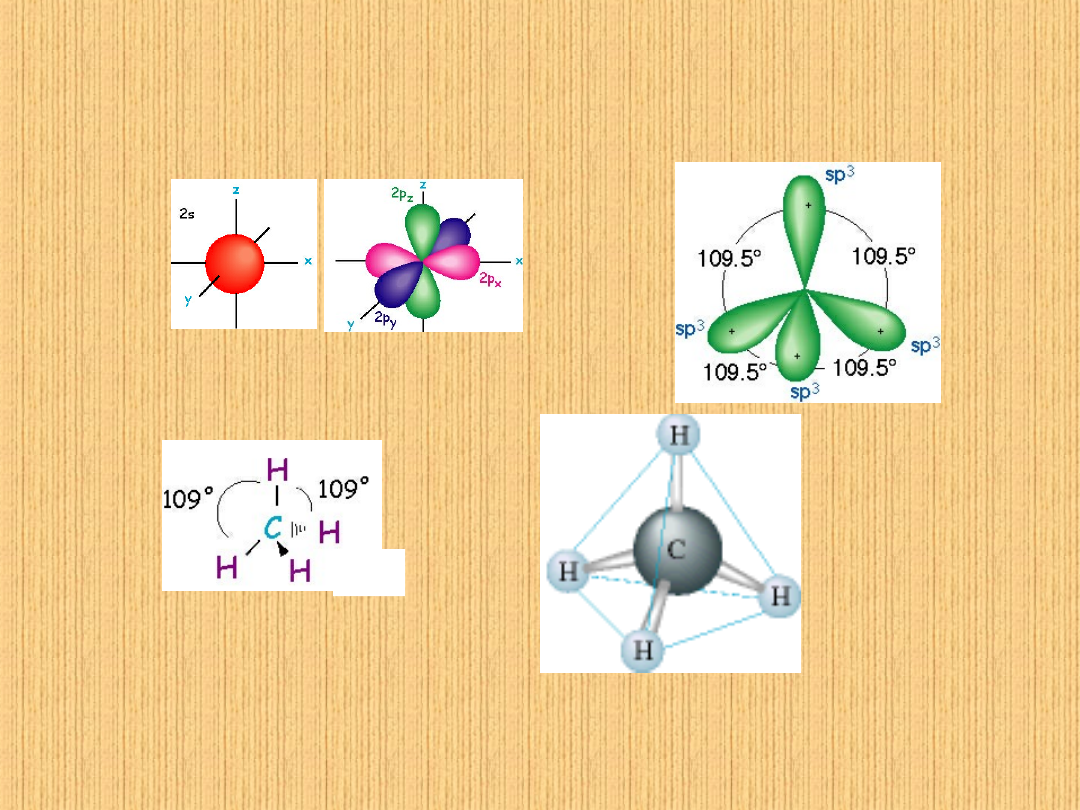
Hybrydyzacje orbitali s i p
sp
3
wszystkie wiązania równej długości
wszystkie kąty równe (109,5°)
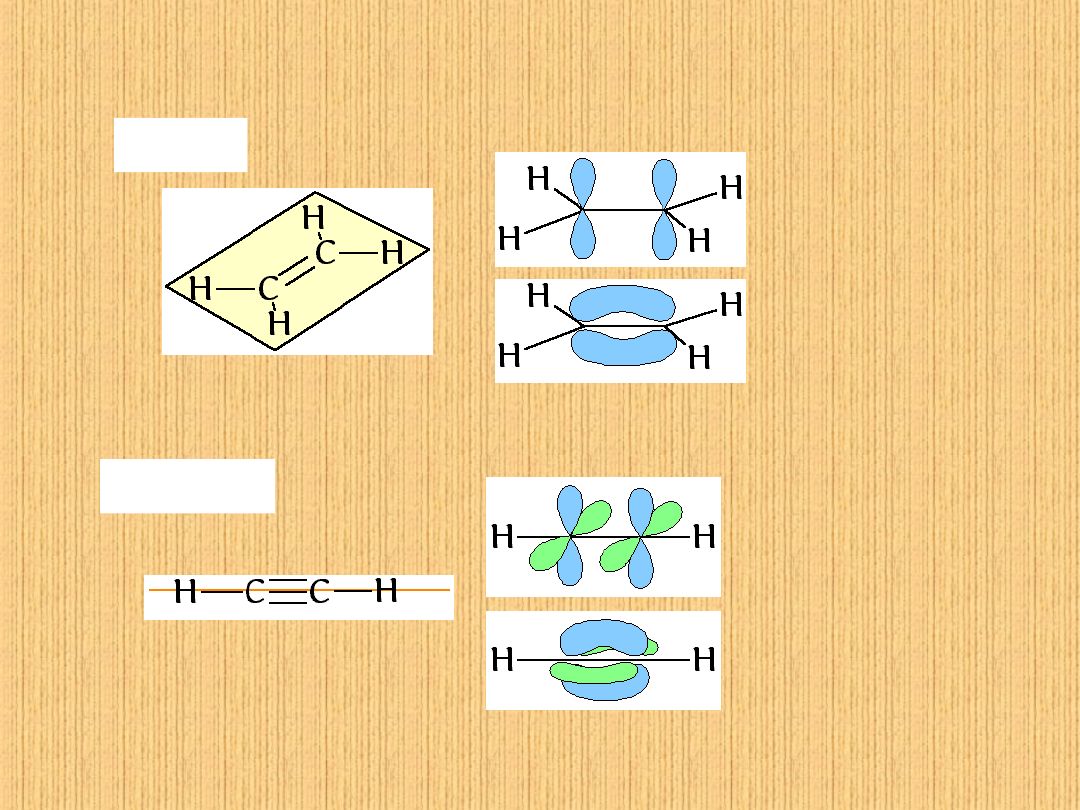
Hybrydyzacja orbitali atomowych
etylen
hybrydyzacja sp
2
cząsteczka płaska
acetylen
hybrydyzacja sp
cząsteczka liniowa
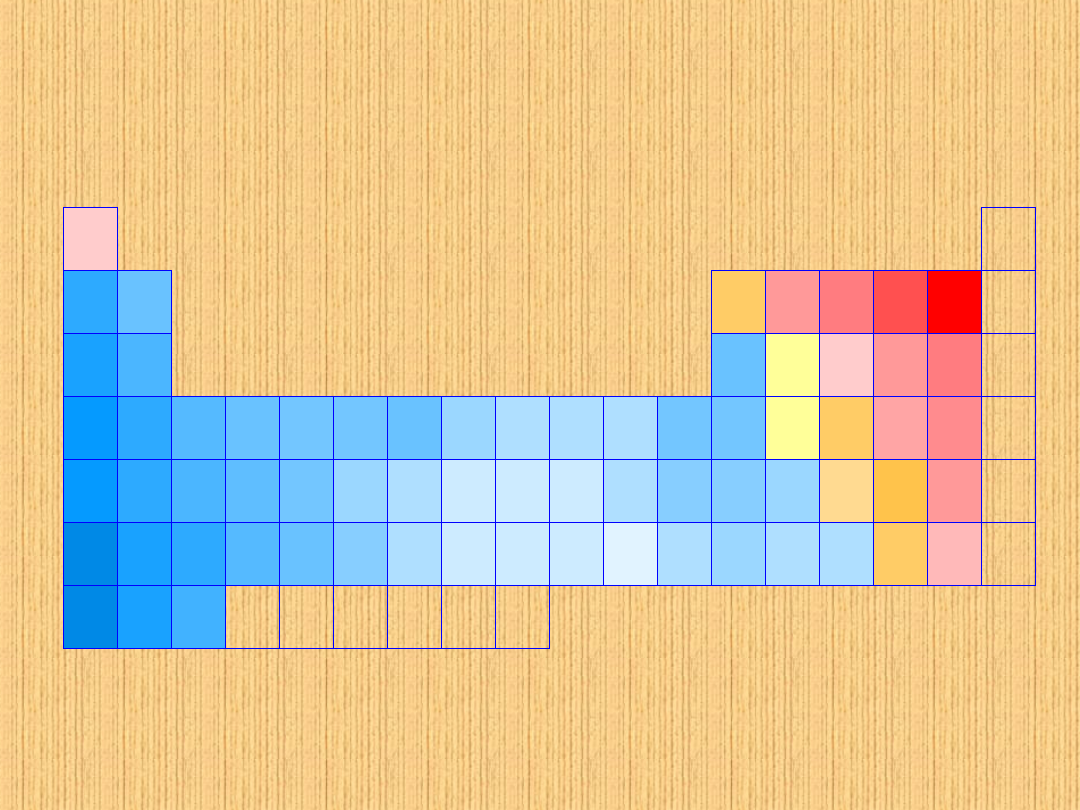
Układ okresowy pierwiastków z podaną
elektroujemnością
H
2,1
Li
1,0
Na
0,9
K
0,8
Rb
0,8
Cs
0,7
Fr
0,7
Be
1,5
Mg
1,2
Ca
1,0
Sr
1,0
Ba
0,9
Ra
0,9
La
1,0
Ac
1,1
Sc
1,3
Y
1,2
Ti
1,5
Zr
1,4
Hf
1,3
Rf
V
1,6
Nb
1,6
Ta
1,5
Db
Cr
1,6
Mo
1,8
W
1,7
Sg
Mn
1,5
Tc
1,9
Re
1,9
Bh
Fe
1,8
Ru
2,2
Os
2,2
Hs
Co
1,9
Rh
2,2
Ir
2,2
Mt
Ni
1,9
Pd
2,2
Pt
2,2
Cu
1,9
Ag
1,9
Au
2,4
Zn
1,6
Cd
1,7
Hg
1,9
B
2,0
Al
1,5
Ga
1,6
In
1,7
Tl
1,8
C
2,5
Si
1,8
Ge
1,8
Sn
1,8
Pb
1,9
N
3,0
P
2,1
As
2,0
Sb
1,9
Bi
1,9
O
3,5
S
2,5
Se
2,4
Te
2,1
Po
2,0
F
4,0
Cl
3,0
Br
2,8
I
2,5
At
2,2
He
Ne
Ar
Kr
Xe
Rn
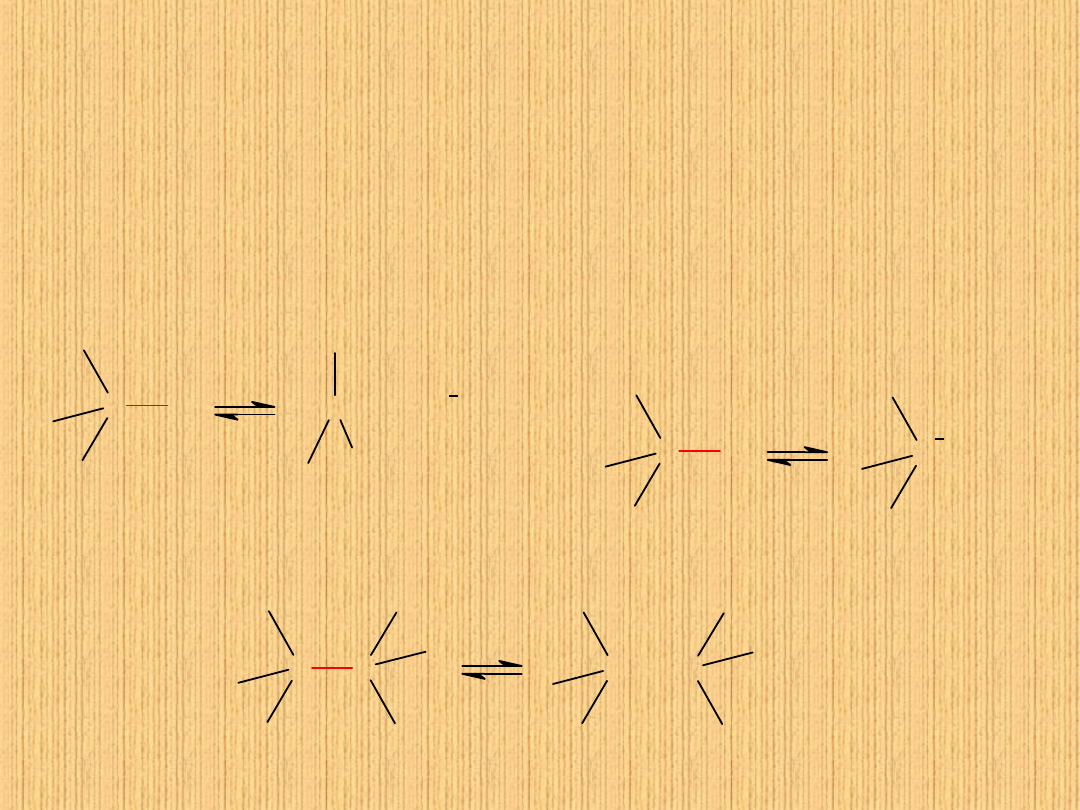
Rodzaje dysocjacji wiązania kowalencyjnego
Rozpad heterolityczny (X- chlorowiec, Y –
metal)
Rozpad
homolityczny
C
X
C
+
X
–
+
+
C
Y
Y
+
C
–
+
+
C
C
C
C
+
Generalnie w związkach organicznych występuje wiązanie
kowalencyjne, względna elektroujemność pozwala przewidywać
kierunek polaryzowalności.
Szereg
elektroujemności
(uproszczony):
Na<Mg<H<C<J<Br<Cl<N<O<P
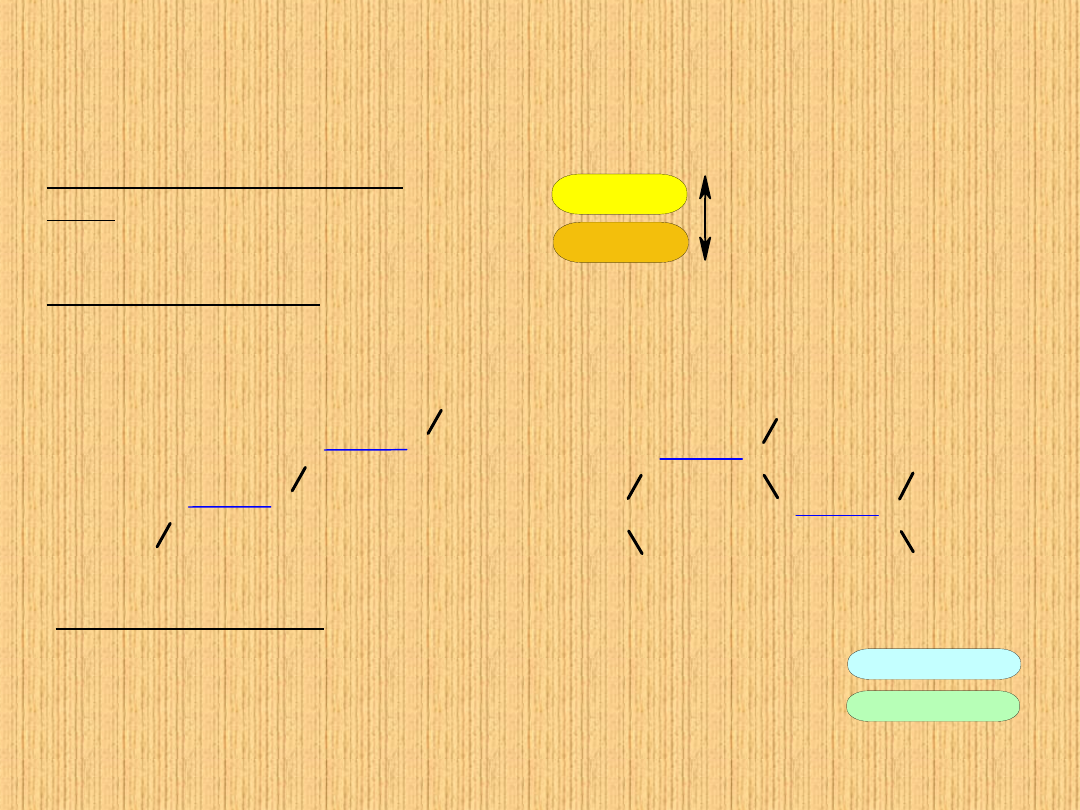
Siły oddziaływań międzycząsteczkowych
dla związków o budowie kowalencyjnej
Oddziaływanie typu dipol-
dipol.
Cząsteczki polarne oddziałują
na siebie znacznie silniej niż
niepolarne
Wiązanie wodorowe.
Forma asocjacji pomiędzy atomem silnie elektroujemnym i atomem
wodoru związanym kowalencyjnie z innym atomem elektroujemnym.
Atomy elektroujemne gł. F, O, N.
Siły van der Waalsa.
Wskutek ruchu elektronów w obszarze jąder
atomowych nawet wówczas, gdy =0 symetria
rozkładu ładunku może być zakłócona przez tworzenie
tzw. chwilowych dipoli. Taki dipol chwilowy może
indukować dipol w przeciwnej orientacji w cząsteczce
sąsiedniej.
H
H
O
H
H
O
H
H
O
H
F
H
F
H
F
+
–
+
–
przyciąganie
elektrostatyczne
+ – +–
+
–
+
– +–
+–
Document Outline
Wyszukiwarka
Podobne podstrony:
Chemia organiczna czesc I poprawiona
chemia organiczna wykład 6
Wykład 9 CHEMIA ORGANICZNA
Chemia Organiczna 4
Chemia organiczna IV
CHEMIA- CHEMIA ORGANICZNA, CHEMIA
bromoacetanilid, Studia, Sprawozdania, Chemia organiczna
Przykladowy egzamin chemia organiczna - ICiP - 2010-zima. , Egzamin
I POPRAWKA EGZAMINU Z CHEMII ORGANICZNEJ, Technologia chemiczna, Chemia organiczna, 4 semestr, organ
więcej podobnych podstron