
Pestycydy
Należą do związków o dużej aktywności
chemicznej oraz dużej sile działania
toksycznego mając a uwadze człowieka,
zwierzęta i rośliny.
Nazwa pochodzi od słów:
pestis -
szkodnik i
cideo -
niszczyć
Pestycydy obejmują dużą grupę
substancji zarówno pochodzenia
roślinnego jak i otrzymanych na drodze
syntez chemicznych.

Według Amerykańskiej Agencji ds. Ochrony
Środowiska (EPA) pod nazwą
pestycyd
rozumie się
substancję lub mieszaninę substancji wykazującą
zdolność niszczenia, odstraszania lub hamowania
rozwoju szkodników, który jako czynnik fizyczny,
chemiczny lub biologiczny niszczy niepożądane
formy roślinne , zwierzęce oraz mikroorganizmy.
Do grupy tych związków, zgodnie z naszym
ustawodawstwem zalicza się także środki
stosowane w akcjach sanitarnych, w higienie
osobistej człowieka oraz w leczeniu wybranych
chorób.
W praktyce agrotechnicznej napary z tytoniu już
ok. 200 lat temu były wykorzystane do zwalczania
mszyc.

Jako pierwszy pestycyd
syntetyczny (
dinitroortokrezolan
potasu
) został wprowadzony w 1892
roku.
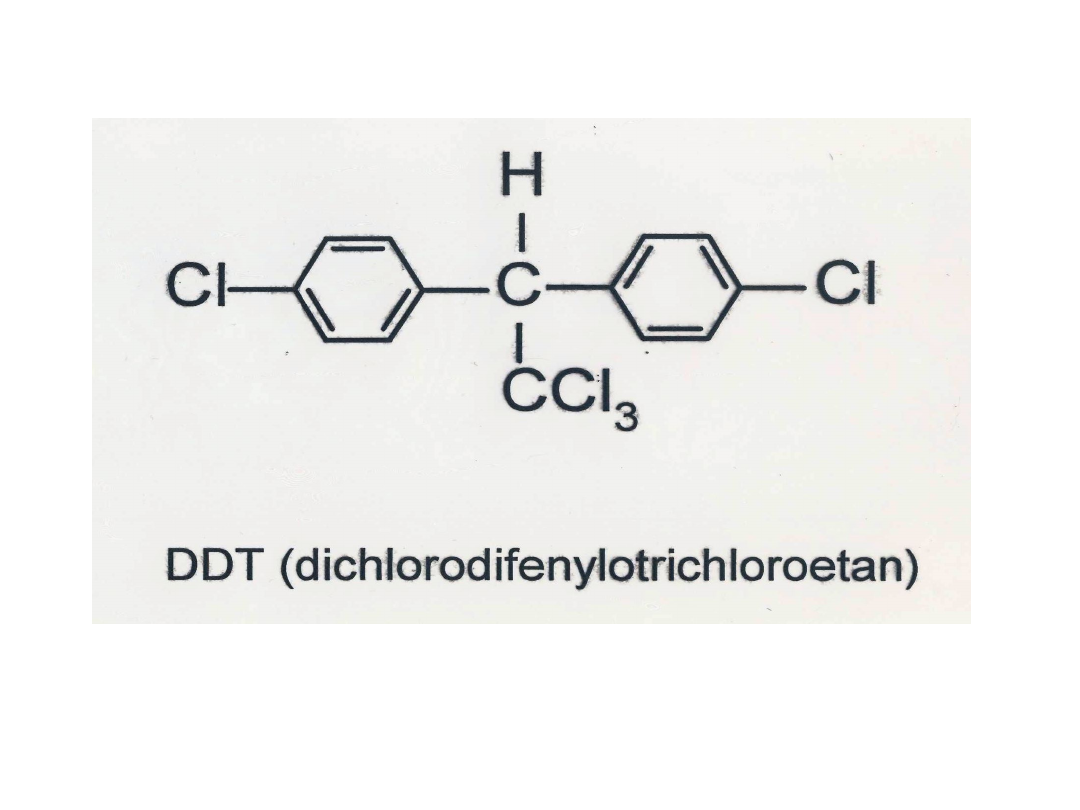
Wykrycie właściwości
szkodnikobójczych
DDT
(dichlorodifenylotrichloroetan) i
2,4
– D
(kwas dichlorofenoksyoctowy) w
czasie II Wojny Światowej
zapoczątkowało rozwój i stosowanie
tej grupy związków.

Najważniejsze przyczyny stosowania
pestycydów:
- wzrost zagrożenia plonów przez szkodniki,
- przeludnienie i niedożywienie ludności w
świecie,
- wzrost zapotrzebowania na żywność,
- plaga chorób przenoszonych przez szkodniki,
- szkody wywoływane przez gryzonie i ślimaki.

Korzyści stosowania pestycydów
Ochrona zdrowia:
- likwidacja i ograniczenie chorób zakaźnych
(zimnica, dżuma, żółta febra),
- wzrost higieny życia i zmniejszenie zapadalnośći
na choroby.
Gospodarka rolna i leśna:
- wzrost plonów podstawowych zbóż,
- zmniejszenie pomorów zwierząt w hodowli,
- zwiększenie ilości i jakości w produkcji mleka,
mięsa i skóry.
Gospodarka materiałowa:
- zmniejszenie strat żywności w magazynach,
- zwiększenie trwałości drewna, papierów i
tekstylii,
- przedłużenie eksploatacji dróg, torów, lotnisk
(odchwaszczanie).

Pestycydy wykorzystuje się do:
- zwalczania lub wabienia organizmów
zwierzęcych, niszczących rośliny lub części roślin,
- zwalczania patogenów wywołujących choroby
roślin,
- zwalczania chwastów,
- niszczenie listowia lub zwalczania roślin
niepożądanych, a nie będących chwastami,
- regulowania i stymulowania wzrostu roślin lub
części roślin z wyłączeniem nawozów,
- zwalczania organizmów zwierzęcych niszczących
produkty roślinne,
- zwalczania czynników powodujących psucie się
(gnicie) produktów roślinnych,

- zwalczania i wabienia organizmów
zwierzęcych lub mikroorganizmów w
domach i innych budynkach, pojazdach,
statkach, samolotach, itp.,
- zwalczania i wabienia organizmów
będących czynnikami chorobotwórczymi dla
człowieka lub zwierząt,
- zabiegów sanitarnych.

Pomimo tak wielkich korzyści, nie należy zapominać
o ich szkodliwym działaniu na człowieka, zwierzęta
oraz rośliny ze względu na ich działanie chemiczne i
toksyczność.
Z jednej strony zrewolucjonizowanie gospodarki
rolnej (wzrost produkcji roślinnej i zwierzęcej) oraz
ochrona zdrowia.
Z drugiej, powstanie nowych nieznanych
problemów zdrowotnych, a szczególnie działania
odległego.
Przykładem może być
DDT
lub
dieldryna
(insektycydy polichlorowane), które ulegają
kumulacji w glebie, organizmie człowieka i tkankach
zwierząt pożytecznych.
Ciągłe i systematyczne wprowadzanie ich do
środowiska i długotrwałe ich działanie wytworzyło
w wyniku selekcji oporność licznych szczepów i
gatunków szkodników (np. stonka ziemniaczana).

Wyniszczeniu uległo wiele gatunków
zwierząt i ptactwa, a długotrwałe stosowanie
prowadzi do przenikania ich do żywności.
Pestycydy obecnie zaliczane są do środków
chemicznych o wysokim stopniu ryzyka
zagrożenia toksykologicznego (zdrowotnego).
Dlatego w każdym przypadku ich
użytkowania należy dokonać rozważnej ostrej
oceny pomiędzy korzyścią , a ich doraźnym i
odległym skutkiem działania toksycznego.

Podział pestycydów wg
zastosowania
(na ich skuteczność gatunkową)
Zoocydy - środki do zwalczania szkodników
zwierzęcych:
- insektycydy
- środki owadobójcze,
- rodentycydy
- środki do zwalczania gryzoni,
- muluskocydy
- środki do zwalczania ślimaków,
- aficydy
- środki do zwalczania mszyc,
- nematocydy
- środki do zwalczania nicieni,
- akarycydy
- środki do zwalczania roztoczy,
- repelenty
- środki odstraszające,
- atraktanty
- środki zwabiające.

Herbicydy - środki do zwalczania chwastów :
- totalne
- niszczące wszystkie
gatunki,
- wybiorcze
- niszczące określone gatunki,
- regulatory wzrostu
-
inhibitory i stymulatory.
Fungicydy
- środki do zwalczania grzybów.
Bakteriocydy
- środki do zwalczania
bakterii.
Podział pestycydów wg innych kryteriów np.
w grupie
zoocydów
podstawą podziału może być
odmienny sposób ich działania szkodnikobójczego
jak:
-
środki kontaktowe,
- środki żołądkowe,
- środki duszące.

Podział pod względem budowy
chemicznej:
Do podstawowych grup związków chemicznych w
których mieści się większość pestycydów należą:
Pestycydy nieorganiczne, np.:
- insektycydy arsenowe
:
- zieleń paryska -
[(Cu(CH
3
COO)
2
·Cu
3
(AsO
3
)],
- arsenian ołowiu (PbHAsO
4
),
- insektycydy fluorkowe
: kreolit (Na
3
AlF
6
), fluorek
sodu (NaF), fluorokrzemian sodu (Na
2
SiF
6
),
- herbicydy nieorganiczne:
amidosulfonian amonu,
boraks, chloran sodu,
- fungicydy:
zasadowy chlorek miedzi (II), siarka.

Pestycydy organiczne:
- polichlorowane pochodne związków cyklicznych:
DDT, HCH, metoksychlor,
- polichlorowane cyklodieny:
heptachlor, aldryna,
- pestycydy fosforoorganiczne:
malation,
paration, fenitrotion,
- karbaminiany:
karbaryl, chlorprofan,
- pochodne mocznika :
diuron, linuron,
- pochodne kwasu ditiokarbaminowego:
tiuran
,zineb, maneb,
- chlorofenole i pochodne kwasu
chlorofenoksyoctowego:
2,4-D, 2,4,5-T,
- dinitroalkilofenole:
dinitrofenol,
- heterocykliczne związki azotu:
prometryna,
pyrazon, dikwat, parakwat,
- związki metaloorganiczne
.

A. Polichlorowane pochodne
związków
cyklicznych
Charakterystyka ogólna
Związki tej grupy są stosowane przede
wszystkim do niszczenia owadów w
rolnictwie i leśnictwie, w akcjach
sanitarnych ( np.: zwalczanie widliszka,
much, owadów zadomowionych).
Do nich należą:
-metoksychlor
(LD
50
– 6000 mg/kg, per
os),
-
DDT
(LD
50
– 100 – 400 mg/kg,
per os),
-
Lindan
(LD
50
– 90 mg/kg, per
os),
-
Aldryna i Dieldryna
(LD
50
– 40 – 60
mg/kg, per os)

Są słabo rozpuszczalne w wodzie, dobrze w
rozpuszczalnikach organicznych.
Dobrze rozpuszczają się w tłuszczach, stąd
kumulują się w tkankach bogatych w tłuszcz
oraz wykazują dużą odporność na czynniki
zewnętrzne jak: temperatura, wilgotność,
światło.
Te cechy wpływają na zdolność ich przetrwania
w środowisku i w organizmach żywych.
W ustroju ulegają bardzo wolnej biotransformacji
w związku z czym podlegają kumulacji w
organizmie.
Kumulują się w tkance tłuszczowej, wątrobie,
nerkach, mózgu i w sercu.

W przypadku zaburzeń ustrojowych (np. głód)
zanik tkanki tłuszczowej może prowadzić do
uwalniania się tych substancji do krwiobiegu, co
może doprowadzić do wtórnego zatrucia.
Wchłanianie
Związki tej grupy wchłaniają się przez drogi
oddechowe, błony śluzowe i skórę oraz przez
przewód pokarmowy (jako pozostałość w
artykułach żywnościowych.
Biotransformacja
W ustroju związki te dość wolno ulegają
biotransformacji w wyniku czego ulegają
kumulacji (w tkance tłuszczowej, wątrobie,
mózgu, nerkach i sercu).
Biotransformacja zachodzi na drodze
odchlorowania, utlenieniu oraz hydrolizie.

Mechanizm działania toksycznego
Działanie toksyczne związane jest głównie z
powinowactwem związków polichlorowych do
układu nerwowego.
Są truciznami wieloukładowymi i w różny
sposób uszkadzają wątrobę i nerki (narządy
biorące udział w detoksykacji i wydalaniu).
Wydalanie
Związki polichlorowane wydalają się z kałem,
a tylko w nieznacznej ilości z moczem głównie
w postaci metabolitów.
Szczególnym przypadkiem, jest wydalanie ich
z mlekiem kobiet karmiących.

Objawy zatrucia
ZATRUCIA OSTRE
( od pół do kilku godzin od
spożycia)
- zaburzenie koordynacji ruchów,
- drętwienie języka,
- przeczulica twarzy i kończyn,
- drgawki,
- zwroty i bóle głowy,
- mdłości i wymioty.
Zgon może nastąpić po 1-2 tygodniach wskutek
zahamowania czynności 0.u.n., porażenia układu
oddechowego lub migotania komór.
Powikłania u ludzi którzy przeżyli: zapalenie
wielonerwowe oraz uszkodzenie wątroby i nerek.

ZATRUCIA PRZEWLEKŁE
- brak apetytu,
- wychudzenie i ogólne osłabienie,
- wzmożona pobudliwość nerwowa,
- zapalenie wielonerwowe,
- niekiedy zaburzenia psychiczne.
Związki tej grupy wykazują również działanie
drażniące i uczulające na skórę (zapalenia
skóry, wypryski, odczyny alergiczne).
Związki te ulegają kumulacji w tkance
tłuszczowej ryb, a tym samym mogą być
szkodliwe dla ptaków wodnych odżywiającymi
się nimi oraz wpływać na ich rozmnażanie.

Trwałość w środowisku niektórych pestycydów
chloroorganicznych
Związek
DDT
Lindan
Aldryna
Dieldryna
Heptachlor
Czas rozkładu w 95 %, lata
- 4 - 30
- 2 - 10
- 1 - 6
- 5 - 25
- 3 - 5

B. Chlorofenole (PCP) i pochodne
kwasów
chlorofenoksykarboksylowych
Proste chlorofenole wykazują biocydowe
właściwości, przy czym tylko
pentachlorofenol
znalazł zastosowanie głównie do niszczenia
młodych chwastów dwuliściennych oraz do
zaprawiania drewna.
Pentachlorofenol
Wchłanianie
Przewód pokarmowy, skórę i układ oddechowy.

Objawy zatrucia
ZATRUCIA OSTRE
- podrażnienie skóry (trądzik)
i błon śluzowych,
- bóle głowy,
- mdłości i ślinotok,
- podwyższenie temperatury ciała i ucisk w
klatce piersiowej,
- osłabienie mięśniowe,
- zgon na skutek porażenia ośrodka
oddechowego, zatrzymania akcji serca lub
obrzęku płuc.
ZATRUCIE PRZEWLEKŁE
- działanie drażniące na skórę,
- ogólne osłabienie (silne pocenie),
- wychudzenie
- zapalenie oskrzeli, a także parastezje.

Kwasy chlorofenoksykarboksylowe
Kwasy chlorofenoksykarboksylowe powstają w
wyniku kondensacji chlorofenoli z
chloropochodnymi kwasów karboksylowych.
Do najważniejszych tych pochodnych, które
znalazły zastosowanie jako pestycydy, należą:
kwas 2,4-dichlorofenoksykarboksylowy
( 2,4 D) i
kwas 2,4,5-trichlorofenoksyoctowy
(2,4,5-T), które znalazły zastosowanie jako
herbicydy (środki chwastobójcze) oraz jako
defolianty (środki niszczące liście).
Związki te były m.in. Powszechnie stosowane
przez armię USA w czasie wojny w Wietnamie w
latach 1962-1970 dla odsłaniania siedlisk
partyzantów w dżungli (1962-1970 r).

Ponad 20 mln ton aktywnej mieszaniny kwasów
chlorofenoksyoctowych pod nazwą „substancja
pomarańczowa” (Orange Agent) zostało rozpylone w
Południowym Wietnamie.
2,4-D (kwas 2,4-dichlorofenoksyoctowy
)
– jest
białą krystaliczną substancją o fenolowym zapachu
Stosowany jest najczęściej jako środek
chwastobójczy.
Wchodzi w skład wielu preparatów handlowych jak:
Pielik, Aminopielik, Herbitor, Trawit.
Narażenie
Główną drogą narażenia u ludzi w pracy zawodowej
jest skóra oraz układ pokarmowy i układ oddechowy.

Wydalanie
Wydala się głównie z moczem w postaci
niezmienionej oraz w postaci produktów
sprzężonych z węglowodanami i aminokwasami.
Toksyczność ostra obu związków jest niewielka i
wynosi rzędu 500 -1000 mg/kg m.c.
Uważa się, że dawka 3-4 g herbicydów tej grupy
jest toksyczna dla człowieka i powoduje
wyraźne objawy toksyczności ostrej, którymi
są :
- działanie drażniące na skórę i błony śluzowe, a
także uczulające,
- działanie na o.u.n. – niezborność ruchów,
zaburzenia równowagi, niepokój, pobudzenie,
możliwa hipertermia, śpiączka i możliwe
porażenie ośrodka oddechowego,

- działanie na przewód pokarmowy –
(nudności, wymioty, bóle brzucha,
biegunki),
- przejściowa dysfunkcja wątroby,
- działanie na układ mięśniowy – (osłabienie
siły mięśniowej, bóle mięśniowe, drżenia
włókienkowe),
- działanie na mięsień sercowy – (zaburzenie
rytmu serca, migotanie komór),
- działanie na obwodowy układ nerwowy –
(możliwe wystąpienie polineuropatii).

C. Insektycydy fosforoorganiczne
Prace nad syntezą związków
fosforoorganicznych z myślą o
wykorzystaniu ich jako
insektycydów
rozpoczęto w 1934 r. w Niemczech, a
największe osiągnięcia w tej dziedzinie są
zasługą chemika Gerarda Schroedera.
Na skalę przemysłową związki
fosforoorganiczne zaczęto produkować po II
wojnie światowej głównie w USA.
Są to związki pochodne kwasu fosforowego
i tiofosforowego o następującym wzorze:
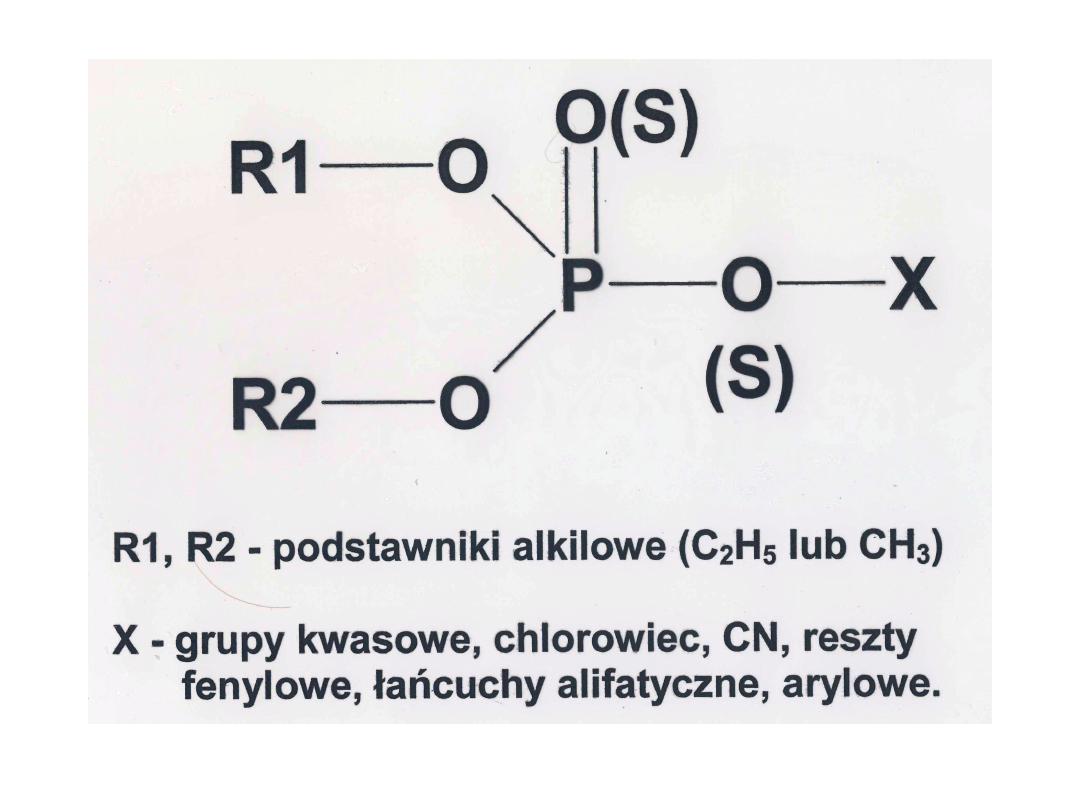

Różne położenia oraz liczba atomów i siarki w
cząsteczce tworzą kilka głównych klas chemicznych
insektycydów fosforoorganicznych o różnej sile
działania toksycznego i o różnym przeznaczeniu.
Insektycydy fosforoorganiczne (estry) występują w
postaci krystalicznej i cieczy oleistych o
nieprzyjemnym zapachu.
Trudno rozpuszczają się w wodzie, ale łatwo
rozpuszczają się w olejach i rozpuszczalnikach
organicznych.
Związki fosforoorganiczne łatwo ulegają
hydrolizie.
Szybkość i podatność na hydrolizę zależy od:
- budowy chemicznej i pH,
- temperatury,
- rodzaju rozpuszczalnika,
- obecności katalizatorów.

Maksymalna szybkość hydrolizy zachodzi przy
pH 7 – 8
.
W miarę zwiększania się pH, szybkość hydrolizy
zmniejsza się o ok. 10 krotnie na każdą jednostkę pH
Diestry powstają w czasie hydrolizy mogą ulegać
dalszemu rozkładowi do monomerów, a nawet do
samego fosforu.
Związki fosforoorganiczne mogą ulegać również
utlenieniu, a szczególnie związki zawierające
ugrupowania z siarką i amidowe.
Reakcje utleniania stanowią pośredni etap aktywacji
toksyczności estrów o budowie siarkowej i amidowej.
Tylko analogi tlenowe wykazują aktywność biologiczną
.
Do znanych związków fosforoorganicznych należą m.in.:
dichlorfos
( -OCH = CCl
2
),
malation
(S),
paration
(S),
soman
(F)
, sarin
(F)
, tabun
(CN).

Wchłanianie
Większość pestycydów fosforoorganicznych
występuje w a reakcjach postaci nie zjonizowanej i
ma charakter lipofilny ,a za tym łatwo wchłaniają
się z przewodu pokarmowego, układu
oddechowego i skórę.
Biotransformacja
Zasadnicze znaczenie dla toksycznego działania
zawiązków fosforoorganicznych ma ich budowa
estrowa.
Biotransformacja tych związków głównie polega
na hydrolizie wiązań estrowych.
Enzymy
katalizujące hydrolizę występują w
wielu tkankach i na ogół są mało swoiste.
Istotna jest wrażliwość tych enzymów na związki
fosforoorganiczne.

Mechanizm działania toksycznego
Wszystkie związki fosforoorganiczne, zależnie od
budowy cząsteczki są pośrednio(
P=S
) lub
bezpośrednio (
P=O
) inhibitorami aktywności
enzymów z grupy
cholinoesteraz
tj.
acetylocholinoesterazy
i
cholinoesterazy
, które są
punktem docelowym dla związków
fosforoorganicznych.
Inhibicja aktywności tych enzymów prowadzi do
wzrostu
acetylocholiny
, która jest mediatorem w
przenoszeniu stanu pobudzenia w neuronach.
Acetylocholina
jest neuroprzekaźnikiem
chemicznym impulsów nerwowych w
zakończeniach nerwowo-mięśniowych (płytka
motoryczna) w przedzwojowych zakończeniach
współczulnych i przywspółczulnych oraz
pozazwojowych zakończeniach przywspółczulnych.

Odgrywa również rolę w zwojach autonomicznych
oraz synapsach o.u.n.
Działaniem obejmuje ośrodkowy i obwodowy
układ nerwowy.
Cholinoesterazy
są enzymami hydrolitycznymi
rozkładającymi różne estry choliny.
Funkcją
cholinoesteraz
jest ograniczenie czasu
działania
acetylocholiny
przez jej rozkład
hydrolityczny do choliny i kwasu octowego.
W organizmie saków występują 2 rodzaje
cholinoesteraz
, które wykazują odrębność reakcji
substratowych, dystrybucji tkankowej i
powinowactwa do estrów fosforoorganicznych.

- Acetylocholinoesteraza
(AChE), która katalizuje
głównie rozkład
acetylocholiny
, w mniejszym
stopniu estry choliny.
Enzym ten występuje we
wszystkich tkankach ludzkich i zwierzęcych,
które mają zdolność przewodzenia impulsów
nerwowych tj. w błonie krwinek nerwowych,
mózgu, rdzeniu kręgowym, płytkach
motorycznych mięśni szkieletowych, mięśni
gładkich drzewa oskrzelowego i pęcherza.
- Cholinoesteraza
(ChE) dla której swoistym
substratem jest ester buterylocholiny, który
występuje w osoczu krwi, wątrobie, trzustce,
nadnerczach, zwojach czuciowych błony
śluzowej i przewodu pokarmowego.

Większość związków fosforoorganicznych
unieczynnia
AChE
i
ChE
z podobną szybkością.
Kliniczne objawy ciężkiego zatrucia występują
wówczas, gdy aktywność enzymów wynosi ok. 30 %.
Proces odnowy
AChE
jest znacznie wolniejszy niż
ChE
i jest również różny w poszczególnych
narządach i tkankach.
Pełna regeneracja
ChE
po głębokim
unieczynnieniu występuje po 30 – 40 dniach,
AChE
w okresie 80 -100 dni.
Odnowa
AChE
w mięśniach i krwinkach jest na
ogół podobna, a znacznie wolniej powraca czynność
AChE
w o.u.n. (do kilku miesięcy).

Zatrucia
Związki fosforoorganiczne są substancjami o
działaniu neurotoksycznym.
Powodują głównie zatrucia ostre i
podprzewlekłe, zwykle o przebiegu gwałtownym,
a niekiedy odległe ( genotoksyczne) jak w
przypadku
dimetoatu
.
Toksyczność ostra
Objawy zatrucia ostrego występują w krótkim
czasie od wchłonięcia trucizny (1/2 do 1 godziny).
W ostrej fazie zatrucia wyróżnia się działane:
-
muskarynowe
– pobudzenie układu
parasympatycznego: wzmożone pocenie,
ślinienie, łzawienie, objawy żołądkowo-jelitowe,
odruchowe oddawanie moczu i kału, zwężenie
źrenic.

-
nikotynowe
- drżenie mięśni, drętwienie, osłabienie
mięśniowe.
-
na o.u.n.
– wzrost pobudliwości, zniesienie
wrażliwości na ból, zniesienie odruchów,
chwiejność emocjonalna.
Ze strony układu krążenia występuje kolejno
zwolnienie i przyspieszenie akcji serca, spadek, a
później wzrost ciśnienia krwi i zapaść.
Zgon następuje zwykle wskutek porażenia
ośrodka oddechowego, zatrzymania akcji serca lub
obrzęku płuc.
Niezależnie od objawów występujących w fazie
ostrej, dla niektórych związków
fosforoorganicznych obserwuje się objawy
działania opóźnionego w postaci neuropatii
obwodowej ( paraliż kończyn dolnych).


Związki fosforoorganiczne nie wywołują zatruć
przewlekłych wynikających z kumulacji materiałowej.
Długotrwałe narażenie na małe dawki wywołuje
stopniowo narastające zahamowanie aktywności
acetylocholinerazy
i rozwój zatrucia w wyniku
kumulacji skutków biologicznych.
Zapobieganie zatruciom
- prowadzenie systematycznej akcji pouczania jak
należy obchodzić się z tego typem związkami ( w
trakcie produkcji, konfekcji, magazynowania,
dystrybucji i stosowania),
- używania właściwej odzieży ochronnej (maski, buty,
rękawice, ubrania,
- sprzedaż w opakowaniach oryginalnych -
fabrycznych i trzymanie pod zamknięciem,

- umiejętne udzielanie pomocy po zatruciu,
- zabiegi z związkami (preparatami) I i II klasy
toksyczności powinne być wykonane przez
specjalne ekipy pracowników,
- rozpylać z wiatrem.
Leczenie
Każdy przypadek zatrucia związkami
fosforoorganicznymi należy uwazżć za bardzo
niebezpieczny dla życia i dlatego należy
natychmiast przystąpić do ratowania.
Postępowanie:
- płukanie żołądka po zatruciu drogą pokarmową,
- zmywanie dużą ilości wody z mydłem w
przypadku skażenia
skóry,

- skażone oczy przemyć 2 % roztworem natrium
bikarbonikum lub przygotowaną wodą,
- udrożnienie dróg oddechowych i zapewnienie
prawidłowego oddychania,
- udzielenie pomocy lekarskiej (specjalistycznej).
Jako odtrutkę w zatruciach związkami
fosforoorganicznymi stosuje się
atropinę
(antagonista acetylocholiny).
Działa przede wszystkim na
receptory
muskarynowe
głównie pochodzenia obwodowego,
a w mniejszym stopniu ośrodkowego.
Nie znosi skutków pobudzenia nerwowo-
mięśniowego i opóźnionego działania
neurotoksycznego

Kolejne odtrutki to
pochodne oksymów
.
Są one swoistymi reaktywatorami zablokowanej
przez związki fosforoorganiczne
acetylocholinoesterazy
.
Do nich należą:
- 2-PAM
(Pralidoksym) – metylojodek pirydyno-2-
aldoksymu,
- Obidoksym
( Toxobudim)- dichlorowodorek eteru
bis-[4-hydroksyiminometylopirydyno-1-
metylowego].
W ciężkich przypadkach zatrucia pochodne
oksymów podaje się łącznie z
atropiną
.
W ciężkich zatruciach jest skuteczniejszy
Obidoksym
, gdyż działa szybciej, silnie, dłużej
utrzymuje się w organizmie i przenika barierę krew-
mózg.

D. Pochodne kwasu karbaminowego
Związki pochodne kwasu karbaminowego pod
nazwą ogólną
karbaminiany
zostały zsyntetyzowane
po raz pierwszy w 1954 roku. Znalazły zastosowanie
jako insektycydy, herbicydy, fungicydy, nematocydy i
inhibitory kiełkowania.
Przykładem tej grupy związków są:
Karbaryl,
Propoksur, Chlorprofam
.
Sąsłabo rozpuszczalne w wodzie, natomiast dobrze
w rozpuszczalnikach organicznych.
Występują w postaci proszków.
Sązwiazkami nietrwałymi, łatwo ulegają hydrolizie
zwłaszcza w środowisku zasadowym. Mała ich
toksyczność umożliwia stosowanie ich w akcjach
sanitarnych do zwalczania szkodników i pasożytów.
Działają bezpośrednio (kontaktowo) lub ogólnie po
wniknięciu.

Wchłanianie
Są niemal całkowicie wchłaniane z przewodu
pokarmowego, skąd ulegają dystrybucji do
narządów i tkanek (8-17 minut).
Wchłaniają się również przez drogi oddechowe i
nieuszkodzoną skórę.
Biotransformacja
Związki tej grupy szybko ulegają utlenieniu pod
wpływem enzymów związanych z cytochromem P-
450 (utlenianie na grupie N-metylowej i
hydroksylacja).
Większość powstałych metabolitów wydalana jest
z moczem po sprzęgnięciu z kwasem glukoronowy.

Mechanizm działania toksycznego
Podobny do związków fosforoorganicznych i
związany jest z hamowaniem aktywności
cholinoesteraz
krwi i tkanek.
Działani tych związków jest jednak słabsze, a
efekty inhibicji
AChE
są łatwiej odwracalne.
W przypadku zatrucia karbaminianami nie
obserwowano opóźnionej neuropatii obwodowej.
Szybkie obniżenie aktywności oraz szybkie
pojawienie się objawów zatrucia w ostrym
zatruciu jest podstawą do podjęcia działań
zapobiegających i leczniczych.
W badaniach na zwierzętach nie stwierdzono
.

Leczenie
W
przypadku zatrucia, leczenie polega na
zwalczaniu groźnych dla życia zaburzeń
czynności układu oddechowego i krążenia
oraz na zapobieganiu.
W leczeniu stosuje się wyłącznie duże
dawki
atropiny
.
Podanie
oksymów
jest przeciwwskazane,
gdyż może pogłębić stopień zatrucia.

E. Pochodne dinitrofenolu
Pod względem struktury pochodne dinitrofenolu (
pierścień benzenowy z 2 grupami -NO
2
oraz grupa
-OH i resztą alkaliczną lub aromatyczną) są mało
zróżnicowaną grupą.
Związki tej grupy są stosowane jako
herbicydy
,
insektycydy lub fungicydy
.
Pochodne dinitrofenoli charakteryzują się dużą
toksycznością ostrą (LD
50
), która dla wszystkich
związkó w jest podobna i mieści się w granicach 20
-60 mg/kg m.c.
Do najczęściej stosowanych należą:
2-metylo-4,6-
dinitro-o-krezol
(DNOC) i
2-(1-metylo-n-propylo)-
4,6-dinitrofenol
(Diniseb, DNBP).
Obydwa związki występują w formie żółtych
kryształów, źle rozpuszczających się w wodzie,
dobrze w rozpuszczalnikach.

Wchłanianie
Wchłaniają się drogą pokarmowa,
przez skórę i drogą oddechową.
Biotransformacja
Dinitrofenole w organizmie ulegają
wolniejszej biotransformacji i wydalaniu niż
mononitrofenole.
Ich obecność w płynach ustrojowych można
jeszcze wykryć nawet po kilku tygodniach
od zatrucia, co sugeruje, że związki te
mogą ulegać kumulacji w przypadku
powtarzanej ekspozycji.

Mechanizm działania toksycznego
Działanie wielokierunkowe:
methemoglobinotwórcze, pobudzające na
o.u.n., mają zdolność przyśpieszania
przemiany materii, podwyższają
temperaturę ciała, powodują kwasicę i
uszkadzają narządy miąższowe.
Przyśpieszenie przemiany materii oraz
wywołanie hipertemii (powyżej
41
0
C), wynika
z biochemicznego mechanizmu działania tych
związków.
Powodują rozprężenie procesu oksydacyjnej
fosforylacji w wyniku której wyzwolona energia w
procesach utlenienia tkankowego nie jest
magazynowana w postaci ATP.

Jednocześnie same procesy oksydacyjne
zachodzą w tkankach ulegają znacznemu
przyśpieszeniu, co z kolei powoduje wzrost
temperatury ciała.
Przemianom tym towarzyszą: zanik glikogenu
w wątrobie i mięśniach oraz zanik tkanki
tłuszczowej.
Zatrucia
OSTRE:
Zatrucie rozwija się bardzo szybko. Objawy
występują w ciągu 24 – 48 godzin od zatrucia.
Objawy zatrucia to: nudności i zaburzenia
żołądkowe, przyśpieszenie oddechu, niepokój,
częstoskurcz, zaczerwienienie skóry, wysoka
temperatura, sinica, zapaść i śpiączka.

W ciągu 24 – 48 godzin może dojść do
wyleczenia lub śmierci.
PRZEWLEKŁE
Objawy są łagodniejsze, ale w krótkim czasie
dochodzi do wyniszczenia organizmu.
Przy zatruciu występuje charakterystyczne
żółte zabarwienie spojówek.
Leczenie
Należy szybko usunąć truciznę i zastosować
zimne kąpiele i podać tlen.
Przetaczanie płynów krwiozastępczych i
elektrolitów, celem wyrównania strat
wynikających z temperatury i pocenia się.
Leczenie objawowe. Nie podawać atropiny!.

F.
Piretroidy
Do pestycydów należy również grupa
związków pochodzenia naturalnego
(roślinnego) oraz syntetyczne związki
chemiczne pod nazwą „
piretroidy
”.
Piretriody są to związki, które były znane od
dawna i stosowano je do zwalczania: grzybów,
owadów, szkodników w pomieszczeniach
zamkniętych, w przechowalnictwie oraz do
utrzymania higieny zwierząt.
A. Piretroidy naturalne są to wyciągi z roślin
rodzaju
Chrysanthemum Pyrethrum (złocienia).
Substancją czynna stanowi mieszanina kilku
związków o budowie estrowej.

Są one estrami
kwasu
cyklopropanokarboksylowego
i
cyklopentanolu
.
Odtworzone w warunkach laboratoryjnych i
wzbogacone syntetycznie wykazują właściwości
insektobójcze, co zostało wykorzystane w walce z
owadami, dla których są truciznami kontaktowymi
lub dożołądkowymi.
Piretroidy naturalne
w dużych dawkach (jakie nie
występują w przyrodzie) są na ogół truciznami
neurotropowymi o dużym powinowactwie do o.u.n. –
drżenie mięśniowe, porażenie i biegunka.
Przyczyną śmierci jest porażenie ośrodka
oddechowego.
Mała trwałość i szybki rozkład pod wpływem
czynników zewnętrznych, zwłaszcza światła oraz
trudności w utrzymaniu ich z roślin na skalę
użytkową ograniczyły ich powszechne zastosowanie.

B. Związki syntetyczne tej grupy, które znalazły
zastosowanie jako insektycydy, to najczęściej :
estry kwasu chryzantemowego
(pirytryna I) lub
kwasu piretrowego
(piretryna II).
W latach siedemdziesiątych XX wieku na drodze
syntezy chemicznej otrzymano pierwsze
piretoidy
światłotrwałe
. Przykładem tych związków są:
alfametryn
a,
cypermetryna
,
deltametryna
,
permetryna
(Ambusz),
dezmetryna
(Semeryn).
Do organizmu wnikają drogą pokarmową,
oddechową i przez skórę. Toksyczność wziewna i
naskórna jest uzależniona od postaci użytkowej.
Dobra ich rozpuszczalność w tłuszczach ułatwia
dystrybucję w organizmie i przenikanie do tkanki
nerwowej.

Piretroidy syntetyczne wykazują głównie
działanie drażniące na skórę (kontaktowe
zapalenie skóry) oraz uczulające na skórę i błony
śluzowe.
Inne objawy jak: działanie na układ oddechowy,
przewód pokarmowy czy rzadko na o.u.n., są
najczęściej wynikiem działania rozpuszczalników
organicznych zawartych w tych preparatach.
Powyższe objawy obserwowano u ludzi po
zatruciu
delmatryną
związku o dużej toksyczności
ostrej (LD
50
ok. 30 mg/kg m.c.).
Dla innych piretroidów tej grupy zakres
medialnych dawek letalnych mieści się w zakresie
od 251 do 4000 mg/kg m.c.
Leczenie objawowe !

Formy użytkowe i sposób stosowania
pestycydów
Dostępne w handlu preparaty zawierają jako
składnik główny
substancję biocydową
o aktywności
biologicznej skierowanej przeciwko określonym
pasożytom lub szkodnikom.
Substancja ta jest rozprowadzona w określonym
medium
(najlepiej obojętnym biologicznie)
, która
spełnia też określoną funkcję użytkową (np. zwiększa
przyczepność lub zapewnia równomierność
naniesienia na powierzchnię roślin, zabezpiecza
przed zwiewaniem lub zmywaniem przez deszcz itp.).
Substancja ta może być stosowana w różnych
formach użytkowych i stężeniach np.:
- pylistej
(kreda, kaolin, talk)
- w formie roztworów wodnych lub w
rozpuszczalnikach.

W przypadku roztworów niewodnych do
emulgowania stosuje się rozpuszczalniki
dobrane odpowiednio do substancji czynnej
(często naftę, oleje mineralne, terpentynę).
Należy pamiętać, że sam rozpuszczalnik
może wykazywać działanie szkodliwe.
Do najczęstszych zabiegów ochrony roślin
należą:
- opylanie,
- rozsiewanie,
- opryskiwanie,
- gazowanie,
- zaprawianie.

Opylanie
– zastosowanie pestycydów w
postaci proszków.
Rozsiewanie
jest sposobem wprowadzenia
pestycydu do gleby.
Opryskiwanie
- stosowanie pestycydów w
postaci roztworów.
Gazowanie
(fumigacja) polega na
stosowaniu pestycydów w formie gazowej w
pomieszczeniach zamkniętych.
Zaprawianie
służy do pokrywania
pestycydem (fungicydem) materiału
siewnego.

Zanieczyszczenie środowiska
pestycydami
Zanieczyszczenie środowiska naturalnego
obejmuje zasadniczo glebę i wody powierzchniowe.
Zanieczyszczenie wód spowodowane jest :
- spływem powierzchniowym z terenów
zanieczyszczonych,
- przenikaniem przez glebę, erozją gleby,
- bezpośrednim opadem na powierzchnię wody przy
opryskach pól i lasów przy użyciu samolotów,

- ściekami powstającymi w czasie produkcji
pestycydów,
- ściekami powstającymi przy myciu urządzeń
używanych do oprysków,
- ściekami miejskimi (fungicydy i bakteriocydy,
- w czasie bezpośredniego stosowania
pestycydów do zwalczania roślin wodnych i
owadów,
- ściekami z zakładów stosujących pestycydy,
- ściekami z zakładów produkujących
pestycydów.

Stopień zanieczyszczenia wód
pestycydami zależy od:
- intensywności upraw w danym regionie,
- rodzaju upraw,
- pory roku,
- intensywności opadów,
- przypływu ścieków wodnych.
Ważną drogą transportu pestycydów do
środowiska naturalnego są także opady
atmosferyczne i wiatr, wskutek czego
skażeniu ulegają zbiorniki wód leżące w
dużej odległości od terenów rolniczych (DDT
stwierdzono w śniegach Antarktydy).

Profilaktyka zatruć pestycydami
- ograniczenie dostępności pestycydów o
największej toksyczności,
- działanie uświadamiające i szkolenie w
zakresie stosowania,
- stosowanie odzieży ochronnej,
- okresowe badania lekarskie,
- monitorowanie wielkości narażenia ludzi w
środowisku.

Pozostałość pestycydów w żywności
Jest to suma związków chemicznych obecnych
w produkcie spożywczym w wyniku stosowania
pestycydów.
Najwyższa dopuszczalna pozostałość
dla pestycydów (NDP)
Jest to najwyższe dopuszczalne stężenie
substancji czynnej środka ochrony roślin w
artykułach spożywczych. Obejmuje również
metabolity o znaczeniu toksykologicznym i
odnosi się do określonego produktu lub grupy
produktów wyrażone w mg/kg.

Okres karencji
Czas od ostatniego zabiegu do zbioru płodów
rolnych lub uboju zwierząt.
Maksymalna granica pozostałości (MGP)
Jest to ustalona ilość pestycydów dla
poszczególnych produktów roślinnych, wyrażona
mg/kg.
Dopuszczalne dzienne pobranie
(DDP)
Maksymalna ilość pestycydu jaką człowiek może
przyjmować codziennie ze wszystkich źródeł.

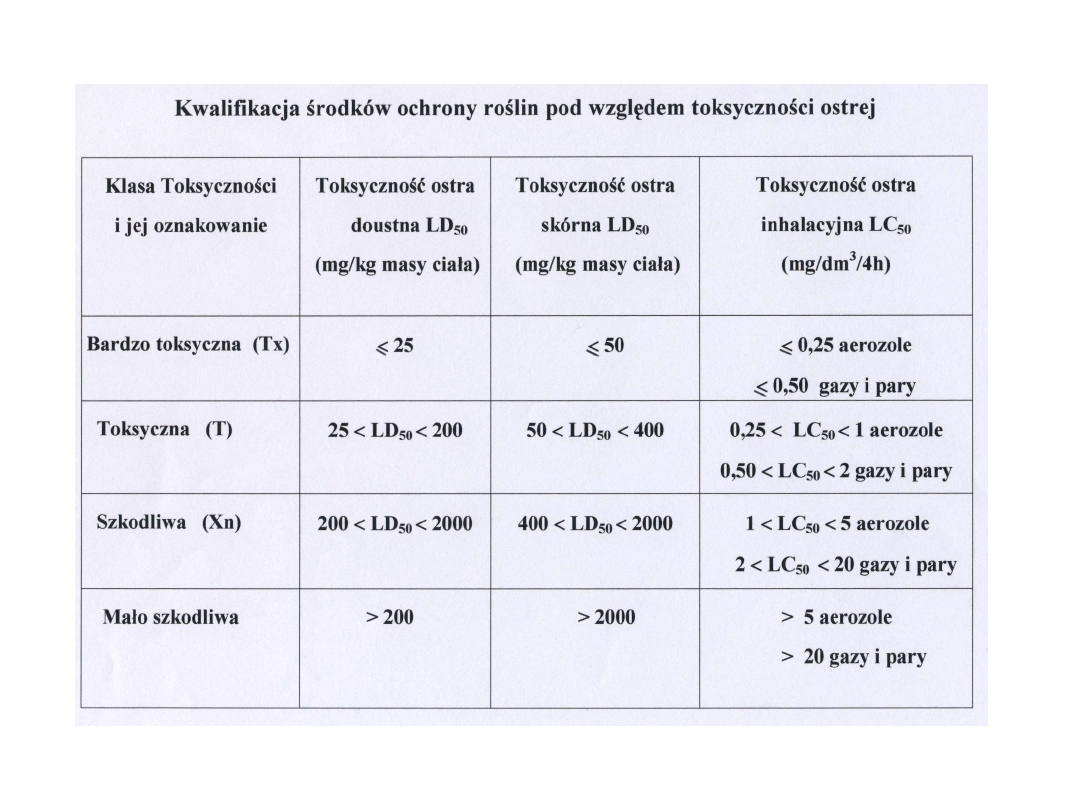
Podział pestycydów ze względu na
trwałość w środowisku
Grupa
Bardzo trwałe
Trwałe
Nietrwałe
Szybko znikające
Trwałość w miesiącach
- powyżej 18 lat
- do 18
- do 6
- do 3
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
- Slide 68
Wyszukiwarka
Podobne podstrony:
13 pestycydów na podawanych dzieciom owocach i warzywach 2
wyklad 13 toksykologia pestycydow
13 ZMIANY WSTECZNE (2)id 14517 ppt
13 zakrzepowo zatorowa
Zatrucia 13
pz wyklad 13
13 ALUid 14602 ppt
pz wyklad 13
ZARZ SRODOWISKIEM wyklad 13
Biotechnologia zamkniete użycie (2012 13)
Prezentacja 13 Dojrzewanie 2
SEM odcinek szyjny kregoslupa gr 13 pdg 1
w 13 III rok VI sem
Wykład 13 UKS
więcej podobnych podstron