
„Zwiększenie liczby wysoko wykwalifikowanych absolwentów kierunków ścisłych Uniwersytetu Jagiellońskiego”
POKL.04.01.02-00-097/09-00
Projekt współfinansowany przez Unię Europejską w ramach Europejskiego Funduszu Społecznego
Spektroskopia elektronowa związków
nieorganicznych
Zaawansowana Chemia Nieorganiczna
kurs dla III roku Chemii UJ
moduł Chemia Nieorganiczna i Strukturalna

Plan seminarium
L.p
.
Temat
Data
1
Spektroskopia
elektronowa
związków
nieorganicznych.
20.11.2013
2
Fotochemia związków nieorganicznych.
27.11.2013
3
Właściwości
magnetyczne
i
elektrochemiczne
związków nieorganicznych.
4.12.2013
4
Kinetyka
i
mechanizmy
reakcji
w
chemii
nieorganiczne.
11.12.2013
5
Termodynamika w chemii nieorganicznej.
18.12.2013
6
Kataliza
homo-
i
heterogeniczna.
Elementy
nieorganicznej nanochemii.
3.01.2014
(Pt)
7
Elementy biologicznej chemii nieorganicznej.
15.01.2014
8
Kolokwium.
?
Zaliczenie
Kolokwium zaliczeniowe
18
Kolokwia wstępne
62
BONUS: Aktywność
71
Maksymalnie
30
0,0 – 15,0 ndst
15,1 – 18,0 dst
18,1 – 21,0 dst+
21,1 – 24,0 db
24,1 – 27,0 db+
27,1 – 30,0 bdb

5
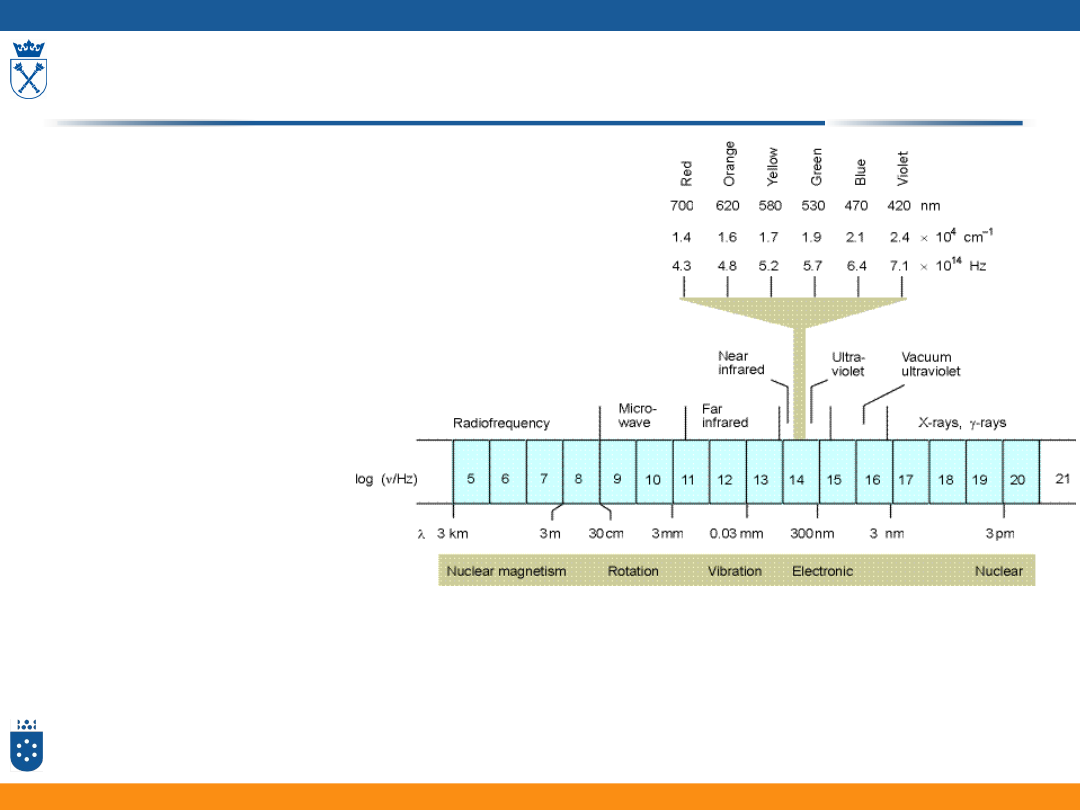
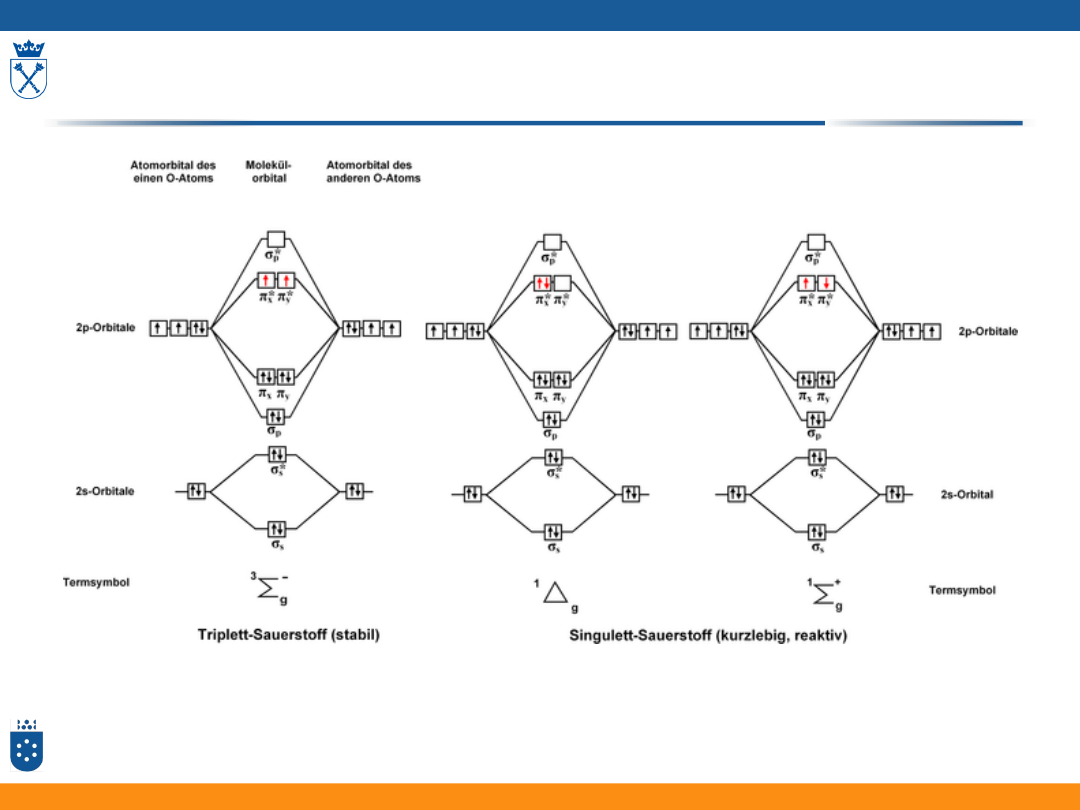
Spektroskopia - tematyka
• Widma elektronowe związków nieorganicznych
• Energia elektronu w atomach – przypomnienie
• Konfiguracja elektronowa pierwiastków –
przypomnienie
• Termy:
• wyznaczenie termu stanu podstawowego – reguły Hunda
• termy w stanie wzbudzonym
• energia termów
• diagramy Tanabe – Sugano
• Orbitale w polu krystalicznym ligandów
6
Formy energii molekuł
• Energia translacji 3/2kT
• Energia rotacji
• Energia oscylacji
• Energia elektronowa
• Energia wewnątrzjądrowa

7
Konfiguracja elektronowa metali bloku d i f
• Cr
2+
---
• Mn
2+
---
• Co
2+
---
• Pr ---
• Eu ---
• Tb ---
Podaj zapis konfiguracji elektronowej dla
następujących atomów i jonów:
1s
2
2s
2
2p
6
3s
2
3p
6
3d
4
1s
2
2s
2
2p
6
3s
2
3p
6
3d
5
1s
2
2s
2
2p
6
3s
2
3p
6
3d
7
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
3
5s
2
5p
6
6s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
7
5s
2
5p
6
6s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
9
5s
2
5p
6
6s
2

8
Energia elektronu w atomie wodoropodobnym
Energia elektronu - liczby kwantowe:
• n = 1,2,3… - główna liczba kwantowa
• l = 0, 1, 2, …, n-1 – orbitalna liczba kwantowa,
• moment pędu elektronu:
• rodzaj orbitalu - s, p, d, f
• m
l
= -l … +l - magnetyczna orbitalna liczba kwantowa,
• rzut orbitalnego momentu pędu na kierunek pola:
• s = ½ - spin
• m
s
= ± ½ - magnetyczna spinowa liczba kwantowa
h
)
1
l
(
l
h
l
m

9
Energia atomu wieloelektronowego
Momenty pędu elektronów sumują się wektorowo dając
wektory wypadkowe.
Wartość energii określają liczby kwantowe:
• L = m
l
– całkowita orbitalna liczba kwantowa
• L = 0, 1, 2…
• rodzaj termu – S, P, D, F, G, H
• S = m
s
– całkowita spinowa liczba kwantowa
Wypadkowe wektory spinu i momentu pędu orbitalnego
dają całkowity moment pędu orbitalnego J
wynikający ze
sprzężenia spinowo-orbitalnego J=L+S
• dla pierwiastków lekkich – sprzężenie LS (Russella-Sandersa) –
oddziaływanie wypadkowego momentu orbitalnego i spinowego
J = |L - S|; … ;L + S
• dla bloku f – sprzężenie j-j - momenty pędu elektronów
charakteryzuje liczba j wynikająca ze sprzężenia l i s dla
poszczególnych elektronów
Z zasady
dodawania wektorów
10
Termy – sposób zapisu
2S+1
L
J
warto
ść
L
0
1
2
3
4
5
6
7
oznaczenie
S
P
D
F
G
H
I
K
J = |L-S|, …. , L+S
•J = |L-S| dla f
n
, n<7
•J = L+S dla f
n
, n>7
S = s
multipletowo
ść
(term
singletowy,
dubletowy,
trypletowy
itd.)
11
Termy – sposób zapisu
2S+1
L
J
multipletowo
ść
(term
singletowy,
dubletowy,
trypletowy
itd.)
Multipletowość:
S=0
S=1/2
Term singletowy – wszystkie elektrony
są sparowane np. wapń
Term dubletowy – jeden
niesparowany elektron np.
scand
12
Termy

Mikrostany
13
różne sposoby rozmieszczenia elektronów na orbitalach dla
danej konfiguracji elektronowej ⇒ mikrostany
mikrostan (1
+
, 1
-
) ⇒ m
l
= +1; + ⇒ m
s
= +½, - ⇒ m
s
= - ½
mikrostan (-1
+
, 0
+
) ⇒ m
l
= +1, 0; m
s
= +½
odpychanie międzyelektronowe ⇒ mikrostany odpowiadające
różnej względnej kątowej gęstości elektronowej mają różne
energie
mikrostany o takiej samej energii przy uwzględnieniu
odpychania międzyelektronowego ⇒ termy

Mikrostany
14
m
s
M
L
+1
0
-1
+2:
1
+
1
-
+1:
1
+
0
+
1
+
0
-
1
-
0
+
1
-
0
-
0:
-1
+
1
+
-1
+
1
-
0
+
0
-
-1
-
1
+
-1
-
1
-
-1:
-1
+
0
+
-1
+
0
-
-1
-
0
+
-1
-
0
-
-2:
-1
+
-1
-
Dla konfiguracji p
2
:
m
l
+1 0 -1
Skoro l=1

15
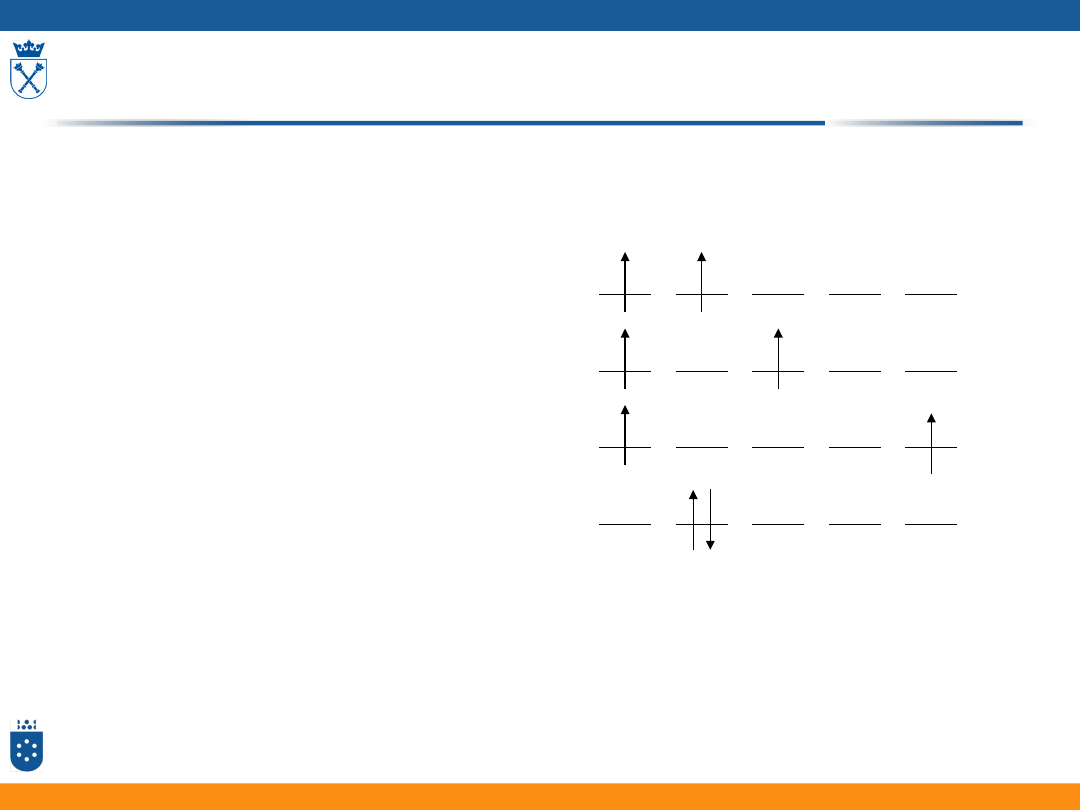
Wyznaczanie termu stanu podstawowego
• Czy energia
poszczególnych
konfiguracji jest taka
sama czy różna?
• Który mikrostan powinien
odpowiadać cząsteczce
w stanie podstawowym?
m
l
= 2 1 0 -1 -2
Różne sposoby
rozmieszczenia
elektronów dla
konfiguracji d
2
:
16
Termy atomowe
• mikrostany danej
konfiguracji elektronowej
mają różne energie na
skutek odpychania
międzyelektronowego
• zbiory mikrostanów o takiej
samej energii termy
m
l
= 2 1 0 -1 -2
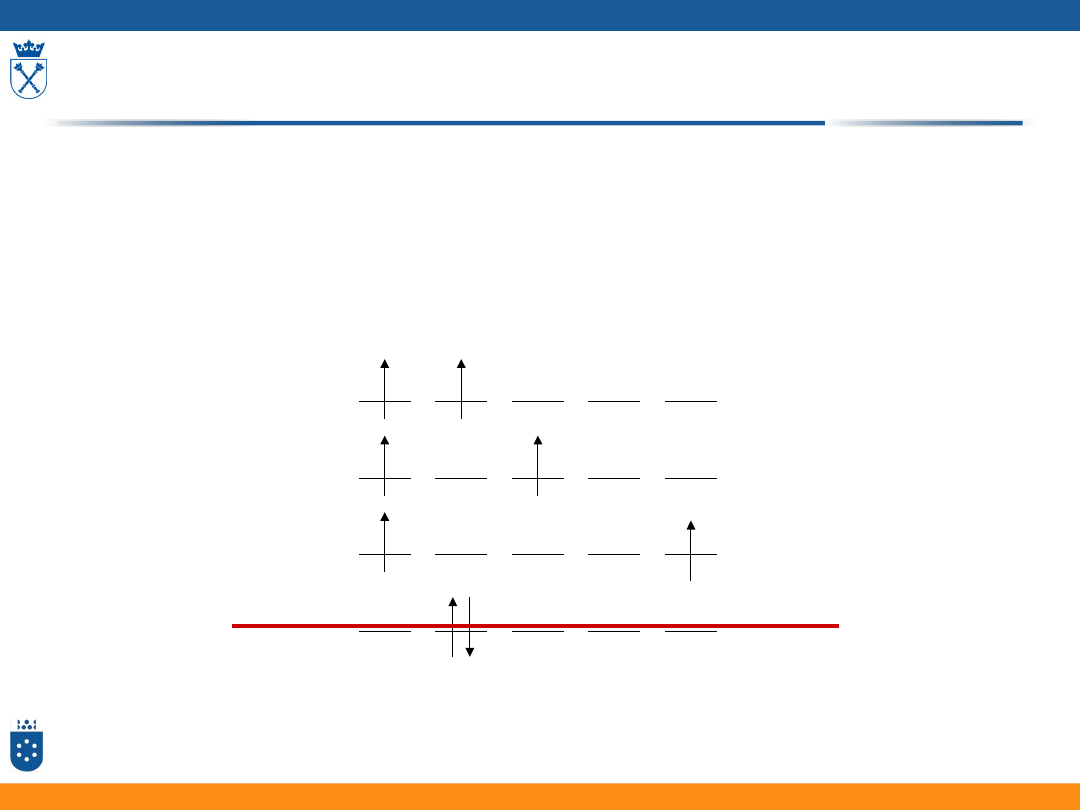
17
Reguły Hunda
1. Dla danej konfiguracji termem o najniższej energii
jest term o największej multipletowości:
m
L
= 2 1 0 -1 -2
a)
b)
c)
d)
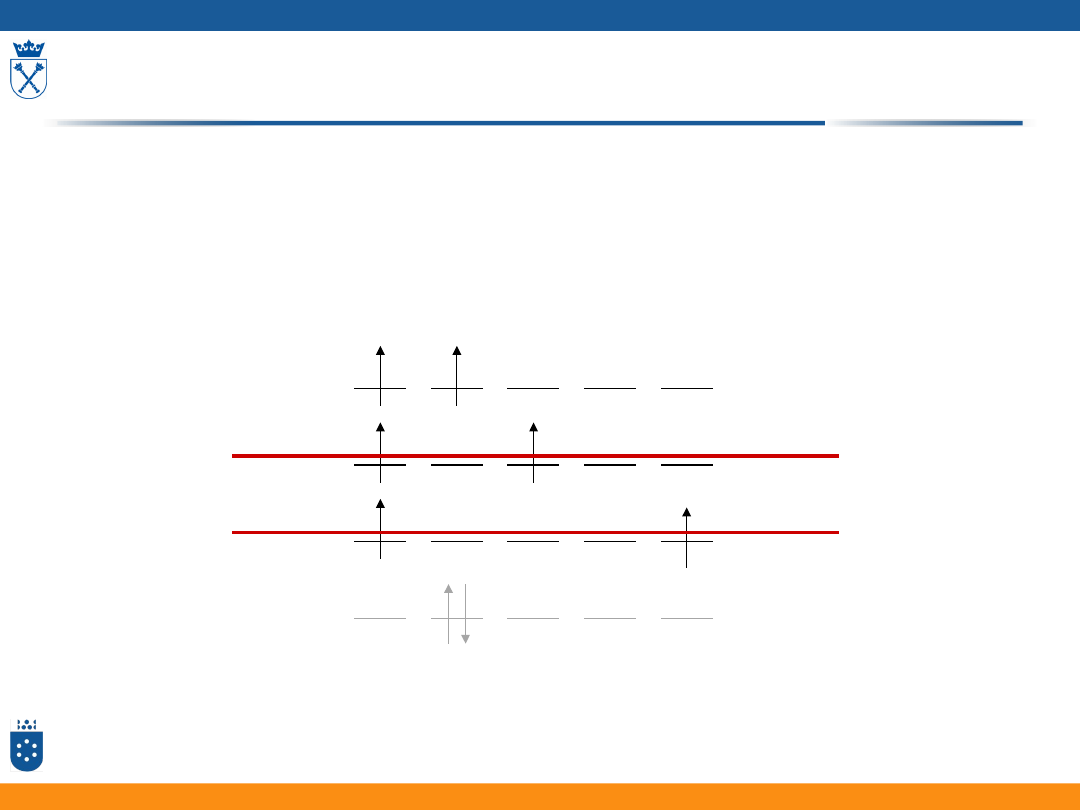
18
Reguły Hunda
2. Dla termu o określonej multipletowości niższą
energię ma
term o większej wartości L
m
L
= 2 1 0 -1 -2
a)
b)
c)
d)

19
Reguły Hunda
3. Dla tych samych wartości S i L:
• Term o najmniejszej wartości J dla
powłok zapełnionych do połowy
• Term o najwyższej wartości J dla powłok
zapełnionych ponad połowę

Wyznaczanie termu stanu podstawowego
20
m
L
= 2 1 0 -1 -2
Ustalić term stanu podstawowego dla konfiguracji
d
3
:
S = 3*1/2 = 3/2
L = 2+1+0 = 3 => term F
Term stanu podstawowego:
4
F

Wyznaczanie termu stanu podstawowego
21
m
L
= 2 1 0 -1 -2
Ustalić term stanu podstawowego dla konfiguracji
d
6
:
S = 5*1/2+1*(-1/2) = 2
L = 2+2+1+0-1-2= 2 => term D
Term stanu podstawowego:
5
D

22
Wyznaczanie termu stanu podstawowego
m
L
= 3 2 1 0 -1 -2
-3
Ustalić term stanu podstawowego dla konfiguracji
f
7
:
S = 7*1/2 = 7/2
L = 3+2+1+0-1-2-3 = 0 =>
term S
J=S=7/2
Term stanu podstawowego:
8
S
7/2

23
Wyznaczanie termu stanu podstawowego - ćwiczenia
Stosując reguły Hunda wyznaczyć term stanu
podstawowego dla izolowanych jonów:
• Cr
2+
--- d
4
• Mn
2+
--- d
5
• Co
2+
--- d
7
• Pr --- f
3
• Tb --- f
9
---
5
D
---
6
S
---
4
F
---
4
I
9/2
---
6
H
5/2

24
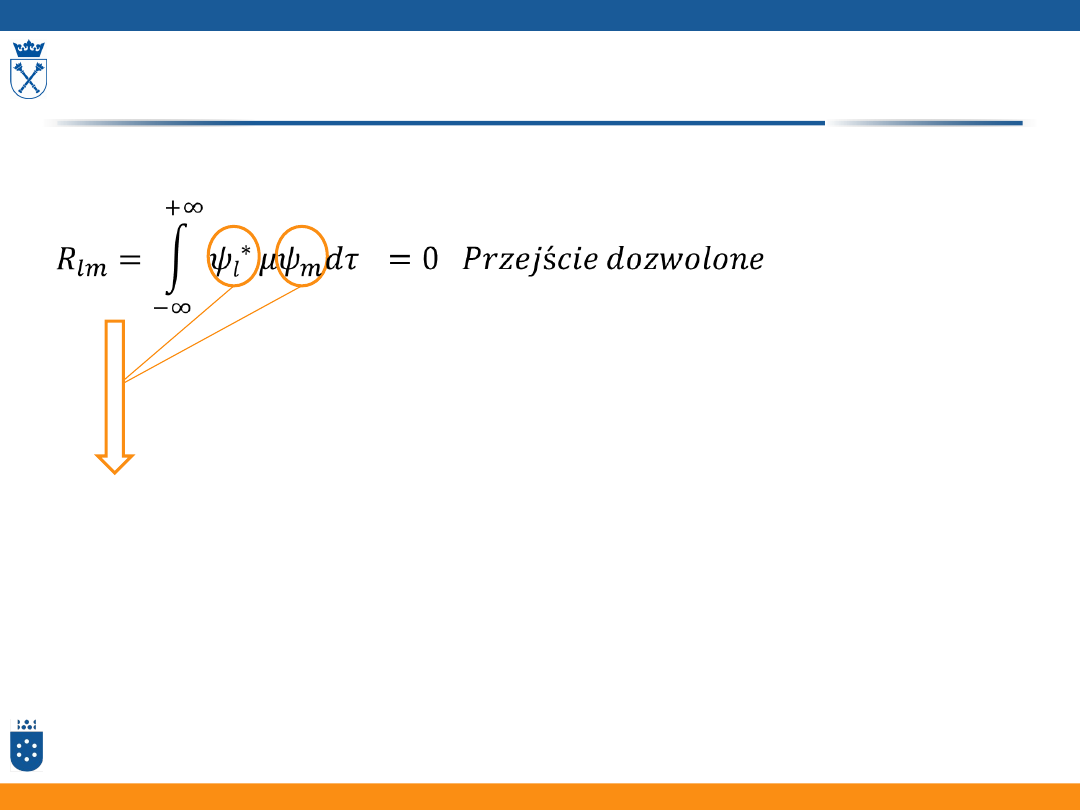
Spektroskopia elektronowa
25
Reguły wyboru przejść elektronowych
Funkcje falowe termów elektronowych
S=0 dla przejść dozwolonych
!!przejścia między termami elektronowymi o tej samej multipletowości!!
- sprzężenie wibronowe
-elektryczny moment kwadrupolowy
-magnetyczny moment dipolowy
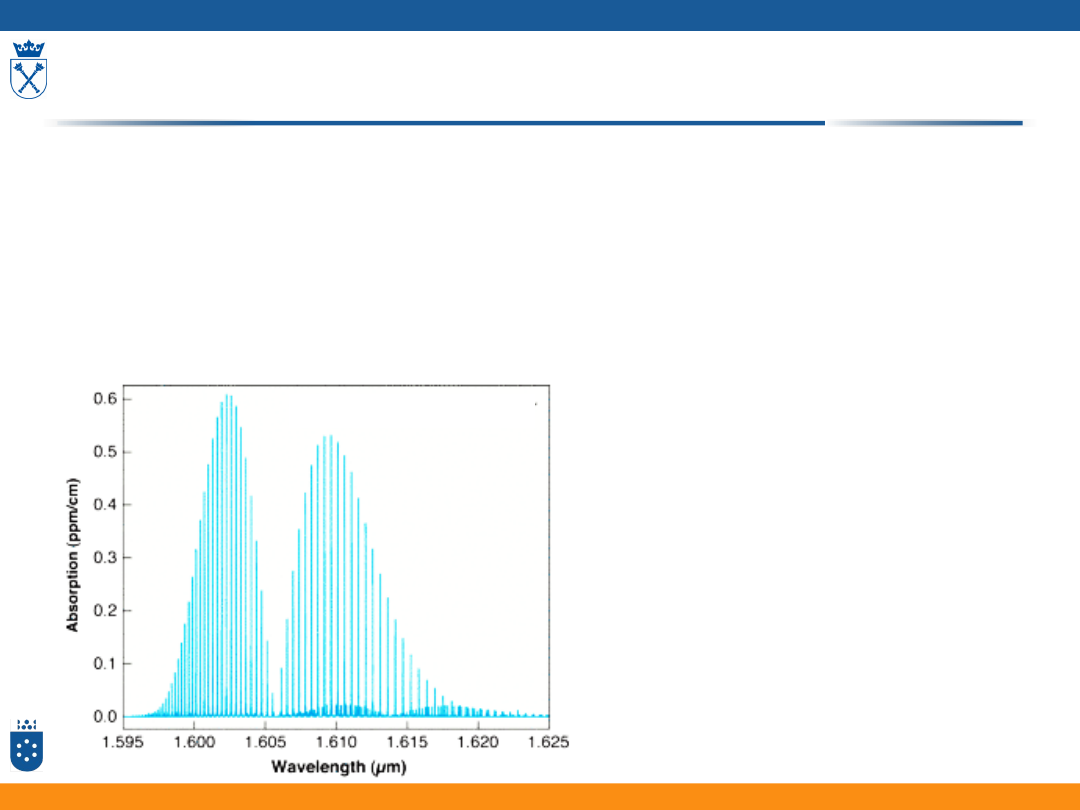
Proste molekuły w fazie gazowej
Pasma przejść elektronowych składają się z:
• szeregu pasm oscylacyjno-elektronowych, a te z kolei z:
• blisko leżących składowych przejść rotacyjnych
• Widma składają się z szeregu linii – interpretacja konturu widma
jest trudna
• Widma mogą dostarczyć informacji o:
• długościach wiązań
• kątach między wiązaniami
• stałych siłowych
• rozkładzie ładunków elektronów walencyjnych
26
Skąd bierze się kontur widma elektronowego?
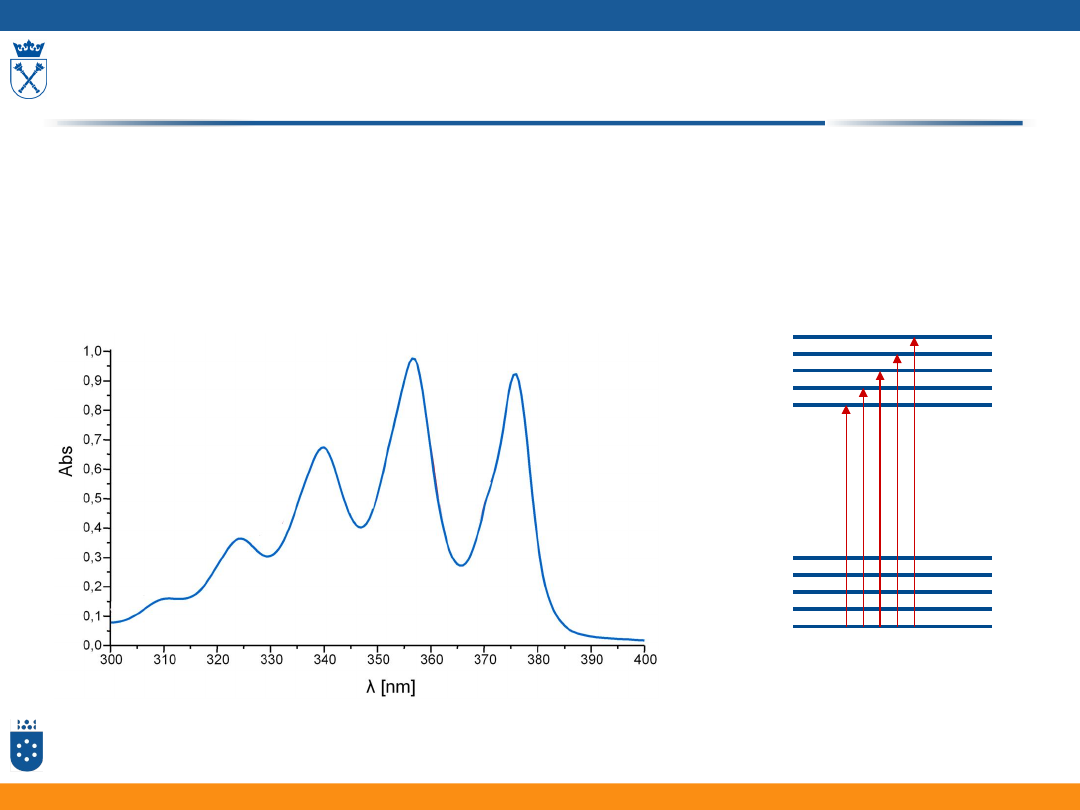
Widma oscylacyjne cząsteczek w fazie ciekłej
• W większości przejścia obserwowane na widmach UV-Vis
są przejściami elektronowymi.
• Na widmie związków w fazie ciekłej nie można obserwować pasm przejść rotacyjnych.
• W pewnych warunkach można otrzymać widmo struktury oscylacyjnej związku chemicznego.
27
S
0
S
1

28
Ogólna charakterystyka widm
• Pełną
strukturę
pasm
elektronowo-oscylacyjno-
rotacyjnych można obserwować tylko dla substancji w
fazie gazowej pod zmniejszonym ciśnieniem.
• W FAZIE CIEKŁEJ:
• rotacje są zahamowane
• składowe oscylacyjne są szerokie i poszczególne pasma
zlewają się ze sobą
• pasma elektronowe są szerokie i rozmyte

29
Typy przejść elektornowych
• Przejścia z przeniesieniem ładunku
Pochłonięcie fotonu powoduje przeniesienie elektronu z
jednej molekuły (donor) na inną (akceptor)
• LMCT
• MLCT
• MMCT
• MSCT
• …
• Przejścia typu d-d

30
Przejścia z przeniesieniem ładunku
• Po absorpcji fotonu elektron ulega przemieszczeniu w
obrębie cząsteczki
• Wiązanie liganda przez jon metalu pociąga za sobą
pojawienie się nowego pasma. Jest ono zwykle przesunięte
względem widma składników w stronę wyższych długości fal.
• Tego typu przejścia są obserwowane dla:
• kompleksów jonów metali przejściowych – przeniesienie
elektronu metal ligand
• halogenków metali alkalicznych w stanie gazowym
• jonów MnO
4
lub CrO
22
– przeniesienie elektronu typu n(tlenu)
* (metalu)
• Pasma tego typu są zazwyczaj bardzo szerokie i mają dużą
intensywność

31
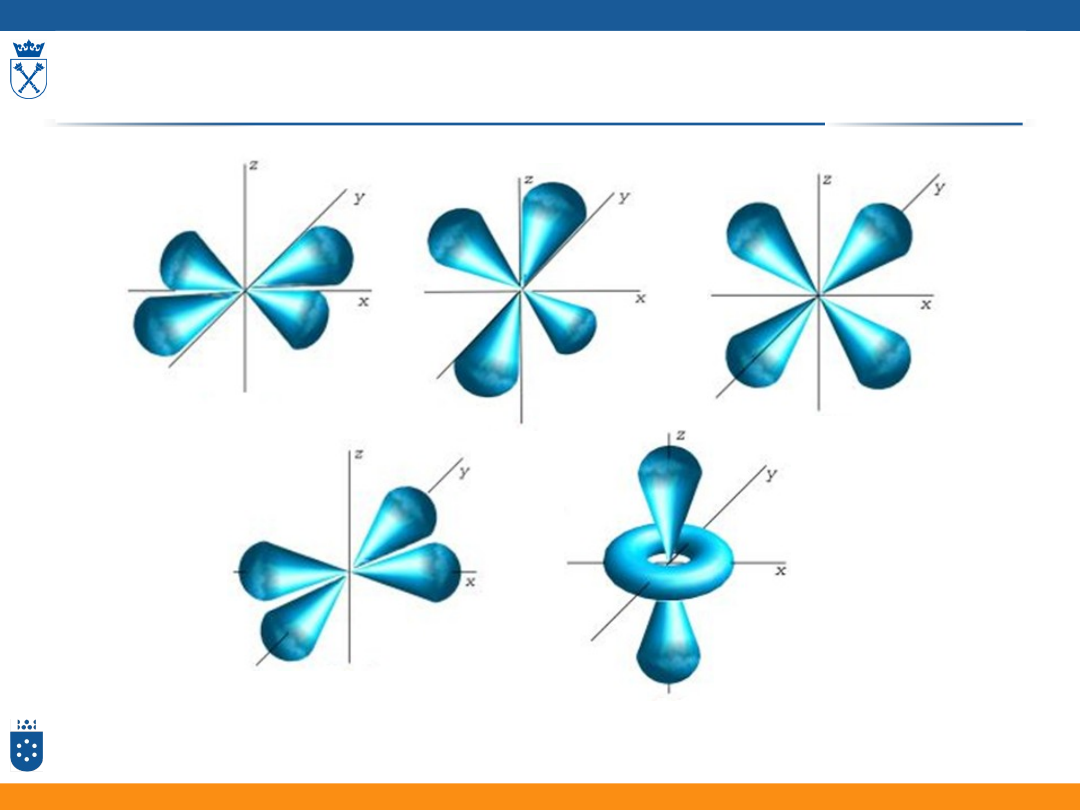
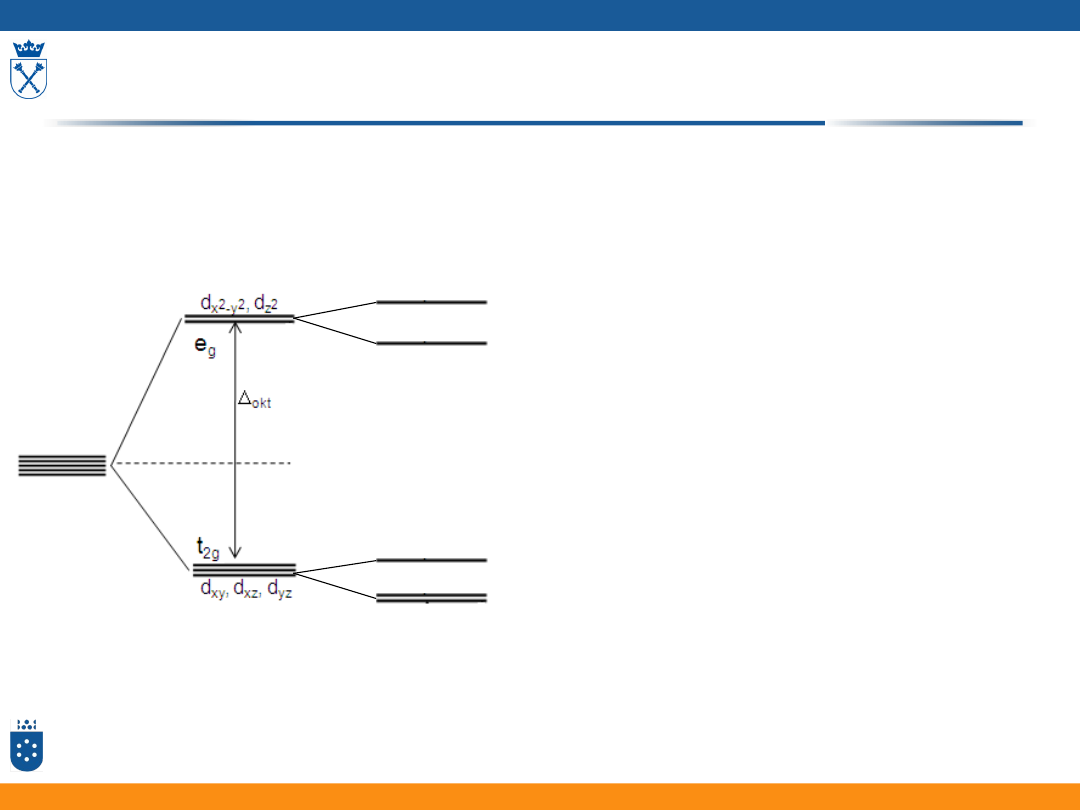
ORBITALE W POLU KRYSTALICZNYM
LIGANDÓW
Spektroskopia kompleksów metali przejściowych
32
Kształty orbitali d
rysunek pobrano ze strony:
http://www.uni-graz.at/exp2www/Physik-HAKB/start.html
d
xy
d
yz
d
xz
d
x2-y2
d
z2
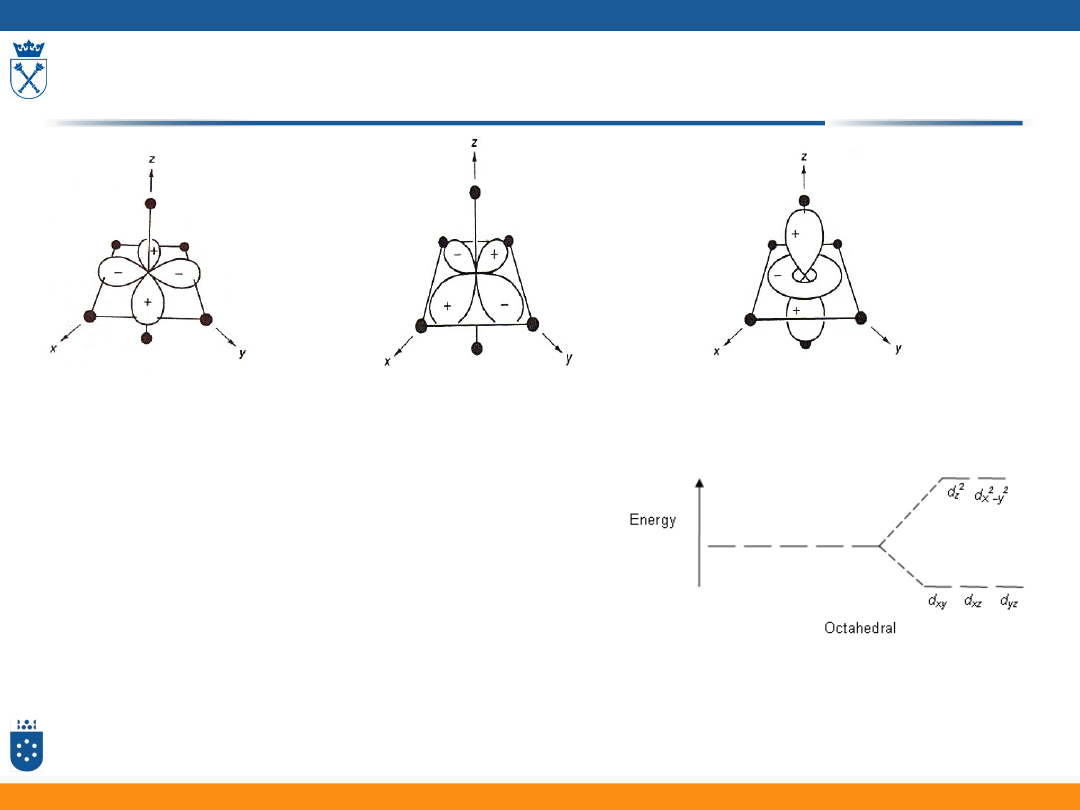
Orbitale d w oktaedrycznym polu ligandów
• Oddziaływanie poszczególnych orbitali d metalu
z orbitalami ligandów nie jest jednakowe
• Orbitale d w oktaedrycznym polu ligandów
dzielą się na dwa zespoły orbitali o różnej
energii:
• 3 orbitale mają energię niższą
• 2 orbitale mają energię wyższą
33
rysunki: Fizyczna chemia nieorganiczna, S.F.A Kettle, Wydawnictwo Naukowe PWN, Warszawa 1999
d
xy
analogicznie d
yz
oraz d
xz
d
x2-y2
d
z2
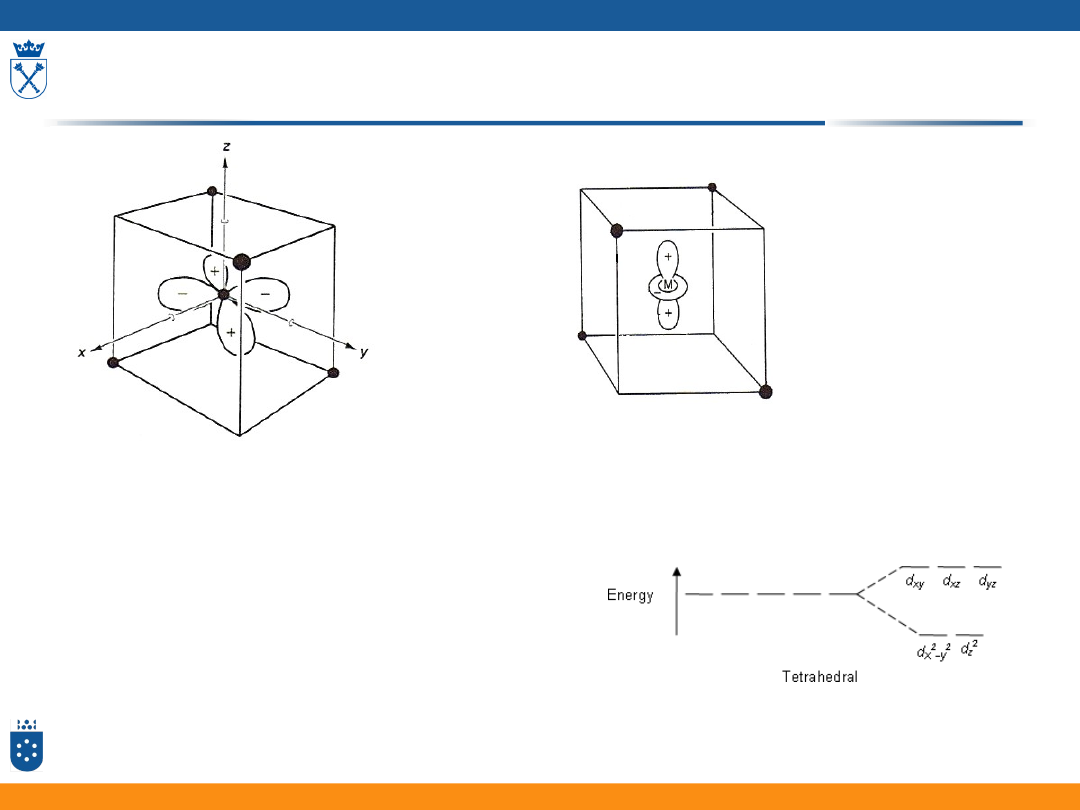
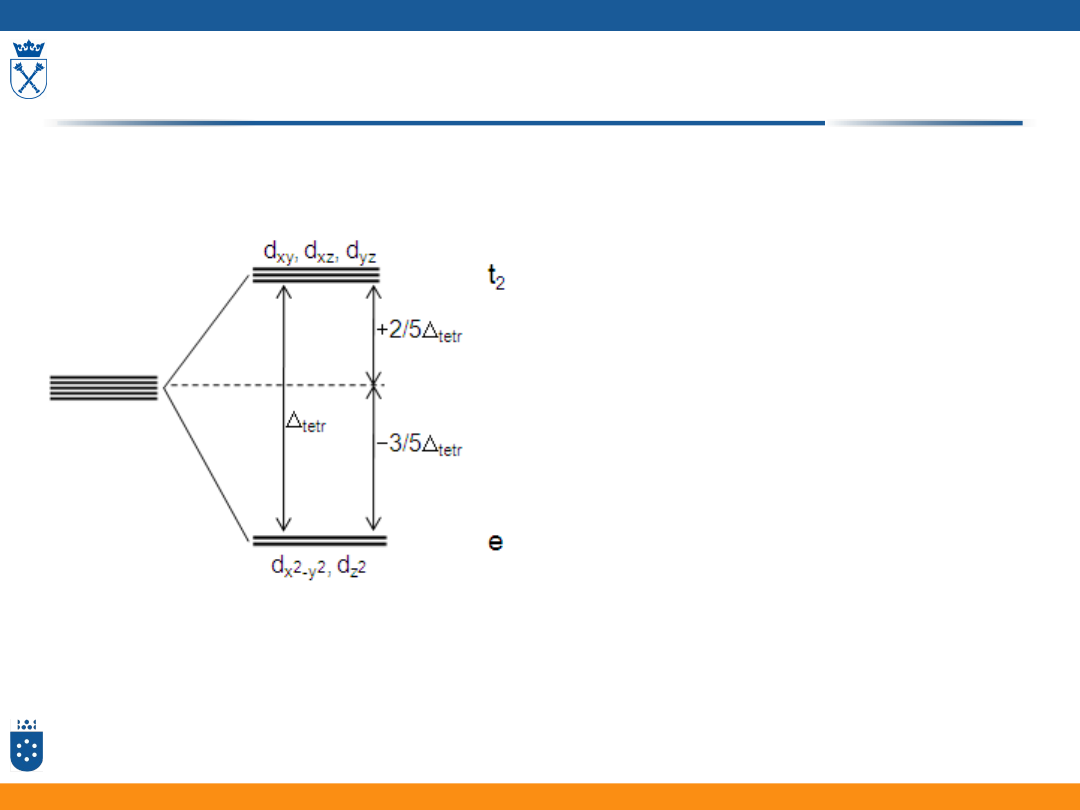
Orbitale d w tetraedrycznym polu ligandów
• Oddziaływanie poszczególnych orbitali d metalu
z orbitalami ligandów nie jest jednakowe
• Orbitale d w tetraedrycznym polu ligandów
dzielą się na dwa zespoły orbitali o różnej
energii:
• 2 orbitale mają energię niższą
• 3 orbitale mają energię wyższą
34
rysunki: Fizyczna chemia nieorganiczna, S.F.A Kettle, Wydawnictwo Naukowe PWN, Warszawa 1999
analogicznie d
yz
oraz d
xz
d
xy
d
z2
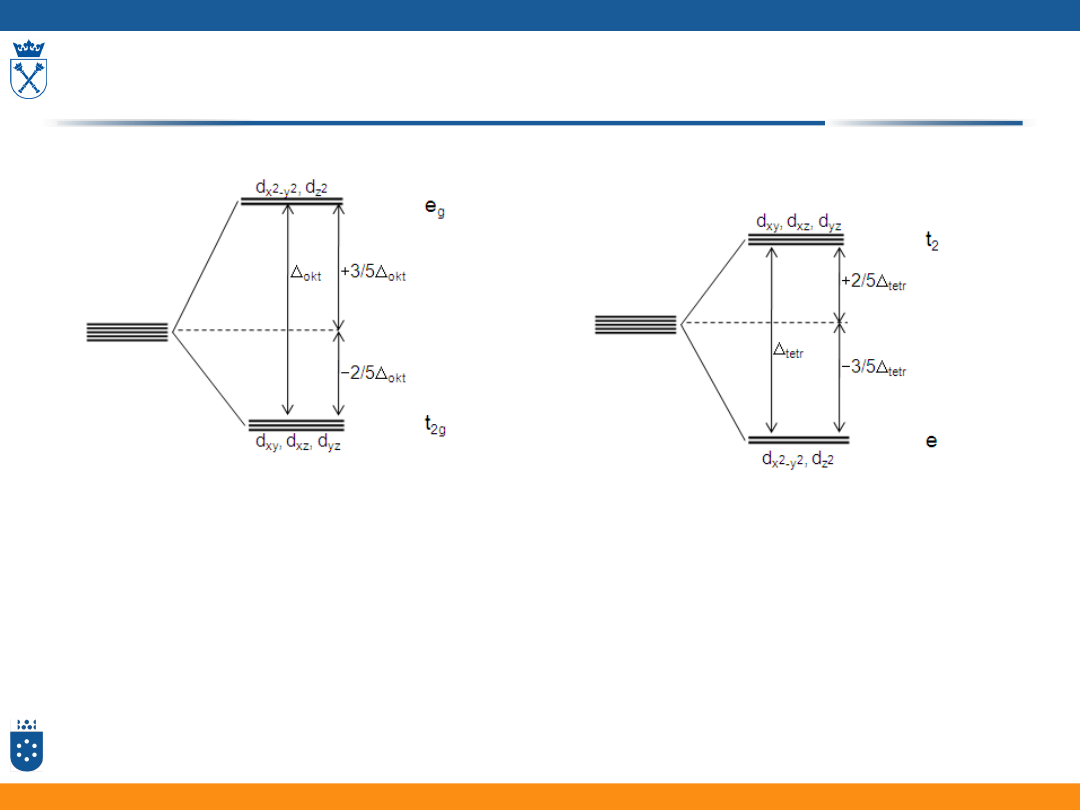
Rozszczepienie orbitali d w polu ligandów
• Różnica energii orbitali d w polu oktaedrycznym jest większa niż
w tetraedrycznym:
tetr
= 4/9
okt
• Zależnie od siły pola ligandów kompleksu przyjmuje różne wartości
35
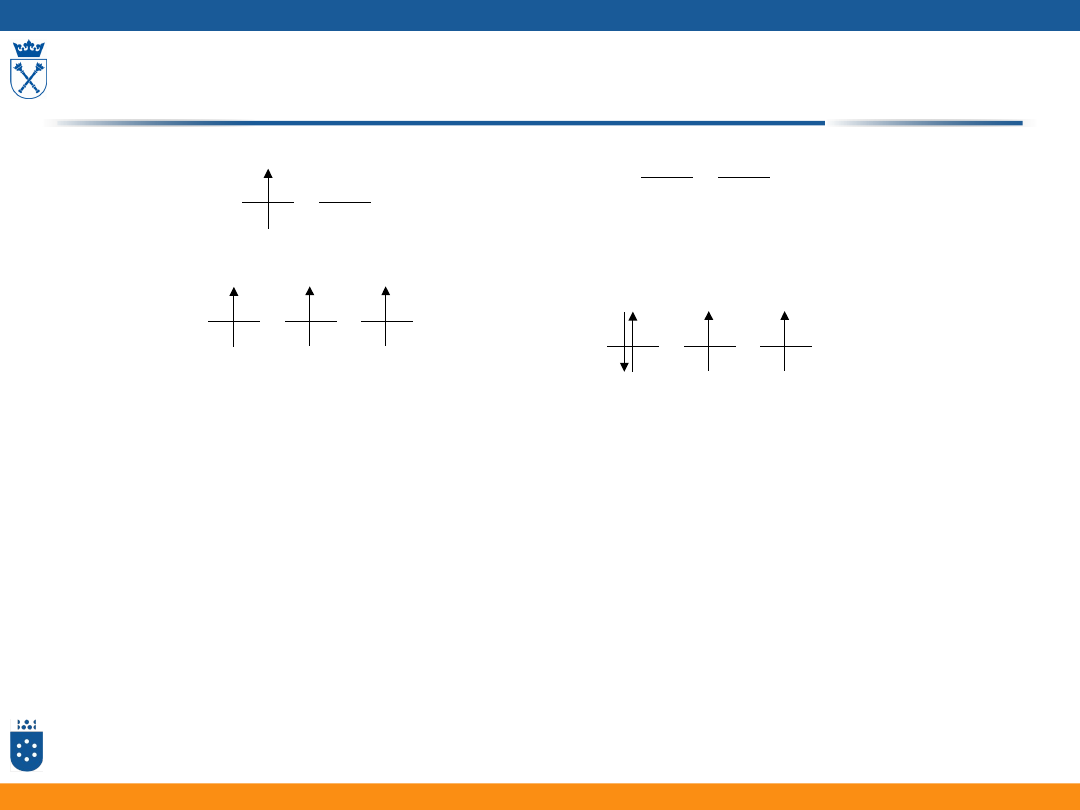
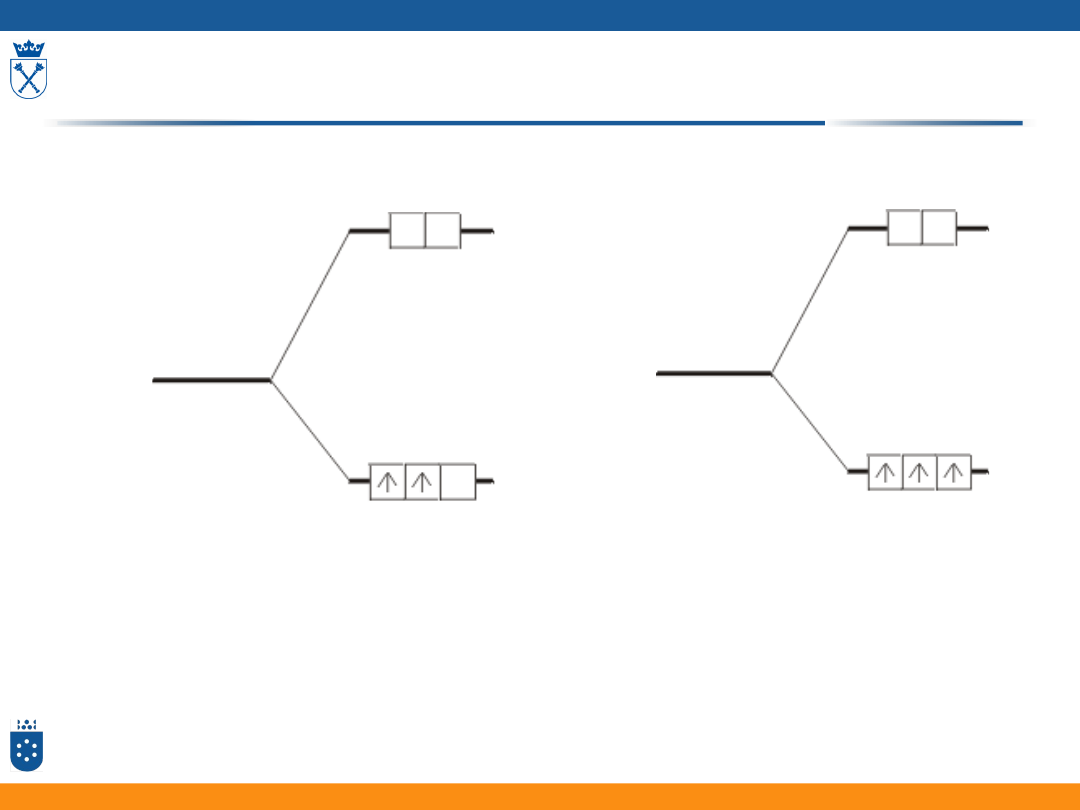
Konfiguracja wysokospinowa i niskospinowa
w oktaedrycznym polu ligandów
• Dla jonów o konfiguracji d
4
-d
7
możliwe dwa różne rodzaje
rozmieszczenia elektronów na rozszczepionych poziomach d
• Konfiguracje wysokospinowe występują dla małych wartości
• Konfiguracje niskospinowe występują dla dużych wartości
36
t
2g
e
g
t
2g
e
g
konfiguracja
wysokospinowa
konfiguracja
niskospinowa
37
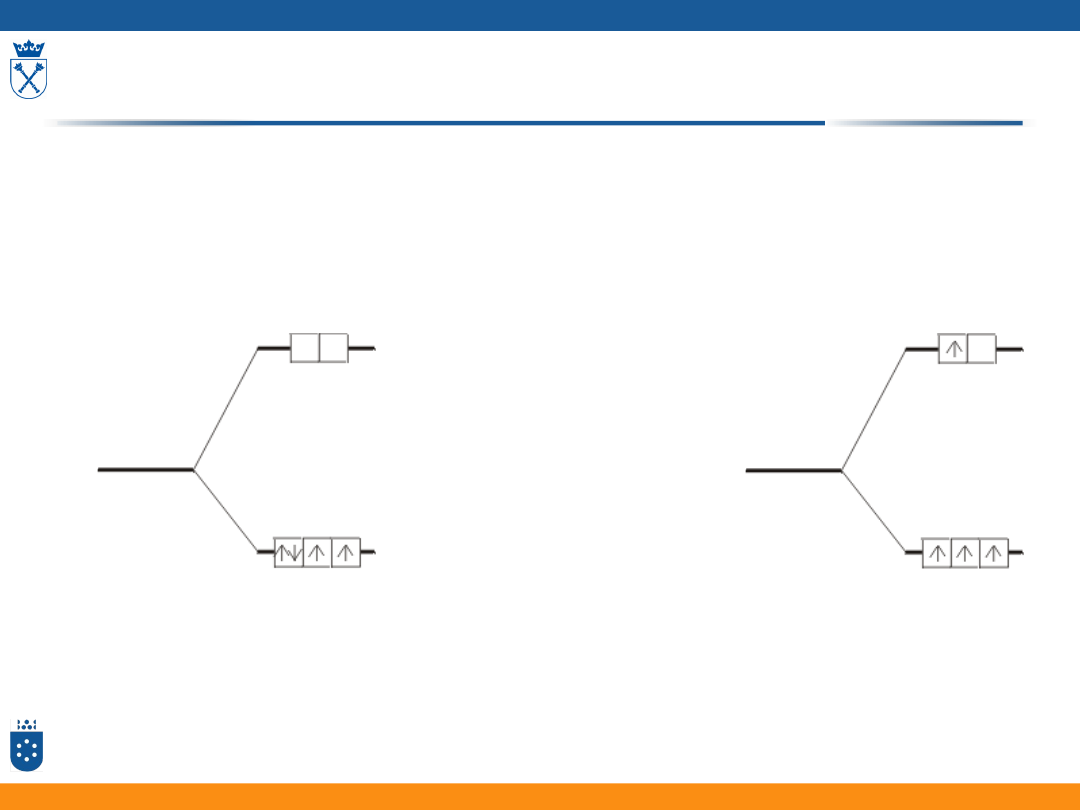
Konfiguracja wysokospinowa i niskospinowa
w tetraedrycznym polu ligandów
• Wartości rozszczepienia w
polu tetraedrycznym są
mniejsze niż w
oktaedrycznym
• Powstają zwykle kompleksy
wysokospinowe
• Konfiguracja niskospinowa
pojawia się rzadko
Przybliżenie słabego i silnego pola
[Ti
2+
]
3d
2
LFSE = 2 0.4
O
=
0.8
O
[V
2+
]
3d
3
LFSE = 3 0.4
O
=
1.2
O
[Cr
2+
] 3d
4
Silne pole
Konfiguracj
a
niskospino
wa
Słabe pole
Konfiguracja
wysokospinow
a
Konkurencja między
tendencją elektronów
do pozostawania
możliwie daleko od
siebie a tendencją do
obsadzania pustych
orbitali o
najmniejszej energii
Przybliżenie słabego i silnego pola

40
Od czego zależy wielkość
rozszczepienia w polu ligandów:
• wartość w kompleksach jonów danego okresu przejściowego o tej
samej wartościowości i z tymi samymi ligandami zmienia się w
stosunkowo wąskich granicach,
• wartość w kompleksach tego samego ligandu szybko rośnie ze
wzrostem wartościowości kationu,
• wartość w kompleksach tego samego ligandu rośnie
o ok. 30% przy przejściu od jonu metalu jednego okresu
przejściowego do odpowiadającego mu jonu metalu następnego
okresu,
• najczęściej spotykane ligandy można uszeregować według
wzrastającego pola ligandów tak, by wzrastało w sposób
praktycznie niezależny od rodzaju kationu.
I
–
< Br
–
< Cl
–
< F
–
< OH
–
<H
2
O < NH
3
< NO
2–
< CN
–

Konfiguracja wysoko- i niskospinowa - ćwiczenie
Jaka jest preferowana konfiguracja orbitali d dla
metalu w poniższych kompleksach? (wysoko- czy
niskospinowa).
• [MnCl
6
]
4
• [Mn(CN)
6
]
4
• [MnCl
4
]
2
41
oktaedryczny wysokospinowy
oktaedryczny niskospinowy
tetraedryczny

Parametry rozszczepienia pola ligandów
[CoX(NH
3
)
5
]
n+
X = I
-
, Br
-
, Cl
-
, H
2
O i
NH
3
[CoI(NH
3
)
5
]
2+
głęboko purpurowy
[CoCl(NH
3
)
5
]
2+
różowy
[Co(NH
3
)
6
]
3+
żółty
Wzrost energii przejścia elektronowego o
najniższej energii, a więc wzrost
O
ze zmianą
liganda w serii

1. wartości
O
wzrastają ze wzrastającym
stopniem utlenienia metalu
[Ru(OH
2
)
6
]
2+
O
= 19 800 cm
-1
[Ru(OH
2
)
6
]
3+
O
= 28 600 cm
-1
2. wartości
O
wzrastają w dół grupy:
3d < 4d < 5d
44
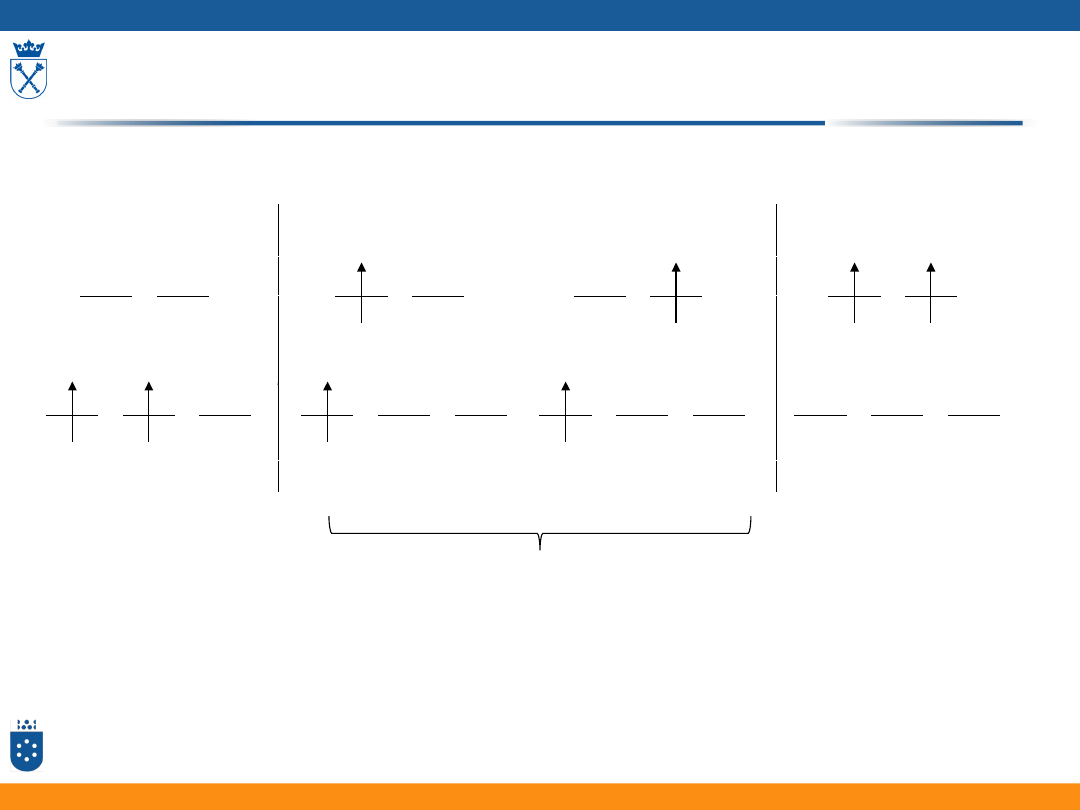
Rozmieszczenie elektronów
w oktaedrycznym kompleksie o konfiguracji d
2
t
2g
e
g
t
2g
2
t
2g
1
e
g
1
e
g
2
wzbudzenia jednoelektronowe wzbudzenie
dwuelektronowe
stan podstawowy

Przejścia d-d
• Pasma d-d dla kompleksów oktaedrycznych mają niską
intensywność
• Przejścia d-d w kompleksach oktaedrycznych są
zabronione ze względu na symetrię (reguła Laporte’a)
• Pasma tych przejść pojawiają się dzięki chwilowym
deformacjom symetrii kompleksu na skutek oscylacji
ligandów
• Dla kompleksów tetraedrycznych nie obowiązuje reguła
Laporte’a
• Pasma d-d dla takich kompleksów mają większą
intensywność niż dla kompleksów oktaedrycznych
45

Energia termu - parametry Racah
Parametry Racah określają wpływ odpychania międzyelektronowego na
energię termów dla określonej konfiguracji.
Parametry Racah są ilościowym wyrażeniem reguły Hunda
i odstępstw od niej.
Energia termu: kombinacja liniowa 3 parametrów Racah A, B i C np. dla
konfiguracji d
2
:
E(
1
S) = A + 14B + 7C
E(
1
G) = A + 4B + 2C
E(
1
D) = A - 3B + 2C
E(
3
P) = A + 7B
E(
3
F) = A - 8B
Energia przejścia między poziomami
3
P i
3
F:
E(
3
P) - E(
3
F) = 15 B
C > 5B
3
F <
3
P <
1
D <
1
G <
1
S
C < 5B
3
F <
1
D <
3
P <
1
G <
1
S
46
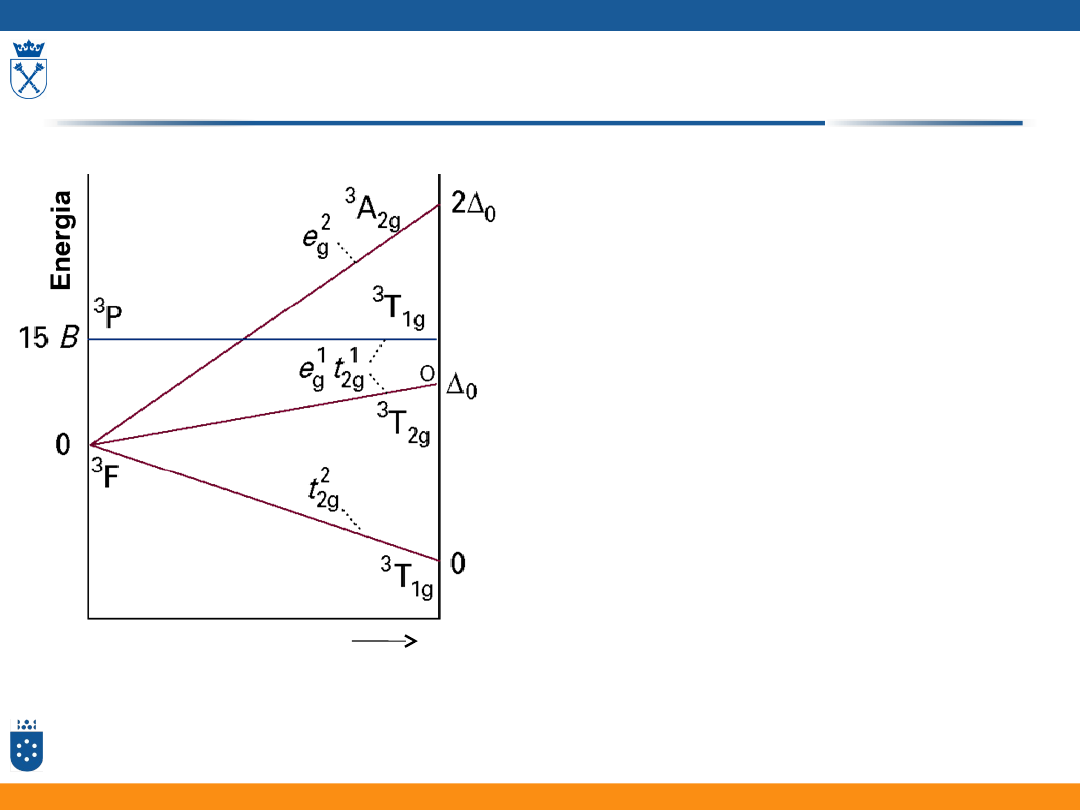
Energia termów w polu ligandów
• W polu ligandów energia
poszczególnych termów różnicuje się
• Energia termów zależy od mocy pola
ligandów
• Zmienia się sposób zapisu termów
• Symbole termów zależą od rodzajów
elementów symetrii danego układu
• Energia potrzebna do wzbudzenia
elektronów zależy od mocy pola
ligandów
47
diagram: Fizyczna chemia nieorganiczna, S.F.A Kettle, Wydawnictwo Naukowe PWN, Warszawa 1999
moc pola ligandów
Diagram dla konfiguracji d
2
w polu oktaedrycznym
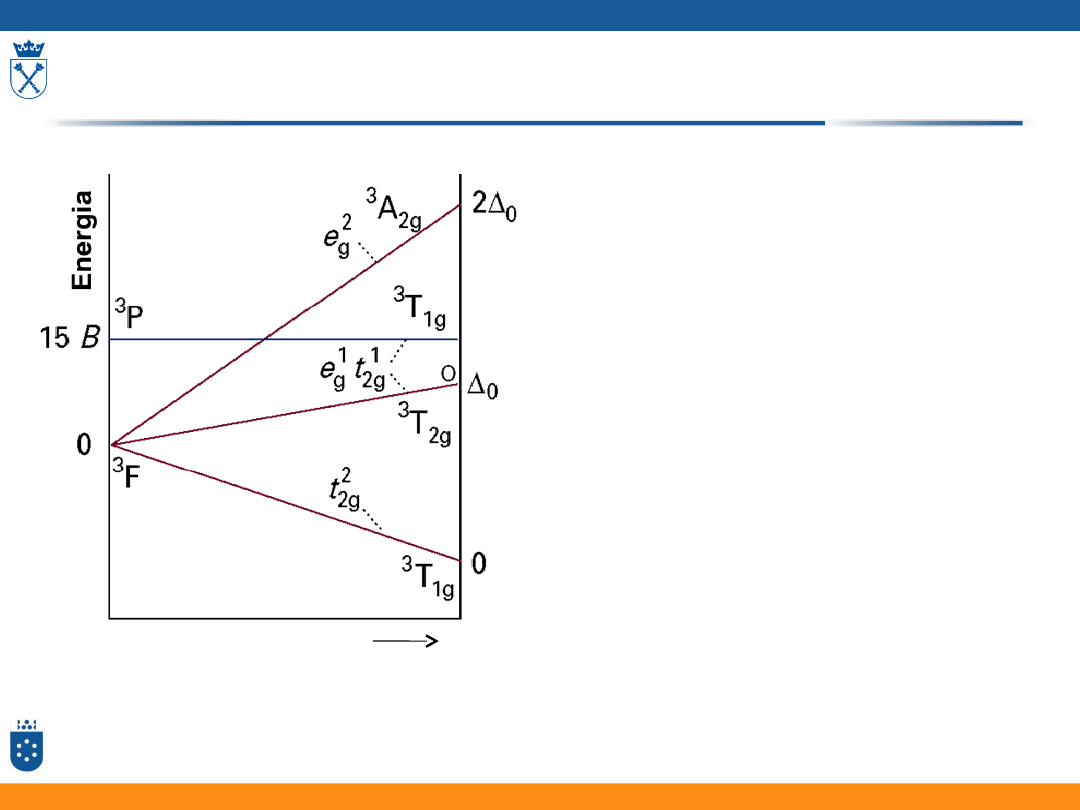
Diagramy Tanabe – Sugano
• Zależność energii poszczególnych
termów od mocy pola ligandów
przedstawiają tzw. diagramy Tanabe
– Sugano
• Parametry na osiach diagramu to:
• moc pola: /B
• energia: E/B
(gdzie B, to jeden z parametrów Racah)
• B oraz to tzw. parametry pola
ligandów
48
diagram: Fizyczna chemia nieorganiczna, S.F.A Kettle, Wydawnictwo Naukowe PWN, Warszawa 1999
moc pola ligandów
Diagram dla konfiguracji d
2
w polu oktaedrycznym
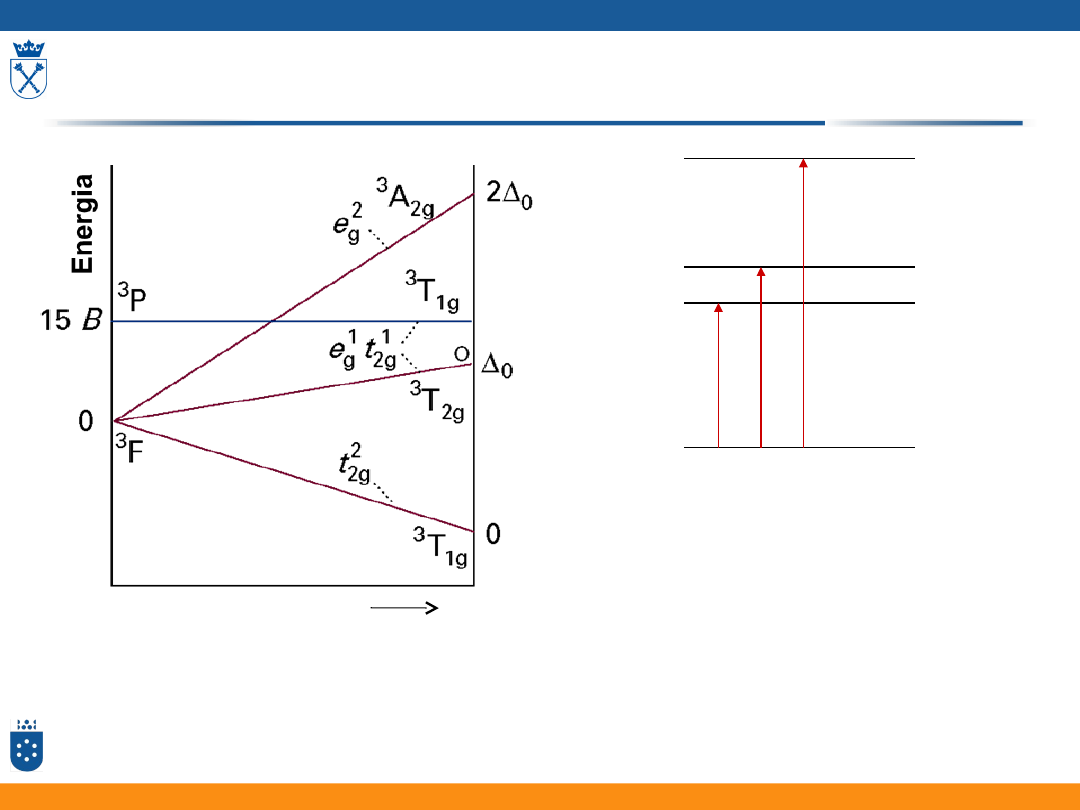
moc pola ligandów
49
Diagramy Tanabe – Sugano
Przejścia elektronowe
Z diagramu TS można odczytać,
że:
• Możliwe są 3 przejścia
elektronowe
• W zależności od mocy pola
ligandów przejścia wystąpią
przy innych długościach fali
diagram: Fizyczna chemia nieorganiczna, S.F.A Kettle, Wydawnictwo Naukowe PWN, Warszawa 1999
Diagram dla konfiguracji d
2
w polu oktaedrycznym
0
Δ
0
3
T
1g
2Δ
0
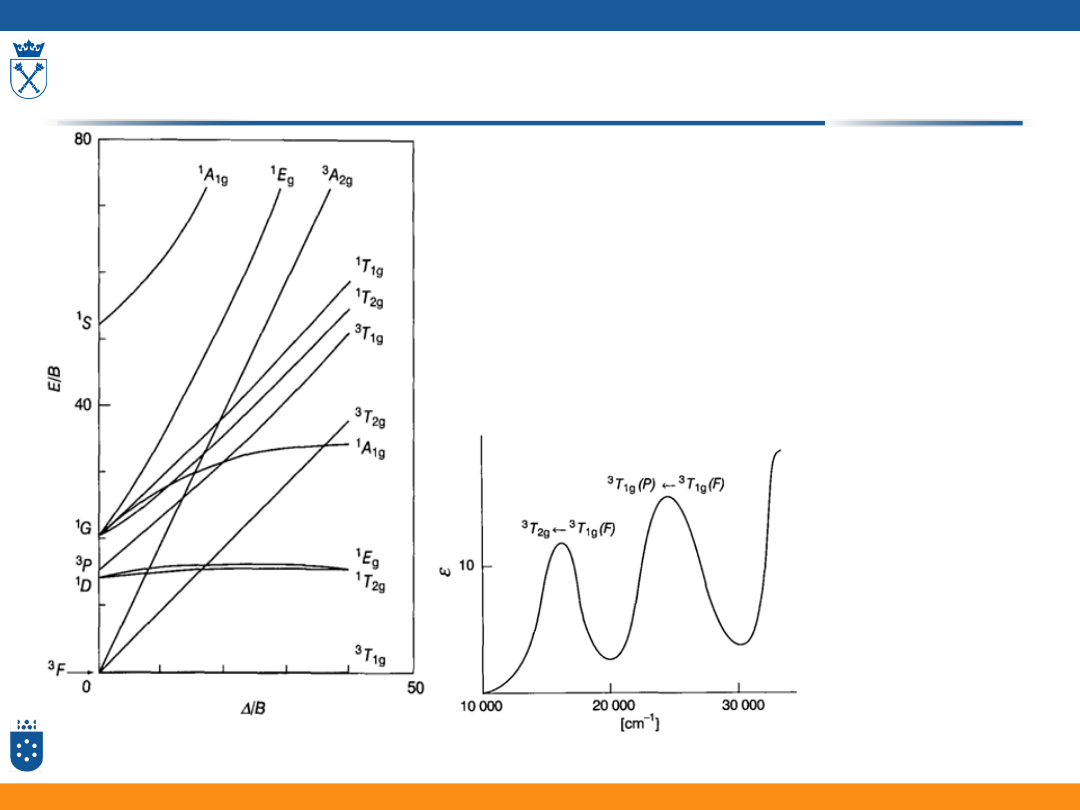
Diagramy Tanabe – Sugano
Widma przejść d-d
Dla znanych wartości parametru
rozszczepienia i B z diagramu TS
można odczytać energię
poszczególnych przejść,
a następnie obliczyć przy jakich
długościach fali pojawią się
pasma
50
diagram dla konfiguracji d
2
: Fizyczna chemia nieorganiczna, S.F.A Kettle, Wydawnictwo Naukowe PWN,
Warszawa 1999
Dwa przejścia d-
d w widmie
kompleksu
[V(mocznik)
6
]
3+
dla /B = 4,42

Diagramy Tanabe – Sugano
Reguła niekrzyżowania się termów
Jeśli wzrastające pole ligandów
powoduje zbliżanie się termów
słabego pola (niebieskie linie) to
one się nie krzyżują lecz
zmieszają (czerwone linie) i
zapobiegną przecięciu – termy o
tej samej symetrii
Zakrzywione linie na diagramach
Tanabe-Sugano są wynikiem
mieszania termów o tej samej
symetrii
51
moc pola ligandów
Stan 1
Stan 2
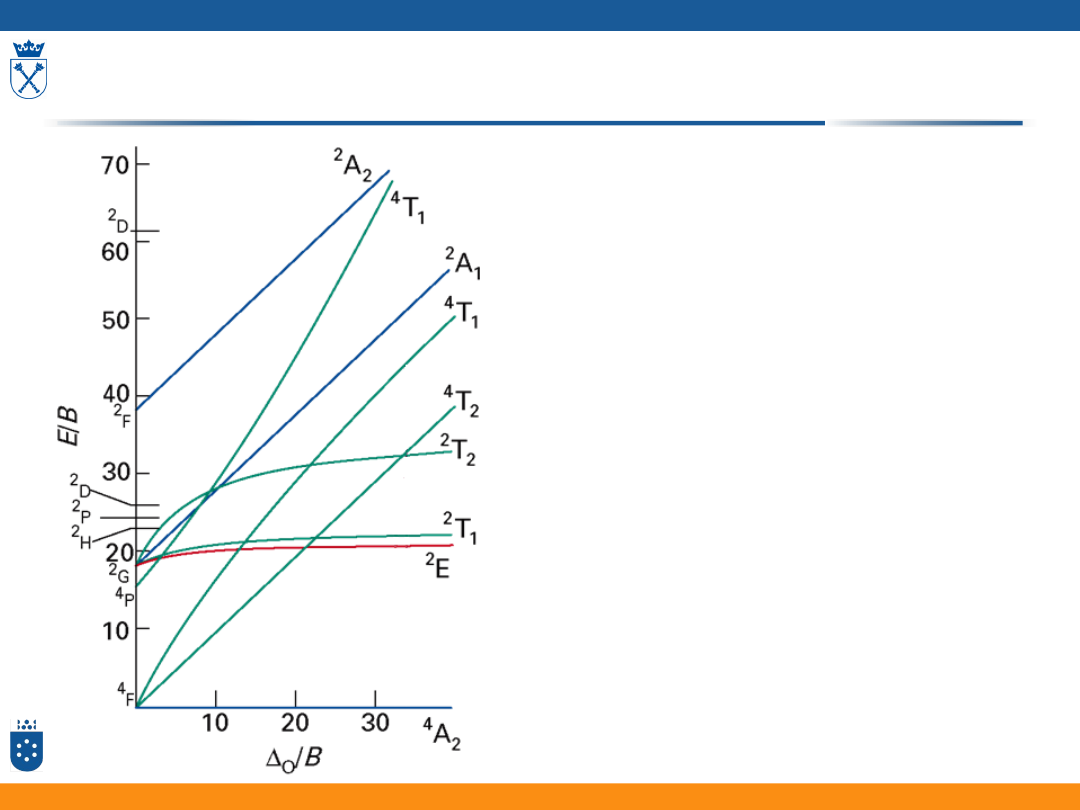
52
Korzystając z zamieszczonego
diagramu oblicz energię dwóch
pierwszych przejść kwartetowych
w widmie kompleksu
[Cr(H
2
O)
6
]
3+
,
dla którego:
Δ
O
= 17 600 cm
-1
i B = 700 cm
-1
Sposób rozwiązania:
1. Identyfikacja przejść:
4
T
2g
4
A
2g
E
1
=?
4
T
1g
4
A
2g
E
2
=?
2. Wyliczenie wartości Δ
O
/B
Δ
O
/B = 17 600/700 = 25.14
Wyznaczanie energii przejść z diagramu TS - Zadanie
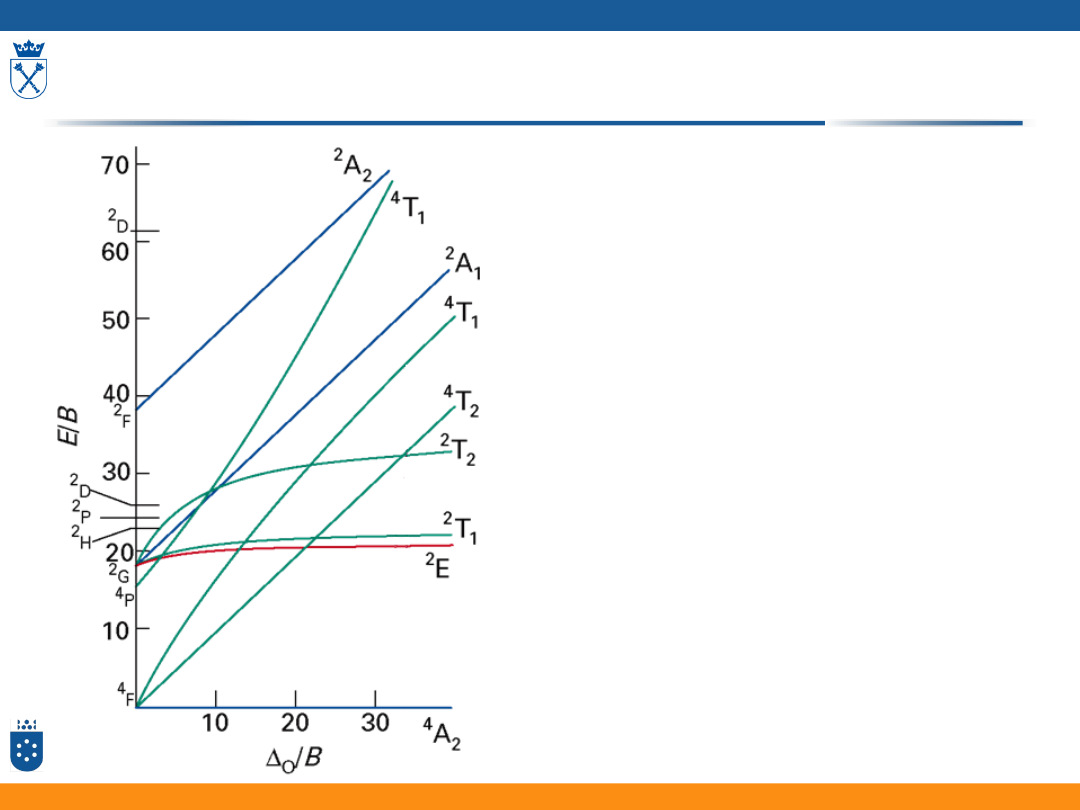
53
Korzystając z zamieszczonego
diagramu oblicz energię dwóch
pierwszych przejść
kwartetowych w widmie
kompleksu [Cr(H
2
O)
6
]
3+
,
dla którego:
Δ
O
= 17 600 cm
-1
i B = 700 cm
-
1
Sposób rozwiązania:
3. Odczytanie wartości E/B z
diagramu TS dla Δ
O
/B =
25.14:
E
1
/B =25 i E
2
/B =32
4.Obliczenie wartości energii:
E
1
= 25 700 = 17 500 cm
-1
E
2
= 32 700 = 22 400 cm
-1
Wyznaczanie energii przejść z diagramu TS - Zadanie
Rozszczepienie orbitali d
w kompleksach płaskich - kwadratowych
• Kompleksy płaskie-kwadratowe
wyprowadzane są z
oktaedrycznych, gdzie
płaszczyzna kwadratu to xy
• Trudno określić, która wartość to
• Nie ma jasnego związku
pomiędzy wartościami
poszczególnych rozszczepień
• Interpretacja widm tego typu
kompleksów jest skomplikowana.
54
e
g
b
2g
b
1g
a
1g

Efekt Jahna-Tellera
Jeśli konfiguracja elektronowa
stanu podstawowego cząsteczki
nieliniowej jest zdegenerowana, to
cząsteczka ulega deformacji
usuwając degenerację i uzyskując
niższą energię.
deformacja tetragonalna – efekt Jahna-
Tellera
deformacja płaska kwadratowa –
ekstremalny przypadek efektu Jahna-
Tellera

Widma elektronowe układów elektronów f
• W widmach lantanowców i aktynowców występują trzy
typy przejść elektronowych:
• f – f – wiele słabych, ostrych pasm w zakresie
promieniowania widzialnego i podczerwonego
• nf – (n+1)d – gdzie n to główna liczba kwantowa; pasma
szerokie o dużej intensywności
• ligand orbital f metalu (pasma CT) – intensywne,
szerokie pasma w zakresie nadfioletu
• W przypadku orbitali f rozszczepienie poziomów w polu
krystalicznym ligandów nie odgrywa znaczącej roli.
56
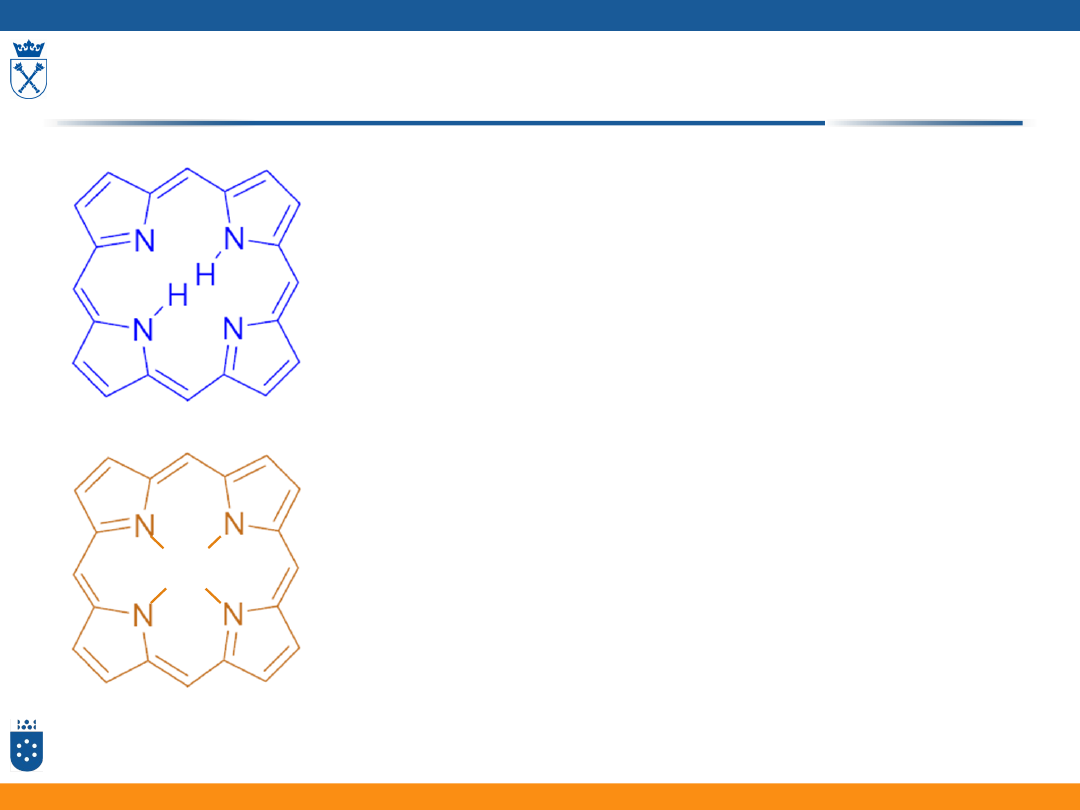
Porfiryny i metaloporfiryny
57
M
II
• Na widmach porfiryn można
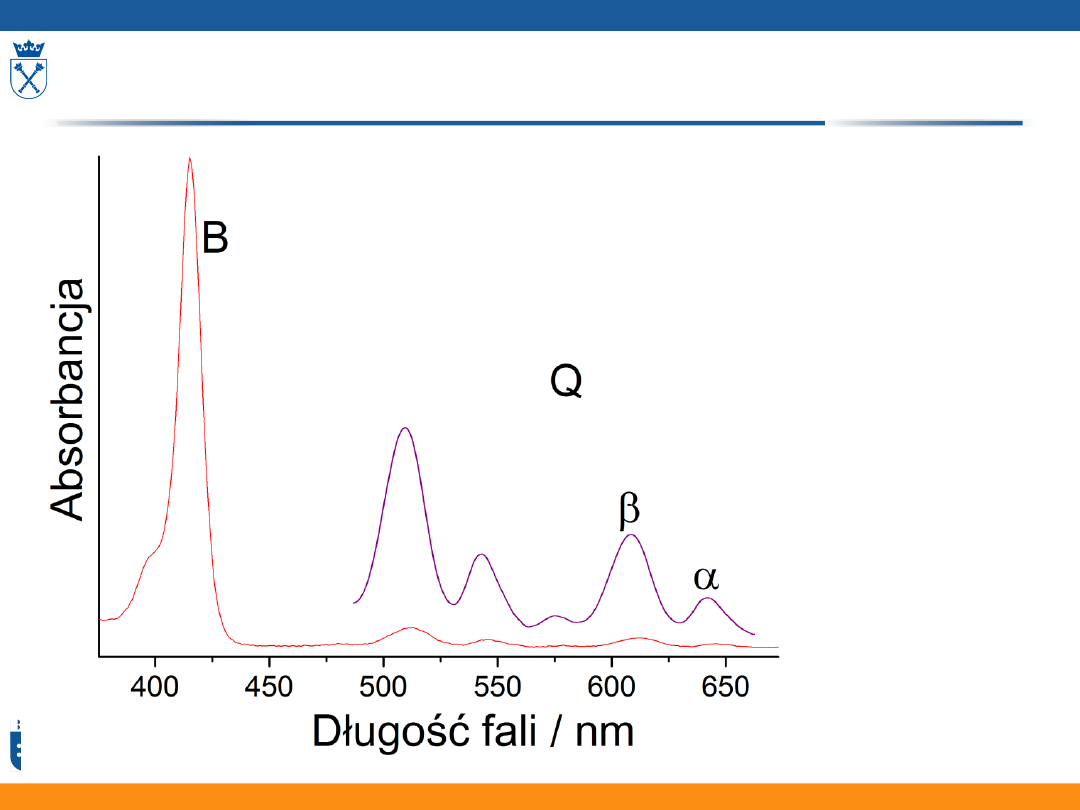
wyróżnić 3 zbiory pasm:
• Q – 450-700 nm – zwykle 2 - 4
pasma
• B – tzw. pasmo Soreta – 380-400
nm – najbardziej intensywne
• N, L, M – 215-325 nm – niezbyt
intensywne, ich położenie zależy
od rozpuszczalnika
• Są to głównie przejścia → *
Porfiryny i metaloporfiryny
58
Zmiana symetrii z D
2h
(H
2
P) na D
4h
(MP)
prowadzi do uproszczenia widma UV-Vis.
Zmniejsza się liczba pasm Q wskutek
pojawienia się degeneracji poziomów LUMO.
59
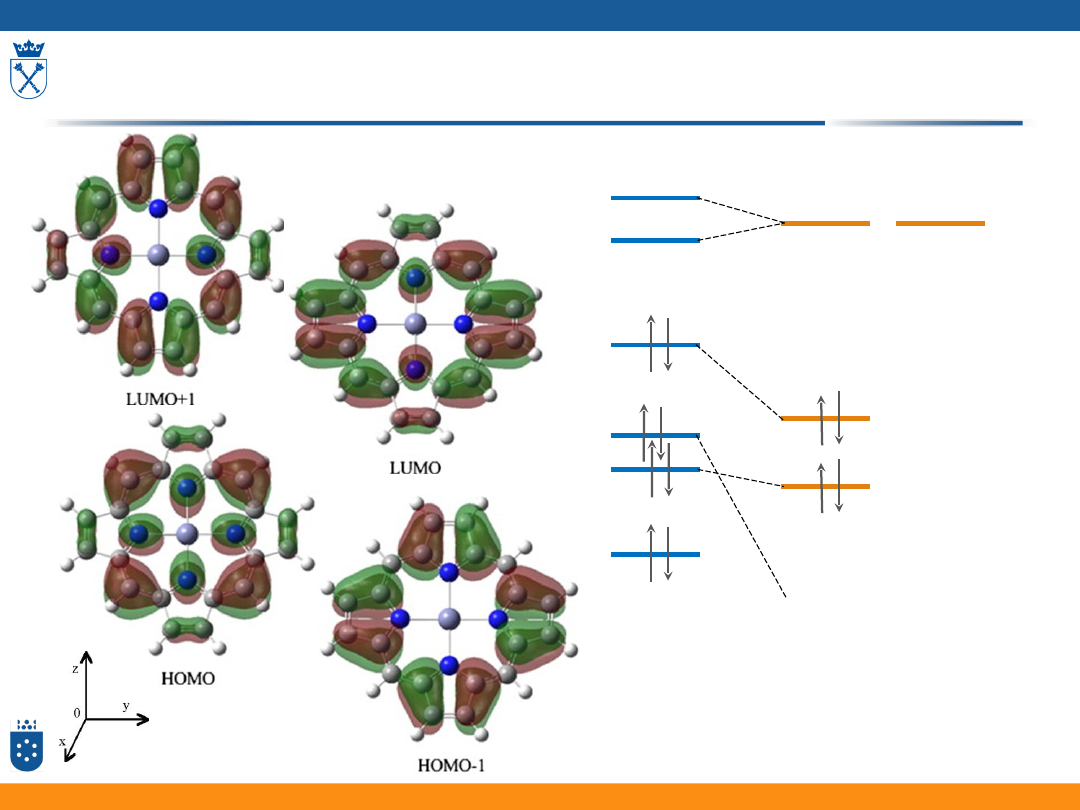
Porfiryny i metaloporfiryny
e
g
(π*)
a
2u
(π)
a
1u
(π)
H
2
P
(D
2h
)
M
II
P
(D
4h
)
(a
2u
)
2
(e
g
)
0
→ (a
2u
)
1
(e
g
)
1
(a
1u
)
2
(a
2u
)
2
(e
g
)
0
→ (a
1u
)
1
(a
2u
)
2
(e
g
)
1
Model czterech orbitali Goutermana
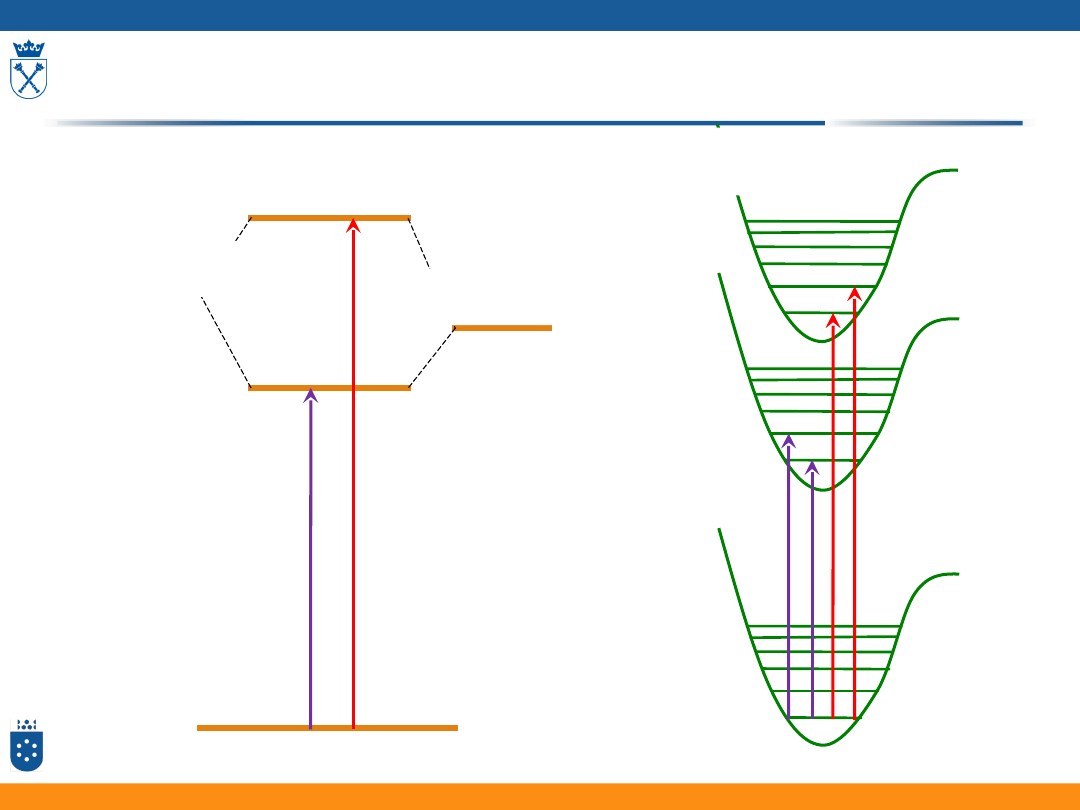
Porfiryny i metaloporfiryny
S
0
S
1
S
2
(a
1u
)
1
(a
2u
)
2
(e
g
)
1
(a
1u
)
2
(a
2u
)
2
(a
1u
)
2
(a
2u
)
1
(e
g
)
1
Pa
sm
o
Q
(
α
)
Pa
sm
o
B
(
S
o
re
ta
)
S
0
S
1
S
2
S
o
re
t
α
β
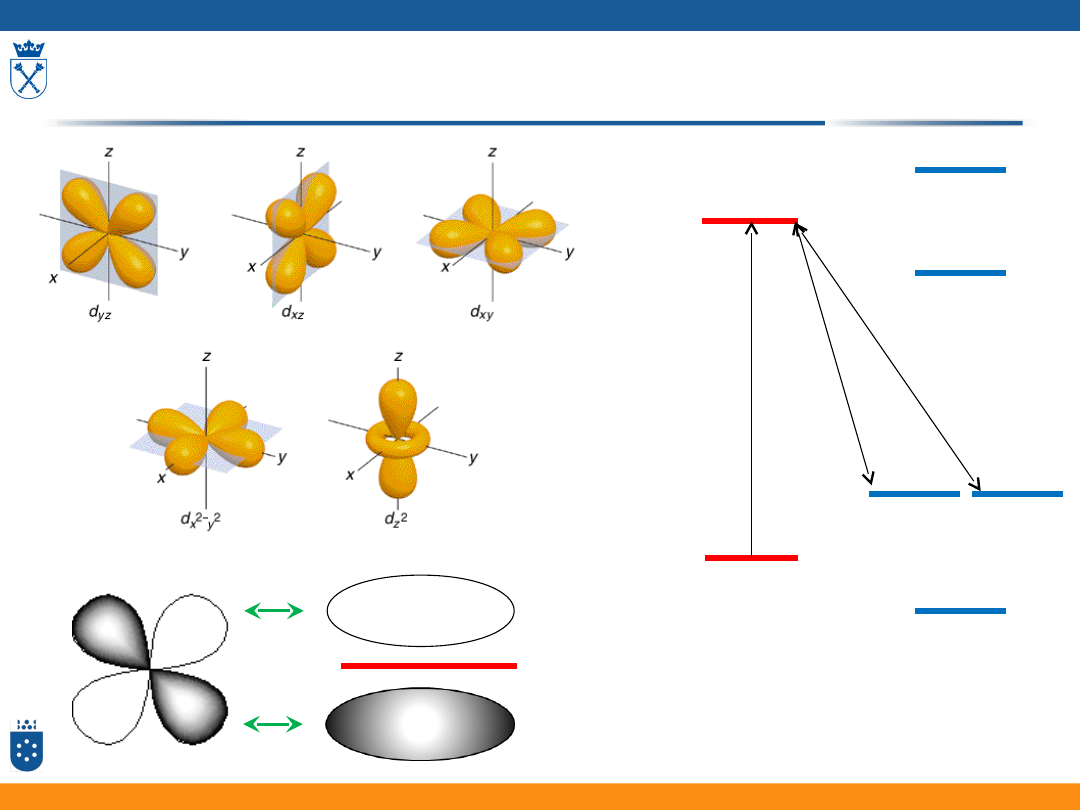
Porfiryny i metaloporfiryny
61
d
x
2
-d
y
2
d
z
2
d
xz
d
yz
d
xy
π
π*
ΔE
d
π
•
Kompleksy
niskospinowe
wykazują
ostrzejsze
pasma
absorpcyjne
niż
kompleksy wysokospinowe.
•
Dla kompleksów wysokospinowych (np.
Fe(II)-porfiryna) można obserwować pasma
CT w podczerwieni.
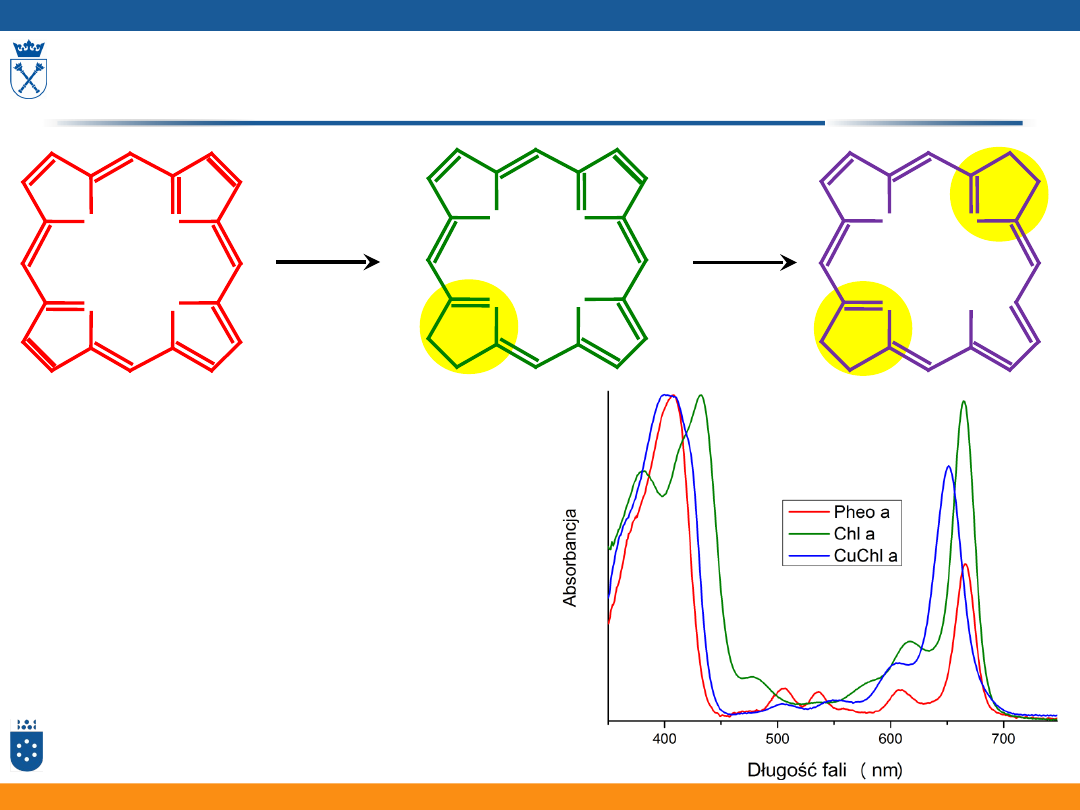
Porfiryny i metaloporfiryny
62
+ 2e
–
+ 2e
–
N
NH
N
N
H
porfiryna
NH
N
N
H
N
chloryna
N
NH
N
N
H
bakteriochloryna
Niezależnie od metalu, zmiany
struktury elektronowej
pierścienia tetrapirolowego
pociągają za sobą zmiany
symetrii:
P >> Chl < BChl
Wynikiem tych zmian jest
zwiększenie intensywności
pasma α.

Absorpcja i emisja porfiryn
Absorpcja
Emisja
Metal
Regularne
Fluorescencyjne
Φ
f
> 10
-3
, Φ
em
> 10
-3
Mg(II), Zn(II), Cd(II),
Sn(IV), Al(III)
Nieregularne – hipso
Fosforescencyjne
Φ
f
< 10
-4
, Φ
em
> 10
-3
Pd(II), Pt(II), Ru(II),
Os(II), Rh(III)
Nieregularne - hipso
Nie emitujące
Φ
em
< 10
-4
Co(II), Ni(II), Fe(II),
Fe(III), Ag(III)
Nieregularne – hiper
Nie emitujące
Φ
em
< 10
-4
Sn(II), Pb(II), Sb(III),
Bi(III), Mn(III), Mo(V),
W(V)
Nieregularne - hiper
Luminescencyjne
Φ
em
> 10
-4
Cr(III)
Kompleksy tetrapirolowe z jonami metali otwartopowłokowych bardzo
słabo
lub
w ogóle nie wykazują emisji fuorescencji/fosforescencji.
63

64
Literatura:
• „Podstawy spektroskopii molekularnej” Z. Kęcki,
Wydawnictwo Naukowe PWN, Warszawa 1998
• „Fizyczna chemia nieorganiczna” S.F.A Kettle,
Wydawnictwo Naukowe PWN, Warszawa 1999
• „Chemia nieorganiczna - podstawy” F.A. Cotton,
G. Wilkinson, P.L. Gaus, Wydawnictwo Naukowe PWN,
Warszawa 1995
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
Wyszukiwarka
Podobne podstrony:
Seminarium 2012 13
Biotechnologia zamkniete użycie (2012 13)
Algebra liniowa i geometria kolokwia AGH 2012 13
kol zal dod pop algebra ETI 2012 13
zestawienie fakultetow 2012 13 Nieznany
cw2 tip 2012 13
analityka podstawy spektroskopii 2012 2013
17 rzs 2012 13 net wersja pods Nieznany (2)
12skaly osadowe 2012 13
Harmonogram V Farmacji 2012 13
E1 2012 13 zad 4 id 149133
9 10 pierwotne kzn 2012 13 net Nieznany (2)
harmonogram zajęć filmoznawstwo 2012-13, Filmoznawstwo
Szereg Fouriera przyklady, SiMR, Studia inżynierskie, Semestr II 2, Równania różniczkowe, 2012 13
2012 13 egzamin 2id 28112 (2)
E1 2012 13 zad 1 id 149130
E1 2012 13 zad 3 id 149132
lekarski KOLOIDY 2012 13
zagadnienia do egzaminu z Podstaw chemicznych, Studia, Chemia, Podstawy chemiczne nauk o Ziemi - dla
więcej podobnych podstron
