
Laboratoryjna
diagnostyka gruźlicy
Dr n. med. Aleksandra Safianowska
asafianowska@wum.edu.pl
Katedra i Klinika Chorób Wewnętrznych,
Pneumonologii i Alergologii
Warszawski Uniwersytet Medyczny
2012/13

M. tuberculosis complex
M. africanum (powszechny w Afryce)
•
M. africanum I (zach. Afryka, podobny do M. bovis),
•
M. africanum II (wsch. Afryka, podobny do M. tbc),
M. bovis
•
M. bovis subsp. bovis ( naturalnie oporny na
pyrazynamid),
•
M. bovis subsp. caprae (wrażliwy na pyrazynamid),
•
M. bovis BCG (szczepionka, terapia raka pęcherza),
M. canetti (Afryka, rzadko izolowany),
M. microti (u gryzoni),
M. pinnipedii (u fok),
M. tuberculosis.

*Ponad 140 gatunków
Podział prątków niegruźliczych*
wg
Runyona
PRĄTKI WOLNOROSNĄCE
(> 7 dni)
SZYBKO-
ROSNĄC
E
(<7 dni)
Typ I
Fotochromogen
ne
(zabarwienie
po
naświetleniu)
Typ II
Skotochromogen
ne
(silne
zabarwienie)
Typ III
Niechromogenne
(brak zabarwienia)
Typ IV
PATOGENNE
M. kansasii
M. marinum
M. interjectum
M. scrofulaceum
M. xenopi
M. avium
M. celatum
M. intracellulare
M. malmoense
M. xenopi
M.abscess
us
M.
chelonae
M.
fortuitum
NIEPATOGENNE
M. gordonae
M. flavescens
M.nonchromogenic
um
M.smegma
tis
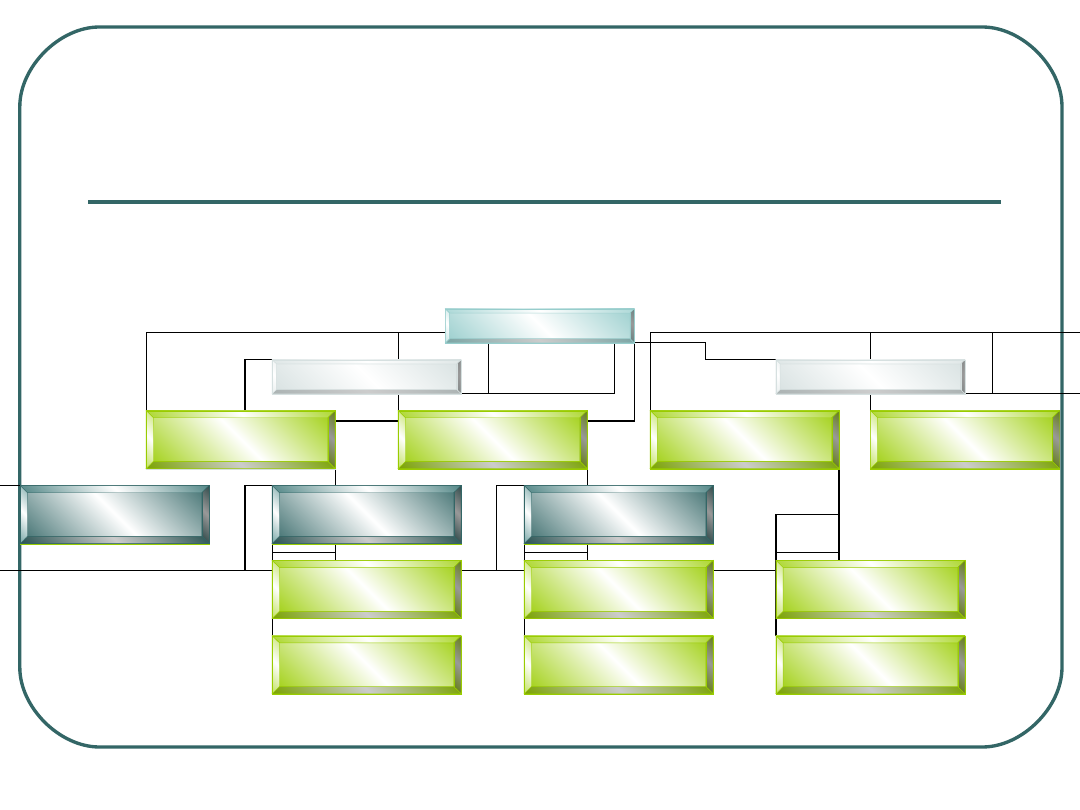
Próbka kliniczna
Bakterioskopia
Hodowla
Rozmaz
+
Rozmaz
-
Biologia
molekularna
MTBC
NTM
Biologia
molekularna
MTBC
Raczej nie
MTBC
Wzrost
Brak
wzrostu
MTBC
Mycobacterium sp.
HPLC lub
biologia molekularna
+
-
-
Procedura w laboratoryjnej
diagnostyce zakażeń
prątkowych
HPLC – Wysokosprawna
chromatografia cieczowa
MTBC – Mycobacterium tuberculosis
complex
NTM – Non-tuberculous Mycobacteria
+

Materiał kliniczny - gruźlica płuc
3 x Plwocina odkrztuszona spontanicznie (3-
5 ml)
•
Nie – ślina!
Plwocina indukowana NaCl (3-5%),
Materiał pobierany w trakcie bronchoskopii
•
Popłuczyny oskrzelowe,
•
Płyn z płukania oskrzelikowo-
pęcherzykowego (Bronchoalveolar Lavage
Fluid – BALF),
•
Po bronchoskopii można pobrać
dodatkową próbkę plwociny.
Popłuczyny żołądkowe (pediatria).

Materiał kliniczny - gruźlica
pozapłucna
Materiał z ogniska chorobowego lub
z najbliższych okolic,
W miarę możliwości pobrać materiał
w jałowych warunkach, co pozwoli
na pominięcie etapu dekontaminacji.
Nie – krew!
•
Z wyjątkiem gruźlicy rozsianej i u
chorych na AIDS.

Materiał kliniczny - gruźlica
pozapłucna cd.
•
Płyny wysiękowe (opłucnowy, osierdziowy,
otrzewnowy);
•
Wycinki tkanek (opłucnej, węzłów chłonnych, skóry)
•
Materiał biopsyjny należy zanurzyć w soli
fizjologicznej;
•
Próbki w formalinie, nie nadają się dla badania
bakteriologicznego.
•
Wydzieliny z przetok, niegojących się ran;
•
Mocz zebrany po nocy– badanie wielokrotne
próbek o objętości co najmniej 200 mL;
•
Płyn mózgowo-rdzeniowy.
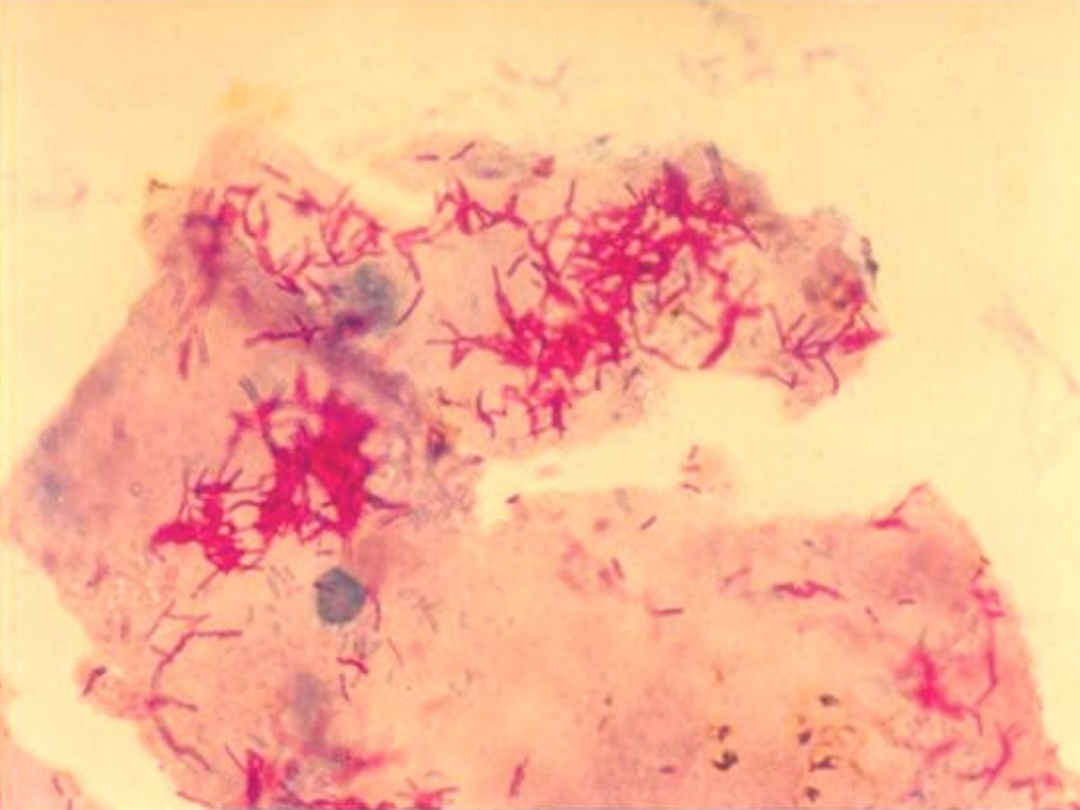
Bakterioskopia - barwienie
Ziehla-Neelsena
Wynik w czasie ≤ 24 godz.
Niska czułość (≥
10
4
bakterii/ 1ml).
Wynik negatywny nie wyklucza
gruźlicy!
Badanie nie różnicuje prątków MTBC
od NTM.
Dla próbek dodatnich zaleca się
badanie molekularne w celu
potwierdzenia lub wykluczenia MTBC.
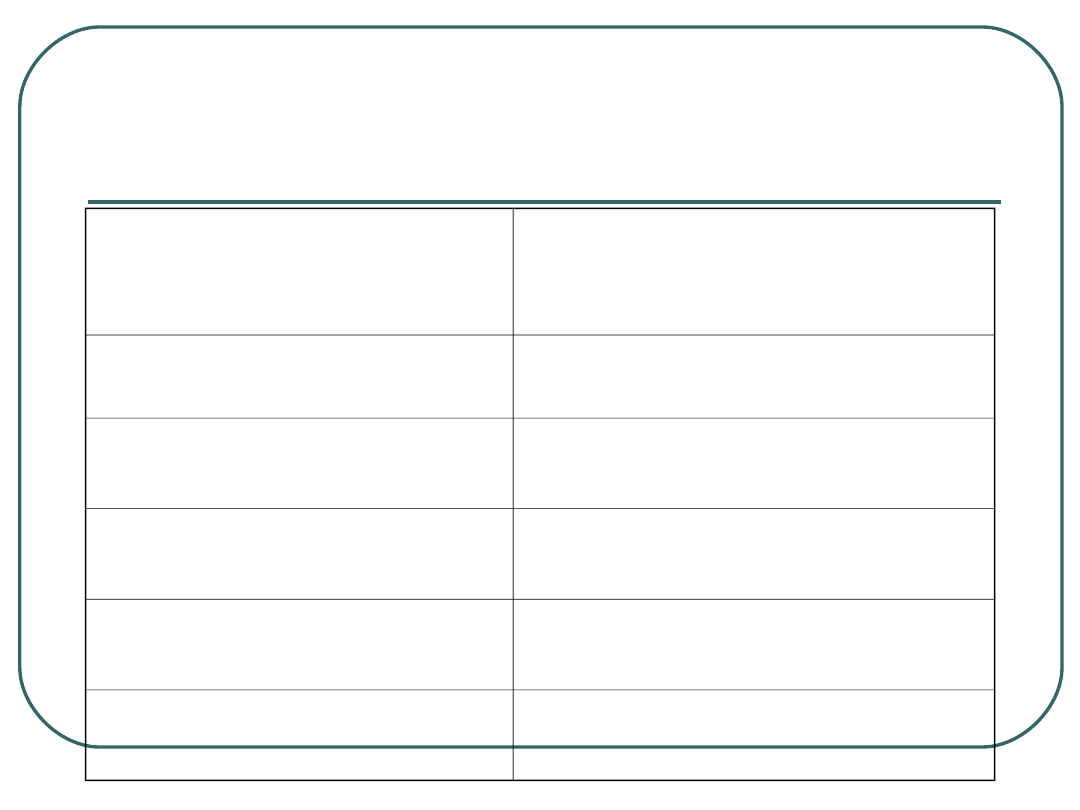
Wynik badania mikroskopowego
Liczba prątków w
barwieniu
Ziehla-Neelsena
Wynik i opis
0 lub 1-2/ 300 pól
widzenia
Negatywny
1-9/ 100 pól widzenia
+
Prątki sporadyczne
1-9/ 10 pól widzenia
++
Prątki nieliczne
1-9/ 1 pole widzenia
+++
Prątki średnioliczne
>9/ 1 pole widzenia
++++
Prątki liczne

Bezpośrednie testy molekularne
(Nucleic Acid Amplification Testing, NAAT)
Testy komercyjne mają porównywalną,
bardzo wysoką swoistość oraz
pozytywną wartość predykcyjną
(>95%).
Czułość testów należy oceniać w
połączeniu z wynikiem mikroskopii.
•
Dla próbek dodatnich w rozmazie, czułość
>98%;
•
Dla próbek ujemnych w rozmazie, czułość
znacznie niższa, ok. 50-70%.

Interpretacja testu molekularnego
w połączeniu z wynikiem rozmazu
NAAT dodatni
NAAT ujemny
Rozma
z
dodat
ni
Potwierdzenie
gruźlicy
Prawdopodobne
prątki niegruźlicze
(NTM)
Wskazane
powtórzenie NAAT
Rozma
z
ujemn
y
Gruźlica wysoce
prawdopodobna
Wskazane
powtórzenie NAAT
Gruźlica
małoprawdopodobna
,
ale niewykluczona !

NAAT wykonujemy gdy:
Istnieje silne podejrzenie procesu
swoistego,
W rozmazie obecne są prątki
kwasooporne,
W hodowli wyizolowano szczep
atypowy, szybkorosnący.
Nie wykonujemy NAAT w trakcie
leczenia przeciwprątkowego.

Hodowla prątków
Czułość 80-85% (10 bakterii/1 ml),
Możliwość typowania i wykonania
testów lekowrażliwości,
Podłoże Loewensteina-Jensena
•
Pożywka jajowa z zielenią malachitową
hamującą wzrost większości nieswoistych
drobnoustrojów.
Automatyczne systemy hodowlane

*Morgan et al. JCM1983,18
:384-8.
Automatyczne systemy hodowlane
Przykłady: BACTEC 460 TB, BACTEC MGIT 960
(obydwa: Becton Dickinson, USA), MB/BacT System
(BioMerieux, Francja);
Pożywka płynna (podłoże Middlebrooka 7H12/7H9),
automatyczny system monitoringu metabolitów
- zwiekszonego wydzielania
14
CO
2
(BACTEC 460
TB) lub zużycia O
2
(pozostałe systemy);
Wyższa czułość, w szczególności dla materiałów
ujemnych w badaniu mikroskopowym*;
Systemy automatyczne stosuje się tylko
równolegle z hodowlą klasyczną, gdyż zdarza
się, że unikalne szczepy M. tuberculosis rosną
wyłącznie na pożywce Loewensteina-Jensena.

Czas oczekiwania na wynik hodowli
Na podłożu stałym:
•
MTBC - średnio 3-4 tygodnie,
•
Wynik ujemny po minimum 8
tygodniach.
W systemach automatycznych:
•
MTBC – do 2 tygodni,
•
Wynik ujemny po 6 tygodniach.
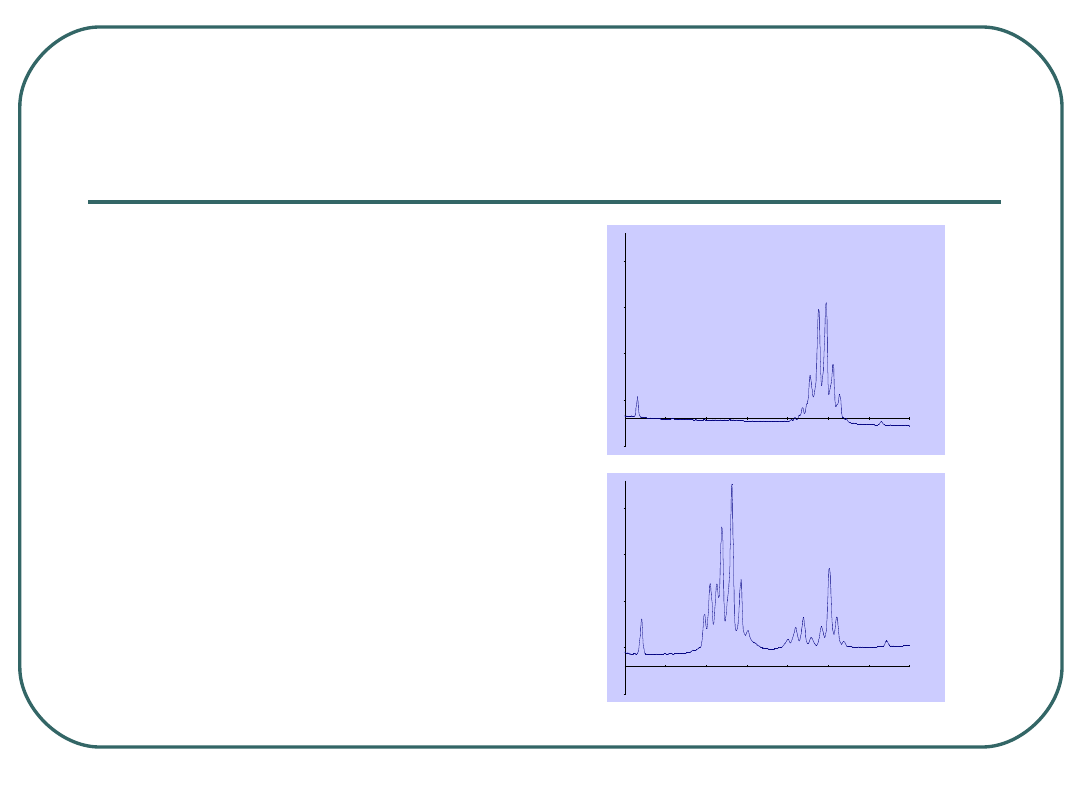
Typowanie prątków
Tradycyjne metody
biochemiczne, np.:
•
Test niacynowy, dodatni dla
M.tuberculosis, ujemny dla
M. bovis i pozostałych NTM,
Wysokosprawna
chromatografia cieczowa
(HPLC)
Metody genetyczne
-0,03
0,02
0,07
0,12
0,17
3
4
5
6
7
8
9
10
-0,03
0,02
0,07
0,12
0,17
3
4
5
6
7
8
9
10
M.tbc
M.avium
HPLC
HPL
C

Lekowrażliwość
Podstawowa, na leki pierwszego rzutu:
•
Streptomycyna (SM)
•
Izoniazyd (INH)
•
Ryfampicyna (RMP)
•
Etambutol (EMB)
•
Pyrazynamid (PZA)
Lekowrażliwość rozszerzona, gdy
•
Stwierdzono oporność na leki pierwszego rzutu,
•
Niepowodzenie/ przerwanie leczenia,
•
Nawroty choroby (hodowla+ po okresie
hodowli-),
•
Kontakt ze szczepem opornym.
Prątki niegruźlicze są naturalnie oporne na
leki pierwszego rzutu.

*W populacji polskiej, wśr
ód chorych wcześniej leczo
nych
Lekooporność
Lekooporność pierwotna – u chorych
nowowykrytych
Lekooporność wtórna - u chorych wcześniej
leczonych
Szczepy wielolekooporne typu MDR-TB
(multidrug resistant tuberculosis )
•
Oporne jednocześnie na INH i RMP;
•
Oporność na INH zazwyczaj poprzedza oporność na
RMP;
•
Oporność na RMP markerem oporności typu MDR*.
Szczepy extremalnie wielolekooporne typu
XDR-TB (extensively drug resistant tuberculosis)
•
Oporne na INH, RMP, fluorochinolon i co najmniej
jeden z dwóch leków: amikacynę lub kapreomycynę.

Molekularne testy lekowrażliwości
Wynik w dniu wykonania, ale nie zastępują
testów fenotypowych, wykonanych z hodowli.
Wskazania:
•
Niepowodzenie lub przerwa w leczeniu,
•
Pochodzenie chorego ze środowiska z
wysokim odsetkiem gruźlicy opornej,
szczególnie MDR-TB.
Xpert MTB/RIF (Cepheid, USA)
•
Real-Time PCR, czas wykonania 2 godz.
•
oporność RMP (rpoB).

Inne badania laboratoryjne – testy
serologiczne
Odpowiedź humoralna w gruźlicy nie ma
charakteru ochronnego.
Poziom swoistych przeciwciał oznacza się
w surowicy techniką ELISA (Enzyme Linked
Immunosorbent Assay).
Negatywna opinia WHO – zdecydowanie
nie zaleca się zastosowania testów
serologicznych w diagnostyce
gruźlicy płucnej ani pozapłucnej.
http://www.tbevidence.org/documents/policies/WHO_factsheet_serodiagnos
tics.pdf

Najczęstsze błędy - I
Jednoznaczna interpretacja wyniku
dodatniego mikroskopii jako gruźlicy.
Poza przypadkami gruźlicy, obecność
prątków kwasoopornych w rozmazie
może wynikać z:
•
kolonizacji prątkami saprofitycznymi,
•
kontaminacji prątkami środowiskowymi,
•
zakażenia oportunistycznego prątkami
niegruźliczymi powodującymi
mykobakteriozy.

Najczęstsze błędy - II
Brak typowania do gatunku wyrośniętych
szczepów prątków lub poprzestanie na
wykonaniu testu niacynowego
różnicujacego jedynie M.tuberculosis
od prątków niegruźliczych, w tym
M.bovis.
Nie pozwala to na:
•
diagnozowanie mykobakterioz,
•
wykrywanie systematycznych zanieczyszczeń
prątkami środowiskowymi.

Najczęstsze błędy - III
Zaniechanie wzywania na dodatkowe
badania mikrobiologiczne chorych ze
wskazaniami klinicznymi, u których
wyhodowano prątki niegruźlicze.
Z tej grupy rekrutują się chorzy na
mykobakeriozy.

Najczęstsze błędy - IV
Brak systematycznej oceny
mikrobiologicznej czystości
sprzętu endoskopowego.

Uwaga!
Ujemne wyniki badań
laboratoryjnych nie wykluczają
rozwoju choroby, bowiem żadna
z metod laboratoryjnych nie
charakteryzuje się
stuprocentową czułością.

Choroba a zakażenie
Aktywna gruźlica,
•
gdy infekcja wymyka się spod kontroli układu
immunologicznego.
Utajone zakażenie M. tuberculosis
(Latent Tuberculosis Infection, LTBI)
•
brak klinicznych i radiologicznych objawów
choroby;
GRUŹLICA
≠
ZAKAŻENIE

Rozpoznanie LTBI
Pośrednio, przez wykrycie odpowiedzi
immunologicznej na antygeny prątka
•
Test skórny (Tuberculin Skin Test, TST)
•
Testy IGRA (Interferon Gamma Release
Assays)
Dodatnie wyniki testów nie pozwalają
na odróżnienie choroby od zakażenia
Dodatni wynik TST lub IGRA nie jest
potwierdzeniem gruźlicy.

Test skórny (in vivo)
Wykrywa nadwrażliwość typu późnego
na antygeny tuberkuliny
Pomiar średnicy nacieku po 72 godz.
Reakcja skórna 6-8 tygodni po
zakażeniu
Mała swoistość – reakcja krzyżowa z M.
bovis BCG i prątkami środowiskowymi
Wpływ szczepienia BCG na wynik
utrzymuje się przez wiele lat.

Kryteria wyniku dodatniego TST
Średnic
a
nacieku
Grupa osób
≥5mm
Osoby HIV-pozytywne;
Osoby mające ostatnio kontakt z
prątkującym chorym;
Osoby ze swoistymi zmianami
radiologicznymi;
Chorzy po przeszczepie;
Chorzy leczeni immunosupresyjnie;
Chorzy poddani przewlekłej
kortykoterapii.

Kryteria wyniku dodatniego TST
c.d.
Średnica
nacieku
Grupa osób
≥10mm
Przyjezdni z rejonów o dużej zachorowalności na
gruźlicę;
Osoby uzależnione;
Bezdomni;
Rezydenci i pracownicy więzień, różnego rodzaju
domów opieki itp.;
Personel laboratorium mikrobiologicznego;
Dzieci <4 r.ż. po kontakcie z osobami z grupy ryzyka;
Chorzy na cukrzycę, niewydolność nerek, krzemicę,
nowotwory układu chłonnego, osoby wyniszczone.
≥15mm
Osoby spoza grupy ryzyka

Przyczyny fałszywie dodatnich
wyników TST
Po szczepieniu BCG;
Efekt booster,
•
Powiększenie się nacieku w wyniku
ponownego wykonania TST, mylnie
zinterpretowanego jako konwersja
odczynu;
W wyniku ekspozycji na prątki
niegruźlicze, powszechnie
występujące w środowisku.

Przyczyny fałszywie ujemnych
wyników TST
Wiek poniżej 6 miesięcy lub powyżej 65 lat,
Zaburzenia odpowiedzi komórkowej,
Zakażenia wirusowe (odra, ospa, różyczka), a w
szczególności HIV ,
Szczepienie żywymi szczepionkami w ciągu ostatnich
6 tygodni,
Ciężkie, wyniszczające choroby (np. prosówka,
nowotwory złośliwe)
Leczenie immunosupresyjne, również
glikokortykoidami
Okres przed wytworzeniem odpowiedzi komórkowej
Błąd wykonania/odczytu.

Testy IGRA (in vitro)
QuantiFERON®-TB Gold (Cellestis Limited,
Australia)
T-SPOT.TB (Oxford Immunotec Ltd., W. Brytania)
Ocena wydzielania IFN- γ przez limfocyty T
stymulowane antygenami swoistymi dla M. tbc
Duża swoistość – szczepienie BCG nie wpływa na
wynik
Kontrola „sprawności immunologicznej”
limfocytów T – ważne w immunosupresji
Wynik ujemny u dorosłych bez zaburzeń
odporności przemawia za wykluczeniem gruźlicy.

Diagnostyka LTBI
Nie dysponujemy żadnym testem bezpośrednim,
wykrywającym prątki M.tbc u bezobjawowo zakażonych
osób.
W populacji osób immunokompetentnych, IGRA ma
wysoką ujemną wartość predykcyjna (w szczególności w
kombinacji z ujemnym wynikiem TST.
U dzieci, w szczególności poniżej 5 roku życia, ujemny
wynik IGRA lub/i ujemny TST nie wykluczają rozwoju
aktywnej gruźlicy.
Żaden z testów nie różnicuje gruźlicy utajonej od
aktywnej lub przebytej choroby.
Żaden z testów nie jest polecany w diagnostyce aktywnej
gruźlicy.
Konsensus europejski dotyczący diagnostyki LTBI:
•
M. Korzeniewska-Koseła, Medycyna Praktyczna 2011/02.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
Wyszukiwarka
Podobne podstrony:
Seminarium 1 Spektroskopia 2012 13
Biotechnologia zamkniete użycie (2012 13)
Algebra liniowa i geometria kolokwia AGH 2012 13
kol zal dod pop algebra ETI 2012 13
zestawienie fakultetow 2012 13 Nieznany
cw2 tip 2012 13
17 rzs 2012 13 net wersja pods Nieznany (2)
12skaly osadowe 2012 13
Harmonogram V Farmacji 2012 13
E1 2012 13 zad 4 id 149133
9 10 pierwotne kzn 2012 13 net Nieznany (2)
harmonogram zajęć filmoznawstwo 2012-13, Filmoznawstwo
Szereg Fouriera przyklady, SiMR, Studia inżynierskie, Semestr II 2, Równania różniczkowe, 2012 13
2012 13 egzamin 2id 28112 (2)
E1 2012 13 zad 1 id 149130
E1 2012 13 zad 3 id 149132
lekarski KOLOIDY 2012 13
zagadnienia do egzaminu z Podstaw chemicznych, Studia, Chemia, Podstawy chemiczne nauk o Ziemi - dla
FIZJOLOGIA I rok tematy cw sem wyk 2012-13, Medycyna, I rok, Fizjologia
więcej podobnych podstron