
Materiałoznawstwo
Dr. Grzegorz Nowak

Plan wykładu
• rodzaje materiałów
• wybrane właściwości materiałów
• metale (stopy)
–
żelazo i stal
–
obróbka cieplna
–
metale nieżelzne
• polimery
• ceramiki i szkła
• metody formowania materiałów
• półprzewodniki
Plan zajęć
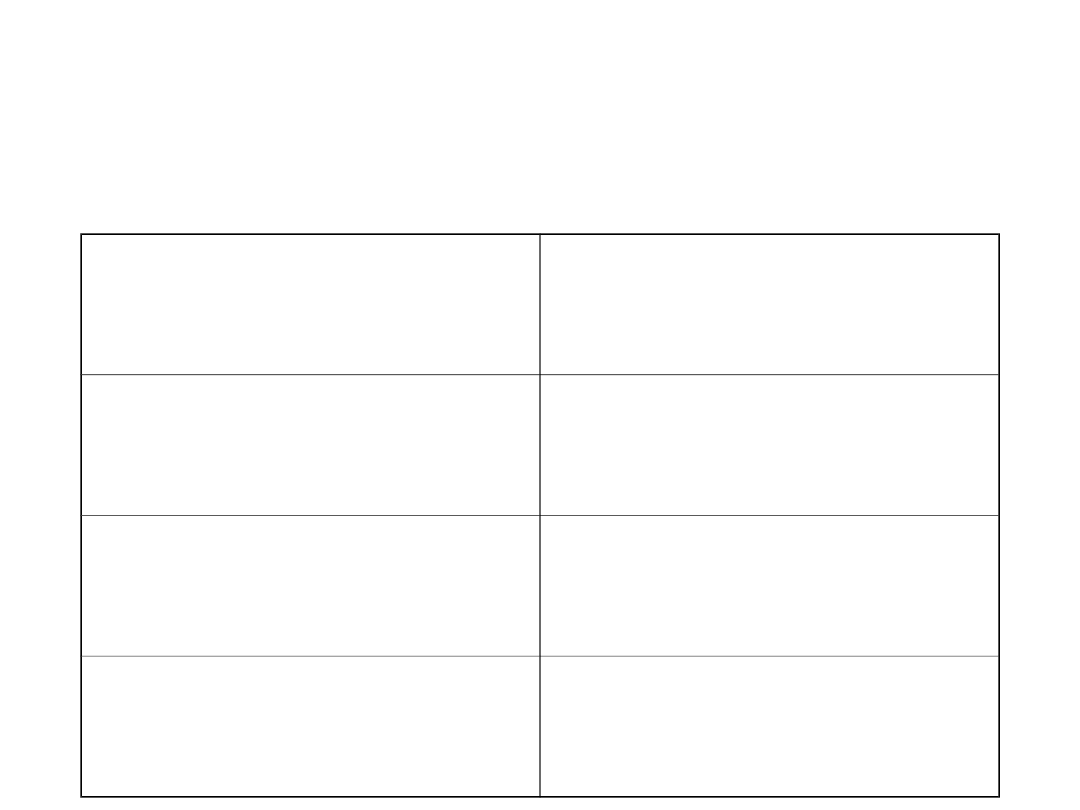
14.02
wstęp, rodzaje i
struktura materiałów
28.03
metale polimery
28.02
własności materiałów
18.04
materiały ceramiczne i
szkła
14.03
wykresy fazowe
09.05
obróbka i formowanie
materiałów
12.05
metale i ich stopy
06.06
materiały
półprzewodnikowe

literatura
• Wstęp do inżynierii materiałowej
M.Blicharski WNT
• Materiały inzynierskie MF.Ashby, DR.Jones
WNT
• Inżynieria materiałowa MW.Grabski,
JA.Kozubowski
• Britney's Guide to Semiconductor Physics:
http://britneyspears.ac/lasers.htm

Inżynieria materiałowa
• Jest to nauka o materiałach z
inżynierskiego punktu widzenia
• Chemia i fizyka zajmują się opisem
własności materiałów
• Inżynieria materiałowa kształtuje
własności materiałów zgodnie z
zapotrzebowaniem

Rodzaje materiałów
• metale
• ceramiki
• polimery
• kompozyty

metale
• spośród 103 znanych
pierwiastków 80 jest metalami
• zwykle używa się stopów metali
• najpopularniejsze są stopy żelaza,
aluminium, miedzi
• duża wytrzymałość, łatwa obróbka

Materiały ceramiczne
• materiał wyjściowy: proszek + lepiszcze
• wymaga spiekania, czasem pod
ciśnieniem
• typowe przykłady: cegła, porcelana, SiC
(karborund), widia (węglik wolframu)
• twarde, kruche, odporne na
temperaturę, trudne w obróbce

polimery
• Tworzywa sztuczne, materiały
wielkocząsteczkowe
• Zbudowane z długich łańcuchów
pojedynczych cząstek
• Łatwe w formowaniu, odporne na
korozje
• Niska sztywność, wrażliwe na
temperaturę

kompozyty
• Składają się z 2 (lub więcej)
materiałów o różnych własnościach
• Własności kompozytu są lepsze niż
każdego składnika osobno
• Przykłady:
– Sklejka
– Beton, żelbeton
– Włókna szklane + żywica

Inne materiały
• Półprzewodniki
– Si, Ge, GaAs, GaN, GaP, In
• Materiały naturalne
– skóra, wełna, wiklina, kość (słoniowa)
• nanomateriały
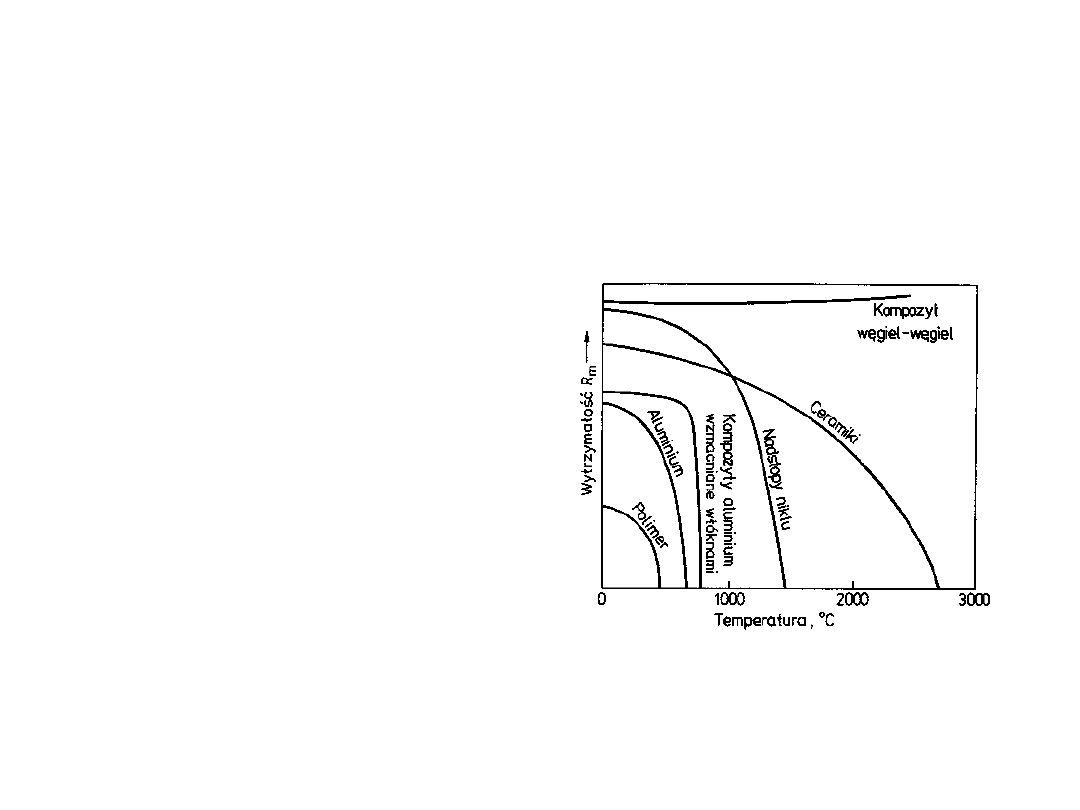
Zakres stosowalności
materiału
• Polimery stosujemy
gdy nie występują
duże obciążenia
• Metale stosujemy
gdy występują duże
obciążenia
• Ceramiki są
najlepsze w
wysokich
temperaturach
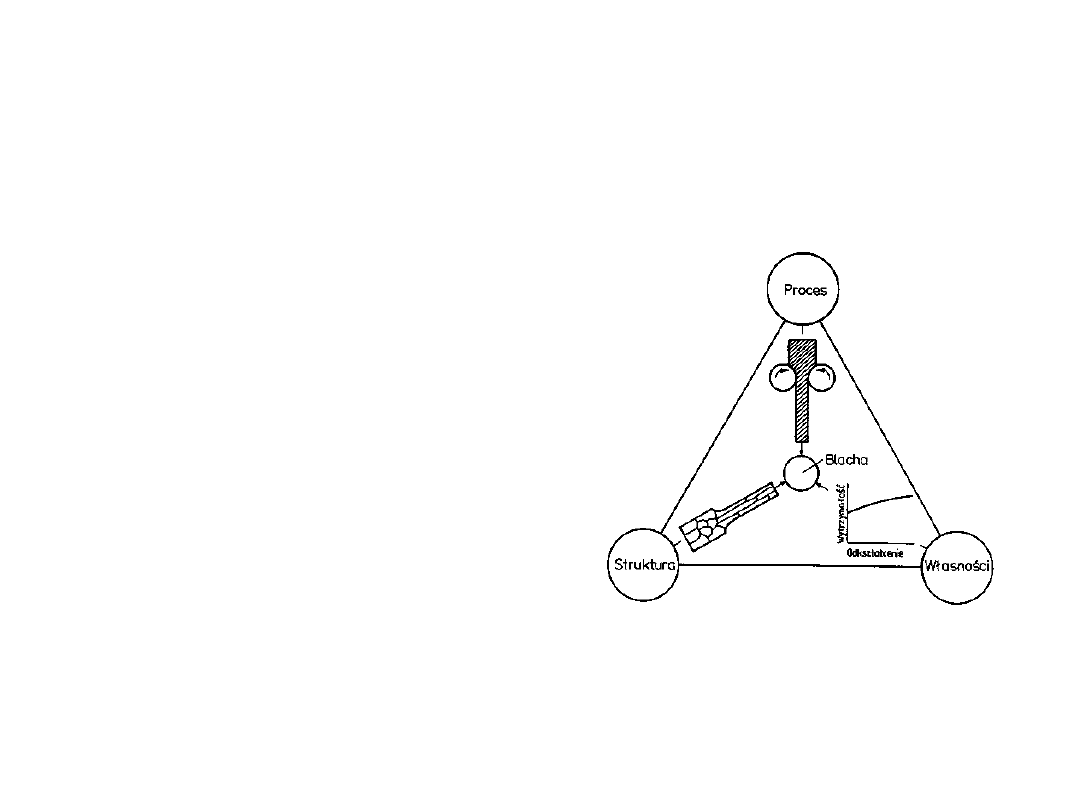
• Własności
materiału, jego
struktura i proces
wytwarzania są
wzajemnie
powiązane

Mikrostruktura
materiałów
• Wszystkie substancje składają się
z atomów
• Istnieje kilka typów wiązań
pomiędzy atomami
• W wyniku oddziaływań
międzyatomowych powstają
struktury wyższego rzędu
Tabela Mendelejewa

Rodzaje wiązań
międzyatomowych
• Kowalencyjne
• Jonowe
• Metaliczne
• Van der Waalsa (wtórne)
• wodorowe

Wiązania kowalencyjne
• Dwa elektrony
pochodzące z
sąsiednich atomów
tworzą parę
• Jest to podstawowy
typ wiązania
• Wiązanie jest
mocne i ma
kierunek

Wiązanie jonowe
•
W związku chemicznym
elektron przechodzi z
jednego atomu na drugi
•
Tworzą się kationy o
ładunku dodatnim i
aniony o ładunku
ujemnym
•
Jony przyciągają się
elektrostatycznie
tworząc wiązanie
•
Tworzą się twarde
kryształy

Wiązanie metaliczne
• Atomy metalu oddają elektrony stając
się kationami
• Swobodne elektrony tworzą gaz
elektronowy który wiąże ze sobą
kationy
• Wiązanie nie ma określonego kierunku
• Metale są dobrymi przewodnikami
prądu i ciepła

Energia wiązań
wiązanie
Energia wiązania
[kJ/mol]
Jonowe
600-1550
Kowalencyjne
500-1250
Metaliczne
100-850
Van der Waalsa
40
wodorowe
20
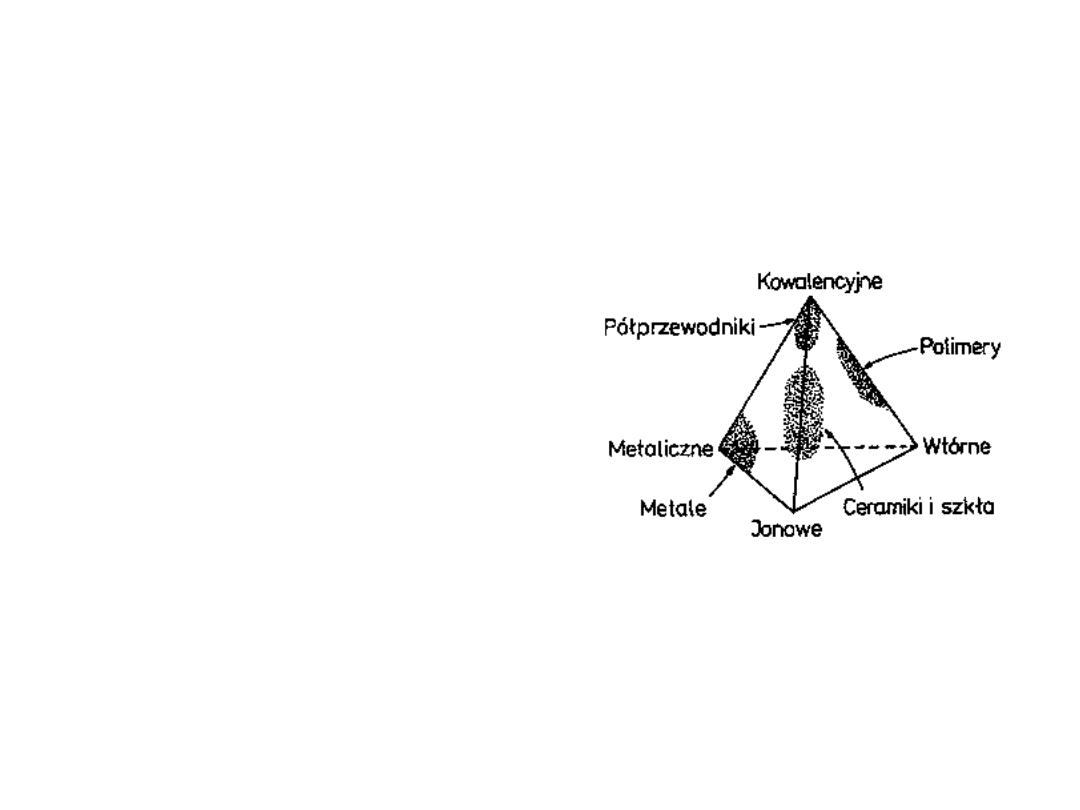
Dominujące typy wiązań w
różnych materiałach
• W metalach dominuje
oczywiście wiązanie
metaliczne
• W ceramikach,
półprzewodnikach i
szkłach dominuje
oddziaływanie
kowalencyjne
• W polimerach istotne
są wiązania
kowalencyjne i van
der Waalsa

Przemiany fazowe
• Pod wpływem warunków zewnętrznych
atomy (cząstki) przyjmują stabilną
konfigurację – tzw. fazę
• Dla układów jednoskładnikowych
występują zwykle trzy fazy
• Dla układów wieloskładnikowych układ
faz może być bardzo skomplikowany
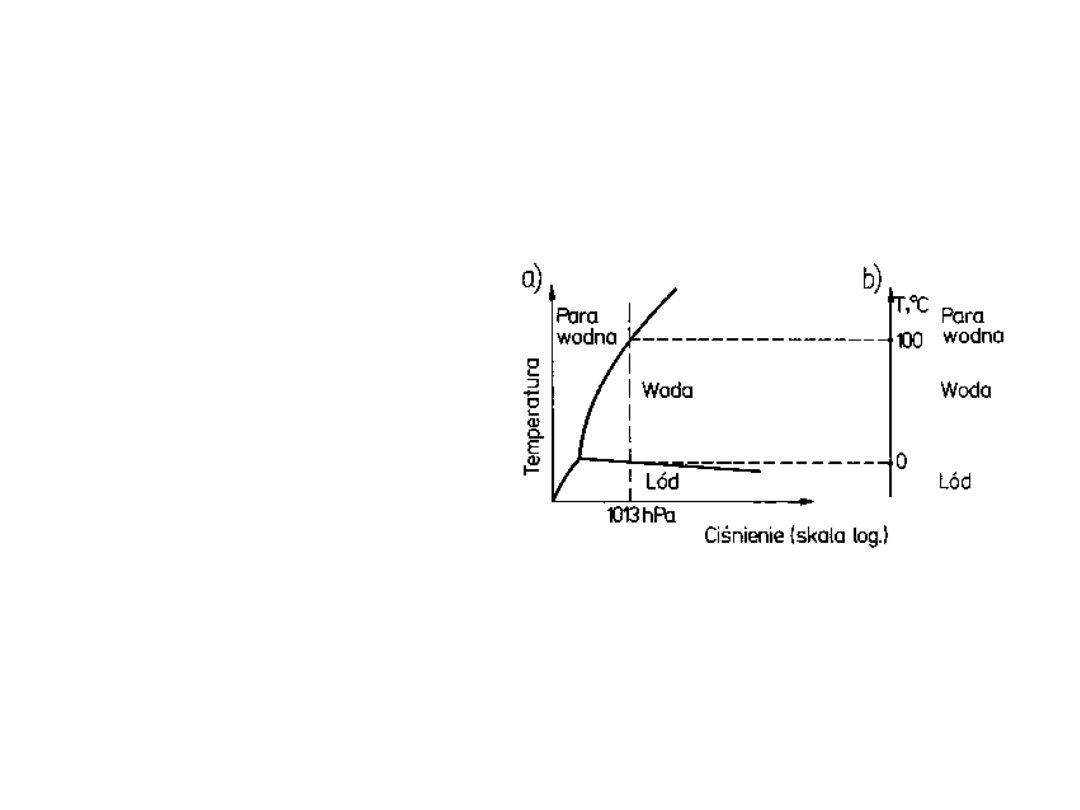
Wykres fazowy układu
jednoskładnikowego
• Poniżej pewnej
temperatury faza
ciekła nie istnieje
• Powyżej określonej
temperatury nie
istnieje faza stała
• Faza ciekła istnieje
tylko powyżej
określonej
temperatury
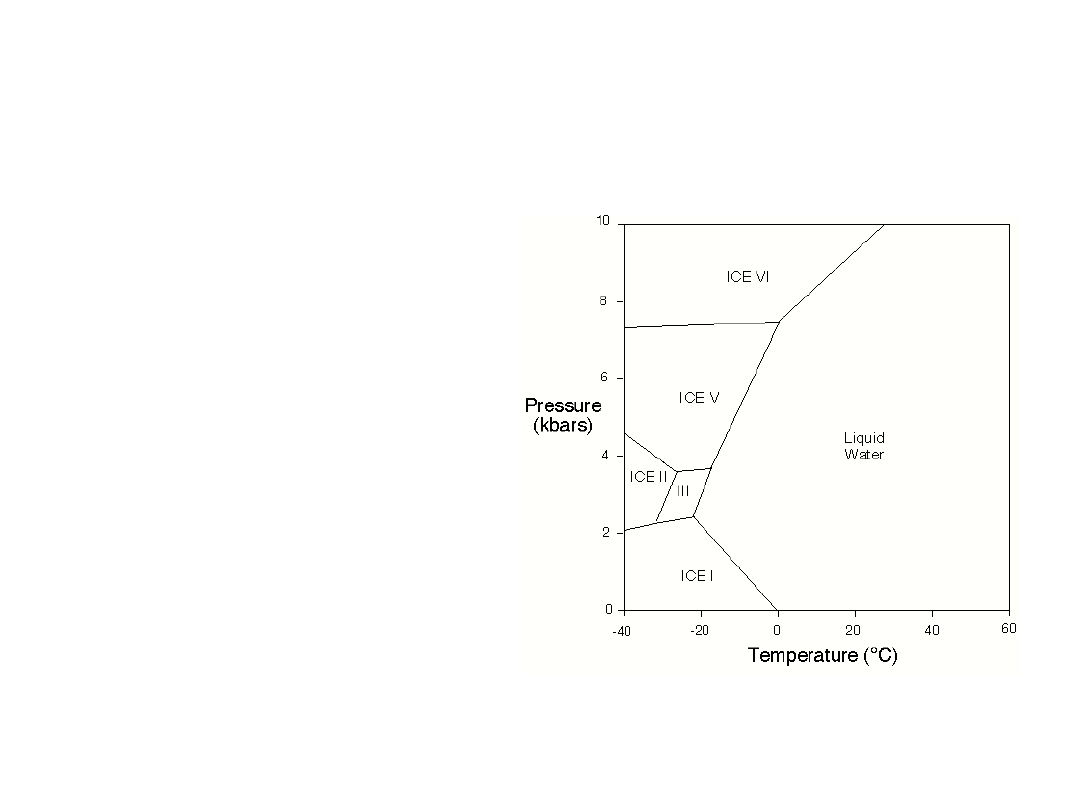
Wykres fazowy dla wody
• W warunkach
wysokiego
ciśnienia lód
może występować
w wielu
postaciach
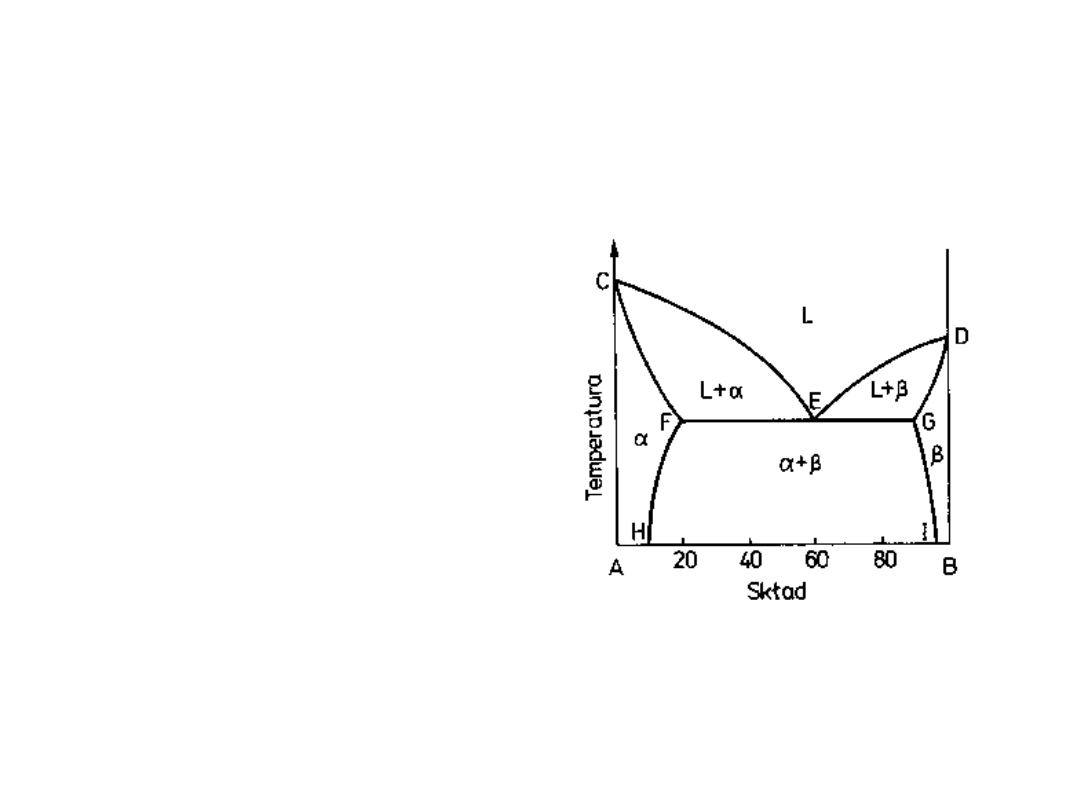
Wykres fazowy dla układu
dwóch składników
• Można określić
między innymi:
– Temperaturę topnienia
– Zakresy
rozpuszczalności
– Ilość faz
• Znając wykres fazowy
i historię układu
można zgadnąć
strukturę materiału
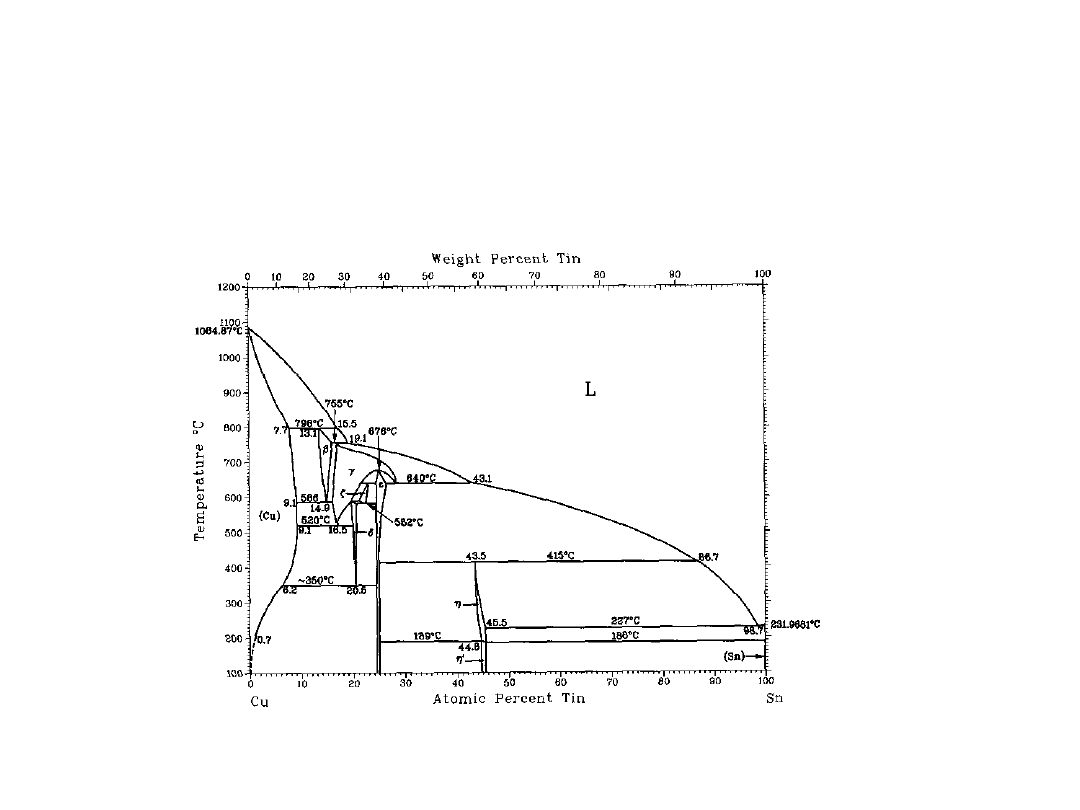
Wykres fazowy dla układu
Cu-Sn (brąz)

Struktura materiałów
• Wiele materiałów ma strukturę
(mikro)krystaliczną
• Własności materiału zależą od
rodzaju kryształu oraz od defektów
struktury krystalicznej takich jak:
– Domieszki
– Dyslokacje
– Granice ziaren

kryształy
• Kryształ jest zbudowany z regularnie
powtarzających się atomów (cząstek)
• Metale i ceramiki mają strukturę
mikrokrystaliczną
• Duże kryształy są wykorzystywane w
technice półprzewodnikowej
• Diament jest kryształem
Kryształy cd
• Typowymi
kryształami są
cukier, sól, lód
• Własności
(mikro)kryształu
bardzo mocno
zależą od zawartych
w nim defektów
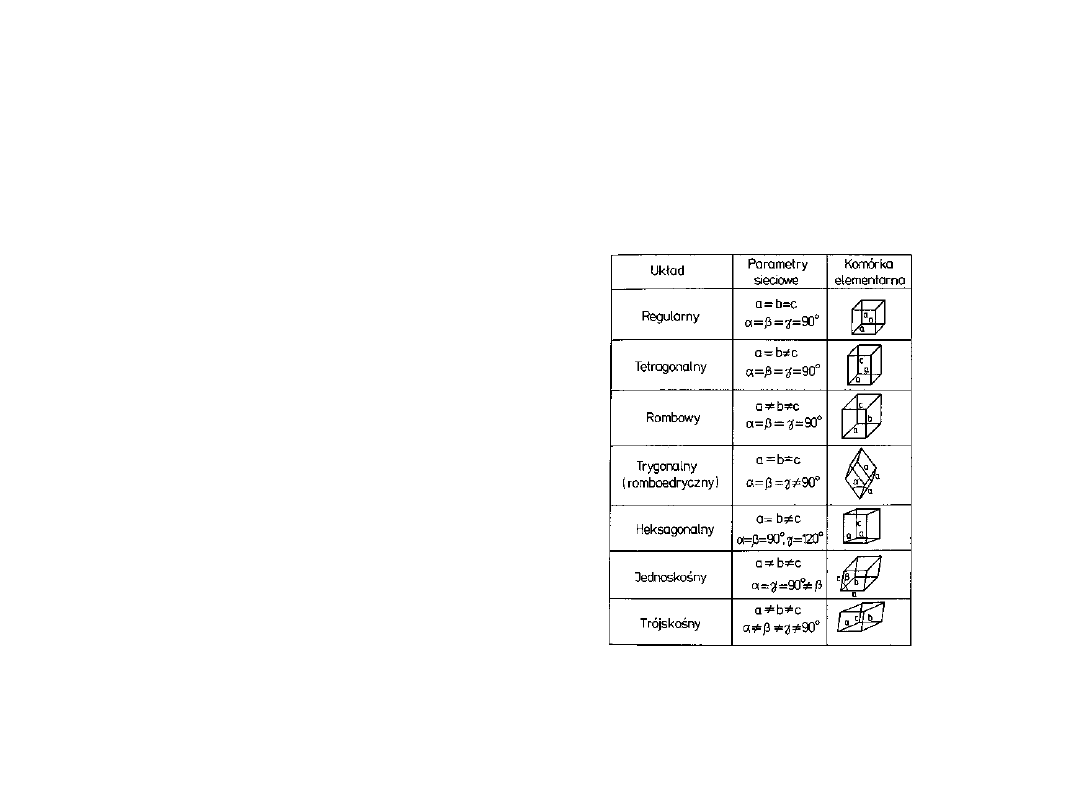
Typy struktur
krystalograficznyc
h

Typy defektów kryształów
• Defekty punktowe
• Dyslokacje
• Granice ziaren

Defekty punktowe
• Domieszki
• Atomy
międzywęzłowe
• Wakansje (luki)
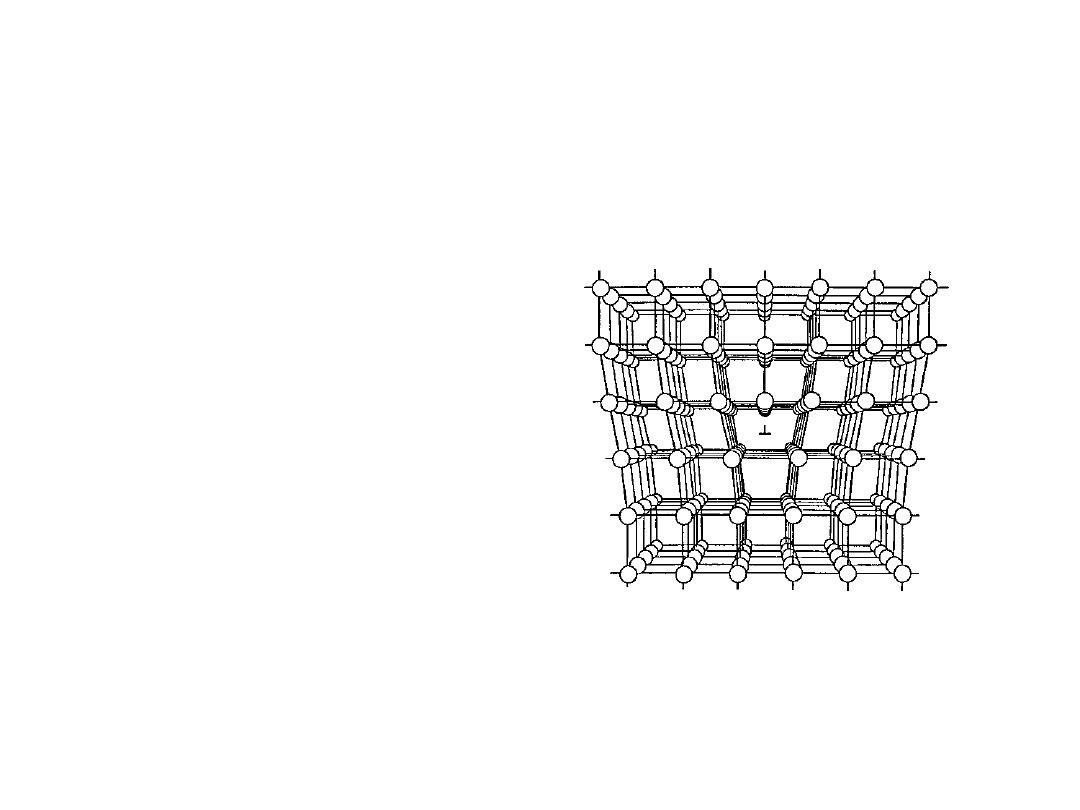
Defekty liniowe -
dyslokacje
• Dwa podstawowe
typy dyslokacji:
krawędziowe i
śrubowe
• Dyslokacja
krawędziowa to brak
jednej półpłaszczyzny
w krysztale
• Dyslokacja śrubowa
to przesunięcie jednej
półpłaszczyzny w
krysztale
Dyslokacje cd
• Przykład
dyslokacji
krawędziowej
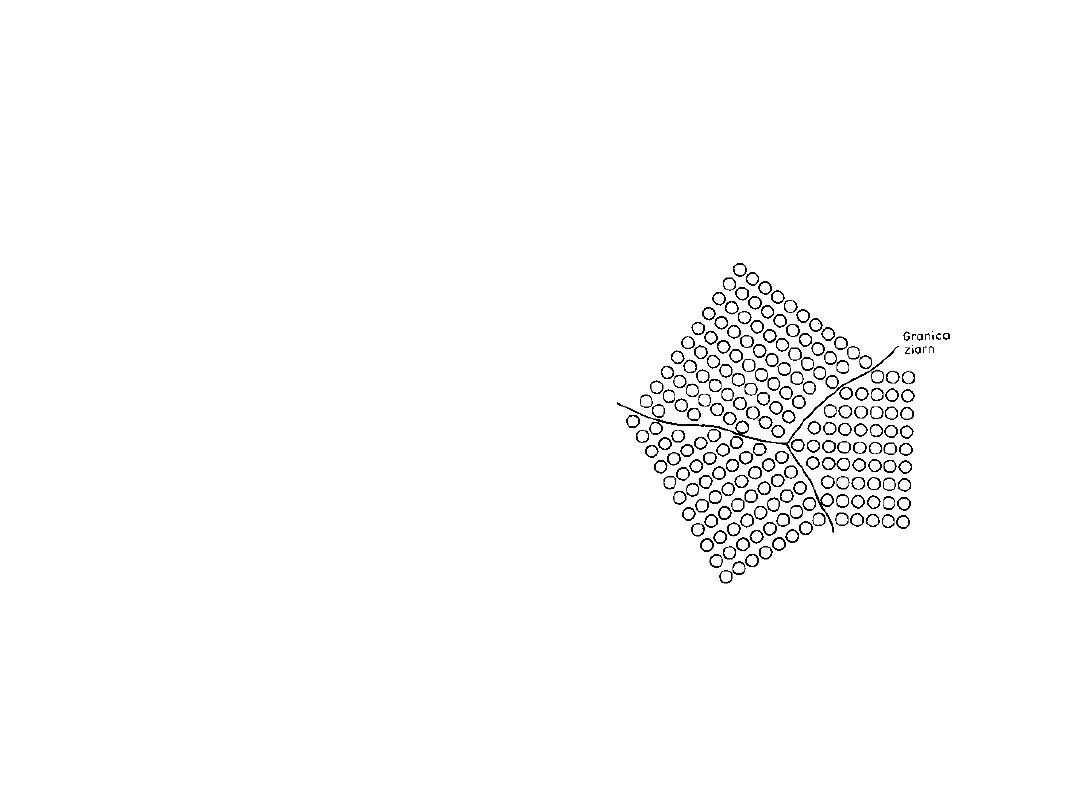
Granice ziaren
• Granice pomiędzy
krystalitami
tworzą granice
ziaren

Defekty w kryształach
• Idealny kryształ jest (powinien być)
twardy
• Obecność dyslokacji powoduje że
materiał staje się plastyczny
• Manipulując defektami można
zmieniać utwardzać materiał
(hartowanie, kucie) bądź go
uplastyczniać (odpuszczanie)

Defekty w kryształach cd
• Domieszki decydują o
własnościach półprzewodników
• Własności ceramik są
zdeterminowane przez granice
ziaren
• Własności plastyczne metali zależą
od dyslokacji

Istotne parametry
materiału
• Gęstość
• Mechaniczne
– sprężystość
– odkształcania
– twardość
– udarność
– zmęczenie
– pełzanie
• Magnetyczne
– diamagnetyki,par
amagnetyki,
ferromagnetyki
• Elektryczne
– izolatory,
przewodniki
• Cieplne
• Optyczne
Ale najważniejszym parametrem jest
cena
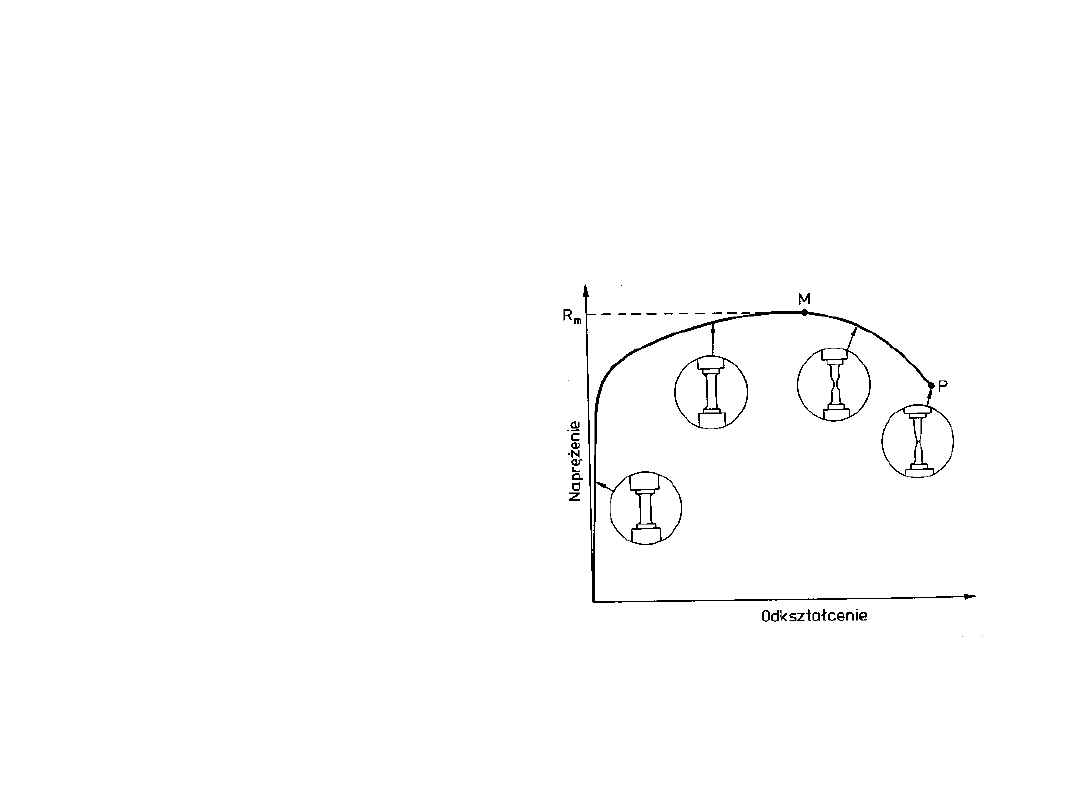
Odkształcenie pod
wpływem naprężeń
Próba zerwania
Mierzymy siłę w
funkcji
wydłużenia
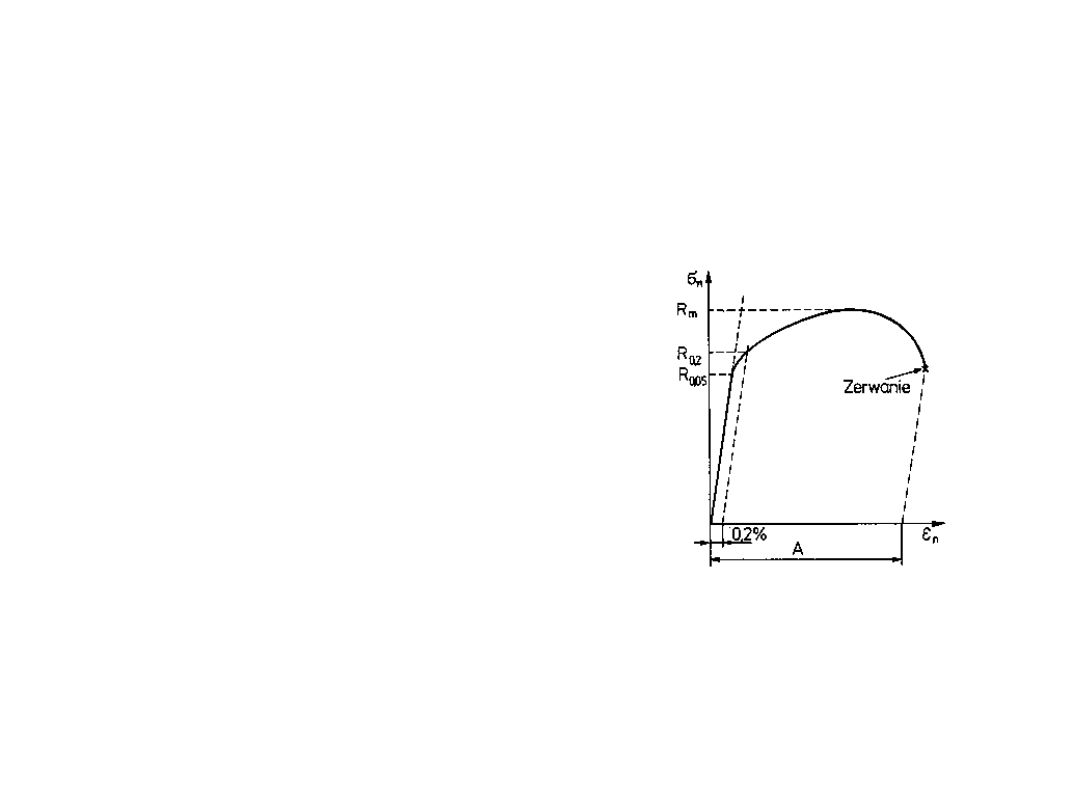
Odkształcenie pod
wpływem naprężeń
• Przy małych naprężeniach
materiał odkształca się
elastycznie. Jest to proces
odwracalny.
• Przy dużym naprężeniu
materiał odkształca się
plastycznie. Ulega
trwałemu odkształceniu.
Jest to proces
nieodwracalny.
• Przy dużym odkształceniu
następuje zerwanie.
Przedmiot ulega
zniszczeniu.

Odkształcenia sprężyste
• W zakresie odkształceń sprężystych
odkształcenie następuje na skutek
zmiany odległości pomiędzy atomami –
bez generacji defektów
• Odkształcenie jest proporcjonalne do
naprężenia (prawo Hooke’a)
= E
gdzie E – moduł Younga (współczynnik
sprężystości)
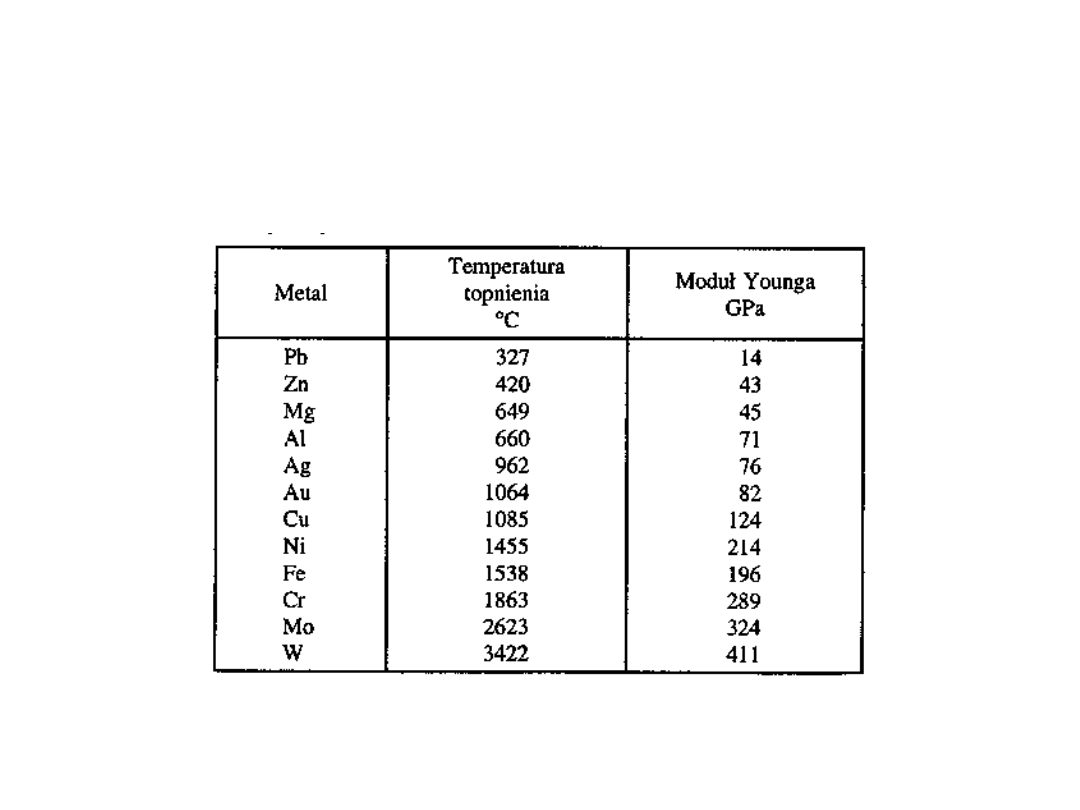
Moduły Young’a
wybranych metali
Zmęczenie materiału
• Na skutek
wielokrotnych
odkształceń powstają
defekty (pęknięcia)
• Występuje w zakresie
odkształceń
sprężystych
• Jest podstawową
przyczyną zniszczeń
urządzeń
mechanicznych
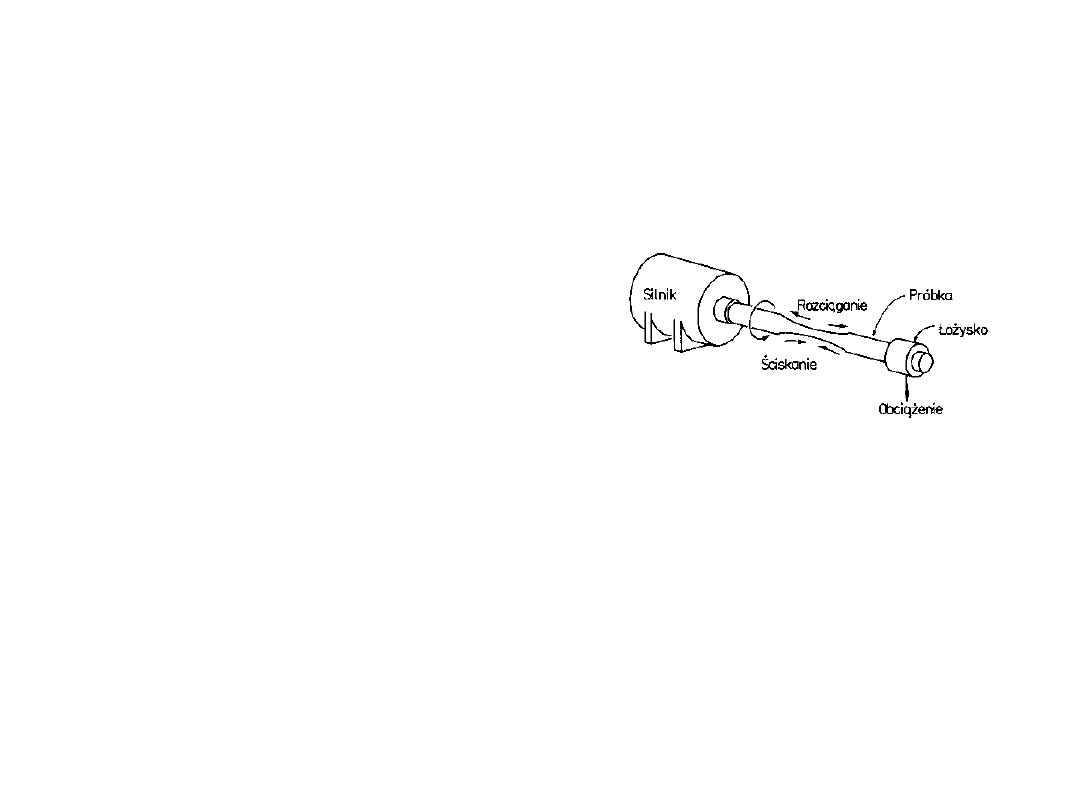
Przykład układu do
badań zmęczeniowych

Zmęczenie - dygresja
• Badania zmęczeniowe
są przykładem badań
niezawodnościowych
(określanie czasu
życia)
• Określenie czasu życia
jest niezbędne dla
wszystkich urządzeń
technicznych
• Często stosuje się
testy akcelerowane
(przyspieszone)
• Czas życia obiektu
mierzy się przy
wyższych
naprężeniach
(temperaturze etc)
niż wymagane w
czasie eksploatacji
• Uzyskane wyniki
ekstrapoluje się do
normalnych
warunków pracy
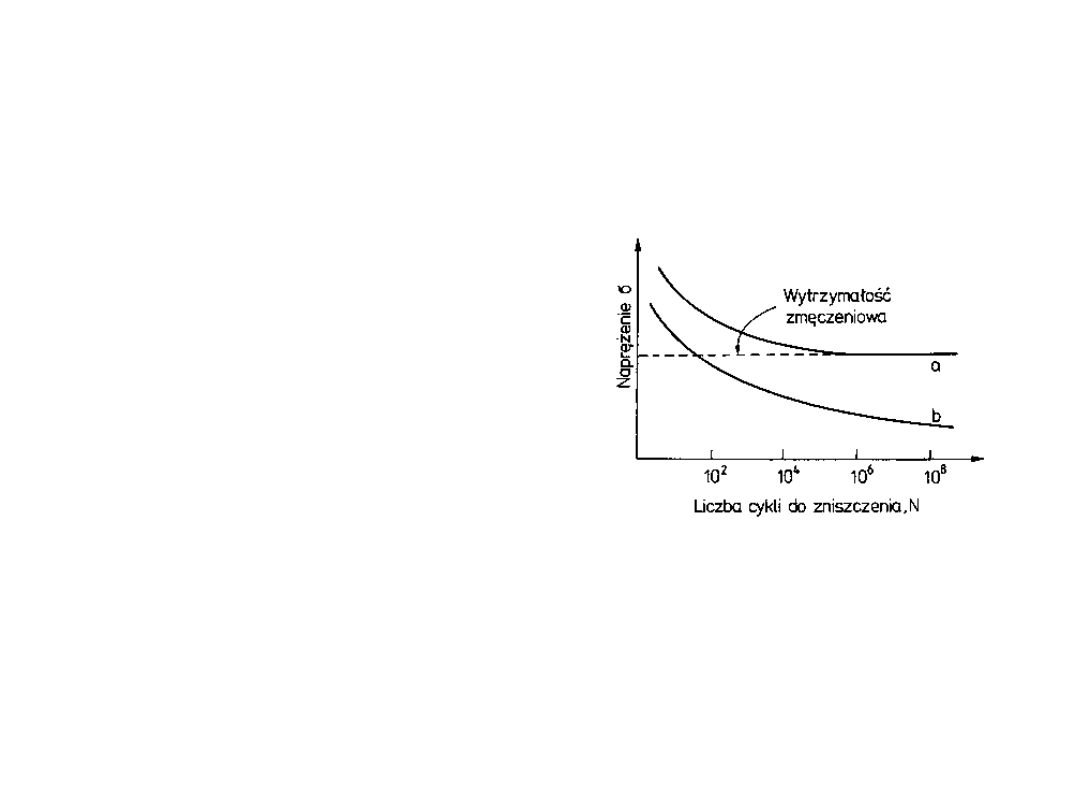
Zmęczenie - dygresja
• Ilość cykli do
zniszczenia zależy
od naprężenia
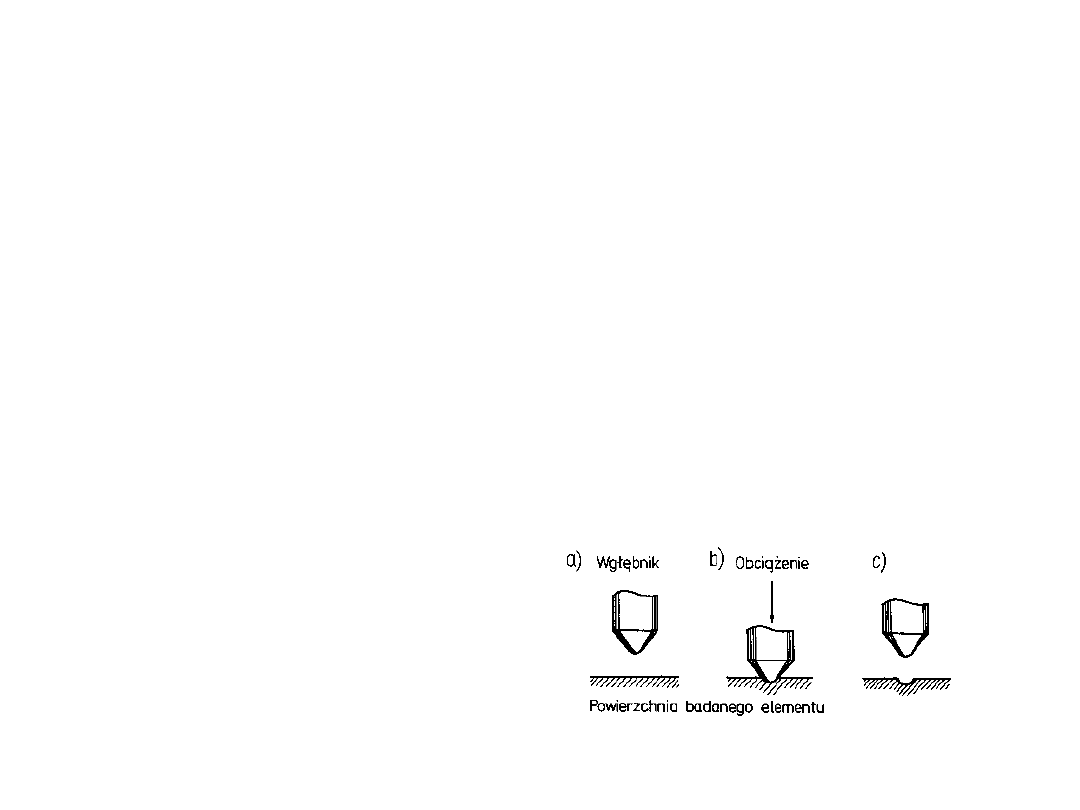
twardość
•
Pomiar twardości
polega na wciskaniu
wgłebnika w badany
materiał i pomiarze
wielkości odcisku
•
Istnieje wiele
znormalizowanych
metod pomiaru
twardości
• Pomiar twardości
jest niezbędny w
trakcie obróbki
termicznej metali
(hartowanie i
odpuszczanie)
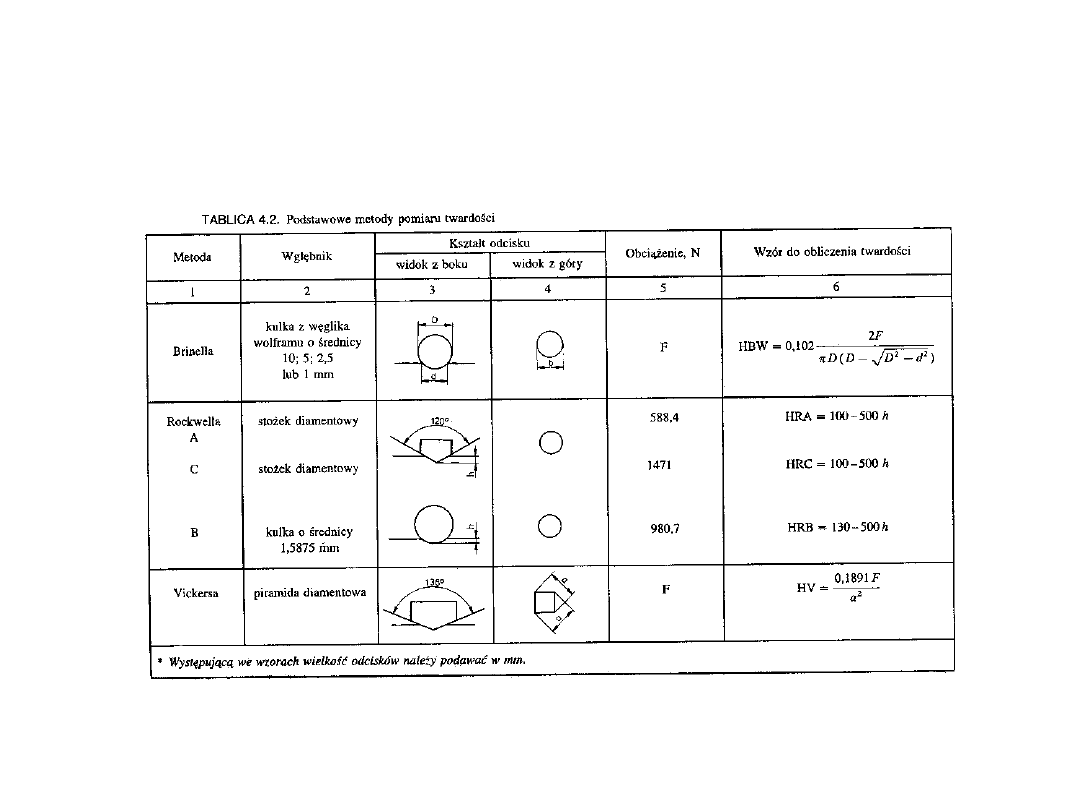
Metody pomiaru
twardości

gęstość
Gęstość to stosunek masy do objętości
d = m / V
Zwykle wyraża się w gramach na
centymetr sześcienny [g / cm
-3
]
Masę mierzy się przy pomocy wagi,
objętość można zmierzyć np. metodą
Archimedesa

Gęstość – materiały
porowate
• Pory dzielą się na zamknięte i
otwarte
• Najdokładniej objętość porów
można zmierzyć pod
mikroskopem. Jest to pomiar
niszczący i czasochłonny

Pomiar gęstości
materiałów porowatych
• Piknometria
– Objętość próbki to objętość której nie
może zająć gaz
– Najczęściej używa się helu (gaz obojętny i
dobrze penetrujący)
• Pozymetria – pomiar wielkości porów
– Wciskamy rtęć do materiału. Im większe
ciśnienie tym mniejsze pory są
wypełniane.

magnetyzm
• Wszystkie rodzaje
atomów oddziałują z
polem
magnetycznym
• Własności
magnetyczne
materiału zależą od
rodzaju atomów oraz
ich wzajemnego
oddziaływania
• Typy materiałów
magnetycznych
– Diamagnetyki
– Paramagnetyki
– Ferromagnetyki
– Antyferromagnety
ki
– ferrimagnetyki
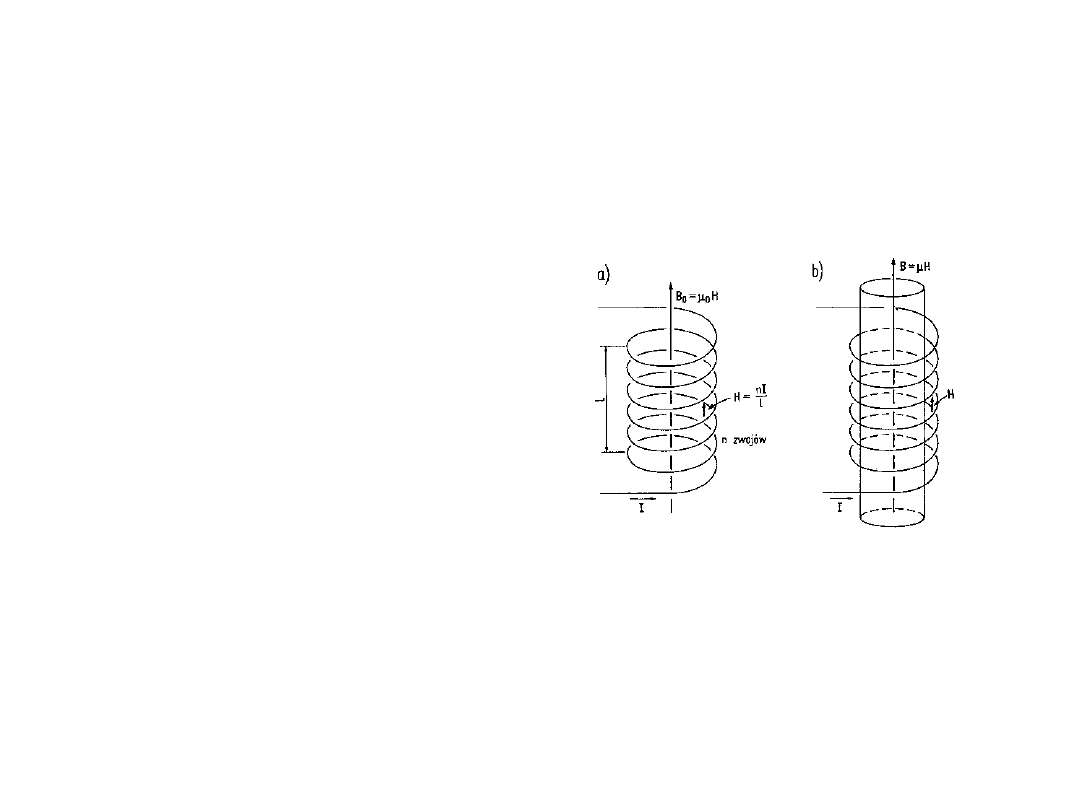
Pole magnetyczne
Indukcja magnetyczna:
B=
0
n I / l
gdzie
0
– przenikalność
magnetyczna próżni
- przenikalność
magnetyczna
materiału

Pole magnetyczne
• Indukcje magnetyczną mierzymy
w teslach
• Ziemskie pole magnetyczne ma
indukcje ok. 0.01 tesli
• Rezonans magnetyczny (MRI)
wykorzystuje pole magnetyczne o
indukcji ok. 2 tesli

diamagnetyki
• Materiały w których
atomy nie mają
trwałego momentu
magnetycznego
• Są wypychane z
pola
magnetycznego
• Jest to efekt słaby
• Ag, Au, Cu, Pb
Indukowane momenty
magnetyczne atomów
ustawiają się przeciwnie
do kierunku
zewnętrznego pola
magnetycznego

paramagnetyki
• Atomy mają stały
moment
magnetyczny
• Są wciągane do
pola
magnetycznego
• Jest to efekt
stosunkowo słaby
• Al, Cr, Mg
Momenty magnetyczne
atomów ustawiają się
zgodnie z kierunkiem
zewnętrznego pola
magnetycznego
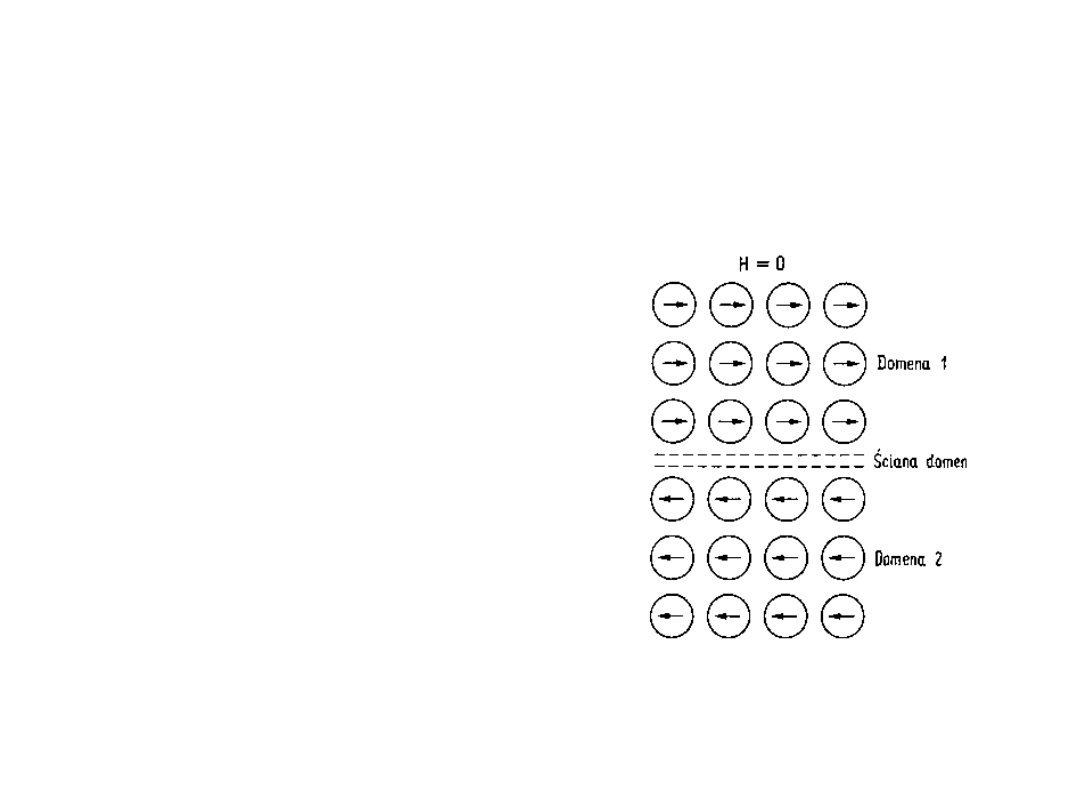
ferromagnetyki
• Atomy mają stały
moment magnetyczny
• Oddziaływania kwantowe
ustawiają momenty
magnetyczne atomów w
tym samym kierunku
• Są trwale
namagnesowane ale
powstaje struktura
domenowa
• Jest to bardzo silny efekt
• Fe, Ni, Co, Gd
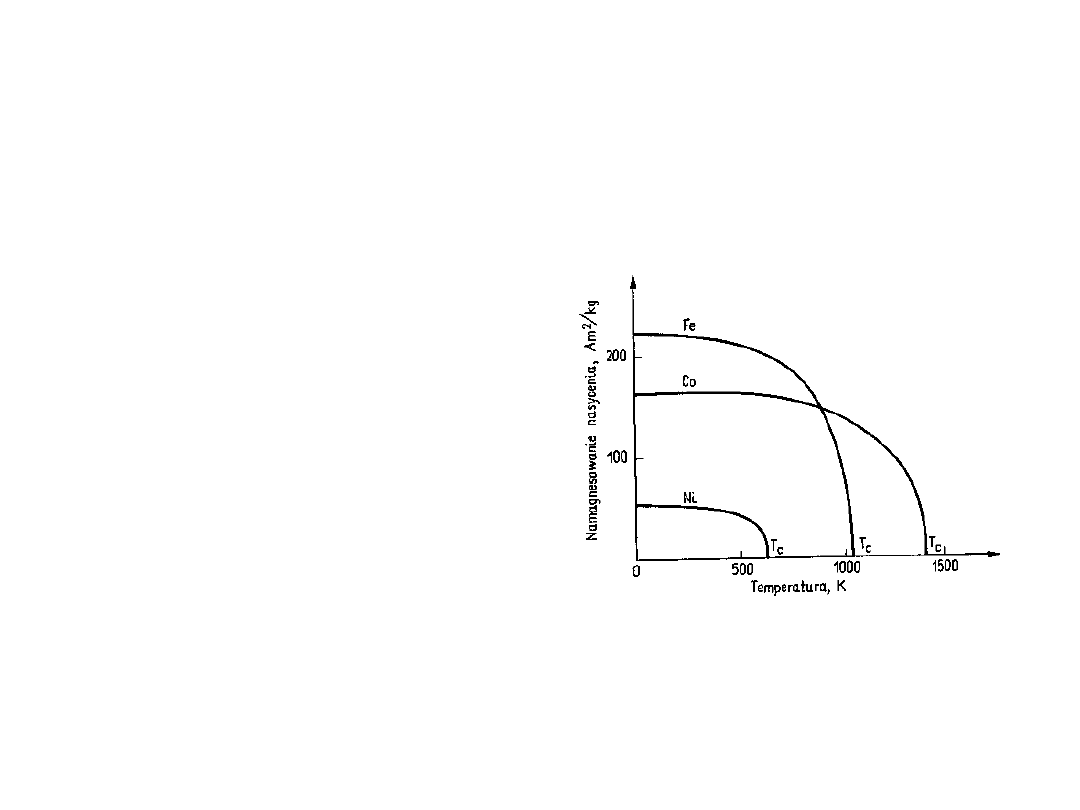
Zależność momentu
magnetycznego od
temperatury
• Drgania termiczne
niszczą
uporządkowanie
magnetyczne
atomów
• Powyżej
temperatury Curie
namagnesowanie
zanika
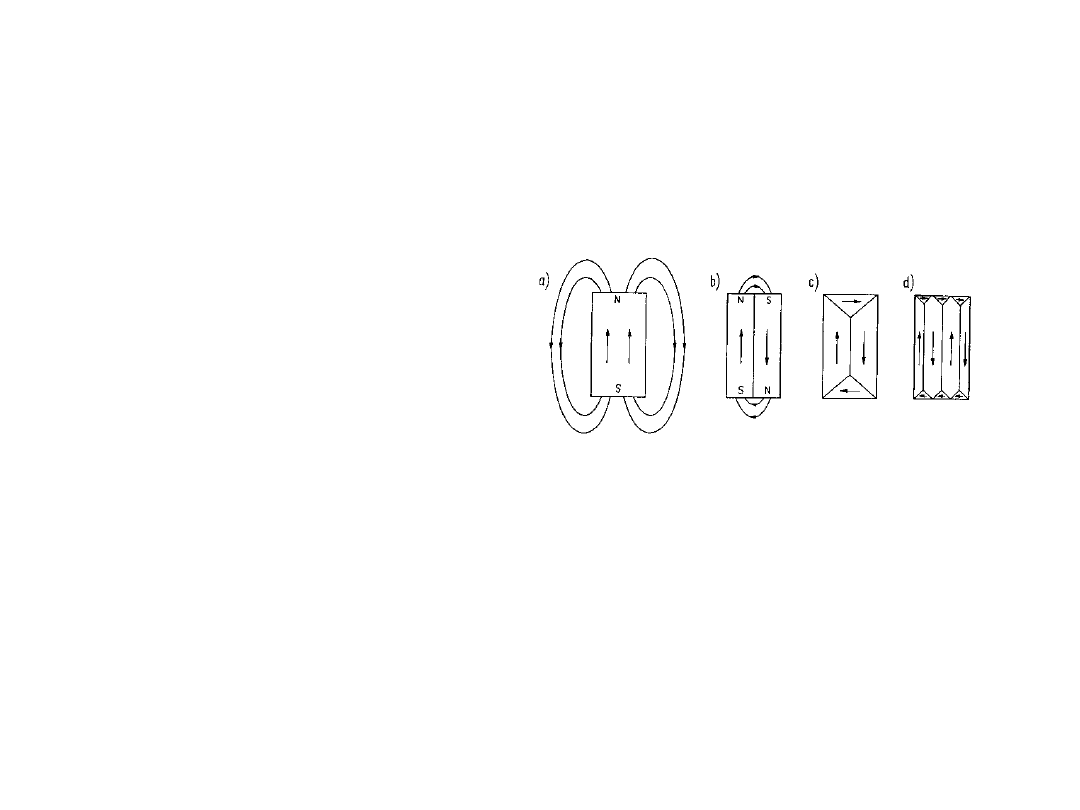
Struktura domenowa
• Wszystkie materiały
ferromagnetyczne
tworzą domeny
• Istnienie domen
utrudnia uzyskanie
silnych magnesów
trwałych
• Przemagnesowanie
domen jest trudne i
wymaga energii
Domeny magnetyczne
ustawiają się tak aby
zminimalizować
zewnętrzne pole
magnetyczne
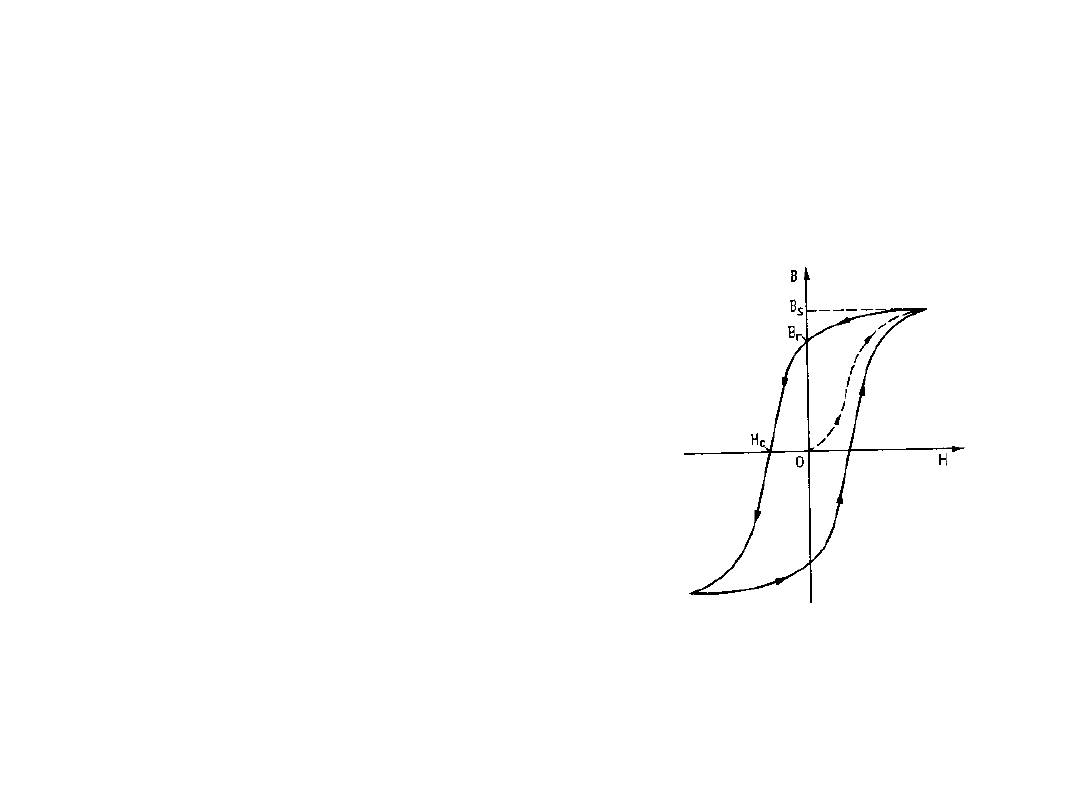
Histereza magnetyczna
• Stan
namagnesowania
zależy od
zewnętrznego pola
magnetycznego i od
historii
• Z wykresu można
odczytać mn:
indukcję nasycenia
indukcję szczątkową
siłę koercji
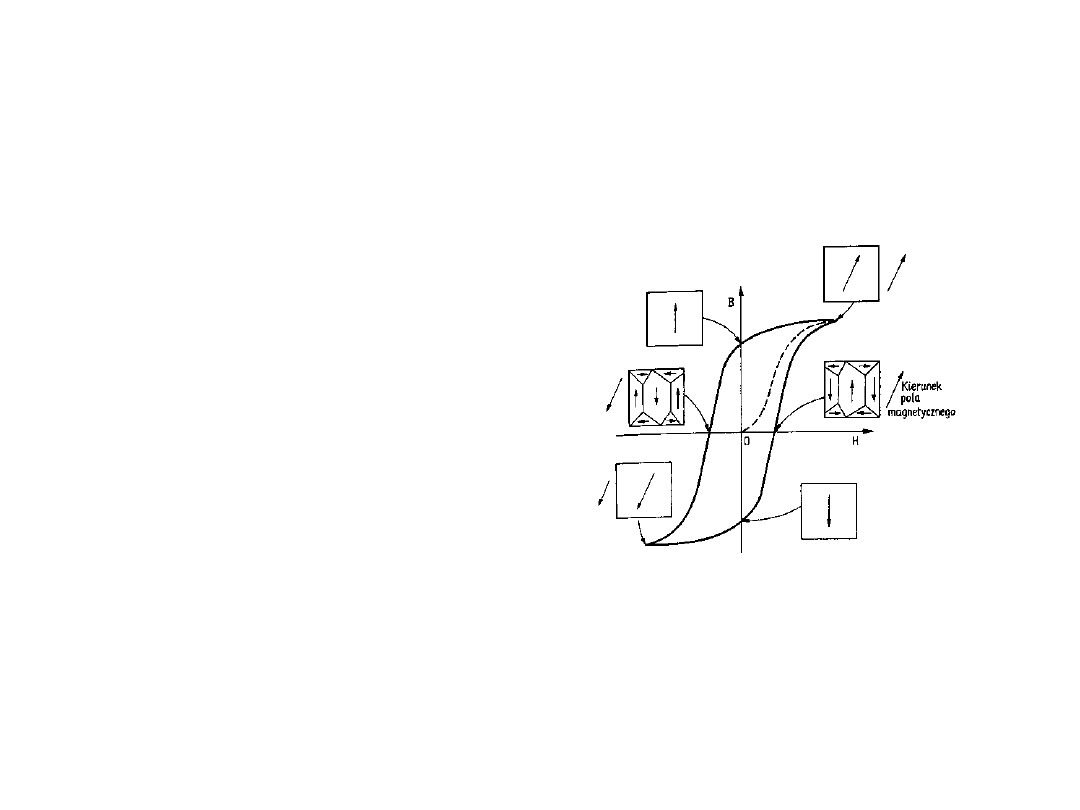
Histereza magnetyczna
• Istnienie domen
magnetycznych jest
przyczyną histerezy
magnetycznej
• Indukcja nasycenia
odpowiada ustawieniu
wszystkich domen
magnetycznych w
jednym kierunku
• Pole powierzchni pętli
histerezy określa
energię traconą w
czasie jednego cyklu

Rodzaje materiałów
magnetycznych
• Materiały
magnetyczne twarde
– Magnesy
– Pamięci magnetyczne
• Materiały
magnetyczne
miękkie
– Rdzenie
transformatorów
– Silniki i prądnice

Materiały magnetyczne
miękkie
• Stopy Fe-Si
– Małe częstotliwości, duże moce
• Stopy Fe-Ni
– Duże częstotliwości, małe moce
• Ferryty
– Bardzo duże częstotliwości
• Szkła metaliczne

Materiały magnetyczne
miękkie
• Stopy Fe-Si
– Dodatek krzemu zwiększa opór
elektryczny (zmniejsza) prądy wirowe
– Dodatek krzemu obniża indukcje
nasycenia i przewodnictwo cieplne
• Stosowany jako rdzenie do
silników i transformatorów

Materiały magnetyczne
miękkie
• Stopy Fe-Ni
– Zawierają ok. 79% Ni
– Mała anizotropia
– Niska magnetostrykcja
• Stosowane w głośnikach,
głowicach odczytujących itp

Materiały magnetyczne
miękkie
• Ceramiki
– Ferrryty
– Granaty
– magnetoplumbity
• Nie przewodzą prądu elektrycznego
• Stosowane w technice radiowej i
mikrofalowej (anteny ferrytowe)

Materiały magnetyczne
miękkie - własności
Zapis magnetyczny
Używa się Fe
2
O
3
lub
CrO
2
w materiale
wiążącym
Temperatura Curie dla
CrO
2
wynosi 128
o
C
Temperatura Curie dla
Fe
2
O
3
wynosi 600
o
C
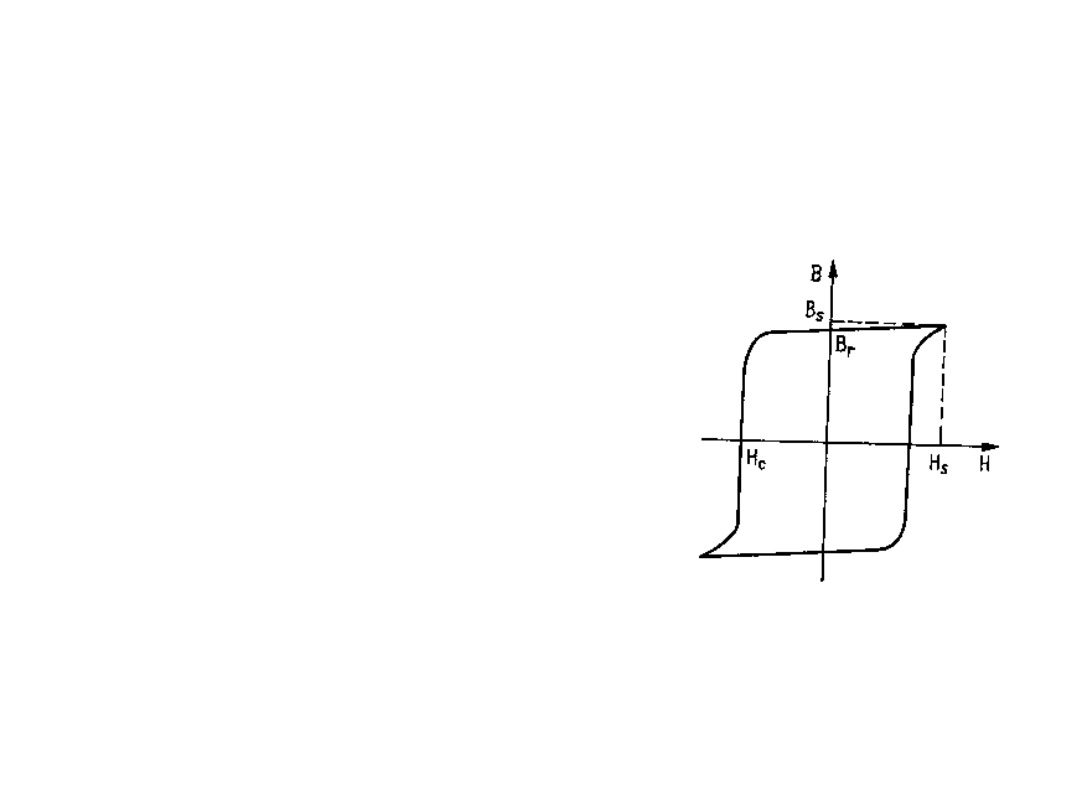
Prostokątna pętla
histerezy

Materiały magnetyczne
twarde
• Stosowane jako magnesy
• Wykonuje się z ziaren tak małych,
że w środku mieści się tylko jedna
domena
• Najczęściej wykonywane metodą
proszków spiekanych

Materiały magnetyczne
twarde - własności

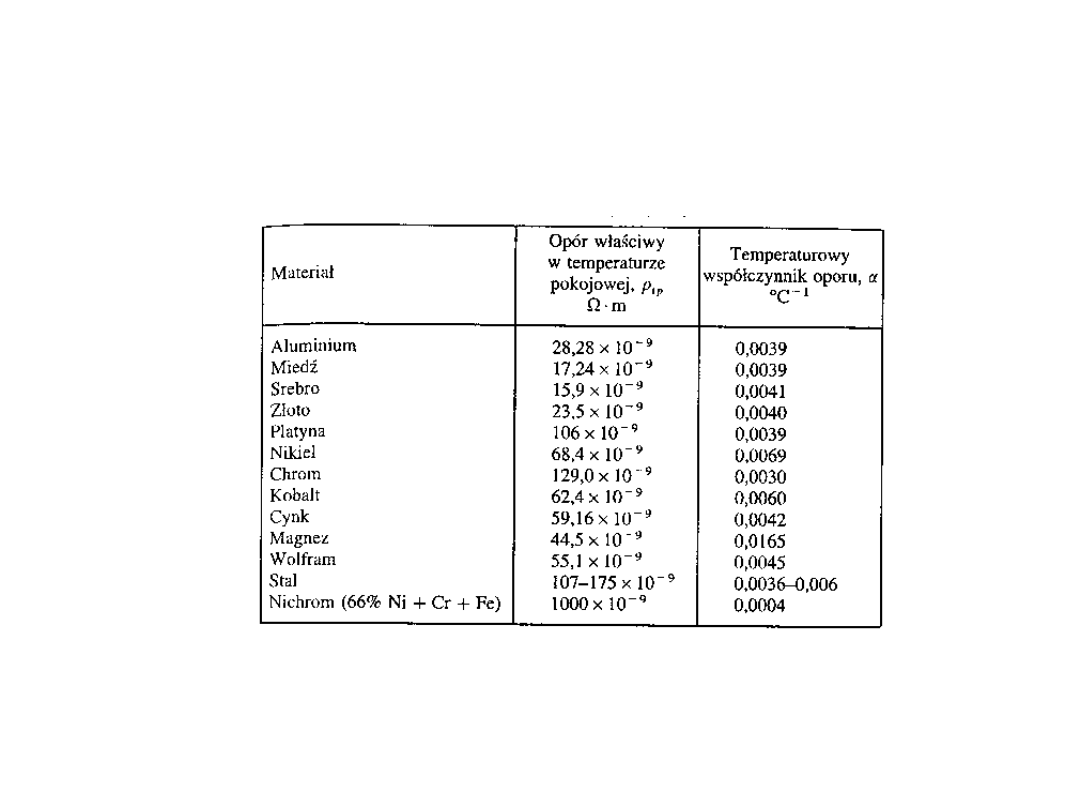
Własności elektryczne
Opór elektryczny jest określony przez
prawo Ohma
I = U / R

Własności elektryczne
Do charakteryzacji materiałów używa się
oporności właściwej [m]
R = l / S
l – długość S – pole przekroju
poprzecznego
Używa się również pojęcia przewodnictwo
właściwe
= 1 / [
-1
m
-1
]

Własności elektryczne
• Materiały dzielimy na:
– Przewodniki
– Półprzewodniki
– Izolatory
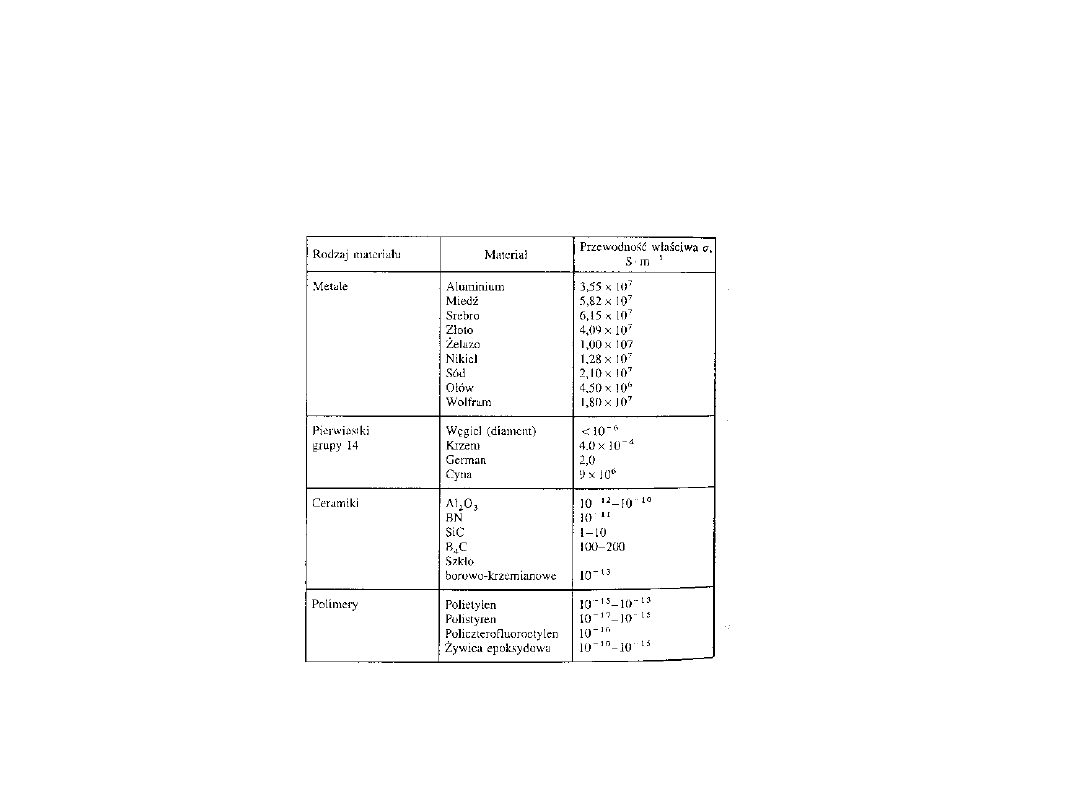
Przewodność elektryczna

Przewodność elektryczna
• Oporność elektryczna zależy od
temperatury
• Oporność metali rośnie w
wyższych temperaturach
• Oporność półprzewodników
zwykle maleje w wyższej
temperaturze.

Przewodność elektryczna
Zależność przewodności
elektrycznej od temperatury opisuje
się jako
=
tp
[1 + ( T – T
p
)]
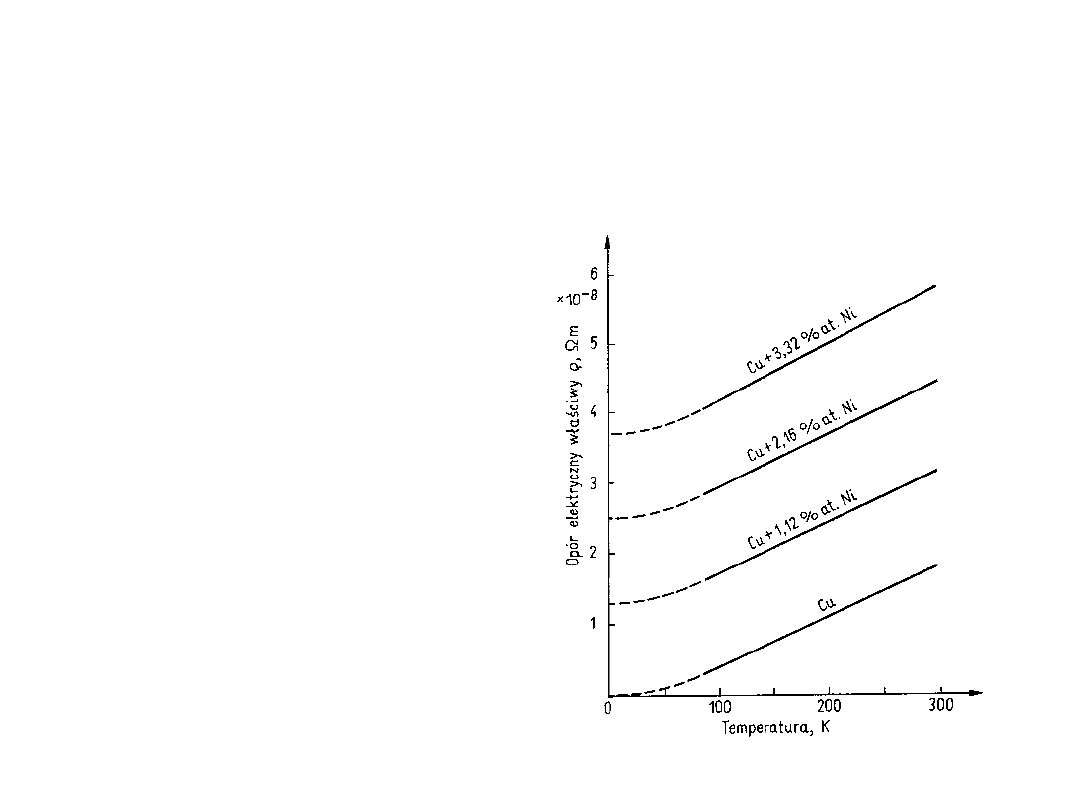
Przewodność elektryczna
Przewodnictwo miedzi
zależy od czystości i
temperatury
Przewodność elektryczna

Własności cieplne
• Przewodnictwo cieplne
• Pojemność cieplna
• Rozszerzalność termiczna

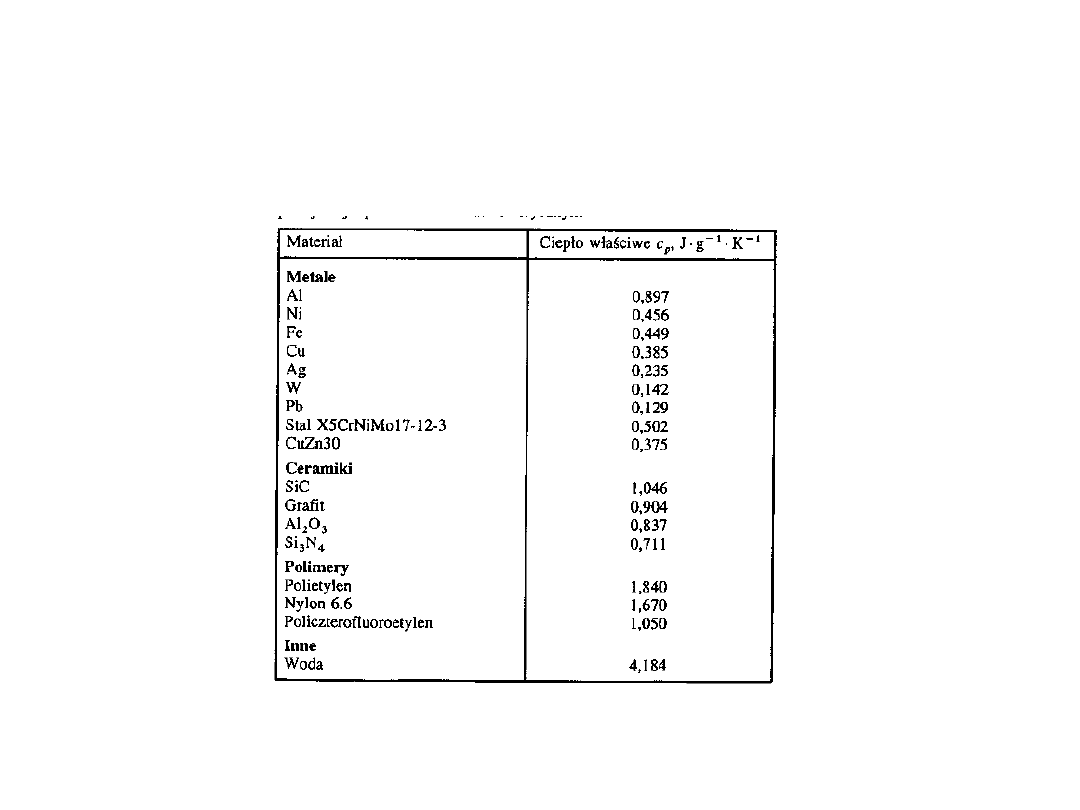
Ciepło właściwe
Ilość energii potrzebna do ogrzania
1 grama o jeden stopień kelvina
Ciepło właściwe mierzymy w [J g
-1
K
-1
]
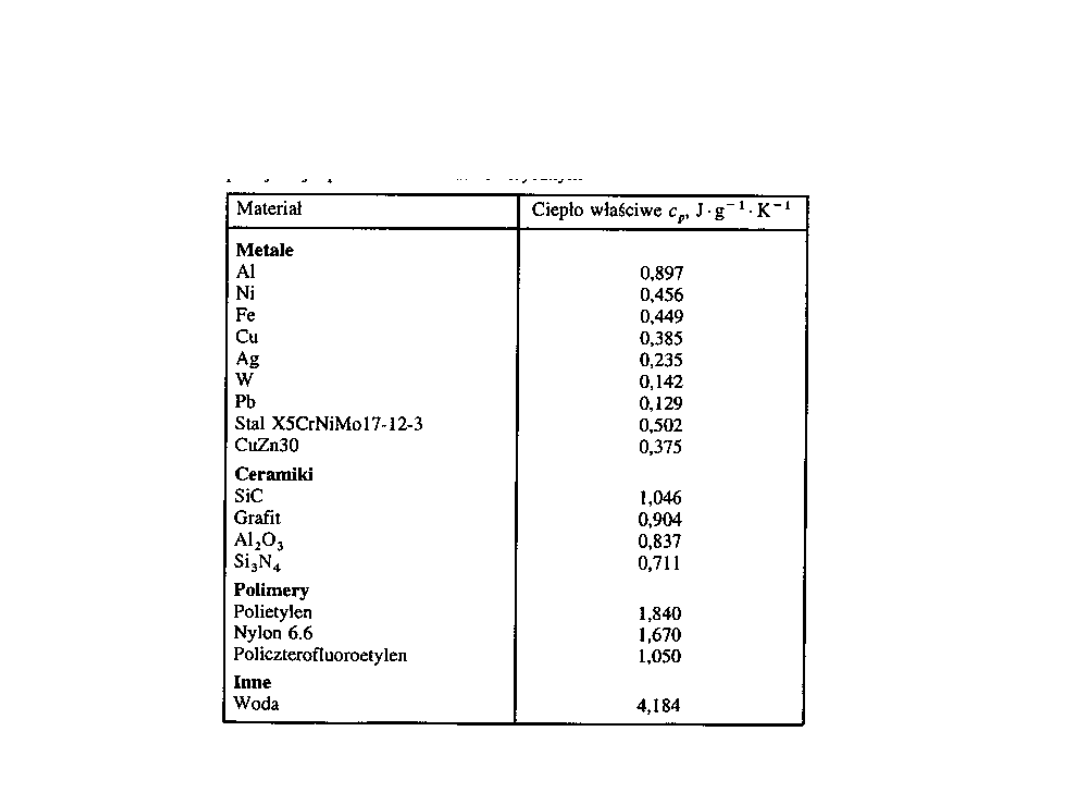
Ciepło właściwe

Przewodnictwo cieplne
Przewodnictwo cieplne jest
zdefiniowane jako
J
Q
= - (dT / dx)
Mierzy ilość ciepła przechodzącą
przez przekrój materiału
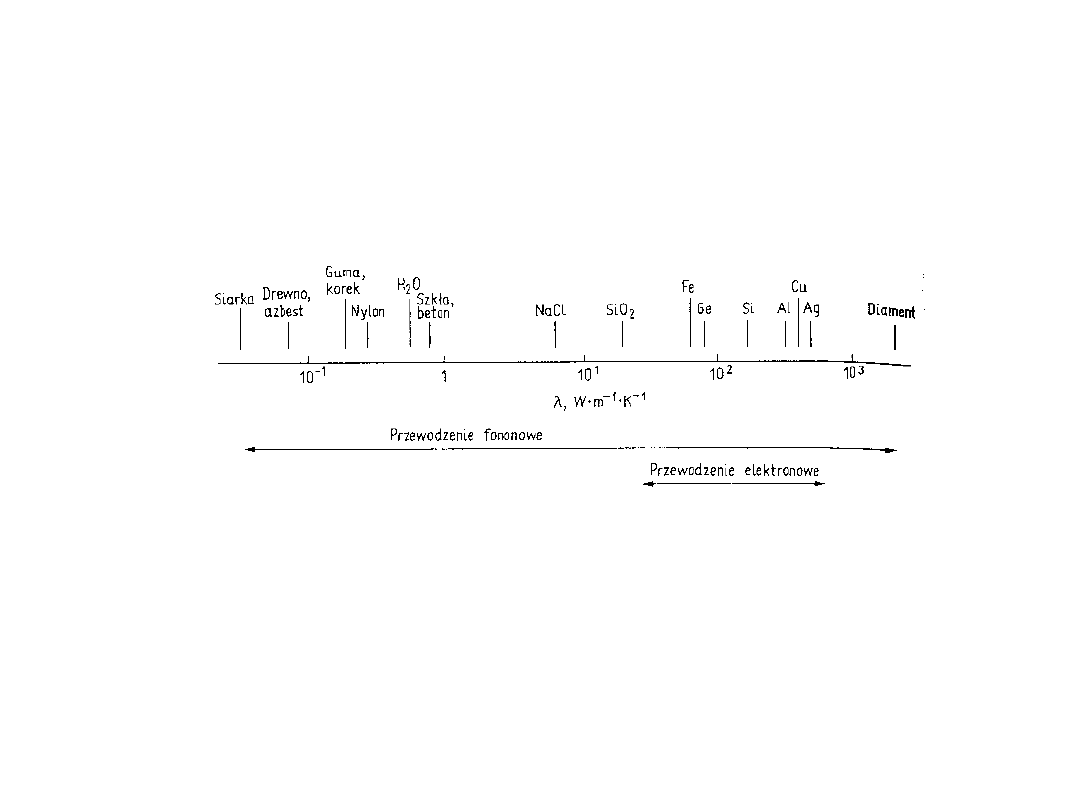
Przewodnictwo cieplne
Przewodnictwo cieplne

Rozszerzalność cieplna
Względna zmiana rozmiaru
liniowego w funkcji temperatury
(L – L
0
) / L
0
= (T – T
0
)
- liniowy współczynnik
rozszerzalności cieplnej [K
-1
]

Własności optyczne

Widmo promieniowania
elektromagnetycznego
Własności optyczne
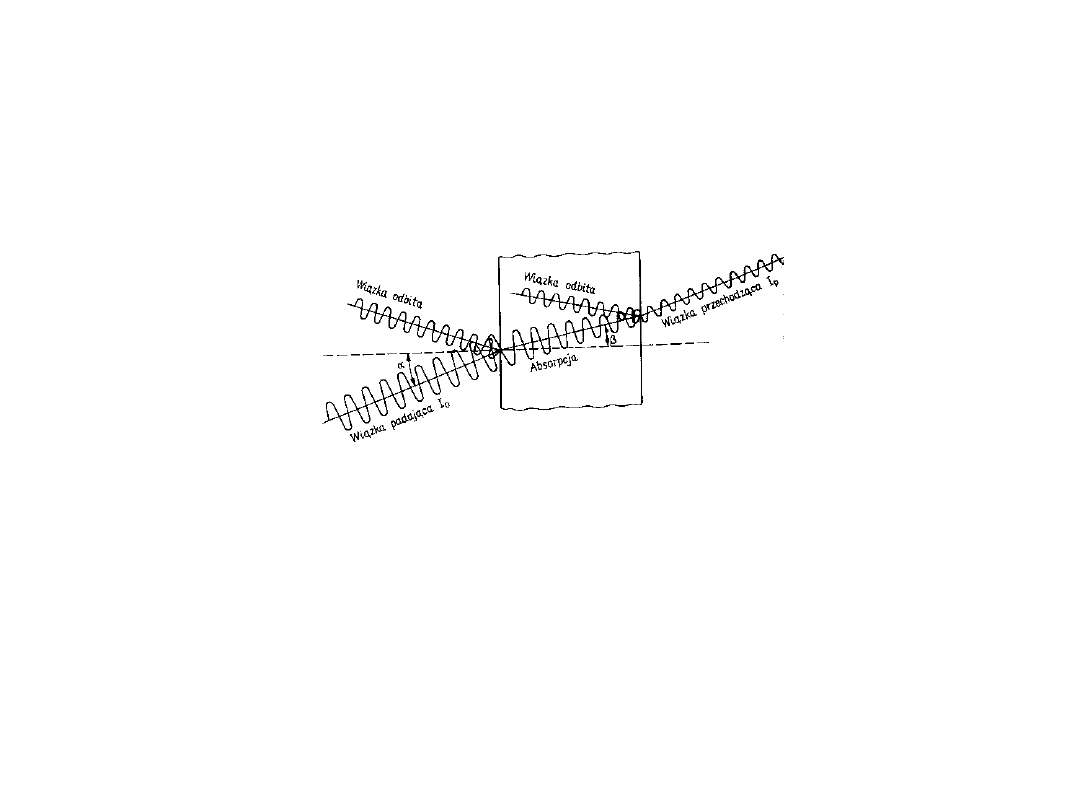
Światło odbija się od powierzchni
część światła wchodzi do materiału, gdzie
może zostać zaabsorbowana lub rozproszona
część światła przechodzi na drugą stronę
Światło wewnątrz materiału może
wielokrotnie odbijać się od powierzchni
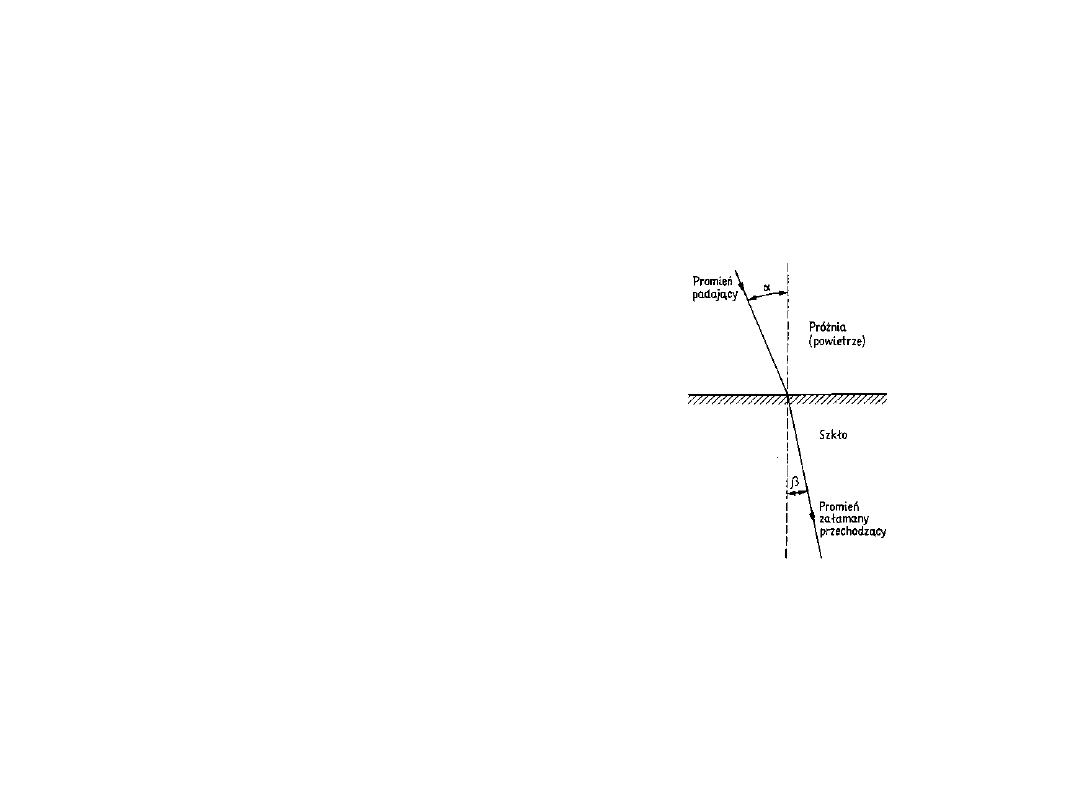
Współczynnik załamania
Współczynnik
załamania n jest
zdefiniowany jako
n = sin / sin
Jest wielkością
bezwymiarową,
zależy od długości
fali światła
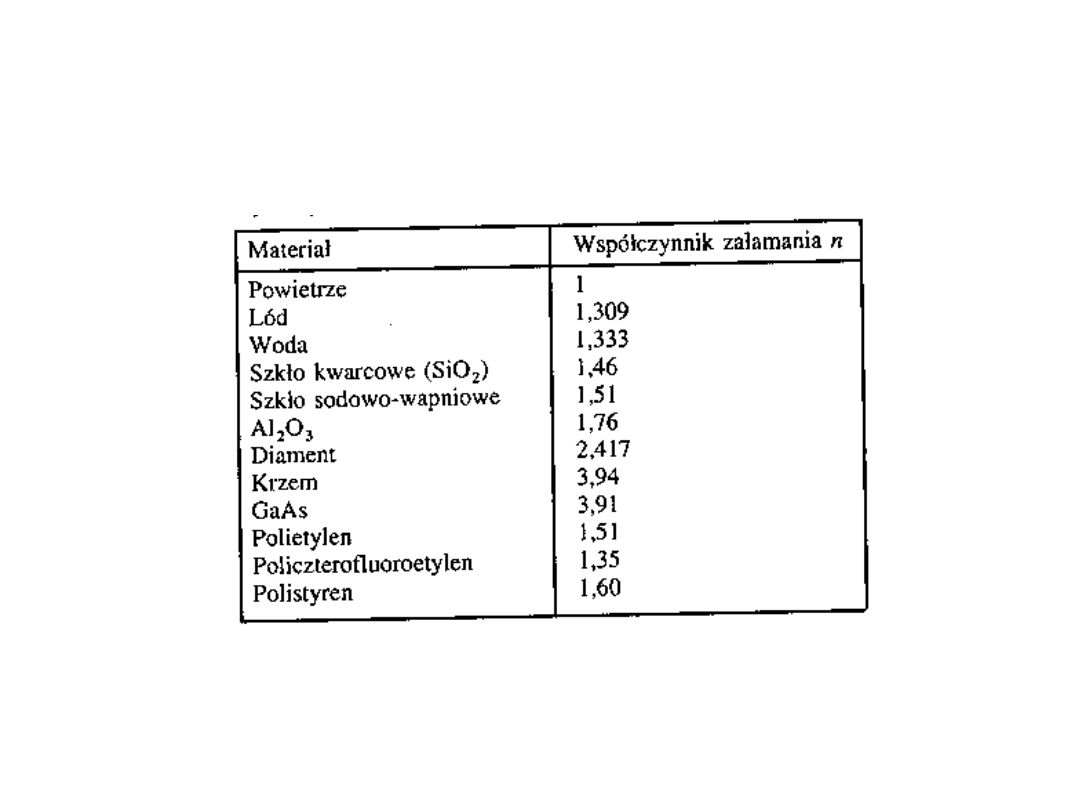
Współczynnik załamania
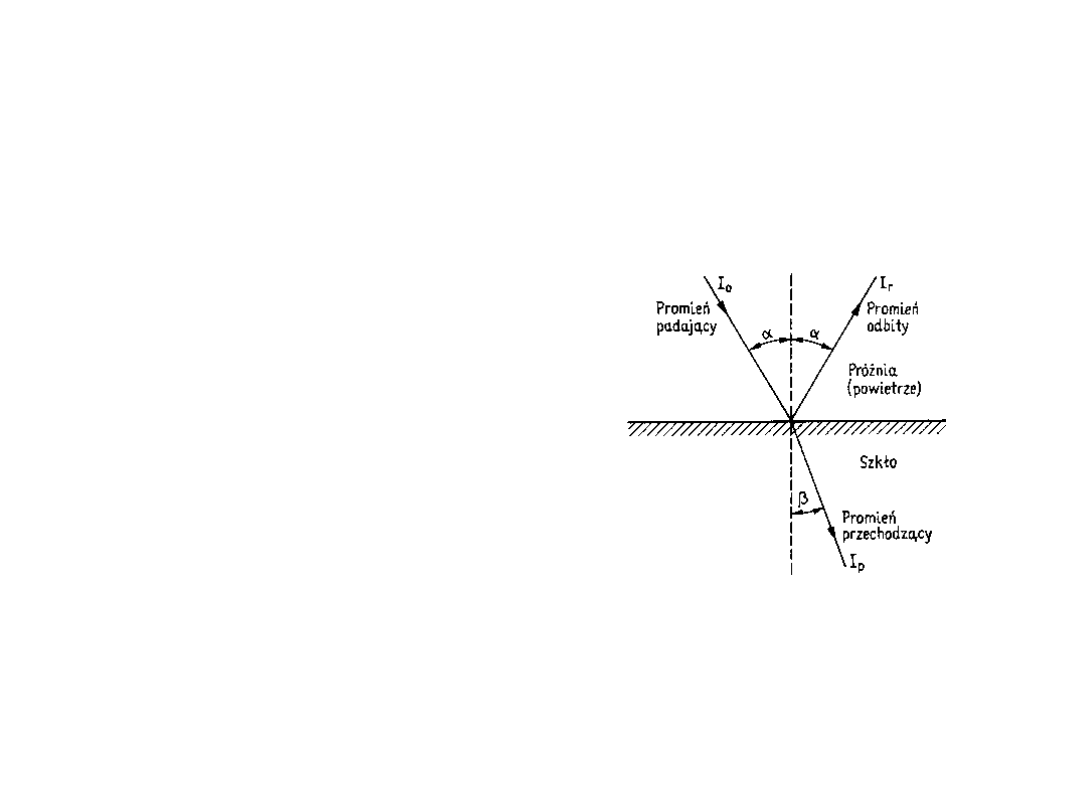
Współczynnik odbicia
Współczynnik odbicia
zależy od
współczynnika
załamania. Jest on
określony wzorem:
R= (n – 1)
2
/
(n+1)
2
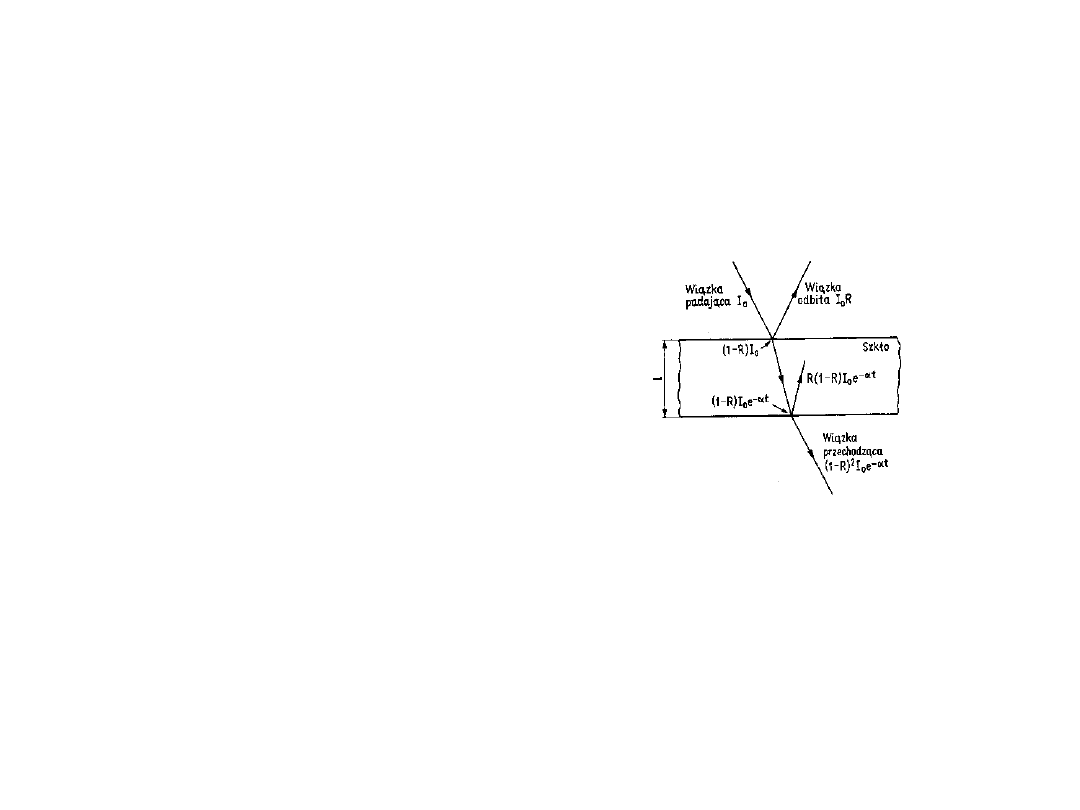
Współczynnik absorpcji

Wykresy fazowe
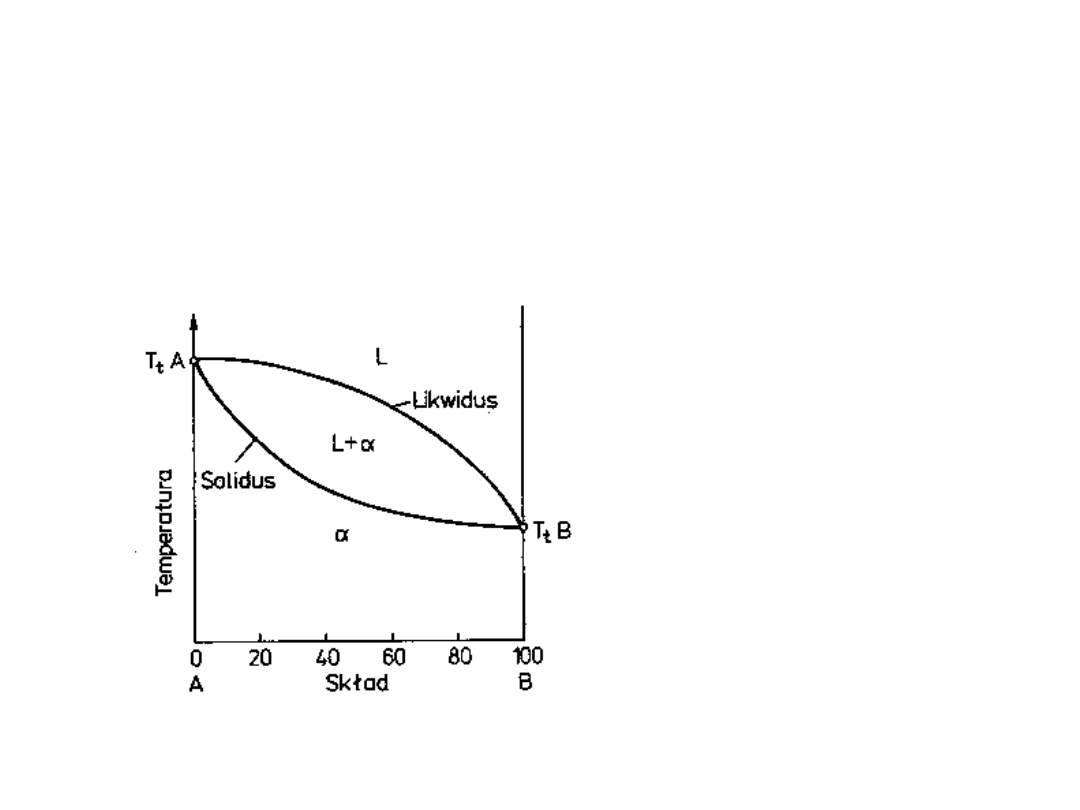
Wykres fazowy dla
substancji wzajemnie się
rozpuszczających
Powyżej linii likwidusu występuje
tylko ciecz
Poniżej linii solidusu występuje tylko
stan (roztwór) stały
Pomiędzy liniami solidusu i
likwidusu współistnieją dwie fazy:
stała i ciekła
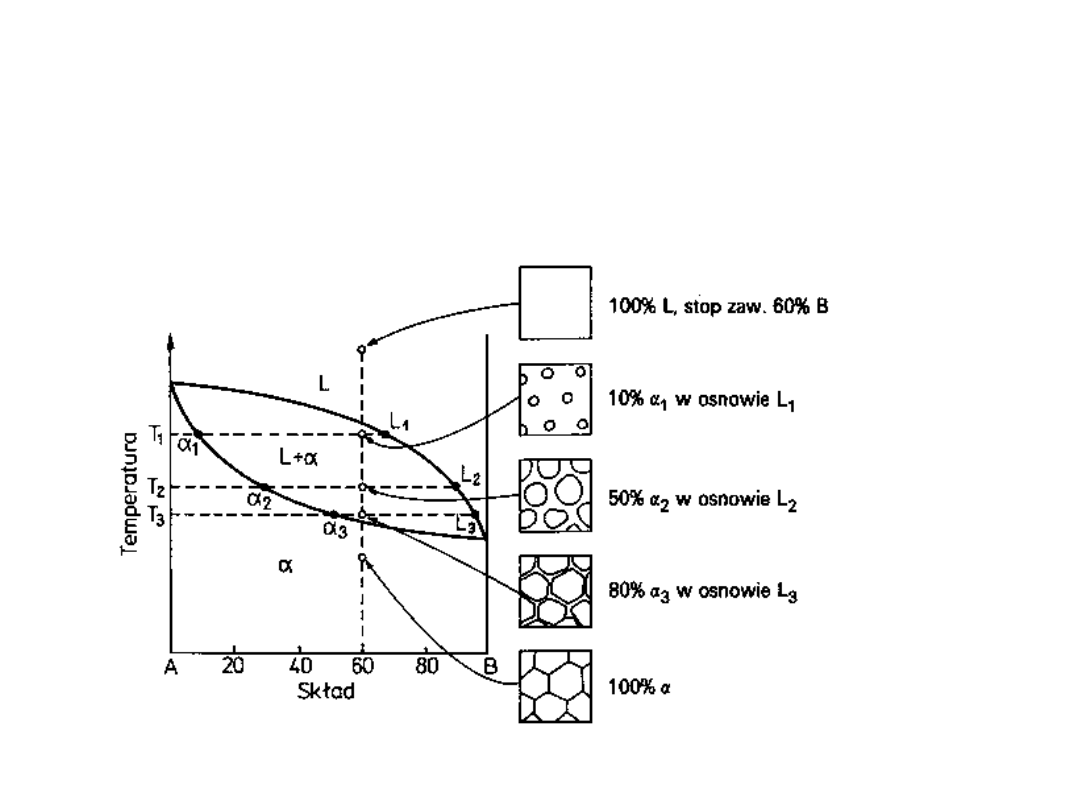
Krzepnięcie układu o
nieograniczonej
rozpuszczalności
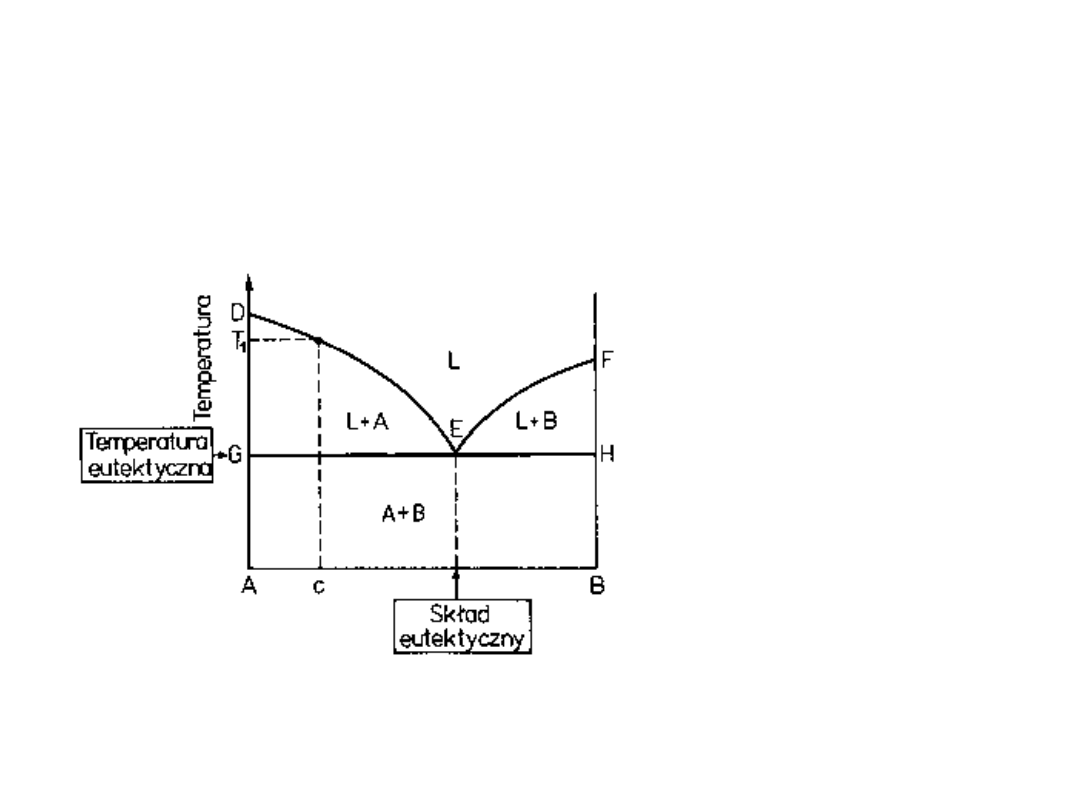
Wykres fazowy dla
składników nie
rozpuszczających się
Ciecz o składzie punktu E jest
nazywana cieczą eutektyczną,
a jej skład składem eutektycznym
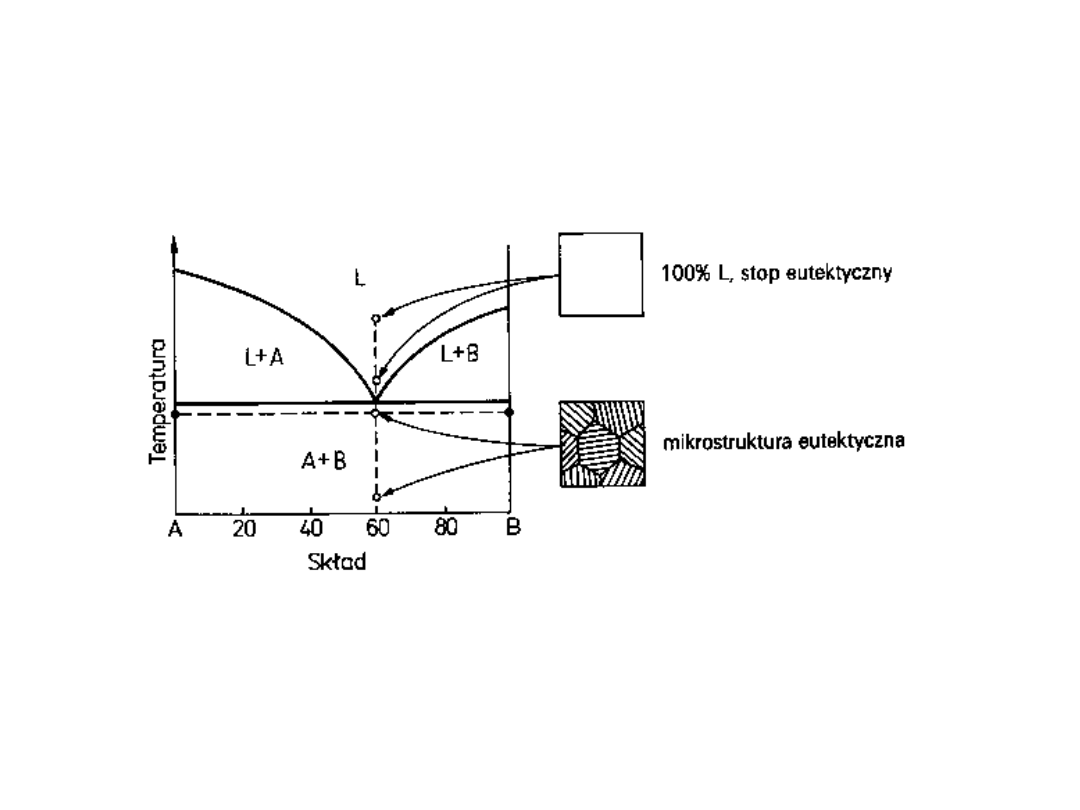
Chłodzenie cieczy
eutektycznej
Powstają zmieszane kryształki składnika A i B
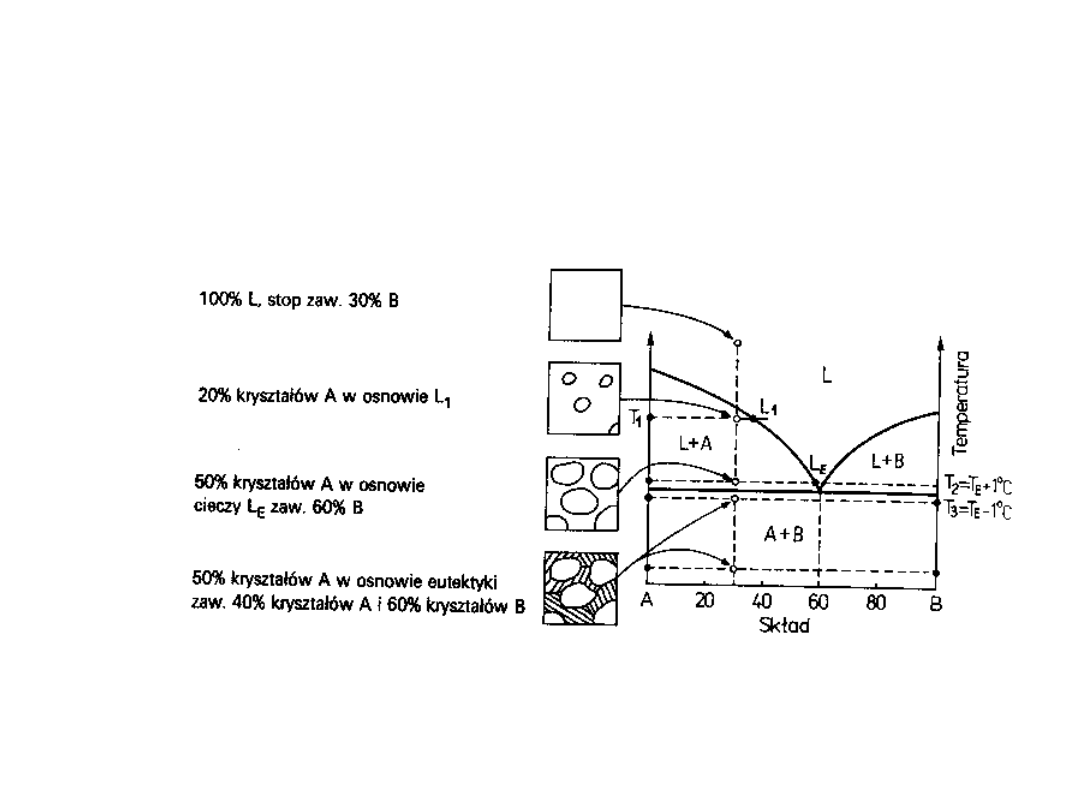
Chłodzenie cieczy
podeutektycznej
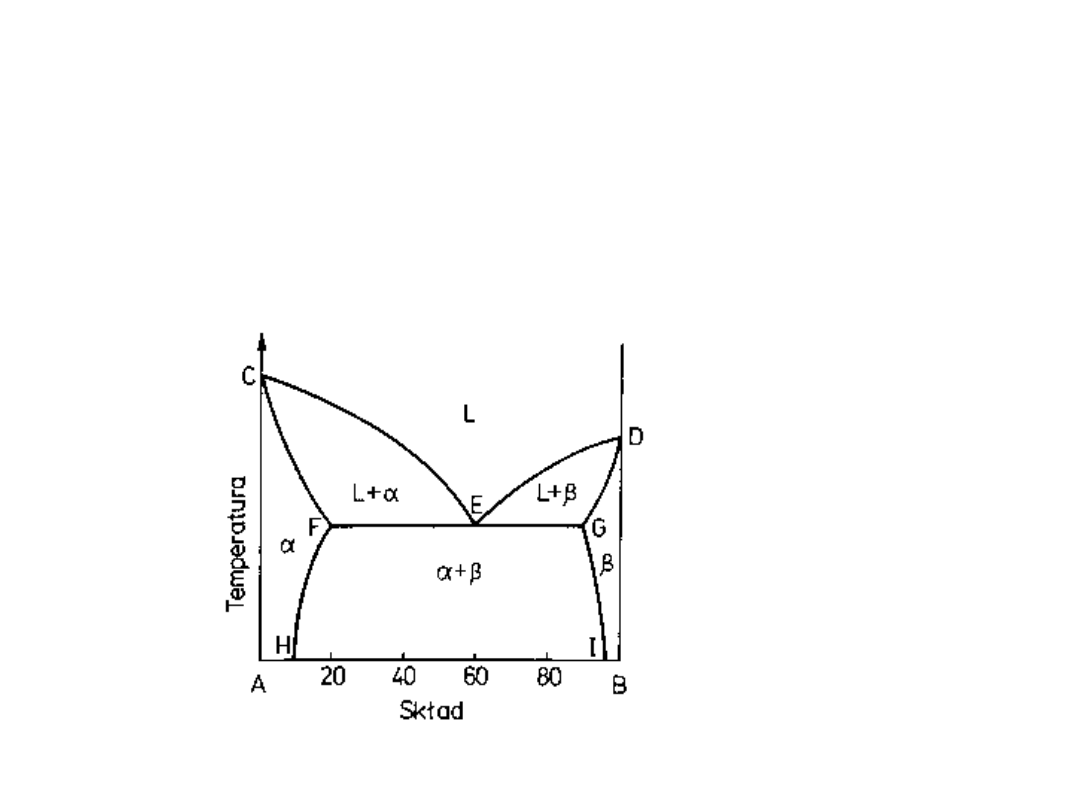
Wykres fazowy z
przemianą eutektyczną
gdy składniki rozpuszczają
się w stanie stałym
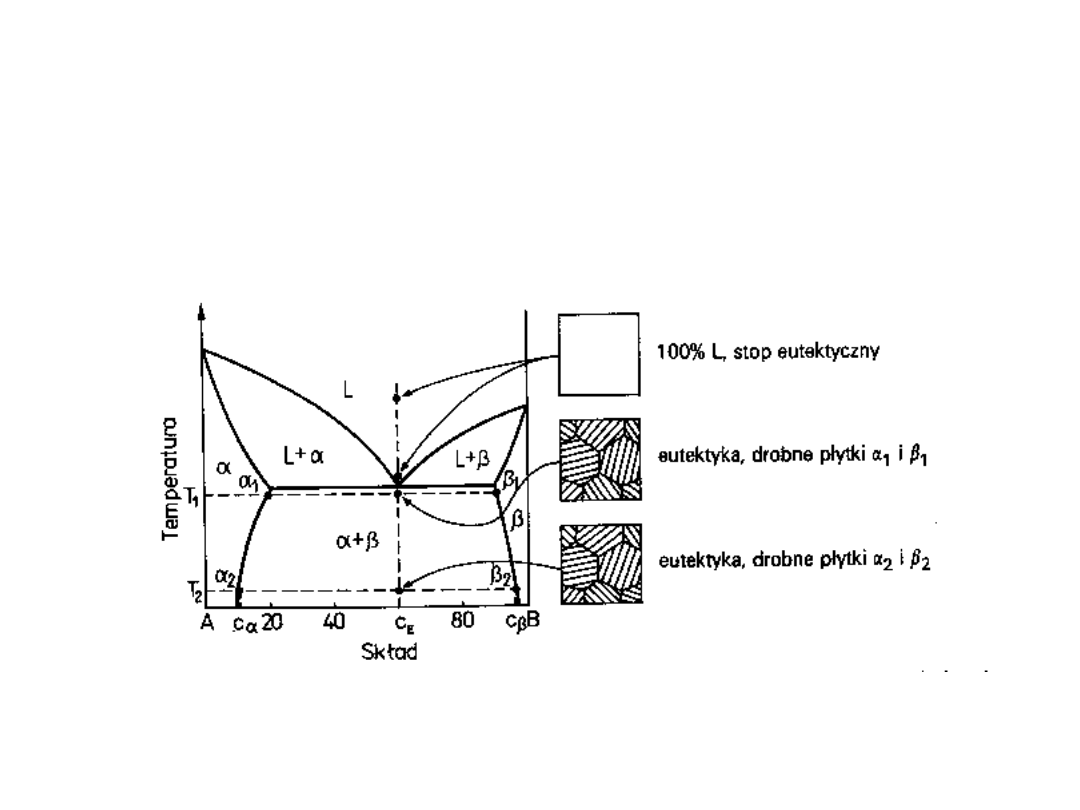
Struktura stopu
eutektycznego w czasie
chłodzenia
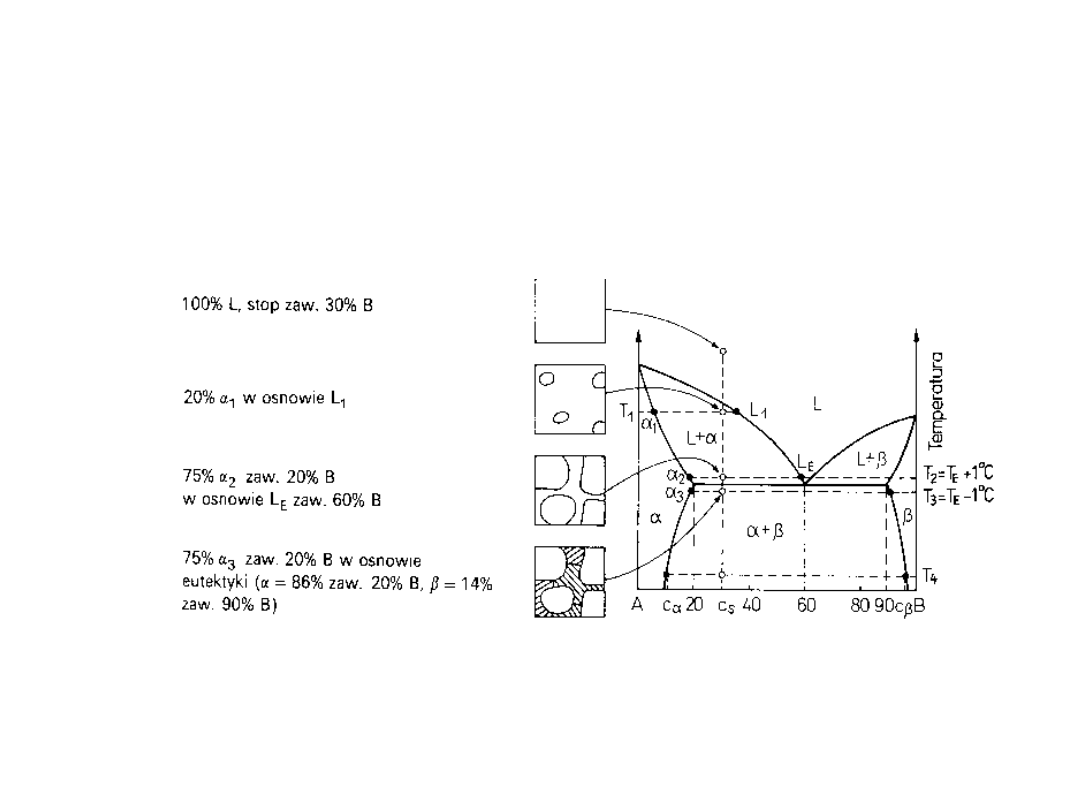
Struktura stopu
podeutektycznego w
czasie chłodzenia
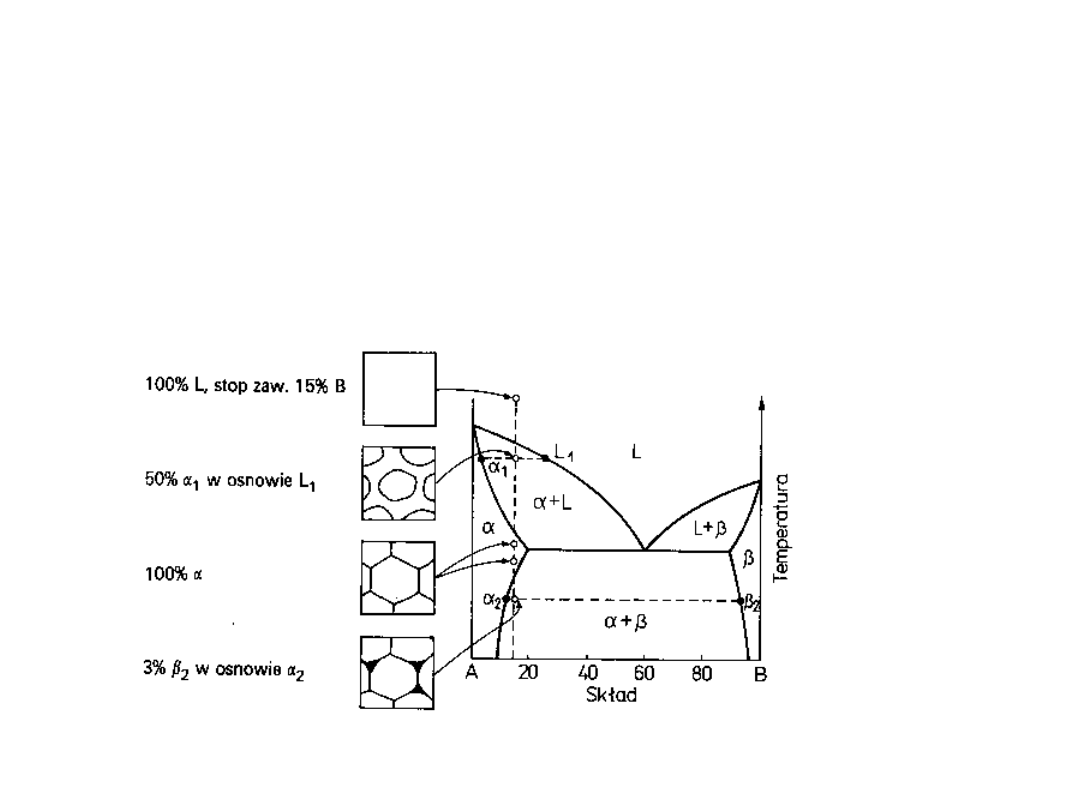
Struktura stopu
podeutektycznego w
czasie chłodzenia bez
przemiany eutektycznej
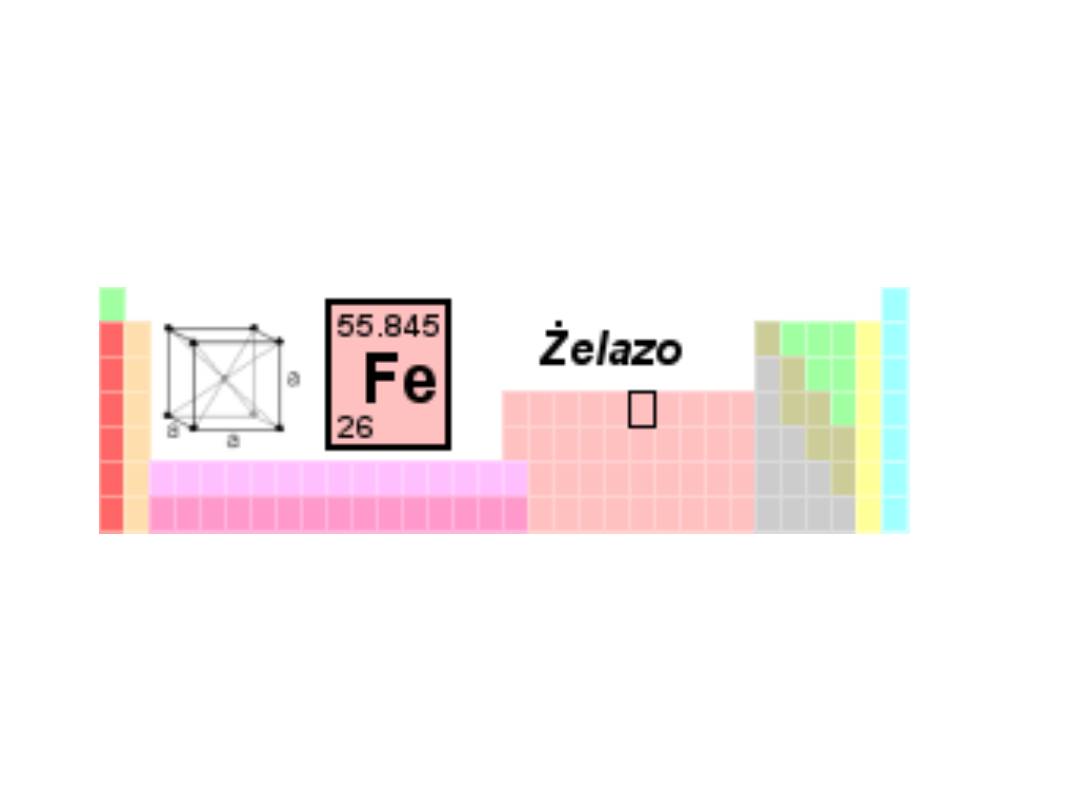
Żelazo - własności

Żelazo - własności
Nazwa, symbol, l.a.*
Żelazo, Fe, 26
Gęstość
7874 kg/m
3
Masa atomowa
55,845 u
Struktura
krystaliczna
regularna
przestrzennie
centrowana
Stan skupienia
stały
Temperatura
topnienia
1808 K (1535
°C)
Temperatura
wrzenia
3023 K (2750
°C)
Temperatura Curie
1043 K (770
°C)

Żelazo - własności
Temperatura Curie
1043 K (770 °C)
Objętość molowa
7,09×10-3
m
3
/mol
Ciepło parowania
349,6 kJ/mol
Ciepło topnienia
13,8 kJ/mol
Prędkość dźwięku
4910 m/s (293,15
K)
Ciepło właściwe
440 J/(kg*K)
Przewodność właściwa
9,93×106 S/m
Przewodność cieplna
80,2 W/(m*K)
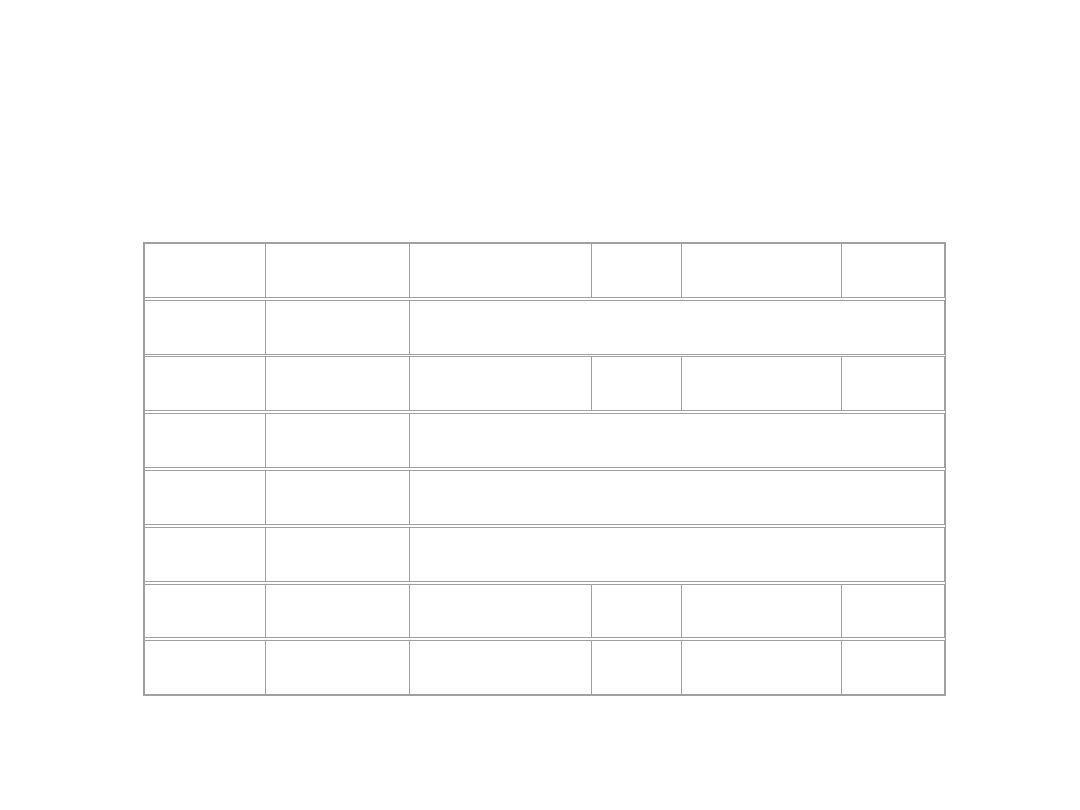
Żelazo - własności
wyst.
54
Fe
5,8%
stabilny izotop z 28
55
Fe
0,231
55
56
Fe
91,72%
stabilny izotop z 30 neutronami
57
Fe
2,2%
stabilny izotop z 31 neutronami
58
Fe
0,28%
stabilny izotop z 32 neutronami
59
Fe
44,503
1,565
59
60
Fe
1,5×10
6
3,978
60

Odmiany alotropowe
czystego żelaza
• Żelazo występuje w trzech
odmianach alotropowych:
– żelazo α
– żelazo γ
– żelazo δ
• Jedynie żelazo α posiada własności
ferromagnetyczne.
• Przemiana alotropowa żelaza α w
żelazo γ zachodzi w temperaturze
723°C przy schładzaniu lub 728°C
przy ogrzewaniu.
• Przemiana alotropowa żelaza γ w
żelazo δ zachodzi w temperaturze
1400°C.
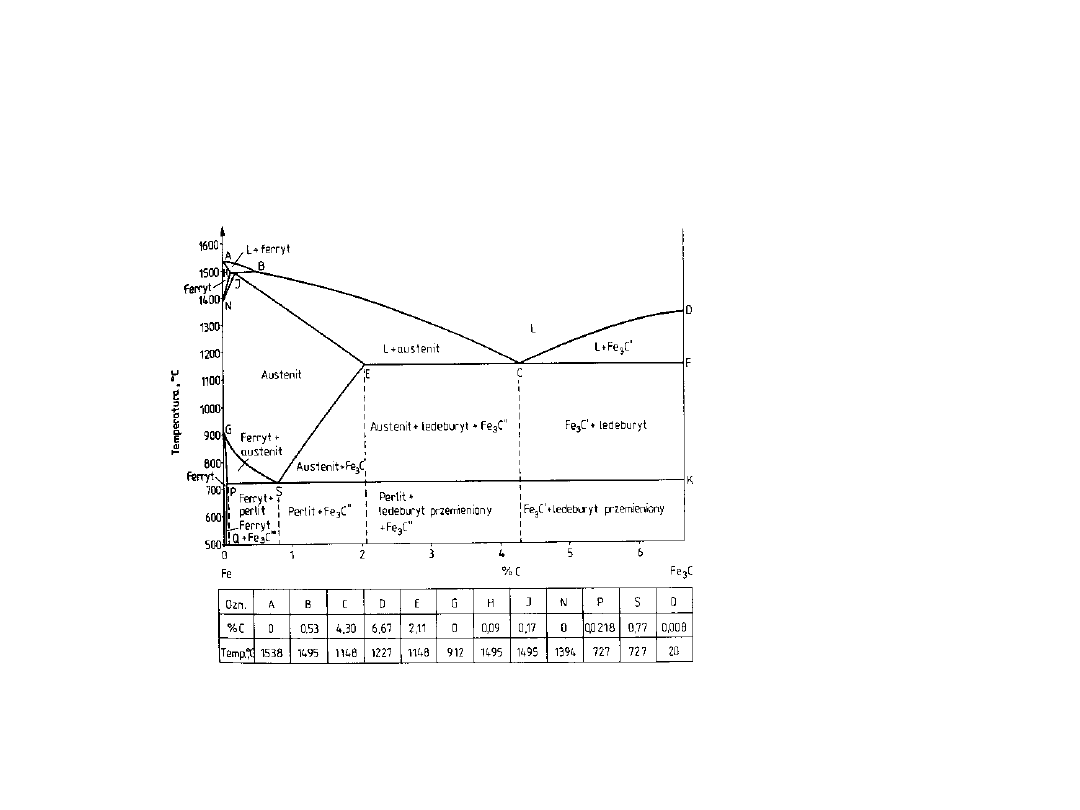
Wykres fazowy żelazo-
węgiel
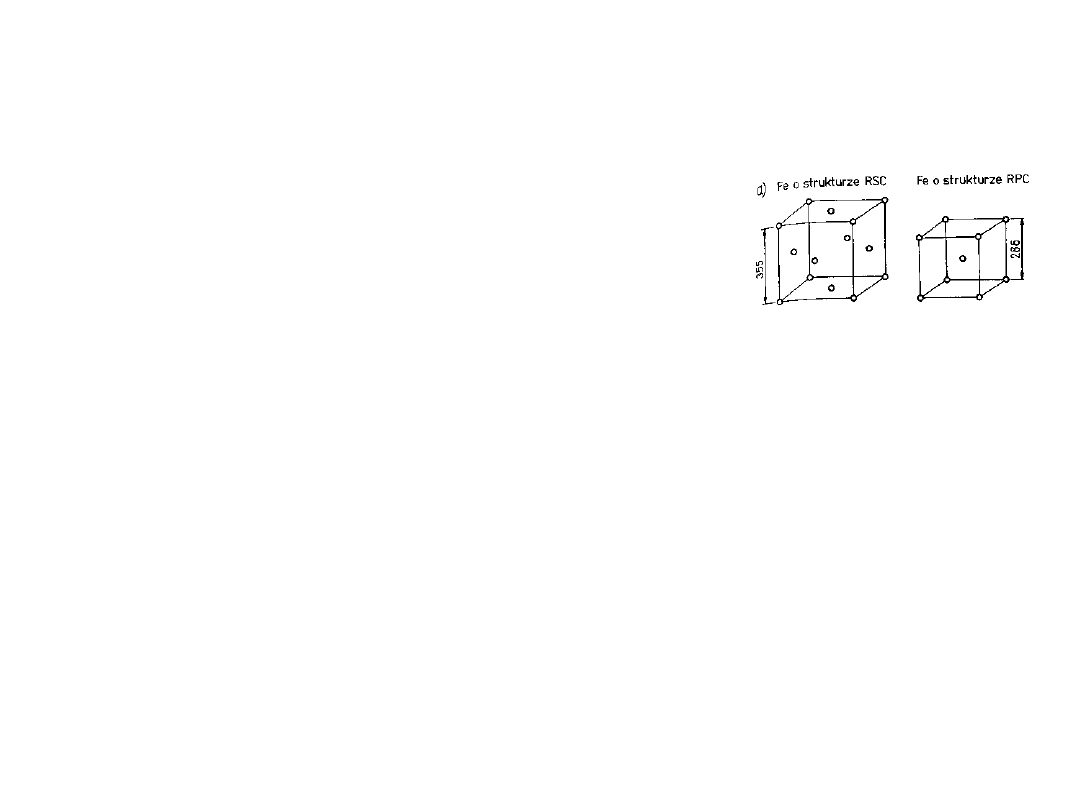
Czyste żelazo
• Fe-
Do temperatury 912
o
C ma ma
strukturę przestrzennie centrowaną (RPC)
• Fe-
od 912
o
C do 1394
o
C ma strukturę
powierzchniowo centrowaną (RSC)
• Fe- ()
od 1394
o
C do temperatury topnienia ma
strukturę przestrzennie centrowaną

Wykres fazowy żelazo-
węgiel
• Ferryt () - międzywęzłowy
roztwór węgla w żelazie .
Maksymalna rozpuszczalność
węgla wynosi 0.02%
• Austenit () - międzywęzłowy
roztwór węgla w żelazie .
Maksymalna rozpuszczalność
węgla wynosi 2.11%

Wykres fazowy żelazo-
węgiel
• Cementyt to węglik żelaza (Fe
3
C).
Zawartość węgla w cementycie jest stała i
wynosi 6.67%
– cementyt wydzielający się z cieczy (poniżej
linii DC) nazywamy cementytem pierwotnym
– cementyt wydzielający się z austenitu (poniżej
linii ES) nazywamy cementytem wtórnym
– Cementyt wydzielający się z ferrytu (poniżej
linii PQ) nazywamy cementytem
trzeciorzędowym

Wykres fazowy żelazo-
węgiel
• Perlit jest produktem przemiany
austenitu zawierającego około
0.77% C. Zbudowany jest z płytek
cementytu i ferrytu o stosunku
grubości ok. 1:8

Wykres fazowy żelazo-
węgiel
• Ledeburyt powstaje z cieczy
zawierającej 4.3% węgla. Składa
się z cementytu i austenitu.
• W temperaturze poniżej 727
o
C
ledeburyt ulega przemianie
tworząc ledeburyt przemieniony

Wykres fazowy żelazo-
węgiel
• Stopy żelaza z węglem do 2.11% C
nazywamy stalami
• Stopy żelaza z węglem o
zawartości węgla powyżej 2.11% C
nazywamy żeliwami
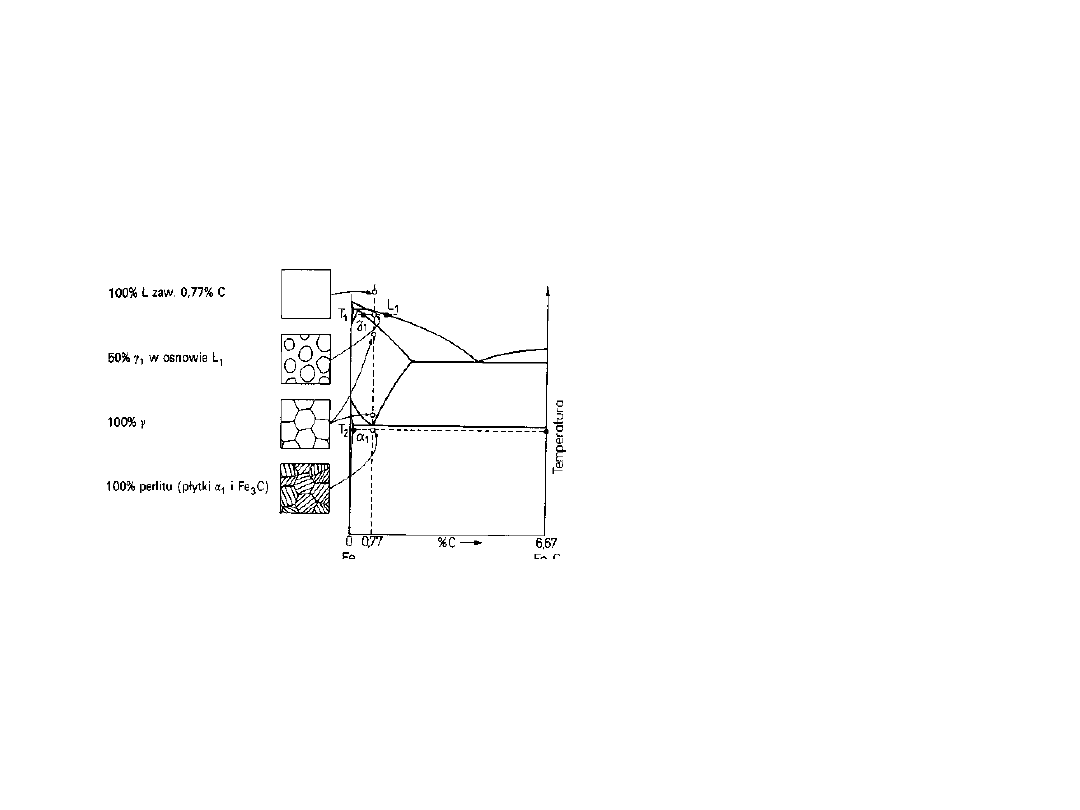
Zmiany struktury stali
(0.77%C) w czasie
chłodzenia
Austenit przemienia się
w perlit
Zmiany struktury poniżej
727
o
C są niewielkie
Zmiany struktury stali
(0.4%C) w czasie
chłodzenia
Z austenitu wydziela się
ferryt
Poniżej 727
o
C pozostały
austenit przemienia się
w perlit
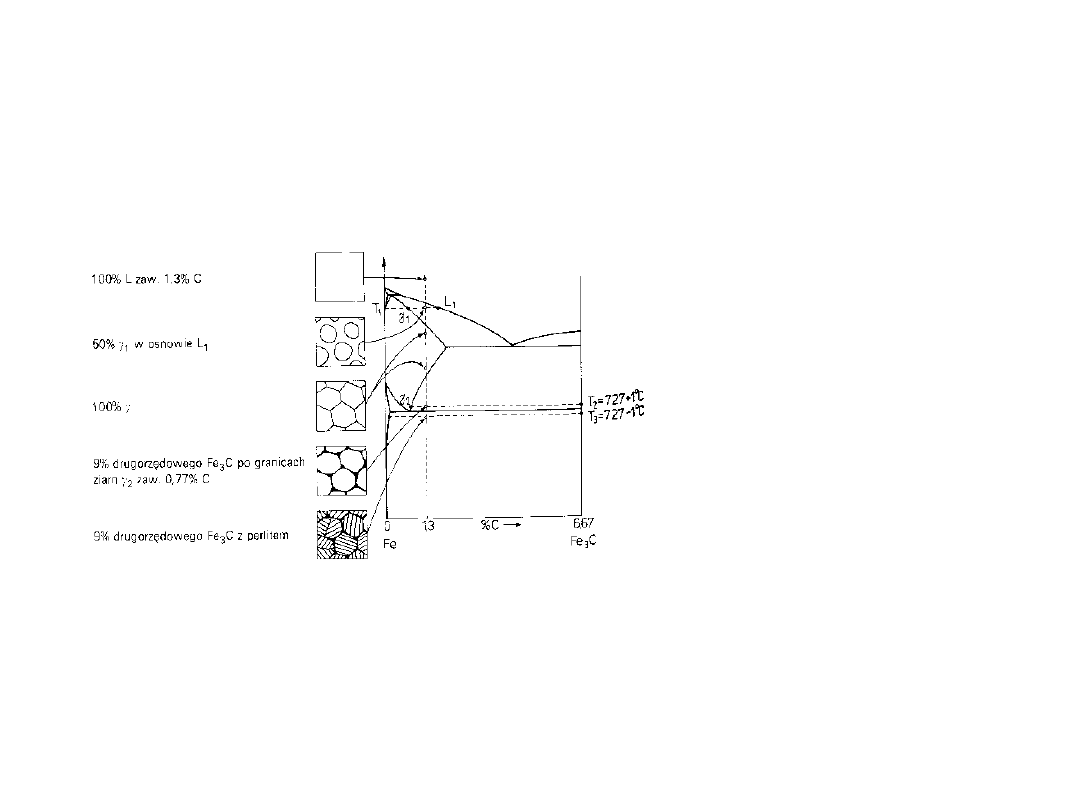
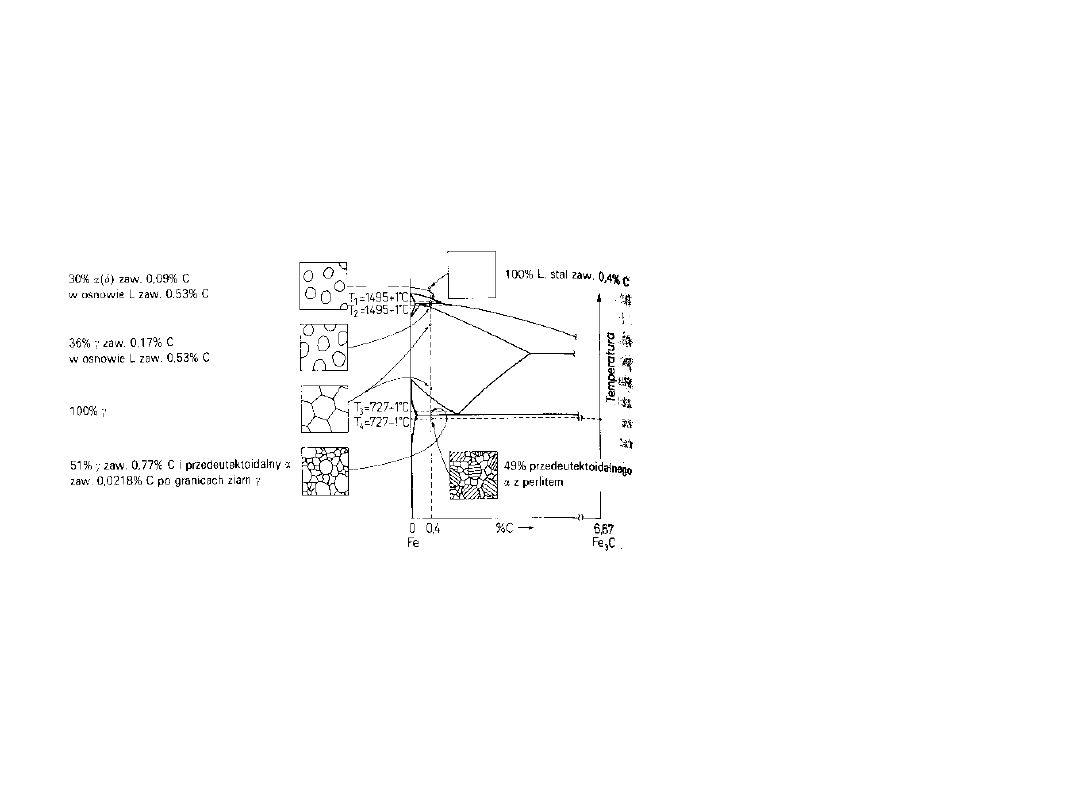
Zmiany struktury stali
(1.3%C) w czasie
chłodzenia
Z austenitu wydziela się
cementyt wtórny
Poniżej 727
o
C pozostały
austenit przemienia się
w perlit
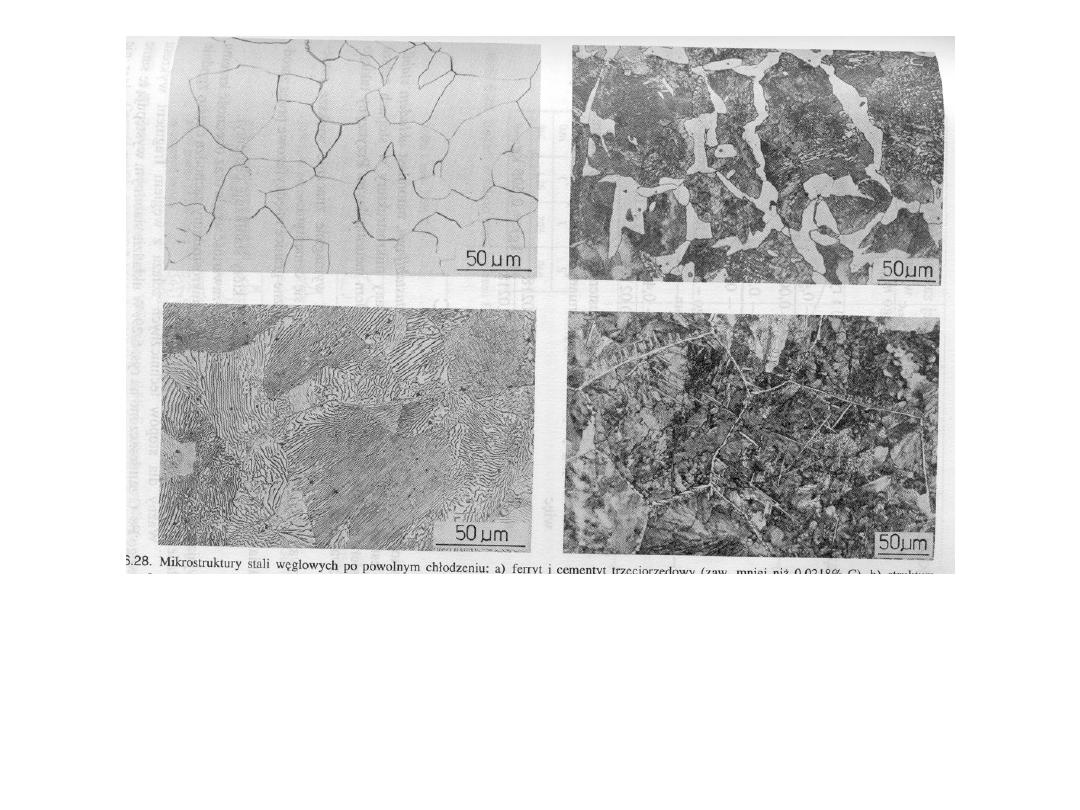
Struktura stali po powolnym chłodzeniu.
a) ferryt i cementyt trzeciorzędowy (poniżej 0.02%C
b) struktura ferrytyczno-perlityczna (0.6%C)
c) struktura perlityczna (0.77%C)
d) perlit i cementyt drugorzędowy

Wykres fazowy żeliwa
• Przemiany fazowe w systemie Fe-C występują
w układzie stabilnym bądź w układzie
metastabilnym
• Układ Fe-Fe
3
C jest układem metastabilnym
• Układ Fe-C (grafit) jest układem stabilnym
• Zwykle przemiany fazowe zachodzą według
układu metastabilnego. Przy większych
koncentracjach węgla, zwłaszcza w obecności
Si, przemiany mogą zachodzić w układzie
stabilnym
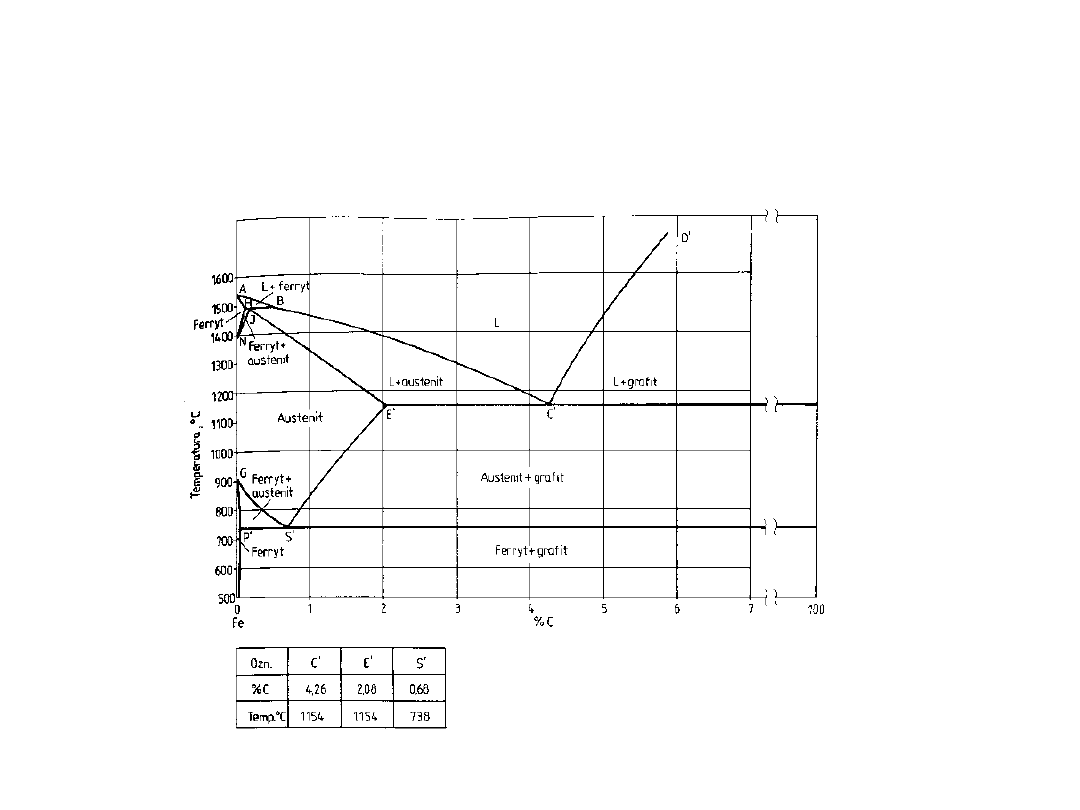
Wykres fazowy żelaza
(stabilny)
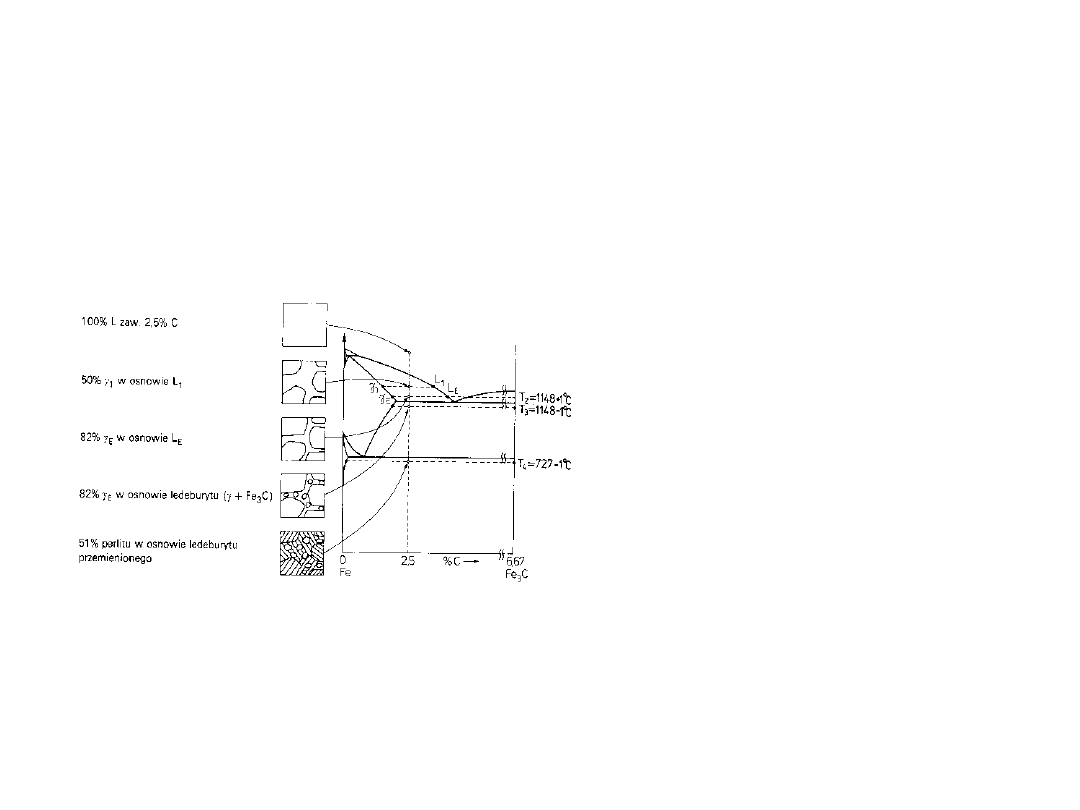
Zmiany struktury stopu
Fe-C
(2.5%C) w czasie
chłodzenia według układu
metastabilnego
Powstaje austenit w
osnowie ledeburytu
Poniżej 727
o
C austenit
przemienia się w perlit
ledeburyt przemienia się
w ledeburyt przemieniony
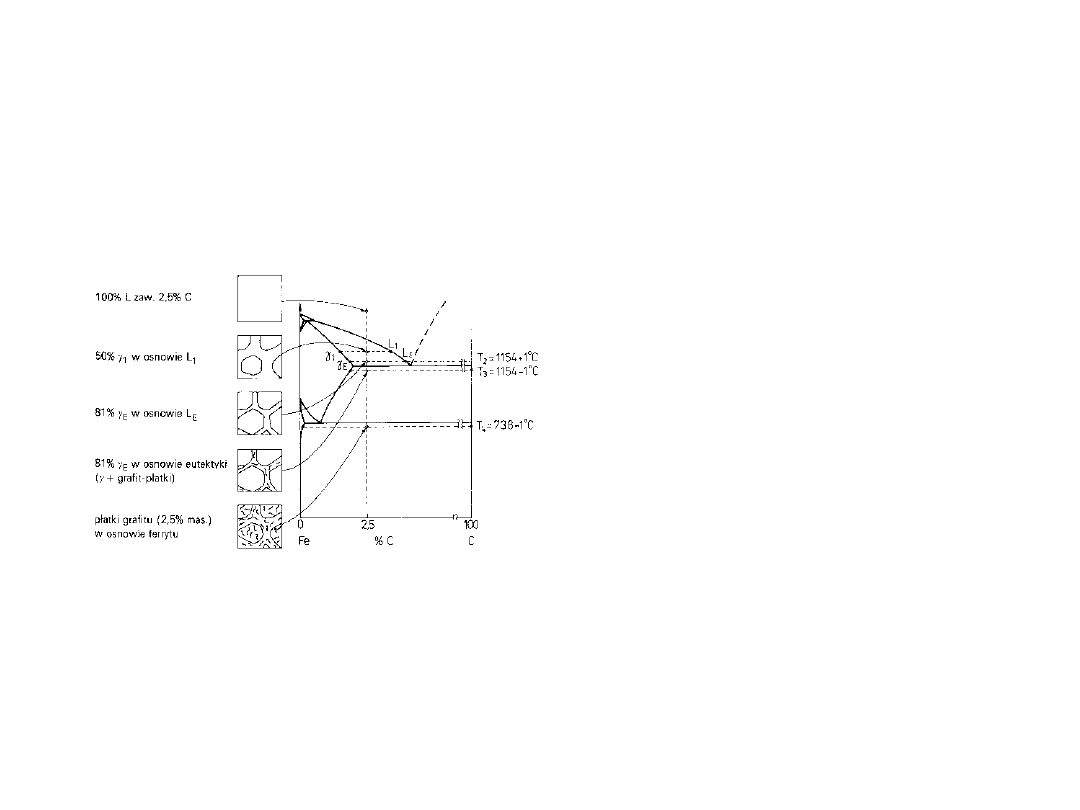
Zmiany struktury stopu
Fe-C
(2.5%C) w czasie
chłodzenia według układu
stabilnego
Powstaje austenit w
osnowie eutektyki
żelazo-grafit (płatki)
Poniżej 727
o
C austenit
przemienia się w perlit
z eutektyki wydziela się
ferryt i grafit

Kinetyka przemian
fazowych - hartowanie
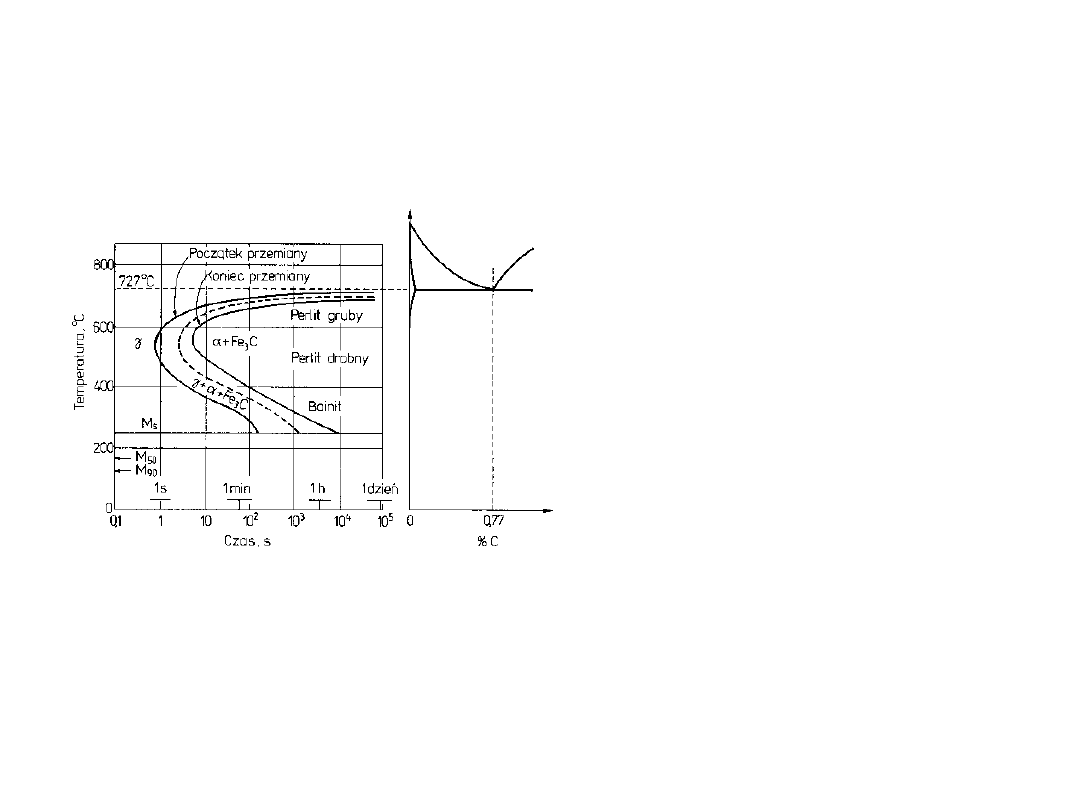
Wykresy CTP
Wykresy Czas,
Temperatura, Przemiana
pokazują kinetykę przemiany
fazowej
Krzywa z lewej strony reprezentuje początek przemiany
fazowej (1% objętości), linia przerywana 50% przemiany, a
krzywa z prawej koniec przemiany (99%)
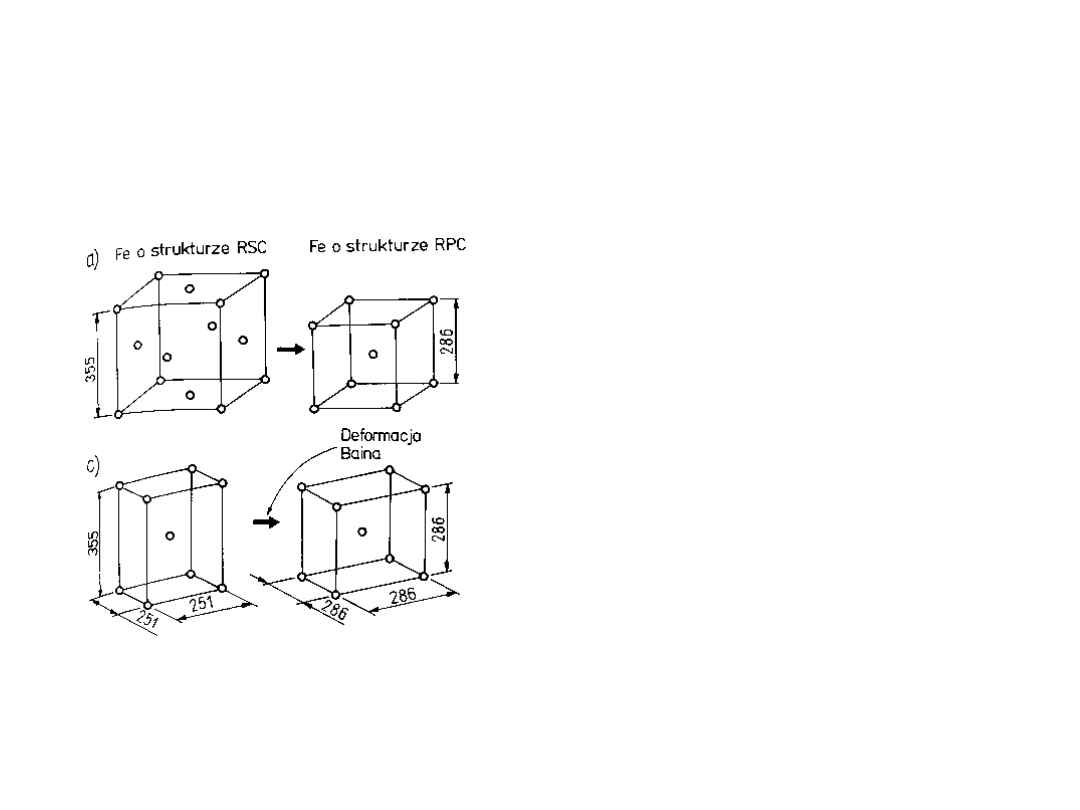
Przemiana
martenzytyczna
Austenit usiłuje
przekształcić się w
żelazo . Ale
rozpuszczony
węgiel przeszkadza.
W wyniku
dostajemy
zniekształconą
strukturę żelaza .

Przemiana
martenzytyczna
• Obróbkę cieplną prowadzącą do
powstania struktury martenzytycznej
nazywamy hartowaniem
• Przemiana martenzytyczna
wprowadza naprężenia do materiału
• Objętość właściwa martenzytu jest
większa od austenitu z którego
powstał (przedmiot hartowany
zmienia rozmiar)

Przemiana
martenzytyczna
• Temperatura
przemiany bardzo
silnie zależy od
składu stali
• M
s
(
o
C)=561-
474(%C)-
33(%Mn)-
17(%Ni)-17(%Cr)-
21(%Mo)
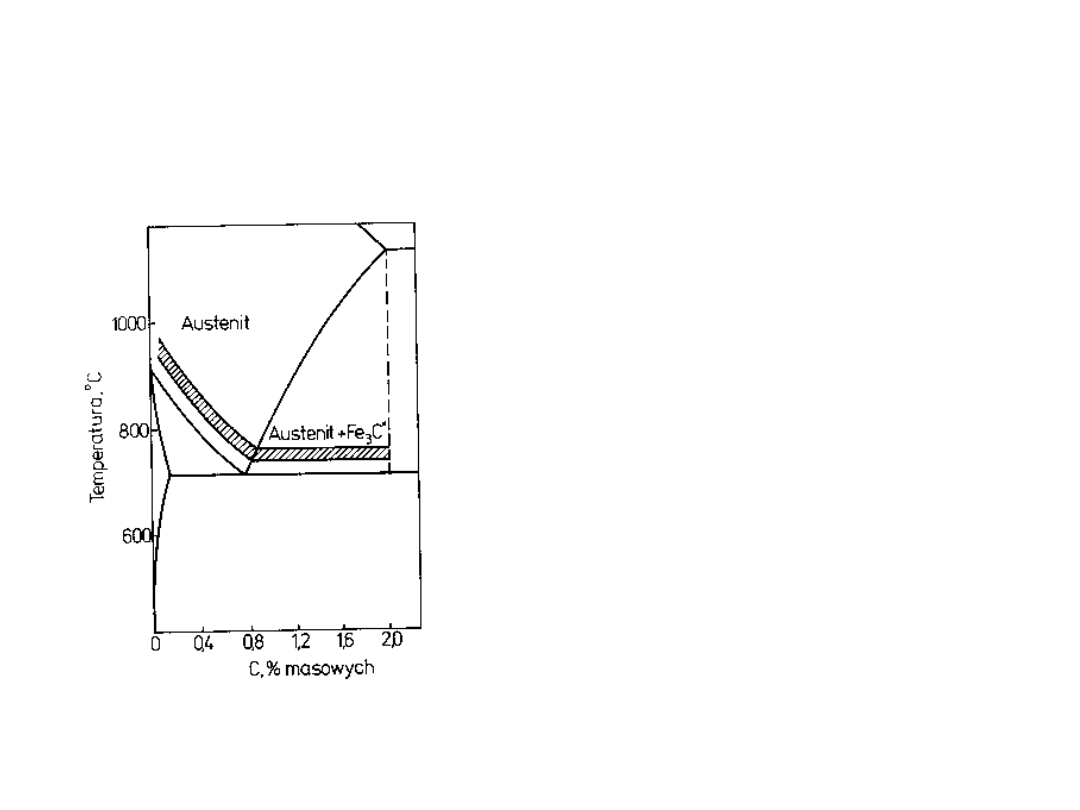
hartowanie
Celem hartowania jest powstanie
struktury martenzytycznej, która
może powstać tylko z austenitu
w czasie hartowania stali trzeba
ją podgrzać do temperatury
umożliwiającej powstanie austenitu
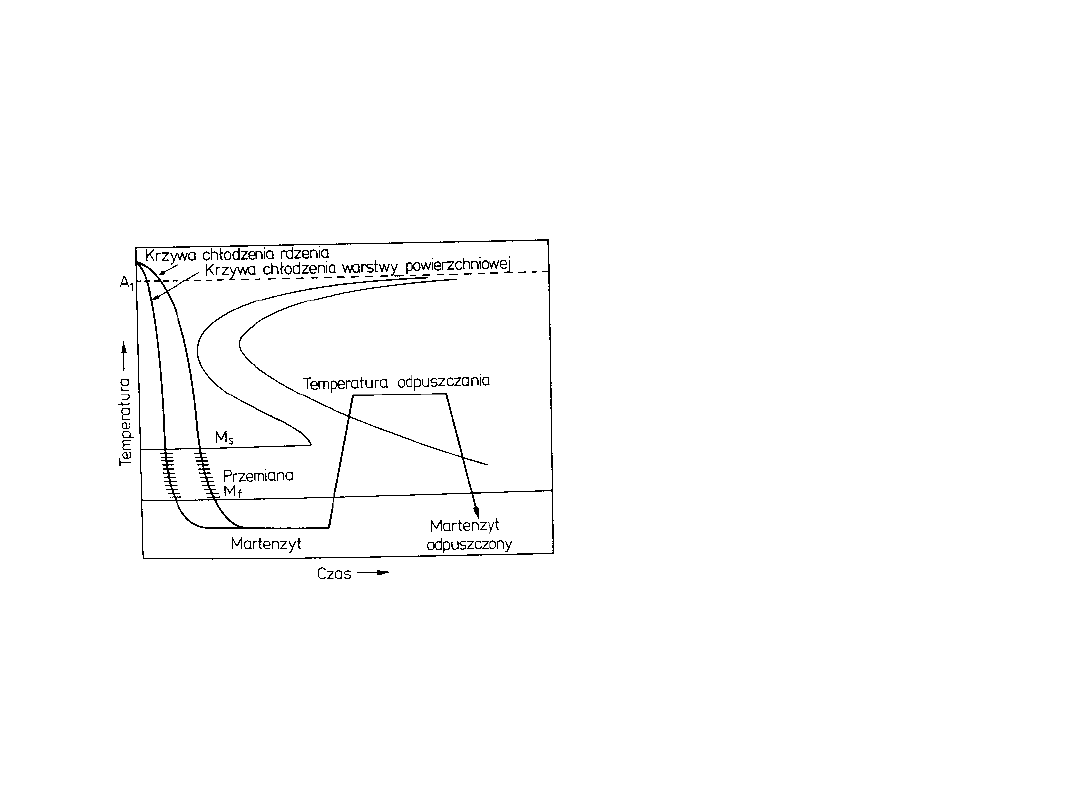
hartowanie
W czasie hartowania należy
stal chłodzić szybko aby
uniknąć przemian w zakresie
dyfuzyjnym
w czasie hartowania powstają
duże naprężenia z powodu
różnicy temperatur pomiędzy
powierzchnią a rdzeniem
materiału
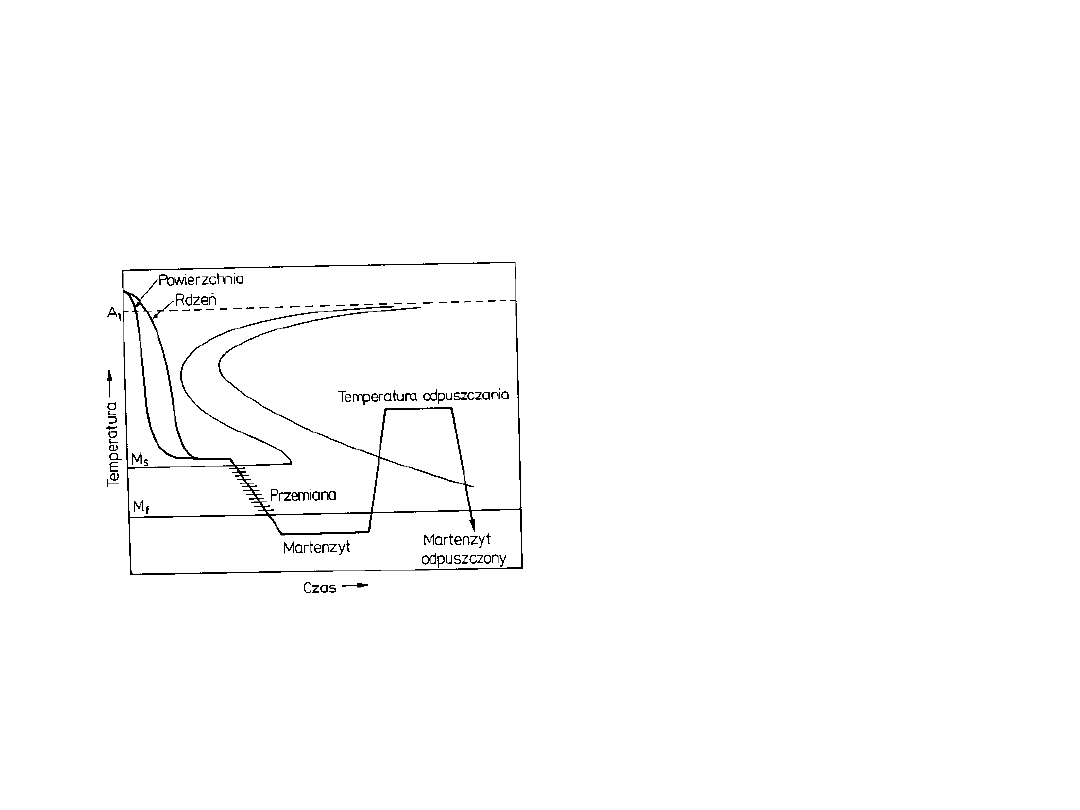
Hartowanie stopniowe
Przedmiot wytrzymuje się
w temperaturze trochę
powyżej M
s
aż do
wyrównania temperatur,
a następnie powoli chłodzi
umożliwiając przemianę
jednocześnie w całej
objętości
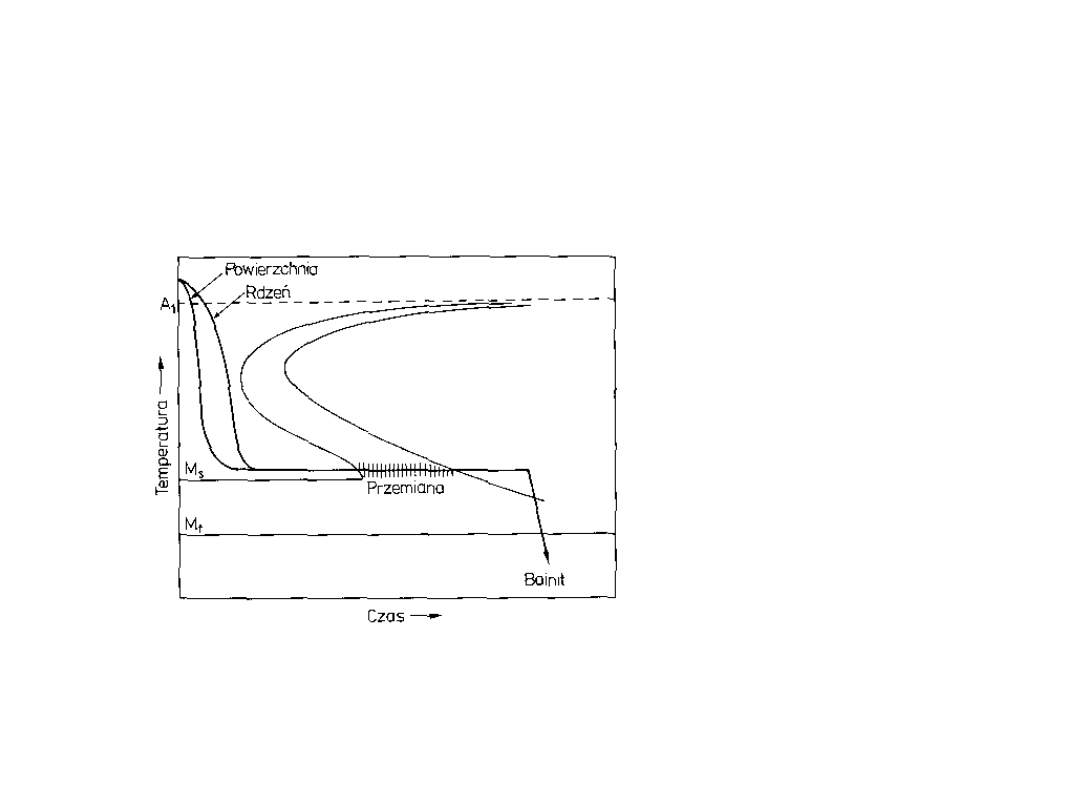
Hartowanie izotermiczne
Oziębianie zostaje
zatrzymane tuż
powyżej M
s
a czas
wytrzymania jest
dostatecznie dłgi

odpuszczanie
• Po zahartowaniu stal ma bardzo
złe własności plastyczne
• Obróbka cieplna polegająca na
nagrzaniu zahartowanej stali w
celu poprawy własności
plastycznych jest nazywana
odpuszczaniem

Stadia odpuszczania
• 100-200
o
C - struktura staje się podobna do
bainilitu. Wytrzymałość stali (zwykle)
maleje
• 200-350
o
C – następuje przemiana austenitu
szczątkowego w ferryt i cementyt.
Powoduje to umocnienie stali
• 250-400
o
C – wydzielanie cementytu, ruch
dyslokacji. Wytrzymałość stali zmniejsza się
• 400-727
o
C – rekrystalizacja osnowy.
Powyżej 727
o
C tworzy się austenit
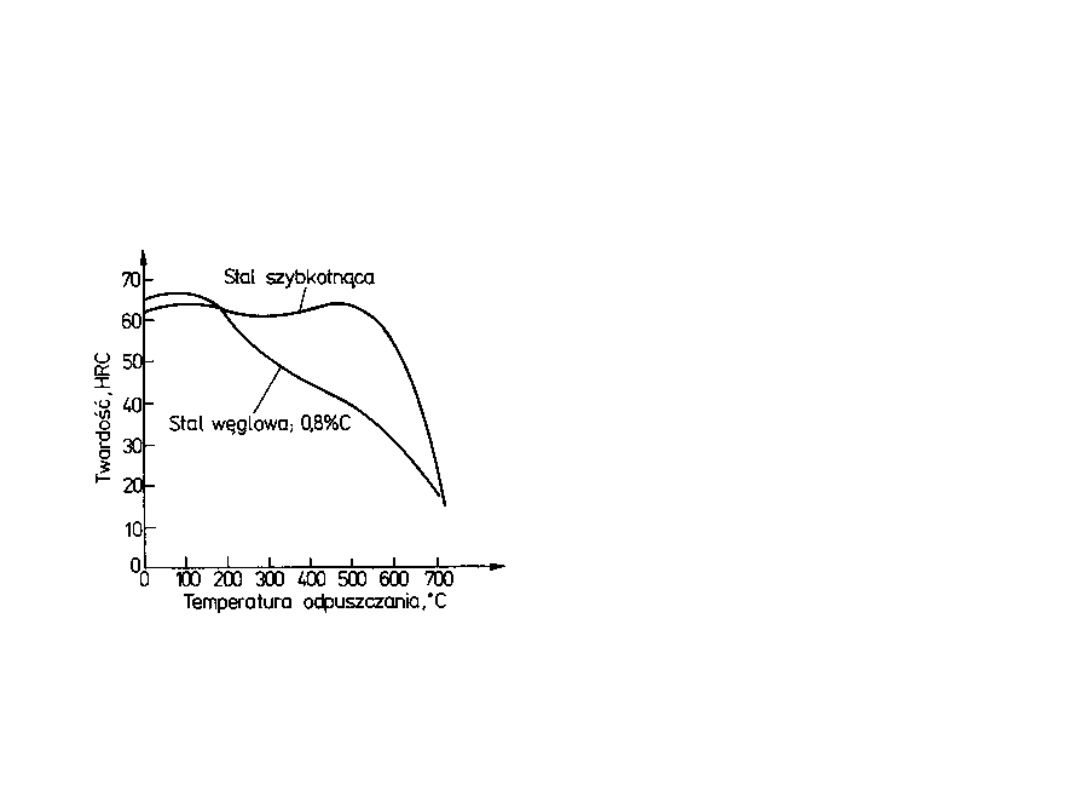
odpuszczanie
W stalach stopowych
mechanizmy
odpuszczania są
bardziej
skomplikowane.
Różnice występują
zwłaszcza przy
odpuszczaniu w
wysokich
temperaturach
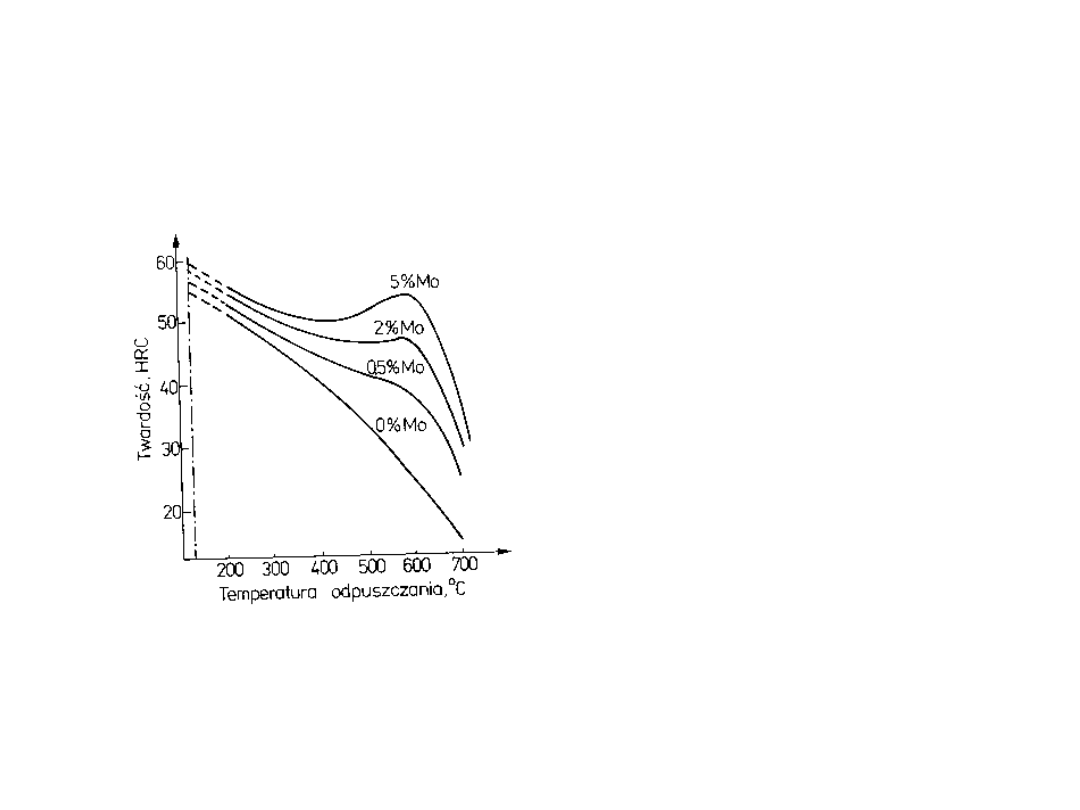
odpuszczanie
Niektóre rodzaje
stali utwardzają się
w czasie
odpuszczanie,
głównie na skutek
tworzenia węglików

Obróbka powierzchniowa
• Hartowanie powierzchniowe – nagrzewa się
tylko cienką warstwę powierzchniowej i ją
hartuje.
• Nawęglanie – nasyca się węglem warstwę
powierzchniową i następnie hartuje
• Azotowanie – nasycenie powierzchni azotem.
Stale do azotowanie zwykle zawierają
aluminium (AlN jest bardzo twardy)
• Inne (nagniatanie, wytwarzanie warstw
diametowych etc)

Wytwarzanie żelaza -
historia

Dymarka
Rekonstrukcja dymarki w
Biskupinie
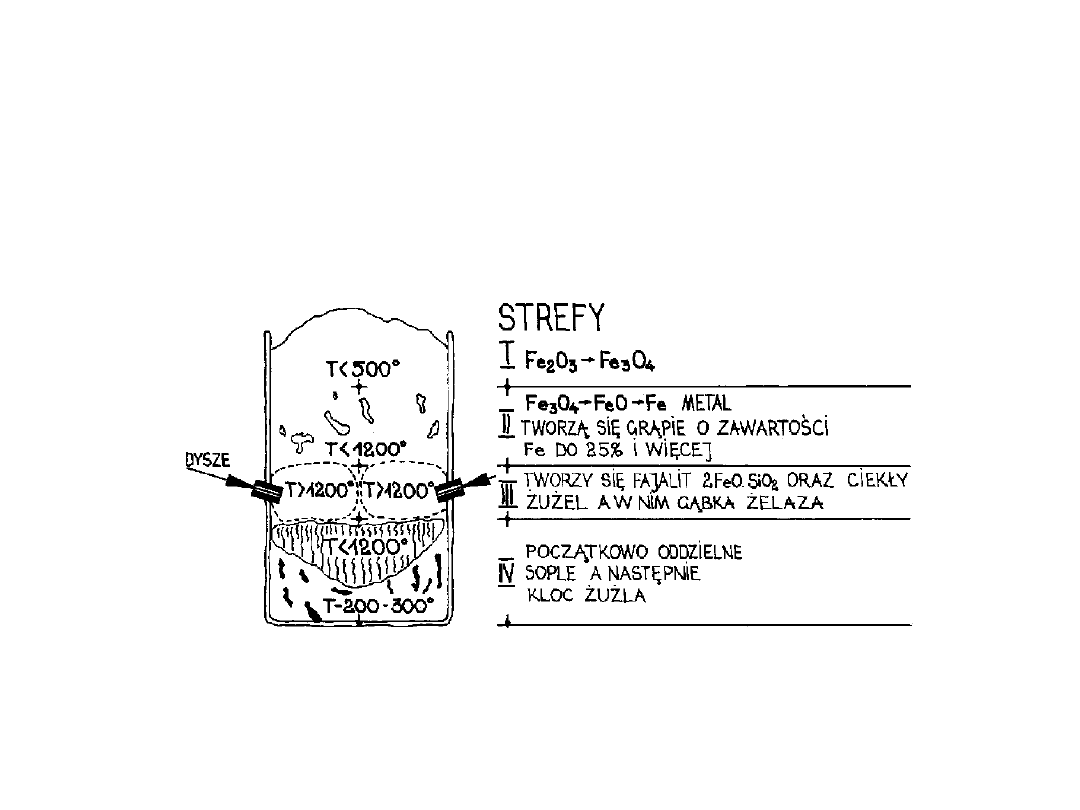
Wytwarzanie żelaza w
dymarkach
http://www.platnerz.com/platnerz-com/scriptorium/faq/zelazodymarkowe/tekst/tekst.html

Wytwarzanie żelaza w
dymarkach
1 - Szyb pieca.
2 - Wsad (węgiel
drzewny + ruda
żelaza).
3 - Kotlinka
wypełniona
ściekającym podczas
wytopu żużlem.
4 - łupka żelaza.
5 - Dysze.
6 - Pierwotny poziom
terenu.
7 - Poziom dna
kotlinki.
http://www.platnerz.com/platnerz-com/scriptorium/faq/zelazodymarkowe/tekst/tekst.html

Wytwarzanie żelaza w
dymarkach
Fragment łupki
żelaznej uzyskanej
w doświadczalnym
piecu dymarskim.
http://www.platnerz.com/platnerz-com/scriptorium/faq/zelazodymarkowe/tekst/tekst.html

Wytwarzanie żelaza w
dymarkach
1 - Żużel
2 - Przecięty pęcherz
spieczonego żelaza.
3 - Węgiel drzewny.
http://www.platnerz.com/platnerz-com/scriptorium/faq/zelazodymarkowe/tekst/tekst.html

Wytwarzanie żelaza w
wielkim piecu
XIX wieczna rycina
przedstawiająca wieki piec
(do produkcji żeliwa)

Wytwarzanie żelaza w
wielkim piecu
• Wielkie piece umożliwiły stropienie
żelaza i produkcję żeliwa na skale
masową
• Wielki piec mógł być używany
wielokrotnie
• Żeliwo można można odlewać
• Stal z żeliwa można uzyskać po
procesie konwersji

Wytwarzanie żelaza w
wielkim piecu
• Początkowo używano tzw. ognisk
fryszerskich
• W 1794 wynaleziono piec pudlarski
• W 1860 zainstalowano w Anglii pierwszy
konwerter („gruszkę”) Bessemera
• W roku 1850 produkcja żeliwa w Anglii
wynosiła około 3 milionów ton podczas gdy
produkcja stali wynosiła tylko 60 tysięcy ton
• W roku 1890 produkcja stali w Anglii
wynosiła ok. 5 milionów ton

Gruszka Bessemera
Powietrze
wdmuchiwano
od spodu

Gruszka Bessemera

Rodzaje stali
• Stale konstrukcyjne
• Stale narzędziowe
• Stale specjalne

Stale konstrukcyjne
• Stale niskostopowe
• Stale do nawęglania
• Stale do azotowania
• Stopowe do ulepszania cieplnego
• Stale sprężynowe
• Stale łożyskowe
• Stale do hartowania powierzchniowego
• Stale maraging

Stale i stopy narzędziowe
• Stal węglowa narzędziowa
• Stal narzędziowa do pracy na
zimno
• Stal narzędziowa do pracy na
gorąco
• Stale szybkotnące

Stale specjalne
• Stale odporne na ścieranie
• Stale nierdzewne i kwasoodporne
• Stale żarowytrzymałe i żaroodporne
• Stale o dużym oporze elektrycznym
• Stale o szczególnych własnościach
magnetycznych

Przemiana
martenzytyczna
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
- Slide 68
- Slide 69
- Slide 70
- Slide 71
- Slide 72
- Slide 73
- Slide 74
- Slide 75
- Slide 76
- Slide 77
- Slide 78
- Slide 79
- Slide 80
- Slide 81
- Slide 82
- Slide 83
- Slide 84
- Slide 85
- Slide 86
- Slide 87
- Slide 88
- Slide 89
- Slide 90
- Slide 91
- Slide 92
- Slide 93
- Slide 94
- Slide 95
- Slide 96
- Slide 97
- Slide 98
- Slide 99
- Slide 100
- Slide 101
- Slide 102
- Slide 103
- Slide 104
- Slide 105
- Slide 106
- Slide 107
- Slide 108
- Slide 109
- Slide 110
- Slide 111
- Slide 112
- Slide 113
- Slide 114
- Slide 115
- Slide 116
- Slide 117
- Slide 118
- Slide 119
- Slide 120
- Slide 121
- Slide 122
- Slide 123
- Slide 124
- Slide 125
- Slide 126
- Slide 127
- Slide 128
- Slide 129
- Slide 130
- Slide 131
- Slide 132
- Slide 133
- Slide 134
- Slide 135
- Slide 136
- Slide 137
- Slide 138
- Slide 139
- Slide 140
- Slide 141
- Slide 142
- Slide 143
- Slide 144
- Slide 145
- Slide 146
- Slide 147
- Slide 148
- Slide 149
- Slide 150
Wyszukiwarka
Podobne podstrony:
Materiałoznawstwo wykłady, informacje, podstawy
Materiałoznawstwo wykłady, informacje, podstawy
Materiały z wykładu przedmiotu Podstawy działalnosci gospodarczej statystyka cz I
Zarządzanie produkcją i usługami wykłady, informacje, podstawy
Materiały z wykładu przedmiotu Podstawy działalności gospodarczej cz 1
Materiały z wykładu przedmiotu Podstawy działalnosci gospodarczej cz 2
Materiały z wykładu przedmiotu Podstawy działalnosci gospodarczej statystyka cz II
informacja 8 podstawy zarzadzania (2), Materiały PSW Biała Podlaska, Podstawy zarządzania- wykład
TPI - materiały, Wykłady TPI, Wykłady nt. teoretyczne podstawy informatyki
pnom wyklad11, Automatyka i Robotyka, Semestr 1, Podstawy Nauki o materialach, Wyklady
Wyklad 1Psychologiczne podstawy, referaty i materiały, Niedostosowanie społeczne, resocjalizacja, pe
Zakres materiału na egzamin z Podstaw Informatyki
Pytania na egzam z infy, I semstr moje materiały, Semestr I, Informatyka stosowana, wyklady i pytani
Wyklad7ALG2001, Informatyka i Ekonometria SGGW, Semestr 1, Algebra Liniowa, materialy od starszych r
egzamin informa, I semstr moje materiały, Semestr I, Informatyka stosowana, wyklady i pytania
Wyklad8ALG2001, Informatyka i Ekonometria SGGW, Semestr 1, Algebra Liniowa, materialy od starszych r
caly materiał, pedagogium, wykłady, Teoretyczne podstawy wychowania
więcej podobnych podstron