
Korozja
materiałów
Dr Jolanta
Dr Jolanta
Piekut
Piekut

Korozja
• Jest to niszczące nieodwracalne
oddziaływanie środowiska na materiały.
• Są to procesy chemiczne lub
elektrochemiczne typu destrukcyjnego,
występujące w materiale budowlanym w
wyniku oddziaływania środowiska
zewnętrznego lub reakcji między składnikami
materiału, zmieniające niekorzystnie jego
właściwości, a w konsekwencji przydatność
funkcjonalną.

Korozja
Obok tych podstawowych rodzajów korozji,
wyróżnia się wiele rodzajów szczególnych, jak
korozja:
• biologiczna, wywoływana działaniem
produktów procesów fizjologicznych,
organizmów żywych (roślin lub zwierząt),
• mikrobiologiczna, wywoływana
oddziaływaniem na materiał produktów
przemiany materii mikroorganizmów (bakterii,
grzybów, drożdży),
• gazowa, wywoływana chemicznym
oddziaływaniem agresywnych gazów.

Korozja
Podział ze względu na środowisko korozyjne
Atmosferyczna
Ziemna
Morska
(w glebie)
woda morska jest
1. Rodzaj gleby
dobrym elektrolitem
2. Wilgotność gleby
3. Napowietrzenie
mikro-
4. Zawartość Cl
-
, S
2-
i makroogniwa
5. Kwasowość i zasadowość
korozyjne
6. Przewodność elektryczna
(prądy błądzące)
jon Cl
-
7. Obecność mikroorganizmów
(bakterie, pleśnie, grzyby)
korozja
wżerowa
sucha wilgotna mokra
Intensywność korozji
zależy od agresywności
atmosfery korozyjnej
1. Atmosfera wiejska (NH
3
)
2. miejska
3. przemysłowa (S
2-
, H
2
S)
4. kopalniana (SO
2
)
5. morska (Cl
-
)

Korozja
Na przebieg procesów korozyjnych ma
wpływ:
- Stopień zanieczyszczenia środowiska
- Temperatura
- Wilgotność powietrza

Korozja materiałów
mineralnych
- materiałów kamiennych
(betonów, materiałów
ceramicznych i szkła)
- metali
organicznych
- drewna
- asfaltu
- tworzyw
sztucznych

Korozja – mechanizm
• Procesy fizyczne - rozpuszczania i
wymywania
rozpuszczonych składników,
• Reakcje chemiczne związane z
powstawaniem
łatwo rozpuszczalnych
soli lub produktów
niewykazujących
właściwości adhezyjnych
• Reakcje chemiczne związane z
powstawaniem
trudno rozpuszczalnych
soli, które podczas
krystalizacji zwiększają
swoją objętość

Skutki procesów korozyjnych
• Zmiana połysku i barwy
• Zmniejszenie wytrzymałości
mechanicznej
• Utworzenie się „wykwitów” na
powierzchni
• Zarysowania i pękanie
• Rozpuszczanie się materiału

Korozja materiałów mineralnych
• Korozja materiałów kamiennych
Odporność materiałów kamiennych zależy od
ich składu chemicznego i porowatości.
Skały o charakterze kwaśnym (duża ilość
SiO
2
i Al
2
O
3
) są odporne na działanie
środowiska kwaśnego,
skały zasadowe (węglanowe) - na działanie
zasad.

Materiały ze skał magmowych
Bazalt, granit, sjenit są odporne na korozję w
typowych warunkach użytkowania.
Jedynie materiały zawierające
oliwin FeMg(SiO
4
)
2
lub piryt FeS
2
ulegają
„wietrzeniu”, które narusza spoistość kamienia.
4 FeS
2
+ 10 H
2
O + 15 O
2
→ 4 FeO(OH) + 8 H
2
SO
4
Przyczyną jest zmniejszenie gęstości
(FeS
2
– 5 000kg/m
3
, FeO(OH)-3 900 kg/m
3
),
co prowadzi do pęcznienia i pękania materiału.
• Tworzący się kwas siarkowy może wtórnie
oddziaływać korozyjnie.

Materiały ze skał osadowych
Wapienie, materiały zawierające związaną
krzemionkę, jak też piaskowce o spoiwie
krzemionkowym są względnie trwałe.
• Piaskowce zawierające glinę są bardzo podatne
na wietrzenie ze względu na pęcznienie pod
wpływem wody.
• W piaskowcach o spoiwie wapiennym występuje
ługowanie spoiwa pod wpływem opadów
zawierających CO
2
.
Ca(OH)
2
+ CO
2
→ CaCO
3
+ H
2
O
CaCO
3
+ H
2
O + CO
2
→ Ca(HCO
3
)
2
Materiały ze skał metamorficznych
Kwarcyt i marmur są względnie odporne.
• Gnejsy i łupki, ze względu na warstwową
strukturę, stosunkowo łatwo ulegają wietrzeniu i
rozpadowi.

Korozja betonu i żelbetu
Ze względu na rodzaj środowiska agresywnego
rozróżnia się korozję:
• ługowania - wywołaną rozpuszczaniem i
wymywaniem z
betonu jego
rozpuszczalnych składników
• kwasową - wywołaną kwaśnym środowiskiem
• węglanową - wywołaną reakcją z CO
2
• magnezową - gdy środowisko zawiera jony Mg
2+
• amonową - spowodowaną jonami NH
4+
• siarczanową - jonami SO
42-
• zasadową - wywołaną zasadowym środowiskiem
• Szczególnym przypadkiem jest korozja wewnętrzna
spowodowana reakcją alkalicznego spoiwa cementowego z
niewłaściwie dobranym kruszywem.
• W praktyce zwykle występuje korozja złożona, spowodowana
różnymi składnikami środowiska agresywnego.

Korozja ługowania
Spowodowana działaniem wód miękkich
(pozbawionych soli wapniowych), o małej
twardości węglanowej.
Wymywaniu ulega przede wszystkim Ca(OH)
2
zmniejszenie szczelności
osłabienie spójności betonu
Agresywność wód miękkich zwiększa się w niższych
temperaturach (większa rozpuszczalność Ca(OH)
2
).

Korozja kwasowa
Spowodowana przez wodne roztwory kwasów:
• mocnych : HCl, H
2
SO
4
, HNO
3
• słaby kwas H
2
S
• kwasy organiczne: octowy, mlekowy
• kwasy humusowe
Związki te reagują ze składnikami kamienia cementowego,
tworząc łatwo rozpuszczalne sole:
Ca(OH)
2
+ 2H
+
→ Ca
2+
+ 2 H
2
O
3 CaO
.
Al
2
O
3
+ 12 H
+
→ 3 Ca
2+
+ 2 Al
3+
+ 6 H
2
O
3 CaO
.
SiO
2
+ 6 H
+
→ 3 Ca
2+
+ H
2
SiO
3
+ 2 H
2
O
Stopniowe zwiększanie porowatości betonu i obniżanie jego
wytrzymałości.
Kwasy reagują też z węglanem wapnia (powstającym w
wyniku karbonatyzacji betonu lub wchodzącym w skład
kruszywa węglanowego):
CaCO
3
+ 2H
+
→ Ca
2+
+ H
2
O + CO
2
↑

Korozja węglanowa
Spowodowana jest działaniem wód zawierających większe
ilości CO
2
.
Ca(OH)
2
+ CO
2
→ CaCO
3
+ H
2
O
CaCO
3
+ CO
2
+ H
2
O → Ca(HCO
3
)
2
W I. etapie na powierzchni betonu pojawiają się rysy wzdłuż prętów
zbrojeniowych, a w II. odpada otulina betonowa.
Podczas karbonatyzacji wzrasta twardość i wytrzymałość betonu na
ściskanie; maleje pH z 12 do 7.
Dla betonu jest to zjawisko pozytywne, dla zbrojenia – negatywne.
W betonie o odczynie zasadowym na powierzchni stali tworzy się
pasywna warstwa tlenków i zbrojenie nie koroduje. Warstwa ta zanika
w betonie o wartości pH < 9,5 i zbrojenie zaczyna korodować.
Tlenek węgla(IV) może występować w
roztworach wodnych w różnych postaciach:
Tlenek(IV) węgla
ogólny (całkowity)
związan
y
woln
y
CO
3
2-
całkowici
e
związany
HCO
3
-
równowagowy
agresywny
częściowo
związany
Ca(HCO
3
)
2
CaCO
3
+ H
2
O + CO
2

Korozja magnezowa i amonowa
Przebiegają według tego samego mechanizmu -
wymiany jonów wapniowych:
• Magnez zastępuje wapń w strukturze betonu:
Ca(OH)
2
+ MgCl
2
→ CaCl
2
+ Mg(OH)
2
(
nie ma wł.
wiążących)
Źródłem jonów magnezowych są wody morskie, a także
substancje stosowane do odladzania nawierzchni dróg.
• W reakcji z solami amonowymi mogą
powstawać rozpuszczalne sole wapniowe,
Ca(OH)
2
+ NH
4
Cl → CaCl
2
+ 2 NH
3
↑ + 2 H
2
O
(wydzielający się amoniak zwiększa porowatość materiału)

Korozja siarczanowa
Jony SO
42-
reagują ze składnikami stwardniałego
zaczynu cementowego, tworząc nierozpuszczalne
produkty korozji, (
krystalizujące z przyłączeniem wody i
zwiększające przy tym znacznie swoją objętość)
.
• W pierwszej fazie powstaje uwodniony siarczan wapnia:
Ca(OH)
2
+ SO
42-
→ CaSO
4
+ 2 OH
-
CaSO
4
+ 2 H
2
O → CaSO
4.
2H
2
O
• Następnie powstaje monosiarczanoglinian tetrawapnia
3CaO
.
Al
2
O
3
+CaSO
4.
2H
2
O +10H
2
O → 3CaO
.
Al
2
O
3.
CaSO
4.
2H
2
O
lub etryngit (sól Candlota)
3CaO
.
Al
2
O
3
+3CaSO
4.
2H
2
O +26H
2
O → 3CaO
.
Al
2
O
3.
3CaSO
4.
32H
2
O

Korozja siarczanowa
Początkowo ma miejsce uszczelnienie betonu
(zwiększenie wytrzymałości),
dalszy wzrost kryształów
duże naprężenia wewnętrzne
rysy i pęknięcia
całkowite zniszczenie tworzywa
• Korozja siarczanowa to najczęściej spotykane
zagrożenie dla betonu.
• Jest szczególnie niebezpieczna, gdy występuje łącznie z
korozją kwasową, - podczas kwaśnych deszczy.
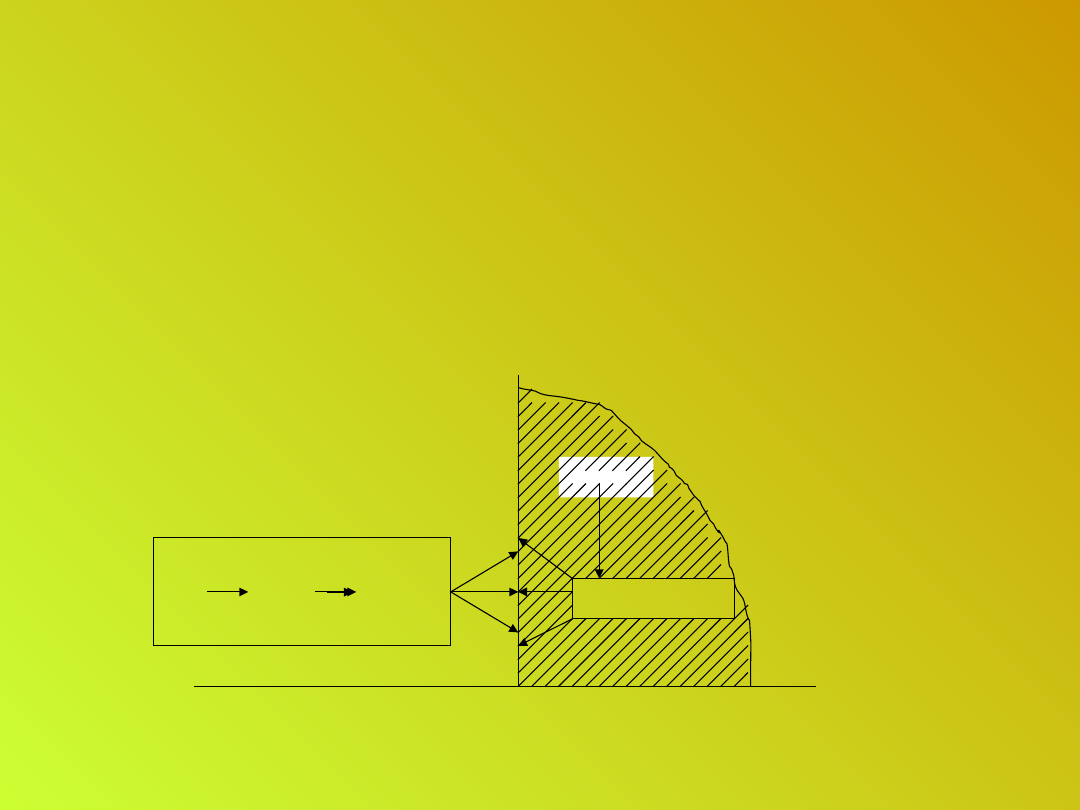
Korozja siarczanowa
• Mechanizm oddziaływania kwaśnych deszczy
na kamień wapienny
CaSO
4
.
2H
2
O
CaCO
3
O
2
H
2
O
SO
2
SO
3
H
2
SO
4
h

Korozja chlorkowa
Związana jest z powstawaniem
soli Friedla
3CaO
.
Al
2
O
3.
CaCl
2.
10H
2
O
pod działaniem:
- wody morskiej,
- środków odladzających
- wód kopalnianych
Na powierzchni betonu widoczne są białe wykwity. Sole cyklicznie
krystalizują się i rozpuszczają w zależności od wilgotności powietrza.
Jony Cl
-
powodują w wilgotnym betonie :
- korozję stali zbrojeniowej
- w większej ilości - rozsadzanie betonu na skutek
cyklicznego nawilżania i wysychania.

Korozja zasadowa
Beton jest odporny na działanie niezbyt stężonych
zasad.
Roztwory mocnych zasad (NaOH lub KOH) o stężeniu >
10%
powodują stopniowy rozkład betonu, tworzą
rozpuszczalne
sodowe lub potasowe krzemiany i gliniany
(zwłaszcza w podwyższonej temperaturze).

Korozja wewnętrzna
• Na skutek alkalicznej reakcji kruszywa
zawierającego reaktywną krzemionkę koloidalną lub
słabo skrystalizowaną,
która reaguje z alkaliami (Na
2
O, K
2
O) zawartymi w cemencie:
SiO
2
+ Na
2
O + nH
2
O → Na
2
SiO
3.
nH
2
O
• Z alkaliami reagują też odmiany dolomitu
CaMg(CO
3
)
2
+ 2NaOH → CaCO
3
+ Mg(OH)
2
+Na
2
CO
3
węglan sodu reaguje następnie z Ca(OH)
2
zawartym w betonie
Na
2
CO
3
+ Ca(OH)
2
→ CaCO
3
+ 2NaOH
przy czym
odtwarza się wodorotlenek sodu i proces postępuje dalej.

Korozja żelbetu
• Jest to korozja betonu i zbrojenia (lub samego
zbrojenia).
• Korozja zbrojenia następuje na skutek
przeniknięcia agresywnych substancji do stali
zbrojeniowej bądź zobojętnienia betonu i utraty
właściwości ochronnych przez otulinę zbrojenia.
• W betonie o niskiej karbonatyzacji
stal znajduje
się w środowisku zasadowym (
11 < pH < 13)
. Stal
jest w tych warunkach pokryta warstewką
pasywną, złożoną z
Fe
2
O
3
i FeO
.
Fe
2
O
3
.
• Zmniejszenie pH do wartości
pH < 10
powoduje
zapoczątkowanie procesów korozji stali.
Powstający produkt korozji
Fe(OH)
2
ma większą
objętość niż stal i beton.

Korozja żelbetu
• W obecności chlorków
proces
korozji
stali
rozpoczyna się nawet
przy wyższej wartości pH
.
Powstaje
FeCl
2
,
który ulegając hydrolizie może być
źródłem HCl, powodującego korozję wżerową
zbrojenia.
FeCl
2
+ 2H
2
O → Fe(OH)
2
+ 2HCl
• Trwałość żelbetu w znaczny sposób zależy od
szczelności betonu i grubości utworzonej wokół
zbrojenia otuliny.

14
13
12
11
10
9
8
7
6
5
4
3
2
1
Młody beton
Stal zbrojeniowa jest
chroniona przed
korozją poprzez
warstwę
pasywną
Beton skarbonatyzowany
Utrata naturalnej ochrony
antykorozyjnej
Słabo
stopnie zaatakowania
mocno
betonu przez środowisko
bardzo mocno
wymagana powłoka ochronna na betonie

Powstawanie wykwitów
na elementach budowlanych
Wykwity na murach ceglanych, ścianach betonowych,
elementach kamiennych powstają, gdy w materiale
zawarte są substancje rozpuszczalne.
Na skutek działania wilgoci i ruchu wody w materiale
substancje te zostają wyniesione na powierzchnię, gdzie
po odparowaniu wody pozostają jako naloty.
Źródła wilgoci:
- opady atmosferyczne
- podciąganie kapilarne wody z gruntu,
- reakcje chemiczne, w wyniku których wydziela się woda np. CO
2
lub
SO
2
(dyfundujące w głąb elementu) z Ca(OH)
2
:
CO
2
+ Ca(OH)
2
→ CaCO
3
+ H
2
O
SO
2
+ Ca(OH)
2
→ CaSO
3
+ H
2
O

Wykwity
Skład chemiczny
Ca(OH)
2
CaCO
3
CaSO
4.
2H
2
O
3CaO
.
Al
2
O
3.
3CaSO
4.
32H
2
O
Charakterystyka
• Wymywany z zapraw i betonu;
utrzymuje się krótko - ulega
wypłukaniu lub przechodzi w CaCO
3
• Rozkład Ca(HCO
3
)
2
, który powstaje
przez przesączenie się wody i CO
2
przez materiały zawierające wapno;
najczęstsze wykwity na betonie
(naloty wapienne); powstaje też przez
karbonatyzację nacieków Ca(OH)
2
• Jony SO
42-
reagują z Ca(OH)
2
z
zaprawy lub betonu tworząc gips
• Jony SO
42-
reagują z uwodnionymi
glinianami wapnia tworząc etryngit;
trudno rozpuszczalny krystaliczny
biały nalot w kształcie igieł

Wykwity
• Na
2
SO
4.
10H
2
O
• MgSO
4.
7H
2
O
• CaCl
2.
6H
2
O
• MgCl
2.
12H
2
O
• Powstaje na cegłach, otrzymanych
przy zastosowaniu zasiarczonego
paliwa i gliny zawierającej alkalia;
biały, zbity osad, łatwo rozpuszczalny
w wodzie, słono-gorzki
• Powstaje na betonie wykonanym
z użyciem wody morskiej; nalot
higroskopijny (wilgotne plamy), łatwo
rozpuszczalny w wodzie, gorzki
• Powstaje na betonie wykonanym
z dodatkiem CaCl
2
jako domieszką
przeciwmrozową; osad higroskopijny,
słono-kwaśny
• Powstaje na betonie wykonanym
z zanieczyszczonej wody zarobowej;
osad łatwo rozpuszczalny,
higroskopijny

Wykwity
• KCl, NaCl
• K
2
CO
3.
Na
2
CO
3.
10H
2
O
• Ca(NO
3
)
2.
4H
2
O
• Powstaje na betonie oraz
murach ceglanych i kamiennych w
wyniku podciągania kapilarnego z
gruntu; rozpuszczalny w wodzie,
słony
• Powstaje na powierzchni
elementów kontaktujących się ze
szkłem wodnym; biały nalot,
rozpuszczalny
• Powstaje na materiałach
budowlanych - zawierających
Ca(OH)
2
pod wpływem produktów
rozkładu związków organicznych
zawierających azot (utlenianie
przez bakterie nitryfikacyjne);
występuje głównie w obiektach
inwentarskich

Zabezpieczenie przed korozją
materiałów kamiennych-ochrona
powierzchniowa
• Związkami nieorganicznymi
– Fluorokrzemiany: ZnSiF
6
, MgSiF
6
, Al
2
(SiF
6
)
3
ZnSiF
6
+ 2CaCO
3
→ 2CaF
2
+ ZnF
2
+ SiO
2
+ 2CO
2
fluatowanie
(uszczelnienie i utwardzenie powierzchni)
- Stężony roztwór szkła wodnego Na
2
SiO
3
(silikatyzacja)
(wydzielenie na powierzchni kamienia żelu krzemionkowego
i osadzenie w porach nierozpuszczalnego CaSiO
3
)
- Ba(OH)
2
reaguje z gazami zawartymi w powietrzu
Ba(OH)
2
+ CO
2
→ BaCO
3
+ H
2
O
Ba(OH)
2
+ SO
3
→ BaSO
4
+ H
2
O

Zabezpieczenie przed korozją
materiałów kamiennych
• Związkami organicznymi
działanie mechaniczne: nie utwardzają powierzchni, tylko czynią ją
szczelniejszą i hydrofobową
- Woski
- Mydła
- Związki krzemoorganiczne- hydrofobizacja żywicami
krzemoorganicznymi (silikonowanie)
CH
3
CH
3
CH
3
- Si - O- Si – O - Si-
CH
3
CH
3
CH
3 n
- Polimery: polimetakrylan metylu, polichlorek winylu, żywice
mocznikowe, formaldehydowe, fenolowe

Korozja metali
• Ze względu na rodzaj reakcji chemicznych
towarzyszących procesowi korozji
rozróżnia się:
- korozję elektrochemiczną,
- korozję chemiczną.

Korozja metali
• Chemiczna
Utlenianie metalu, redukcja
utleniacza i powstanie
produktu korozji zachodzi w
tym samym miejscu
powierzchni metalu bez
przepływu swobodnych
elektronów
1. Roztwarzanie
Fe + 2 HCl → FeCl
2
+ H
2
2. Utlenianie
Fe + ½ O
2
→
FeO
warstwy pasywne
• Elektrochemiczna
warunek: zetknięcie metalu z
powietrzem i wodą
powstanie ogniw
korozyjnych
1. Ogniwo stykowe Zn/Cu
A(Zn): Zn – 2e → Zn
2+
K(Cu): 2H
+
+ 2 e → H
2
depolaryzacja wodorowa
O
2
+ 4 H
+
+4e → 2H
2
O
O
2
+ 2H
2
O + 4e → 4 OH
-
depolaryzacja tlenowa
2. Ogniwo stężeniowe
3. Niejednakowego
napowietrzenia
4. Napreżeniowe
5. temperaturowe

Ze względu na rodzaj zniszczenia
korozyjnego wyróżnia się:
• korozję powierzchniową występującą na
całej powierzchni metalu,
• korozję miejscową występującą w
określonych miejscach metalu
.
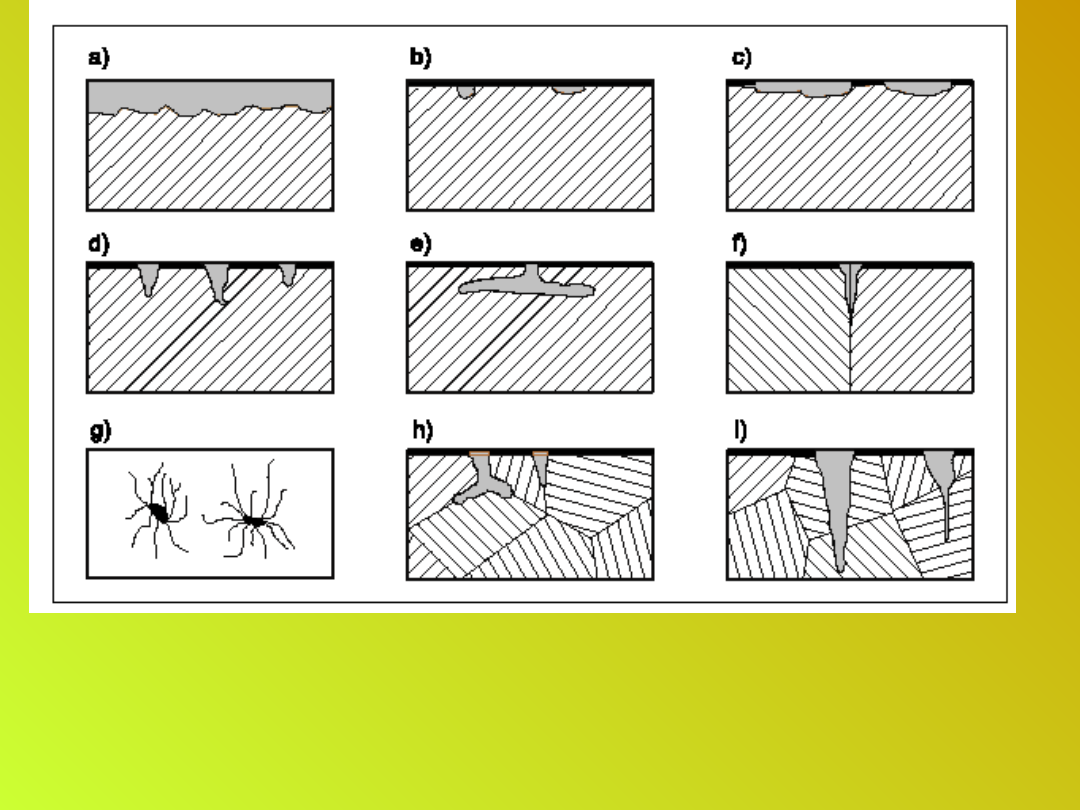
Rodzaje korozji metali
a) powierzchniowa, równomierna, b) punktowa, c) plamowa,
d) wżerowa, e) podpowierzchniowa, f) szczelinowa, g)
nitkowa,
h) międzykrystaliczna, i) śródkrystaliczna

Korozja materiałów
W zależności od oddziaływań mechanicznych
na materiał stanowiący materiał konstrukcyjny
wyróżnia się korozję:
• naprężeniową, wywoływaną jednoczesnym
oddziaływaniem na metal czynników korozyjnych i
statycznych naprężeń rozciągających,
• zmęczeniową, wywoływaną jednoczesnym
oddziaływaniem na metal czynników korozyjnych i
szybkozmiennych naprężeń mechanicznych,
• cierną, wywoływaną jednoczesnym
oddziaływaniem na metal czynników korozyjnych i
tarcia.

Korozja metali
• Żelazo pozostaje w bezpośrednim
kontakcie z węglem (lub Fe
3
C) i
elektrolitem (np.woda deszczowa); na
powierzchni stali znajduje się
niezliczona liczba mikroogniw.
• Fe to anoda (-)
• Fe
3
C – katoda (+).
Potencjał standardowy półogniwa
Fe/Fe
2+
jest niższy od potencjału
półogniwa węglowego.
Elektrolit w mikroogniwie to woda
deszczowa z rozpuszczonymi tlenkami
węgla, azotu i siarki.
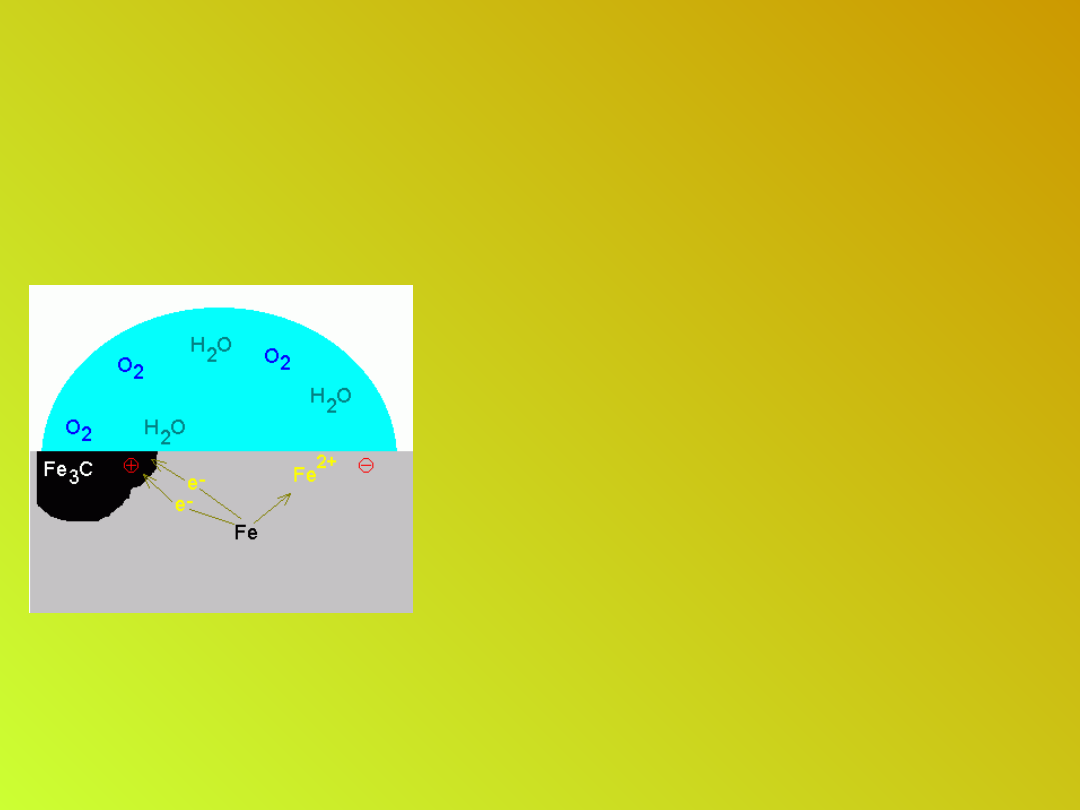
Korozja metali
• Utlenianie anodowe:
A(-) : Fe - 2e- → Fe
2+
Jony Fe
2+
przechodzą do
roztworu, a elektrony
przepływają na katodę
węglową.

Korozja metali
• Redukcja katodowa:
K(+) : 2H
2
O + O
2
+ 4e
-
→ 4OH
-
Katoda węglowa nie zużywa się.
Jej zadanie polega na
"transportowaniu" elektronów z
żelaza na granicę faz węgiel-woda,
gdzie następuje redukcja tlenu
rozpuszczonego w elektrolicie
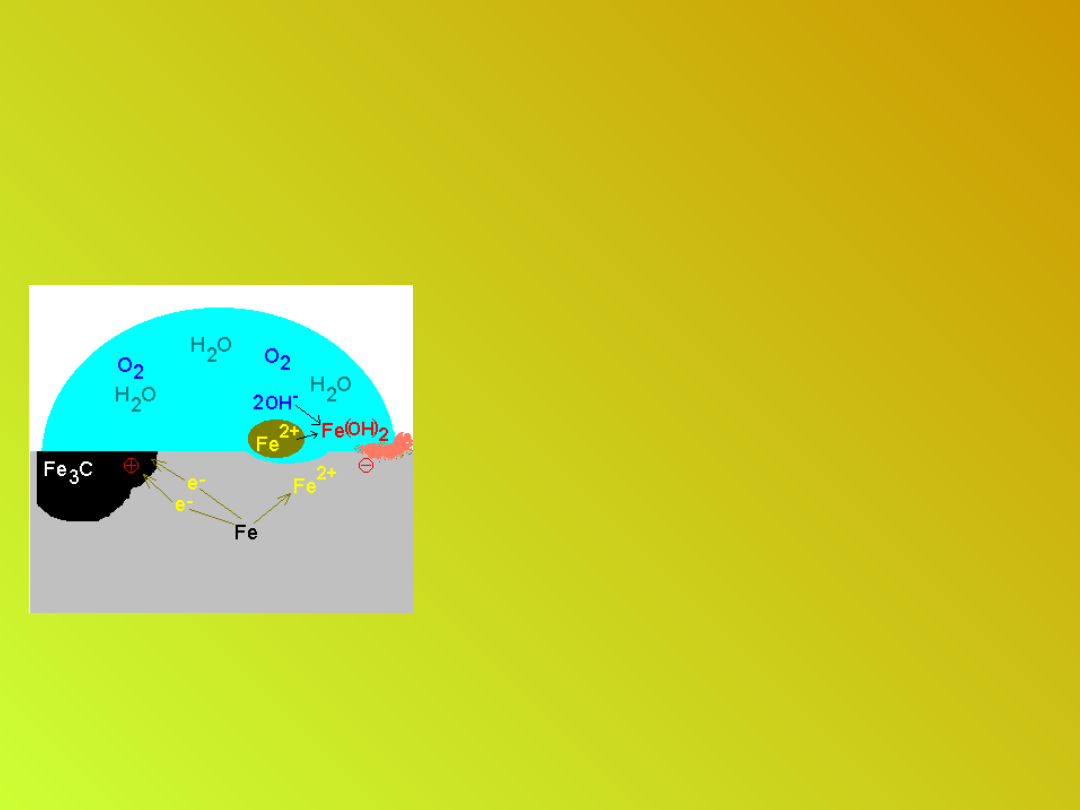
Korozja metali
• Powstające jony OH
-
reagują z jonami Fe
2+
Fe
2+
+2OH
-
→ Fe(OH)
2

Korozja metali
• Na powierzchni żelaza
tworzy się warstwa jego
uwodnionych tlenków –
rdza, która z powodu swej
porowatej struktury
zatrzymuje wilgoć i
przyspiesza proces korozji
niszcząc głębsze warstwy
materiału.
4Fe(OH)
2
+ O
2
→ 2Fe
2
O
3
xH
2
O +
2H
2
O
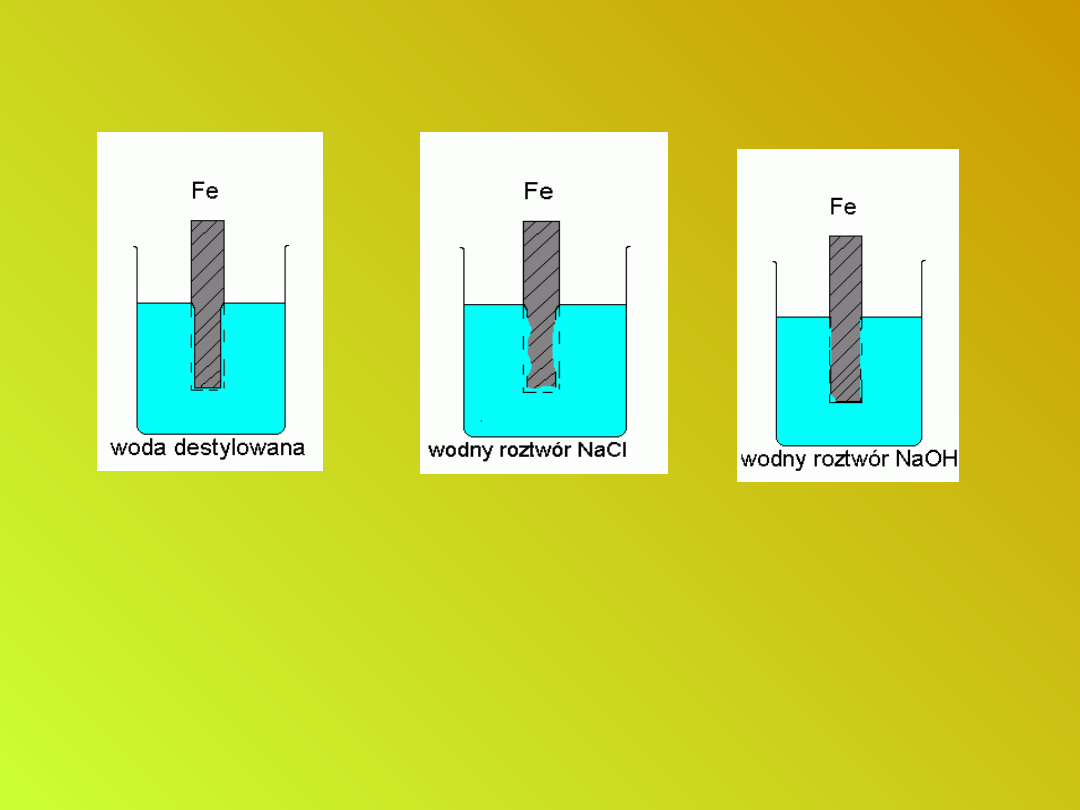
Czynniki wpływające na szybkość
korozji
Wyraźne zahamowanie
reakcji następuje w
obecności zasady
ponieważ jony OH
-
,
przesuwają równowagę
reakcji katodowej w lewo.
Szybciej
koroduje blacha
w obecności
chlorku sodu
Proces zachodzi
bardzo wolno
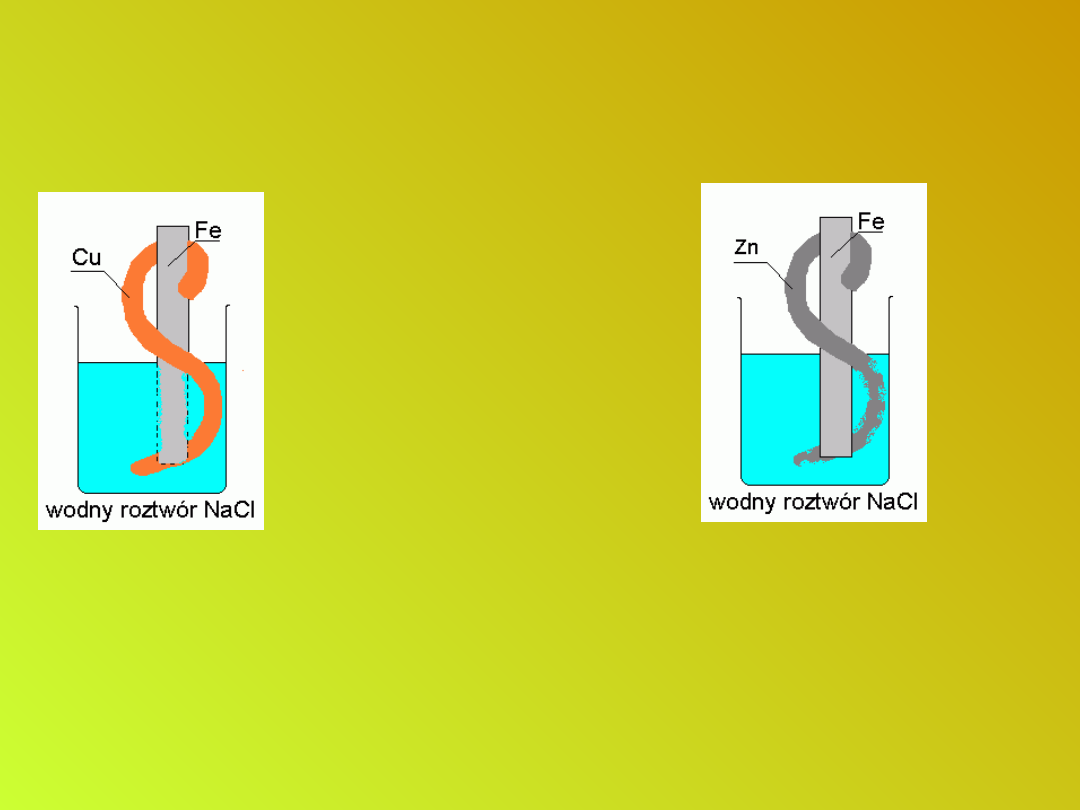
Czynniki wpływające na szybkość
korozji
Żelazo połączone jest z miedzią ;
ogniwo, w którym żelazo spełnia rolę
anody i ulega szybkiemu
zniszczeniu.
(-) Fe - 2e- → Fe
2+
Połączenie żelaza z cynkiem daje
efekt odwrotny - żelazo nie koroduje,
stanowi katodę ogniwa; zużywa się
cynk
(-) Zn - 2e- → Zn
2+

Skłonność do korozji metali, w
zależności od potencjału
elektrochemicznego
• Złoto
• Srebro
• Miedź
• Nikiel
• Żelazo
• Cynk
• Glin
• Magnez
• Metale szlachetne
• Metale
nieszlachetne
Zabezpieczanie wyrobów
stalowych przed korozją
• Zadaniem ich jest izolowanie
powierzchni metali od
dostępu tlenu i wilgoci.
• Konstrukcje stalowe (np.
mosty) maluje się farbami
olejnymi i lakierami, a
niekiedy nakłada minię,
smołę lub asfalt.
• Niektóre metale, wśród nich
glin, samorzutnie pokrywają
się na powietrzu zwartą
warstwą tlenku, który chroni
metal przed dalszą korozją.
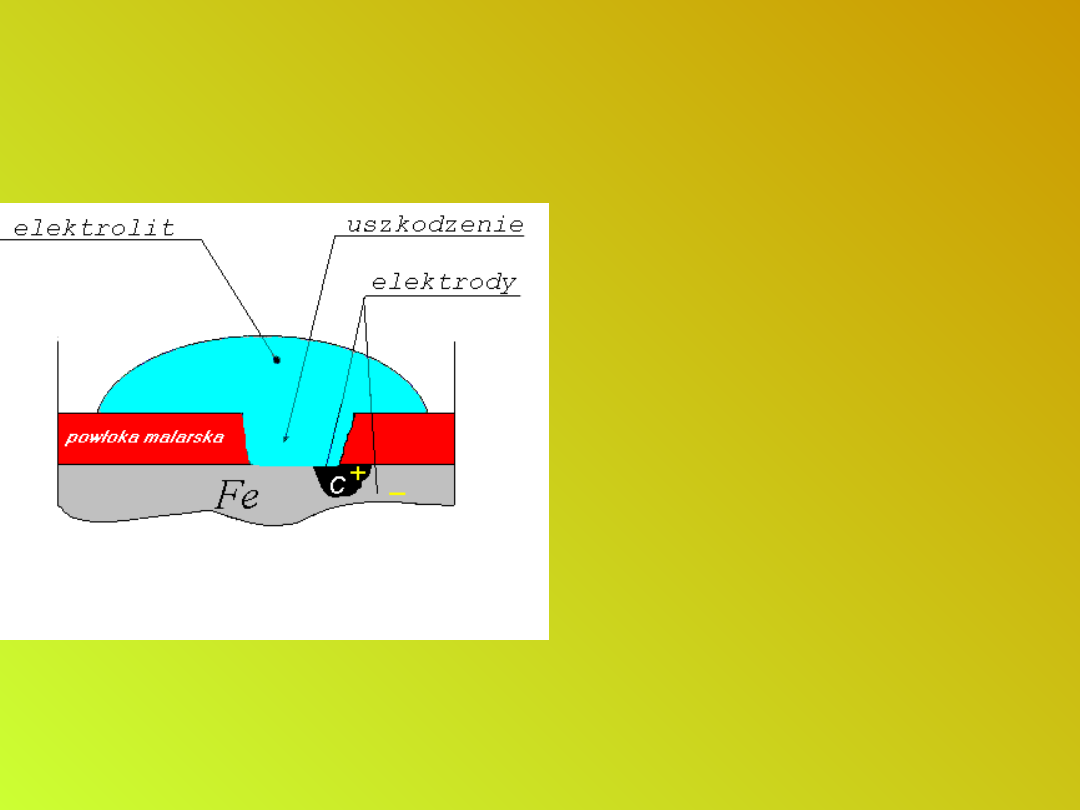
Niemetaliczne powłoki
ochronne.
Zabezpieczanie wyrobów
stalowych przed korozją
• Powłoki z metali stojących w
szeregu elektrochemicznym
przed żelazem (cynk, chrom)
spełniają rolę anody w ogniwie
i nawet jeśli powłoka ulegnie
uszkodzeniu mechanicznemu,
do roztworu nie będzie
przechodziło żelazo, lecz metal
tworzący powłokę.
• Korozja cynku przebiega
bardzo powoli dzięki
tworzeniu się
powierzchniowej warstwy
trudno rozpuszczalnych
związków. Dlatego stosuje się
blachy ocynkowane do
pokrywania dachów, wyrobu
rynien, wiader itp.
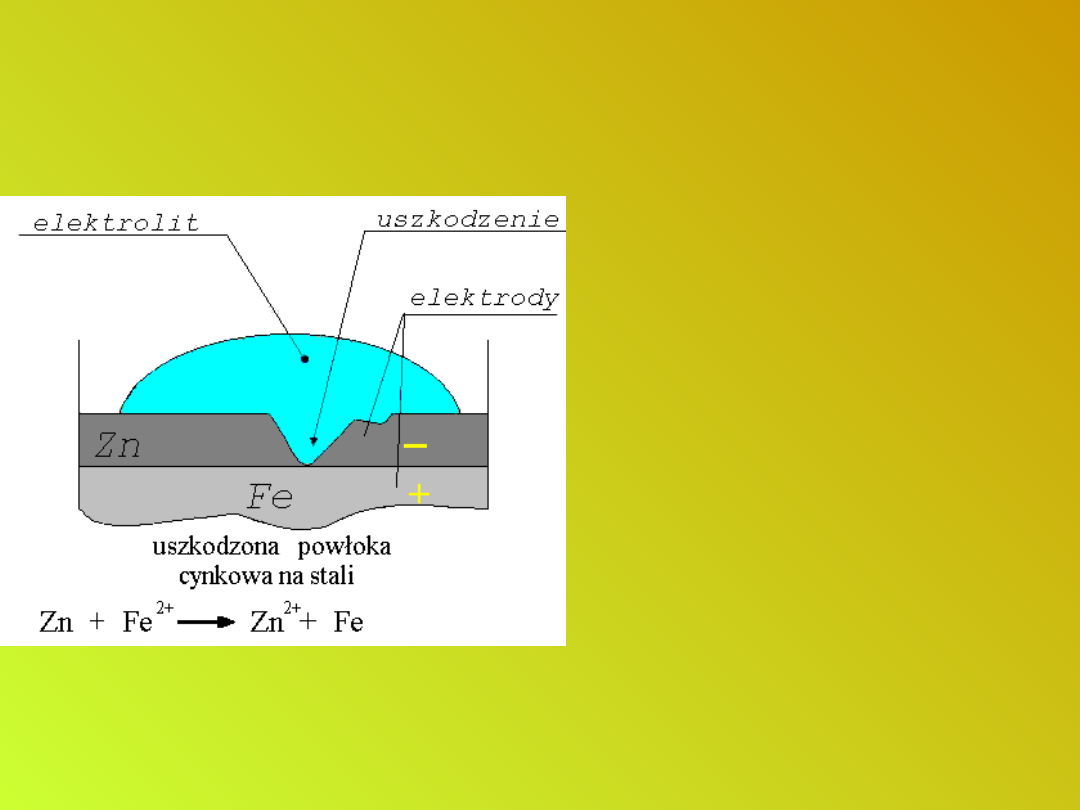
Metaliczne powłoki ochronne z
metali o niższym od żelaza
potencjale standardowym.
Zabezpieczanie wyrobów
stalowych przed korozją
Działanie powłoki wykonanej z
miedzi, cyny lub niklu jest
czysto mechaniczne i powłoka
spełnia swoje zadanie tylko
wtedy, gdy jest zupełnie
szczelna.
Z chwilą jej uszkodzenia proces
korozji staje się intensywniejszy
niż bez powłoki.
Powłoka stanowi katodę, a
żelazo ulega anodowemu
rozpuszczeniu:
Fe - 2e- → Fe
2+
Dlatego też puszki po
konserwach, wykonane z
blachy ocynowanej, rdzewieją
bardzo szybko.
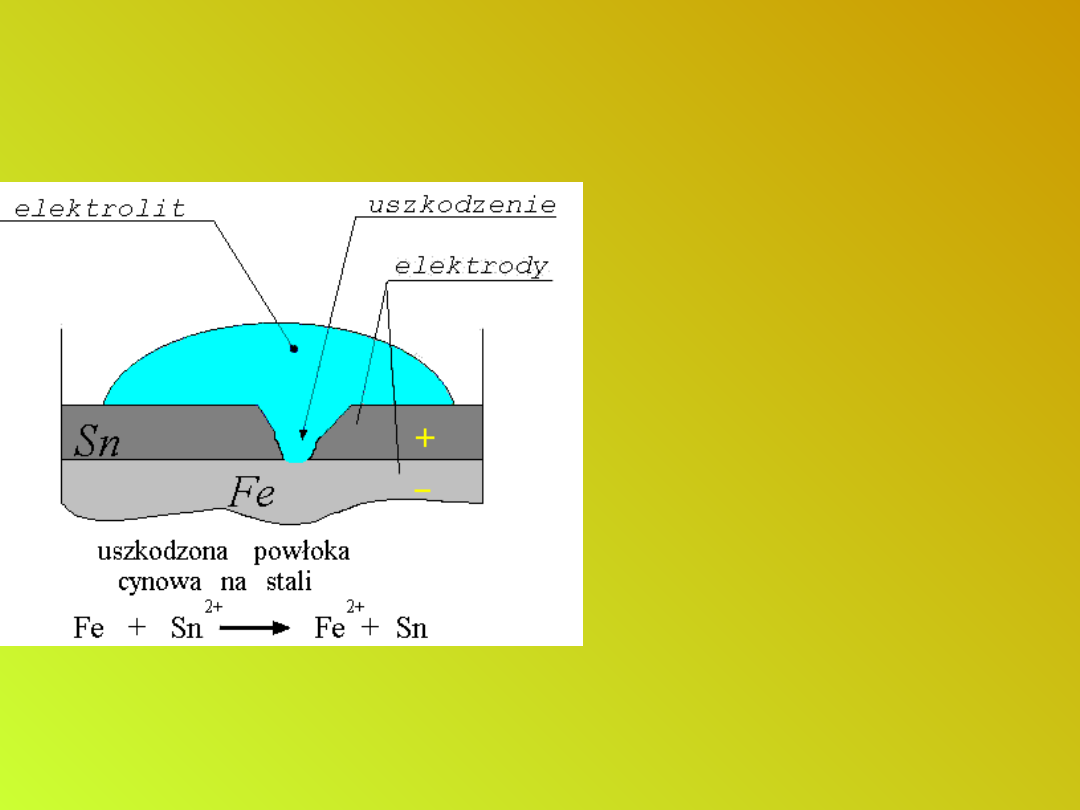
Metaliczne powłoki ochronne z
metali o wyższym od żelaza
potencjale standardowym.
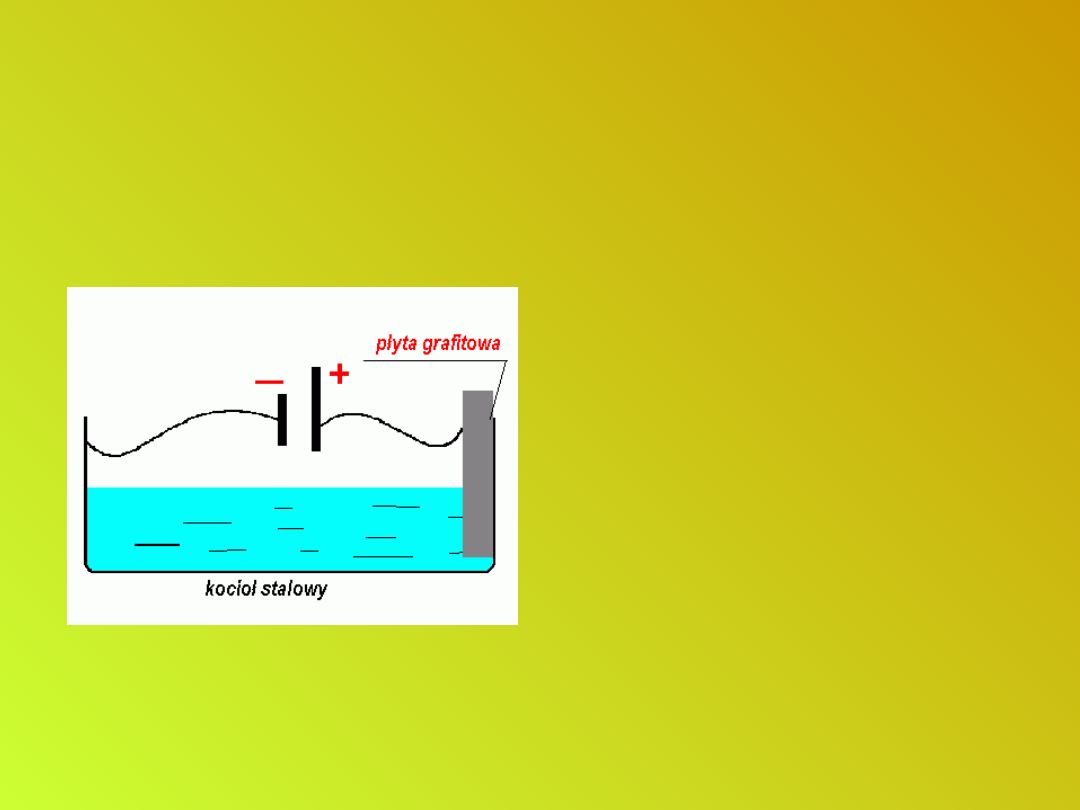
Zabezpieczanie wyrobów
stalowych przed korozją
Elementy konstrukcji
narażone na korozję
łączy się z ujemnym
biegunem źródła prądu
stałego o napięciu rzędu
1 - 2 V. Dodatni biegun
łączy się z grafitową
płytą przylegającą do
konstrukcji. Ponieważ
elektrony doprowadzone
ze źródła prądu
zobojętniałyby
powstające jony, proces:
Fe - 2e- → Fe
2+
nie zachodzi.
Ochrona katodowa.
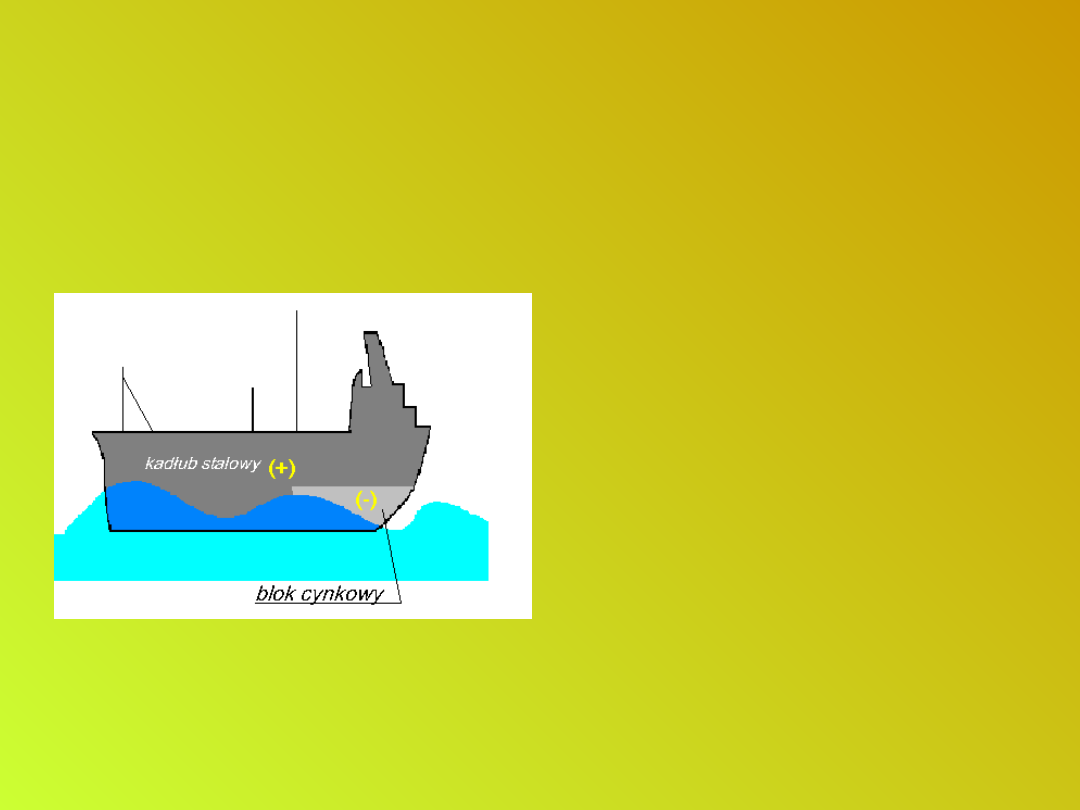
Zabezpieczanie wyrobów
stalowych przed korozją
• Do chronionego rurociągu
lub kadłuba okrętu
przytwierdza się tzw.
protektory - bloki z metalu
o niższym od żelaza
potencjale normalnym (np.
z magnezu, cynku).
Protektor stanowi anodę
zwartego ogniwa i sam
zużywa się, przechodząc
do roztworu (wody
gruntowej lub morskiej).
Elementy ochronne muszą
być co pewien czas
wymieniane.
Ochrona protektorowa.


Warstewki pasywne tworzące się w
powietrzu na różnych metalach
Metal
Warstewka
pasywna
Cu
Cu
2
O
CuO
Cu
2
[(OH)
2
CO
3
]
Cu
2
[(OH)
2
SO
4
]
Zn ZnO + Zn
2
[(OH)
2
CO
3
]
Pb
Pb
2
[(OH)
2
CO
3
]
Al
Al
2
O
3
Mg
Mg
2
[(OH)
2
CO
3
]
Uwagi
• czerwonobrunatna; suche powietrze
• czarna; suche powietrze, podwyższona
temperatura; łatwo się łuszczy
• zielona patyna; powietrze atmosferyczne
• szara patyna; atmosfera przemysłowa
• szara
• szara, rozpuszczalna w wodzie (na
gorąco)
• szara, rozpuszczalna w słabych kwasach
i zasadach
• biała, matowa

Dodawanie inhibitorów
(opóźniaczy).
W kotłach parowych (np.
centralnego ogrzewania) i
instalacjach chłodniczych (np.
samochodowych) ciecz znajdująca
się w zamkniętym obiegu stanowi
środowisko sprzyjające korozji.
Dodanie niewielkich ilości
substancji silnie
adsorbujących się na
powierzchni metalu i
blokujących dostęp jonów
wodorowych opóźnia
znacznie procesy korozyjne.
Przykłady inhibitorów:
• nieorganiczne: niektóre
związki arsenu, niklu, cyny,
magnezu (stosowane w
środowisku obojętnym i
zasadowym)
• organiczne: krochmal,
klej, białko (stos. w
środowisku kwaśnym)
Działanie inhibitorów
tłumaczy się tworzeniem
trudno rozpuszczalnych
warstewek zaporowych w
miejscach katodowych lub
anodowych.

Korozja drewna
•
Drewno w porównaniu ze stalą, betonem i materiałami
kamiennymi jest odporne na korozję
A) czynniki klimatyczne:
– cykliczne zawilgocenie i zamarzanie
- Promieniowanie UV
- Wahania temperatury
B) czynniki biologiczne: niszcząca działalność organizmów
żywych
(grzyby, glony, bakterie, owady, gryzonie)
C) Czynniki chemiczne
: pH 2 (stężone kwasy zwęglają drewno)
pH 11
Celuloza bardziej odporna na korozję chemiczną niż lignina i
hemiceluloza

Korozja materiałów bitumicznych
Asfalty
•
Odporne na działanie wodnych środowisk agresywnych
•
Twarde asfalty ulegają działaniu silnych utleniaczy (stęż.
HNO
3
, stęż. H
2
SO
4
, Cl
2
, Br
2
)
•
Stężone zasady powodują zmiękczanie
•
Rozpuszczają się w rozpuszczalnikach organicznych
•
Pod wpływem tlenu i światła starzeją się (produkty
rozpuszczalne mają odczyn kwaśny, są agresywne w
stosunku do metali)
Smoły i paki
•
Większa reaktywność niż asfaltów (reaktywne grupy
funkcyjne) i większa podatność na niszczenie

Korozja tworzyw sztucznych
• O
2
, O
3
, spaliny, przemysłowe gazy odlotowe, opady
atmosferyczne powodują niszczenie struktury tworzyw
• Niebezpieczny dla polimerów jest CH
3
COOH
(rozpuszczalnik i reagent)
• Woda przyspiesza proces starzenia tworzyw (wymywa
antyutleniacze)
Tworzywa wykazują odporność na działanie zasad i
kwasów w umiarkowanej temperaturze. Są odporne na
działanie rozpuszczalników organicznych, nie
rozpuszczają się w wodzie.


Zniszczenia betonu w dźwigarze mostu
wywołane korozją stali zbrojeniowej

Rozległy ubytek otuliny
spowodowany korozją zbrojenia

Ubytki betonu na powierzchni zewnętrznej
zbiornika spowodowane przez nieprawidłową
powłokę ochronną
(stan po usunięciu powłoki i skorodowanego
betonu)

Produkty korozji
brojenia na stropie
zbiornika wody pitnej

Ubytki betonu spowodowane korozją zbrojenia
w stropie tunelu

Ubytki betonu na płytach stanowiących
umocnienie grobli

Korozja betonu na płytach stanowiących
umocnienie skarpy zapory
(fot. Hydroprojekt Kraków)

Ubytki betonu
powstałe w strefie
falowania w
konstrukcji
komory zamknięć
zapory wodnej

Ubytki betonu w
filarze jazu
powstałe w
strefie zmiennych
stanów wody

Korozja betonu w
konstrukcji
zbiornika
oczyszczalni
ścieków

Korozja betonu ciosu podłożyskowego
wiaduktu autostradowego

Raki na powierzchni zewnętrznej ściany zbiornika

Przecieki przez ścianę oporową w konstrukcji ujęcia
wody
(stan po oczyszczeniu skorodowanego betonu)
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
- Slide 68
- Slide 69
- Slide 70
- Slide 71
Wyszukiwarka
Podobne podstrony:
egzamin korozja mat bud
egzamin korozja mat bud
Dz bud 4
KOROZJA PODSTAWY TEORETYCZNE I SPOSOBY ZAPOBIEGANIA
Zao bud 1
wyklad 12nowy procesy elektrodowe i korozja
KOROZJA BIOLOGICZNA II
korozja i tarcie
BUD OG wykład 11 3 Geosyntetyki
KOROZJA PODSTAWY TEORETYCZNE I SPOSOBY ZAPOBIEGANIA
BUD OG wykład 11 1 Tworzywa sztuczne
14 Korozja metali i stopów
wykład III bud ciało i szybkość
Bud II ćw proj 4
mat bud 006 (Kopiowanie) (Kopiowanie)
bud 13
1 2085 (2316+S) odporna na korozję na formy
mat bud 102 (Kopiowanie) (Kopiowanie)
więcej podobnych podstron