
Amfetamina i jej
Amfetamina i jej
pochodne.
pochodne.
Gr.d

Pochodne amfetaminy:
„Pochodne środki pobudzające
amfetaminy” (ATS) to amfetaminy oraz
narkotyki z grupy ekstazy. Amfetaminy to
pokrewne związki chemiczne, które
stymulują ośrodkowy układ nerwowy,
dwa najważniejsze z nich to amfetamina i
metamfetamina. Najlepiej znaną
substancją z grupy ekstazy jest 3,4-
metylenodwuoksymetamfetamina
(MDMA), choć w tabletkach ekstazy
znajdowane są również inne pokrewne
analogi.
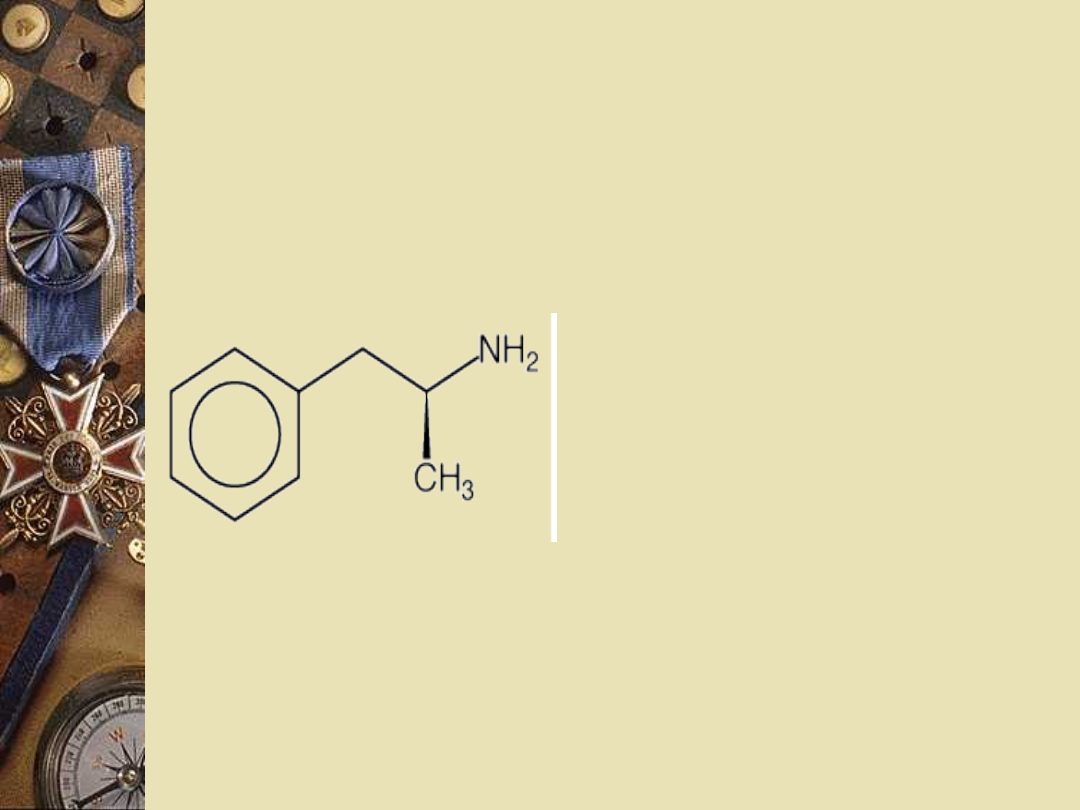
Amfetamina
Pochodna
fenyloetyloaminy
Biały krystaliczny
proszek o gorzkim
smaku
Temperatura
wrzenia: 97°C pod
ciśnieniem 12
mmHg
Rozpuszczalność w
wodzie ok. 15 g/l

Amfetamina:
W formie prawoskrętnej wykazuje 2-krotnie
wyższą aktywność ośrodkową niż jej
lewoskrętny enancjomer
Stosowana w postaci soli z kwasem
siarkowym lub fosforowym
Mechanizm psychostymulujący polega na
nasilaniu uwalniania dopaminy i
noradrenaliny z neuronalnych magazynów
o.u.n., także hamowania wychwytu
zwrotnego tych amin ze szczeliny
synaptycznej

Stosowanie amfetaminy prowadzi do
zwiększenia aktywności psychicznej,
przyspiesza procesy kojarzenia, wywołuje
euforię, zwiększa wydolność fizyczną, znosi
uczucie głodu
Amfetamina jest preparatem toksycznym
prowadzącym do uzależnienia
psychicznego i fizycznego
Wchłania się po podaniu doustnym i
doodbytniczym

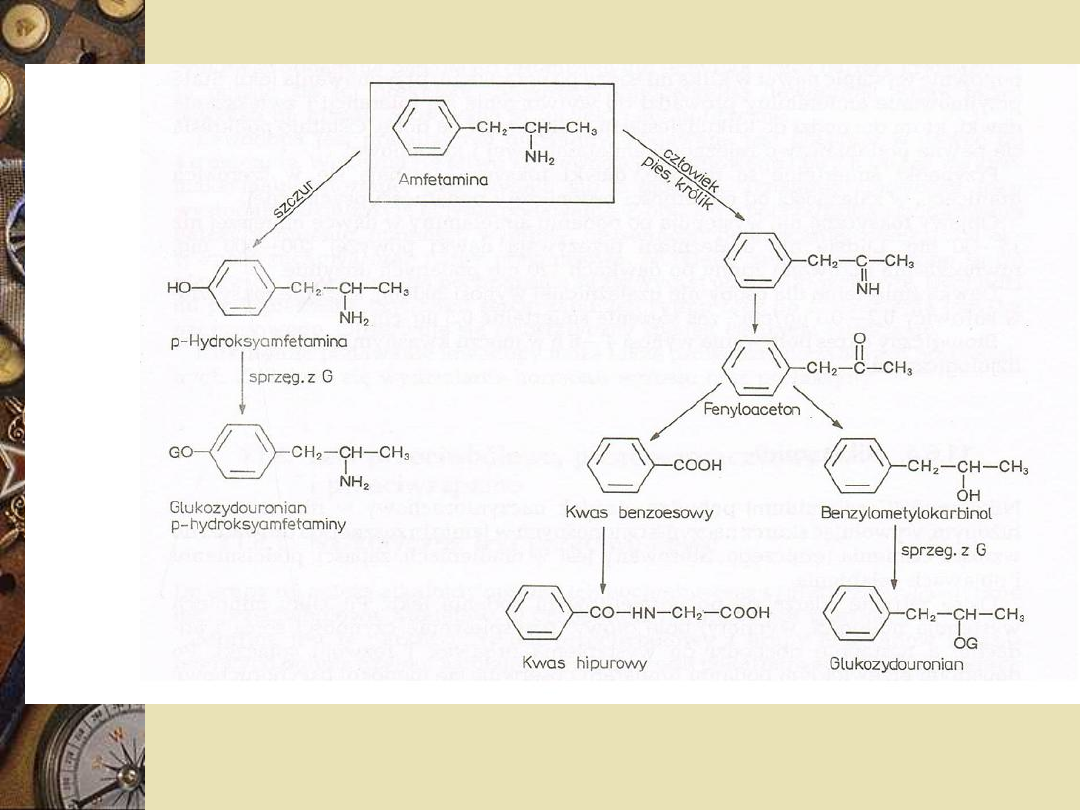
Metabolizm amfetaminy
W organizmie ulega biotransformacji 2
drogami: oksydatywna deaminacja do
fenyloacetonu, który jest utleniany do
kwasu benzoesowego i po związaniu z
glicyną wydala się w postaci kwasu
hipurowego. Uboczny szlak to
hydroksylacja pierścienia
aromatycznego do 4-
hydroksyamfetaminy, który wiąże się z
kwasem glukuronowym lub siarkowym

Amfetamina:
Wydala się z moczem, szybkość wydalania
zależy od pH moczu i gwałtownie zwiększa
się przy jego zakwaszeniu
Około 30% wydala się w postaci
niezmienionej w ciągu 24h, zaś około 90%
w ciągu 3-4 dni
Wydala się także w postaci metabolitów:
kwasu hipurowego, benzyloglukuroidu,
hydroksyamfetaminy, norefedryny

Objawy zatrucia ostrego:
Bezsenność
Pobudzenie psychoruchowe
Euforia
Zaburzenia procesów myślowych
Częstoskurcz
Zaburzenia rytmu serca, zaburzenia
ciśnienia
Suchość w jamie ustnej
W ciężkich przypadkach śpiączka, mogą
pojawić się zespoły drgawkowe

Długotrwałe przyjmowanie większych
dawek amfetaminy prowadzi do
przyzwyczajenia i rozwoju psychoz
toksycznych
Stałe przyjmowanie amfetaminy prowadzi
do wytworzenia się tolerancji i
zwiększenia dawki
Objawy toksyczne nie występują w dawce
mniejszej niż 15-30 mg. Dawka śmiertelna
dla osoby nie uzależnionej wynosi 200mg,
stężenie toksyczne w surowicy 0,2-0,3
µg/cm
3
, stężenia śmiertelne 0,5 µg/cm
3

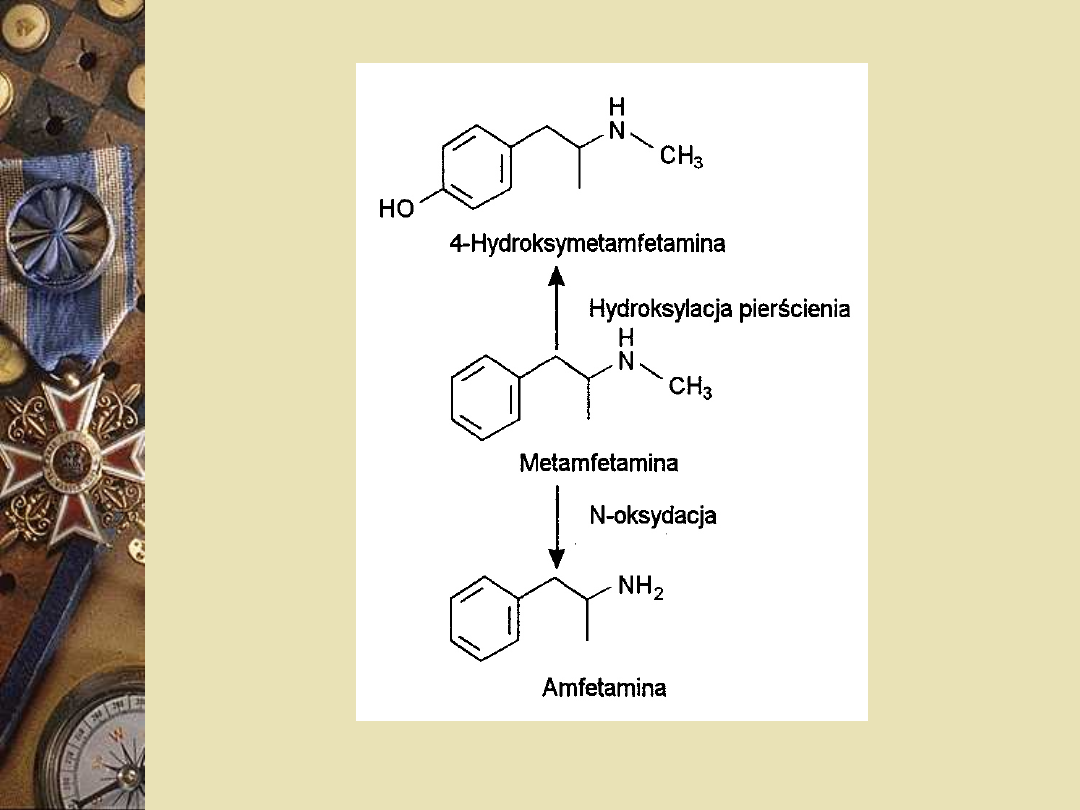
Metamfetamina
N-metylowa pochodna amfetaminy
Stosowana w postaci chlorowodorku
Działa nieco silniej ośrodkowo, a słabiej
obwodowo od amfetaminy
Obwodowe działanie stymulujące
zakończenia presynaptyczne układu
adrenergicznego wynika z analogii
strukturalnej amfetaminy i
metamfetaminy do efedryny i amin
biogennych (noradrenaliny i adrenaliny)

Metamfetamina
Metamfetamina jest wydalana głównie w
postaci niezmodyfikowanej (około 44%
dawki) oraz dwóch metabolitów:
amfetaminy (6-20%) i 4-
hydroksyamfetaminy (około 10%).
Podobnie jak w przypadku amfetaminy,
kwaśny mocz powoduje wzrost zarówno
szybkości wydalania, jak i ilości narkotyku
wydalanego w postaci niezmienionej.

MDMA:
MDMA czyli 3,4-
metylenodioksymetamfetamina,
popularnie zwana ekstazą. Jest analogiem
amfetaminy, wykazującym silne działanie
euforyzujące, stymulujące oraz
wzbudzające uczucie bliskości z
otoczeniem. Przeciętna dawka stosowana
przez osoby używające MDMA wynosi
około 60 - 240 mg.

Działanie i objawy:
Euforia, wzmożona percepcja, podniecenie,
poczucie siły i napływu energii, drażliwość.
Po zażyciu większej dawki mogą nastąpić: urojenia
i omamy wzrokowe i czuciowe, rozszerzone źrenice,
wzrasta puls i ciśnienie krwi, występuje nadmierna
potliwość i gwałtowne zmiany temperatury ciała,
bóle w klatce piersiowej.
Skutki przedawkowania: drażliwość, bezsenność,
niestrawność, skurcze, szybki wzrost temperatury
ciała, nadpobudliwość, halucynacje, omdlenia,
gwałtowne skoki ciśnienia, drgawki i śmierć.
Zespół abstynencyjny: apatia, ospałość, depresja,
dezorientacja, zwiększone łaknienie.

Metody wstępnej
identyfikacji amfetaminy
Próba Marquisa:
a)
Umieścić na płytce niewielką ilość materiału
b)
Dodać 1 kroplę odczynnika- 0,25 ml 37% roztworu
formaldehydu w 10 ml lodowatego kwasu octowego.
c)
Dodać 2 krople kwasu siarkowego
Barwa pomarańczowa zmieniająca się w brunatną
wskazuje na obecność amfetaminy lub metamfetaminy.
Barwa żółta do żółto-brązowej wskazuje na obecność 2,5-
dimetoksy-4-etyloamfetaminy (DOET) lub 2,5-dimetoksy-4-
metyloamfetaminy (STP, DOM).
Barwa żółto-zielona do zielonej wskazuje na obecność 2,5-
dimetoksyamfetaminy (DMAS) lub brolamfetaminy (DOB).
Barwa czarna wskazuje na obecność tenamfetaminy
(MDA), 3,4-metylenodioksyamfetaminy (MDMA), N-
etylotenamfetaminy (MDE) lub N-hydroksytenamfetaminy
(N-OH MDA).

Próba z kwasem siarkowym: amfetamina i
metamfetamina nie dają zabarwienia z tym odczynnikiem,
natomiast szereg ich pochodnych tworzy z kwasem
siarkowym barwne połączenia.
Próba Simsona: dodać 1 kroplę (0,9 g nitroprusydku
sodu w 90 ml wody i 10 ml aldehydu octowego) i 2 krople
(2 g węglanu sodowego w 100 ml wody). Barwa niebieska
może wskazywać na obecność metamfetaminy.
Próba Simsona z acetonem: dodać 1 kroplę (1 g
nitroprusydku sodu w 100 ml 5% (V/V) wodnego roztworu
acetonu) i 1 kroplę (2 g węglanu sodu w 100 ml wody).
Barwa purpurowa może wskazywać na obecność
amfetaminy.
Próba z kwasem galusowym: dodać 1 kroplę 0,5 g
kwasu galusowego w 100 ml stężonego kwasu siarkowego
Zabarwienie jasnozielone do ciemnozielonego może
wskazywać na obecność tenamfetaminy (MDA), 3,4-
metylenodioksymetamfetaminy (MDMA),N-
etylotenamfetaminy (MDA) lub N-hydroksytenamfetaminy
(N-OH MDA).

Przygotowanie próbki do
chromatografii. Ekstrakcja
ciecz - ciecz
Ekstrakcję amfetaminy i metamfetaminy z moczu
przeprowadza się w środowisku alkalicznym, pH-11
Do próbówki pobiera się 2 ml moczu i dodaje: roztwór
wzorca wewnętrznego (roztwór 2-metylofenyloetyloamin),
roztwór wodorotlenku sodu, wodę (5 ml) i dichlorometan (20
ml). Zamkniętą próbówkę wstrząsa się i wiruje przy małej
szybkości przez 5 minut, a następnie usuwa się górną
warstwę. Jeśli konieczne jest dalsze oczyszczanie ekstraktu
stosuje się postępowanie oparte na zwrotnej ekstrakcji do
kwasu. Do ekstraktu dodaje się 2 ml 0,15 M roztworu kwasu
siarkowego(VI) i zamkniętą próbówkę wstrząsa się i wiruje.
Górną (wodną) warstwę przenosi się do próbówki i dodaje 1
ml 1M roztworu wodorotlenku sodu oraz 2,5 ml 1-
chlorobutanu lub dichlorometanu. Zamkniętą probówkę
wstrząsa się energicznie i wiruje. Rozpuszczalnik organiczny
przenosi się do czystej probówki, dodaje 50 μl mieszaniny
metanolu i kwasu octowego (9:1) i odparowuje do sucha.

Przygotowanie próbki do
chromatografii. Ekstrakcja
ciecz - ciało stałe
Mocz (1 ml) i kwas fosforowy (0,5 ml) miesza
się starannie w probówce i wlewa do
kolumienki. Kolumienkę suszy się powietrzem
przez około 30 sekund i płucze się kolejno
kwasem fosforowym (1 ml), kwasem octowym
(0,5 ml) i metanolem (1 ml). Po powtórnym
wysuszeniu kolumienki substancje badane
eluuje się za pomocą metanolu z dodatkiem
roztworu amoniaku (3%, v/v, 2 ml).
Ekstrakt odparowuje się do sucha pod
próżnią lub w strumieniu azotu.

Analiza ilościowa
amfetaminy - metody
chromatograficzne
Chromatografia gazowa sprzężona ze
spektrometrią mas
Wysokosprawna chromatografia cieczowa:
Metoda bez derywatyzacji- ekstrakty odparowuje
się do sucha w strumieniu azotu, a następnie
rozpuszcza się pozostałość w 50-100 μl acetonitrylu
lub fazy ruchomej.
Roztwory wzorcowe o stężeniu 0,01 mg/ml
przygotowuje się w acetonitrylu
Kolumna: długość 10 cm, średnica wewnętrzna 4,0
mm, materiał wypełniający – krzemionka
zmodyfikowana grupami oktadecylowymi.
Faza ruchoma: acetonitryl-woda (12:200 v/v) +
kwas fosforowy (0,1%)

Metoda z
derywatyzacją
przeprowadza się ekstrakcję próbek. Roztwory wzorcowe
przygotowuje się, rozpuszczając wzorce w czystym
moczu, aby uzyskać stężenie 5 μl/ml. Ekstrakty
odparowuje się do sucha w strumieniu azotu, a następnie
suchą pozostałość rozpuszcza w 200 μl 2% roztworu
węglanu sodu i dodaje równą objętość soli sodowej
kwasu β-naftochinono-4-sulfonowego. Po ogrzewaniu w
temperaturze 60°C przez 30 minut roztwór wodny
ekstrahuje się mieszaniną heksanu i eteru dietylowego w
stosunku 2:1, mieszając przez 2 minuty. Warstwę
organiczną przenosi się do czystej probówki, odparowuje
do sucha w strumieniu azotu, a pozostałość rozpuszcza
się w 100 μl acetonitrylu.
Kolumna: długość 150 mm, średnica wewnętrzna 3,9
mm, materiał wypełniający -oktadecylokrzemionka.
Faza ruchoma: Acetonitryl-metanol-0,01 M kwas
siarkowy (20:20:60, v/v/v).

Test wieloparametrowy Szybki, skriningowy test do
jednoczesnego jakościowego oznaczania obecności kilku
narkotyków (kokainy, amfetaminy, marihuany, ekstazy, morfiny,
benzodiazepin) i ich metabolitów w ludzkim moczu. Test jest
immunochromatograficznym testem skriningowym służącym
do jakościowego wykrywania wymienionych narkotyków. W
metodzie tej narkotyk obecny w próbce moczu
współzawodniczy z koniugatem narkotyku unieruchomionym
na membranie płytki o ograniczoną liczbę monoklonalnych
przeciwciał przeciw danemu narkotykowi. Na płytce znajdują
się immobilizowane koniugaty każdego z testowanych
narkotyków w strefie testowej „T”: oraz koniugaty przeciwciał
przeciwko każdemu narkotykowi. Podczas oznaczania próbka
moczu w wyniku działania sił kapilarnych przesuwa się w górę
płytki. Jeśli w próbce moczu, stężenie określonego narkotyku
jest mniejsze niż wynosi czułość testu dla tego narkotyku
wówczas nie będą wysycone miejsca wiązania na
przeciwciałach. Przeciwciała zostaną przechwycone przez
immobilizowane koniugaty danego narkotyku
i pojawi się czerwony prążek w strefie testowej „T” (wynik
ujemny). Jeżeli stężenie określonego narkotyku w próbce
moczu jest wyższe niż wynosi czułość testu dla tego narkotyku,
to pojawi się czerwony prążek w strefie „T” – wynik dodatni.

Oznaczanie amfetaminy
Analiza amfetaminy w ludzkim materiale biologicznym
(krew, mocz) z wykorzystaniem metody mikroekstrakcji
do fazy stacjonarnej w fazie nadpowierzchniowej :
Urządzenie do SPME ma kształt zbliżony do strzykawki.
Najważniejszym jego elementem jest włókno kwarcowe
pokryte fazą stacjonarną. Procedura analityczna SPME
obejmuje dwa etapy. W pierwszym etapie włókno jest
doprowadzane do kontaktu z próbką w fazie gazowej (lub
w fazie ciekłej), w wyniku czego dochodzi do sorpcji
analitów. W drugim etapie włókno jest wystawiane na
działanie wysokiej temperatury w gorącym dozowniku
chromatografu gazowego, a uwolnione anality
przenoszone są do kolumny chromatograficznej.

MATERIAŁ I METODA
Procedura szybkiej analizy amfetaminy wymaga wstępnie
kondycjonowania włókna SPME w gorącym dozowniku
chromatografu gazowego przez czas konieczny do oczyszczenia
włókna, od pół godziny do kilku godzin. Dopiero po tym etapie
można przystąpić do przygotowania próbki moczu i krwi do
analizy końcowej. Do szklanego naczyńka przeniesiono po 1 ml
próbki, dodano wzorzec amfetaminy oraz roztworu węglanu
potasu. Zamknięto szczelnie naczyńko i wymieszano zawartość.
W trakcie termostatowania próbki amfetamina jest uwalniana do
fazy nadpowierzchniowej. Po 20 min włókno SPME wprowadza
się do fazy nadpowierzchniowej wewnątrz naczyńka i eksponuje
przez 5 min. Termiczna desorpcja analitów w gorącym
dozowniku chromatografu gazowego uwalnia substancje, które
są dalej rozdzielane i oznaczane w układzie chromatograficznym
GC-FID.

Do zalet metody SPME należy zaliczyć ograniczenie ilości
koniecznych operacji analitycznych. Tym samym istnieje
mniejsze ryzyko popełnienia błędu grubego i
systematycznego, a dodatkowo znacznie skraca się czas
analizy.
Metoda jest prosta a jej koszty są relatywnie niskie. W
odróżnieniu od innych metod wzbogacania analitów, w
metodzie SPME całkowicie wyeliminowano zużycie
drogich i toksycznych rozpuszczalników.
Metoda SPME wymaga jednak stosunkowo częstej
kalibracji oraz szczególnej dbałości o czystość włókna
sorpcyjnego. W celu uzyskania powtarzalnych wyników
metodą SPME konieczne jest dokładne kontrolowanie i
odtwarzanie parametrów procesu sorpcji i desorpcji
analitów z włókna.

PRZYPADKI ŚMIERTELNYCH ZATRUĆ Z
UDZIAŁEM P-METOKSYAMFETAMINY (PMA) I P-
METOKSYMETAMFETAMINY (PMMA) W
MATERIALE ZAKŁADU MEDYCYNY SĄDOWEJ W
WARSZAWIE
Dwóch mężczyzn straciło przytomność w mieszkaniu jednego z
nich. P.W. zmarł przed przybyciem pogotowia. Lekarz pogotowia
stwierdził „...stan bardzo ciężki, w skurczu spastycznym, z
drgawkami, pojedyncze płytkie oddechy, siny”. U pacjenta
wystąpił także szczękościsk i zatrzymanie krążenia. Po masażu
pośrednim serca i podaniu adrenaliny czynność serca
powróciła. W momencie przyjęcia na oddział „...pacjent w stanie
skrajnie ciężkim, oddech wspomagany, sinica obwodowa,
źrenice średnio szerokie, bez reakcji na światło, brak odruchu
rzęskowego i rogówkowego, reakcji na ból i odsysanie”. Zgon
nastąpił w mechanizmie nagłego zatrzymania krążenia – w 30
minut od rozpoczęcia akcji ratunkowej przez lekarza pogotowia.
Badanie toksykologiczne wykazało obecność amfetaminy, PMA,
PMMA i kokainy w badanym materiale biologicznym tj. we krwi,
moczu i tkankach żołądka. W kieszeni jednego z denatów
znaleziono fragment tabletki. Skład tabletki): PMA-16%, PMMA-
13%, efedryna 13%, amfetamina 1% oraz śladowe ilości
ubocznych produktów syntezy.

Materiał do badania stanowiły: krew, mocz i żołądek wraz z
treścią pobrane podczas sekcji zwłok w Zakładzie Medycyny
Sądowej w Warszawie.
Krew i mocz odpowiednio rozcieńczano buforem,
wykorzystywanym do oznaczeń metodą immunofluorescencji w
świetle spolaryzowanym, a następnie wirowano i wykonywano
oznaczenie związków z grupy amfetamin w moczu.
Potwierdzenia obecności związków z klasy amfetamin
dokonywano wg metody Gjerde. Do fiolek o poj. 20 ml pobierano
1 ml krwi lub moczu, dodawano 1400 μl roztworu standardu
wewnętrznego, 400 μl 20% roztworu NaOH i 10 ml
cykloheksanu. Ekstrakcję prowadzono 10 minut w temperaturze
pokojowej. Warstwę organiczną odparowywano w łagodnym
strumieniu powietrza w temperaturze pokojowej. Do suchej
pozostałości dodawano 50 μl bezwodnika kwasu
heptafluoromasłowego (HFBA) i ogrzewano 20 minut w
temperaturze 75°C. Odczynnik odparowywano w temperaturze
pokojowej, a suchą pozostałość zawieszano w 50 μl metanolu. Tak
przygotowane próby poddawano analizie przy użyciu
chromatografu gazowego sprzężonego z detektorem oraz
automatycznym podajnikiem próbek. Nastrzyku o objętości 1 μl
dokonywano w trybie niepodziałowym, gazem nośnym był hel z
przepływem 1 ml/min. Zbierania danych dokonywano w trybie
skanowania widma w zakresie mas od 5 do 550 AMU.

Bibliografia:
„Toksykologia” [pod red.] W. Seńczuk,
Warszawa 2002, Wydawnictwo
Lekarskie PZWL
„Chemia Leków [pod red.] A. Zejca i
M. Gorczycy Warszawa 2004,
Wydawnictwo Lekarskie PZWL
„Toksykologia kliniczna” T. Bogdanik
http://www.chem.univ.gda.pl/analiza/d
http://www.ipin.edu.pl/ain/archiwum/2
002/1/t15n1_4.pdf
Document Outline
- Amfetamina i jej pochodne.
- Pochodne amfetaminy:
- Amfetamina
- Amfetamina:
- PowerPoint Presentation
- Metabolizm amfetaminy
- Slide 7
- Slide 8
- Objawy zatrucia ostrego:
- Slide 10
- Metamfetamina
- Metamfetamina
- Slide 13
- MDMA:
- Działanie i objawy:
- Metody wstępnej identyfikacji amfetaminy
- Slide 17
- Przygotowanie próbki do chromatografii. Ekstrakcja ciecz - ciecz
- Przygotowanie próbki do chromatografii. Ekstrakcja ciecz - ciało stałe
- Analiza ilościowa amfetaminy - metody chromatograficzne
- Metoda z derywatyzacją
- Slide 22
- Oznaczanie amfetaminy
- MATERIAŁ I METODA
- Slide 25
- PRZYPADKI ŚMIERTELNYCH ZATRUĆ Z UDZIAŁEM P-METOKSYAMFETAMINY (PMA) I P-METOKSYMETAMFETAMINY (PMMA) W MATERIALE ZAKŁADU MEDYCYNY SĄDOWEJ W WARSZAWIE
- Slide 27
- Bibliografia:
Wyszukiwarka
Podobne podstrony:
Amfetamina i jej pochodne
Amfetamina i jej pochodne
Amfetamina i jej pochodne(1) ppt
Rola witaminy C i jej pochodnych w metabolizmie skóry
Rola witaminy C i jej pochodnych w metabolizmie skór2
Rola witaminy C i jej pochodnych w metabolizmie skóry część II
23 PRZETACZANIE KRWI I JEJ POCHODNYCH
Rola witaminy C i jej pochodnych w metabolizmie skór1
Rola witaminy C i jej pochodnych w metabolizmie skóry
Amantadyna i jej pochodne leki o wielu możliwościach
6 Pochodna i jej zastosowanie
Opcje i instrumenty pochodne (26 stron), Opcja jest to umowa dająca jej posiadaczowi prawo do wykona
1 Filozofia â pochodzenie nazwy od czego się zaczyna jakie są jej przesłanki
12. Definicja pochodnej funkcji jednej zmiennej w punkcie i przykład jej interpretacji, Studia, Seme
Teksty, Syro-palestyna, Nazwa Palestyna pochodzi od ludu Filistynów, którzy osiedlili się na jej wyb
więcej podobnych podstron