Przyczyny uszkodzeń DNA endogenne: błędy replikacji, reaktywne
formy tlenu
(źródła RFT w warunkach fizjologicznych i patologicznych)
Egzogenne: RFT pojawiające się w wyniku metabolizmu
ksenobiotyków (jakich?), ekspozycji na promieniowanie jonizujące i
UV, tworzenie dimerów pirymidynowych
Skutki działania RFT na kwasy nukleinowe: utlenianie zasad, tlenowa
deaminacja, przerwy pojedynczej/podwójnej nici, miejsca
apurynowe/apirymidynowe, wiązania krzyżowe, addukty DNA z
produktami peroksydacji lipidów
Uszkodzenia wynikające z działania interkalujacych związków
chemicznych (jakich?), toksyn roślinnych (psoralenów), toksyn
środowiskowych. Chemioterapia: leki alkilujące, antymetabolity.
Działanie policyklicznych węglowodorów aromatycznych na DNA –
ten temat można powiązać z analizą adduktów metodą
32
P –
postlabelingu.

USZKODZENIA DNA: MODYFIKACJA
ZASAD
•
I. POJEDYNCZE ZASADY
•
A. Deaminacja cytozyny do uracylu
•
B. Deaminacja adeniny do hipoksantyny
•
C. Alkilacja
•
D. Insercja lub delecja nukleotydu
•
E. Inkorporacja analogu zasady
•
F. Depurynacja
•
II. DWIE ZASADY
•
A. Indukowane światłem UV tworzenie dimerów
tyminy
•
B. Tworzenie wiązań krzyżowych

USZKODZENIA DNA: MODYFIKACJE
ŁAŃCUCHA
• III. PRZERWY POJEDYNCZEJ/PODWÓJNEJ NICI
• A. Promieniowanie jonizujące
• B. Reaktywne formy tlenu
• IV. WIĄZANIA KRZYŻOWE
• A. Pomiędzy zasadami w tym samym
łańcuchu lub łańcuchu dopełniającym
• B. Pomiędzy DNA i białkami, np. histonami

„ENDOGENNE” CZYNNIKI TWORZĄCE
WIĄZANIA KRZYŻOWE W DNA
• KWAS AZOTAWY POWSTAJE W ŻOŁADKU
Z PRODUKTÓW SPOŻYWCZYCH
• PRODUKTY PEROKSYDACJI LIPIDÓW
(MDA) → ETENOADDUKTY
• HCHO (wiązania krzyżowe DNA-białko i
białko-białko)
PROMIENIOWANIE KSENOBIOTYKI INFEKCJE AUTOUTLENIENIE
.
OH
PUFA
TOKSYCZNE ALDEHYDY
DNA
TLENOWE
MODYFIKACJE
ZASAD
ADDUKTY
PROMIENIOWANIE KSENOBIOTYKI INFEKCJE
.
OH
POŚREDNIE I BEZPOŚREDNIE ODDZIAŁYWANIE RFT Z
DNA
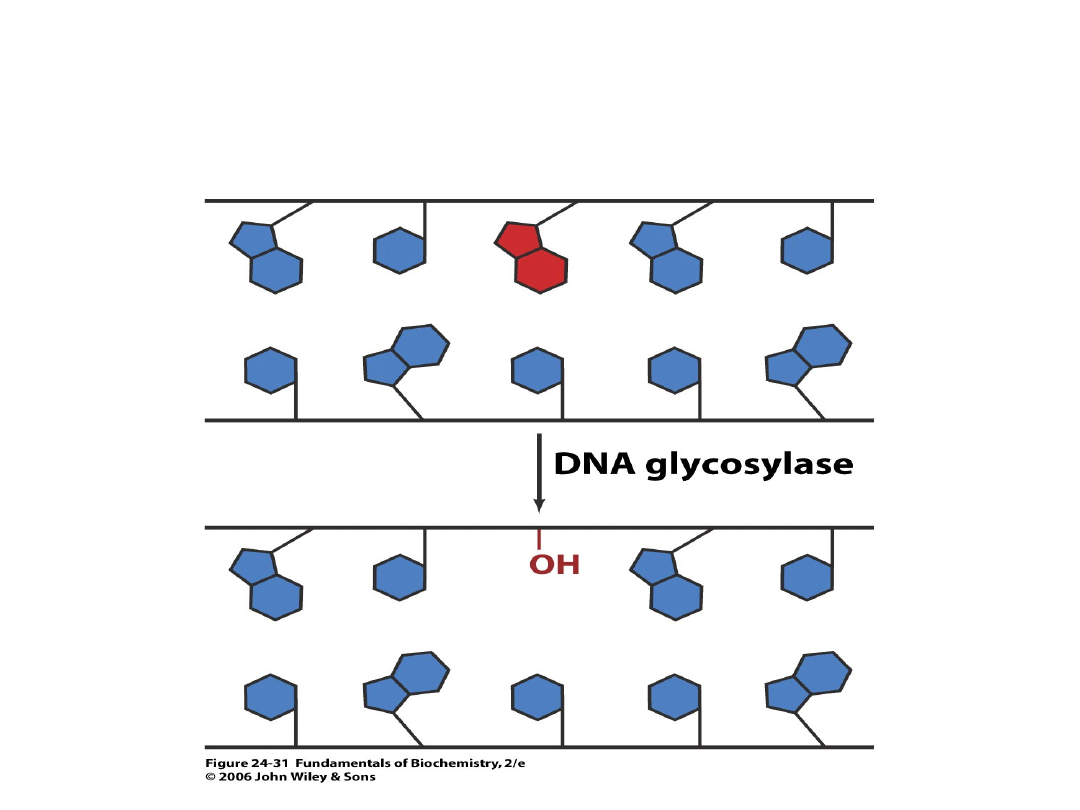
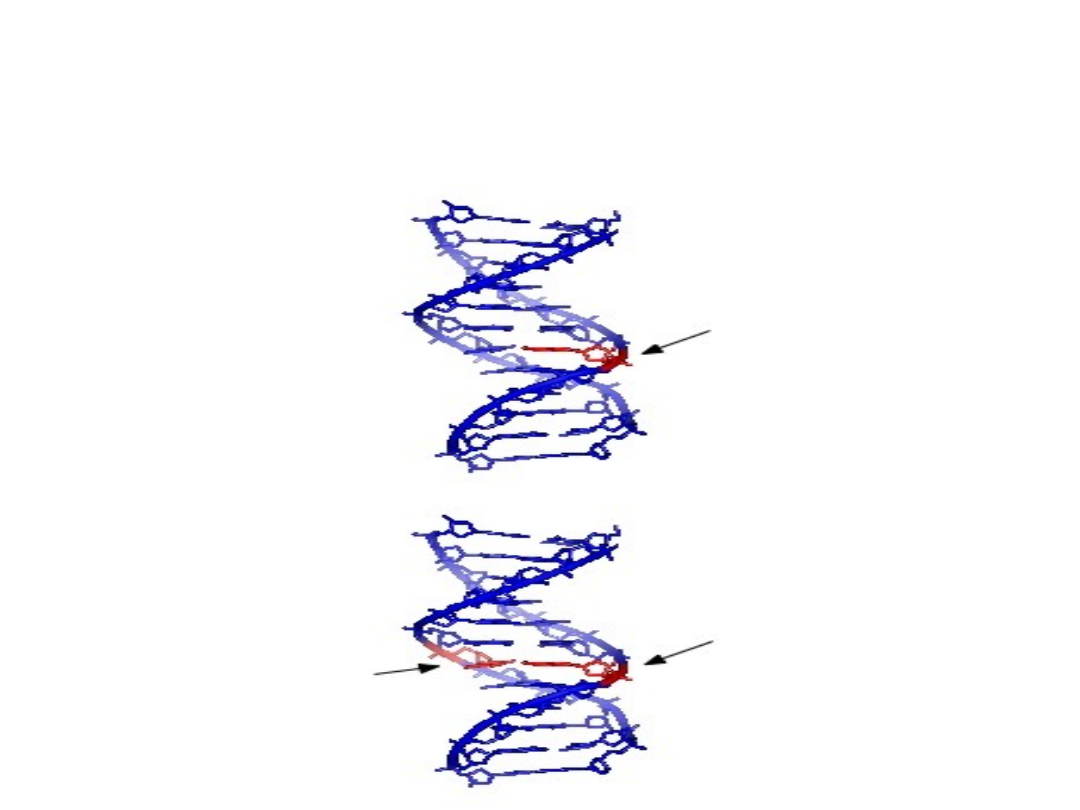
POWSTANIE MIEJSCA
APURYNOWEGO

Uszkodzenia DNA a mutacje
Naprawa uszkodzeń DNA – krótkie przypomnienie wiadomości z
biochemii
(BER, NER, MMR, NHEJ)
Odpowiedź komórek na uszkodzenia DNA
Cykl komórkowy, punkty kontrolne - krótkie przypomnienie wiadomości z
biochemii
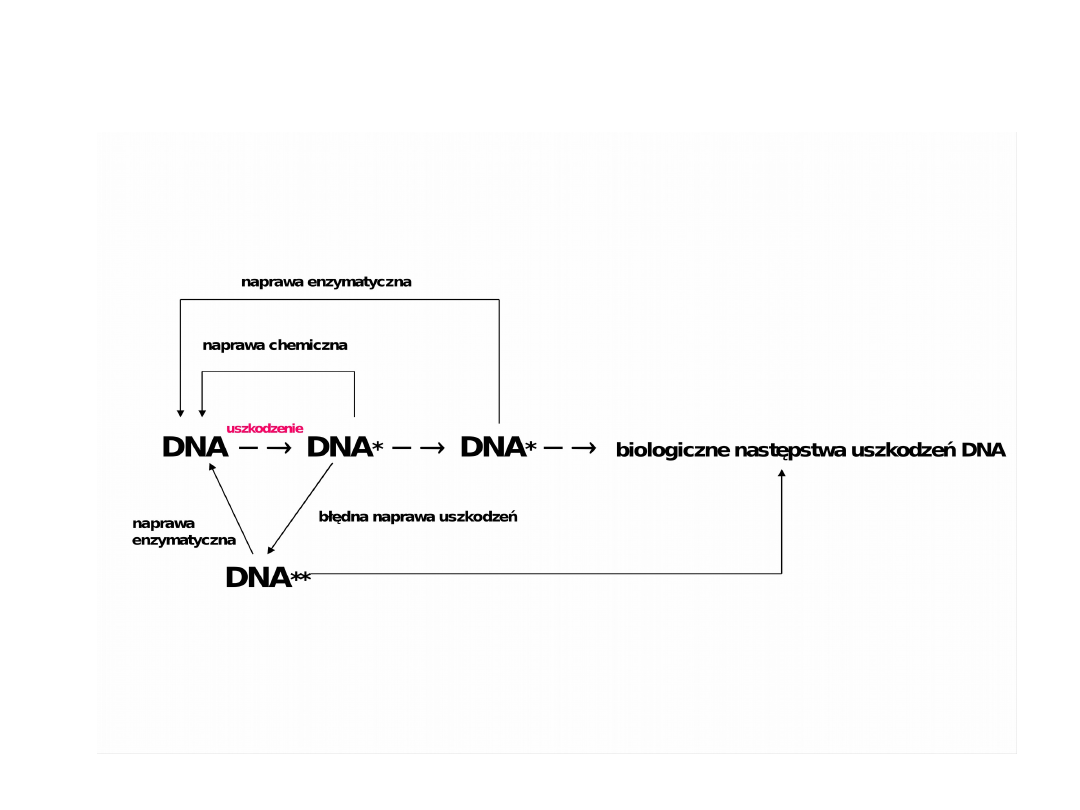
Wywołanie biologicznych następstw
uszkodzeń DNA i schemat naprawy
DNA* - cząsteczka uszkodzona, DNA** - cząsteczka błędnie naprawiona

NAPRAWA USZKODZONEGO DNA
• Bezpośrednie „odwrócenie” uszkodzenia
– nie jest wymagana matryca, nie
zachodzi przerwanie pojedynczej nici:
– Tworzenie dimerów tyminy pod wpływem UV –
dodatkowe wiązania kowalencyjne pomiędzy
sąsiednimi T – fotoreaktywacja przy udziale
fotoliazy (aktywność zależna od absorpcji
światła 300-600 nm)
– Metylacja guaniny odwracana przez
aktywność MGMT (metylotransferaza), reakcja
stechiometryczna a nie katalityczna, 1
cząsteczka MGMT może być użyta 1x); MGMT
jest indukowana przez niskie dawki czynników
alkilujacych, warunkuje oporność komórek
nowotworowych na chemioterapię
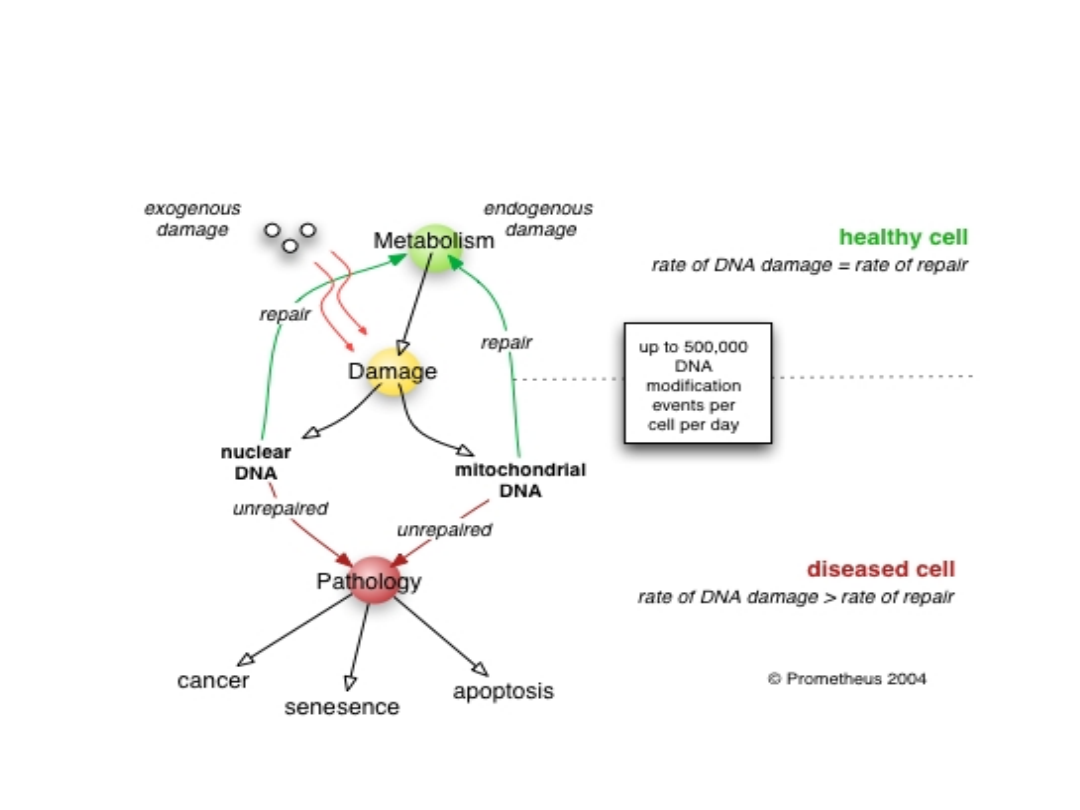
ODPOWIEDŹ KOMÓREK NA USZKODZENIA DNA

TECHNIKI ANALITYCZNE SŁUŻĄCE DO
OCENY USZKODZEŃ DNA
• Elektroforeza kometkowa
• GC/MS
•
32
P-postlabeling
• Zsynchronizowana
spektrofotometria
fluorescencyjna
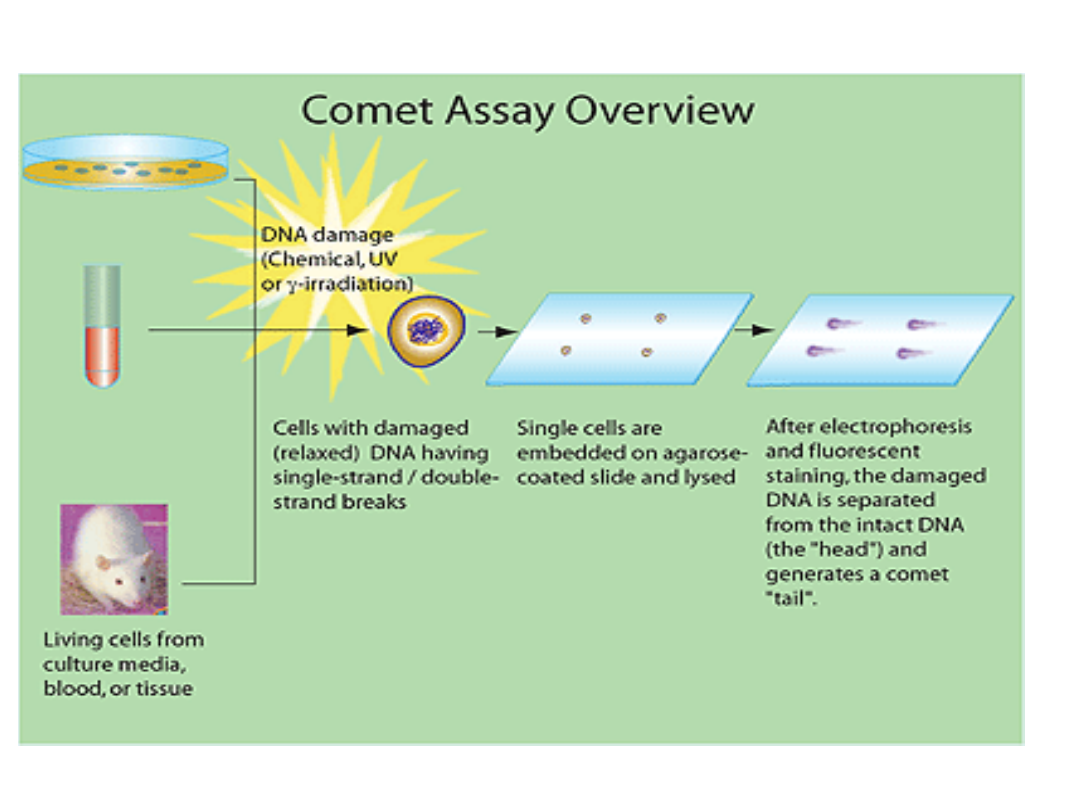
ELEKTROFOREZA KOMETKOWA

GC/MS
• Kolumna kapilarna wypełniona nośnikiem, stały przepływ gazu,
który nie reaguje z nałożoną próbką (argon, hel, wodór, azot)
• Spektrometria mas (MS): cząsteczki naładowane elektrycznie
przechodzą przez pole magnetyczne – rozpad naładowanych
cząsteczek i identyfikacja fragmentów obciążonych ładunkiem,
identyfikacja całej cząsteczki „poskładanej” z fragmentów
• Próbka do analizy MS musi mieć postać gazu (waporyzacja); w
komorze jonizacyjnej cząsteczki rozpadają się na jony w kolizji z
elektronami (M+ lub M
+
.); każdy jon indywidualnie wchodzi do
akceleratora. Wszystkie jony mają te samą energię kinetyczną.
Określone napięcie powoduje przejście tylko jednego
naładowanego fragmentu do detektora
• Zderzenie jonu z powierzchnią detektora wybija elektrony
(fotopowielacz – wzmocnienie ładunku)
• Elektrony wychwytywane w kolektorze – pomiar ładunku
• Masa proporcjonalna do wykrytego ładunku: m/z
• Wykres widma masowego: każdy pik odzwierciedla inny fragment
struktury cząsteczki; cząsteczka w całości – największa masa
widma (jon molekularny; „masa macierzysta”)
• Ograniczenia metody: zdolność rozdzielcza detektora
Policykliczne węglowodory
aromatyczne są kancerogenne
po aktywacji metabolicznej,
która może prowadzić do
powstawania adduktów –
produktów interakcji metabolitów
chemicznych kancerogenów z
DNA.
Addukty kancerogen - DNA
uważane są za krytyczne
uszkodzenia decydujące o
inicjacji procesu
nowotworowego.
32
P-POSTLABELING: WYKRYWANIE ADDUKTÓW,
np. kancerogen-DNA
W badaniach in vitro lub na zwierzętach możliwe jest
zastosowanie kancerogenów znakowanych izotopami
(tryt)

•
Wyizolowany DNA
jest hydrolizowany
enzymatycznie do
nukleotydów
Nukleaza P1
rozkłada
niezmodyfikowane
nukleotydy
Znakowanie
32
P
pozostałych
nukleotydów w
pozycji 5`
Chromatografia TLC
Autoradiografia
Hydroliza
enzymatyczn
a
Mikrokokalna
nukleaza
fosfodiesteraza II
Np(m
5
Cp+Cp+Tp+Ap+Gp)
+G
*
p+A
*
p
Nukleaza P
1
N+pi+G
*
p+A
*
p
32
P-
labeling
32
P-G
*
p+
32
P-
A
*
p
Rozdział
chromatograficzny
32
P-POSTLABELING
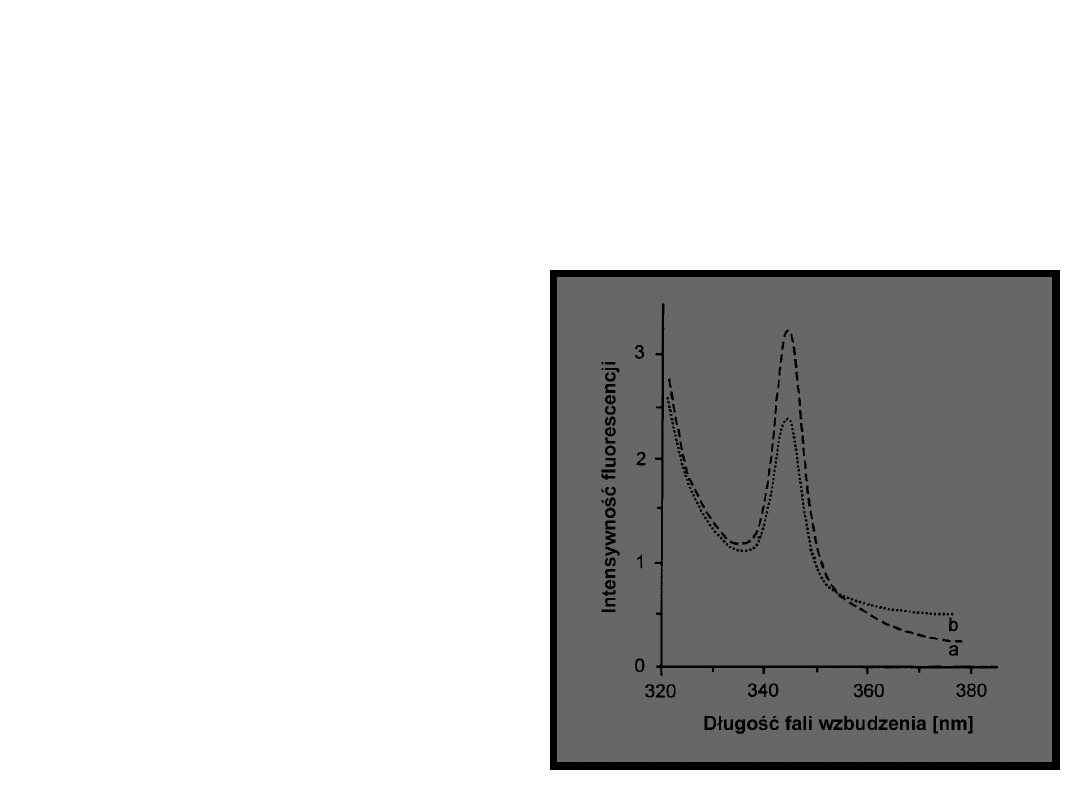
Pomiar
zsynchronizowanej
spektrofotometrii
fluorescencyjnej –
rejestrowanie
widma
fluorescencyjnego
przy zmiennej
długości fali
wzbudzenia i
emisji, ale przy
utrzymywaniu
stałej różnicy
między tymi
wartościami
Δλ=34 nm
a – wzorcowe
addukty
DNA:kancerogeny
b – DNA izolowane
z próby badanej
ZSYNCHRONIZOWANA SPEKTROFOTOMETRIA
FLUORESCENCYJNA
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
Wyszukiwarka
Podobne podstrony:
USZKODZENIE DNA
W11 Uszkodzenia DNA i ich konsekwencje
Uszkodzenia DNA
biologia, NAPRAWA DNA, Mechanizmy naprawy oksydacyjnych uszkodzeń DNA
W12 Uszkodzenia DNA i naprawa
02 USZKODZENIA DNA A
W11 Uszkodzenia DNA i ich konsekwencje
Uszkodzenia i naprawa DNA obieralny prof E Pastwa
Biochemia kliniczna W VII0 03 2011 Uracyl w DNA – znaczenie biologiczne
W10 Uszkodzenia białek i DNA
W10 Uszkodzenia białek i DNA
IG.4 - Uszkodzenia i naprawa DNA w komórkach nowotworowych, Genetyka, Inżynieria genetyczna
Mechanizm uszkodzenia i naprawy DNA, Patologia i choroby
badania uszkodzeń, metody analizy DNA
W9 Uszkodzenia białek i DNA
W9 Uszkodzenia białek i DNA (asus Komputer's conflicted copy 2012 05 26)
W10 Uszkodzenia białek i DNA
więcej podobnych podstron