
Wykład 2
Białka - struktura i funkcje
2.1. Aminokwasy
http://www.mlyniec.gda.pl/~chemia/organiczna/
aminokwasy.htm
http://chemik12.webpark.pl/rozne/aminokwasy.htm
http://pl.wikipedia.org/wiki/Bia%C5%82ko
http://www.pmp.p-net.pl/biologia/bialka.htm

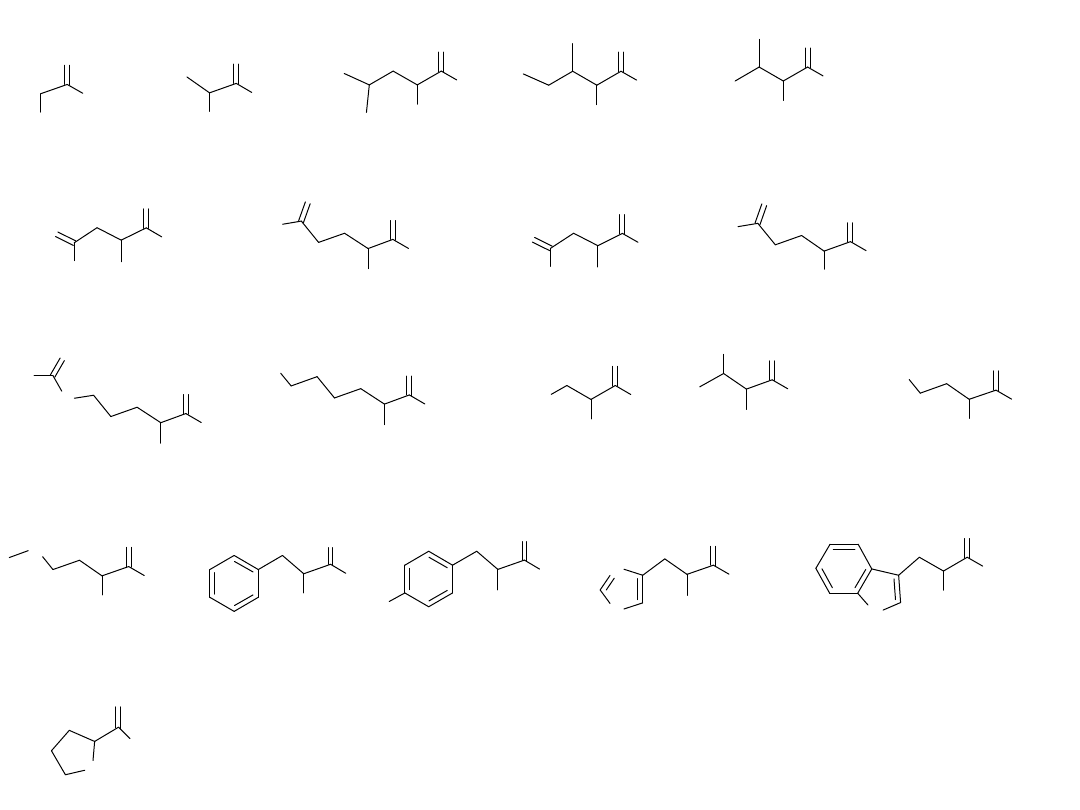
Aminokwasy są związkami
chemicznymi, składającymi się z dwóch
grup funkcyjnych: grupy kwasowej (–
COOH) i grupy aminowej (-NH
2
). Te
grupy są przyłączone do tego samego
atomu węgla. Atom węgla nazywamy
atomem alfa. Tak więc aminokwasy
występujące w przyrodzie są alfa-
aminokwasami. Obie grupy funkcyjne
są zdolne do przyłączania i
odszczepiania kationu wodorowego.
Wykazują więc równowagi pomiędzy
różnymi formami sprotonowanymi w
roztworze. Stężenia tych form zależą
od stężenia jonu wodorowego w
roztworze, a więc od pH.
NH
2
O
OH
NH
2
O
N
H
NH
N
H
2
OH
NH
2
O
O
NH
2
OH
NH
2
O
O
OH
OH
NH
2
O
O
O
H
OH
NH
2
O
OH
NH
2
O
OH
NH
2
O
OH
NH
2
O
OH
NH
2
O
O
N
H
2
OH
NH
2
O
N
H
2
OH
NH
2
O
H
O
OH
N
O
O
OH
NH
2
O
S
H
OH
NH
2
O
S
OH
NH
2
O
OH
NH
2
O
O
H
OH
NH
2
O
N
N
H
OH
NH
2
O
N
H
OH
NH
O
OH
Arginina Arg
Alanina Ala
Kwas asparaginowy Asp
Asparagina Asn
Kwas glutaminowy Glu
Glicyna Gly
Leucyna Leu
Izoleucyna ILeu
Walina Val
Glutamina Gln
Lizyna Lys
Seryna Ser
Treonina Thr
Cysteina Cys
Metionina Met
Fenyloalanina Phe
Tyrozyna Tyr
Histydyna His
Tryptofan Trp
Prolina Pro
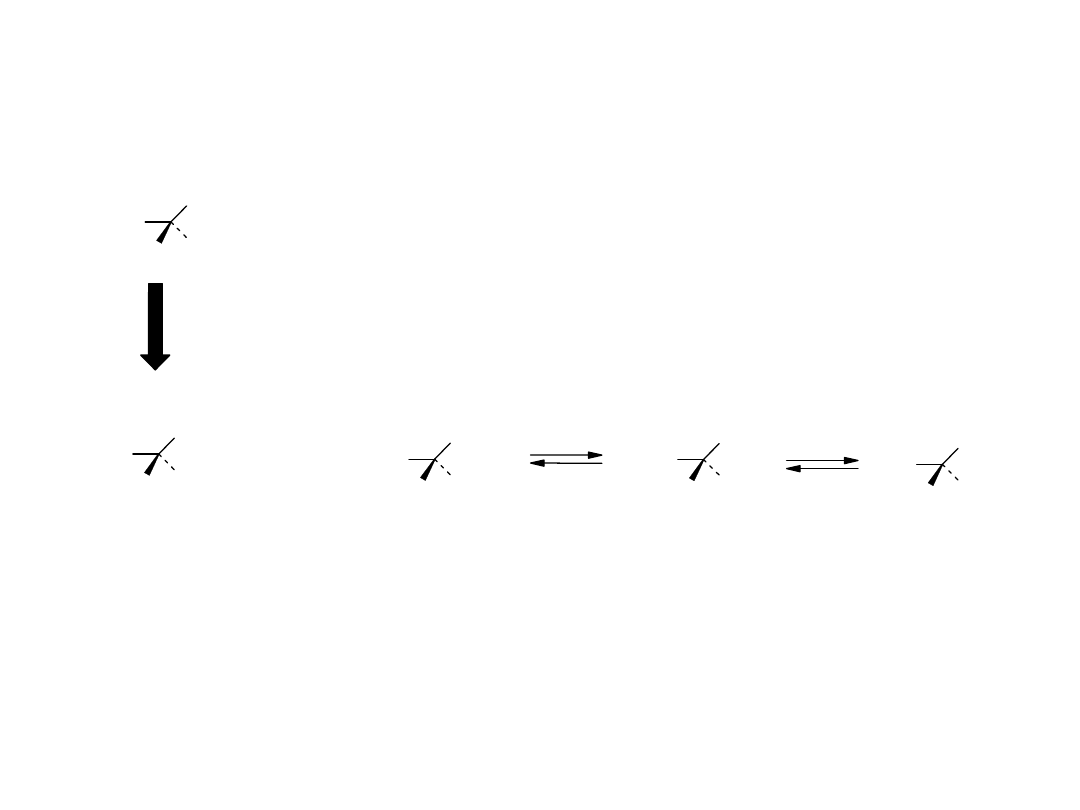
N
H
2
H
COOH
H
H
COO
H
H
3
N
H
COO
H
H
3
N
H
H
H
3
N
COOH
H
COO
H
N
H
2
-
+
zwitterjon
(jon obojnaczy)
+
+ H
+
+ H
+
- H
+
- H
+
-
+
-
Równowagi w roztworze wodnym glicyny
GLicyna (Gly) - kwas - aminooctowy

Forma kationowa aminokwasu dominuje w
środowisku kwaśnym, forma anionowa w
środowisku zasadowym, natomiast stężenie formy
zwitter-jonu jest największe w pH, zwanym
punktem izoelektrycznym (pomiędzy wartościami
pK
a
grup: aminowej i karboksylowej). Punkt
izoelektryczny to pH, w którym stężenia form
jonowych są sobie równe.
Ogólnie:
Wartość pK
a
jest to takie pH, przy którym stężenia
formy sprotonowanej i zdeprotonowanej są sobie
równe. Rozważmy równowagę kwasową:
AH H
+
+ A
-
Stała równowagi tej reakcji ma postać:
K
a
= [A
-
][H
+
]/[AH],
co, po zlogarytmowaniu i przekształceniu daje:
pK
a
= pH + log([AH]/[A
-
])
Jest to równanie Hendersona-Hasselbacha.
Opisuje ono sens fizyczny stałej równowagi
kwasowej, podany powyżej.
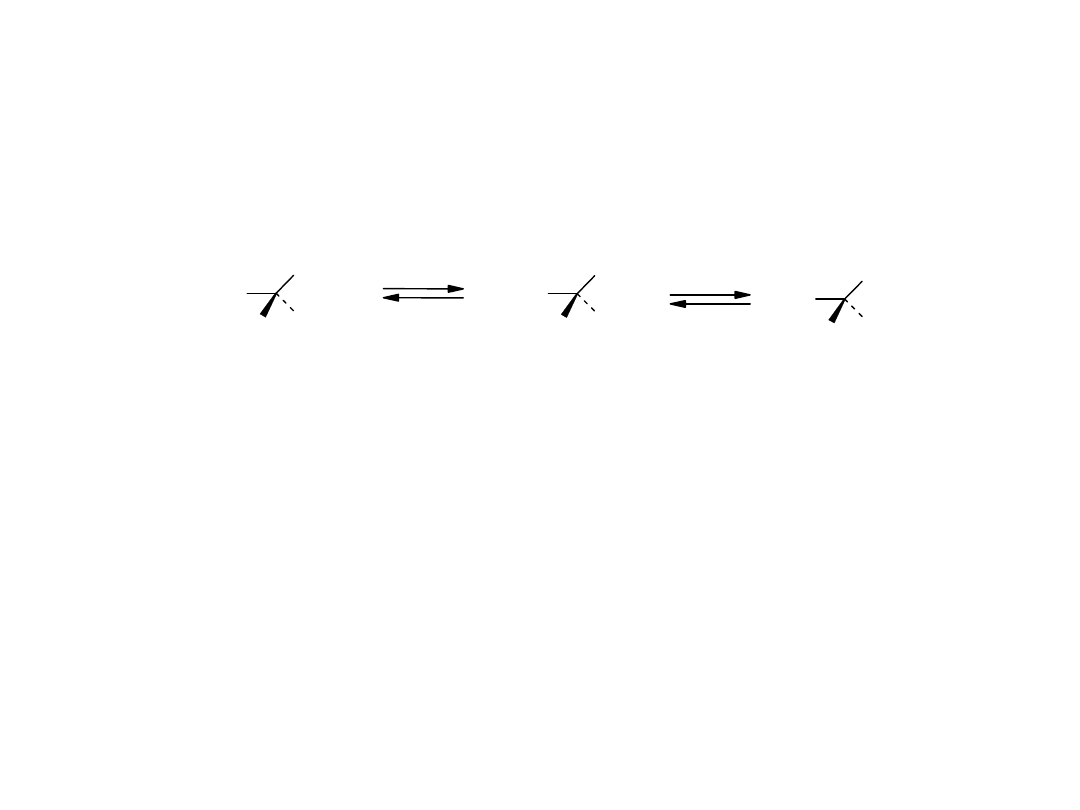
pK
a
to takie pH, przy którym stężenia form:
sprotonowanej i zdeprotonowanej są sobie równe
H
COO
H
H
3
N
H
H
H
3
N
COOH
H
COO
H
N
H
2
+
+ H
+
+ H
+
- H
+
- H
+
-
+
-
GLicyna (Gly) - kwas - aminooctowy
pK
a
1
= 2.4
pK
a
2
= 9.8
Gly
+
Gly
-
Gly
ZI
W pH < 2.4: [Gly
+
] > [Gly
ZI
]
W pH = 2.4: [Gly
+
] =[Gly
ZI
]
W pH > 2.4: [Gly
+
] < [Gly
ZI
]

Nazwa
Grupa boczna
Akronim
Skrót
pK
a
*
Glicyna
-H
Gly
G
2.4; 9.8
Alanina
-CH
3
Ala
A
2.3; 9.9
Walina
-CH(CH
3
)
2
Val
V
2.3; 9.6
Leucyna
-CH
2
C(H)(CH
3
)
2
Leu
L
Izoleucyna
-CH(CH
3
)CH
2
CH
3
Ile
I
Seryna
-CH
2
OH
Ser
S
2.1; 9.2
Treoniona
-CH(CH
3
)OH
Thr
T
Asparaginia
n
-CH
2
COO
-
Asp
D
2.0; 10.0; 3.9
Glutaminia
n
-CH
2
CH
2
COO
-
Glu
E
2.2; 9.7; 4.3
Asparagina
-CH
2
C(O)NH
2
Asn
N
Glutamina
-CH
2
CH
2
C(O)NH
2
Gln
Q
Prolina
a
Pro
P
Lizyna
-CH
2
CH
2
CH
2
CH
2
NH
3
+
Lys
K
2.2; 9.2; 10.8
Arginina
-
CH
2
CH
2
CH
2
NHC(NH
2
)
2
+
Arg
R
1.8; 9.0; 12.5
Cysteina
-CH
2
SH
Cys
C
1.8; 10.8; 8.3
Metionina
- CH
2
CH
2
SCH
3
Met
M
Phe
F
1.8; 9.1
Tyrozyna
Tyr
Y
2.2; 9.1; 10.9
Histydyna
His
H
1.8; 9.2; 6.0
Tryptofan
Trp
W
* W kolejności: grupa karboksylowa (); grupa aminowa: grupa funkcyjna w łańcuchu bocznym
.

H
H
3
N
COOH
COOH
H
H
3
N
COO
COOH
H
H
3
N
COO
COO
H
N
H
2
COO
COO
+ H
+
- H
+
+
-
Równowagi w roztworze
wodnym
kwasu asparaginowego
(Asp)
pK
a
1
= 2.0
pK
a
2
= 3.9
pK
a
3
= 10.0
+
-
+ H
+
- H
+
+
-
+ H
+
- H
+
-
-
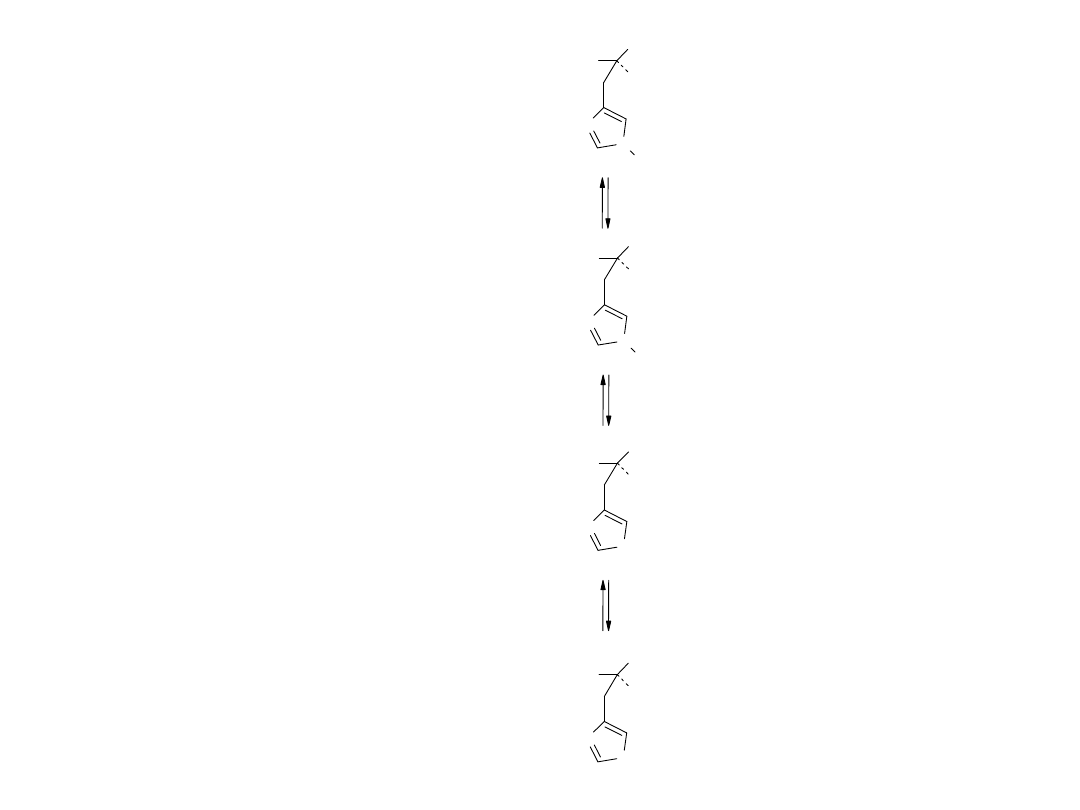
N
N
H
H
3
N
COOH
H
N
N
H
H
3
N
COO
H
N
N
H
H
3
N
COO
N
N
H
N
H
2
COO
+ H
+
- H
+
+
Równowagi w roztworze
wodnym histydyny (His)
pK
a
1
= 1.8
pK
a
2
= 6.0
pK
a
3
= 9.2
-
+ H
+
- H
+
+
+ H
+
- H
+
+
-
-
-
-

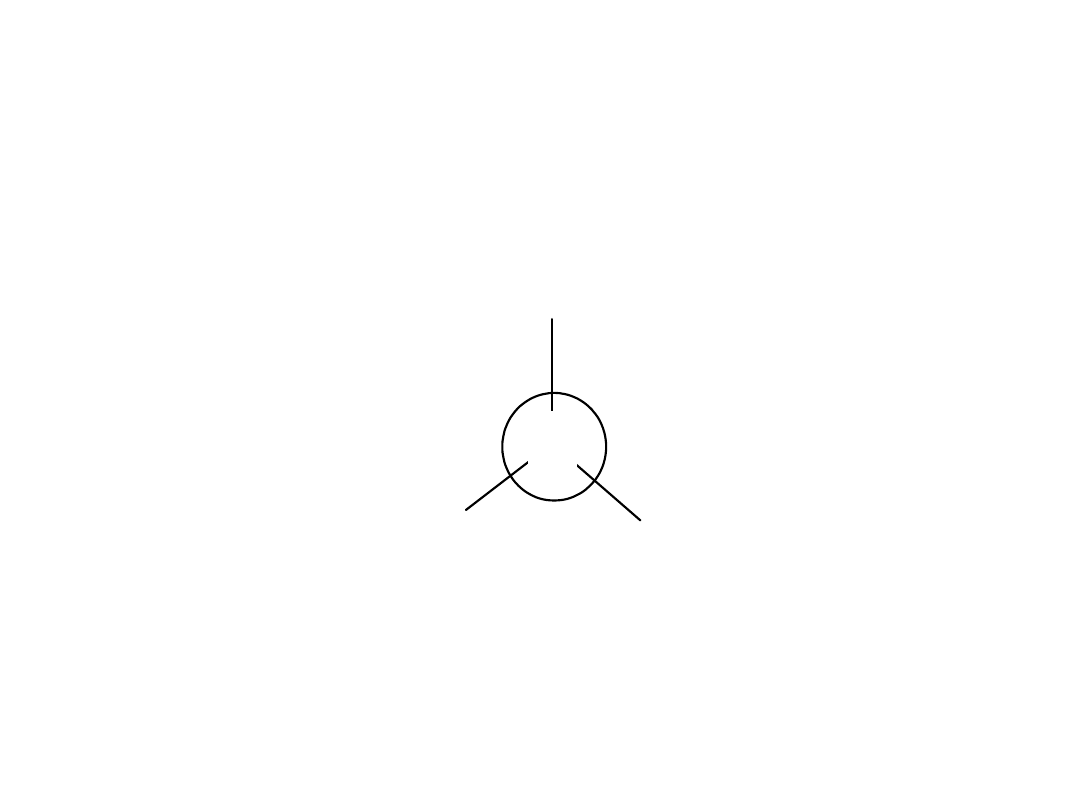
Gdy do tego samego atomu węgla są przyłączone cztery różne
podstawniki, to występuje zjawisko stereoizomerii.
Ma to miejsce we wszystkich aminokwasach, z wyjątkiem glicyny
C
+
H
3
N
R
COO
-
H
Jeśli obrócimy cząsteczkę aminokwasu (wzór
cząsteczki w postaci zwitter-jonu) o kąt 90
tak, aby atom wodoru (najmłodszy) leżał
bezpośrednio za atomem węgla C, to
otrzymamy projekcję Newmana.
COO
C
H
3
NH
3
+
-
C
Projekcja Newmana Alaniny
Wodór jest za symbolem środkowego węgla

Atom węgla ma cztery różne podstawniki: -H
(najmłodszy),
-NH
3
+
(atom
azotu
jest
najstarszy,
bo
ma
największą
masę
atomową),
-COO
-
(atom
węgla
grupy
karboksylowej łączy się z dwoma atomami
tlenu), np. -CH
3
(atom węgla pierwszy atom
łańcucha bocznego). W konsekwencji atom
węgla jest centrum chiralności. Można ją
zdefiniować najłatwiej poprzez obrócenie
cząsteczki tak, aby można było poprowadzić
linię od najstarszego podstawnika (atomu
związanego
z
centrum
chiralności)
w
kierunku
podstawnika
o
malejącym
starszeństwie
(masie
atomowej
atomu
związanego
bezpośrednio
z
centrum
chiralności).
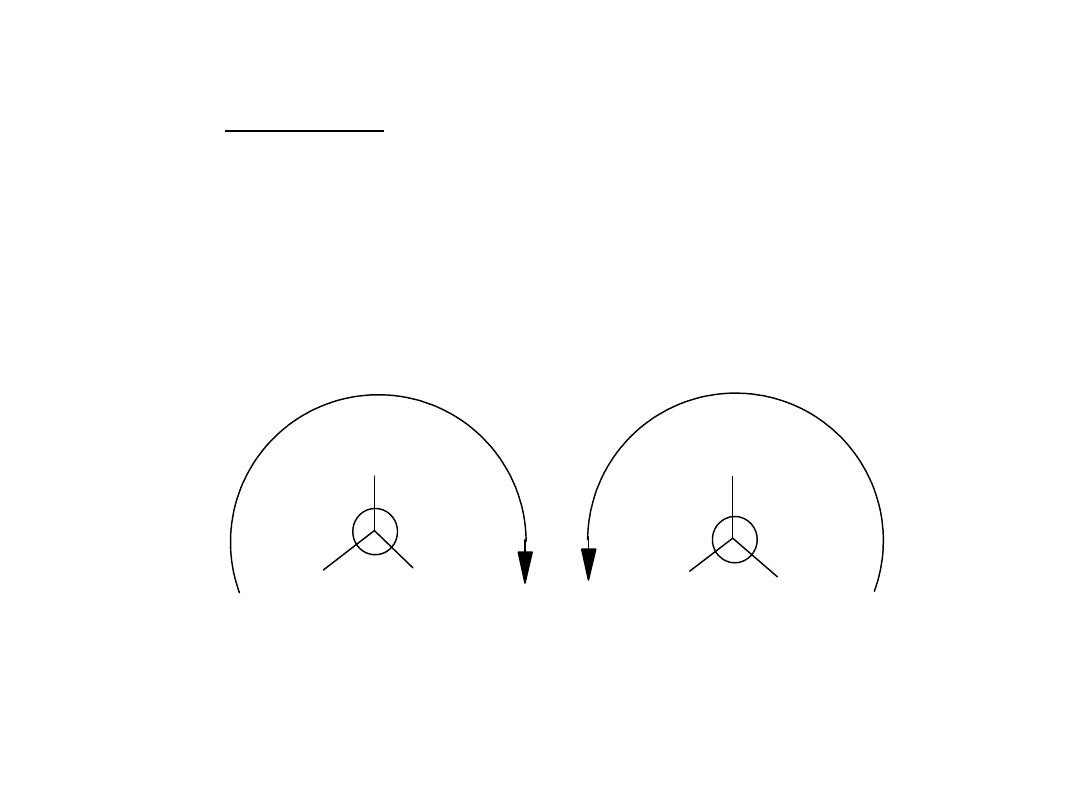
Projekcja Newmana
L-Alanina (w postaci zwitter-jonu)
Konfiguracja absolutna S (L) i R (D)
Według nomenklatury Kahna-Ingolda-
Preloga
S- sinister; R-rectus
COO
H
3
N
CH
3
COO
C
H
3
NH
3
+
+
-
-
Konfiguracja prawoskrętna
D-Alanina
Konfiguracja
lewoskrętna
L-Alanina
Te dwa izomery mają odmienne właściwości.
Są one względem siebie enancjomerami

Enancjomery skręcają płaszczyznę światła
spolaryzowanego w przeciwne strony.
Wszystkie aminokwasy z wyjątkiem glicyny
mają węgiel
chiralny (centrum asymetrii, centrum
stereogeniczne).
Aminokwasy występujące w białkach zwierząt
i człowieka są aminokwasami typu L.
W przyrodzie występuje co najmniej 20
aminokwasów, którym przypisano stałe akronimy
trójliterowe oraz symbole jednoliterowe. Lista nazw
wraz z akronimami jest pokazana w uprzedniej
Tabeli.

Aminokwasy są połączone ze sobą
wiązaniem peptydowym (typu amidowego)
+
H
3
N
C
C
R
O
H
N
H
C
COO
-
R
H
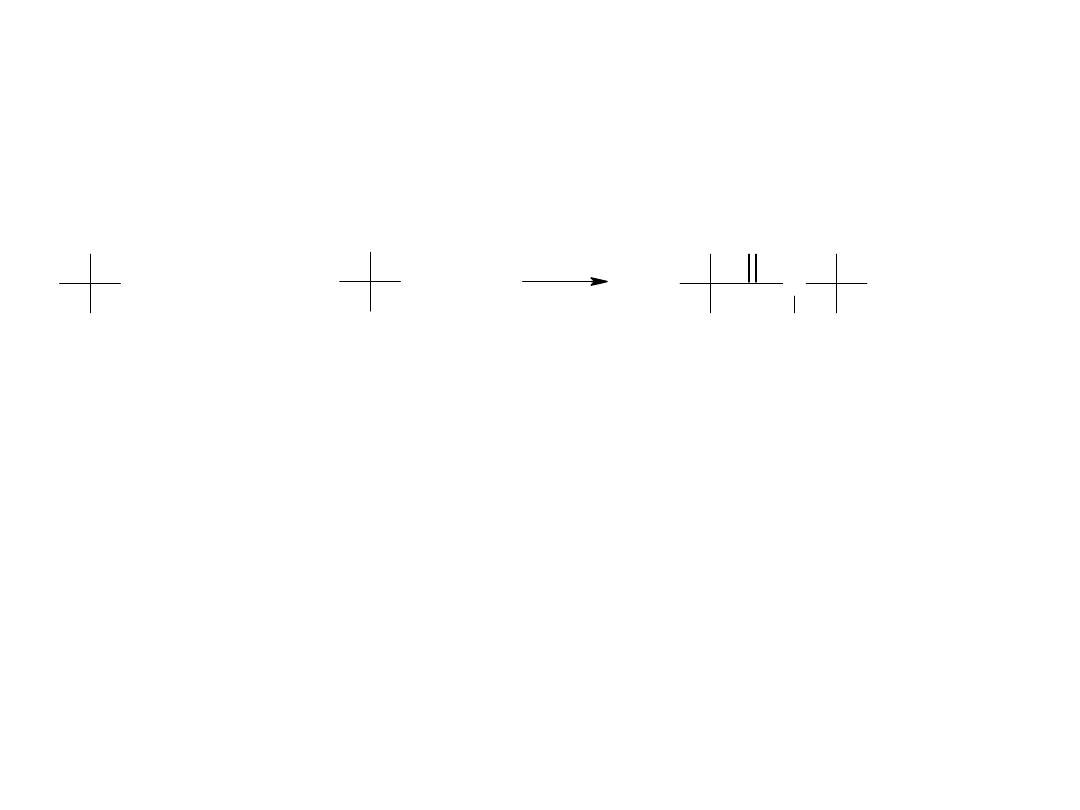
Wiązanie to powstaje jako skutek kondensacji dwóch aminokwasów
w reakcji:
N
H
2
R
H
COOH
N
H
2
R'
H
COOH
N
H
2
R
H
O
N
H
R'
H
COOH
+
+
H
2
O
Ugrupowanie amidowe jest „płaskie”, tzn. atomy C-C’(O)-
N(H)-C leżą w jednej płaszczyźnie. Wiązania C=O i C-N
mają charakter wiązania podwójnego odpowiednio w 60% i
40%. Ograniczona swoboda rotacji wokół wiązania C’-N
powoduje możliwość występowania izomerii cis/trans.
Wiązania występujące w białkach są zwykle trans (jak na
rysunku).

Wykład 3
2.1. Wiązania
peptydowe,
struktura I-IV-
rzędowa
2. Białka - struktura i
funkcje
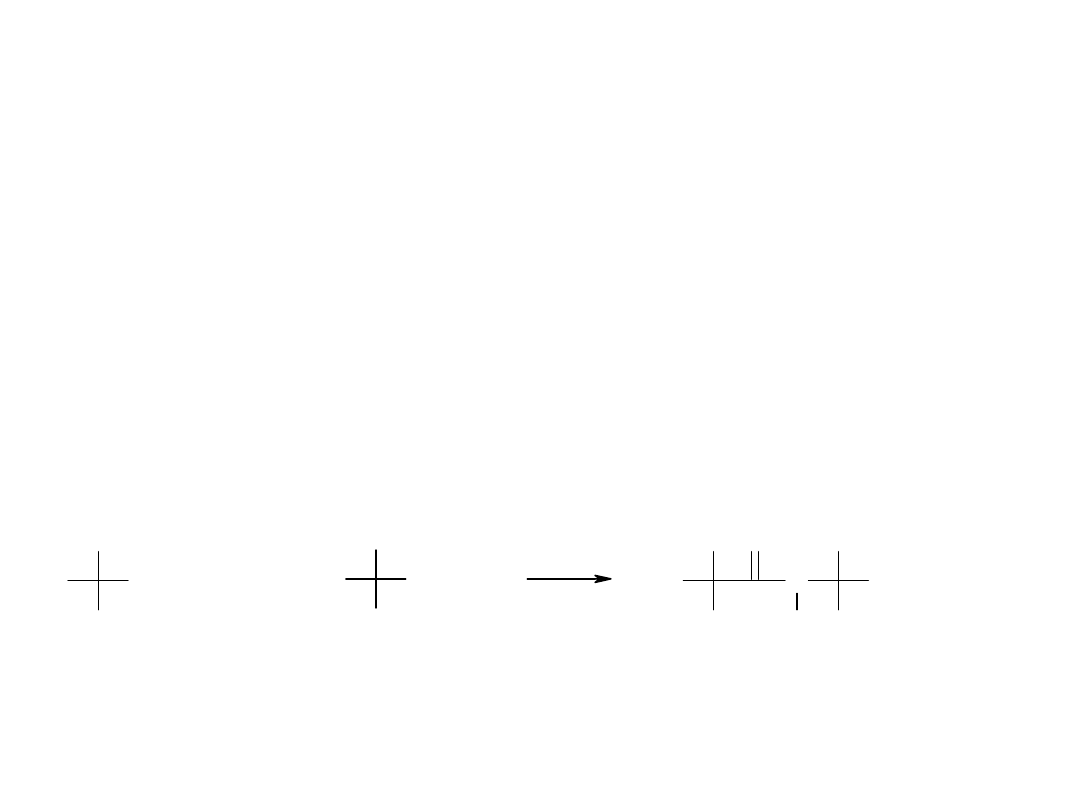
N
H
2
R
H
COOH
N
H
2
R'
H
COOH
N
H
2
R
H
O
N
H
R'
H
COOH
+
+
H
2
O
Wiązanie pomiędzy dwoma aminokwasami (wiązanie peptydowe)
Wiązanie pomiędzy dwoma aminokwasami (wiązanie peptydowe)
jest wiązaniem pomiędzy węglem grupy karboksylowej poprzedniego
jest wiązaniem pomiędzy węglem grupy karboksylowej poprzedniego
aminokwasu i azotem grupy alfa-aminowej drugiego aminokwasu.
aminokwasu i azotem grupy alfa-aminowej drugiego aminokwasu.
Wiązanie pomiędzy węglem i azotem ma charakter wiązania częściowo
Wiązanie pomiędzy węglem i azotem ma charakter wiązania częściowo
podwójnego. Obrót wokół tego wiązania nie jest swobodny.
podwójnego. Obrót wokół tego wiązania nie jest swobodny.

Gdy obrót wokół wiązania nie jest swobodny (np. wiązanie
Gdy obrót wokół wiązania nie jest swobodny (np. wiązanie
podwójne C=C), to może wystąpić izomeria geometryczna typu
podwójne C=C), to może wystąpić izomeria geometryczna typu
cis – trans:
cis – trans:
H
H
C
H
3
CH
3
H
CH
3
C
H
3
H
N
O
H
N
O
H
Buten-2
izomer cis
izomer trans
Peptyd
izomer cis
izomer trans
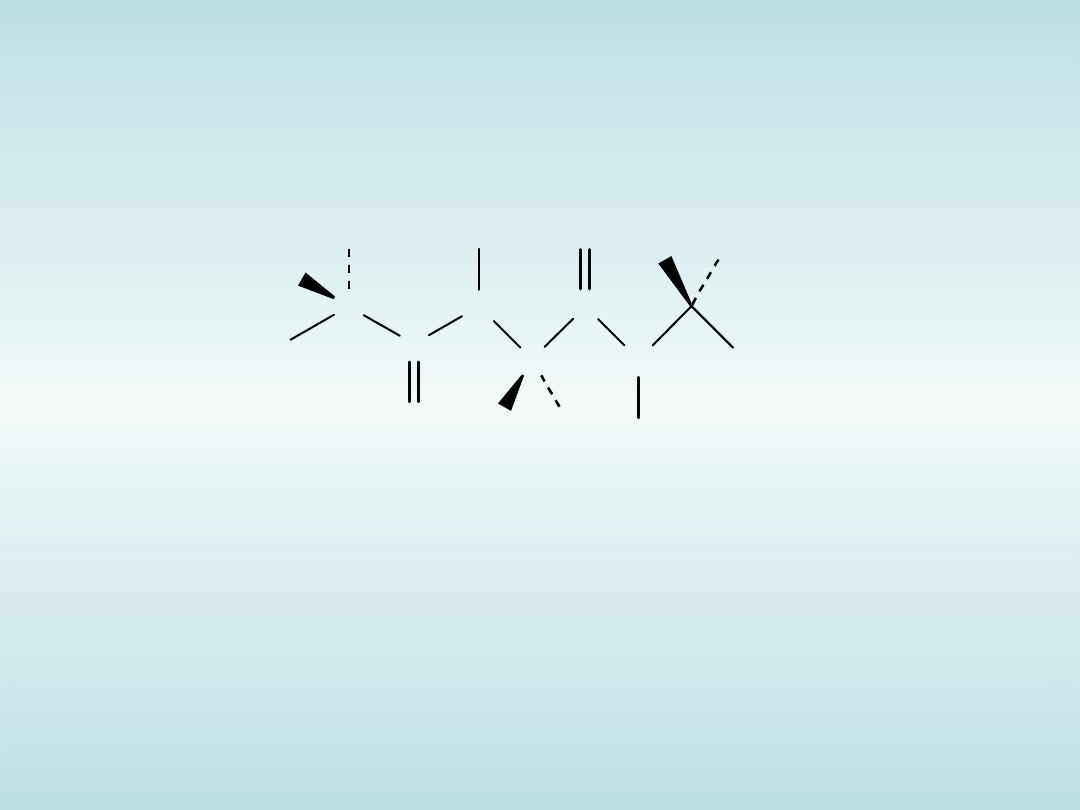
NH
3
C
C
O
N
R
H
H
C
C
R
H
O
N
H
COO
H
R
+
-
Wiązania peptydowe w polipeptydach
(tutaj jest to tripeptyd – trzy połączone ze sobą aminokwasy)
są płaskie i zawsze typu trans.
Atomy głównego łańcucha polipeptydu, to:
N, C
C’, N, Ca, C’, N, Ca, C’.

Struktura białek (polipeptydów)
Białka
są
polimerami,
których
monomery
stanowią
aminokwasy.
Powtarzającym
się
elementem
w
strukturze łańcucha polipeptydowego
są
aminokwasy.
Łańcuch
główny
stanowią atomy N-C-C’, czyli atomy
azotu
(wiązania
amidowego
(peptydowego)),
atomy
węgla
aminokwasu, podstawione grupami:
aminową,
karboksylową,
atomem
wodoru i grupą boczną aminokwasu
(R), oraz atomy węgla karbonylowego
wiązania amidowego.

Struktura I-rzędowa:
Określone białko ma ściśle zdefiniowany
skład i
sekwencję
(kolejność)
aminokwasów; mówimy o pierwszorzędowej
strukturze białka.
Mówiąc o strukturze pierwszorzędowej,
podajemy kolejność aminokwasów w białku,
np.:
Gly Gly Ala His Ala Asp Asp Gly Ala Gly
Arg

Struktura II-rzędowa:
Łańcuch polipeptydowy ma
ściśle określoną
konformację
,
którą opisują kąty dwuścienne
łańcucha głównego, liczone od
N-końca (wolna grupa aminowa)
do C-końca (wolna grupa
karboksylowa). Postać
natywna
(naturalna) białka ma tylko jedną
możliwą konformację w stanie
aktywnym.
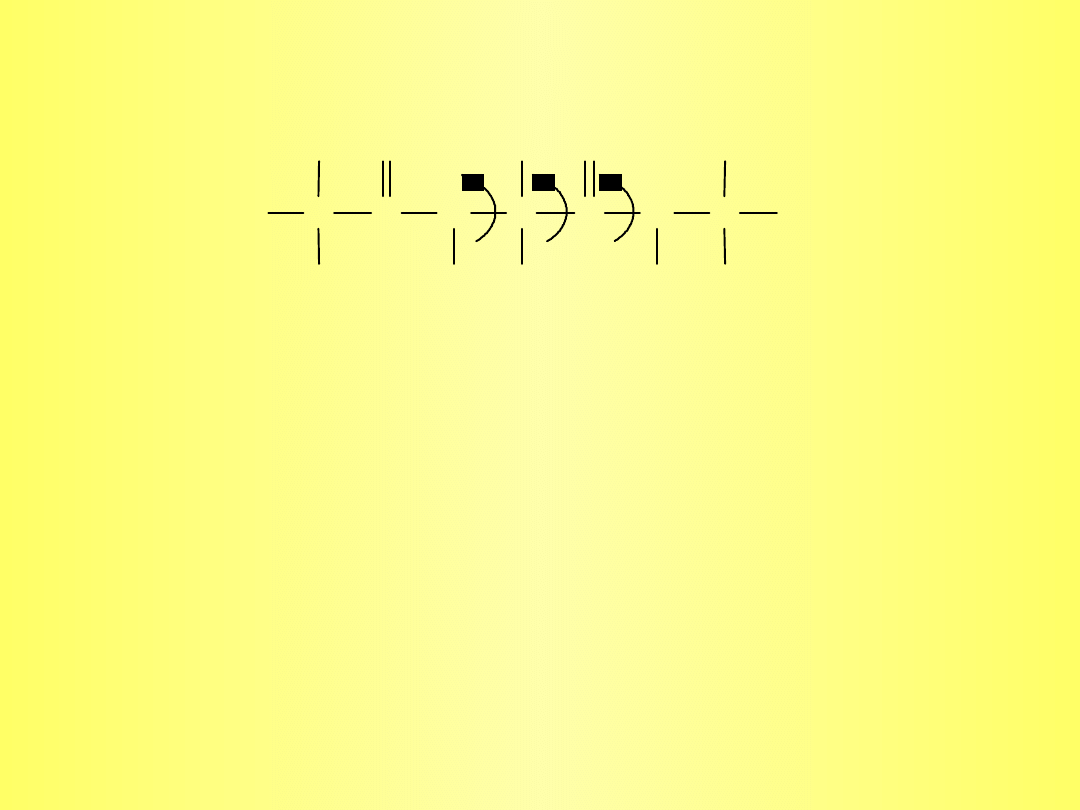
+
H
3
N C
H
R
C N
O
C C N
H
R
O
C COO
-
H
R
H
H
Kąty dwuścienne opisujące konformację łańcucha głównego:
N-C -
C-C’ -
C’-N -

Struktury powtarzające się
periodycznie (regularne,
uporządkowane)
Spirala -58 stopni; = -47 stopni; = 180 stopni
Płachta : = 180 stopni; = 180 stopni; = 180 stopni
W rejonach, w których kilka kolejnych aminokwasów
ma takie same kąty łańcucha głównego występują struktury
uporządkowane. Spirala alfa (alfa-helisa) ma kształt sprężyny:
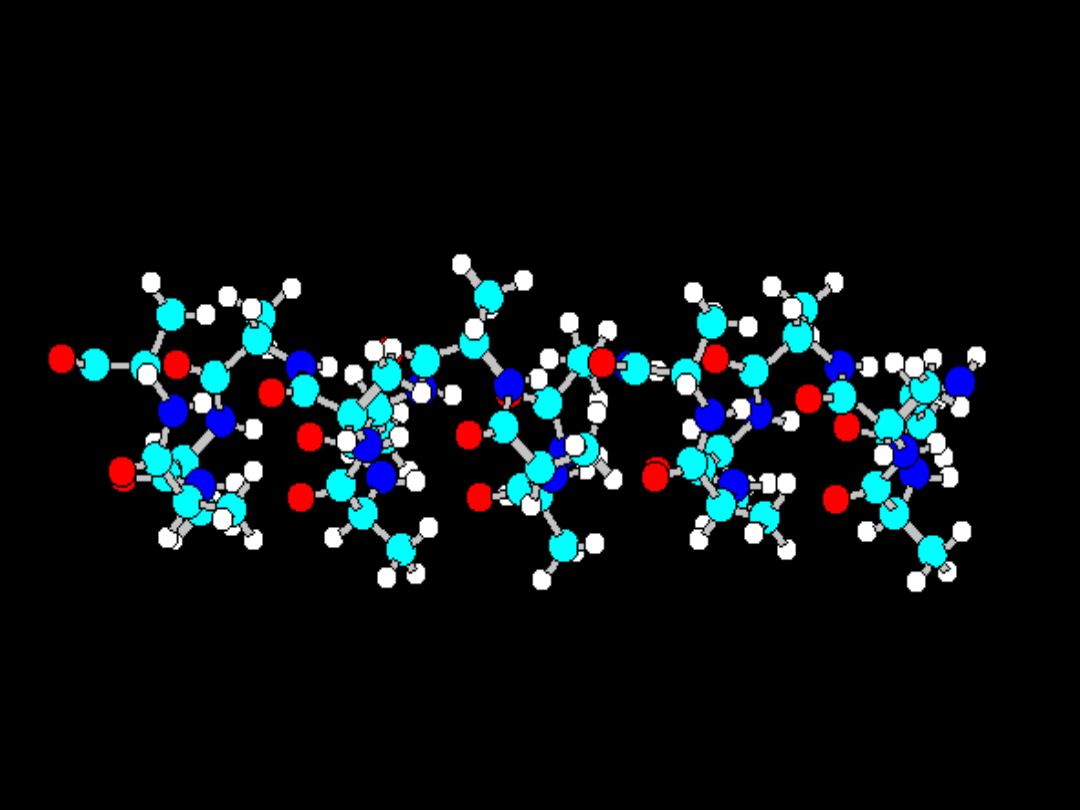

O ile atomy łańcucha głównego w
alfa-helisie tworzą spiralę,
to w beta-płachcie atomy łańcucha
głównego leżą w jednej
płaszczyźnie.
Obie konformacje łańcucha często
występują w strukturze białka.
Następne przezrocze pokazuje
konformację beta-płachty w dwóch
rzutach
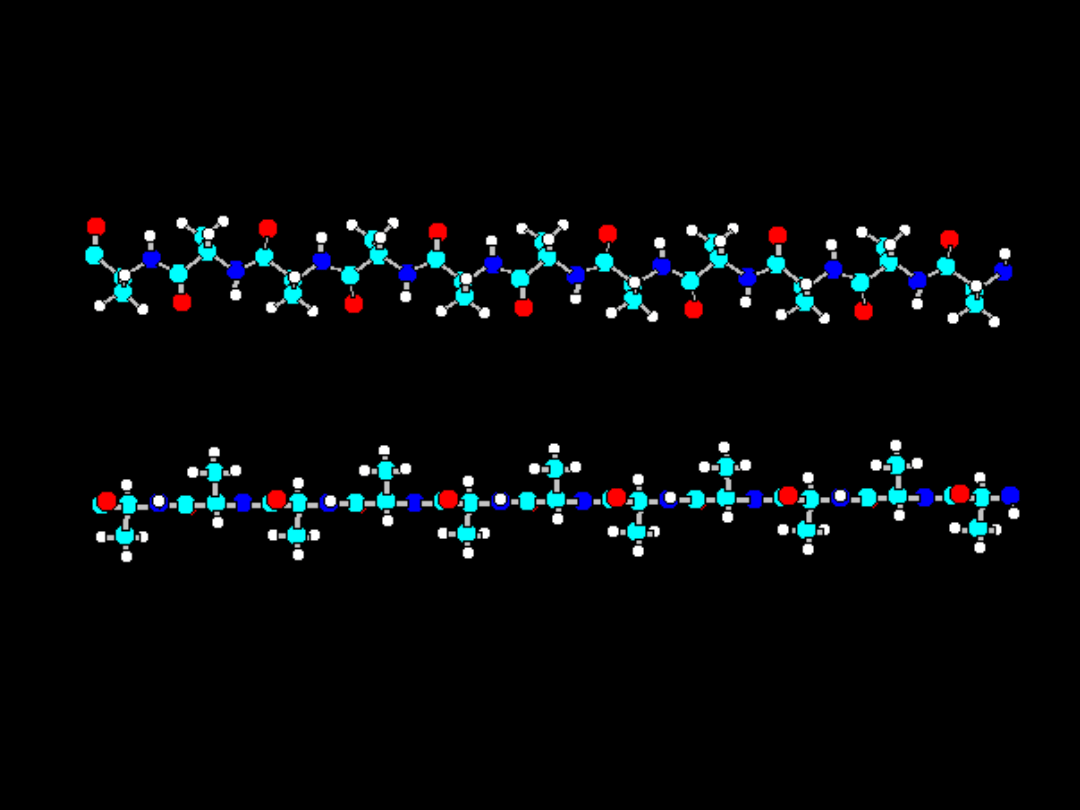

Struktura III-rzędowa:
Na konformację łańcucha
głównego mogą wpływać
dodatkowe oddziaływania i
wiązania, np.
wiązanie
dwusiarczkowe
pomiędzy
grupami bocznymi Cys (tworzą
mostek kowalencyjny -S-S-
pomiędzy odległymi resztami
Cys) i
wiązania wodorowe
pomiędzy odległymi częściami
łańcucha polipeptydowego.
N
O
S
N
H
O
H
H
N
O
S
H
O
H
N
H
N
O
S
N
H
O
H
N
O
S
O
H
N
H
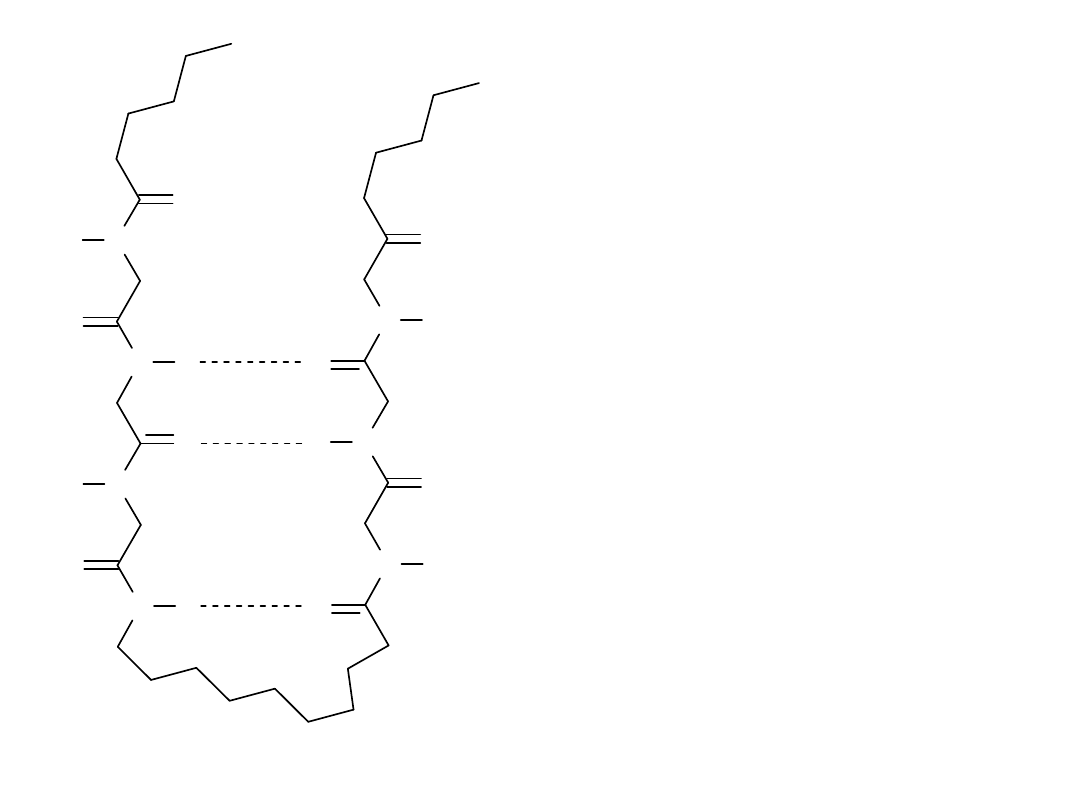
N
N
N
N
O
O
O
O
H
H
H
H
N
N
N
O
O
H
O
O
H
H
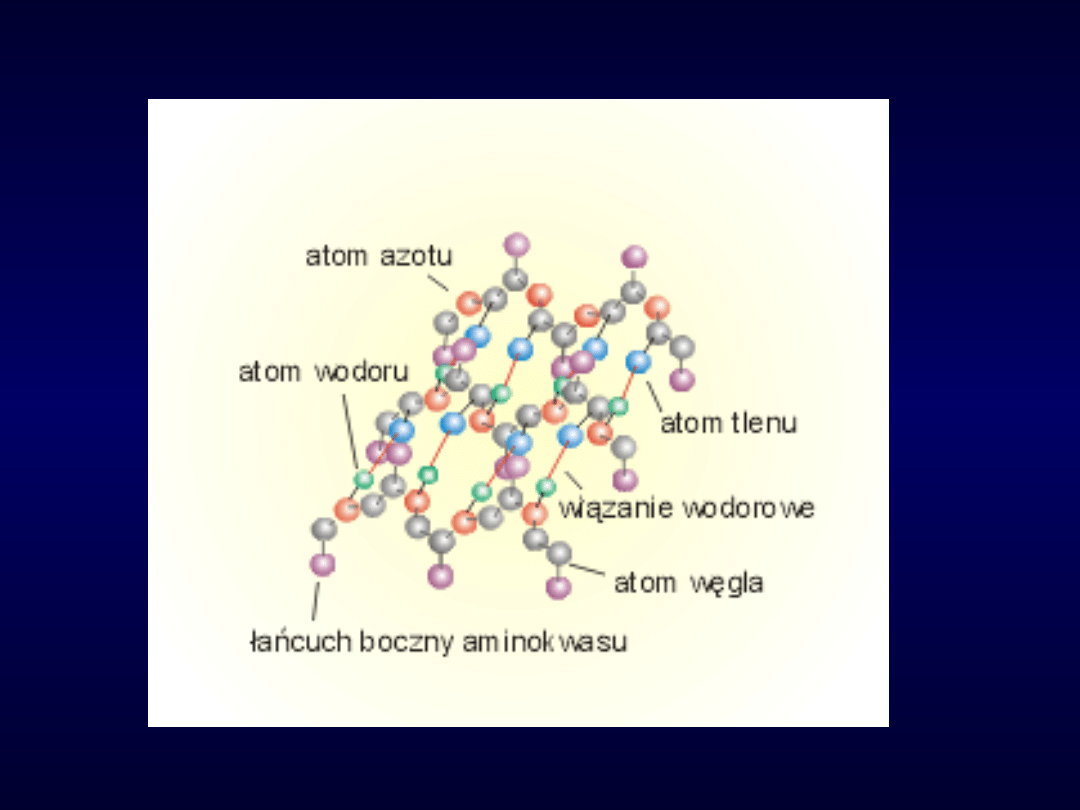
Fragment łańcucha
Fragment łańcucha
polipeptydowego z wiązaniami
polipeptydowego z wiązaniami
wodorowymi pomiędzy
wodorowymi pomiędzy
atomami wodoru (grupy N-H) i
atomami wodoru (grupy N-H) i
atomami tlenu (grupy C=O)
atomami tlenu (grupy C=O)
należącymi do odległych
należącymi do odległych
aminokwasów w sekwencji (w
aminokwasów w sekwencji (w
łańcuchu), Wiązania wodorowe
łańcuchu), Wiązania wodorowe
są zaznaczone liniami
są zaznaczone liniami
przerywanymi.
przerywanymi.
Wiązania wodorowe występują
Wiązania wodorowe występują
zarówno w alfa-helisie, jak i
zarówno w alfa-helisie, jak i
beta-pętli. To one są
beta-pętli. To one są
odpowiedzialne za trwałość
odpowiedzialne za trwałość
konformacyjną tych
konformacyjną tych
uporządkowanych struktur.
uporządkowanych struktur.
Na tym rysunku pokazany jest
Na tym rysunku pokazany jest
fragment łańcucha
fragment łańcucha
polipeptydowego zawierający
polipeptydowego zawierający
beta-pętlę.
beta-pętlę.
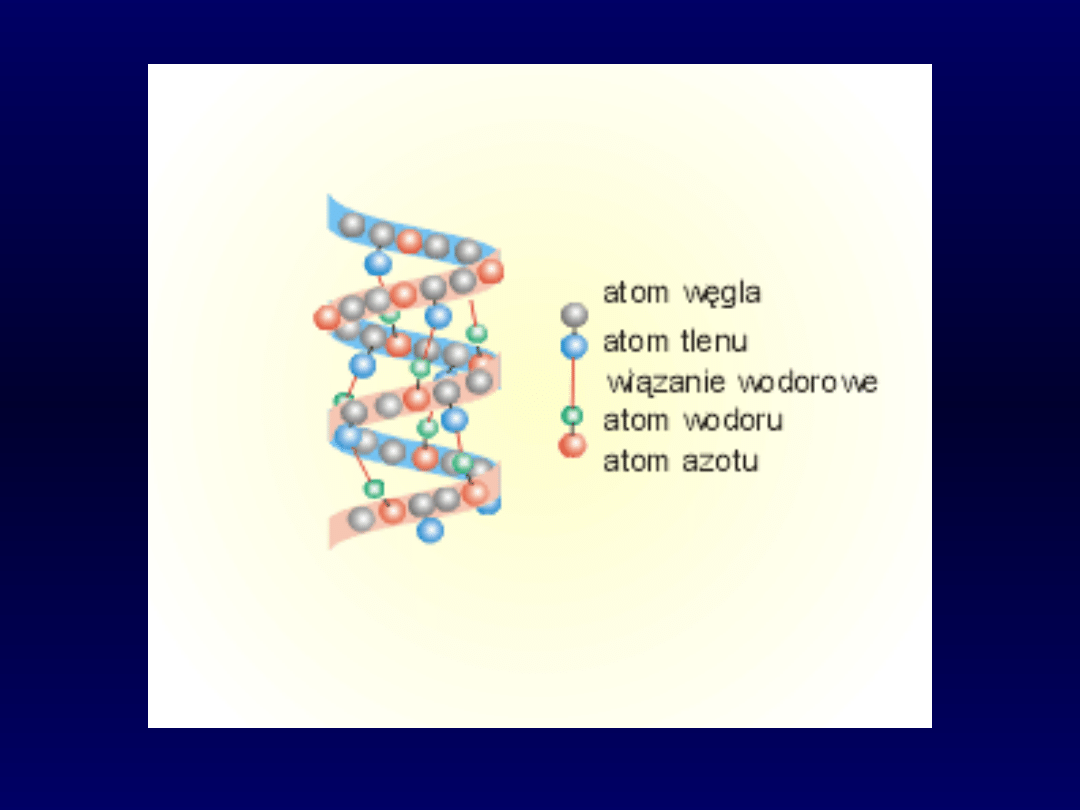

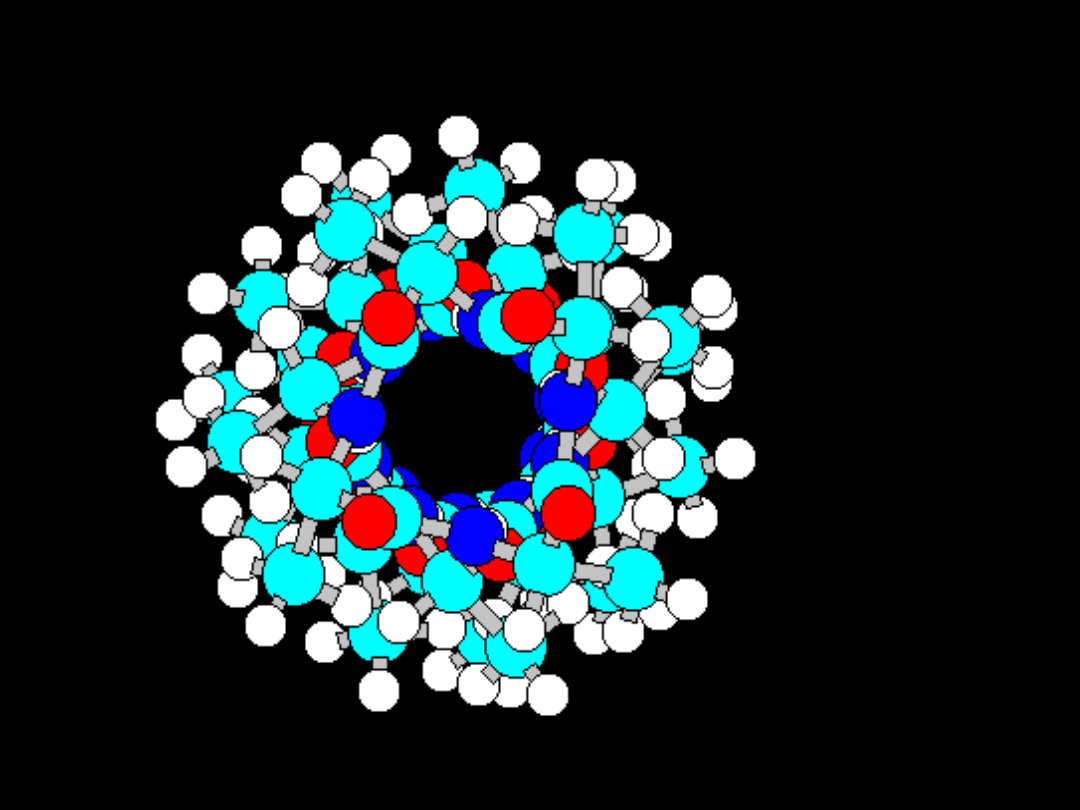
Struktura IV-
rzędowa:
Większość białek występuje w
stanie
natywnym
w
postaci
asocjatów wyższego rzędu, tj.
związanych
ze
sobą
niekowalencyjnie
kilku
podjednostek.
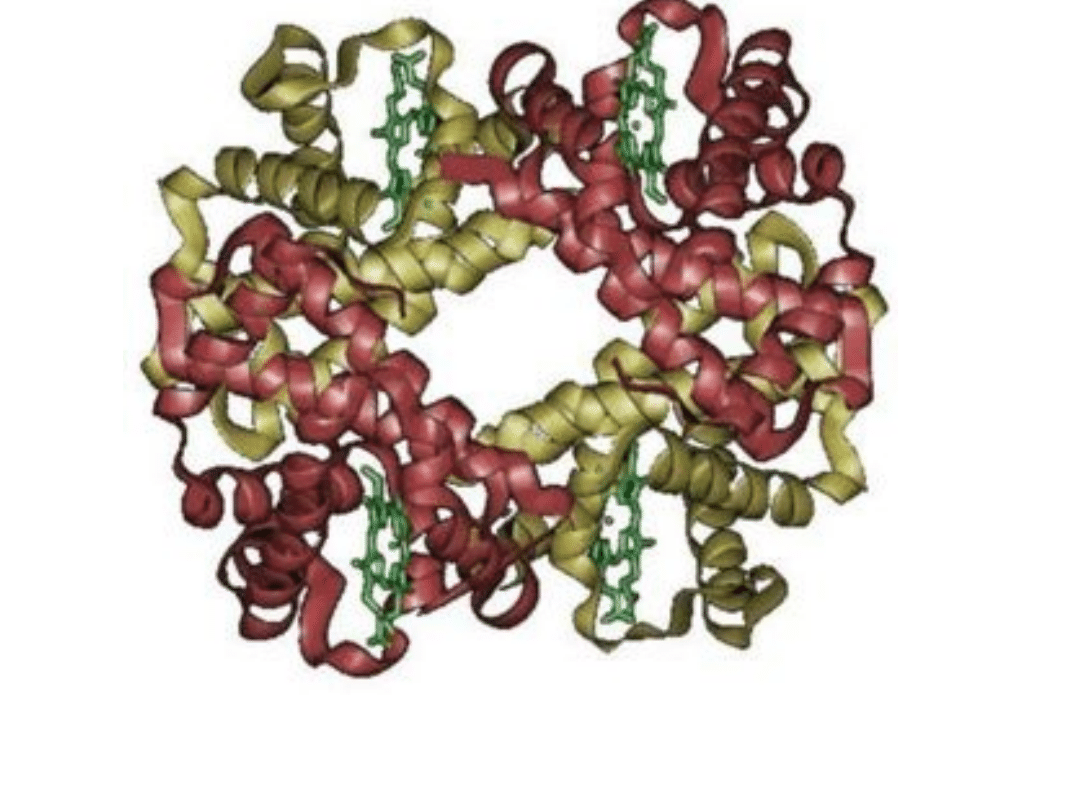
Struktura przestrzenna hemoglobiny. Dwie podjednostki alfa i
dwie podjednostki beta są zaznaczone różnymi kolorami.
Zielony jest hem.

Sposoby organizacji struktury białek
Obecność grup zawierających atomy wodoru
związane z atomem azotu i tlenu i jednocześnie
grup karbonylowych daje możliwość tworzenia
wiązań wodorowych
pomiędzy sobą.
Ponadto grupy te tworzą wiązania wodorowe z
cząsteczkami wody otaczającymi białko. W
konsekwencji te części reszt aminokwasowych,
które mają charakter
hydrofilowy
eksponowane
są na zewnątrz cząsteczki, natomiast aminokwasy
z niepolarnymi grupami bocznymi, mające
charakter hydrofobowy, unikają kontaktu z wodą i
zwykle tworzą trudno dostępne
kieszenie
hydrofobowe
.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
Wyszukiwarka
Podobne podstrony:
11 Resusc 2id 12604 ppt
1 GENEZA KOMERCYJNEGO RYNKU OCHRONY W POLSCE 2id 9262 ppt
20 2id 21226 ppt
08 BIOCHEMIA mechanizmy adaptac mikroor ANG 2id 7389 ppt
(1)Zarzadzanie instytucjami kredytowymi 2id 781 ppt
16 2id 16615 ppt
1Wstep i historia 2id 19223 ppt
200 Faszyzm 2id 21545 ppt
11 Przełom XVIII XIX w 2id 12570 ppt
2 Objawy kliniczne w szpiczaku plazmocytowym – patomechanizm objawów 2id 19582 ppt
16 WITAMINY 2id 16845 ppt
więcej podobnych podstron