
Moc kwasów i zasad
Właściwości kwasowo-zasadowe związków zależą od:
wartości ładunku, którym obdarzona jest cząsteczka
(odłączenie protonu od cząsteczki kwasu jest trudniejsze im ładunek kwasu jest bardziej ujemny)
H
3
PO
4
↔ H
+
+ H
2
PO
4
-
K
a1
= 7·10
-3
H
2
PO
4
-
↔ H
+
+ HPO
4
2-
K
a2
= 6·10
-8
HPO
4
2-
↔ H
+
+ PO
4
3-
K
a3
= 5·10
-13
H
2
O
H
3
O
+
- H
2
O – OH
-
- O
2-
wzrost mocy kwasów
wzrost mocy zasad
wzrost
mocy
kwasów

wzrost właściwości kwasowych
LiH – BeH
2
– CH
4
– NH
3
– H
2
O
- HF
wzrost właściwości zasadowych
- II okres
wartości elektroujemności atomu
wiążącego proton

-
V grupa
HNO
3
– H
3
PO
4
– H
3
AsO
4
– H
3
SbO
4
– HBiO
3
wzrost mocy kwasów
-zastąpienie wodoru w NH
3
i H
2
O
podstawnikiem
elektroujemnym
i
mniej elektroujemnym
KOH →
H
2
O
→ HOCl → HONO
2
↑ ↑ ↑
↑
KNH
2
→
NH
3
→ NH
2
Cl →
NH
2
NO
2
wzrost mocy kwasów
wzrost mocy
kwasów

-wpływ liczby elektroujemnych grup
(OH
-
, O
2-
) połączonych z atomem pierwiastka
wzrost mocy kwasów
ClOH – OClOH – O
2
ClOH – O
3
ClOH
-III okres
w związkach typu XOH wzrost elektroujemności i wartościowości
pierwiastka X wpływa na kwasowość tych związków
[
Na
]OH–[HO
Mg
]OH–[(OH)
2
Al
]OH–[(HO)O
Si
]OH–[(HO)
2
O
P
]OH–[(HO)O
2
S
]OH – [O
3
Cl
]OH
wzrost kwasowości

-
wpływ rozmiaru atomu (promienie jonowe), wpływ
ładunku
– pierwiastki metaliczne grup przejściowych (
Mn, Cr
)
Mn(OH)
2
– Mn(OH)
3
– Mn(OH)
4
– H
3
MnO
4
– H
2
MnO
4
–
HMnO
4
Zasadowy słabo zasadowy
amfoteryczny słabo kwaśny kwaśny
silnie kwaśny
Mn
2+
Mn
3+
Mn
4+
H
2
MnO
4
-
HMnO
4
-
MnO
4
-
- wpływ elektroujemnych atomów podstawionych
w oddaleniu od wiązania tlen-wodór
CH
3
COOH
K
A
= 1,8 · 10
-5
CH
2
ClCOOH
K
A
= 2 · 10
-3
CHCl
2
COOH
K
A
= 8 · 10
-2
CCl
3
COOH
K
A
= 3 · 10
-1
Im atom ma mniejszy promień a większy ładunek dodatni – wzrasta kwasowość

wpływ wielkości jonów i atomów, gdy zmiany
elektroujemności są niewielkie
wzrost kwasowości
HF HCl HBr HI
H
2
O H
2
S H
2
Se H
2
Te
NH
3
PH
3
AsH
3
SbH
3
- najmocniejsze kwasy beztlenowe
wzrost elektroujemności
wzrost promieni jonowych

CsOH,
RbOH, KOH, NaOH
- najmocniejsze zasady
LiOH, wodorotlenki II grupy
– słabsze zasady
oprócz Mg(OH)
2
i Be(OH)
2
średnia słaba
Kwasy tlenowe
znaczenie nadmiaru atomów tlenu nad atomami wodoru
REGUŁA PAULINGA
H
n
XO
m
m-n=0
H
6
TeO
6
H
4
GeO
4
H
3
AsO
3
HClO
HBrO
HIO
słabe
kwasy
m-n=1
H
3
PO
4
H
2
HPO
3
HH
2
PO
2
H
3
AsO
4
H
2
SO
3
H
2
SeO
3
HClO
2
średnie
kwasy
m-n=2
H
2
SO
4
H
2
SeO
4
HClO
3
HNO
3
mocne
kwasy
m-n=3
HClO
4
HMnO
4
bardzo mocne
kwasy

Elektrolity mocne
nie stosują się do prawa działania mas
przewodzą prąd elektryczny (za przenoszenie
ładunków odpowiadają odpowiednie jony
znajdujące się w roztworze)
Przewodnictwo elektrolitów
mocnych
zależy od
stężenia
(wraz ze wzrostem stężenia maleje
przewodnictwo) –
nie
jest to zależność liniowa
w przypadku
stężonych
roztworów – powyżej 1 mol/l
dalsze zatężanie nie powoduje zmian przewodnictwa
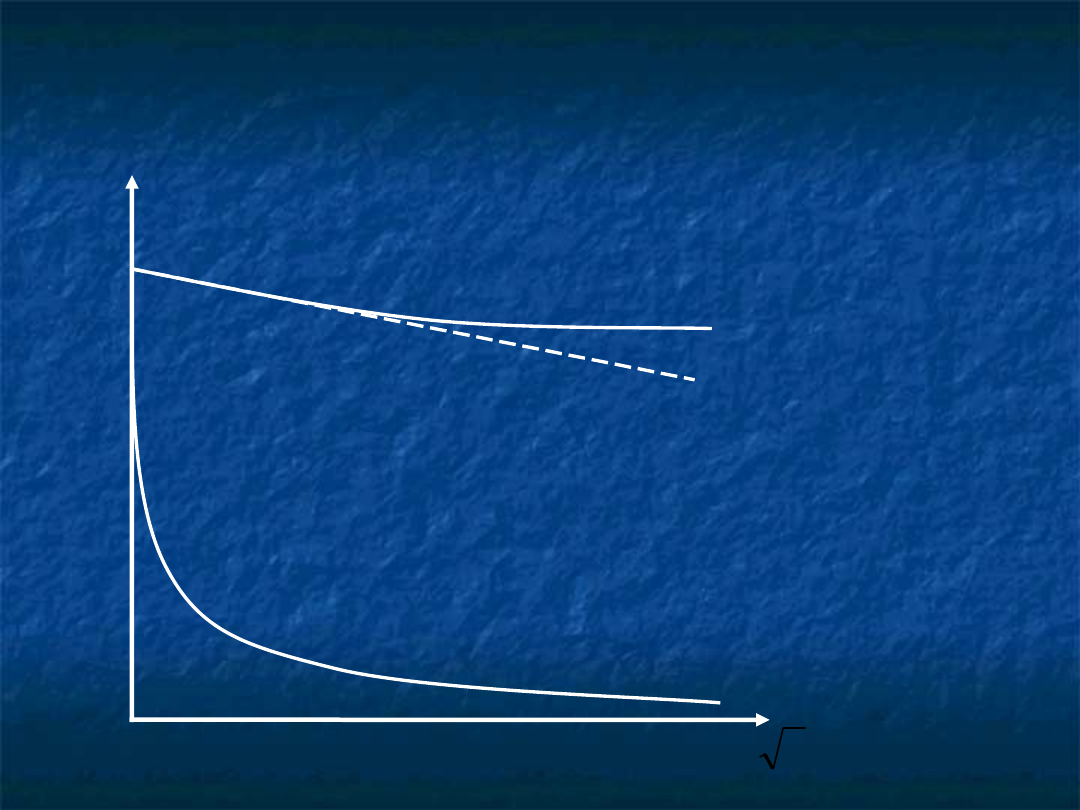
Λ
c
mocny elektrolit
słaby elektrolit

zmierzone wartości
ciśnienia osmotycznego,
względnego obniżenia prężności par nad
roztworem,
obniżenia temperatury krzepnięcia i
podwyższenia temperatury wrzenia
są większe
od wartości obliczonych teoretycznie z
prawa van’t Hoffa i Raoulta dotyczących roztworów
zależą
od liczby niezależnych cząsteczek w danej
objętości – wielkości koligatywne
na przykład:
dla soli typu
AB
współczynnik izotoniczny i = 2
dla soli typu
AB
2
współczynnik izotoniczny i = 3
ogólnie dla
A
p
B
q
wartości i p + q

stężone
roztwory mocnych elektrolitów
zachowują się jakby ich stężenie było
mniejsze od rzeczywistego
wydaje się, że mocne elektrolity w stężonych
roztworach nie ulegają pełnej dysocjacji
ponieważ
ograniczona jest wzajemna swoboda ruchów jonów,
tworzą się pary i tryplety jonowe
Zachowanie się elektrolitów mocnych tłumaczy
teoria Debye’a i Hückla,
która uwzględnia
wzajemne oddziaływania na siebie wszystkich jonów
w roztworze.

Rzeczywista zdolność cząsteczek do reagowania
określona jest jako
aktywność (a)
gdzie f – współczynnik aktywności, przyjmuje wartości mniejsze od
jedności
W przypadku bardzo rozcieńczonych roztworów f w przybliżeniu jest
równe 1 i efektywne stężenie jonów jest równe stężeniu
rzeczywistemu.
Aktywność
elektrolitów
zależy
od:
- wzajemnego oddziaływania jonów
-
obecności jonów obcych w roztworze (aktywność badanego
jonu maleje pod wpływem wzrostu stężenia innych jonów
obecnych w roztworze)
c
f
a
c
a
f
c
a

W kilkuskładnikowym elektrolicie
współczynniki
aktywności
wszystkich jonów zależą od tzw.
siły
(mocy) jonowej (I )
roztworu oraz
ładunku
jonu (z )
:
2
2
1
z
c
I
gdzie:
c – stężenie mol/l danego jonu
z – jego ładunek
Im
wyższa jest siła jonowa
roztworu,
tym
mniejsze są współczynniki aktywności
wszystkich
jonów obecnych w roztworze.
I
z
f
2
509
,
0
lg
Jeżeli siła jonowa
nie przekracza wartości 0,01 mol/l,
można obliczyć
współczynnik aktywności ze wzoru:

Obliczyć
siłę jonową
roztworu: 0,02 mola HCl i 0,05 mola KNO
3
w 1dm
3
2
3
2
2
2
1
1
1
1
2
1
NO
K
Cl
H
I
3
/
07
,
0
05
,
0
05
,
0
02
,
0
02
,
0
2
1
dm
mol
I
2
2
3
2
2
1
3
2
2
1
Cl
Al
Ba
I
I roztworu: 0,02 mola BaCl
2
i 0,03 mola AlCl
3
3
/
24
,
0
1
13
,
0
9
03
,
0
4
02
,
0
2
1
dm
mol
I
Siła jonowa roztworów zawierających jedynie elektrolity typu AB równa jest
sumie stężeń tych elektrolitów. Jony kilkuwartościowe znacznie bardziej
zwiększają siłę jonową.
Przykład:
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
Wyszukiwarka
Podobne podstrony:
42 Moc elektryczna w obwodach prądu przemiennego ppt
Moc elektrolitów [Naprawione]
dopasowanie odbiornika na maks moc, Elektrotechnika niestacjonarne, Sem2, Teoria Obwodów, Brudnopisy
Przetwornica napięcia do samochodowego wzmacniacza dużej moc, Elektronika, Różne
Moc bierna 13 14 1, Prywatne, EN-DI semestr 4, Elektroenergetyka, wykład + ćwiczenia
moc w obwodach protokół, Politechnika Lubelska, Studia, Elektrotechnika, ELEKTROTECHNIKA LABORATORIU
moc, studia, elektrotechnika, materialy
STR1, Inzynieria Materiałowa, I semestr, Elektrotechnika, elektrotechnika, 0.3 - moc i energia pradu
STR2, Inzynieria Materiałowa, I semestr, Elektrotechnika, elektrotechnika, 0.3 - moc i energia pradu
Moc przy przebiegach odkształconych v4, Elektrotechnika
Moc w obwodach prądu sinusoidalnego v2, Elektrotechnika
Pomiar mocy, Inzynieria Materiałowa, I semestr, Elektrotechnika, elektrotechnika, 0.3 - moc i energi
03elektr, Inzynieria Materiałowa, I semestr, Elektrotechnika, elektrotechnika, 0.3 - moc i energia p
sciagi z mocy - wyklad 7 i 8 -1, Księgozbiór, Studia, Elektronika i Elektrotechnika, Moc
moc maxymalna beta, Politechnika Poznańska, Elektrotechnika, Teoria obwodów, Laboratoria, 03. Źródło
Moc przy przebiegach odkształconych, Elektrotechnika
Moc pradu trojfazowego, UTP-ATR, Elektrotechnika i elektronika dr. Piotr Kolber, sprawozdania
więcej podobnych podstron