
ANDROGEN
EZA
ang. androgenesis

ANDRO + GENEZA
• Andro- <gr. andros= mężczyzna>,
pierwszy człon wyrazów złożonych,
wskazuje na związek z
mężczyzną/męskością, tego co
oznacza człon drugi.
• Geneza <gr. genesis>, zespół
warunków i przyczyn, które się
złożyły na powstanie i rozwój czegoś

= ANDROGENEZA
czyli:
• proces rozwoju nowej rośliny z
gametofitu męskiego(ziarna pyłku)
• w warunkach kultury in vitro
• uzyskuje się w ten sposób rośliny
haploidalne(posiadające gametyczną
liczbę chromosomów- n)
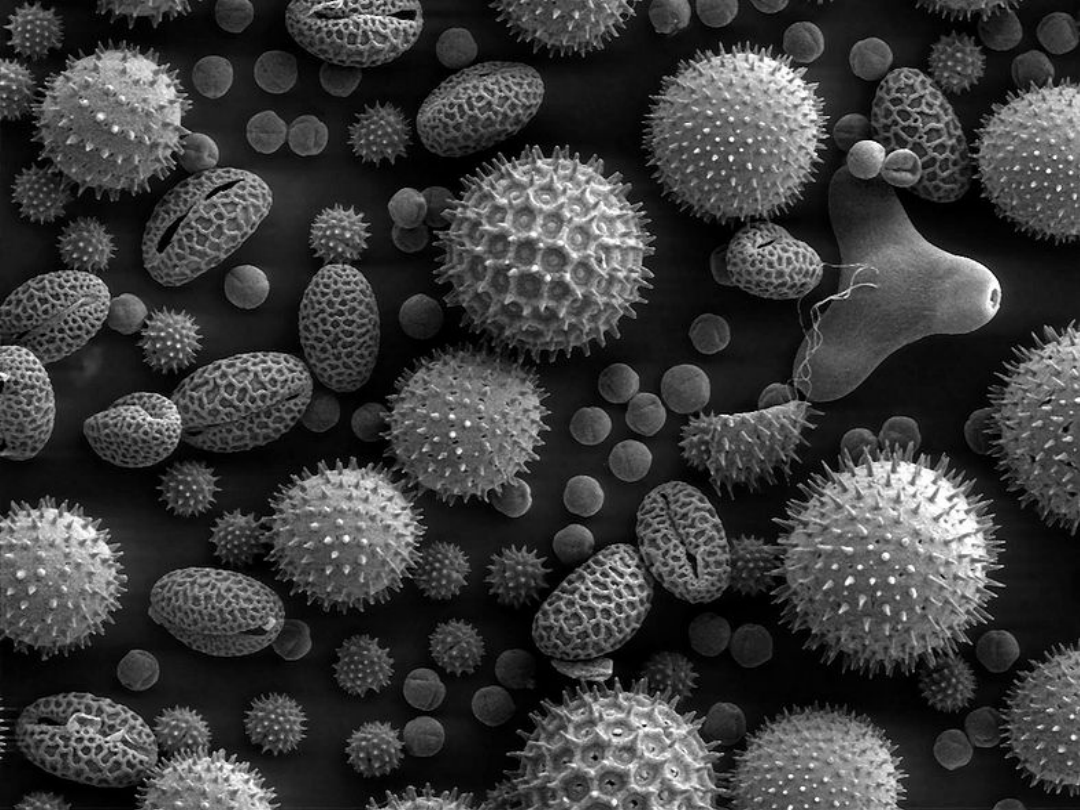
Ziarna pyłku różnych roślin w powiększeniu mikroskopem
elektronowym

Zarys historyczny
Proces indukowanej androgenezy został
opisany po raz pierwszy w kulturze in vitro
pylników Datura inoxia w 1966r.
W rok później u Nicotiana tabacum
W 1970 u Brassica
Obecnie androgeneza jest najbardziej
rozpowszechnioną metodą dzięki
której otrzymano haploidy u ok. 240
gatunków( rodziny Solanaceae,
Gramineae i Cruciferae)

Nicotiana tabacum=
Tytoń szlachetny
Datura inoxia=
Bieluń indyjski

W Polsce
pierwszy
mi
roślinam
i w
kulturac
h
pylników
była
Atropa
belladon
na

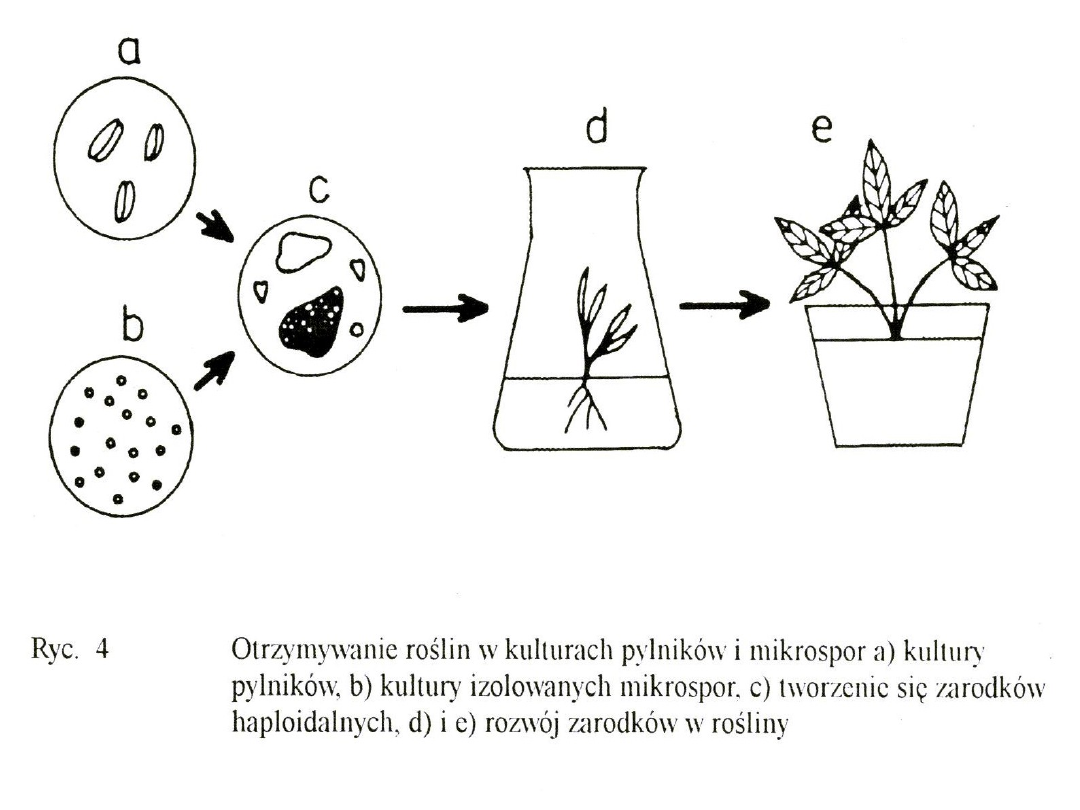
Proces androgenezy można
uzyskać poprzez
:
kultury in vitro
całych pylników
kultury izolowanych
mikrospor
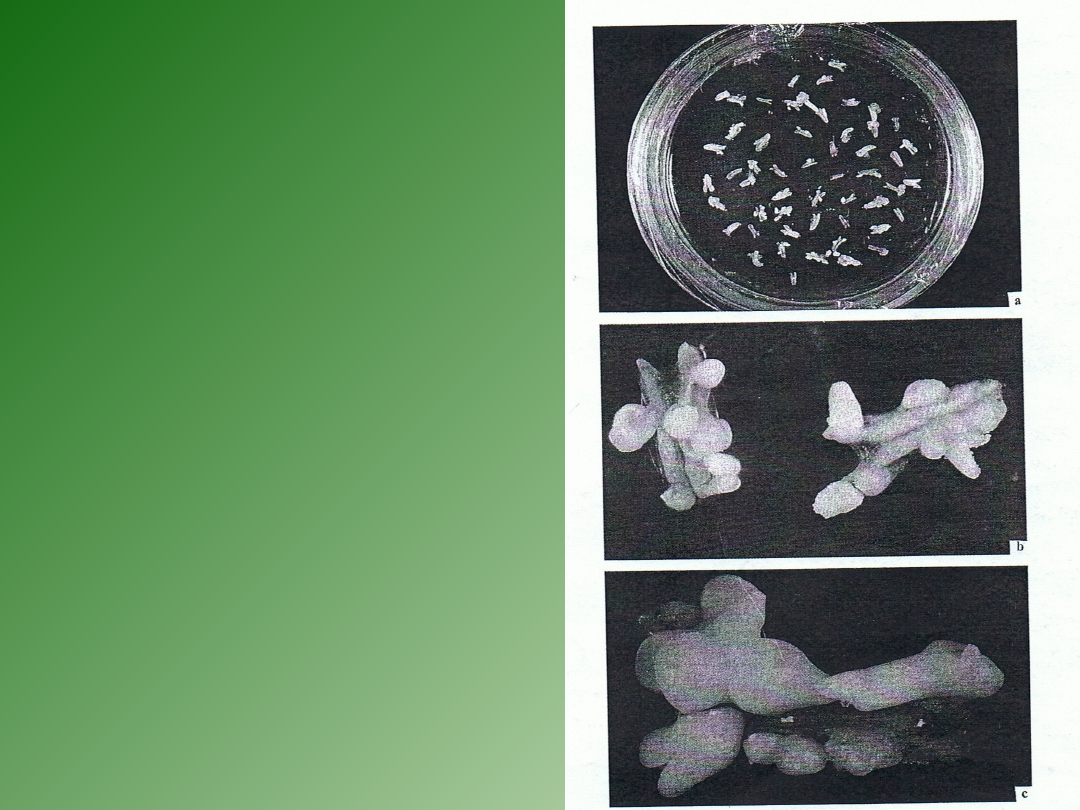
Kultury
pylników

Kultury izolowanych
mikrospor
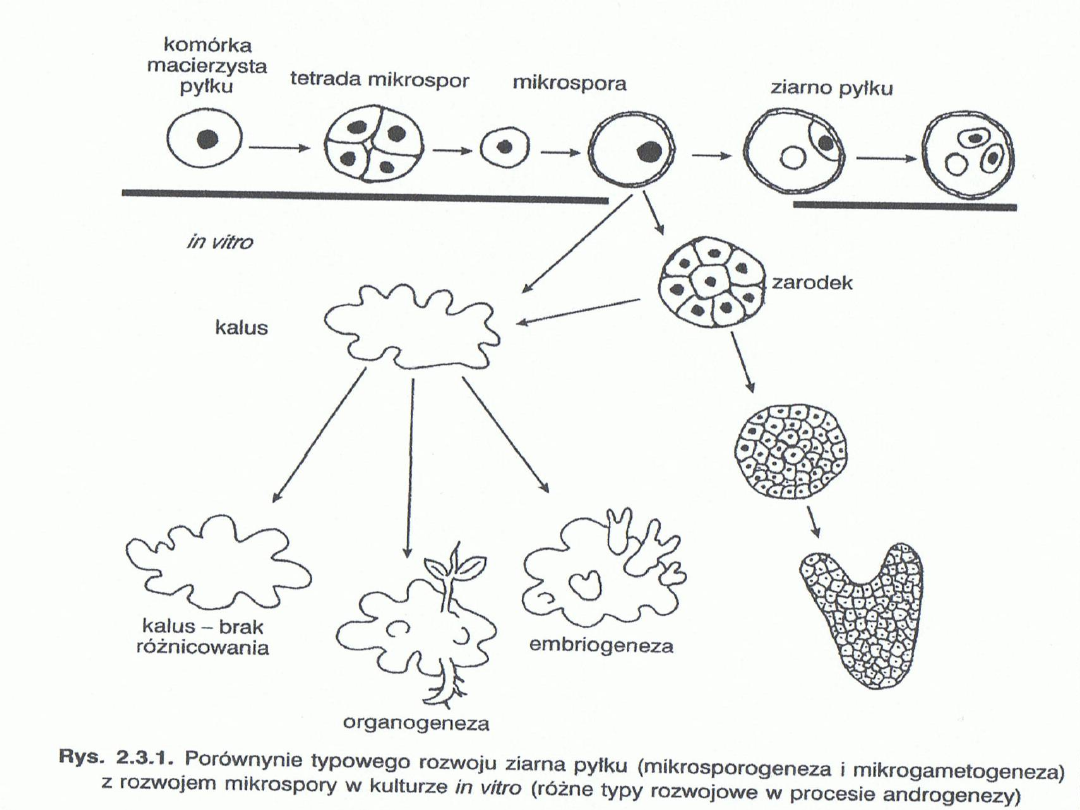
Bezpośrednia
Pośrednia

Czynniki, decydujące o
pozytywnych efektach
androgenezy:
• Genotyp dawcy pylników(rośliny
matecznej)
• Stadium rozwoju pyłku(mikrospory)
• Warunki kultury in vitro(fizyczne i
chemiczne)
• Warunki wzrostu roślin donorowych

Genotyp dawcy pylników(rośliny
matecznej)
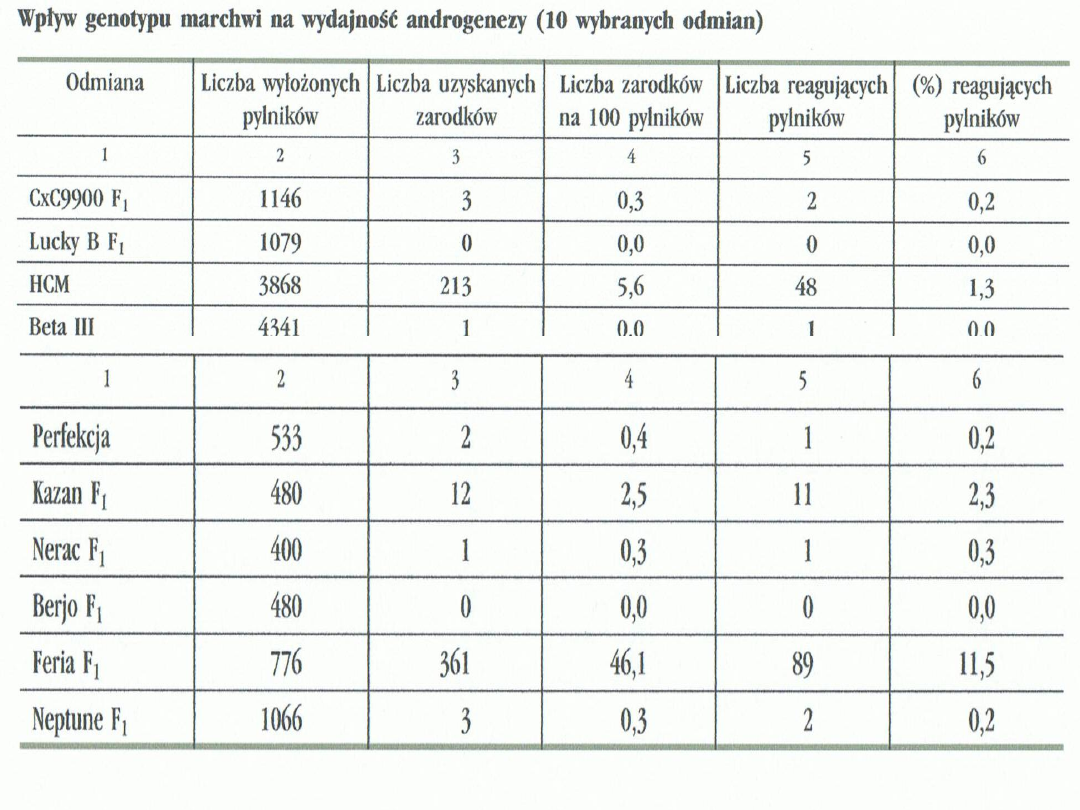
Genotyp rośliny dawcy jest jednym z
najważniejszych czynników wpływających na
efektywność androgenezy.
Zdolność do androgenezy uwarunkowana jest
genetycznie.
Stąd też plon uzyskanych zarodków jest bardzo
różny dla różnych gatunków a nawet odmian.
W zależności od tego jaki genotyp posiada
roślina mateczna, efektywność procesu
androgenezy może być większa, lub mniejsza
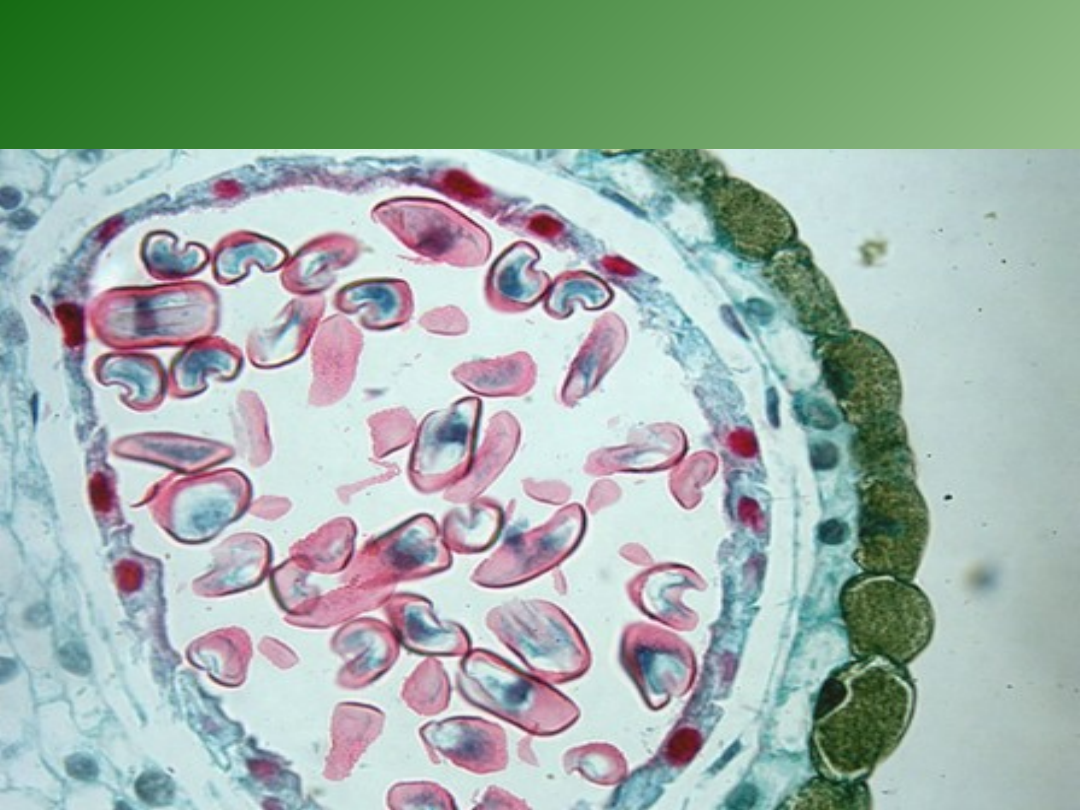
Stadium rozwoju
pyłku(mikrospory)
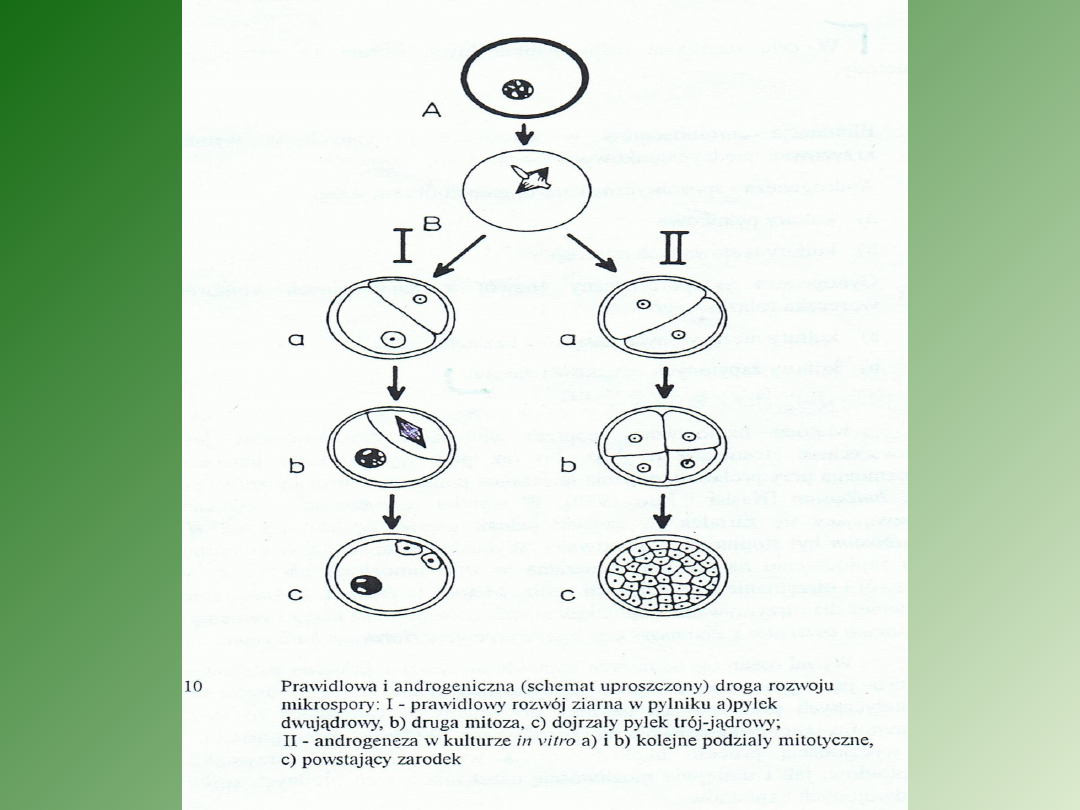
Stadium rozwojowe mikrospor w pylnikach
poddanych kulturze jest czynnikiem
decydującym o powodzeniu indukcji
zarodków.
Dla większości
gatunków jest to
stadium jedno-
lub wczesno-
dwujądrowe
Schemat

• Po kilku dniach hodowli mikrospor na
pożywce następuje zmiana kierunku
rozwoju z gametofitycznego na
sporofityczny, a pierwszym krokiem
tego procesu jest anormalny-
symetryczny podział jądra, w
przeciwieństwie do typowego
podziału asymetrycznego

Warunki kultury in
vitro(fizyczne i chemiczne)
• W celu stymulacji androgenezy stosuje się
różnego typu zabieg zwiększające
efektywność tego procesu. Wyniki
wykazują że szok termiczny, któremu
poddane są pylniki, znacznie zwiększa
plon androgenicznych zarodków.
• Dobór pożywki indukującej androgenezę
jest również ważnym czynnikiem
wpływającym na efektywność
androgenezy.

• Do najczęściej stosowanych
pożywek należą:
» MS (Murashiga i Skooga)
» NN (Nitscha i Nitscha)
» B5 wg Gamborga
• Modyfikacje tych pożywek
związane z indywidualnymi
wymaganiami genotypów
dotyczą przede wszystkim
zawartości regulatorów wzrostu
oraz stężenia cukru

Czynniki fizyczne kultur in
vitro
• Czynniki fizyczne uwzględnione w procesie
androgenezy to:
* temperatura(z reguły 24-25 °C, zapoczątkowanie
procesu wymaga szoku termicznego)
*światło(w początkowych etapach ciemność lub
światło rozproszone, gdy zapoczątkowany zostanie
rozwój zarodków lub kalusa eksponuje się na światło)
* pH( 5,5-5,8 zwykle odczyn kwaśny)
*pojemność naczyń( ilość powietrza nie może być
zbyt mała lub zbyt duża)

Czynniki chemiczne kultur in
vitro
• Czynniki chemiczne uwzględnione w procesie
androgenezy to:
* cukry( sacharoza- zwykle w stężeniu 2-4%,
czasami maltoza)
*substancje wzrostowe(auksyny i cytokininy- z
reguły są one niezbędne w początkowych fazach
kultury. Najczęściej stosuje się 2,4-D i kinetynę)
*etylen(może działać jako aktywator lub
inhibitor androgenezy)

Warunki wzrostu roślin
donorowych
• Warunki wzrostu rośłin- dawców
pylników to ważny czynnik wpływający
na proces androgenezy
Wyższy plon zarodków można otrzymać
z rośłin rosnącyhc w ściśle
kontrolowanych warunkach.
A także gdy pąki kwiatowe były
pobierane z kwiatostanów w
początkowym okresie kwitnienia.


Miernik efektywności kultury
pylników i mikrospor
Efektywność kultury pylników lub
izolowanych mikrospor mierzy się za
pomocą ustalonych wskaźników.
E=R/T(100%)
Gdzie:
E- efektywność kultury
R- liczba reagujących eksplantatów
T- ogólna liczba eksplantatów
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
Wyszukiwarka
Podobne podstrony:
moja kariera www prezentacje org
82 Dzis moj zenit moc moja dzisiaj sie przesili przeslanie monologu Konrada
agresja moja
ANDROGENY, aktualne
HOTELARSTWO MOJA KOPIA
zaburzenia odzywiania pcos zespoly androgenizacji
Moja macocha
Moja Funkcja, excel
Moja autocharakterystyka - do przerobienia
Ferdydurke moja prezentacja, moja prezentacja
Przynoszę Tobie moja dziewczyno, Teksty piosenek, TEKSTY
moja część, medycyna, giełdy, interna1, Interna pytania
nalogi-moja-swiadomosc-zagrozen 53511, pedagogika, scenariusze lekcji, psychologia, scenariusze godz
więcej podobnych podstron