
Łączenie się atomów
Typ wiązań
opis
Właściwości
wiązań
Przykład wiązań
jonowe
wiązanie
chemiczne
utworzone w
wyniku
przyciągania się
jonów powstałych
przez całkowite
przejście
elektronów z
jednych atomów
do innych.
• z reguły to
twarde
kryształy,
dobrze
rozpuszczalne
w wodzie
• wodne
roztwory
związków
jonowych
przewodzą
prąd
elektryczny
NaCl
atomowe
(kowalencyjne)
wiązanie
chemiczne
utworzone w
wyniku
uwspółbieżnienia
elektronów
walencyjnych
łączących się
atomów
• gaz, ciecz,
ciało stale
• nierozpuszczal
ne lub słabo
rozpuszczalne
w wodzie
• nie przewodzą
prądu (wyj.
grafit)
H
2
atomowe
spolaryzowane
(kowalencyjne
spolaryzowane)
wiązanie
chemiczne, w
którym wspólna
para elektronowa
przesunięta jest
w stronę jednego
z tworzących je
atomów
• zależy od
stopnia
spolaryzowania
cząsteczek
HCl
Wzory chemiczne i
modele cząsteczek
Opis
Przykłady
Wzór sumaryczny
określa rodzaj i liczbę
atomów pierwiastków
tworzących związek
chemiczny
H
3
PO
4
Wzór strukturalny
oprócz rodzaju i liczby
atomów pierwiastków
pokazuje wiązanie
miedzy poczekalnymi
atomami; nie stosuje się
do związków o budowie
jonowej
H H
O
Wzór półstrukturalny
to uproszczony wzór
strukturalny w chemii
organicznej
CH
3
-CH
2
-CH
3
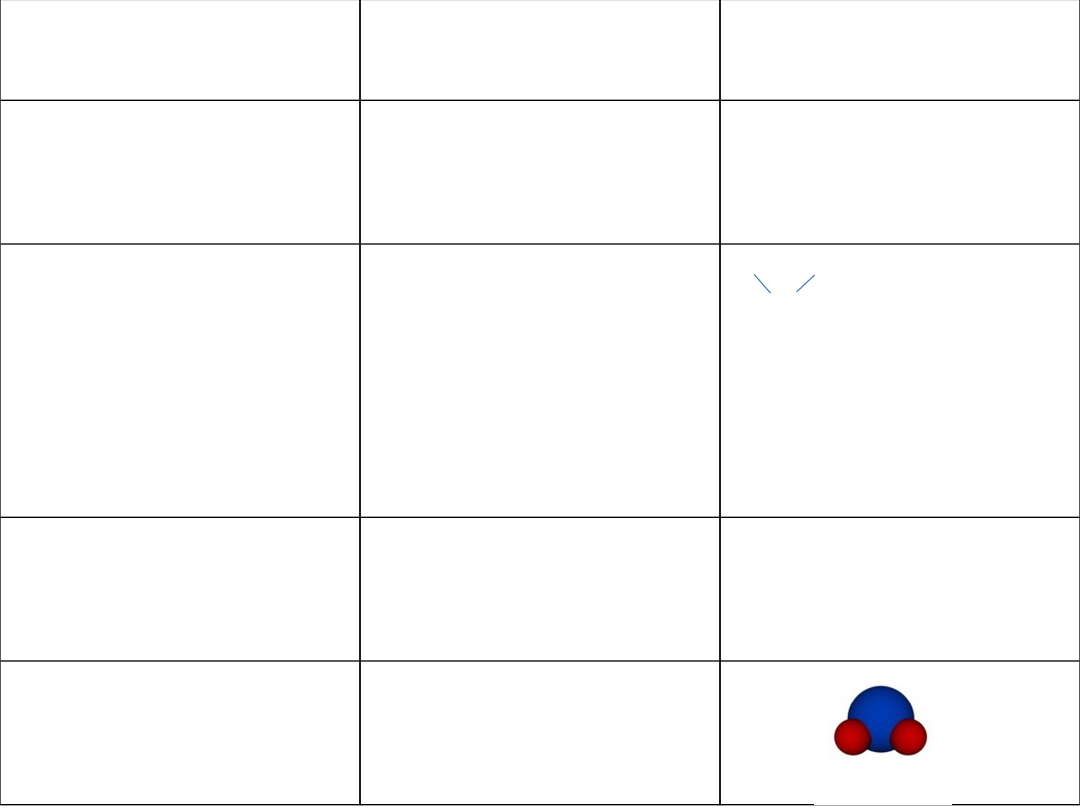
Model cząsteczki
Jest wizualizacją
budowy związku
chemicznego
Typy reakcji
Schematyczny opis
Przykłady
reakcja
łączenia(syntezy)
A+B AB
N
2
+ 3H
2
2NH
3
reakcja rozpadu(analizy)
AB A+B
2HgO 2Hg + O
2
reakcja wymiany
AB+C AC+B
2Mg + Co
2
2MgO
+ C
AB+CD AC+BD
HCl + NaOH
NaCl + H
2
O
Document Outline
Wyszukiwarka
Podobne podstrony:
Odpowiedzi do Sparwdzianu Łaczenie się atomów gr b i a
SPRAWDZIAN ŁĄCZENIE SIĘ ATOMÓW
Odpowiedzi do Sparwdzianu Łaczenie się atomów gr b i a
Łączenie się atomów
Wykład 13 Łączenie się
2005 01 Bezpieczne łączenie się z Internetem [Bezpieczenstwo]
Łączenie się w grupy
D19240968 Rozporządzenie Prezydenta Rzeczypospolitej z dnia 10 grudnia 1924 r o fuzji (łączeniu się
Łączenie się z WiFi z poziomu konsoli
D19220265 Ustawa z dnia 7 kwietnia 1922 r o łączeniu się spółdzielni
Automatyczne łączenie się NEO po włączeniu komputera
w atomowej grze liczy się ten pierwszy, N W O - nowy porzadek swiata iluminaci
FIZYKA-sprawozdania, sciaga, Jądro atomowe, zwane też nuklidem, składa się z dwóch rodzajów cząstek
Zagrozenia zwiazane z przemieszczaniem sie ludzi
więcej podobnych podstron