
Modele badawcze GMO w przebiegu
kancerogenezy i chemoprewencji.

IDEA:
Złożoność nowotworów i pilna potrzeba poprawy
zdrowia pacjentów dostarczyły bodźców do
wykorzystywania modeli zwierzęcych. Naukowcy
wykorzystują zwierzęta z różnych powodów.
Przede wszystkim są one porównywalnymi
organizmami, które pozwalają naukowcom
odkryć podstawy tego, jak i dlaczego nowotwory
powstają, dlaczego pierwotne nowotwory dają
przerzuty, i jak różne rodzaje profilaktyki i
leczenia mogą być używane do zatrzymania
postępu nowotworu lub jego rozprzestrzeniania i
przedłużyć życie pacjenta.

CEL:
Pomimo tego, że badania porównawcze wykazały pewne fenotypowe różnice
pomiędzy nowotworami ludzkimi a zwierzęcymi, istnieje wiele podobieństw,
m. In. W mechanizmach funkcjonowania. Na tych podobieństwach naukowcy
opierają się, aby:
odkryć i przetestować nowe metody leczenia nowotworów,
znaleźć lepsze sposoby wykrywania nowotworów na najwcześniejszych
etapach, gdy nowotwory złośliwe są najbardziej uleczalne,
opracować nowe metody profilaktyki nowotworów: zapobiegania
powstawaniu nowotworów lub zapobiegania rozwojowi choroby we
wczesnych stadiach w guzy,
ustalić, dlaczego niektóre osoby są bardziej narażone na zachorowanie na
nowotwór, są mniej wrażliwe na terapię, albo są bardziej wrażliwe na dawki
chemioterapii i szybciej występują u nich efekty uboczne.
Dogłębna analiza różnic między nowotworem w modelach zwierzęcych, jak i
u ludzi często zapewnia nieoczekiwany wgląd w biologię nowotworu
człowieka, dostarczając informacji, których nie uzyskano by, badając tylko
podobieństwa
.

Wyróżniamy kilka kategorii modeli badawczych
nowotworów:
Zwierzęta, u których nowotwory występują spontanicznie, bez
jakiejkolwiek zmiany genów zwierzęcia lub zainicjowania
transformacji nowotworowej przez zabiegi chemiczne.
Zwierzęta, których geny zostały zmienione tak, aby rozwinęły
się u nich nowotwory tych samych typów i o podobnych
właściwościach jak nowotwory, które te geny powodują u ludzi.
Zwierzęta, u których rozwijają się nowotwory, jeśli są one
wystawione na działanie czynników środowiskowych, takich jak
czynniki chemiczne lub promieniowanie.
Zwierzęta, których naturalny, niezmieniony genotyp pozwala
naukowcom zidentyfikować geny, które wytwarzają skłonność
do rozwoju nowotworu.

MYSZY:
Badacze używają myszy z wielu powodów. Myszy są małe,
wymagają niewielkich ilości jedzenia i niewielkiej przestrzeni
życiowej, mają konsekwentne objawy choroby, rozmnażają się
szybko i mają sporą ilość potomstwa w miocie, są łatwe w
hodowli i mogą być łatwo wysyłane z obiektów hodowlanych
do placówek badawczych. Ich zastosowanie jako modeli
badawczych nowotworów pozwala na wyjątkowy wgląd w
biologię nowotworów u ludzi, a ostatnio również w ich
genetykę. Innym ważnym powodem, dla którego
wykorzystywane są właśnie myszy, jest ich podobieństwo
genetyczne do człowieka.
Myszy są pożądane jako modele badawcze, ze względu na
odkrycie dokonane w 1981 roku. Wykazano wtedy, że komórki
linii zarodkowej myszy mogą być modyfikowane genetycznie
i wykazywać stałą ekspresję obcych genów.

Pierwsze publikacje o użyciu myszy transgenicznych jako
modeli badawczych pojawiły się w 1984 roku. Opisano dwa
modele badawcze: jeden, w którym badano nowotwory mózgu,
otrzymano poprzez wprowadzenie do mysich komórek
jajowych wirusowego onkogenu SV40 Tag. Drugi został
otrzymany przez dostarczenie zmutowanego ludzkiego
onkogenu o nazwie c-Myc z użyciem MMTV, wirusa, który
infekuje tkanki sutka u myszy. U myszy rozwinęły się
nowotwory gruczołów sutkowych przypominające ludzki rak
piersi.
W 1987 roku do uzyskiwania transgenicznych modeli
badawczych zaczęto wykorzystywać procedurę homologicznej
rekombinacji w zarodkowych komórkach macierzystych myszy.
Ta metoda pozwoliła manipulować materiałem genetycznym
myszy w o wiele większym zakresie niż to było możliwe
dotychczas, co umożliwiło odtworzenie u myszy wielu
sekwencji DNA, które badacze uważali za powiązane z
procesem transformacji nowotworowej u ludzi. Z racji tego, że
badacze są w stanie zmodyfikować materiał genetyczny myszy
z wielką precyzją, można stwierdzić czy, jak, kiedy
i w jakich układach określone geny wpływają na rozwój
nowotworów i ich zdolność do tworzenia przerzutów.

W innej kategorii modeli badawczych
nowotworów modyfikuje się myszy tak, aby miały
one mutacje predysponujące do rozwoju
nowotworów. Ważnym czynnikiem jest również
umożliwienie komórkom posiadającym dane
mutacje przejścia przez punkty kontrolne cyklu
komórkowego. U niektórych z tych myszy po
zadziałaniu odpowiednim czynnikiem
środowiskowym będą się rozwijać ściśle
określone typy nowotworów. Jednym z wariantów
takiego modelu jest dalsze krzyżowanie tych
myszy z myszami transgenicznymi, u których
zaburzono niektóre szlaki komórkowe.

SZCZURY:
Szczury mają pewne zalety jako modele badawcze i
są one jednym z najpowszechniej stosowanych
organizmów do badań medycznych. Ponieważ szczury
są większe niż myszy, istnieje wiele obszarów i
parametrów które łatwiej u nich zbadać w
porównaniu do myszy, na przykład pomiary ciśnienia
krwi i badania serii próbek krwi są łatwiej
uzyskiwane u szczurów niż u myszy. Wiele ważnych
prac w dziedzinach farmakologii, toksykologii,
odżywiania, behawiorystyki i innych zagadnieniach
zostało opracowanych na szczurzych modelach
badawczych. Dane z tych różnych inicjatyw stanowią
doskonałą podstawę dla wielu rodzajów badań
dotyczących leczenia nowotworów i ich skutków.

MUTAGENEZA
CHEMICZNA:
Jednym z narzędzi służących do uzyskania
genetycznie zmodyfikowanych zwierząt jest
traktowanie zarodków chemicznym
mutagenem, który powoduje uszkodzenie
DNA. Najczęściej stosowany do tego celu
jest N-etylo-N-nitrozomocznik. Przełomowe
badania wykazały, że strategia ta może być
stosowana na szczurach i może być
wykorzystywana do zakłócania ekspresji
genów odgrywających rolę w transformacji
nowotworowej, w tym BRCA1 i BRCA2.

MUTAGENEZA
INSERCYJNA:
Inny wariant badawczy genetycznie
modyfikowanych szczurów polega na
wprowadzeniu do genomu materiału
genetycznego retrowirusów i
transpozonów. Te ruchome elementy
genetyczne mogą włączyć się do
genomu i zakłócić ekspresję genów i
regionów regulatorowych. Jednakże, ze
względu na ich nieswoistą insercję,
rezultat integracji z genomem nie
zawsze jest pożądany.

STRATEGIE
TRANSGENICZNE:
Najpowszechniej stosowaną metodą
otrzymywania transgenicznie modyfikowanych
szczurów, opisaną w 1990 roku, była
mikroiniekcja konstruktów DNA do przedjądrzy.
Do niedawna bardziej precyzyjna metoda z
użyciem ES, wykorzystywana w badaniach na
myszach była dla szczurów nieosiągalna, jednak z
wolna zaczęło się to zmieniać i obecnie
przewiduje się powstanie wielu modeli
badawczych na szczurach „warunkowo
transgenicznych” (z możliwością „włączania” i
„wyłączania” ekspresji transgenu) z
wykorzystaniem technik knock-out i knock-in.

RYBKI DANIO:
Do niedawna te rybki
wykorzystywano wyłącznie jako
ozdobę akwarium. Poręczna
możliwość obserwacji rozwoju
zarodków i biologicznych
procesów u dorosłych ryb, w
połączeniu z szybkim cyklem
życiowym sprawiły, że naukowcy
mogli uzyskać wgląd w
mechanizmy i procesy, które
mogą być porównane do wielu
aspektów ludzkiej biologii.


Szybko stało się jasne, że w danio można obserwować
również rozwój narośli nowotworowych. To sprawiło, że
danio znalazło zastosowanie jako model badawczy w
kancerogenezie. Chociaż z pewnością istnieją
rozbieżności pomiędzy kancerogenezą u Danio a ludzkimi
procesami, wiele z tych genów i szlaków sygnałowych,
które biorą udział w wywoływaniu transformacji
nowotworowej jest porównywalnych u obu gatunków.
Danio zostają genetycznie zmodyfikowane tak, aby były
podatne na rozwój niektórych nowotworów. Dodatkowo
podaje im się związki indukujące kancerogenezę. W
rybkach danio można również hodować i monitorować
ludzkie komórki nowotworowe. Modele badawcze z
udziałem danio znajdują się obecnie w fazie szybkiego
rozwoju.

KANCEROGENEZA

Czym jest
kancerogeneza?
To długotrwały proces prowadzący do powstawania
nowotworu.
Związany jest on z nagromadzeniem się w komórce
zmian genetycznych i epigenetycznych. W ich
efekcie dochodzi do upośledzenia lub wzmocnienia
ekspresji genów zaangażowanych w regulację cyklu
komórkowego: protoonkogenów i genów
supresorowych. Zmieniona komórka ulega
niekontrolowanym podziałom i staje się niewrażliwa
na sygnały kierujące ją na drogę samobójczej śmierci.

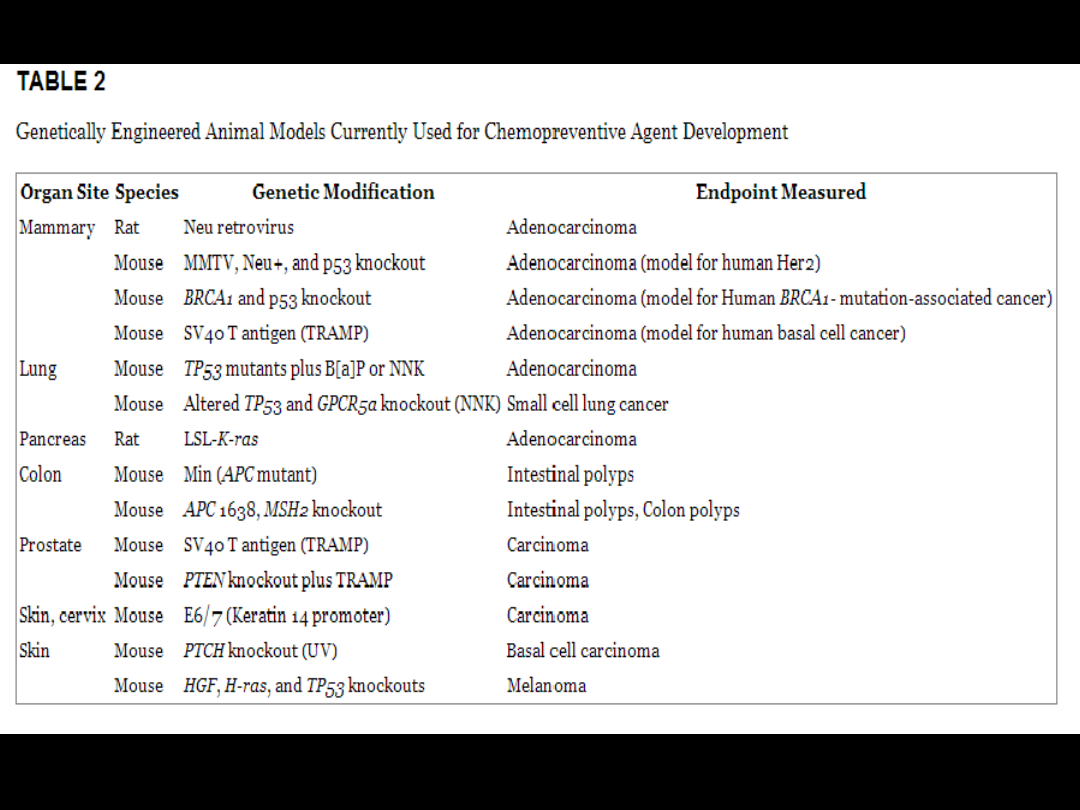
Kancerogeny, czynniki
rakotwórcze, onkogeny…
Czynniki onkogenne są to czynniki, których
działanie inicjuje procesy nowotworzenia.
Dzielimy je na:
chemiczne, np. niektóre metale ciężkie (Ni, Cd,
Co), substancje smoliste, azbest .
fizyczne, np. promieniowanie UV i jonizujące.
biologiczne: egzogenne takie jak wirusy (HPV),
bakterie (Helicobacter pylori) oraz endogenne, np.
błędy replikacji, pośrednie produkty przemiany
materii (hormony, wolne rodniki).
UVaga na
Słońce!
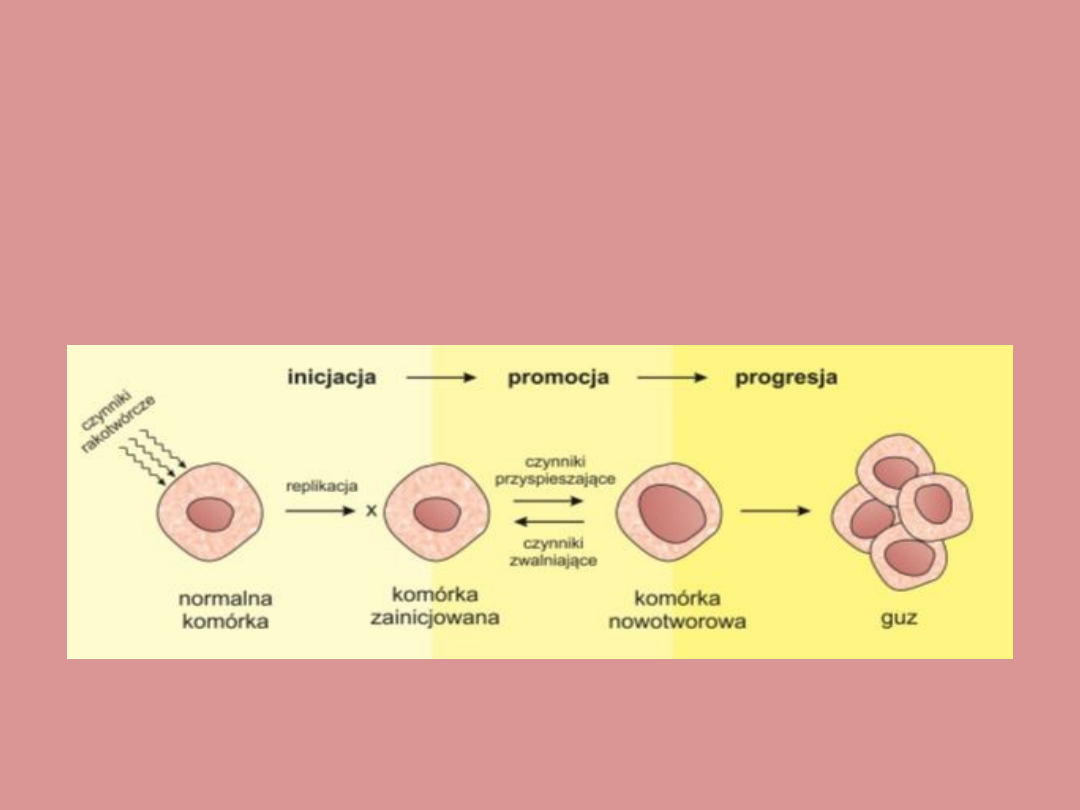
ETAPY KARCENOGENEZY
Kancenogeneza to proces ciągły, w którym wyróżniamy 3
podstawowe etapy:
1) Inicjację,
2) Promocję,
3) Progresję.
Niekiedy wyróżnia się także etap preinicjacji, czyli narażenia na
działanie czynników kancerogennych. Może on trwać całe życie i nie
prowadzić do powstawania zmian nowotworowych.

Rola wirusów w
onkogenezie
Jedną z najważniejszych przyczyn powstawania raka u
zwierząt są tzw.
retrowirusy onkogenne
. Są to wirusy
RNA, których replikacja zachodzi przez
intermediat
, czyli
DNA (prowirus) ingerujący z genomowym DNA gospodarza
i ulegający transkrypcji do potomnego wirusowego RNA.
(wirus wykorzystuje przy tym polimerazę RNA
gospodarza).
Wiele retrowirusów onkogennych posiada dodatkowy gen,
którego nie obserwuje się w spokrewnionych wirusach
nieonkogennych.
Onkogen ten różni się w zależności od typu wirusa i
znajduje się pod kontrolą silnej sekwencji wzmacniającej,
czyli
enhancera
zlokalizowanego w długich powtórzeniach
końcowych (tzw. LTR) genomu wirusa.

Związek różnych wirusów z
nowotworami u człowieka
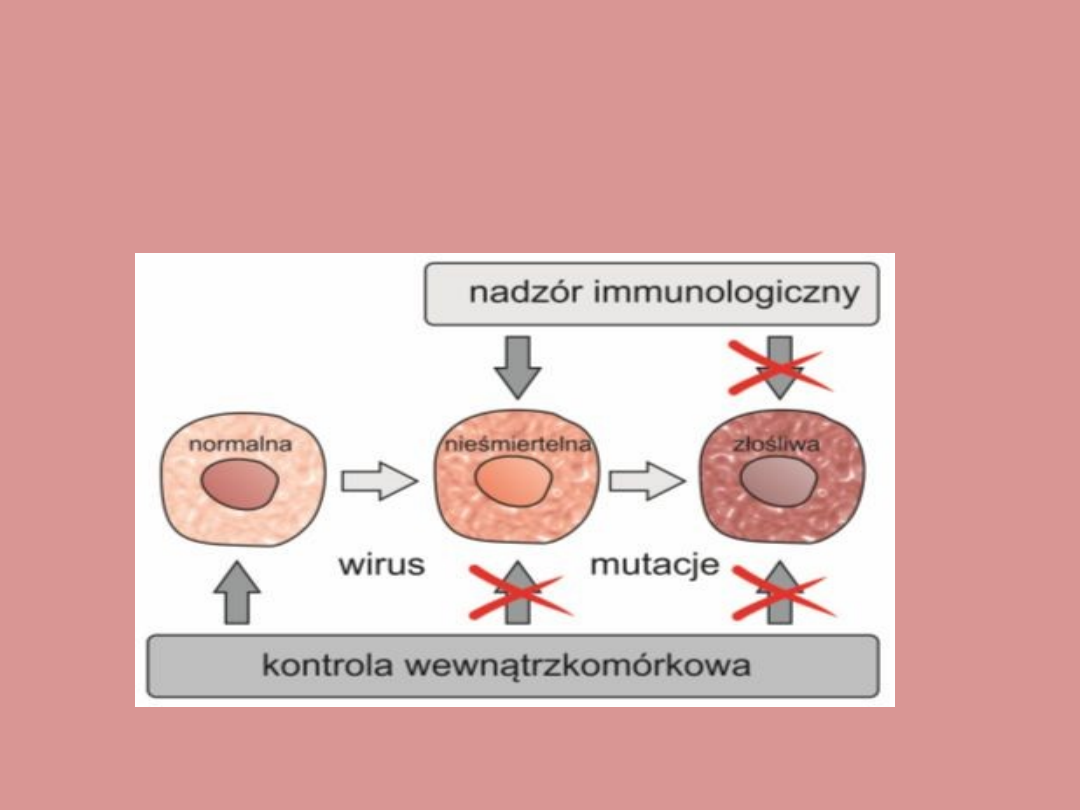
Mechanizmy kontroli
wewnątrzkomórkowej i zewnątrzkomórkowej
w przebiegu ontogenezy wirusowej i progresji
nowotworowej…

Nowotwór jako choroba
genetyczna
Charakterystyczną cechą nowotworów jest ich
zdolność do ulegania niekontrolowanym
podziałom.
W ich wyniku guz rozrasta się w obrębie tkanki
macierzystej i niszczy otaczające go struktury,
upośledzając przy tym czynności sąsiadujących
narządów.
Ta nieregularna mitoza prowadzi do
heteroploidii, a znajdujące się w komórkach
rakowych chromosomy często wykazują
rearanżacje strukturalne.
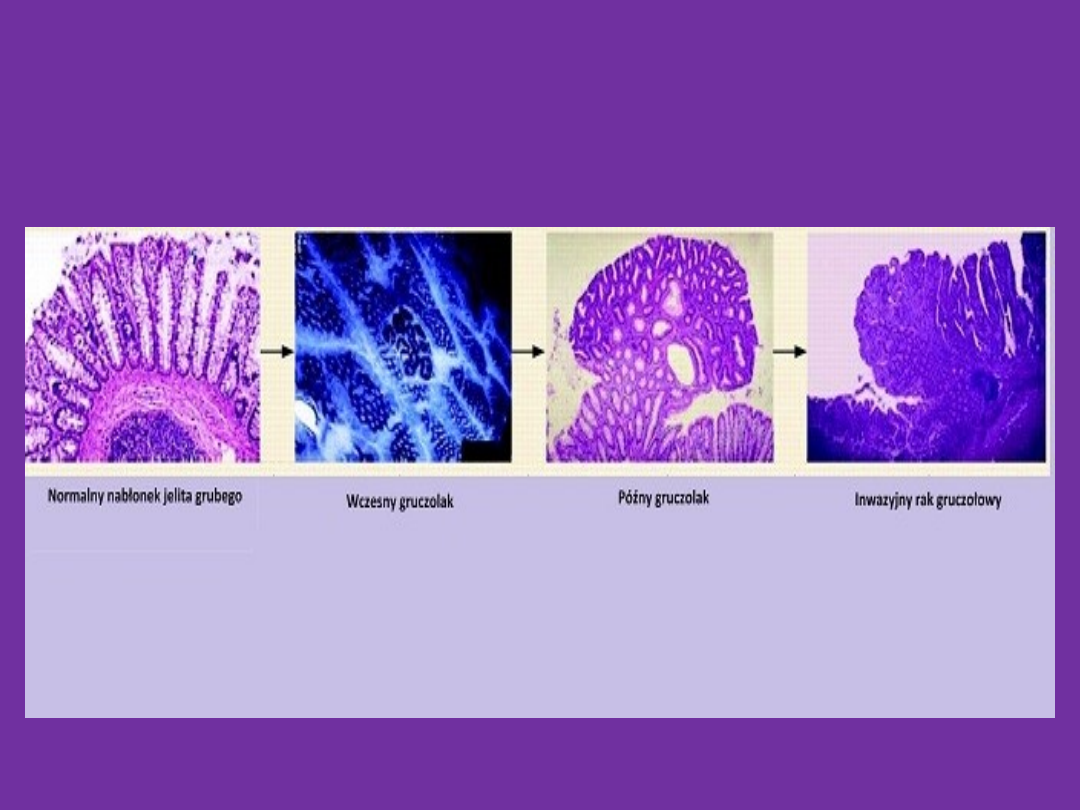
Rak jelita grubego –
epidemiologia i kancerogeneza
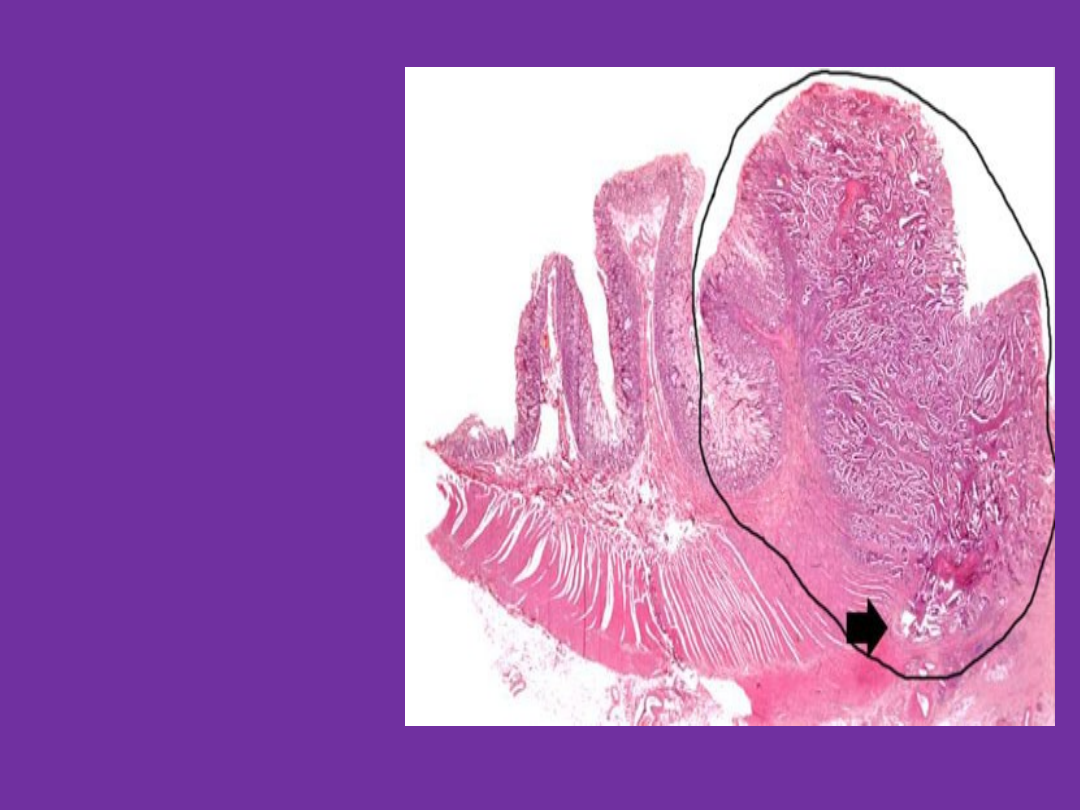
Rak w obrębie
ściany jelita
grubego.
Po lewej stronie:
prawidłowa ściana
jelita (kosmki
jelitowe). Po prawej:
nieprawidłowy
rozrost komórek
nabłonka - rak.
Strzałka wskazuje
naciekanie mięśni w
obrębie ściany jelita
przez komórki raka.
CHEMOPREWENCJA:
Prewencja, czyli zapobieganie rozwojowi nowotworów, stała się
nowym perspektywicznym kierunkiem we współczesnej onkologii,
szczególnie w odniesieniu do raka jelita grubego, piersi i gruczołu
krokowego. Karcynogeneza jest wieloletnim i złożonym procesem
prowadzącym do powstania nowotworu, w przebiegu którego
można wyróżnić trzy zasadnicze etapy: inicjację, promocję i
progresję. Chemoprewencja to strategia polegająca na
zastosowaniu związków pochodzenia naturalnego lub
syntetycznego, które zapobiegają powstawaniu nowotworów
poprzez zahamowanie lub odwrócenie procesu karcynogenezy.
Związki chemoprewencyjne dzielimy na dwie podstawowe grupy:
blokujące etap inicjacji (strategia antyinicjacyjna, czyli
chemoprewencja pierwotna − I rzędu) oraz supresyjne, modulujące
etap promocji i progresji nowotworu (strategia
antypromocyjna/antyprogresyjna, czyli chemoprewencja wtórna − II
rzędu). Zależnie od mechanizmu działania czynniki te mogą
skutecznie oddziaływać na jeden, dwa lub wszystkie trzy etapy
karcynogenezy.
Modele zwierzęce są aktualnie wykorzystywane do
oceny skuteczności potencjalnych czynników
chemoprewencyjnych, w tym syntetycznych substancji
chemicznych, czynników chemicznych otrzymywanych z
naturalnych produktów i mieszanin naturalnych
produktów. Obserwacje poczynione w tych modelach,
jak również inne dane są następnie wykorzystywane do
wytypowania najbardziej obiecujących środków
chemoprewencyjnych, które następnie kwalifikują się
do dalszych badań klinicznych. Modele zwierzęce
skupiające się na konkretnych narządach są stosowane
w celu określenia, które środki lub klasy czynników
mogą być najbardziej skuteczne w nietoksycznych
dawkach, aby zapobiec narządowo-specyficznym
formom nowotworu.
W stosowanych modelach zwierzęcych albo indukuje się
kancerogenezę karcynogenami specyficznymi dla
poszczególnych narządów albo używa się zwierząt
transgenicznych, u których dochodzi do insercji, delecji lub
modyfikacji w określonych genach, które odpowiadają za proces
transformacji nowotworowej w określonym organie. Modele
zwierzęce, w których bada się nowotwory, wykazujące
szczególne cechy umożliwiające badanie chemoprewencji są
dostępne dla płuc, okrężnicy, skóry, pęcherza moczowego,
gruczołu sutkowego, gruczołu krokowego, głowy i szyi,
przełyku, jajników i trzustki. Oprócz badań reakcji na dawkę
pojedynczego czynnika, takie modele są często używane do
testowania kombinacji czynników, testowania różnych dróg
dostarczania substancji do organizmu i dostarczania
podstawowych danych farmakokinetycznych i
toksykologicznych. Dla niektórych z bardziej standardowych
modeli zwierzęcych istnieje istotna korelacja z wynikami badań
nad chemoprewencją u ludzi. Istnieje coraz większa liczba
badań nad chemoprewencją u ludzi, które dały pozytywne
wyniki, a stosowane środki lub ich kombinacje dawały również
takie rezultaty w badaniach na zwierzętach.

„Strażnik genomu”:
Produkt białkowy genu P53 odgrywa istotną rolę w regulacji
cyklu komórkowego. Jego aktywna forma umozliwia zatrzymanie
cyklu komórkowego w fazie G1 umożliwiając naprawę
uszkodzonego frag. DNA lub zapoczątkowanie apoptozy. Mutacja
w obrębie tego genu stanowi najczęstszą przyczynę
powstawania nowotworów u człowieka. Według doniesień
zespołu Donehowera już w 1992 r. ustalono, iż myszy
homozygotyczne względem znokautowanego p53, są żywotne,
ale wysoce podatne na samorzutną kancerogenezę, we
wczesnym etapie życia. Natomiast myszy heterozygotyczne,
posiadające tylko jeden uszkodzon allelp53 wykazują podatność
na rozwój nowotworu, choć czas jego pojawienia się jest
późniejszy.

Min-mouse:
• Min-mouse (multiple intensinal neoplasia),
• Mutacja genu Apc, biorącego udział w transdukcji sygnałów
komórkowych, polega na zmianie kodonu leucyny na kodon
stop,
• Nowotwory jelita grubego, dziedziczne polipowate i
niepolipowate, samorzutne, guzy w obrębie jelita ciękiego
• Myszy wykorzystywne do oceny skuteczności działań
prewencyjnych, oraz badania stosowanych leków w terapii
nowotworowej

Pochodny model Min-
mouse:
• Mutacja w kodonie 716 Apc z jenoczesną inaktywacją genu
cyklooksygenazy typu 2 (Cox-2),
• Krzyżówka myszy ApcD716 z nokautami Cox-2
• Mniejsza podatność na powstawanie polipów jelitowych, w
porównaniu do myszy Min-mouse, co dowodzi istotną rolę
enzymu Cox-2 w powstawaniu nowotworów w obrębie jelita,
co z kolei kwalifikuje leki selektywnie hamujące aktywność
Cox-2 do stosowania w leczeniu i zapobieganiu
nowotworom jelita grubego
TRAMP:
Rak prostaty jest nowotworem, który zwykle rozwija się u
mężczyzn około 50. roku życia. Nowotwór nabłonka prostaty
(PIN), początkowa zmiana złośliwa, rozwija się w postać
inwazyjną ciągu kilku lat. Ze względu na szczególne cechy
towarzyszące powstawaniu raka prostaty, ten typ
nowotworu może stanowić paradygmat w profilaktyce
nowotworowej. Trwają badania nad opracowaniem nowych
czynników chemoprewencyjnych, które miałyby za zadanie
zakłócić powiązane z transformacją nowotworową szlaki
sygnałowe. Do oceny skuteczności tych związków są
używane modele zwierzęce, szczególnie genetycznie
modyfikowane myszy. Model, w którym badany jest
transgeniczny gruczolakorak mysiej prostaty (TRAMP) został
uznany za najbardziej dokładny jeśli chodzi o badania
chemoprewencji. Udowodniono, że genisteina, alfa-
difluorometyloornityna, toremifen, R-flurbiprofen,
celekoksyb i polifenole w zielonej herbacie zapobiegają
rozwojowi raka prostaty myszy TRAMP.

Zwierzęta transgeniczne ułatwiają
równoczesne badanie indukcji
uszkodzeń DNA oraz ich naprawy,
tym samym aktywność mutagenną i
działanie kancerogenne w jednym
systemie badawczym.
Większość znanych i stosowanych związków
chemoprewencyjnych to substancje pochodzenia
roślinnego. Dzieli się je na kilka klas:
(1)związki hamujące etap inicjacji transformacji
nowotworowej,
(2) związki hamujące proliferację komórek prenowotworowych
i nowotworowych na etapie promocji i progresji nowotworu
(3) związki wykazujące jednoczesne działanie opisane w
punktach 1 i 2, do których zaliczana jest kurkumina oraz
m.in. Resweratrol.

• Skuteczność i selektywność potencjalnych
środków chemoprewencyjnych jest zazwyczaj
wstępnie oceniana w hodowlach komórkowych na
podstawie wyników klasycznych testów, np.
zdolności do zahamowania wzrostu komórek,
zatrzymania cyklu komórkowego czy indukcji
apoptozy.
• W następnym etapie są prowadzone
przedkliniczne badania in vivo na odpowiednio
dobranych modelach zwierzęcych, w tym także
na zwierzętach transgenicznych, u których rozwój
nowotworów jest indukowany przez podanie
określonych karcynogenów chemicznych. Jedynie
nieliczne środki, charakteryzujące się dużą
efektywnością działania i małą toksycznością u
zwierząt, mają szansę na zastosowanie w
badaniach klinicznych u człowieka.

• Istnieje kilka raportów na
temat chemoprewencyjnego
działania likopenu lub
karotenoidów pomidorów
opartych na badaniach na
modelach zwierzęcych.
• Większość, ale nie
wszystkie, z tych badań
wykazują pozytywny efekt.

Likopen (E160d) – organiczny związek
chemiczny z
grupy karotenów, węglowodór
nienasycony o budowie podobnej
do kauczuku naturalnego. Należy do
rodziny naturalnych pigmentów
(karotenoidów) występujących u roślin i
zwierząt. Jest jednym
z przeciwutleniaczy, posiada
właściwości chroniące organizm przed
licznymi chorobami układu
krwionośnego, a przede wszystkim
przed rakiem.
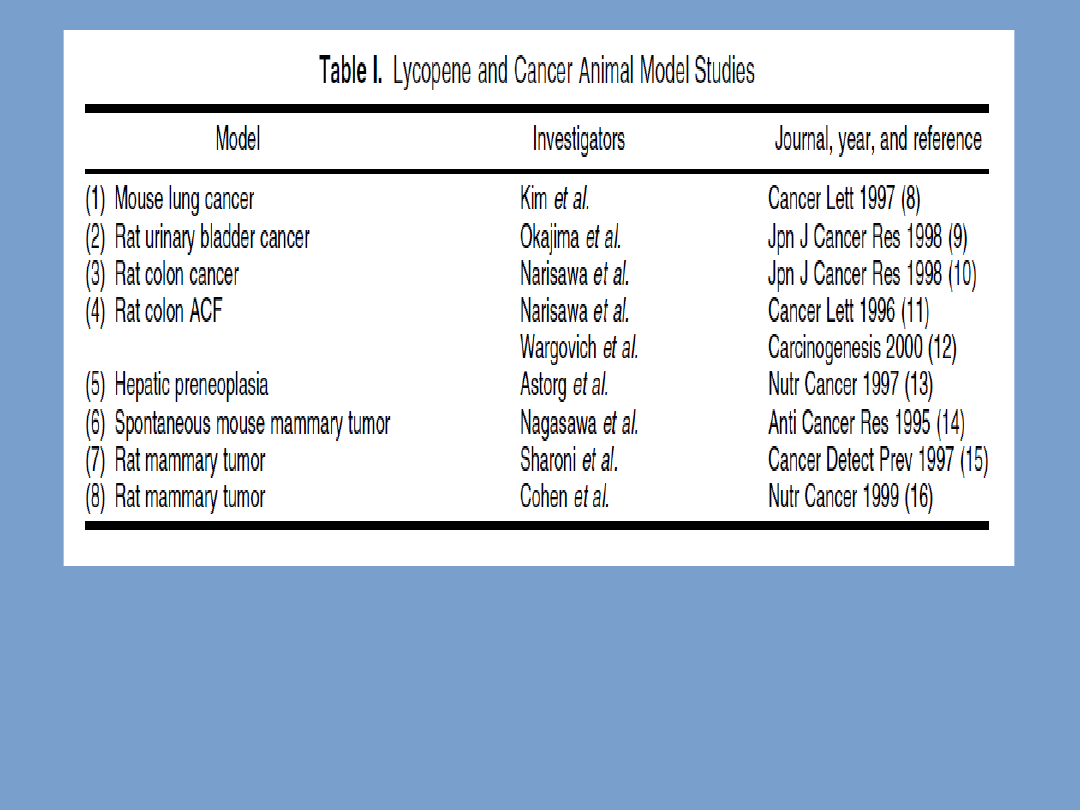
Obecnie 8 modeli zwierząt zostało opublikowanych. Pozytywne
wyniki zarejestrowano w przypadku płuc myszy, szczurzego
pęcherza moczowego i i okrężnicy.

• Wśród wielu związków pochodzenia
naturalnego wykazujących
właściwości przeciwnowotworowe,
szczególne miejsce zajmuje
resweratrol.
• Do szczegółowej analizy wytypowano
3,4,4’,5-transtetrametoksystylben
(3,4,4’,5-TMS).
• H
ipoteza selektywnego działania
przeciwnowotworowego 3,4,4’,5-TMS
którego zastosowanie eliminuje
komórki nowotworowe bez
uszkodzenia komórek prawidłowych
może stanowić podwaliny prób
zmierzenia się z możliwością
zastosowania tego związku nie tylko
w bezpiecznej dla pacjenta terapii
przeciwnowotworowej (eliminującej
wyłącznie uszkodzone lub
zmutowane komórki), ale także
zwiększenia komfortu życia chorego.
Resweratrol

• W świetle tych danych, a także
wyników badań in vitro, 3,4,4’,5-TMS
został poddany dalszym testom na
myszach transgenicznych NOD/SCID,
którym wszczepiono wybrane w
pierwszym etapie badań najbardziej
wrażliwe, na badany związek, ludzkie
komórki nowotworowe.
• Innowacyjna metoda mysich
ksenograftów NOD/SCID umożliwia
przyżyciową, nieinwazyjną ocenę
rozwoju guza i kontrolowanie
odpowiedzi komórek nowotworowych
na terapeutyczną dawkę
ksenobiotyku. Metoda ta umożliwia
nie tylko określenie wielkości guza, ale
również wizualizację metastazy
spontanicznej z guza pierwotnego
oraz wykrycie mikrorozsiewów
komórek nowotworowych
(mikrometastazy).
• Metoda mysich ksenograftów, choć
powszechnie stosowana na świecie,
jest bardzo rzadko wykorzystywana w
Polsce.

NOD SCID Mouse
Charakterystyka
Nowa generacja myszy o obniżonej
odporności uzyskana przez Centralny
Instytut Zwierząt Eksperymentalnych w
2000r.
Nie wykazują aktywności limfocytów T, B i
komórek NK.
Kod
394
Kolor umaszczenia
Biały (albino)
Zastosowania
Biologia nowotworów

Kurkumina
• Kurkumina jest związkiem pochodzenia
roślinnego, uzyskiwanym z kłączy azjatyckiej
byliny ostryżu długiego (Curcuma longa,
Zingiberaceae), powszechnie stosowanym jako
przyprawa w kuchni orientalnej oraz w przemyśle
spożywczym i tekstylnym jako barwnik. Jednakże
wykorzystanie kurkuminy wykracza dalece poza
tradycjne zastosowania kulinarne, a związek ten,
ze względu na swoje właściwości lecznicze,
znany jest w medycynie Dalekiego Wschodu od
ponad 4000 lat.
• Wielką zaletą kurkuminy, wykazaną w badaniach
na zwierzętach oraz ludziach, jest jej niska
toksyczność.
• Długotrwałe przyjmowanie niewielkich ilości
kurkuminy nie tylko nie wywołuje niekorzystnych
efektów, ale wręcz jest uznawane za jeden z
powodów mniejszej zachorowalności na
nowotwory, zwłaszcza przewodu pokarmowego
(Mohandas i Desai1999).

• W
ykaza
no
, że w mózgach
transgenicznych myszy ze
zmutowanym ludzkim genem APP
kodującym białko prekursorowe β-
amyloidu i wyrażonymi objawami AD,
karmionych przez pół roku
kurkuminą, dochodzi do
zahamowania stanu zapalnego i
ograniczenia ilości uszkodzeń
wywołanych przez stres oksydacyjny.

• Dopełnieniem badań wskazujących na
przeciwnowotworowe właściwości kurkuminy
prowadzonych w warunkach in vitro są badania na
zwierzętach.
• Bardzo użyteczne w badaniach in vivo są modele z
wykorzystaniem ksenograftów, tj. pozbawionych
odporności zwierząt laboratoryjnych, którym
przeszczepiono komórki nowotworowe człowieka
(ang. xenografts). W tych warunkach, dochodzi do
rozwoju nowotworu typowego dla komórek, które
zostały wprowadzone do organizmu zwierzęcia;
umożliwia to badanie rozwoju nowotworu i
skuteczności terapii na żywych organizmach.
• Wykazano, że kurkumina poprzez obniżenie
aktywności czynnika transkrypcyjnego NF-κB,
hamuje wzrost guza i angiogenezę u myszy, którym
przeszczepiono komórki nowotworowe raka jajnika
(Lim i współaut. 2007).
• Podobnie w mysim modelu raka trzustki,
zastosowanie kurkuminy wywołuje zahamowanie
zarówno tworzenia nowych naczyń krwionośnych w
otoczeniu guza jak i proliferacji komórek
nowotworowych oraz uwrażliwia je na
chemioterapię.

• Wykazano, że u myszy, którym
wszczepiono komórki raka okrężnicy, po
podaniu kurkuminy dochodzi do
znaczącego spadku masy guza oraz
zahamowania angiogenezy w jego
otoczeniu.
• Podawanie kurkuminy myszom, którym
uprzednio wszczepiono komórki ludzkiego
glejaka U87, powodowało zahamowanie
wzrostu guza, jak również indukcję śmierci
komórkowej o znamionach autofagii (Aoki i
współaut 2007).
• Zmniejszenie się rozmiaru guza i
zahamowanie angiogenezy obserwowano
również w przypadku mysich modeli
ksenograftów raka pęcherza (Lim i
współaut. 2005a ).

Literatura
• Rocznik Państwowego Zakładu Higieny, Tom 48, Nr 4, 1997
• http://ebm.rsmjournals.com/content/227/10/864.full.pdf+html
• http://www.efs.wup.poznan.pl/att/stypendia/Hanna_Piotrowska.pdf
• http://en.wikipedia.org/wiki/NOG_mouse
• http://www.criver.com/EN-US/PRODSERV/BYTYPE/RESMODOVER/R
• http://kosmos.icm.edu.pl/PDF/2008/53.pdf
• Organizmy transgeniczne w fermacji i medycynie, Michał Cichocki
Document Outline
- Slide 1
- IDEA:
- CEL:
- Wyróżniamy kilka kategorii modeli badawczych nowotworów:
- MYSZY:
- Slide 6
- Slide 7
- SZCZURY:
- MUTAGENEZA CHEMICZNA:
- MUTAGENEZA INSERCYJNA:
- STRATEGIE TRANSGENICZNE:
- RYBKI DANIO:
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Czym jest kancerogeneza?
- Kancerogeny, czynniki rakotwórcze, onkogeny…
- Slide 19
- ETAPY KARCENOGENEZY
- Rola wirusów w onkogenezie
- Związek różnych wirusów z nowotworami u człowieka
- Slide 23
- Nowotwór jako choroba genetyczna
- Rak jelita grubego – epidemiologia i kancerogeneza
- Slide 26
- CHEMOPREWENCJA:
- Slide 28
- Slide 29
- Slide 30
- Min-mouse:
- Pochodny model Min-mouse:
- TRAMP:
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Resweratrol
- Slide 40
- NOD SCID Mouse
- Kurkumina
- Slide 43
- Slide 44
- Slide 45
- Literatura
Wyszukiwarka
Podobne podstrony:
Paradygmaty modele badawcze, Różne pracy z pedagogiki
Jakościowe modele badawcze
Modele transgeniczne jako modele badawcze
Przebieg procesu badawczego Podstawowe typy badań
CHEMOPREWENCYJNE I KANCEROGENNE SKŁADNIKI ŻYWNOŚĆI
GMO metody wykrywania 2
Metody i cele badawcze w psychologii
Przebieg porodu z video
02metody badawcze psychologii spolecznej2id 4074 ppt
w5b modele oswietlenia
33 Przebieg i regulacja procesu translacji
Orientacje badawcze
Modele krajobrazu
86 Modele ustrojowe wybranych panstw
więcej podobnych podstron