
Modele
transgeniczne jako
modele badawcze
Mariola Sitnik
Michał Stec
Aleksandra
Szewczyk
biotechnologia
gr. 11 G

Badania z wykorzystaniem
zwierząt laboratoryjnych :
• środowisko - 28%
• rolnictwo - 23%
• przemysł - 40%
• żywność i konserwanty - 12%

Całkowita światowa liczba badań z użyciem
zwierząt może przekraczać 50 mln rocznie.
• USA – około 15 mln procedur
• EU – około 11 mln procedur
• JAPONIA – około 5 mln procedur
• KANADA – około 2 mln procedur
• SZWAJCARIA - >1 mln procedur
- eksperymenty zwierzęce
- procedury /normalne zwierzęta doświadczalne/
- procedury /zwierzęta modyfikowane
genetycznie/

Badania biomedyczne:
• rozwój nowych metod terapii i profilaktyki –
28%
• podstawowe badania biologiczne i
medyczne – 31%
• testowanie bezpieczeństwa
niemedycznych produktów używanych w
gospodarstwie, rolnictwie, przemyśle – 2%
• hodowla zwierząt laboratoryjnych – 37%
• rozwój nowych metod diagnozowania – 2%

Modele
transgeniczne jak
narzędzia badawcze

Uzyskanie wiarygodnych wyników badań farmakologicznych,
toksykologicznych oraz badań nad procesami fizjologicznymi
wymaga badań „in vivo”, czyli na organizmach żywych.
Najczęściej wykorzystuje się w tym celu modele zwierzęce.
Konieczne jest „dostosowanie” takiego zwierzęcia, których
wyniki mają mieć odniesienie do ludzi. W tym celu wykorzystuje
się modyfikacje genetyczne. Ponadto modele transgeniczne
pozwalają na szeroko rozumiane poznawanie genów, ich
funkcjonowanie, współdziałanie, ekspresje, specyficzność oraz
odpowiedź na bodźce hormonalne. Stosowanie transgenicznych
modeli zwierzęcych jest chętnie wykorzystywanym narzędziem
w badaniach toksykologicznych i farmakologiczntych.

Od wielu lat najczęściej wykorzystywanymi zwierzętami w badaniach
eksperymentalnych są małe gryzonie np. myszy i szczury. Wiele cech
powoduje, że są one równie chętnie wykorzystywane do badań z użyciem
modeli transgenicznych.
Najważniejsze zalety tych gryzoni:
• Małe rozmiary i częste, niezależne od sezonu cykle
rozrodcze
• Możliwość krzyżowania wsobnego
• Długa historia hodowli i dostępność protokołów
hodowlanych
• Istnienie i dostępność licznych odmian genetycznych
• Możliwość zastosowania transgenezy
• Stosunkowo duża wydajność transgenezy

Modele transgeniczne stworzono dla wielu ludzkich chorób, takich
jak różnego rodzaju nowotwory, schorzenia neurologiczne,
choroby układu sercowo-naczyniowego, krwiotwórczego lub
immunologicznego. Odgrywają one bardzo istotną rolę w
badaniach nad chorobami o podłożu genetycznym .
Przykłady badań nad chorobami ludzkimi z wykorzystaniem
zwierząt modyfikowanych genetycznie:
• Mysz podatna na zakażenie wirusem polio
• „Smart mouse” (inteligentna mysz) – badania
biochemicznych podstaw procesów zapamiętywania
• badania mutagenezy toksyczności i metabolizmu
ksenobiotyków
• Badania kancerogenezy i chemoprewencji nowotworów
• „Min mouse” – badania nowotworów jelita grubego
• Badania mechanizmów skórnej kancerogenezy
• Badania nad genem P53

Metody hodowli
genetycznie
zmodyfikowanych
zwierząt
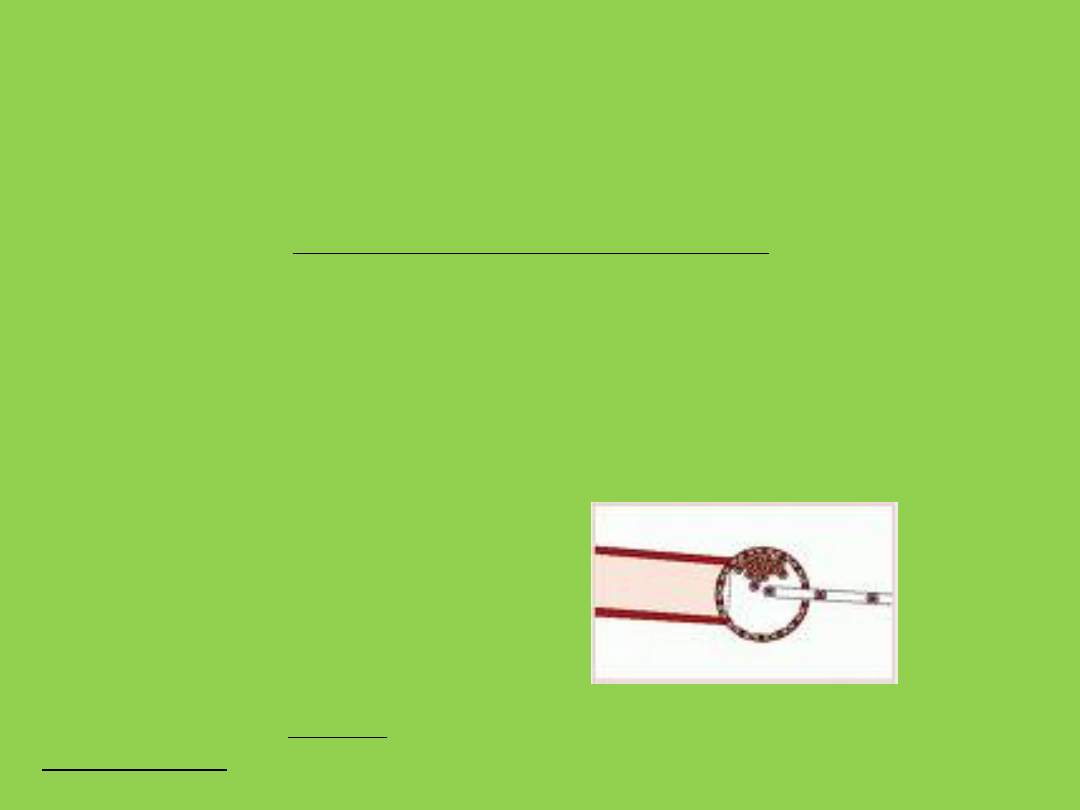
Technika oparta na wirusach
.
Jest to najstarsza z trzech głównych technologii. Następuje w niej
wprowadzenie wirusa do komórki, po to, aby dostarczył transgen do
docelowych jąder. Obecnie naukowcy z niej rezygnują, ze względu na
jej niedoskonałość: wielokrotne wprowadzanie transgenu do obcego
genomu utrudnia lub wręcz uniemożliwia interpretacje efektów
badań.
Stosowanie tej metody daje niewielką ilość żywych transgenicznych
organizmów. Prowadzi także do produkcji tzw. mozaikowych zwierząt,
których transgen jest przenoszony i dokonuje ekspresji jedynie w
niektórych komórkach ciała. Dodatkowo wiadomo, że materiał
genetyczny wirusów łączy się z sekwencjami DNA obcego genomu, co
w konsekwencji prowadzi do powstania nowych, bardziej zajadłych
wirusów.
Ponadto, znany jest
fenomen zwany
„wprowadzoną
onkogenezą”, oparte na
tym, że komórki, do
których zostały
wprowadzone obce
genomy wirusów, ulegają
zrakowaceniu

Pronuklearne mikroiniekcje
Ta często stosowana metoda stanowi normę badawczą, ze względu
na jej skuteczność w porównaniu do wirusowej transgenezy –
chociaż jej średnia skuteczność wynosi 1-10%, co oznacza, że nadal
90-99% zwierząt jest zabijana.
W tej technice samice zwierząt (np. myszy) otrzymują zastrzyk
hormonalny, wywołujący wzmożoną produkcje komórek jajowych. Po
takiej sesji hormonalnej zapładnia się naturalnie samice, które po
określonym czasie zabija się w celu uzyskania embrionów.
Następnie za pomocą iniekcji wprowadzone zostają do nich
transgeny. 20 lub 30 embrionów jest wówczas transferowanych do
odpowiedniej liczby samic myszy, które były uprzednio
przygotowane do przyjęcia ciąży. Jest ich tyle, gdyż zazwyczaj tylko
4-5% początkowych embrionów zawiera transgen. Następnie po
trzech tygodniach od wykonanego transferu następuje poród
zwierząt, które przeżyły ten proces.

Embrionalne jądro komórkowe
.
Ta metoda posługuje się jądrem zarodowych komórek
macierzystych, we wczesnym stadium rozwoju, zwanym
blastocytem. Blastocyty to embriony, które rozwinęły się kilka
dni po zapłodnieniu i składają się z ok. 100 zarodowych
komórek, które jeszcze się nie zagnieździły.
Embriony, które mają tylko kilka dni, są pobierane z
wcześniej zabitego zwierzęcia. Komórki są izolowane i
przechodzą proces inkubacji in vitro.
W tym czasie wprowadzany jest
transgen za pośrednictwem
zaprojektowanego wirusa lub
prądu elektrycznego. Transgen jest
wprowadzany razem z innym
genem, tzw. markerem, który
pozwala zidentyfikować jądro
komórkowe zawierające transgen,
oraz je wyselekcjonować
antybiotykiem – tylko komórki
zawierające transgen będą na
niego odporne. Następnie zostają
one połączone z nowym, „obcym”
blastocytem i transferowane do
ciężarnej samicy.

Podstawowe standardy zwierzętarni:
• Oświetlenie
-Optymalne natężenie – 60 luksów (natężenie 1 000-2 000 luksów wywołuje
ślepotę u zwierząt)
-Odległość od źródeł światła – szczególnie istotna u zwierząt
albinotycznych
-Ciemność – szyszynka pobudzona do produkcji enzymu HIOMT – synteza
melatoniny – hamowanie wydzielania z podwzgórza LHRH – hamowanie
działania przysadki mózgowej
• Temperatura – 20 – 22stopni C (strefa obojętności cieplnej –
charakterystyczna dla gatunku – oddawanie i wytwarzanie ciepła
optymalne)
• Wilgotność – optymalna dla zwierząt laboratoryjnych wynosi około 55±5%
wilgotności względnej (powiązanie z temperaturą)
• Ciśnienie – czynnik bardzo trudny do standaryzacji, regulowany systemami
wentylacyjno-klimatyzacyjnymi
• Skład powietrza – właściwy skład powietrza osiąga się przez określoną
liczbę wymian powietrza na godzinę (pomieszczenie o kubaturze 60 m3 –
10 - 20 wymian w ciągu godziny, powietrze filtrowane przez zespół 3 filtrów)
• Kilkukrotnie filtrowana woda pitna
• Konieczne ubrania ochronne: fartuchy, ochraniacze na buty, czepki,
rękawice

Standardy pracy przy hodowli za wyższą barierą:
• pracownicy przechodzą przez 3-stopniową śluzę:
1. szatnia – zdjęcie wszystkich rzeczy, łącznie z okularami,
2. 20 minutowy prysznic – środek dezynfekujący + woda,
3. założenie jałowego ubrania roboczego,
• pomieszczenia dla zwierząt są monitorowane –
przechodząc z jednego do drugiego należy zmieniać
maskę, rękawiczki etc.,
• osoby pracujące w części hodowlanej nie mogą posiadać
zwierząt domowych, które mają kontakt z gryzoniami,
• osoby z objawami chorobowymi nie mogą przebywać w
części hodowlanej,
• wychodząc przechodzi się przez podobne procedury, ale
bez mycia.
Wszystkie środki ostrożności stosuje się, ponieważ
zwierzęta te mają bardzo słabą odporność i nie posiadają
naturalnej flory bakteryjnej.

Standardy hodowli nad zwierzatami
modyfikowanymi genetycznie




Założenia i problemy badań na modelach transgenicznych
• Podstawowe procesy biologiczne są na tyle podobne u rozmaitych
gatunków, że możliwe jest ich porównywanie
• Model zwierzęcy jest zwykle rozważany z punktu widzenia jego
podobieństwa do modelowanego problemu występującego u
człowieka
• Przedkliniczne modele ludzkich schorzeń nie zostały unormowane
(zestandaryzowane)
• Różnorodne modele zwierzęce są wykorzystywane do badania
patogenezy, zapobiegania lub leczenia tej samej choroby
• Trudno interpretować literaturę lub porównywać wyniki badań,
ponieważ stosowane są bardzo różnorodne i często niewłaściwe
modele
- pożyteczny model zwierzęcy powinien symulować dokładnie
zdefiniowaną chorobę i umożliwić badanie jej etiologii,
podstawowych mechanizmów oraz leczenia
- powinien umożliwiać odkrycie nowych celów terapeutycznych,
rozwój nowych terapii oraz wykorzystanie wyników badań w klinice

Wnioski:
• stopień skomplikowania chorób ludzkich powoduje, że
nawet najlepsze modele zwierzęce tylko w ograniczonym
stopniu symulują procesy chorobowe występujące u
człowieka
• jednakże dobre zrozumienie braków wybranego modelu
zwierzęcego pozwala na prowadzenie skutecznych badań i
opracowywania nowych terapii
Badania opinii publicznej na temat wykorzystania zwierząt
transgenicznych:
- 43% - uważa je za bezpieczne
- 36% - uważa je za niebezpieczne
- 21% - nie ma zdania
To w dalszym ciągu mała ilość pozytywnych opinii, mimo
bardzo szerokiego wachlarza zastosowań badań na
modelach transgenicznych.

Dziękujemy za uwagę

Literatura:
• notatki z wykładów z przedmiotu „biologia zwierząt”, 2012
•
http://laboratoria.net/pl/artykul/12147.html
•
http://bmz.wbbib.uj.edu.pl/documents/2167477/edafd0a0-
105e-49c7-a30e-a1071978e1e7
•
http://pl.wikipedia.org/wiki/Organizmy_modelowe
• http://pollasa.sggw.pl/AHS.pdf
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Modele transgeniczne jak narzędzia badawcze
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Standardy hodowli nad zwierzatami modyfikowanymi genetycznie
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
Wyszukiwarka
Podobne podstrony:
Paradygmaty modele badawcze, Różne pracy z pedagogiki
Jakościowe modele badawcze
Modele badawcze GMO w przebiegu kancerogenezy i chemoprewencji
eures transgraniczny jako wsparcie swobodnego przepływu osób w UE
Biologia systemowa jako paradygmat badawczy teorii inteligentnego projektu
Irena Socha Repertuar jako kategoria badawcza w polskiej nauce o książce (streszczenie)
Urszula Augustyniak, Antyklerykalizm szlachecki w Rzeczypospolitej Obojga Narodów jako problem badaw
Wykład 2 Koszt jako kategoria badawcza BW
transgenderyzm jako zjawisko kulturowe
Małek, Eliza Filtry Wierzchonia jako narzędzie badawcze filologa (2006)
Irena Socha Repertuar jako kategoria badawcza w polskiej nauce o książce (streszczenie) (2)
9 nacjonalizm jako problem badawczy we wspoczesnej polsce
Socjologia wizualna, fotografia jako metoda badawcza Sztompka Piotr
Modele gipsowe jako wizytówka laboratorium protetycznego
Modele dynamiki klastra jako narzędzie badania mozliwosci adaptacyjno rozwojowych klastra
Modele kompetencji jako podstawa rekrutacji i selekcji pracowników
więcej podobnych podstron