
BUDOWA I WŁAŚCIWOŚCI
PIERWIASTKÓW O
CHARAKTERZE BIOLOGICZNYM
MIKROELEMENTY I
MAKROELEMENTY

PIERWIASTKI W
ORGANIZMIE
ŻYWYM I W
LITOSFERZE
Skład chemiczny organizmów żywych
jest jakościowo zupełnie różny od
składu środowiska, w którym te
organizmy żyją. Pierwiastki występują
w przyrodzie w różnych ilościach i
wchodzą w skład różnych związków
chemicznych.
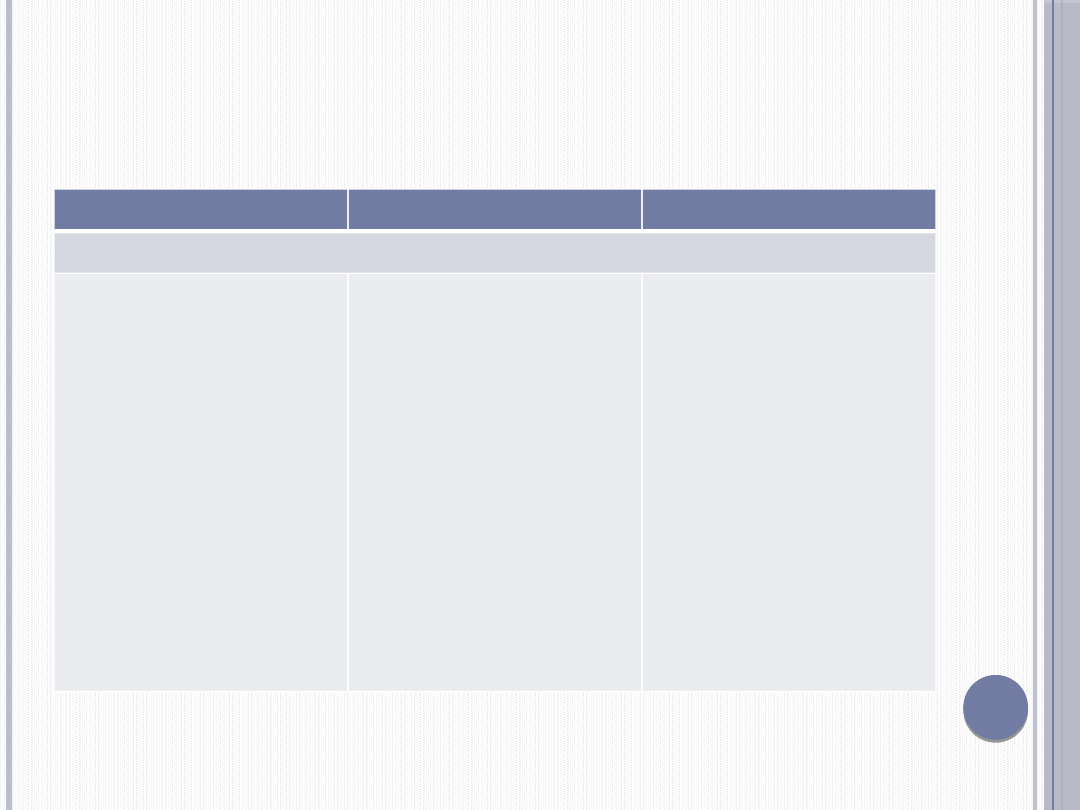
SKŁAD PIERWIASTKOWY LITOSFERY
I ORGANIZMU LUDZKIEGO
Pierwiastek
Litosfera
Człowiek
Procent wagowy
Tlen
Krzem
Glin
Żelazo
Wapń
Sód
Potas
Magnez
Wodór
Węgiel
Fosfor
Siarka
Azot
50
28
9
5
3,6
2,6
2,4
2,1
0,9
0,09
0,08
0,05
0,03
63
-
-
0,004
1,5
0,15
0,25
0,04
10
20
1
0,2
3,1

Procentowa zawartość
pierwiastków jest znacznie
większa w organizmie niż
w litosferze, np.:
Wodoru (H) i fosforu (P) ok.
10 x
Azotu (N) 100 x
Węgla (C) 200 x

Zawartość poszczególnych pierwiastków w
materiałach pochodzenia biologicznego jest
bardzo zróżnicowana.
Każdy z pierwiastków, nawet jeśli występuje
w ilościach śladowych, pełni ważne, często
wielorakie funkcje biologiczne, a jego
niedobór lub brak może mieć poważne skutki
dla organizmu, a dla niektórych granica
między ilością niezbędną a szkodliwą jest
bardzo wąska.
Ze względu na stężenie danego
pierwiastka w organizmie pierwiastek
ten można zaliczyć do jednej z dwóch
grup: MAKROELEMENTÓW lub
MIKROELEMENTÓW.

MAKROELEMENTY
Stanowią łącznie 99,9 % masy ciała człowieka
dorosłego
Węgiel (C)
Wodór (H)
Tlen (O)
Azot (N)
Fosfor (P)
Wapń (Ca)
Potas (K)
Sód (Na)
Siarka (S)
Chlor (Cl)
Magnez (Mg)

MIKROELEMENTY
Ich udział w składzie suchej masy organizmu: 0,01%.
Żelazo (Fe)
Miedź (Cu)
Cynk (Zn)
Kobalt (Co)
Bor (B)
Molibden (Mo)
Mangan (Mn)
Selen (Se)
Jod (I)
Fluor (F)
Krzem (Si)

MAKROELEMENTY

WĘGIEL (C)
Niemetal, ciało stałe
Wchodzi w skład milionów związków
organicznych i odgrywa ogromną rolę w
przyrodzie.
Tworzy złoża węgli kopalnych (mieszaniny
węgla i związków węgla) :
Antracyt
Węgiel kamienny
Węgiel brunatny
Torf

Jako minerał nieorganiczny najbardziej powszechnym
jest wapień CaCO
3
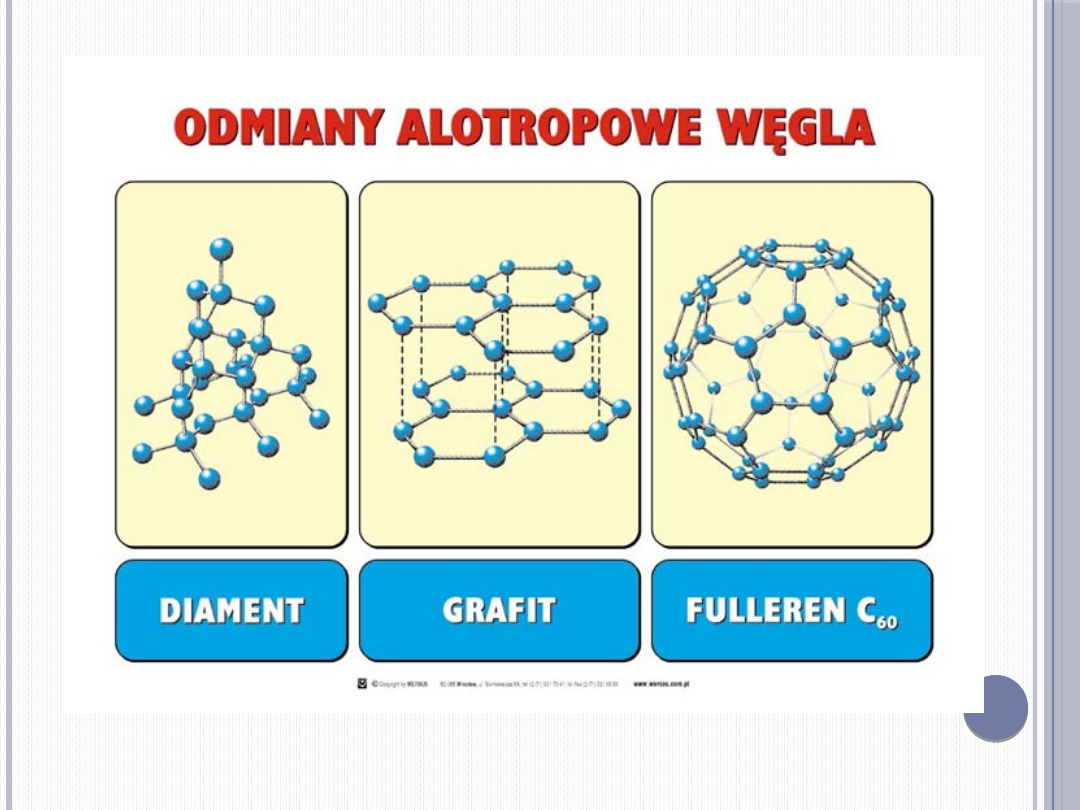
Węgiel tworzy dwie krystaliczne odmiany alotropowe:
diament, grafit i fulleren
Oraz odmiany bezpostaciowe: sadza, koks, węgiel
drzewny
Bez względu na odmianę alotropową, nie rozpuszcza
się w żadnym pospolitym rozpuszczalniku
Elementarny węgiel wydobywa się na ogół z
ziemi, zwykle jako węgiel kopalny, lecz również
jako grafit i diament. Te naturalne formy węgla nie
zawsze nadają się do praktycznego wykorzystania,
opracowano więc przemysłowe metody ich
przekształcania, umożliwiające otrzymanie
pożądanego produktu

ATOM WĘGLA W ZWIĄZKACH
ORGANICZNYCH
Atomy węgla w związkach organicznych są
czterowartościowe
Atomy węgla mogą łączyć się ze sobą, tworząc
wyjątkowo trwałe łańcuchy o dowolnej długości,
proste lub rozgałęzione, pierścienie lub dowolne
kombinacje pierścieni
Atomy węgla w związkach organicznych mogą
łączyć się ze sobą lub z atomami innych
pierwiastków wiązaniami pojedynczymi,
podwójnymi lub potrójnymi
Elektrony nie uczestniczące w wiązaniach pomiędzy
atomami węgla są wykorzystywane do tworzenia
wiązań z atomami innych pierwiastków (zgodnie z
wartościowością).

WODÓR (H)
W stanie wolnym spotykamy go tylko w
górnych warstwach atmosfery, występuje w
postaci
gazowych cząsteczek dwuatomowych H
2
Niemetal
W związkach z węglem występuje np.: w ropie
naftowej, drewnie, tkankach roślinnych i
zwierzęcych
To najlżejszy ze znanych gazów
Bezbarwny
Bezwonny
Prawie nierozpuszczalny w wodzie

OTRZYMYWANIE WODORU
Na skalę przemysłową wodór otrzymuje się
następującymi metodami:
Poprzez konwersję realizowaną
podczas przepuszczania alkanu nad
parą wodną, np. metanu:
C
x
H
2y
+ 2xH
2
O → (2x+y)H
2
+
xCO
2
CH
4
+ 2H
2
O → 4H
2
+ CO
2
Przez reakcję pary wodnej z koksem
w reakcji Boscha:
C + H
2
O → CO + H
2

Termiczny rozpad CH
4
:
2CH
4
–
T=2000 °C
→ C
2
H
2
+ 3H
2
Reakcje metanu z tlenem:
2CH
4
+ O
2
→ 2CO + 4H
2

W laboratorium można go otrzymać na kilka
sposobów:
Elektroliza wodnego
roztworu soli lub wodorotlenku
metalu alkalicznego bądź
wody:
2H
2
O → 2H
2
+O
2
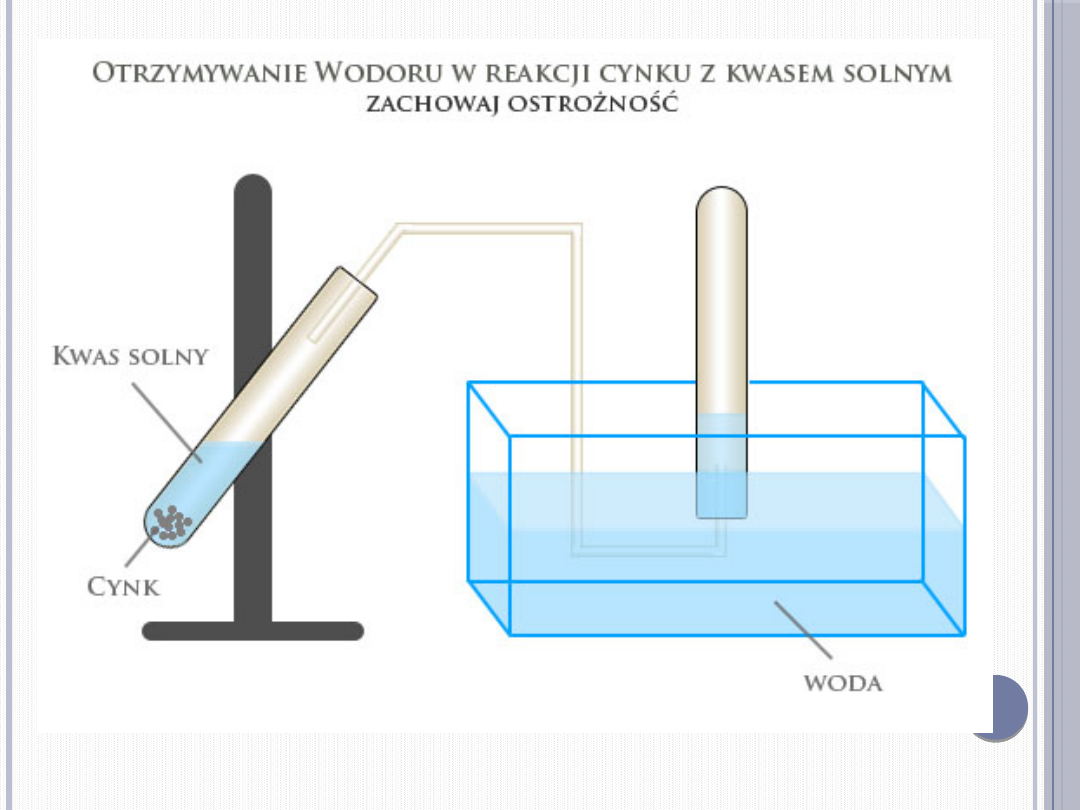
Reakcja metalu z kwasem:
np. Zn + 2HCl → ZnCl
2
+ H
2
↑

Spalanie magnezu w parze
wodnej:
Mg + H
2
O → MgO + H
2
↑
Reakcja
metalu amfoterycznego z
roztworem zasady, np.:
Al + 2NaOH + 6H
2
O →
2Na[Al(OH)
4
] + 3H
2
↑
Powyższe reakcje roztwarzania metali
wykonywać można dogodnie w aparacie Kippa.

TLEN (O)
Niemetal
Tlen w stanie wolnym występuje w
postaci cząsteczek dwuatomowych O
2
W cząsteczkach trójatomowych w
postaci ozonu O
3
(głównie w ozonosferze)
Stanowi 20,95% objętości atmosfery
W postaci związków z innymi pierwiastkami
wchodzi w skład hydrosfery (gdzie jego
zawartość wynosi około 89% – woda) i
litosfery jako tlenki (np. krzemionka (piasek)
zawiera ok. 53% tlenu)

ZNACZENIE BIOLOGICZNE TLENU
Jest to pierwiastek biogenny
W przyrodzie obieg tlenu odbywa
się w cyklu zamkniętym
Jest niezbędny organizmom
tlenowym do
przeprowadzenia fosforylacji
oksydacyjnej będącej
najważniejszym
etapem oddychania.

NIEKTÓRE SPOSOBY
OTRZYMYWANIA TLENU
Poprzez rozkład wodnego
roztworu nadtlenku wodoru (wody
utlenionej lub perhydrolu) pod
wpływem ciepła lub katalizatora,
np. dwutlenku manganu:
2H
2
O
2
→ 2H
2
O + O
2
↑
w wyniku elektrolizy wody:
2H
2
O → 2H
2
↑ + O
2
↑
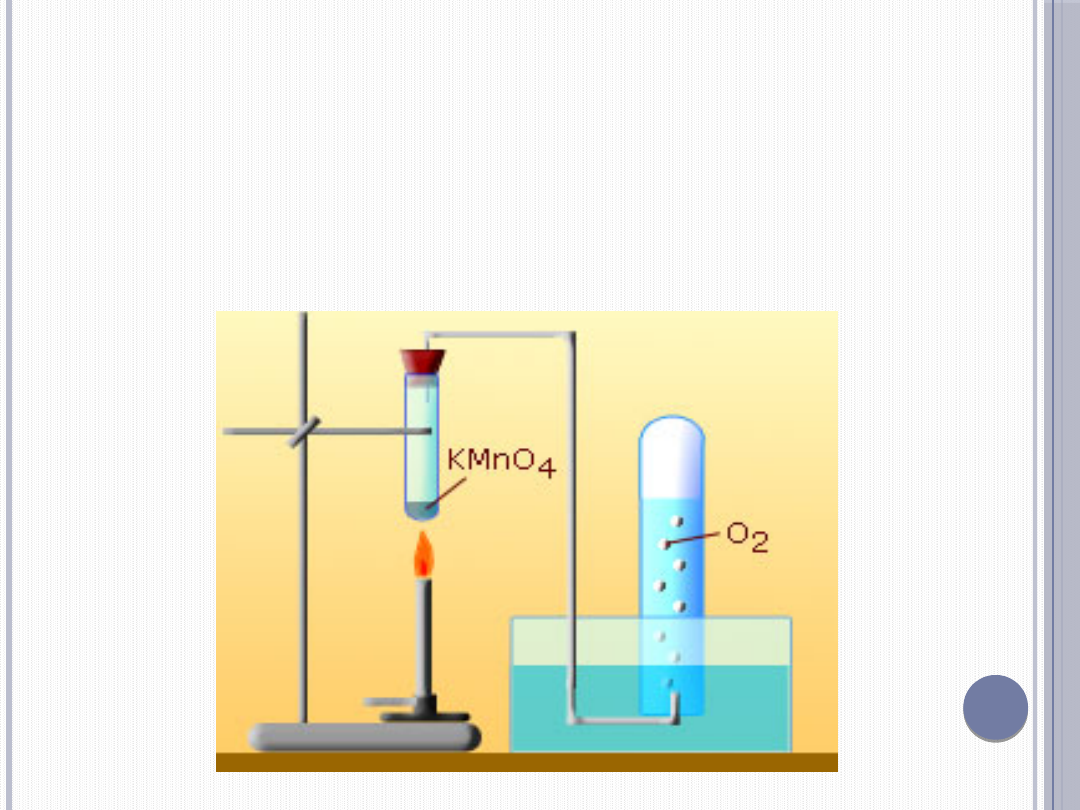
PODGRZEWANIE NADMANGANIANU POTASU W TEMP. POW. 230 °C:
2KMNO
4
→ K
2
MNO
4
+ MNO
2
+ O
2
↑

AZOT (N)
Niemetal
Podstawowy składnik powietrza (78,09%)
W zwykłych warunkach jest gazem o bardzo
trwałych cząsteczkach dwuatomowych N
2
Jest niereaktywny chemicznie
Wchodzi w skład wielu związków: amoniak,
kwas azotowy (V), azotany (V) oraz
ważnych związków organicznych: kwasy
nukleinowe, nukleotydy, aminokwasy,
aminy, amidy, alkaloidy

Naturalnie azot wiązany jest głównie
przez bakterie azotowe w brodawkach roślin
motylkowych oraz w trakcie wyładowań
atmosferycznych
Azot pod normalnym ciśnieniem jest obojętny
dla organizmów żywych. Może jednak wywołać
objawy zatrucia u osób przebywających w
powietrzu o zwiększonym ciśnieniu. W takich
warunkach azot lepiej rozpuszcza się w płynach
ustrojowych i tkankach bogatych w lipidy (np. w
mózgu), co prowadzi do pojawienia się objawów
zatrucia
Jeszcze bardziej niebezpieczne od rozpuszczania
się azotu w tkankach jest jego wytrącanie się w
postaci pęcherzyków gazu, podczas
zmniejszania ciśnienia. Szybkie zmniejszanie
ciśnienia powoduje chorobę kesonową.

OTRZYMYWANIE AZOTU
Azot o wysokiej czystości można uzyskać
poprzez termiczny rozkład azotanu(III)
amonu:
NH
4
NO
2
→ N
2
↑ + 2H
2
O
W laboratorium można otrzymać azot w
wyniku łagodnego
ogrzewania mieszaniny chlorku
amonu (salmiaku) i azotynu sodu:
NH
4
Cl + NaNO
2
→ N
2
↑ + NaCl + 2H
2
O

SÓD (NA)
Metal
Srebrzysty, miękki i kowalny
Bardzo reaktywny
Przechowuję się go w nafcie (jak wszystkie
litowce)
Kationy Na
+
należą do V grupy analitycznej i
barwią płomień na intensywny kolor żółty.

PRÓBA PŁOMIENIOWA SODU

ZNACZENIE BIOLOGICZNE SODU
Jony sodu są głównym kationem
zewnątrzkomórkowym
Bierze udział w gospodarce wodno-
elektrolitowej, wpływając na stan uwodnienia
komórki.
Jako kationy jednowartościowe, wraz z
jonami potasu (K
+
) zwiększają płynność
cytoplazmy
Jony sodowe zachowują prawidłową
pobudliwość komórek (przewodzenie
bodźców nerwowych uzależnione jest od
transportu kationów Na
+
przez błonę aksonu)

OTRZYMYWANIE SODU
Obecnie produkowany jest w
procesie elektrolizy stopionego chlorku
sodu w obecności chlorku
wapnia (dodawanego jako topnik obniżający
temperaturę topnienia mieszaniny poniżej
700 °C).
Metaliczny sód można również otrzymać
podczas elektrolizy wodnego roztworu
chlorku sodu stosując jako katodę - rtęć, z
którą sód tworzy amalgamat.

POTAS (K) I JEGO ZNACZENIE
BIOLOGICZNE
Metal
Reaktywny chemicznie
Kationy K
+
należą do V grupy kationów i
barwią płomień na kolor fioletowy
Bierze udział w przewodzeniu impulsów
przez neuron. Kationy potasu są głównymi
jonami wewnątrzkomórkowymi,
koniecznymi do utrzymania potencjału
czynnościowego błon komórkowych.
Podwyższa stopień
uwodnienia koloidów komórkowych
Aktywator wielu enzymów

WAPŃ (CA)
Metal
Srebrzystobiały
Podobnie jak Na
+
i K
+
musi być
przechowywany w nafcie
Kationy Ca
2+
należą do IV grupy kationów i
barwią płomień na kolor ceglastoczerwony.
Wapń występuje w górnych warstwach
Ziemi


GŁÓWNE MINERAŁY I SKAŁY:
Wapień, marmur, kreda ( CaCO
3
)
Dolomit (MgCO
3
.
CaCO
3
)
Anhydryt (CaSO
4
)
Gips (CaSO
4
.
2H
2
0)
Fluoryt (CaF
2
)
Fosforyty np.: (Ca
3
(PO
4
)
2
Saletra wapniowa (Ca(NO
3
)
2
Kalcyt
Argonit
Apatyt
Krzemiany

ZNACZENIE BIOLOGICZNE
WAPNIA
To pierwiastek szkieletotwórczy, wchodzi w skład kości,
zębów, niektórych ścian komórkowych
Jest składnikiem płynów ustrojowych
Aktywator enzymatyczny
Przekaźnik wtórny – kinazy białkowe
Odpowiada za przewodzenie impulsów
bioelektrycznych;
Bierze udział w krzepnięciu krwi
Bierze udział w skurczu mięśni szkieletowych, gładkich i
mięśnia sercowego
Bierze udział w reakcjach zapalenia i regeneracji
Bierze udział w
wydzielaniu hormonów i neurotransmiterów
Obniża stopień uwodnienia koloidów komórkowych,
cytoplazmy

MAGNEZ (MG)
Metal
Występuje w skorupie ziemskiej pod postacią
minerałów: dolomitu, magnezytu
Magnez można otrzymać
poprzez redukcję tlenku magnezu lub
metodami elektrochemicznymi
Jest niezbędny dla organizmu jako czynnik:
przeciwstresowy, przeciwalergiczny,
przeciwzapalny, ochraniający przed
promieniowaniem jonizującym
Jako aktywator enzymów, bierze udział w
procesach krzepnięcia krwi (hamuje),
tworzenia energii, skurczu mięśni

MIKROELEMENTY

ŻELAZO (FE)
Twardy, srebrzysty metal, ulega pasywacji
Stosowany w formie stopów
W organizmie znajduje się w wielu
ważnych białkach: hemoglobinie, mioglobi
nie, w tym też w centrach aktywnych
licznych enzymów takich
jak: katalaza, peroksydazy oraz cytochromy
Żelazo bierze udział w przenoszeniu tlenu
w organizmie (hemoglobina, mioglobina)
Prawie całe żelazo jest w formie kompleksów
z białkiem (zapasowa, transportowa i
funkcjonalna forma żelaza)

MIEDŹ (CU)
Metal, zaliczany do półszlachetnych
W naturze występuje w postaci rud oraz w
postaci czystej jako minerał
Miedź jest potrzebna do właściwego
wykorzystania żelaza w organizmie, tj: do
uruchomienia rezerw żelaza dla syntezy
hemoglobiny, jest potrzebna do
tworzenia się erytrocytów
Miedź wchodzi w skład enzymów:
oksydazy cytochromowej, tyrozynazy,
oksydazy kwasu askorbinowego

CYNK (ZN)
Błękitnobiały, kruchy metal, w skorupie
ziemskiej występuje w postaci minerałów
Cynk jest składnikiem wielu enzymów
Bierze udział w mineralizacji kości,
gojeniu się ran, wpływa na pracę układu
odpornościowego, prawidłowe
wydzielanie insuliny przez trzustkę oraz
na stężenie witaminy A i cholesterolu.
Cynk odgrywa rolę w funkcjonowaniu
komórek płciowych samców (zwiększa
produkcje plemników)

FLUOR (F)
Niemetal
Fluor w stanie wolnym występuje w postaci
dwuatomowej cząsteczki F
2
Jest żółtozielonym silnie trującym gazem o
ostrym zapachu podobnym do chloru
Fluor jest otrzymywany poprzez elektrolizę
ciekłego fluorowodoru z dodatkiem
wodorofluorku potasu (KHF
2
)
Fluor w odpowiednich ilościach jest pierwiastkiem
niezbędnym dla prawidłowego rozwoju kości i
zębów, bowiem rozpiętość pomiędzy dawką
niezbędną a toksyczną dla człowieka jest
najmniejsza ze wszystkich mikroelementów

PYTANIA
1.
Według jakiego kryterium i jak dzielimy
pierwiastki w organizmach żywych?
2.
Wymień makro- i mikro- elementy.
3.
Podaj znany Ci sposób otrzymywania
wodoru i tlenu.
4.
Podaj znaczenie biologiczne sodu i wapnia.
5.
Podaj znaczenie biologiczne cynku.
Document Outline
- Slide 1
- Pierwiastki w organizmie żywym i w litosferze
- Skład pierwiastkowy litosfery i organizmu ludzkiego
- Slide 4
- Slide 5
- MAKROELEMENTY
- MIKROELEMENTY
- Slide 8
- Węgiel (C)
- Slide 10
- Slide 11
- Atom węgla w związkach organicznych
- Wodór (H)
- Otrzymywanie wodoru
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Tlen (O)
- Znaczenie biologiczne tlenu
- Niektóre sposoby otrzymywania tlenu
- Slide 22
- Azot (N)
- Slide 24
- Otrzymywanie azotu
- Sód (Na)
- Próba płomieniowa sodu
- Znaczenie biologiczne sodu
- Otrzymywanie Sodu
- Potas (K) i Jego znaczenie biologiczne
- Wapń (Ca)
- Slide 32
- Główne minerały i skały:
- Znaczenie biologiczne wapnia
- Magnez (Mg)
- Slide 36
- Żelazo (Fe)
- Miedź (Cu)
- Cynk (Zn)
- Fluor (F)
- Pytania
Wyszukiwarka
Podobne podstrony:
biofizyka, błony, Budowa i właściwości struktur biologicznych zależy nie tylko od właściwości związk
Właściwości i funkcje błon biologicznych
Układ okresowy, a właściwości pierwiastków
Budowa i właściwości kwasów tlenowych
budowa i właściwości białek
BIAŁKA BUDOWA, WŁAŚCIWOŚCI I FUNKCJE
Charakterystyka biologiczna i psychologiczna przemian okresu dojrzewania
AMINOKWASY I BIAŁKA BUDOWA WLASCIWOSCI I FUNKCJE
Budowa komórki, Ratownicto Medyczne, Biologia
Pytania dodatkowe na zajęcia laboratoryjne z KSPD, Budowa, właściwości i zastosowania pomiarowe inte
Oko budowa i właściwości
8. Budowa i rola ukladu pokarmowego, BIOLOGIA SEM I
Budowa szkieletu. Konspekt lekcji Biologii., budowa szkieletu
Budowa chemiczna organizmow, dydaktyka, biologia-praktyki, II gimnazjum
więcej podobnych podstron