
•Glikol
•Gliceryna
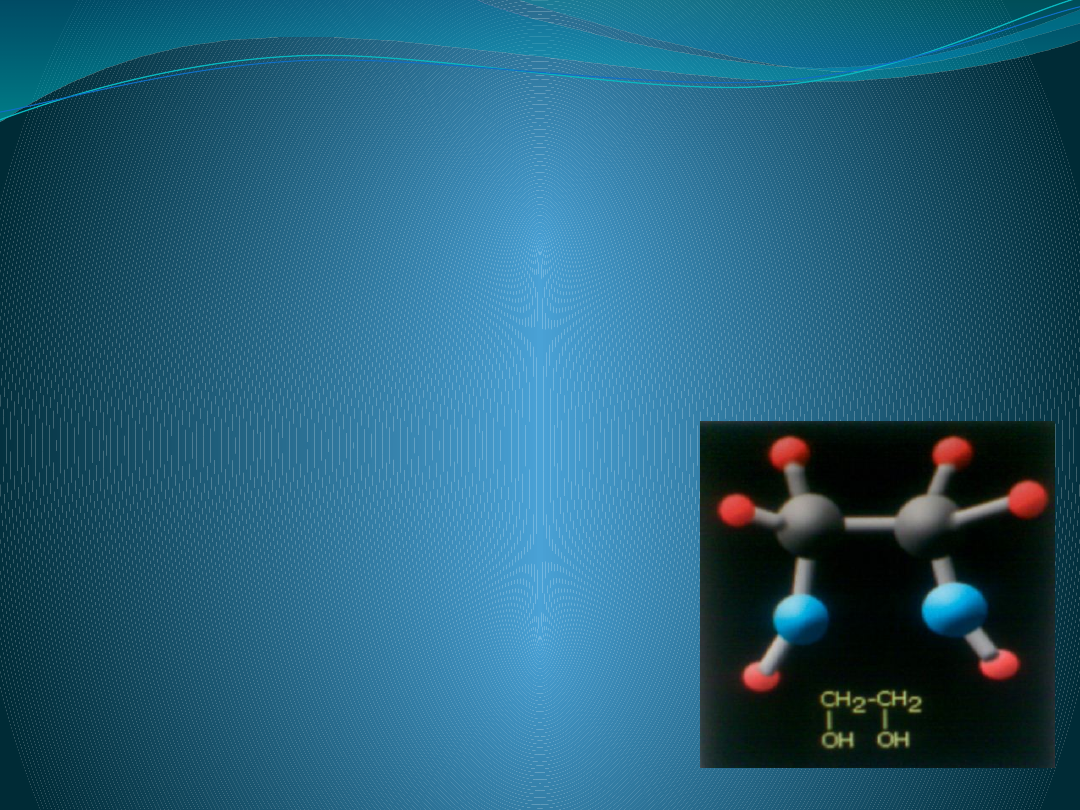
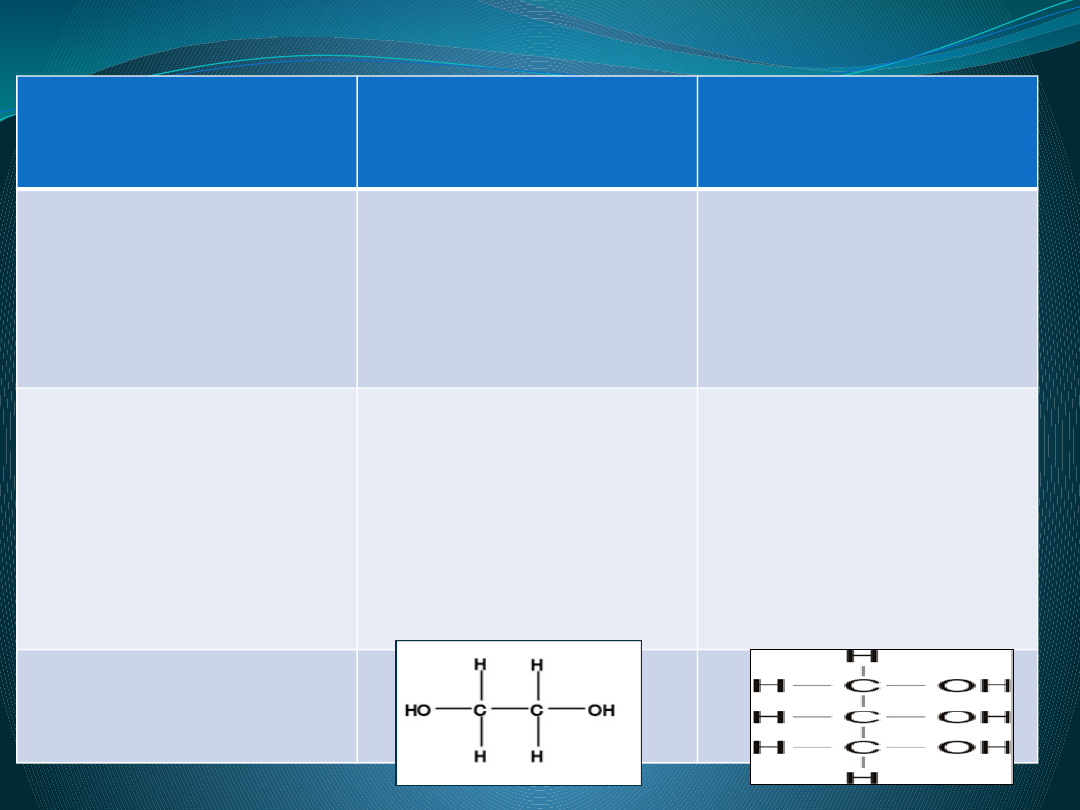
Glikol etylowy
Etanodiol (etano-1,2-diol)czyli glikol etylenowy,
uzyskuje się go przez katalityczne utlenienie
etenu, najprostszy alkohol polihydroksylowy.
Wzór sumaryczny
C2H4(OH)2
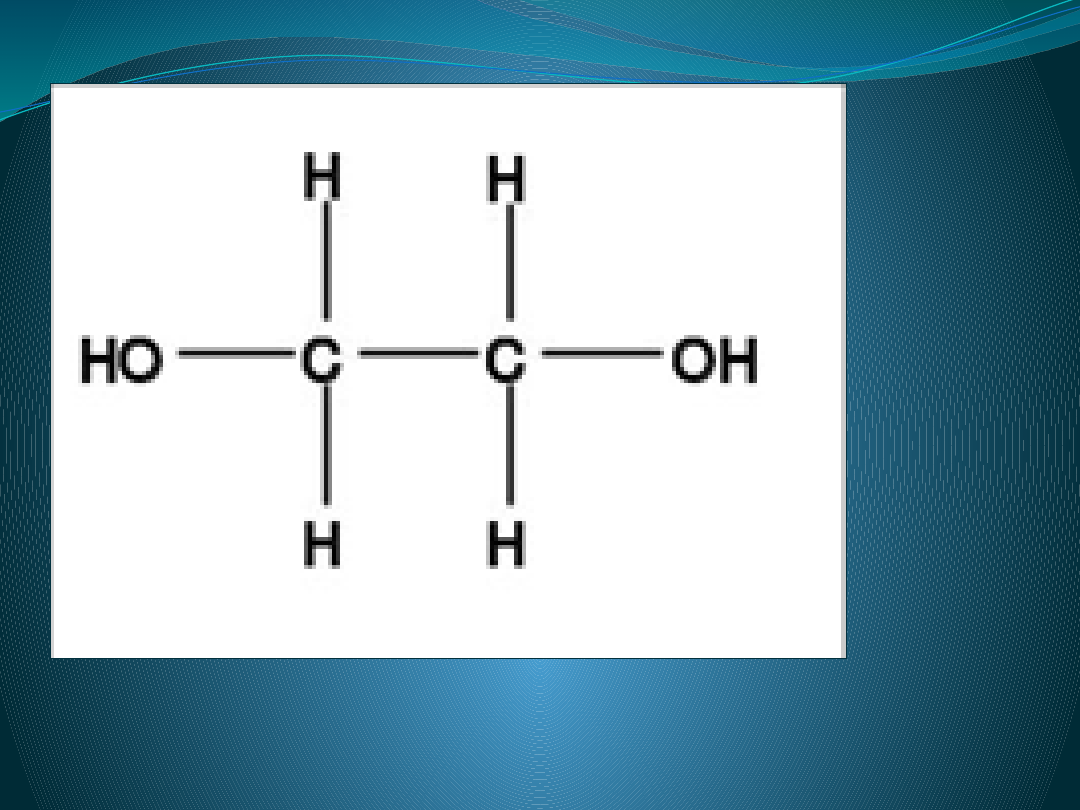
Wzór strukturalny

Nazewnictwo
Takie same jak przy
jednowodorotlenowych, tylko przed
końcówką – ol występuje krotność
występowania grup hydroksylowych i
wymienione są lokanty ich występowania,
np.:
można stosować również nazwy
zwyczajowe: glikol etylowy dla etno-1,2-
diolu lub gliceryna (glicerol) dla propano-
1,2,3-triolu

Właściwości Fizyczne
Bezbarwna ciecz
Dobrze rozpuszcza się w
wodzie
Ma większą gęstość od
wody
Substancja toksyczna
Trujący
Słodki smak
Wysoka temperatura
wrzenia
Reaguje z sodem
Nie reaguje z zasadami
łatwopalny

Właściwości chemiczne
• alkohole wielowodorotlenowe mają większe właściwości kwasowe,
niż alkohole jednowodorotlenowe
•Właściwości zasadowe uwidaczniają się podczas reakcji,
• gliceryna i glikol reagują z metalami alkalicznymi tworząc alkoholany:
gliceryniany i glikolany
•
gliceryna i glikol reagują z wodorotlenkami lub tlenkami metali
ciężkich (np. CuO) dając alkoholany:
• glikol etylenowy ulega utlenieniu do kwasu szczawiowego:

Zastosowani
e
•Składnik samochodowych
płynów chłodzących
•Prekursor polimerów
•Do produkcji żywic
poliestrowych
•Do produkcji żywic
alkidowych
•Włókna
syntetyczne
•Rozpuszczalniki
•Plastyfikatory
•Materiały
Wybuchowe
•Tworzywa
sztuczne

GLICERYNA
Popularna nazwa zwyczajowa glicerolu. Jest to najprostszy alkohol
trójwodorotlenowy (trihydroksylowy). Gliceryna jest gęstą cieczą.
Rozpuszcza się w wodzie i w alkoholu, ale nie rozpuszcza się w
tłuszczach. Pod względem chemicznym należy do alkoholi. Gliceryna
jest rozpuszczalnikiem wielu substancji jak soda czy boraks.
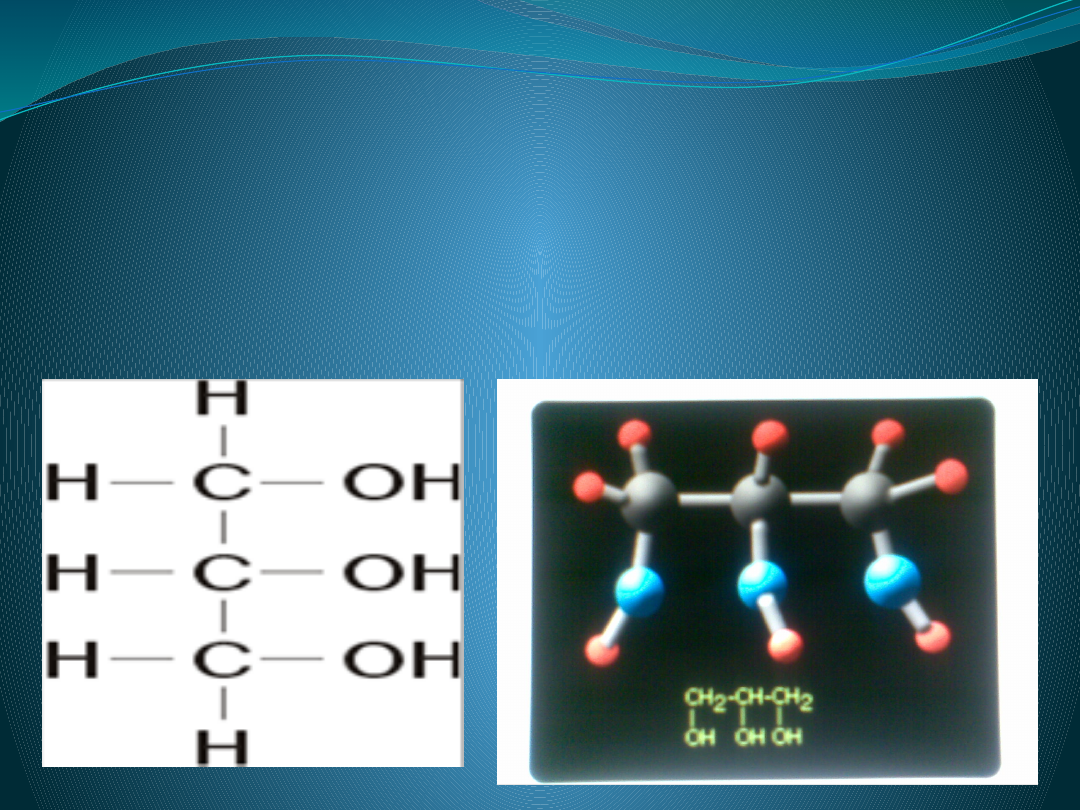
Wzór sumaryczny
C3H5(OH)3
Wzór strukturalny

Właściwości fizyczne
•Syropowata ciecz
•Smak słodki
•Rozpuszczalna w wodzie
•Bezbarwna
•Gęsta
•Nietoksyczna
•Temperatura wrzenia to 290 C
•Spala się w powietrzu jasnożółtym
kopcącym płomieniem
•Ma właściwości higroskopijne

*obecność większej ilości grup
hydroksylowych zwiększa polarność
alkoholi i ich reaktywność
*alkohole polihydroksylowe
(wielowodorotlenowe) mają większe
właściwości kwasowe, niż alkohole
jednowodorotlenowe
*gliceryna reaguje z kwasem
azotowym , tworząc triazotan (V)
glicerolu (nitroglicerynę)
Właściwości chemiczne

Zastosowanie
• Kojące właściwości
• Kosmetyki
• Przemysł spożywczy
• Farmaceutyka
• W przemyśle tekstylnym
• Dodatek do farb
• Rozpuszczalnik
• Środek odwadniający
• Materiały wybuchowe
• Składnik do napełniania
e-papierosów
• Garbarstwo
• Środki czystości
• Płyny hamulcowe

Ciekawostki
•Naukowcy z wrocławskiego Uniwersytetu Przyrodniczego pierwsi w Polsce
wymyślili sposoby wykorzystania gliceryny pozostałej po produkcji biopaliw.
•Podstawowy składnik kremów, tych
drogich i tańszych.
•Unikaj gliceryny w kremach na zimę
•Każda z nas jej używa, nawet nieświadomie. Wystarczy wziąć do ręki
opakowanie pierwszego z brzegu kremu do rąk czy
•pomadki i przeczytać skład.
•gliceryna sprawdzi się jak kosmetyk
na wysuszone końcówki włosów.
•stanowi źródło energii.
GLIKOL
GLICERYNA
Właściwości fizyczne
-ciecz o słodkim smaku
-bezbarwna
-wysoka temperatura
wrzenia(wyższa niż
etanolu)
-syropowata ciecz
-słodki smak
-rozpuszczalna w
wodzie
-właściwości
higroskopijne
Zastosowanie
-Płyny chłodzące
-materiały wybuchowe
-tworzywa sztuczne
-Składnik
samochodowych
płynów chłodzących
-Prekursor polimerów
-kosmetyki
-Farmaceutyka
-Materiały wybuchowe
-środki czystości
-płyny hamulcowe
-przemysł tekstylny
-rozpuszczalnik
Wzór
Tabela porównawcza
WYKONAŁY
Malwina Tatera
Anna Krakowiak
KL.IIIu
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- WYKONAŁY
Wyszukiwarka
Podobne podstrony:
O glikolach i glicerynie
CHEMIA, Zastosowanie Gliceryny, Gliceryna (glicerol; ATC: A 06 AX 01) - organiczny związek chemiczny
chemia, alkeny1, Alkeny ulegają utlenieniu KMnO4 do glikoli
CHEMIA, Zastosowanie Glikolu etylenowego, Glikol (etylenowy), (etano-1,2-diol, C2H4(OH)2, z gr
Chemia labolatorium, Tłuszcze, Skład i budowa cząsteczek tłuszczu - tłuszcze są to estry gliceryny (
Chemia Bionie wyk1
chemia powt
Glikoliza prezentacja (ang)
Wykład Chemia kwantowa 11
wyklad z czwartku chemia fizycz dnia19 marca
chemia(1) 3
Chemia węglowodory
Chemia organiczna czesc I poprawiona
ERGONOMIA chemia
chemia organiczna wykład 6
więcej podobnych podstron