Białka- struktura, poziomy
organizacji, denaturacja i wysalanie.

Czym są białka?
Białka to wielkocząsteczkowe substancje
naturalne - biopolimery. Obok białek
strukturalnych (budulcowych), istnieją białka
regulatorowe: hormony, enzymy i receptory.
Mogą być także pomocnym źródłem energii.
Jednostkami monomerycznymi białek są
aminokwasy.

Skład pierwiastkowy białek
węgiel (C): 50 – 55%
azot (N): 15 – 18%
tlen (O): 19 – 24%
wodór (H): 6 – 8%
siarka (S): 0,3 – 3%

Podział białek
W zależności od swoich właściwości fizyko-chemicznych oraz
pełnionych funkcji białka dzielimy na: Białka (ze względu na
komplikację budowy):
- proste (cząsteczki są zbudowane wyłącznie z łańcuchów
polipeptydowych)
- złożone (cząsteczki zawierają oprócz łańcuchów polipeptydowych,
trwale wbudowany składnik niepeptydowy Np.: jon metalu -
hemoglobina)
- część białkowa - apoenzym
- część niebiałkowa - koenzym

Białka proste
Zbudowane są wyłącznie z aminokwasów.
Dzielimy je na następujące grupy:
1. protaminy
2. histony
3. albuminy
4. globuliny
5. prolaminy
6. gluteliny
7. skleroproteiny

Białka złożone:
1. chromoproteiny
2. fosfoproteiny
3. nukleoproteiny
4. lipidoproteiny
5. glikoproteiny
6. metaloproteiny

Struktury białek
Pierwszorzędowa
Drugorzędowa
Trzeciorzędowa
Czwartorzędowa
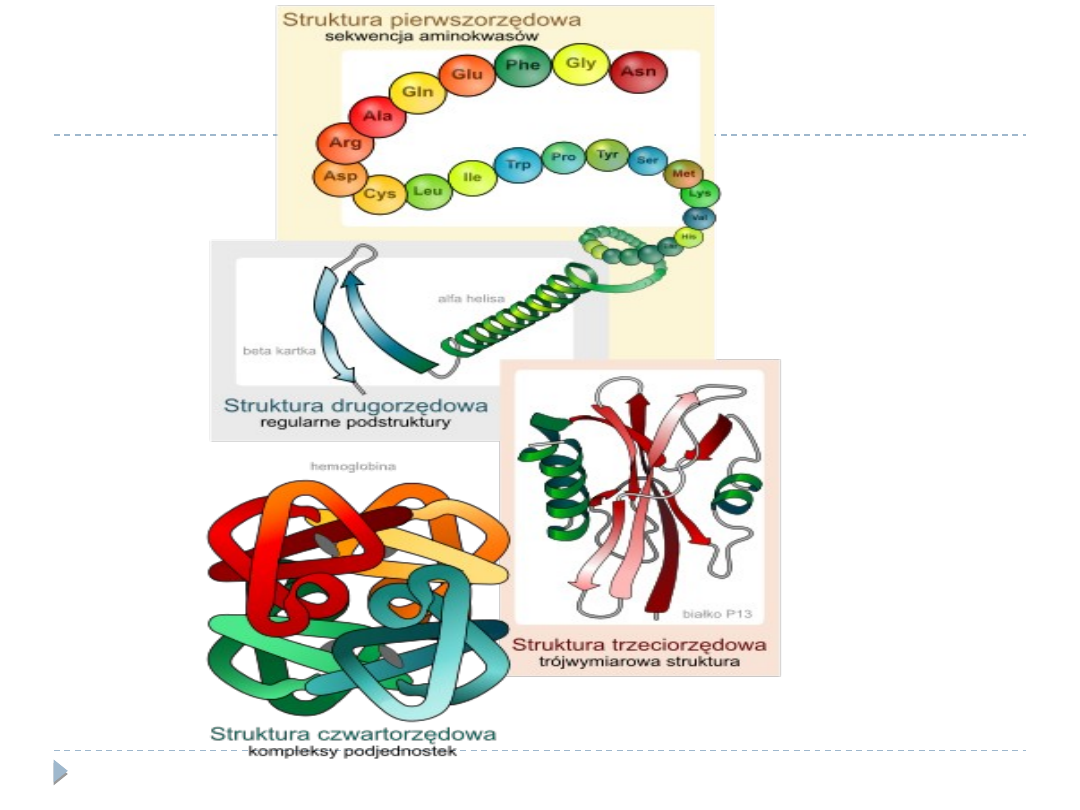

Struktura pierwszorzędowa białka
Czyli najniższy poziom organizacji strukturalnej cząsteczki
jest wyznaczona przez sekwencję aminokwasów w łańcuchu
polipeptydowym. Jest ona uwarunkowana jeszcze zanim
zostanie zsyntetyzowany łańcuch polipeptydowy, gdyż
informacja o kolejności aminokwasów w cząsteczce białka
jest zakodowana w DNA, w postaci sekwencji nukleotydowej.
Dzięki procesom transkrypcji, a później translacji sekwencja
nukleotydowa zostaje odczytana w trakcie syntezy
odpowiedniego polipeptydu.

Struktura drugorzędowa białka
Odpowiada przestrzennemu ułożeniu atomu węgla alfa i
grup tworzących wiązania peptydowe w przestrzeni;
strukturę tę warunkują: polarność, sztywność wiązania
peptydowego i wiązania wodorowe; wyróżnia się trzy typu
konfiguracji głównego łańcucha: struktura β – przypomina
wyglądem pofałdowaną kartkę; utworzona jest przez dwa
łańcuchy polipeptydowe lub dwa fragmenty tego samego
łańcucha; konformację tę stabilizują wiązania wodorowe,
które powstają pomiędzy grupami –CO i –NH sąsiednich
łańcuchów położonych obok siebie;
struktura α – kształtem przypomina cylinder zbudowany z
ciasno, prawoskrętnie skręconej sprężyny;
struktura kolagenu.


Struktura trzeciorzędowa białka
Powstaje w wyniku oddziaływania
poszczególnych reszt aminokwasowych
pomiędzy sobą. Oprócz wiązań wodorowych,
mogą zostać utworzone tzw. "mostki solne" -
w reakcji pomiędzy grupami funkcyjnymi
pochodzącymi od aminokwasów kwaśnych
(Np.: kwas glutaminowy) i zasadowych (Np.:
arginina).

Struktura czwartorzędowa białka
Białka złożone z więcej niż jednego łańcucha
polipeptydowego; przestrzenny układ
wszystkich łańcuchów polipeptydowych
danego białka.

Wiązania w strukturze III i IV–rzędowej
warunkowane są przez:
wiązania S–S (mostki dwusiarczkowe);
wiązania jonowe (wzajemne oddziaływania pomiędzy
bocznymi łańcuchami aminokwasów zasadowych i
kwasowych);
wiązania hydrofobowe (oddziaływanie niepolarnych grup
łańcuchów bocznych aminokwasów niepolarnych);
siły van der Waalsa (oddziaływania elektrostatyczne,
przyciągające lub odpychające);
wiązania generowane przez metale, najczęściej
dwuwartościowe, które wiązaniem koordynacyjnym łączą się
z połączeniami bocznymi aminokwasów.

Denaturacja białek
Jest to zjawisko nieodwracalne; wywołuje się je
czynnikami chemicznymi (stężone kwasy,
zasady), czynnikami mechanicznymi (np. UV);
białko ulega też koagulacji, czyli denaturacji na
ciepło; denaturacja niekoniecznie musi być
związana z koagulacją.
Towarzyszą jej zmiana właściwości
makroskopowych białek: wzrasta lepkość, zmienia
się skręcalność światła spolaryzowanego i
rozpuszczalność w punkcie izoelektrycznym ,
następuje utrata właściwości biologicznych,
modyfikacja reszt aminokwasowych, wreszcie
nieodwracalna
(ścinanie się białka).

Wysalanie białek
Inaczej wytrącanie białek.
To odwracalny proces koagulacji polegający na
zmniejszeniu wzajemnych oddziaływań
cząsteczek białek i wody w wyniku
wprowadzenia do roztworu jonów określonej
soli, np. (NH
4
)
2
SO
4
,NaCl, Na
2
SO
4
(jony te silniej
niż cząsteczki białka oddziałują z
cząsteczkami wody --> niszczenie
stabilizującej białko otoczki hydratacyjnej).
Dodanie rozpuszczalnika spowoduje przejście
białka w stan zolu, czyli peptyzację.
Document Outline
- Slide 1
- Czym są białka?
- Skład pierwiastkowy białek
- Podział białek
- Białka proste
- Białka złożone:
- Struktury białek
- Slide 8
- Struktura pierwszorzędowa białka
- Struktura drugorzędowa białka
- Slide 11
- Struktura trzeciorzędowa białka
- Struktura czwartorzędowa białka
- Wiązania w strukturze III i IV–rzędowej warunkowane są przez:
- Denaturacja białek
- Wysalanie białek
Wyszukiwarka
Podobne podstrony:
Bialka ich struktury i poziomyorganiazacji
STRUKTURA I ZAŁOŻENIA ORGANIZACYJNO TECHNICZNE SYSTEMU ŁĄCZNOŚCI RATOWNICTWA I ZARZĄDZANIA KRYZYSOWE
POZIOMY ORGANIZACJI I FUNKC, Inne
Procesy umysłowo poznawcze i ich poziomy organizacji
Poziomy organizacji życia wykład
Komórka jako elementarna jednostka strukturalna i funkcjonalna organizmu
POZIOMY ORGANIZACJI w przyrodzie
W7 Białka struktura i funkcja
Struktura mechanistyczna i organiczna
Plan cwiczen ze Struktury i Funkcji Organizmu 2010, Biologia 2010, Rok I, Semestr I, SiFO Zwierząt
Wymień poziomy organizacji życia organizmów, Ogrodnictwo, II semestr, ekologia i ochrona środowiska
Zrównoważony rozwój na poziomie organizacji
Bialka struktury przestrzenne
Komórka jako podstawowa jednostka strukturalna i funkcjonalna organizmu, Ratownictwo Medyczne(1), bi
Struktury i zasady organizacji jednostek systemu ratownictwa, Kwalifikowana Pierwsza Pomoc
Agencje reklamowe i ich struktura, technik organizacji reklamy, Dokumenty - Organizacja Reklamy
struktura mechanistyczna i organiczna 2
więcej podobnych podstron