
Materiały do
ćwiczeń
z farmakologii dla
studentów WWL
semestr 1
rok 2015/16
zaktualizowany 1.10.2015

Ćwiczenia nr 4 -8

1/leki przeciwlękowe (anksjolityki) i uspakajające
2/leki nasenne
3/leki przeciwdepresyjne
4/leki neuroleptyczne ( neuroleptyki)- o dominującym
działaniu przeciwurojeniowym i przeciwomamowym, także
uspokajającym, hamującym psychofizyczne pobudzenie
5/leki normotymiczne - leki stabilizujące nastrój i napęd
psychoruchowy
6/leki nootropowe i prokognitywne - leki aktywizujące i
usprawniające procesy ośrodkowego układu nerwowego ,
korzystnie wpływające na procesy poznawcze
Leki psychotropowe
- podział

Neuroprzekaźniki OUN
1/ HAMUJĄCY
GABA (receptor GABA A,
GABA B
)
2/ POBUDZAJĄCE
kwas glutaminowy ( receptory NMDA)
kw. asparaginowy

1/ Anksjolityki – leki p/lękowe
I/ benzodiazepiny (podstawowa grupa leków
p/lękowych … ale czy podstawowa w leczeniu
zaburzeń lękowych?)
II/ inne (buspiron, hydroksyzyna)
III/barbiturany – obecnie stosowane z innych wskazań !!!
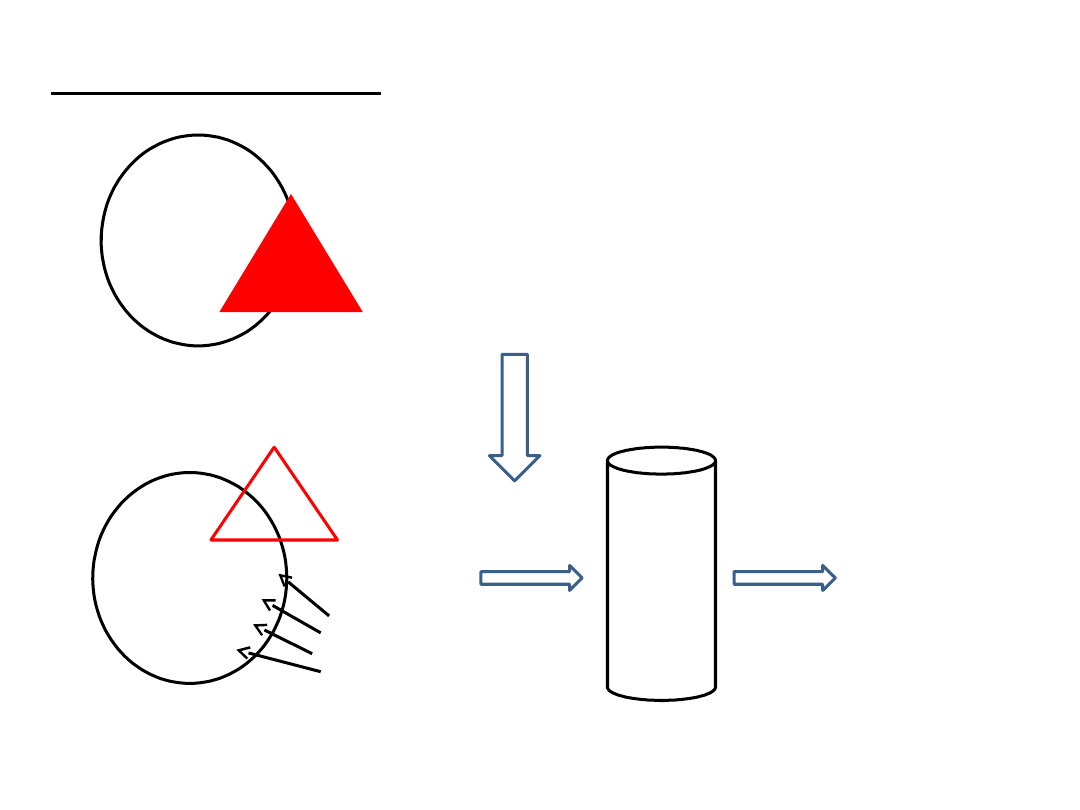
Recept
or
GABA A
„receptor BZD”
+ BZD
Recept
or
GABA A
GABA
BZD
Cl-
Cl-
Cl-
hiperpolaryzacja
błony komórkowej,
zmniejszona
aktywność
neuronalna
Benzodiazepiny – mechanizm działania

Benzodiazepiny wywierają działanie:
p/lękowe
uspokajające ( sedacja)
nasenne ( skrócenie czasu wystąpienia snu, zmniejszenie ilości
wybudzeń, skracają fazę REM, wydłużają non-REM
– ogólnie: skracają fazy snu konieczne do
regeneracji mózgu)
rozluźniające mięśnie ( miorelaksacyjne)
p/drgawkowe ( głównie długodziałające)
amnestyczne ( niepamięć wsteczna)
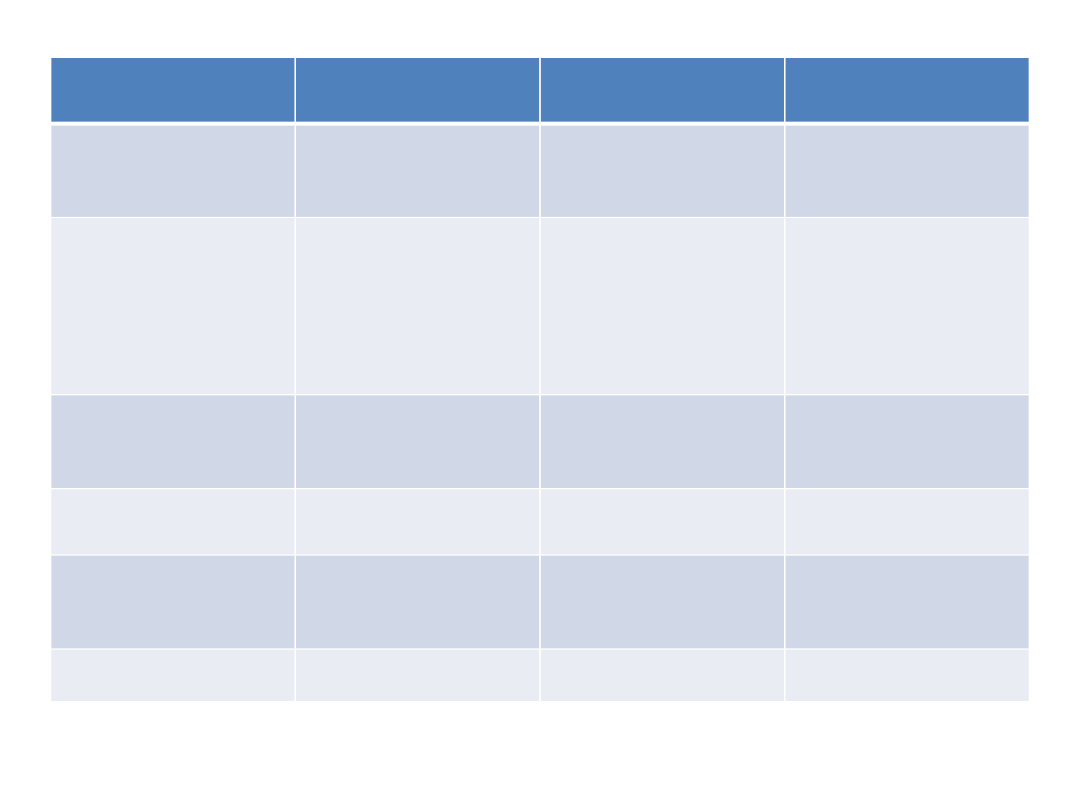
Wskazanie
kliniczne
Cel
podania/uwagi
lek
Drogi podania
zaburzenia lękowe przerwanie ostrej
reakcji lękowej,
„zakręt życiowy”
p.o
i.m.
i.v
bezsenność
obecnie
NIEZALECANE, ale
nie przerywać
nagle u pacjentów
przewlekle
przyjmujących
nitrazepam,
estazolam,
midazolam,
lorazepam
napad
padaczkowy,
napad drgawkowy
przerwanie
napadu
klonazepam
diazepam
i.v.
per rectum, i.m.,
i.v.
AZA
leczenie objawów
odstawiennych
diazepam
p.o. , rzadziej i.v.
premedykacja
przed zabiegami
diagnostycznymi,
chirurgicznymi
midazolam
diazepam
p.o., i.v.
Wg rekomendacji WHO 1996 ( obowiązujące do dziś) były zalecane u pacjentów
z zamiarami samobójczymi – obecnie jest to raczej przeciwwskazanie
Wskazania kliniczne do BZD
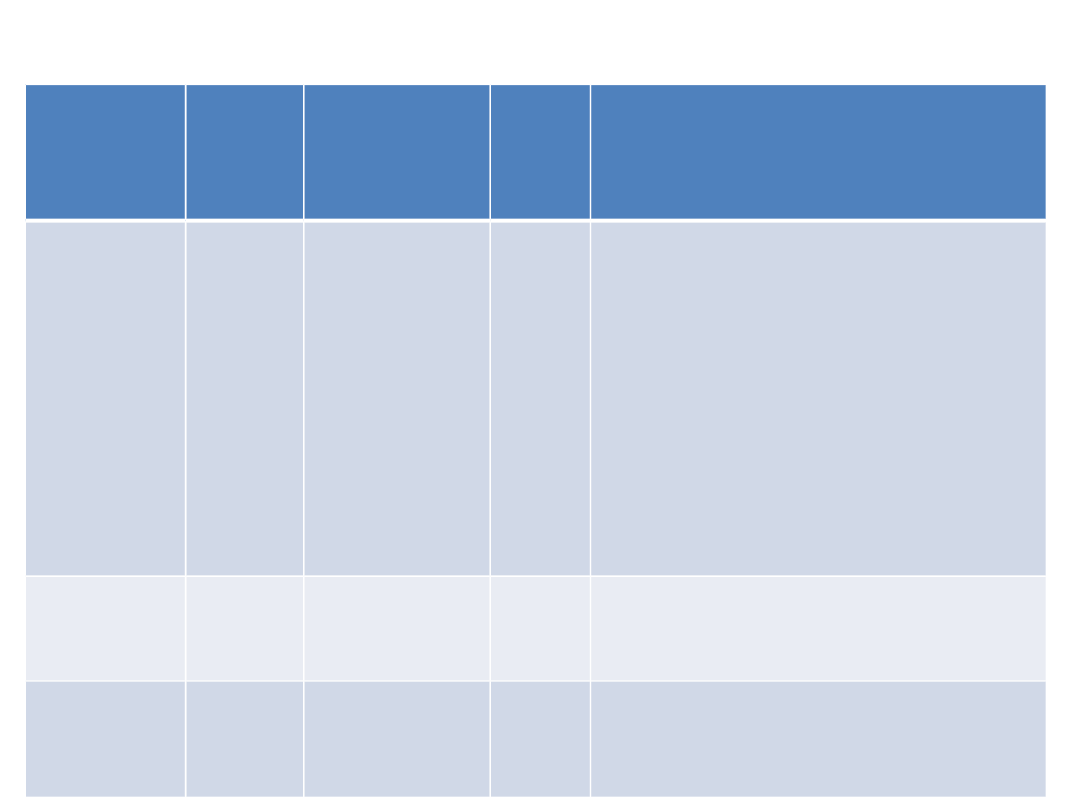
lek
T1/2
(h)
wskazania Czas
dział
ania
(h)
Preparaty handlowe
diazepa
m
20-40
lęk,
drgawki,
premedyka
cja
>24
•Relanium – tabl 0.002; 0.005
•Relanium -amp -0.01,
zaw.doust
2mg/5ml
•Relsed – wlewki doodbyt-
0.005; 0.01
•Diazepam Desitin–roztw.
doodbyt-
0.005;
0.01
klonazep
am
20-40
padaczka,
drgawki
>24
Clonazepamum - tabl 0.0005;
0.002
amp. 0.001
klorazep
at
5*
lęk
długodzi
ał
ający
metabol
it)
Cloranxen; Tranxene 5; 10mg
Benzodiazepiny
długodziałające
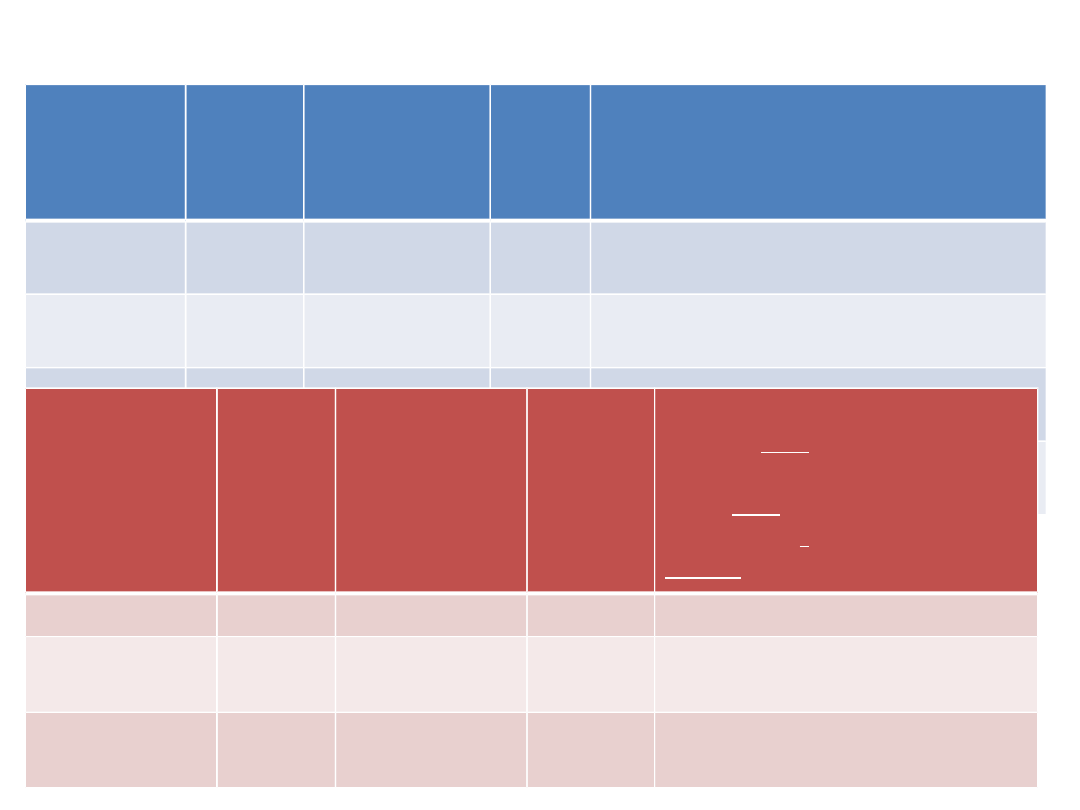
lek
T1/2
(h)
wskazania Czas
dział
ania
(h)
medazep
am
lęk
Rudotel, Medazepam – tabl
0.01
lorazepa
m
2-6
lęk
15-30 Lorafen – tabl 0.001; 0.0025
nitrazepa
m
bezsenność
??
4-15
Nitrazepam – tabl 0.005
estazola
m
10-20 bezsenność
??
18
Estazolam – tabl 0.002
Benzodiazepiny
średniodługodziałające
alprazolam 6-12
lęk,
24
Afobam – tabl 0.25;
0.5; 1 mg
Xanax – tabl 0.25; 0.5;
1; 2 mg
XanaxSR tabl 0.5;1; 2
mg**
oksazepam
8-12
lek
12- 18
Oxazepam –tabl 0.01
temazepam 8-20
bezsen-
ność
9-12
Signopam – tabl 0.01
bromazepa
m
3-15
lęk
15
Lexotan 3; 6 mg
**SR – forma o przedłużonym uwalnianiu
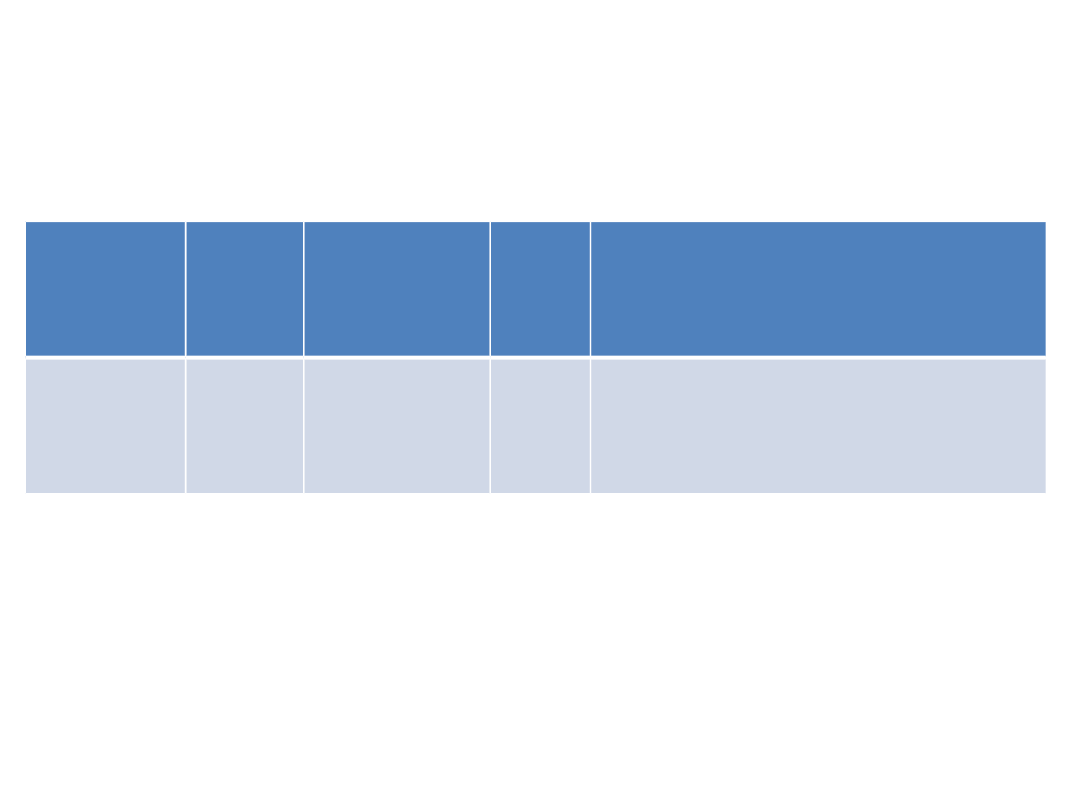
lek
T1/2
(h)
wskazania Czas
dział
ania
(h)
midazola
m
2
premedyka
cja
bezsenność
??
18
Dormicum – tabl 0.0075; 0.015
Midanium - amp- 0.005, 0.015;
Benzodiazepina krótkodziałająca
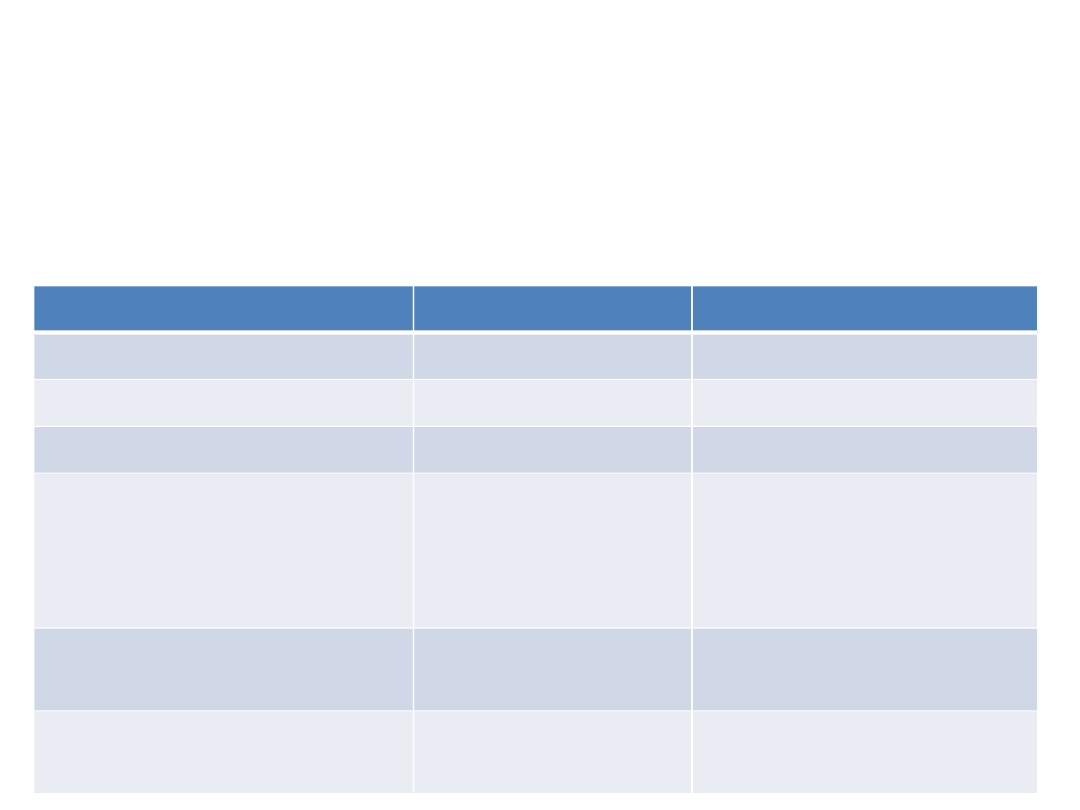
Różnice pomiędzy BZD krótko- i długodziałającymi
długodziałające
krótkodziałające
ryzyko uzależnienia
mniejsze
DUŻE
objawy odstawienne jw
jw
lęk z odbicia
jw
jw
czas od odstawienia
do wystąpienia
objawów
odstawiennych
10 dni
2 dni
czas trwania
objawów
kilka tygodni
kilka dni
ryzyko kumulacji
duże
małe

Działania niepożądane:
uzależnienie
tolerancja
zespół „z odbicia”
zawroty głowy, zmęczenie, senność, ataksja,
dyzartria
zaburzenia czynności intelektualnych i
ruchowych
(spowolnienie ruchowe osłabienie refleksu
wzrost ryzyka upadków /złamań ( zwłaszcza
starsi)
zaburzenia poznawcze ( zwłaszcza starsi,
przewlekle)
zwiększają ryzyko sercowo-naczyniowe
( przewlekle)
paradoksalne odhamowanie ( dzieci, starsi) –
wzrost
pobudliwości, agresji
Przy przedawkowaniu
śpiączka
potencjalna tylko możliwość depresji ośrodka
oddechowego –
są to leki relatywnie bezpieczne

Uzależnienie
–
psychiczny i/lub fizyczny
stan konieczności przyjmowania substancji w
celu doświadczenia jej wpływu na psychikę,
a także uniknięcia przykrych objawów
towarzyszących jej brakowi.
Ujawnia się również szkodliwy wpływ środka
uzależniającego na osobowość jednostki
i jej otoczenie

Zespół z odbicia –
nasilenie
objawów
występujących przed leczeniem np.
lęk
pobudzenie
zaburzenia snu
napady drgawkowe, padaczka (
głównie
klonazepam
)
Przy nagłym przerwaniu nawet krótkiej
terapii, głównie
BZD krótkodziałającymi - dlaczego??)))))

Zespół z odbicia
–
lek, niepokój dysforia
pobudzenie
zaburzenia snu, koszmary
napady drgawkowe, padaczka
( głównie
klonazepam)

OBJAWY ZESPOŁU ABSTYNENCJI –
dot.osób uzależnionych
dysforia
łzawienie, katar
bezsenność, uporczywe ziewanie
nadmierne pocenie , zlewne poty
wzrost ciśnienia tętniczego
drżenia mięśniowe
bolesne skurcze jelit
jadłowstręt
dezorientacja, zaburzenia świadomości, ( starsi)
stany deliryczne
drgawki
zapaść

Interakcje BZD
( wybrane):
z substancjami DZIAŁAJACYMI
DEPRESYJNE NA OUN tj.
środki znieczulenia ogólnego
leki nasenne
opioidy
leki zwiotczające
leki p/drgawkowe
alkohol
leki antyhistaminowe

Leki nasenne nowej generacji, tzw. leki
„Z”
agoniści receptora BZD-owego, ale nie będący BZD
Stosowane tylko jako leki nasenne!!!
Uzależniają!!!
•Zolpidem
•Zopiklon
•Zaleplon

Dobrze byłoby uzmysłowić sobie:
Czy BZD działają objawowo czy przyczynowo?
Dlaczego aktualnie, w doraźnym „leczeniu” bezsenności, preferowane są leki Z ?
Czy BZD są skuteczne i bezpieczne? Kiedy tak, kiedy/u kogo nie?
Jakie są zasady ich bezpiecznego stosowania?
Czy powodują depresję oddechowego?
Co to jest – zjawisko tolerancji, uzależnienie, kumulacja, zjawisko z odbicia,
zespół abstynencyjny?
Jaka jest zależność między tolerancją a objawami abstynencyjnymi i
uzależnieniem ?
Czy przyjmując BZD można mieć zespół abstynencyjny?
Czy mogą powodować drgawki?
Jakie jest ich miejsce w leczeniu zaburzeń lękowych?
Czym można tłumaczyć ograniczenie ich stosowania u pacjentów z tendencjami
samobójczymi?
Jakie są odmienności w pisaniu recept na BZD i zolpidem - z czego one wynikają?
Jakie są różnice między BZD a hydoksyzyną i buspironem
(np. w mechanizmie działania,
uzyskiwanych efektach, bezpieczeństwie stosowania)

Rp.
Xanax 0.001
in tabulettis No 20
(dwadzieścia miligramów)
S. 1 x 1 tabl
Przykładowy sposób pisania recepty na BZD i
niebenzodiazepinowe leki nasenne
Na podst. Rozp. Min. Zdrowia z dnia 21.08.2014 zmieniającego rozporządzenie w sprawie
środków odurzających , substancji psychotropowych …
„Recepta wystawiona na preparaty zawierające
środki odurzające lub substancje
psychotropowe zawiera oprócz danych …
sumaryczną ilość środka … wyrażoną
słownie
albo
ilość środka wyrażoną słownie
za pomocą ilości jednostek dawkowania oraz
wielkości dawki „

II/
•Hydroksyzyna
•Buspiron
Mechanizmy nie związane z przekaźnictwem GABA-ergicznym
( jakie?)
Wady , zalety ( jakie?)

III/ barbiturany
Mechanizm działania : agoniści rp. GABA A
OBECNIE NIE SĄ STOSOWANE JAKO LEKI P/LĘKOWE;
USPOKAJĄCE ze względu na liczne i niebezpieczne
działania niepożądane:
depresja ośrodka oddechowego
działanie kardiodepresyjne
uzależnienie , tolerancja
niski wskaźnik terapeutyczny
indukują cytochrom P-450
senność, koszmary nocne
niemożność wykonywania precyzyjnych czynności ruchowych
ataksja
Stosowane jako leki p/drgawkowe ( Fenobarbital) i środki znieczulenia
ogólnego
( Tiopental)

4/ leki p/padaczkowe
- mechanizmy
działania :
1/blokada napięciowozależnych kanałów
sodowych
karbamazepina, (okskarbamazepina)
kwas walproinowy
fenytoina
lamotrigina
2/ nasilenie hamowania synaptycznego za pośrednictwem GABA
barbiturany
( i dezoksybarbiturany)
benzodiazepiny
wigabatryna, tiagabina, pregabalina, gabapentyna i in
3/ zapobieganie wnikaniu jonów Ca⁺²
4/ zmniejszenie przekaźnictwa
glutaminergicznego/asparaginianowego poprzez np.
blokowanie receptorów NMDA
Najczęściej leki przeciwpadaczkowe mają kilka mechanizmów
działania, tylko któryś z wymienionych dominuje

Co warto przemyśleć:
Które leki p/padaczkowe są stosowane przewlekle, a które doraźnie do
przerwania napadu drgawek?
Czy tylko padaczka jest wskazaniem do nich?
Jak zmniejszać ryzyko działań niepożądanych?
Co rozumiesz pod pojęciem „dawka pożądana „ leku p/padaczkowego?
Leki p/padaczkowe u kobiet – o czym należy pamiętać?
A w przyszłości:
Czy leki p/padaczkowe mają znaczenie w leczeniu bólu, a jeśli tak - to jakiego?

2/Leki przeciwdepresyjne
Cel działania:
zwiększanie ilości neuromediatorów (głównie 5HT, NA,
D) w szczelinie synaptycznej
osiągane jest to na drodze wielu mechanizmów

Noradrenalina ( NA)
•sen, czuwanie, koncentracja uwagi
•ukł. krążenia – pobudzenie
Receptory α1 i α2
Pobudzenie receptora α1 (
post
synaptyczny) powoduje AKTYWACJĘ układu współczulnego
Pobudzenie receptora α2 ( głównie
pre
synaptyczny) powoduje ZAHAMOWANIE *aktywacji
układu współczulnego
*ZAHAMOWANIE aktywacji układu współczulnego zachodzi też poprzez wchłanianie zwrotne
NA ze szczeliny synaptycznej ( reuptake) oraz przez rozkład NA przez enzymy ( MAO,
COMT)
Dopamina ( D)
Regulacja :
procesów ruchowych– ukł. pozapiramidowy,
emocji - ukł. limbiczny,
wydzielanie hormonów gł. prolaktyny -
podwzgórze
Uogólniając pobudzenie rp. D powoduje
pobudzenie motoryczne i emocjonalne

5-HT (5- hydroksytryptamina,
serotonina)
sen
emocje
pobudzenie ruchowe
popęd seksualny
łaknienie
moduluje ból
Rozkładana przez MAO-A

Receptory dla serotoniny
( wybrane):
5-HT1 – (autoreceptory, receptory hamujące)
ich pobudzenie osłabia przekaźnictwo
serotoninergiczne
5HT2 - ich pobudzenie nasila
przekaźnictwo
serotoninergiczne
( ponadto zablokowanie 5HT2 – zmniejsza
uwalnianie D (
patrz: neuroleptyki atypowe
)

Acetylocholina (Ach)
ruch, emocje, sen/czuwanie, pamięć
Ogólnie: w OUN wywiera działanie pobudzające
receptory M i N
W jakich chorobach OUN wykorzystuje się leki
działające przez receptory M?

chor. Alzheimera
(zwyrodnienie neuronów
produkujących Ach- jej prawidłowa ilość
warunkuje procesy
uczenia się i funkcjonowania mózgu)
–
jedną z grup leków są leki
pobudzające rp. M
choroba Parkinsona (niedobór D w
OUN) –
jedną z grup leków są antagoniści
rp. M
(wykorzystywany antagonizm
pomiędzy Ach i D)
neuroleptyki, leki p/depresyjne
( TLPD) – mają
działanie cholinolityczne (są
antagonistami rp.
M)- głównie działania niepożądane

Histamina ( H)
receptory H1 i H2
neuroleptyki, TLPD – blokują rp. H1
(działanie antyhistaminowe)
działanie uspokajające
wzrost masy ciała
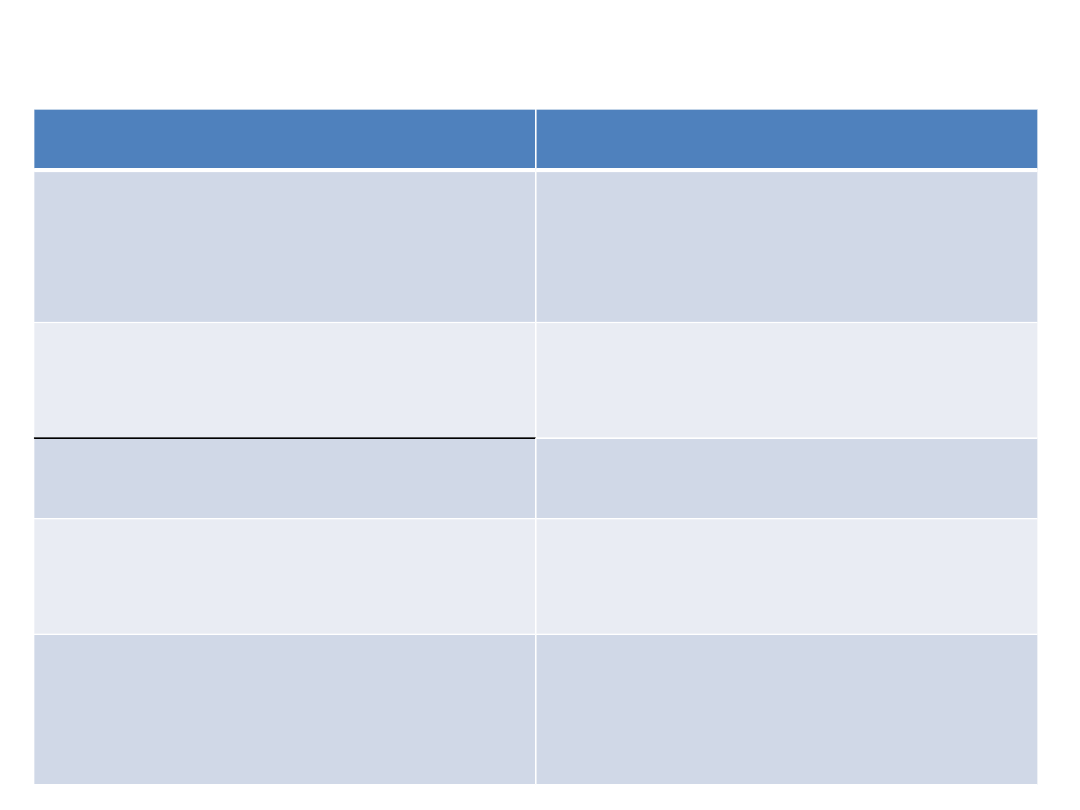
Grupa
Przedstawiciele
Nieselektywne inhibitory
wychwytu zwrotnego NA i
serotoniny (TLPD)
amitryptylina, doksepina,
klomipramina, opipramol
Selektywne inhibitory
wychwytu NA i serotoniny
(SNRI)
wenlafaksyna, duloksetyna
Selektywne inhibitory
wychwytu NA (NRI)
reboksetyna, maprotylina
Selektywne inhibitory
wychwytu serotoniny (SSRI)
fluoksetyna, fluwoksamina,
citalopram, escitalopram
paroksetyna, sertralina,
Inhibitory wychwytu zwrotnego
dopaminy i noradrenaliny
(NDRI)
bupropion
Podział leków p/depresyjnych ze względu na mechanizm działania
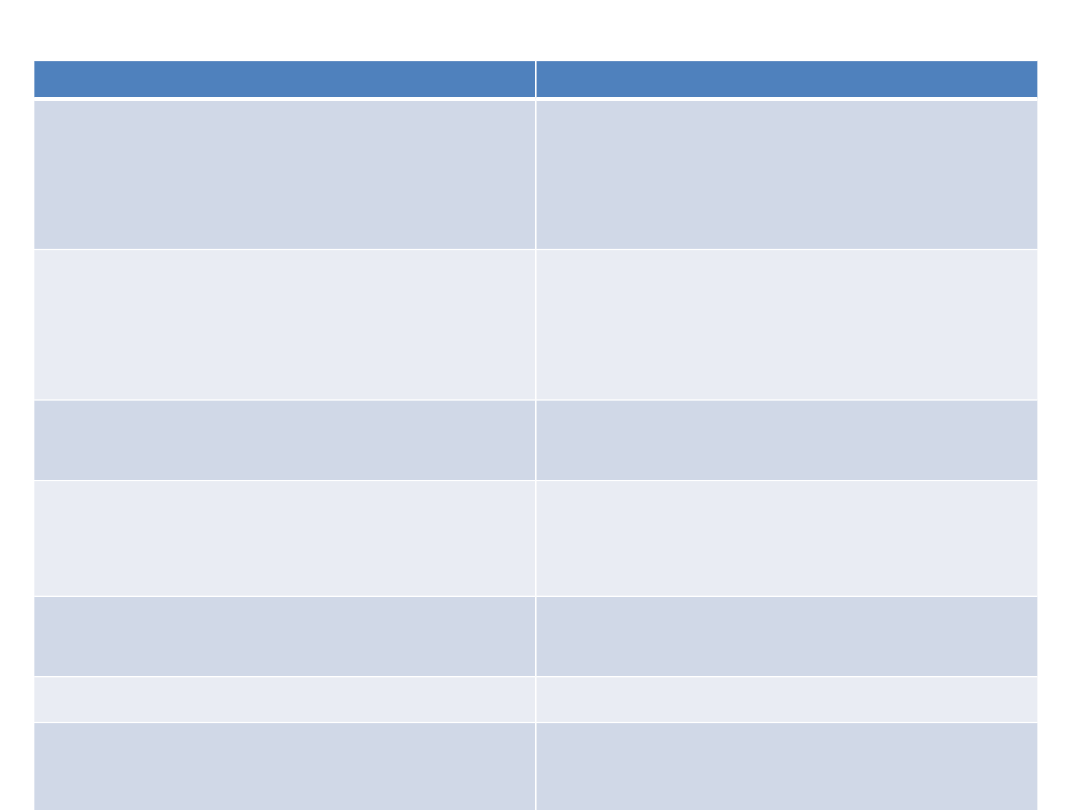
Grupa leków p/depresyjnych
Przedstawiciele
Inhibitory wychwytu zwrotnego
dopaminy i noradrenaliny
(NDRI)
bupropion
Antagoniści receptora
serotoninowego i słabe
inhibitory wychwytu serotoniny
trazodon
Antagonista receptorów
serotoninowych
wortioksetyna
Antagoniści receptorów α2-
adrenergicznego oraz
serotoninowego
mianseryna, mirtazapina
Selektywne odwracalne
inhibitory MAO-A
moklobemid
Agonista receptorów MT1 i MT2 agomelatyna
Nasilające wychwyt serotoniny,
działające na oś stresu i
neuroplastyczność
tianeptyna

Działania niepożądane TLPD
1/ działanie cholinolityczne tj. atropinopodobne ( blokowanie receptorów
muskarynowych układu przywspółczulnego)
•
wysychanie błon śluzowych
•
zaburzenia oddawania moczu
•
zaparcia atoniczne
•
zaburzenia akomodacji
•
nasilenie jaskry
•tachykardia
2/ działanie p/histaminowe
•
sedacja, senność,
•
przyrost masy ciała
I) TLPD
– nieselektywne inhibitory wychwytu
zwrotnego amin
(serotoniny i
noradrenaliny)

3/ działanie α1-adrenolityczne
•
spadki ciśnienia tętniczego
4/działanie kardiotoksyczne
•
bloki p-k (wydłużają przewodnictwo w mięśniu sercowym)
•
arytmie komorowe ( VT, VF)
•
torsade de pointes” ( bo wydłużają odstęp QT)
•
ryzyko nagłego zgonu
5/ związane z wychwytem zwrotnym amin
•
zaburzenia erekcji i ejakulacji
•
osłabienie łaknienie, biegunka, nudności
•
pobudzenie psychoruchowe
•
drżenia mięśniowe
6/nadmierna potliwość

II/ SSRI
Mechanizm działania:
Blokowanie SERT powoduje:
1/ desensytyzację autoreceptorów 5HT1A
( down regulation)
2/wzrost przekaźnictwa przez receptory
postsynaptyczne
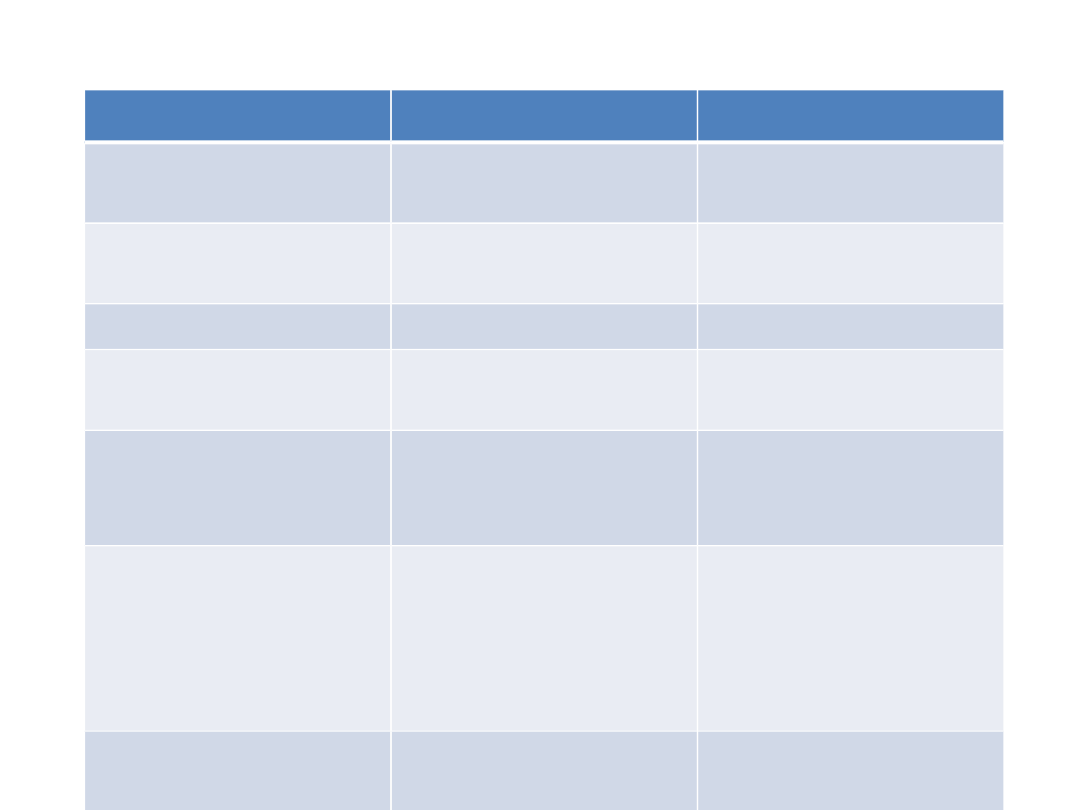
SSRI
TLPD
wpływ na układ
krążenia
brak
niekorzystny
działanie
cholinolityczne
brak
duży
próg drgawkowy brak wpływu
obniżają
indeks
terapeutyczny
szeroki
wąski
bezpieczeństwo
przy
przedawkowaniu
bezpieczne
ryzyko zatrucia
czas
wystąpienia
efektu
terapeutyczneg
o
ok. 2 tyg
ok. 2 tyg
czas trwania
terapii
min. 6 mies
min. 6 mies
potencjał
uzależniający
brak
brak
„Brak” - oznacza brak lub bardzo niewielki wpływ!!!
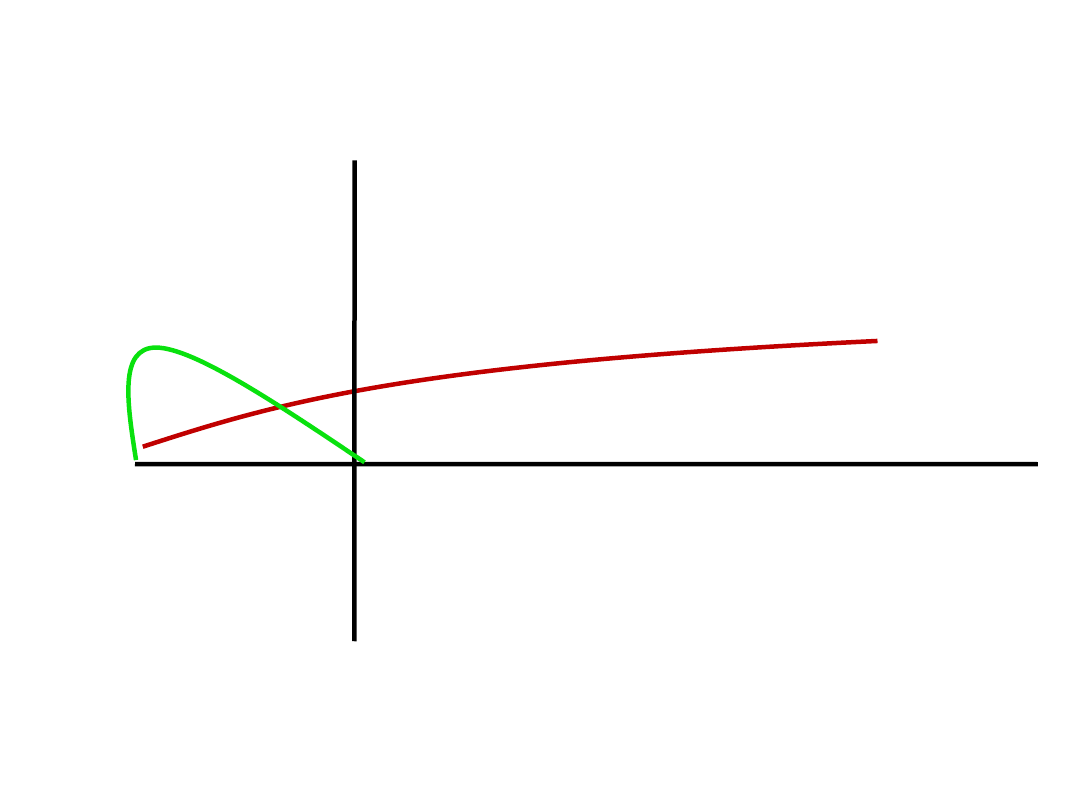
0
2 tyg
6 mies
Efekt przeciwdepresyjny SSRI
Początek działania,
lęk po SSRI
BZD

Rola leków p/depresyjnych w leczeniu zaburzeń
lękowych:
W leczeniu zaburzeń lękowych wykorzystuje się
:
benzodiazepiny
( stany ostre, krótkotrwałe kryzysy życiowe)
leki p/depresyjne
( leczenie przewlekłe)
Hydroksyzyna
Buspiron
neuroleptyki

Zalety i wady wybranych leków stosowanych w
zaburzeniach lękowych - podsumowanie
benzodiazepiny -
szybki początek działania, udokumentowana
skuteczność, stosunkowo bezpieczne po przedawkowaniu, ryzyko uzależnienia,
buspiron
-nie powoduje uzależnienia, stosunkowo bezpieczny po przedawkowaniu
opóźniony efekt działania (2-4 tyg), skuteczny tylko w lęku uogólnionym,
hydroksyzyna
raczej nie powoduje uzależnienia ( kontrowersje - nie oceniono
wyników długotrwałego stosowania), szybki efekt działania ,
skuteczna tylko w lęku uogólnionym
TLPD
- nie powodują uzależnienia, dostateczne dane kliniczne dotyczące
skuteczności (z wyjątkiem fobii społecznych), mały koszt leków
opóźniony efekt działania (po 2-6 tyg.), ryzyko zgonu w przypadku przedawkowania,
SSRI
nie powodują uzależnienia, udokumentowana skuteczność, względnie
bezpieczne po przedawkowaniu, opóźniony efekt działania (2-6 tyg.),

Co warto by przemyśleć:
TLPD i SSRI - które z nich są bezpieczniejsze u osób starszych,
u chorych kardiologicznych? Z czego to wynika?
Jaki jest ,zgodnie z obecnym stanem wiedzy, potencjał
uzależniający leków p/depresyjnych?
Czy tylko depresja jest wskazaniem do ich stosowania?
Zasady bezpiecznego stosowania leków p/depresyjnych
Czy można (okresowo) łączyć np. SSRI i BZD? Dlaczego?

4/Neuroleptyki
Podział kliniczny neuroleptyków ( leków przeciwpsychotycznych):
1)klasyczne (antagoniści receptorów dopaminergicznych D2)
2) atypowe ( silniej blokują receptory 5-HT2A niż D2;
częściowi agoniści receptorów D2)
Dlatego obie grupy różnią się min. wywieranymi efektami i działaniami
niepożądanymi

Działania niepożądane neuroleptyków:
1/ ZABURZENIA POZAPIRAMIDOWE (
mechanizm)
2
/ hiperprolaktynemia (
mechanizm)
3/ układ sercowo - naczyniowy (
mechanizm)
4/ mielotoksyczność
5/ objawy cholinolityczne (
mechanizm
)
6/ objawy z OUN
7/ inne : wzrost masy ciała, hiperglikemia, uszkodzenie wątroby
8/ fotosensybilizacja
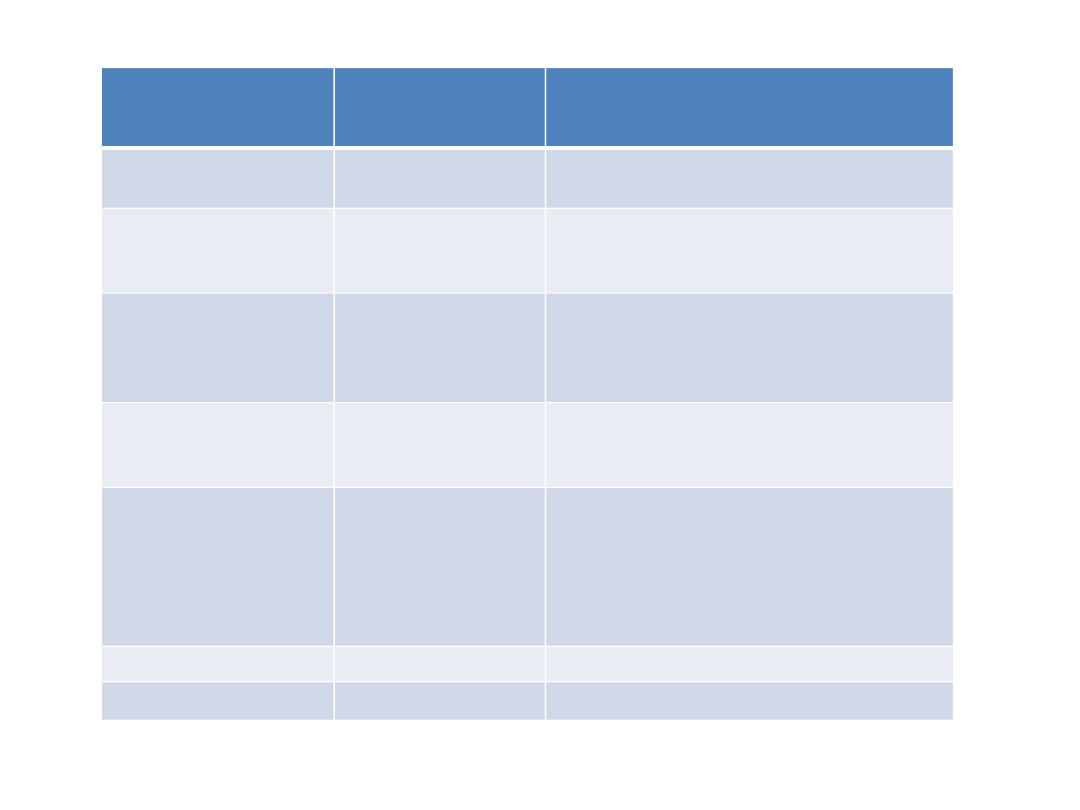
NL
klasyczne
NL atypowe
mechanizm
działania
blokowanie rp.
D2
częściowe blokowanie rp. D2
blokowanie rp. 5HT2
znoszenie
objawów
pozytywnych
+++
+
znoszenie
objawów
negatywnych
+
+++ (mają działanie
prokognitywne,
antyautystyczne, poprawiają
nastrój
ryzyko objawów
pozapiramidowyc
h
BARDZO DUŻE
+
zaburzenia
metaboliczne
( wzrost masy
ciała,
hiperglikemia,
hiperlipdemia)
+
+++
agranulocytoza
++
+++
wydłużenie QT
++
+++

Co warto przemyśleć:
Czy leki p/psychotyczne są wykorzystywane tylko w leczeniu psychoz?
Jaki jest mechanizm działań niepożądanych NL klasycznych?
Co oznacza pojęcie „częściowy antagonista” opisujące mechanizm
działania NL atypowych?
Jakie są zalety/wady NL atypowych w porównaniu z NLklasycznymi?
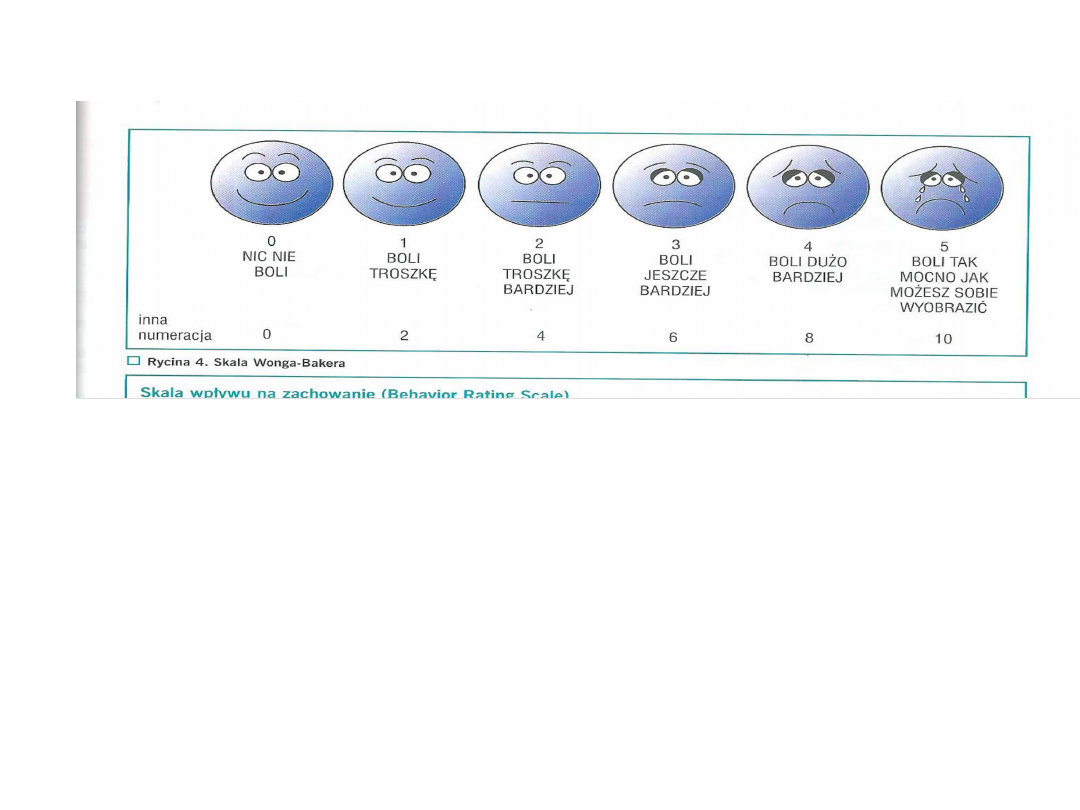
Skala bólu (NRS)
a)łagodny ( NRS 1-4)
b)umiarkowany ( NRS 4-6)
c)silny ( NRS 6-10)
Leki przeciwbólowe ( analgetyki)

Podział leków przeciwbólowych ( analgetyków)
1/ opioidy
a/ słabe opioidy
b/ silne opioidy
2/ nieopiodiowe leki p/bólowe (słabe analgetyki)
a/ niesterydowe leki p/zapalne ( NLPZ)
b/ paracetamol
c/ metamizol

Koanalgetyki
Do najskuteczniejszych koanalgetyków
należą leki
p/depresyjne (np. Duloksetyna) i
p/padaczkowe ( np. Pregabalina)
Practise Guidelines for Chronic Pain Management.
Anesthesiology 2010,112;810-33

+koanalge
tyk
DRABINA
ANALGETYCZNA
III
/ silne opioidy
( morfina,
fentanyl, buprenorfina,
oksykodon, metadon)
II
/ słabe opioidy
( kodeina,
dihydrokodeina, tramadol) i
nefopam
I
/analgetyki
nieopioidowe
NLPZ
paracetamol
metamizoll)

Działania NLPZ
przeciwzapalne
przeciwbólowe
przeciwgorączkowe
antyagregacyjne ( głównie ASA w małych dawkach)

Inhibitory cyklooksygenaz(COX)
COX1 –konstytutywna
występuje fizjologicznie ; bierze udział w przemianie AA
ochrona p. pok. (PGI2) i nerek (PGE2), działanie
prozakrzepowe – TXA2
COX2 – indukowalna
indukowana czynnikami prozapalnymi
COX3- w OUN.
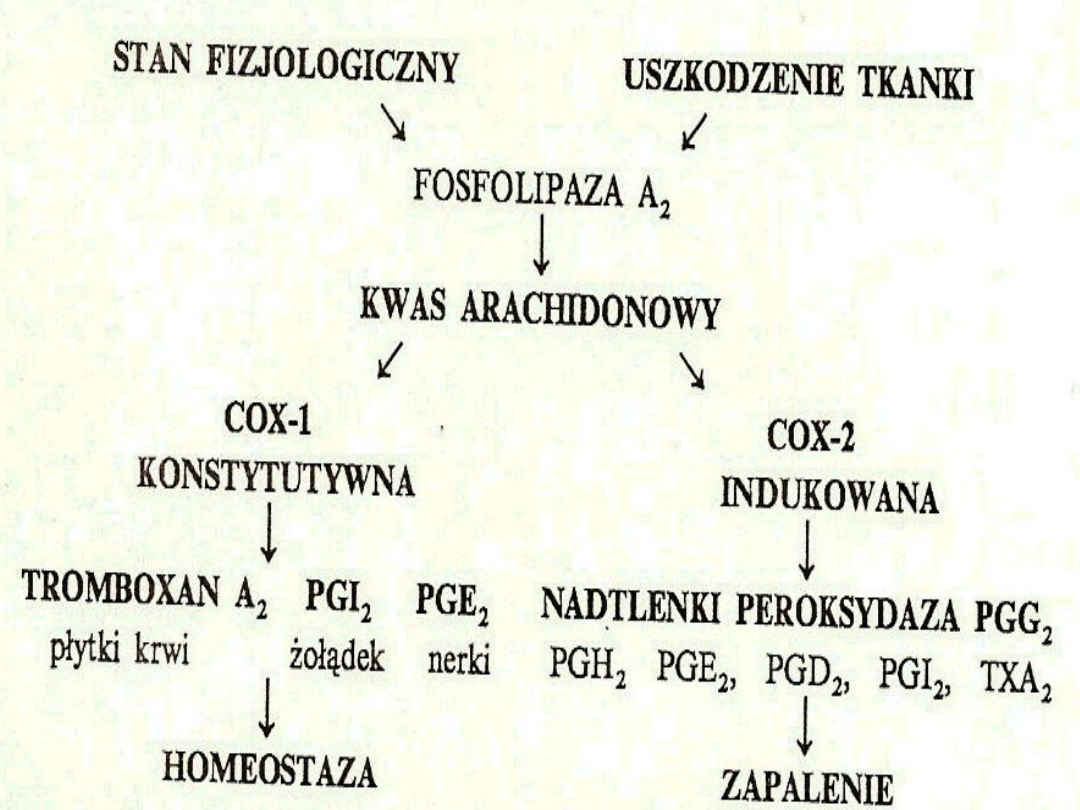

Podział NLPZ w zależności od
wpływu
na aktywność cyklooksygenaz
COX-1 selektywne - małe dawki ASA
COX nieselektywne – ibuprofen, naproksen,
piroxicam,
(COX1/2; 0.5-3.0)
ketoprofen, indometacyna,
acetamycyna
COX-2 preferencyjne– diklofenak*, nabumeton*,
(COX1/2 ; 20-50)
meloksykam, nimesulid
COX-2 wysoce selektywne ( COX-2 specyficzne) –
(COX1/2; 180)
celekoksyb, (
rofekoksyb –
wycofany; dlaczego?)
*diklofenak, nabumeton- przez niektórych zaliczane są do nieselektywnych

Wskazania:
Zespoły bólowe:
ostre i przewlekle
łagodne i umiarkowane
Są to leki I-wyboru w bólach kostno-stawowych np. choroba
zwyrodnieniowa stawów, RZS, ZZSK, bóle pourazowe,
pooperacyjne
Dołączane do opioidów pozwalają zredukować ich dawkę i
działania niepożądane

OBJAWY NIEPOŻĄDANE
1/ Przewód pokarmowy !!!
nudności, dyskomfort w nadbrzuszu
owrzodzenia żołądka i dwunastnicy
krwawienia z przewodu pokarmowego
enteropatie
niedokrwistość (wynikająca z przewlekłego krwawienia)j

Zwiększenie ryzyka uszkodzenia/krwawień z przewodu
pokarmowego powoduje jednoczesne przyjmowanie NLPZ z:
ASA
doustnymi bisfosfonianami;
glikokortykosteroidami( ogólnymi)
doustnymi antykoagulantami/heparyną
SSRI ( prawdopodobnie)
spironolaktonem (nasila gastrotoksyczność NLPZ)
Ryzyko gastropatii po NLPZ zmniejsza:
1. przyjęcie NLPZ z posiłkiem
(spowolniona absorpcja leku , ale też jego działanie
przeciwbólowe)
2. popicie leku dużą ilością płynów;
3. stosowanie IPP przy przewlekłej terapii NLPZ
4/ wybranie NLPZ najmniej drażniącego przewód
pokarmowy np. wybiórczego
COX2

2/ nerki (nefrotoksyczność)
zmniejszenie przesączania kłębuszkowego aż do ostrej
niewydolności nerek
(zwłaszcza starsi)
retencja sodu/wody, obrzęki
Zmniejszają skuteczność hipotensyjną IKA, sartanów, beta-
blokerów, diuretyków
Mogą zwiększać ciśnienie krwi nasilać obj. niewydolności serca,
nadciśnienie

3/układ krwiotwórczy
niedokrwistość aplastyczna
zmniejszenie agregacji płytek
agranulocytoza ( gł. metamizol???)
4/wątroba (hepatotoksyczność)
wzrost aminotransferaz ( rzadko)- głównie diklofenak
5/ OUN
bóle głowy, zawroty głowy
zaburzenia świadomości
szum w uszach, upośledzenie
słuchu - przemijające (ototoksyczność)
drżenia mięśni

6/ reakcje nadwrażliwości
(hamując COX nasilają szlak lipooksygenazy i produkcję
leukotrienów)
astma oskrzelowa ( nazywana astmą aspiranową - ale w
95-98%
nadwrażliwość krzyżowa ASA- inne NLPZ)
postać skórna (pokrzywka, rumień, obrzęk
naczynioruchowy)
fotodermatozy

IBUPROFEN
krótki T1/2
unikać łączenia z ASA (zmniejsza działanie antyagregacyjne
ASA)
zaliczany do słabych analgetyków
KETOPROFEN
krótki T1/2
duże ryzyko uszkodzenia śluzówki p. pokarmowego
reakcje fototoksyczne (żel na Rp. –
rekomendacja CHMP
)
NAPROKSEN
stosunkowo długi T1/2
bardziej ototoksyczny niż inne NLPZ
NLPZ z wyboru u pacjentów w dużym ryzykiem sercowo-
naczyniowym

DIKLOFENAK
uważany za najbardziej hepatotoksyczny z NLPZ
duże ryzyko zdarzeń zakrzepowych (jak po koksybach )

Koksyby
mniejsze prawdopodobieństwo powikłań ze strony
p. pokarmowego
większe ryzyko powikłań ze strony układu sercowo-
naczyniowego
(zwiększenie ryzyka zawału m. sercowego, udaru mózgu,
choroby
zatorowo-zakrzepowej naczyń obwodowych, zatoru t.
płucnej) – z
tego powodu wycofano z rynku rofekoksyb ( Vioxx)
Pozostał na rynku:
•celekoksyb – Celebrex tabl 100; 200mg
( 200mg w 1-2 dawkach podzielonych )
COX1>>>COX2
TXA
2
>>> PGI

Siła działania;
czas działania
słabe
umiarkowane
silne
krótko
ibuprofen
diclofenac
ketoprofen
umiarkowany
naproxen
długo
nabumeton
piroxicam
Porównanie siły i czasu działania wybranych
NLPZ

Wybrane interakcje NLPZ
1/Osłabiają działanie leków hipotensyjnych i
moczopędnych
2/Nasilają
doustnych antykoagulantów ( acenokumarol,
warfaryna)
klopidogrel)
doustnych leków hipoglikemizujących

PARACETAMOL (ACETAMINOFEN)
hamuje COX-3 – izoformę COX-1 w OUN
nie ma działania p/zapalnego
nie wywiera działań niepożądanych na śluzówkę p.
pokarmowego
nie działa na agregację płytek
lek p/bólowy z wyboru w ciąży
maksymalna dawka dobowa - 4.0 g
dawka toksyczna – 10g
(W różnych opracowaniach można znaleźć różne dawki. Wielkość
tych dawek zależy też od stanu pacjenta!!!)

Małe ryzyko
sercowo-
naczyniowe
Duże ryzyko
sercowo-
naczyniowe
Małe ryzyko uszk.
p. pok
dowolny NLPZ w
najmniejszej
dawce skutecznej
naproxen
Duże ryzyko uszk.
p. pok
koksyby
paracetamol
Dobór leku p/bólowego w zależności od
ryzyka
choroby p. pokarmowego i/lub ryzyka
sercowo
naczyniowego

METAMIZOL
Mechanizm :
ośrodkowo – hamuje COX-3
obwodowo – hamuje selektywnie COX-2
najsilniejszy p/bólowy nieopioidowy lek analgetyczny
skuteczny w bólach spowodowanych skurczem mm. gładkich
???
agranulocytoza???
p/wskazany w ciąży

NEFOPAM
Mechanizm działania:
wpływ na antynocyceptywne układy hamujące poprzez
hamowanie wychwytu zwrotnego serotoniny i
noradrenaliny.
nie ma działania p/ zapalnego, antyagregacyjnego
zajmuje 2-gi szczebel drabiny analgetycznej ( 50% siły
działania
MF)
ból umiarkowany, ostry - np. pooperacyjny, zębów
DN -tachykardia, senność , uspokojenie

Co warto wiedzieć:
Czy wszystkie nieopiodowe leki p/bólowe wywierają takie same działania?
Jakie są mechanizmy podstawowych działań niepożądanych NLPZ?
Czym należy się kierować przy wyborze leków p/bólowych, p/zapalnych?
Jaka jest całkowicie bezpieczna droga ich podania ( przy stosowaniu ogólnym)
z pacjenta z chorobą wrzodową?
Pacjent kardiologiczny ( nadciśnienie, niewydolność serca) – czy może przyjmować NLPZ,
jakie wybrać?
Dlaczego zatrucie paracetamolem u dzieci jest rzadsze niż u dorosłych?
Dlaczego u alkoholików, osób wyniszczonych dawka toksyczna paracetamolu
jest mniejsza?
Jakie praktyczne korzyści wiążą się ze stosowaniem koanalgetyków?

I/ czyści agoniści
II/ mieszani agoniści i antagoniści
III/ częściowi agoniści
IV/ czyści antagoniści
Podział opioidów w zależności od
powinowactwa do receptorów i aktywności
wewnętrznej
Opioidy
Największe znaczenie dla działania przeciwbólowego
leków opioidowych ma receptor µ- są jego agonistami

I/ czyści agoniści
1/ morfina i inne alkaloidy opium
- alkaloidy fenantrenowe ( morfina, kodeina)
- alkaloidy benzyloizochinolinowe
( np. papaweryna)
2/ leki półsyntetyczne
- oksykodon, hydromorfon
3/ leki syntetyczne
- pochodne morfinianu (dekstrometorfan)
- pochodne piperydyny (fentanyl i jego analogi,
petydyna,
difenoksylat, loperamid,)
- pochodne 4,4-difenyloheptanu ( metadon)
- pochodne difenyloizopentanolu ( propoksyfen,
lewopropoksyfen)

II grupa – mieszani
agoniści/antagoniści
- pochodne benzomorfanu
( pentazocyna)
III grupa – częściowi agoniści
pochodne fenantrenu (buprenorfina)
IV grupa – leki antagonistyczne
nalokson, naltrekson

WSKAZANIA
bóle ostre ( np. pooperacyjne)
bóle przewlekłe umiarkowane i silne
(NRS 6-10)
a/ nowotworowe
b/ nienowotworowe (BPNN) np. bóle kręgosłupa,
neuropatie
Inne zastosowania opioidów cd.
biegunki (loperamid, difenoksylat )
kaszel ( kodeina, dekstrometorfan)
terapia uzależnień od opioidów/opiatów ( metadon)
znoszenie depresji ośrodka oddechowego ( nalokson –
antagonista µ)
kardiogenny obrzęk płuc wywołany ostrą
niewydolnością
lewokomorową

I/ CZYŚCI AGONIŚCI
MORFINA
1/Działanie ośrodkowe:
przeciwbólowe
uspokajające
depresja czynności oddechowej
przeciwkaszlowe
wpływ na ośrodek wymiotny
zwężanie źrenic
obniżenie progu drgawkowego
wpływ na wydzielanie dokrewne
2/Działania obwodowe:
działanie na mięśnie gładkie (na które, jak?)
wpływ na czynność skurczową macicy ( jaki?)
uwalnianie histaminy

METABOLIZM MORFINY
p.o. - mała dostępność biologiczna ; b. wysoka
skuteczność.
gdzie sens, gdzie logika?
w wątrobie powstaje m.in. morfino-6-glukuronian,
który ma większą
siłę działania niż MF
Dawkowanie morfiny - ogólne zasady
preferowana droga doustna ew. podskórna
p.o.>
s.c.>
i.v.>
i.m
dawka dobierana indywidualnie (miareczkowanie)

Klasycznie do miareczkowania
stosowany jest wodny roztwór
morfiny:
0.5% ( 1ml=5mg MF) lub
1.0 % (1ml=10mgMF)

Rpw.
Morphini hydrochloridi 2.0
Aquae destilatae ad 400.0
M.f.solutio
D.S. 1ml ( 5mg) co 4 godz doustnie
Łącznie 2g (dwa gramy) morfiny
Przykładowa recepta na
0.5% roztwór MF
1ml=5mg

Działania niepożądane:
żołądkowo- jelitowe
nudności, wymioty
zaparcia
OUN
senność
upośledzenie czynności poznawczych
halucynacje, majaczenie
depresja ośrodka oddechowego
napady drgawkowe
z autonomicznego układu nerwowego
suchość w jamie ustnej
zatrzymanie moczu
hipotonia ortostatyczna
skórne
świąd
nadmierna potliwość

PRZECIWWSKAZANIA
Astma oskrzelowa
Niewydolność oddechowa
Urazu czaszki i OUN
Nadciśnienie śródczaszkowe
Psychozy alkoholowe
Kolka żółciowa, nerkowa
Stany spastyczne jelit
Ostatnie 2 tygodnie ciąży, poród
Zaburzenia rytmu serca

EFEKT
tak/szybko
słabo
nie
p/ bólowy
+++
euforyzujący
+++
depresja OUN
+
zaparcia
+++
mioza
+++
Tolerancja

OBJAWY ZESPOŁU ABSTYNENCJI
dysforia
łzawienie, katar
bezsenność
uporczywe ziewanie
zlewne poty
wzrost ciśnienia tętniczego
drżenia mięśniowe
bolesne skurcze jelit
stany deliryczne
drgawki
zapaść
Objawom odstawiennym zapobiega METADON
KODEINA
metabolizowana do MF ( 20% osób nie posiada enzymu
potrzebnego do
przemiany)
wykorzystywane jest głównie działanie p/kaszlowe
wchodzi w skład leków złożonych z NLPZ lub
paracetamolem np.
Nurofenu, Efferalganu, Thicodinu

Pochodne morfinianiu:
Dekstrometorfan
działanie p/kaszlowe
uzależnia
bezpieczny w dawkach terapeutycznych ( 90mg/dobę)
środek psychoaktywny ( dawki 225 – 1500mg) - euforia,
dysocjacja
Np.
Acodin
Prep. złożone : Gripex ( Max/Noc) Grypolek, Dexapico, Dexapini
- OTC

Pochodne piperydyny
FENTANYL
silne działanie p/bólowe ( 100x silniejsze od morfiny)
bezpieczny u pacjenta z niewydolnością nerek
drogi podawania:
1/dożylnie – anestezjologia : NLA, analgo-sedacja
2/ przezskórnie – p/bólowo przewlekle
( efekt p/bólowy w systemie TTS z opóźnieniem po ok. 12 godz!!!)
3/ przezśluzówkowo (donosowo, podpoliczkowo) – p/bólowo w bólach
przebijających
W celu usuwania bólów przebijających pacjent z chorobą nowotworową
powinien być zawsze zaopatrzony w preparaty o natychmiastowym uwalnianiu

Wskaźnik
równoważności
analgetycznej
Morfina p.o./i.v; i.m; s.c.
3:1
( tzn. 1mg MF
podanej p.o.
odpowiada 3mg MF
podanej i.v; i.m;
s.c.)
Morfina p.o./oksykodon p.o.
1:1.5
Morfina p.o./ buprenorfina TTS
1:75
Morfina p.o./fentanyl TTS
1:100
Nie ma krzyżowej oporności bólu na opioidy
Tabela przelicznika dawek morfiny ( przykłady)

Pochodne piperydyny cd.
PETYDYNA
neurotoksyczny metabolit
silne bóle ( np. pooperacyjne, pourazowe) –ale NIE
nowotworowe:
(obecnie ani petydyna ani pentazocyna nie są
wskazane w leczeniu
bólów nowotworowych)
opioid (!) z wyboru w kolce nerkowej i wątrobowej
bóle porodowe - nie hamuje czynności skurczowej
macicy, słabiej
(niż MF) przechodzi przez łożysko

Opioidy jako leki zapierające
LOPERAMID
nie działa p/bólowo
silne działanie zapierające ( 40-50 x silniejsze od
morfiny)
nie przenika do OUN – małe /brak
prawdopodobieństwo depresji
ośrodka oddechowego
nie wywołuje zależności
nie występuje tolerancja na działanie zapierające
DIFENOKSYLAT
nie działa p/bólowo
silne działanie zapierające
przenika do OUN ( może spowodować depresję ośrodka
oddechowego

Pochodne 4,4-difenylohepantonu
Metadon
Mechanizmy działania:
agonista rp.μ
antagonista rp. NMDA
hamuje reuptake serotoniny
Zastosowanie
1/ leczenie uzależnienia od morfiny, heroiny (znosi
euforyzujące działanie morfiny/heroiny podanej i.v. , nie
powodując objawów abstynencji –przejście z zależności
niekontrolowanej w kontrolowaną)
2/ leczenie bólu – (jedynie przez specjalistów)
silnie p/bólowo
b. duże różnice indywidualne w farmakokinetyce
możliwość groźnych DN

Pentazocyna ani petydyna nie są obecnie
wskazane w leczeniu
bólów nowotworowych
II/ mieszani agoniści i
antagoniści
•
pentazocyna
Wskazania :
ból ostry

III/ częściowi agoniści
BUPRENORFINA - pochodne fenantrenu
jest częściowym agonistą receptorów μ
oraz antagonistą na
rp. κ
dobrze wchłania się z p. pokarmowego i błon śluzowych
małe niebezpieczeństwo DN (np. zależności fizycznej,
zaparć, nudności,
depresji oddechowej)
wykazuje „efekt pułapowy” ( w dużych dawkach ,
praktycznie nie
stosowanych)
bezpieczna u pacjentów z niewydolnością nerek
efekt p/bólowy w systemie TTS z opóźnieniem (po 12
godz)
drogi podania:
• podjęzykowa
• przezskórna
• dożylna

IV/ „czyści antagoniści”
znoszą objawy przedawkowania opioidów (depresję oddechową)
nie pogłębiają depresji oddechowej wywołanej przez np. barbiturany
( zastosowanie w zatruciach mieszanych )
znoszą toksyczne działanie alkoholu etylowego
NALOKSON –
jedynie pozajelitowo ( w zwalczaniu wymiotów apomorfinowych, w znoszeniu
depresji oddechowej w przedawkowaniu opioidów
NALTREKSON-
może być stosowany doustnie
po detoksykacji u osób uprzednio uzależnionych od morfiny, heroiny , alkoholu
INNE
TRAMADOL
„słaby” opioid – 2-gi szczebel drabiny analgetycznej
(siłą
działania p/bólowego odpowiada pentazocynie)
podwójny mechanizm działania –
1/ opioidowy: jest agonistą receptorów opioidowych ( w
40%),
(2) nieopioidowy: aktywuje zstępujący układ hamowania
bólu na poziomie
rdzenia ( hamuje wychwyt zwrotny serotoniny i NA)
Przelicznik
Tramadol p.o./MF p.o.
1 : 0.2
Tramadol i.v./MF p.o.
1 : 0.1

Co warto wiedzieć :
1/ Czy stosując przewlekle jeden opioid można do przerwania bólu przebijającego używać
innego?
2/ Dlaczego postaci TTS nie stosuje się w bólu przebijającym?
3/O czym należy koniecznie pamiętać zalecając/ przepisując receptę na fentanyl TTS i buprenorfinę TTS
4/ Dlaczego buprenorfina wykazuje efekt pułapowy ( nawet jeśli tylko teoretycznie)?
5/ Dlaczego kodeina nie jest obecnie chętnie stosowana jako lek p/bólowy?
6/ Jakie możliwości terapeutyczne daje brak oporności krzyżowej bólu na opioidy?
7/ Które leki p/bólowe mogą powodować zespół serotoninowy ?
8/ Które silne opioidy są bezpieczne u pacjentów z niewydolnymi nerkami?
9/ Czy można opioid łączyć z NLPZ?
10/ Jakie działania morfiny są korzystne u pacjenta z ostrym zespołem wieńcowym?
11/Czy tramadol może być stosowany do przerywania bólów przebijających? Jeśli tak to w jakiej postaci?
12/ Co to jest terapia multimodalna oraz terapia sekwencyjna bólu ostrego?
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
- Slide 68
- Slide 69
- Slide 70
- Slide 71
- Slide 72
- Slide 73
- Slide 74
- Slide 75
- Slide 76
- Slide 77
- Slide 78
- Slide 79
- Slide 80
- Slide 81
- Slide 82
- Slide 83
- Slide 84
- Slide 85
- Slide 86
- Slide 87
- Slide 88
- Slide 89
- Slide 90
- Slide 91
- Slide 92
- Slide 93
- Slide 94
- Slide 95
- Slide 96
Wyszukiwarka
Podobne podstrony:
MATERIALY DO WYKLADU CZ IV id Nieznany
MATERIALY DO WYKLADU CZ VIII i Nieznany
materiały do ćw 3
(f) sprawozdanie do cw 3 (2014 2015) aa
MATERIALY DO WYKLADU CZ V id 2 Nieznany
Materialy do cw lab biochemia
MATERIALY DO WYKLADU CZ III id Nieznany
Materialy do wykladu (cz 1) id Nieznany
Materialy do cw. 5
Materiały do ćw 4
MATERIAŁY DO WYKŁADU CZ I
(f) sprawozdanie do cw 2 (2014 2015)aa
MATERIAŁY DO WYKŁADU CZ. VI
Materialy do wykladu (cz 2) id Nieznany
Materialy do wykladu (cz 3) id Nieznany
Materiały do wykładów cz. 2, AJD - PEDAGOGIKA, I rok, I semestr, Wstęp do filozofii
materiały do ćwiczeń woiągi 2015, Semestr 5, Woiągi
więcej podobnych podstron