
ELEKTROCHEMIA

• Reakcje polegające na wymianie
elektronów pomiędzy substancją
utleniającą a substancją redukującą
to reakcje utleniania i redukcji
(procesy redoks).
ELEKTROCHEMIA
2 Mg (s) + O
2
2 MgO
(g)
(s)
magnez jest reduktorem: utlenia się do jonów
Mg
2+
tlen jest utleniaczem: redukuje się do O
2-

Samorzutna reakcja?
Jaki jest kierunek reakcji?
ELEKTROCHEMIA
Cu
2+
(aq) + Zn (s) Cu (s) + Zn
2+
(aq)
Cu
2+
(aq) + Zn (s) Cu (s) + Zn
2+
(aq)
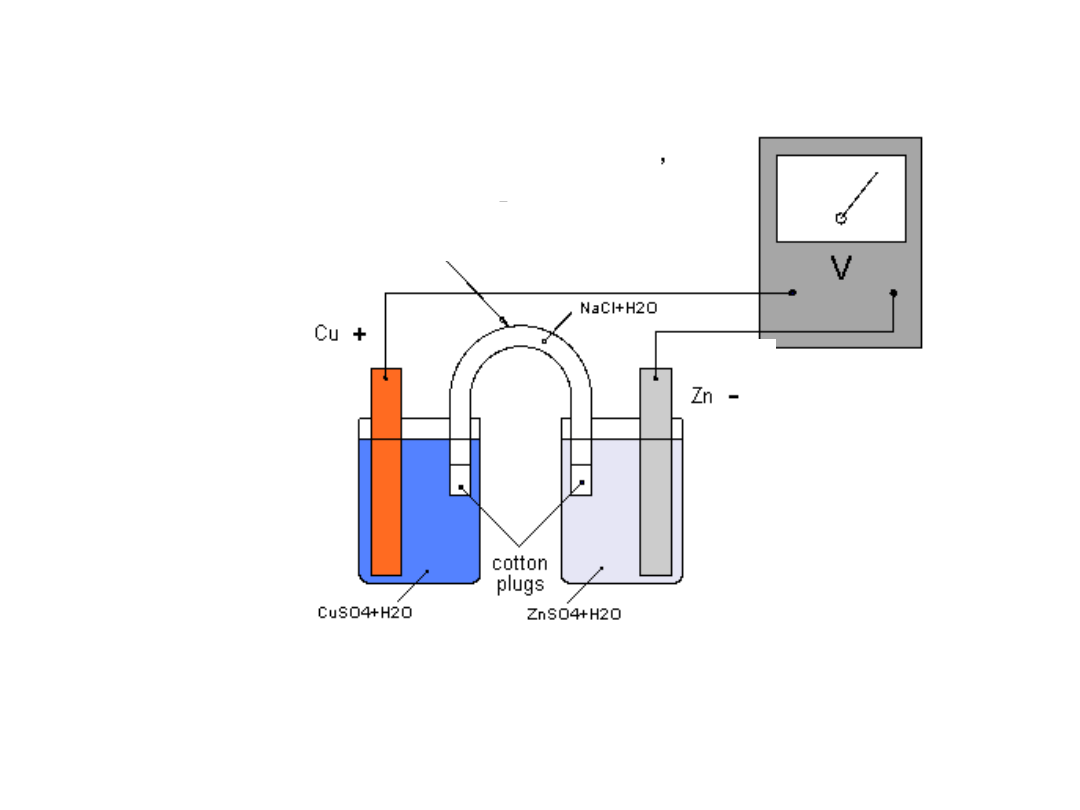
Ogniwo Daniella
Zn ZnSO
4
(c
1
) CuSO
4
(c
2
) Cu
mostek solny
anoda
Ogniwo Daniella (wersja z
mostkiem solnym)
katoda

Ogniwo Daniella

• Ogniwo Daniella jest źródłem
energii elektrycznej.
• Energia powstaje w wyniku
przebiegającej
samorzutnie
reakcji chemicznej.
• W ogniwie zachodzą reakcje
utleniania i redukcji.
Ogniwo Daniella

• DLA OGNIWA DANIELLA:
• elektroda cynkowa (ANODA) (-):
Zn Zn
2+
+2e
-
• Obserwujemy zużywanie się elektrody
cynkowej z równoczesnym wzrostem stężenia
siarczanu cynku w roztworze. Zachodzi
reakcja utleniania, w trakcie której zachodzi
przekazanie elektronów elektrodzie
powodujące pojawienie się ładunku
ujemnego. Anoda ma więc niższy potencjał.

• DLA OGNIWA DANIELLA:
• elektroda miedziana (KATODA) (+):
Cu
2+
+2e
-
Cu
• Jednocześnie na katodzie wydziela się miedź,
a stężenie siarczanu miedzi maleje. Zachodzi
reakcja redukcji.
• Katoda ma wyższy potencjał w wyniku
odbierania elektronów przez substancję
ulegającą redukcji.

Cu
2+
(aq) + Zn (s) Cu (s) + Zn
2+
(aq)
SUMARYCZNA reakcja w ogniwie:
Ta sama reakcja zachodzi w roztworze
siarczanu miedzi, ale nie towarzyszy temu
przepływ prądu.
W ogniwie galwanicznym w wymianie
elektronów pośredniczy obwód
zewnętrzny ogniwa.

Potencjał elektrody zanurzonej w roztworze
jonów tego samego pierwiastka zwany
potencjałem utleniająco-redukujacym
(potencjał redox), określa
RÓWNANIE
NERNSTA
E = E
o
+ RT/nF * lna
M
n
+
E
o
- potencjał normalny,
R - stała gazowa,
F - stała Faraday’a,
n - liczba elektronów biorących udział w
reakcji utlenienia-redukcji,
a
M
n
+
- aktywność kationów metalu w
roztworze (dla roztworów rozcieńczonych:
stężenie).

OGNIWA GALWANICZNE
• W ogniwie wytwarza się różnica
potencjałów określana jako SIŁA
ELEKTROMOTORYCZNA OGNIWA (SEM).
• PÓŁOGNIWO
to metal (elektroda) wraz z
otaczającym go roztworem.
• OGNIWO
to dwie elektrody zanurzone w
elektrolicie (przewodniku jonowym), którym
może być roztwór, ciecz lub ciało stałe.

Budowa ogniw galwanicznych:
• półogniwa mogą być zanurzone w
tym samym elektrolicie
• półogniwa mogą być zanurzone w
różnych elektrolitach.
• kontakt elektryczny zapewniony jest
przez klucz elektrolityczny.
OGNIWA GALWANICZNE
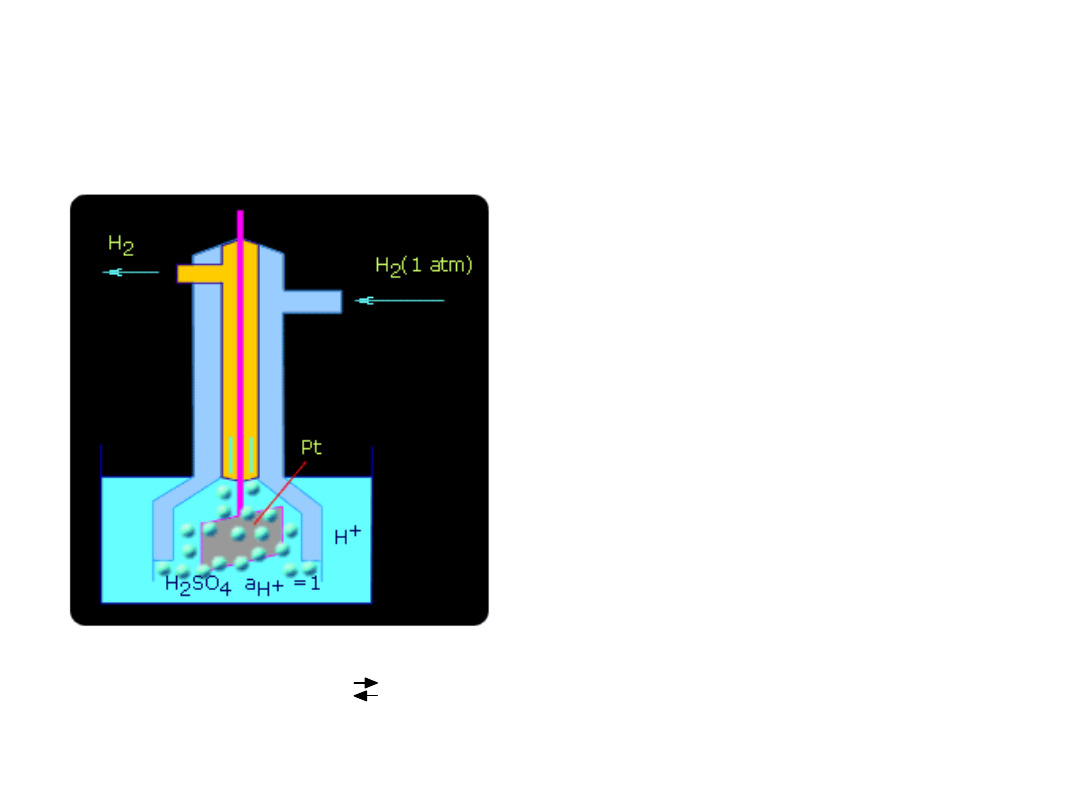
PÓŁOGNIWO WODOROWE
Standardowe półogniwo wodorowe
Pt H
2
(g) H
+
(aq)
2H
3
O
+
+ 2e
-
H
2
+ 2 H
2
O

• Potencjał standardowego półogniwa wodorowego przyjmuje
się umownie za ZERO.
• Siła elektromotoryczna (SEM) ogniwa złożonego z normalnej
elektrody wodorowej i dowolnej innej elektrody daje zatem
bezpośrednio potencjał zastosowanej elektrody.
• Stosując elektrodę wodorową można wyznaczyć względne
wartości potencjałów normalnych przez pomiar siły
elektromotorycznej ogniwa zbudowanego z normalnej
elektrody wodorowej i badanej elektrody zanurzonej w
roztworze swych jonów o aktywności równej jedności.
SEM takiego ogniwa jest różnicą potencjałów normalnych
obu elektrod.
E
o
= E
oH2
- E
oM
• Ponieważ potencjał standardowej elektrody wodorowej równa
się zeru to zmierzona wartość SEM jest STANDARDOWYM
WZGLĘDNYM POTENCJAŁEM DANEJ ELEKTRODY.
PÓŁOGNIWO WODOROWE

SZEREG
ELEKTROCHEMICZNY
• Reakcje elektrodowe uszeregowane
według rosnących wartości
odpowiadających im potencjałów
standardowych noszą nazwę
szeregu napięciowego metali
• Stabelaryzowane są nie tylko
wartości potencjałów standardowych
elektrod metalicznych, ale także
gazowych oraz elektrod redoks.
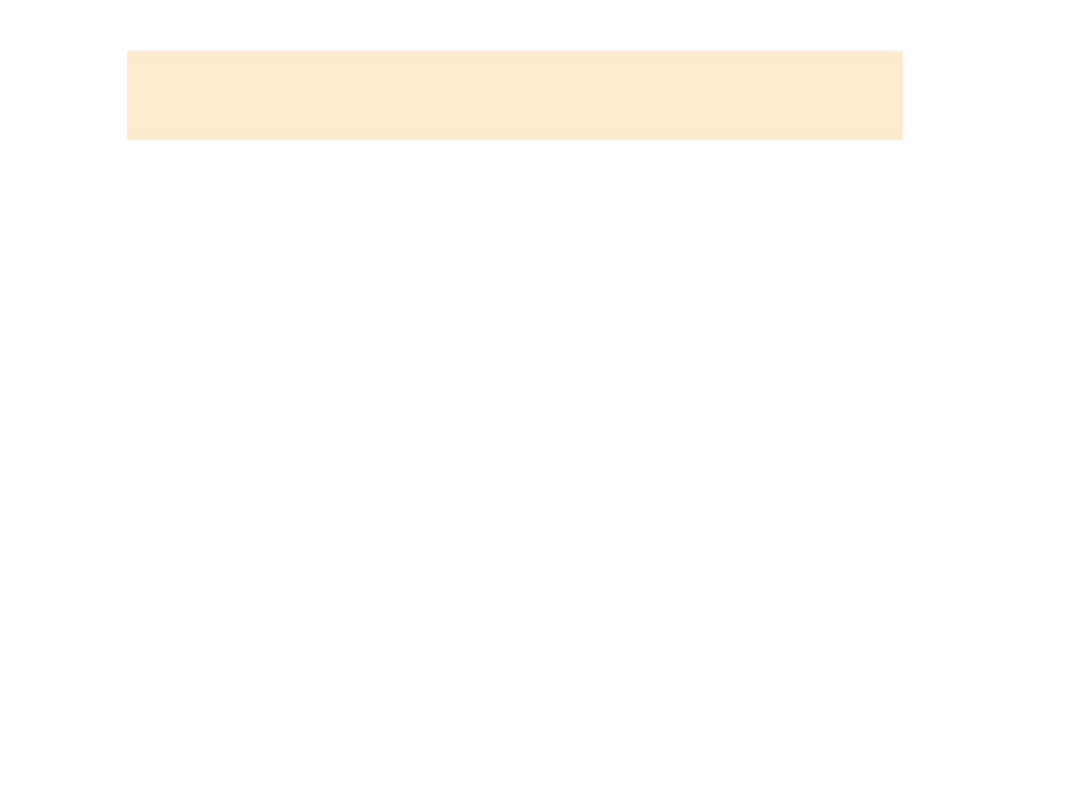
Elektroda
Reakcja elektrodowa
Potencjał
standardowy
/V/
K/K
+
K ⇆ K
+
+ e
- 2,92
Ca/Ca
2+
Ca ⇆ Ca
2+
+ 2e
- 2,84
Na, Na
+
Na ⇆ Na
+
+ e
- 2,71
Mg/Mg
2+
Mg ⇆ Mg
2+
+ 2e
- 2,37
Al/Al
3+
Al ⇆ Al
3+
+ 3e
- 1,66
Zn/Zn
2+
Zn ⇆ Zn
2+
+ 2e
- 0,76
Cr/Cr
3+
Cr ⇆ Cr
3+
+ 3e
- 0,71
Fe/Fe
2+
Fe ⇆Fe
2+
+ 2e
- 0,44
Cd/Cd
2+
Cd ⇆ Cd
2+
+ 2e
- 0,43
Co/Co
2+
Co ⇆ Co
2+
+ 2e
- 0,25
Ni/Ni
2+
Ni ⇆ Ni
2+
+ 2e
- 0,24
Sn/Sn
2+
Sn ⇆ Sn
2+
+ 2e
- 0,14
Pb/Pb
2+
Pb ⇆ Pb
2+
+ 2e
- 0,13
H
2
/H
+
H
2
⇆
2H
+
+ 2e
0,00
Cu/Cu
2+
Cu
2+
+ 2e ⇆ Cu
+ 0,345
Hg/Hg
2+
Hg
2+
+ 2e ⇆ Hg
+ 0,854
Ag/Ag
+
Ag
+
+ e⇆Ag
+ 0,800
Au/Au
+
Au
+
+ e ⇆ Au
+ 1,420

SZEREG ELEKTROCHEMICZNY -
ZNACZENIE
1. Znajomość standardowych
potencjałów elektrod umożliwia
obliczanie siły elektromotorycznej
ogniw złożonych z dwóch dowolnych
półogniw.

Obliczając SEM danego ogniwa zapisujemy schemat ogniwa, tak by symbol
półogniwa w którym zachodzi redukcja, znalazł się po prawej stronie.
Jest to ogólnie przyjęta zasada schematycznego zapisywania ogniw!
Np. schemat ogniwa Daniella w którym zachodzi reakcja:
Cu
2+
(aq) + Zn (s) Cu (s) + Zn
2+
(aq)
zapiszemy:
Zn ZnSO
4
CuSO
4
Cu
Zn/Zn
2+
Zn <=> Zn
2+
+ 2e
- 0,76 V
Cu/Cu
2+
Cu
2+
+ 2e <=> Cu
+ 0,345 V
Wartości potencjałów odpowiednich półogniw
wynoszą
:
SEM STANOWI RÓŻNICĘ POTENCJAŁÓW ELEKTRODY PRAWEJ I LEWEJ:
E = +0,34V - (-0,76V) = 1,10 V

• SEM ogniwa zbudowanego z dwóch
metali jest tym większą im dalej od
siebie są one położone w szeregu
napięciowym.
SZEREG ELEKTROCHEMICZNY -
ZNACZENIE
2. Potencjały standardowe substancji
informują o ich właściwościach.
SZEREG ELEKTROCHEMICZNY -
ZNACZENIE
Wypierają H
2
z wody, pary,
kwasów
Li
K
Ca
Na
Wypierają H
2
z pary,
kwasów
Mg
Al
Mn
Zn
Fe
Wypierają H
2
z tylko z
kwasów
Ni
Sn
Pb
H
2
Nie wypierają
H
2
z kwasów
Cu
Ag
Pt
Au

• Metale o dodatnim potencjale
reagują
TYLKO
z kwasami
utleniającymi czemu towarzyszy
redukcja niemetalu wchodzącego w
skład kwasu:
3Cu + 8HNO
3
3Cu (NO
3
)
2
+ 2NO
+4H
2
O
• Metale w stanie wolnym
zachowują się jak reduktory. Są
tym silniejszymi reduktorami im
niższy jest ich potencjał
standardowy.
SZEREG ELEKTROCHEMICZNY -
ZNACZENIE

Praktyczny podział ogniw galwanicznych
• nieodwracalne
ogniwa galwaniczne
(ogniwa pierwotne)
• ogniwa odwracalne
- akumulatory
(ogniwa wtórne)
• ogniwa paliwowe
, w których
substraty reakcji elektrodowych
doprowadzane są z zewnątrz do
powierzchni elektrod.

ELEKTROLIZA

ELEKTROLIZA
• W ogniwie galwanicznym energia
elektryczna powstaje w wyniku
przebiegającej w nim samorzutnie reakcji
chemicznej.
• Urządzenie zbudowane w taki sam sposób
jak ogniwo, lecz w którym przebieg reakcji
wymuszony jest przez przyłączenie
elektrod do zewnętrznego źródła prądu
stałego nazywane jest elektrolizerem.
• Proces zachodzący w elektrolizerze to
ELEKTROLIZA
.
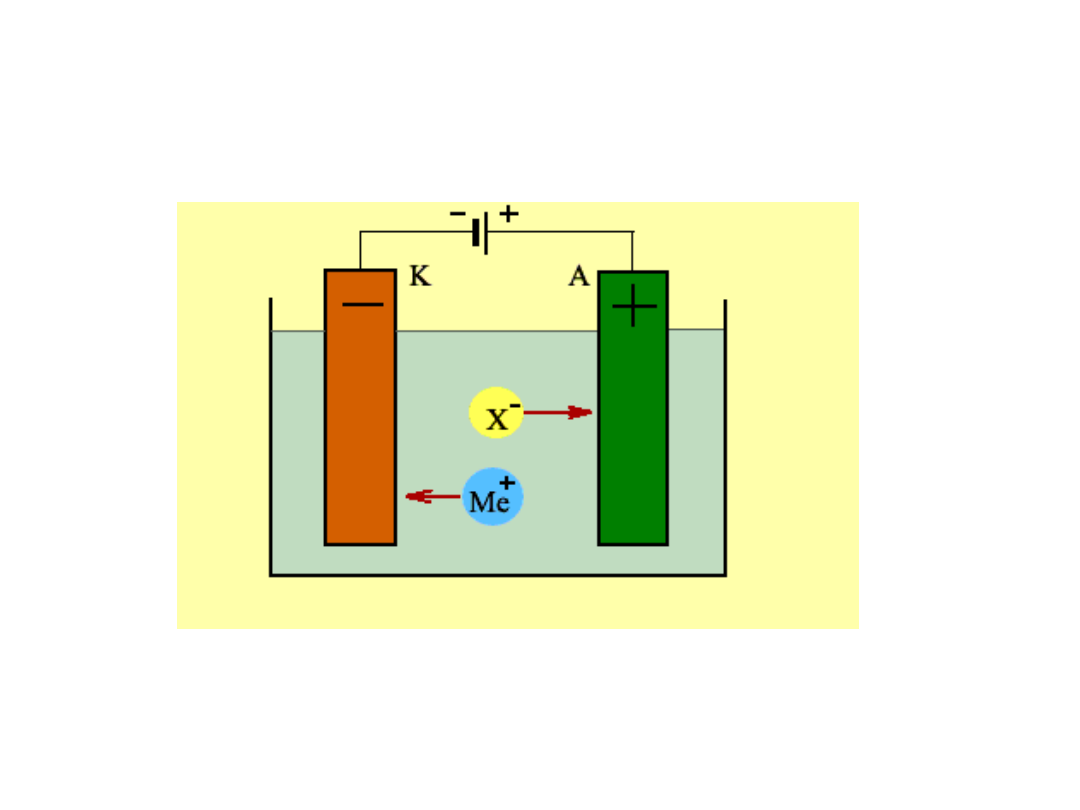
ELEKTROLIZA
Katoda: reakcja redukcji (-) elektrony płyną z zewnętrznego źródła prądu
Anoda: reakcja utleniania (+) elektrony płyną do zewnętrznego źródła prądu
.

• Michael Faraday (1833 r) - pierwsze ilościowe
badania nad zjawiskiem elektrolizy.
• masa substancji ulegającej przemianie na elektrodzie
jest proporcjonalna do przepuszczonego przez
elektrolit ładunku elektrycznego
• masy różnych substancji ulegających podczas
elektrolizy przemianom elektrochemicznym na
elektrodach wskutek przepływu tej samej wielkości
ładunku elektrycznego są proporcjonalne do ich
równoważników elektrochemicznych.
ELEKTROLIZA

m= k
e
It
m – masa substancji, która uległa przemianie chemicznej
I- natężenie prądu [A]
t- czas elektrolizy [s]
k
e
- równoważnik elektrochemiczny, odpowiadający masie substancji,
która uległa przemianie pod wpływem ładunku jednego kulomba [g/C]
k
e
= G/ zF
G – masa molowa reagenta [g/mol]
z- liczba elektronów biorąca udział w reakcji
F- stała Faradaya, czyli ładunek niesiony przez 1 mol elektronów,
96 480 C/mol
ELEKTROLIZA

• Procesy chemiczne przebiegające na
powierzchni elektrod podczas
przepływu prądu zależą od
właściwości chemicznych zarówno
metalu jak i składników roztworu, a
ponadto od różnicy potencjałów
pomiędzy elektrodami.
ELEKTROLIZA

• Reakcje katodowe (reakcje redukcji)
np.:
Cu
2+
+ 2e
-
Cu
2H
3
O
+
+ 2e
-
H
2
+ 2H
2
O
• Kolejność wydzielania substancji jest związana z ich położeniem w
szeregu elektrochemicznym.
• Jeżeli elektrolit stanowią obojętne sole metali I grupy układu
okresowego np. NaCl, Na
2
SO
4
to na katodzie zachodzi reakcja
redukcji wody:
2H
2
O + 2e
-
H
2
+ 2OH
-
Nie można otrzymać metali alkalicznych z roztworów wodnych
ich soli!
Redukcja tych kationów zachodzi łatwo ze stopionych soli
ELEKTROLIZA

Reakcje anodowe (reakcje utleniania). Istotny jest materiał
anody.
• ELEKTRODY NIEROZPUSZCZALNE
(Pt, C, Pd, Au).
Rolą elektrody jest transport elektronu od substancji z roztworu do
obwodu zewnętrznego elektrolizera.
Jeżeli w roztworze obecne są jony halogenkowe (Cl
-
, I
-
) to na anodzie
wydzielają się chlorowce:
2Cl
-
Cl
2
+ 2e
-
Utlenianie wody
jest jedyną reakcją anodową w roztworach
siarczanów , azotanów, fosforanów (jony te nie ulegają utlenieniu
w środowisku wodnym)
2H
2
O O
2
+ 4H
+
+ 4e
-
ELEKTROLIZA

• ELEKTRODY ROZPUSZCZALNE
uczestniczące
w procesie utleniania anodowego (elektrody
wykonane z Fe, Zn, Cu, Ni).
Może nastąpić roztwarzanie elektrody:
Cu Cu
2+
+ 2e
-
ELEKTROLIZA

• Zastosowanie elektrolizy
• jedyna przemysłowa metoda
otrzymywania fluoru
• metoda otrzymywania metali
alkalicznych w wyniku elektrolizy
stopionych soli
• otrzymywanie powłok galwanicznych
• otrzymywanie metali o wysokiej
czystości (elektrorafinacja miedzi)
ELEKTROLIZA

KOROZJA MATERIAŁÓW

KOROZJA
• Korozja jest to proces niszczenia
metali w wyniku reakcji
elektrochemicznych i chemicznych
zachodzących podczas zetknięcia się
metali z otaczającym je
środowiskiem gazowym albo ciekłym.
Proces zaczyna się na powierzchni
metalu.

Biorąc za podstawę klasyfikacji przyczyny zjawiska
rozróżnia się trzy rodzaje korozji:
• elektrochemiczną
• chemiczną
• biologiczną
Korozja elektrochemiczna jest najczęściej
spotykanym typem korozji.
Korozji ulegają nie tylko metale, ale także materiały
konstrukcyjne takie jak beton czy tworzywa
sztuczne.
KOROZJA

• Właściwym procesem korozyjnym
wywołanym przez działanie ogniw
korozyjnych jest proces anodowy
(przejście atomów metalu M do
roztworu w postaci jonów dodatnich
M
n+
, gdzie n oznacza ich ładunek
M M
n+
+ n e
KOROZJA METALI

• Uwolnione w procesie anodowym
elektrony zużywane są w równolegle
przebiegającym procesie katodowym.
Może to być wydzielanie wodoru: w przypadku
kwaśnego roztworu elektrolitu depolaryzacja
wodorowa przebiega według równania reakcji:
2H
+
+ 2e H
2
albo redukcja rozpuszczonego w obojętnym
roztworze elektrolitu tlenu (depolaryzacja
tlenowa) według równania:
1/2 O
2
+ 2e + H
2
O 2 OH
-
KOROZJA METALI

Proces anodowy i katodowy biegną w różnych miejscach
powierzchni metalu.
Lokalne ogniwa korozyjne można podzielić na:
• ogniwa powstałe wskutek zetknięcia dwóch różnych
metali
• ogniwa powstałe w wyniku zetknięcia metalu z
wtrąceniami niemetalicznymi (np. tlenek metalu)
• ogniwa wytworzone wskutek częściowej pasywacji
metalu, tj. częściowego pokrycia go tlenkami
• ogniwa powstałe w rezultacie napięć mechanicznych,
występujących w niejednorodnym chemicznie metalu
czy stopie.
• ogniwa stężeniowe tworzące się wówczas, gdy kawałek
metalu styka się z roztworami o różnych stężeniach soli
lub tlenu
KOROZJA METALI
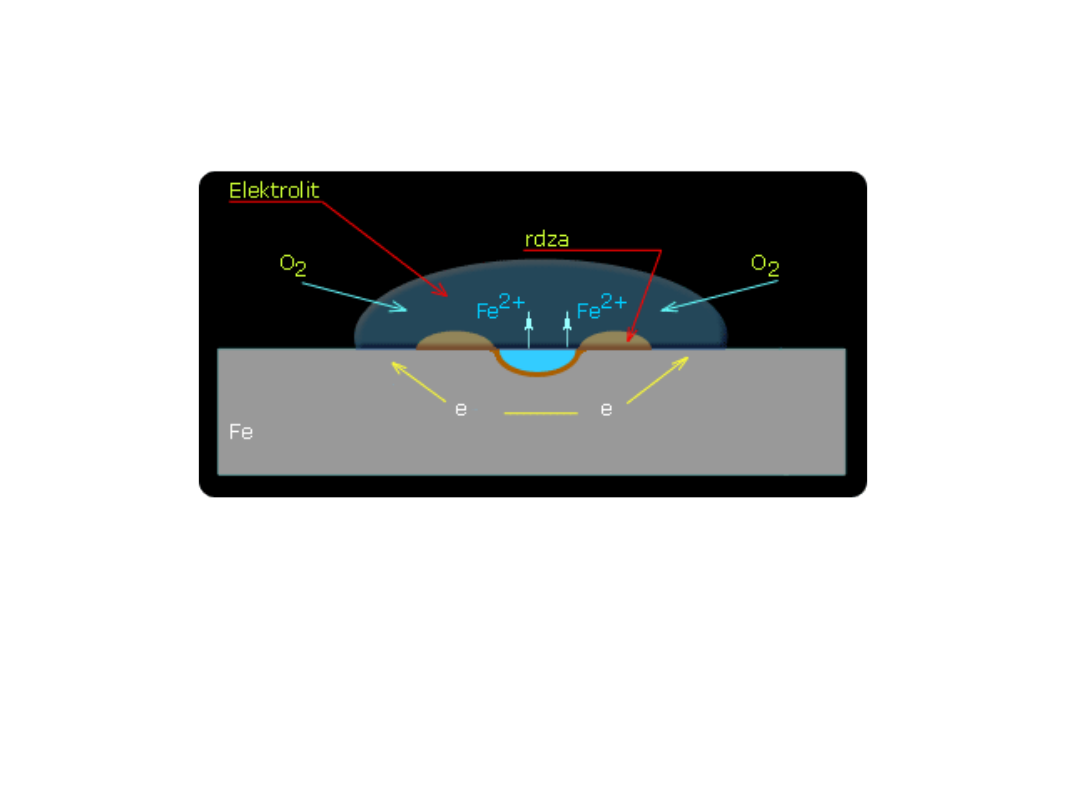
KOROZJA METALI
O
2
+ 4e
-
+ H
2
O 4
OH
-
2Fe 2Fe
2+
+
4e
-

• W przypadku płytki z żelaza powstające w reakcji katodowej
jony OH
-
spotykają się z dyfundującymi od obszarów
anodowych jonami Fe
2+
dając nierozpuszczalny Fe(OH)
2
. Pod
wpływem rozpuszczonego w wodzie tlenu Fe(OH)
2
ulega
powolnemu utlenieniu do Fe(OH)
3
według równania
2Fe(OH)
2
+ H
2
O + 1/2O
2
2Fe(OH)
3
• Mieszanina wodorotlenków Fe(OH)
2
i Fe(OH)
3
, po dłuższym
czasie na skutek reakcji częściowo przechodzi w tlenki
żelaza(III) o różnym stopniu uwodnienia lub w węglany. Jest
to tzw. rdza.
• Dla metali technicznych proces korozji jest znacznie
bardziej skomplikowany, co wynika z niejednorodności
powierzchni i zawartych w nich domieszek.
KOROZJA METALI

W krańcowym przypadku korozję
można rozpatrywać jako wynik
działania lokalnych mikroogniw, w
których rolę mikroanod odgrywa
korodujący metal mikrokatod zaś
obce wytrącenia.
KOROZJA

• Korozja może być także
spowodowana przez przepływ
przypadkowych prądów. Prądy
pochodzą z rozmaitego typu
urządzeń (tramwaje, kolej
elektryczna). Np. dla rur zakopanych
w ziemi na granicy styku metal-
wilgotna gleba zachodzą procesy, w
wyniku których w miejscach gdzie
prąd opuszcza przewód zachodzi
korozja.
KOROZJA

OCHRONA PRZED KOROZJĄ
Istotny jest dobór tworzywa i jego
odpowiednia obróbka, gdyż wszelkie
niejednorodności sprzyjają korozji.
1. Dobór odpowiedniego metalu lub
stopu.

2. Osłabienie agresywności
środowiska. Sposób ten można
stosować, gdy ilość ośrodka
atakującego jest ograniczona.
Stosuje się w tym przypadku:
• zmniejszenie depolaryzacji
tlenowej
przez usuwanie tlenu i
elektrolitów o odczynie obojętnym
np. odpowietrzanie wody kotłowej
OCHRONA PRZED KOROZJĄ

• inhibitory (opóźniacze).
Są to substancje
organiczne lub nieorganiczne, które
dodane do środowiska agresywnego,
zmniejszają wybitnie szybkość procesów
korozyjnych. Działanie inhibitorów
tłumaczy się tworzeniem trudno
rozpuszczalnych warstewek zaporowych w
miejscach katodowych lub anodowych
metalu.
OCHRONA PRZED KOROZJĄ

• ochrona katodowa
polega na tym, że do konstrukcji
chronionej dołącza się zewnętrzną anodę w postaci
metalu o potencjale elektrodowym niższym niż materiał
chronionej konstrukcji.
Płyta taka nazywa się PROTEKTOREM.
Połączenie protektora z konstrukcją chronioną
wykonuje się przez bezpośredni styk lub za pomocą
przewodnika. Materiał chronionej konstrukcji staje się
katodą i nie koroduje.
Dobrym materiałem na protektor dla konstrukcji
pracujących w wodzie morskiej jest cynk. Ma on
zastosowanie do ochrony kadłubów statków, kotłów i
rurociągów.
OCHRONA PRZED KOROZJĄ

•
powłoki ochronne metaliczne
na podstawie działania
rozróżnia się powłoki katodowe i anodowe.
POWŁOKI KATODOWE
utworzone są z metalu o potencjale elektrodowym
bardziej elektrododatnim niż metal chroniony w danych warunkach
oddziaływania środowiska.
Działanie powłoki ochronnej katodowej jest czysto mechaniczne, spełnia
swoje zadanie tylko wtedy, gdy powłoka jest całkowicie szczelna.
Powłokami katodowymi na stali są: nikiel, miedź, cyna, ołów, chociaż
mogą być stosowane również powłoki wielowarstwowe np. Cu-Ni-Cr.
POWŁOKI ANODOWE
utworzone są z metalu o bardziej elektroujemnym
potencjale elektrodowym niż metal chroniony. Powłoki te chronią metal
elektrochemicznie, nawet jeżeli są porowate. Dla stopów żelaza
najlepszym pokryciem anodowym jest cynk i kadm.
OCHRONA PRZED KOROZJĄ

• powłoki ochronne niemetaliczne
otrzymuje się
przez wytworzenie na powierzchni metalu chronionego
jego związku chemicznego, najczęściej tlenku,
fosforanu itp. na drodze reakcji chemicznej lub
elektrochemicznej.
Powłoki ochronne niemetaliczne nakładane dzielą się na:
a) nieorganiczne - emalie, powłoki cementowe
b) organiczne - lakiery, smoły, asfalty, smary i farby
Głównym zadaniem tych powłok jest mechaniczna
izolacja powierzchni metalicznej od środowiska
agresywnego.
OCHRONA PRZED KOROZJĄ
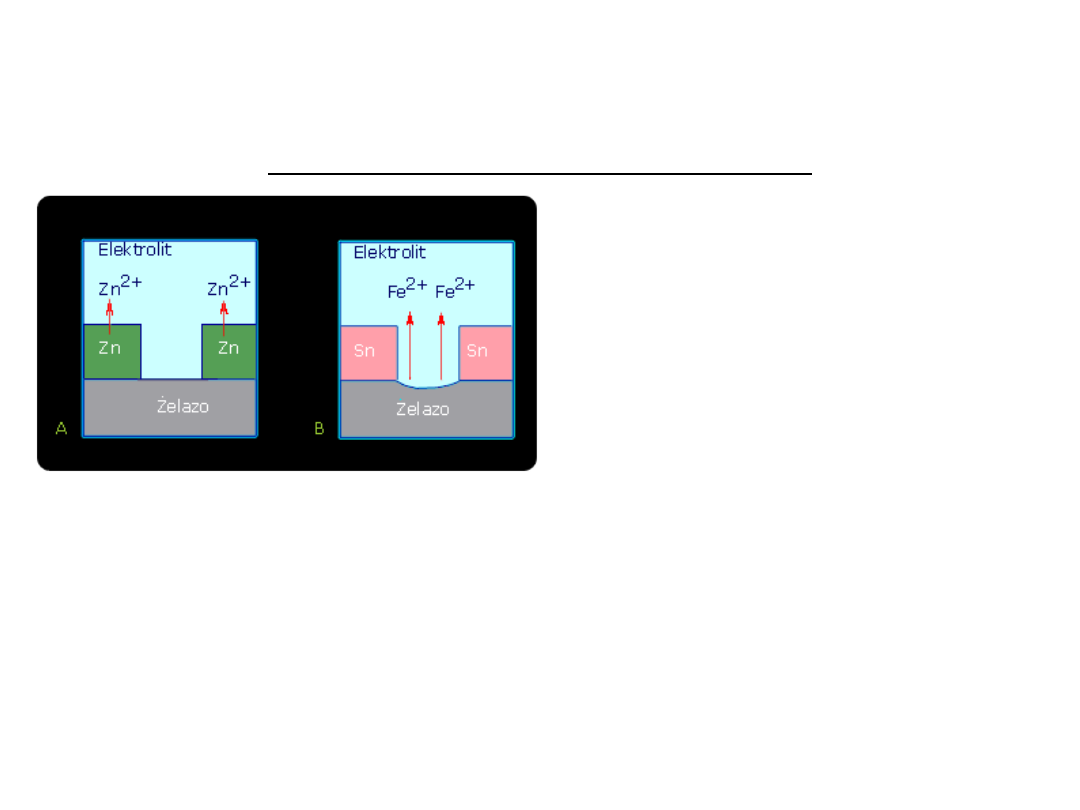
OCHRONA PRZED KOROZJĄ
Przykłady zastosowania powłok metalicznych
Zn/Zn
2+
Zn <=> Zn
2+
+ 2e
- 0,76
Fe/Fe
2+
Fe <=> Fe
2+
+
2e
- 0,44
Sn/Sn
2+
Sn <=> Sn
2+
+ 2e
- 0,14
Fe/elektrolit/Sn.
Fe Fe
2+
+ 2e
Uwolnione elektrony są zużywane w
procesie katodowym (depolaryzacja
wodorowa, gdy roztwór jest kwaśny, a
tlenowa - gdy obojętny.
Zn / elektrolit / Fe

PASYWNOŚĆ METALI
• Właściwość metali polegająca na
tym, że nie ulegają one reakcji
anodowego roztwarzania pomimo
osiągnięcia potencjału, przy którym
proces ten powinien zachodzić.
Jedna z teorii pasywacji zakłada, że
na powierzchni metalu tworzy się
cienka warstewka tlenku, która
izoluje metal od zetknięcia się ze
środowiskiem.

Pasywacji ulegają:
• chrom, nikiel, molibden, tytan,
cyrkon – pod wpływem działania
powietrza
• żelazo – pod wpływem działania np.
stężonego kwasu azotowego
PASYWNOŚĆ METALI

Pasywacji sprzyja:
• obecność anionów o działaniu
utleniającym (np. NO
3
-
, ClO
3
-
)
Pasywacji przeciwdziała:
• obecność jonów halogenkowych,
substancji redukujących oraz
podwyższenie temperatury.
PASYWNOŚĆ METALI

KOROZJA CHEMICZNA
KOROZJA CHEMICZNA
Korozja chemiczna polega na bezpośrednim ataku
czynnika korozyjnego na metal lub stopy.
Przez metal podczas reakcji z czynnikiem
korozyjnym (utleniaczem)
NIE PRZEPŁYWA PRĄD
ELEKTRYCZNY
. Wymiana elektronów między
metalem a utleniaczem przebiega w środowisku
nie wykazującym przewodnictwa jonowego.
Reakcję korozji według mechanizmu chemicznego
można przedstawić za pomocą ogólnego równania.
mM + nU --> M
m
U
n
M - metal, U - utleniacz

• Najpospolitszym przykładem tego typu korozji
jest korozja w gazach w podwyższonej
temperaturze.
Żelazo czyli stal ogrzewane w powietrzu lub
ogólnie w atmosferze utleniającej, powleka się
warstewką tlenków żelaza głównie: Fe
3
O
4
, ale
powstają także pewne ilości Fe
2
O
3
i FeO,
wskutek bezpośredniej reakcji między żelazem
a tlenem czy też innym czynnikiem
utleniającym.
KOROZJA CHEMICZNA

Korozja chemiczna atakuje zwykle
równocześnie całą powierzchnię metalu
narażoną na zetknięcie z czynnikiem
korozyjnym albo prowadzi do wytworzenia
szczelnie przylegającej ochronnej warstwy
produktów korozji, albo daje w wyniku
warstwę porowatą, nie chroniącą metalu.
W tym drugim przypadku korozja trwa aż
do zupełnego zniszczenia metalu lub
wyczerpania czynnika korozyjnego.
KOROZJA CHEMICZNA
Document Outline
- Slide 1
- ELEKTROCHEMIA
- ELEKTROCHEMIA
- Ogniwo Daniella
- Ogniwo Daniella
- Ogniwo Daniella
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- OGNIWA GALWANICZNE
- OGNIWA GALWANICZNE
- PÓŁOGNIWO WODOROWE
- PÓŁOGNIWO WODOROWE
- SZEREG ELEKTROCHEMICZNY
- Slide 16
- SZEREG ELEKTROCHEMICZNY - ZNACZENIE
- Slide 18
- SZEREG ELEKTROCHEMICZNY - ZNACZENIE
- SZEREG ELEKTROCHEMICZNY - ZNACZENIE
- SZEREG ELEKTROCHEMICZNY - ZNACZENIE
- Praktyczny podział ogniw galwanicznych
- elektroliza
- ELEKTROLIZA
- ELEKTROLIZA
- ELEKTROLIZA
- ELEKTROLIZA
- ELEKTROLIZA
- ELEKTROLIZA
- ELEKTROLIZA
- ELEKTROLIZA
- ELEKTROLIZA
- KOROZJA Materiałów
- KOROZJA
- KOROZJA
- KOROZJA METALI
- KOROZJA METALI
- KOROZJA METALI
- KOROZJA METALI
- KOROZJA METALI
- KOROZJA
- KOROZJA
- OCHRONA PRZED KOROZJĄ
- OCHRONA PRZED KOROZJĄ
- OCHRONA PRZED KOROZJĄ
- OCHRONA PRZED KOROZJĄ
- OCHRONA PRZED KOROZJĄ
- OCHRONA PRZED KOROZJĄ
- OCHRONA PRZED KOROZJĄ
- PASYWNOŚĆ METALI
- PASYWNOŚĆ METALI
- PASYWNOŚĆ METALI
- Korozja chemiczna
- KOROZJA CHEMICZNA
- KOROZJA CHEMICZNA
- KOROZJA CHEMICZNA
Wyszukiwarka
Podobne podstrony:
w10 elektrochemia korozja
wyklad 12nowy procesy elektrodowe i korozja
PROCESY ELEKTROCHEMICZNE I KOROZJA
w10, Elektrotechnika, Podstawy elektroenergetyki i bezpieczeństwo użytkowania urządzeń elektrycznych
elektrochemia korozja
wykład 5 elektroliza i korozja
wyklad 12nowy procesy elektrodowe i korozja
więcej podobnych podstron