
ELEKTROCHEMIA

• Reakcje polegające na wymianie
elektronów pomiędzy substancją
utleniającą a substancją redukującą
to reakcje utleniania i redukcji
(procesy redoks).
ELEKTROCHEMIA
2 Mg (s) + O
2
2 MgO
(g)
(s)
magnez jest reduktorem: utlenia się do jonów
Mg
2+
tlen jest utleniaczem: redukuje się do O
2-

Samorzutna reakcja?
Jaki jest kierunek reakcji?
ELEKTROCHEMIA
Cu
2+
(aq) + Zn (s) Cu (s) + Zn
2+
(aq)
Cu
2+
(aq) + Zn (s) Cu (s) + Zn
2+
(aq)
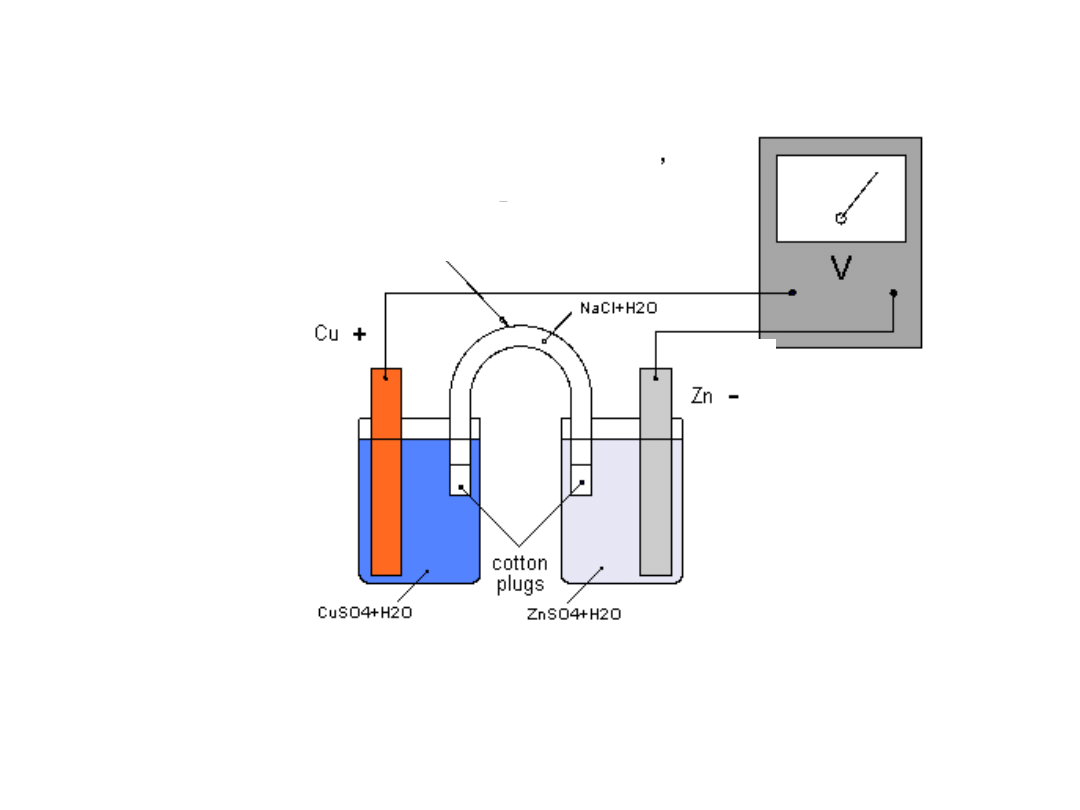
Ogniwo Daniella
Zn ZnSO
4
(c
1
) CuSO
4
(c
2
) Cu
mostek solny
anoda
Ogniwo Daniella (wersja z
mostkiem solnym)
katoda

Ogniwo Daniella

• Ogniwo Daniella jest źródłem
energii elektrycznej.
• Energia powstaje w wyniku
przebiegającej
samorzutnie
reakcji chemicznej.
• W ogniwie zachodzą reakcje
utleniania i redukcji.
Ogniwo Daniella

• DLA OGNIWA DANIELLA:
• elektroda cynkowa (ANODA) (-):
Zn Zn
2+
+2e
-
• Obserwujemy zużywanie się elektrody
cynkowej z równoczesnym wzrostem stężenia
siarczanu cynku w roztworze. Zachodzi
reakcja utleniania, w trakcie której zachodzi
przekazanie elektronów elektrodzie
powodujące pojawienie się ładunku
ujemnego. Anoda ma więc niższy potencjał.

• DLA OGNIWA DANIELLA:
• elektroda miedziana (KATODA) (+):
Cu
2+
+2e
-
Cu
• Jednocześnie na katodzie wydziela się
miedź, a stężenie siarczanu miedzi maleje.
Zachodzi reakcja redukcji.
• Katoda ma wyższy potencjał w wyniku
odbierania elektronów przez substancję
ulegającą redukcji.

Cu
2+
(aq) + Zn (s) Cu (s) + Zn
2+
(aq)
SUMARYCZNA reakcja w ogniwie:
Ta sama reakcja zachodzi w roztworze
siarczanu miedzi, ale nie towarzyszy temu
przepływ prądu.
W ogniwie galwanicznym w wymianie
elektronów pośredniczy obwód
zewnętrzny ogniwa.

Potencjał elektrody zanurzonej w roztworze
jonów tego samego pierwiastka zwany
potencjałem utleniająco-redukujacym
(potencjał redox), określa
RÓWNANIE
NERNSTA
E = E
o
+ RT/nF * lna
M
n
+
E
o
- potencjał normalny,
R - stała gazowa,
F - stała Faraday’a,
n - liczba elektronów biorących udział w
reakcji utlenienia-redukcji,
a
M
n
+
- aktywność kationów metalu w
roztworze (dla roztworów rozcieńczonych:
stężenie).

OGNIWA GALWANICZNE
• W ogniwie wytwarza się różnica
potencjałów określana jako SIŁA
ELEKTROMOTORYCZNA OGNIWA (SEM).
• PÓŁOGNIWO
to metal (elektroda) wraz
z otaczającym go roztworem.
• OGNIWO
to dwie elektrody zanurzone w
elektrolicie (przewodniku jonowym),
którym może być roztwór, ciecz lub
ciało stałe.

Budowa ogniw galwanicznych:
• półogniwa mogą być zanurzone w
tym samym elektrolicie
• półogniwa mogą być zanurzone w
różnych elektrolitach.
• kontakt elektryczny zapewniony jest
przez klucz elektrolityczny.
OGNIWA GALWANICZNE
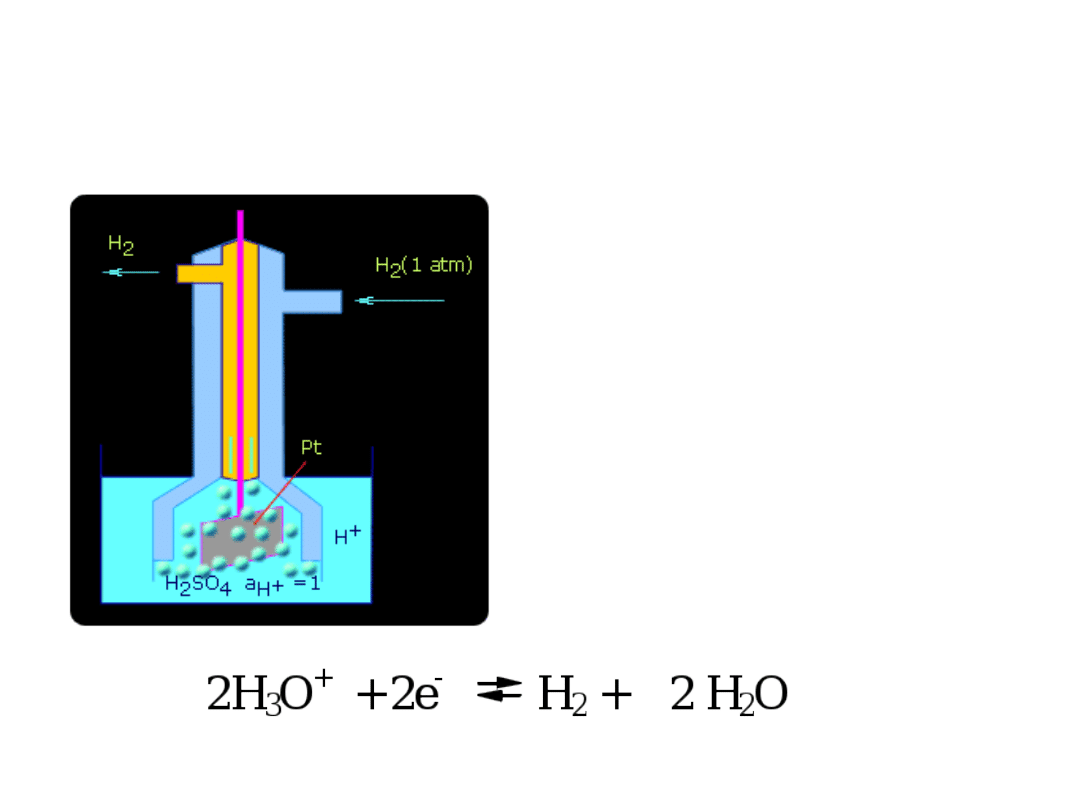
PÓŁOGNIWO WODOROWE
Standardowe półogniwo wodorowe
Pt H
2
(g) H
+
(aq)

• Potencjał standardowego półogniwa wodorowego
przyjmuje się umownie za ZERO.
• Siła elektromotoryczna (SEM) ogniwa złożonego z
normalnej elektrody wodorowej i dowolnej innej
elektrody daje zatem bezpośrednio potencjał
zastosowanej elektrody.
• Stosując elektrodę wodorową można wyznaczyć
względne wartości potencjałów normalnych przez
pomiar siły elektromotorycznej ogniwa zbudowanego z
normalnej elektrody wodorowej i badanej elektrody
zanurzonej w roztworze swych jonów o aktywności
równej jedności.
SEM takiego ogniwa jest różnicą potencjałów
normalnych obu elektrod.
E
o
= E
oH2
- E
oM
• Ponieważ potencjał standardowej elektrody wodorowej
równa się zeru to zmierzona wartość SEM jest
STANDARDOWYM WZGLĘDNYM POTENCJAŁEM
DANEJ ELEKTRODY.
PÓŁOGNIWO WODOROWE

SZEREG
ELEKTROCHEMICZNY
• Reakcje elektrodowe uszeregowane
według rosnących wartości
odpowiadających im potencjałów
standardowych noszą nazwę szeregu
napięciowego metali
• Stabelaryzowane są nie tylko wartości
potencjałów standardowych elektrod
metalicznych, ale także gazowych
oraz elektrod redoks.
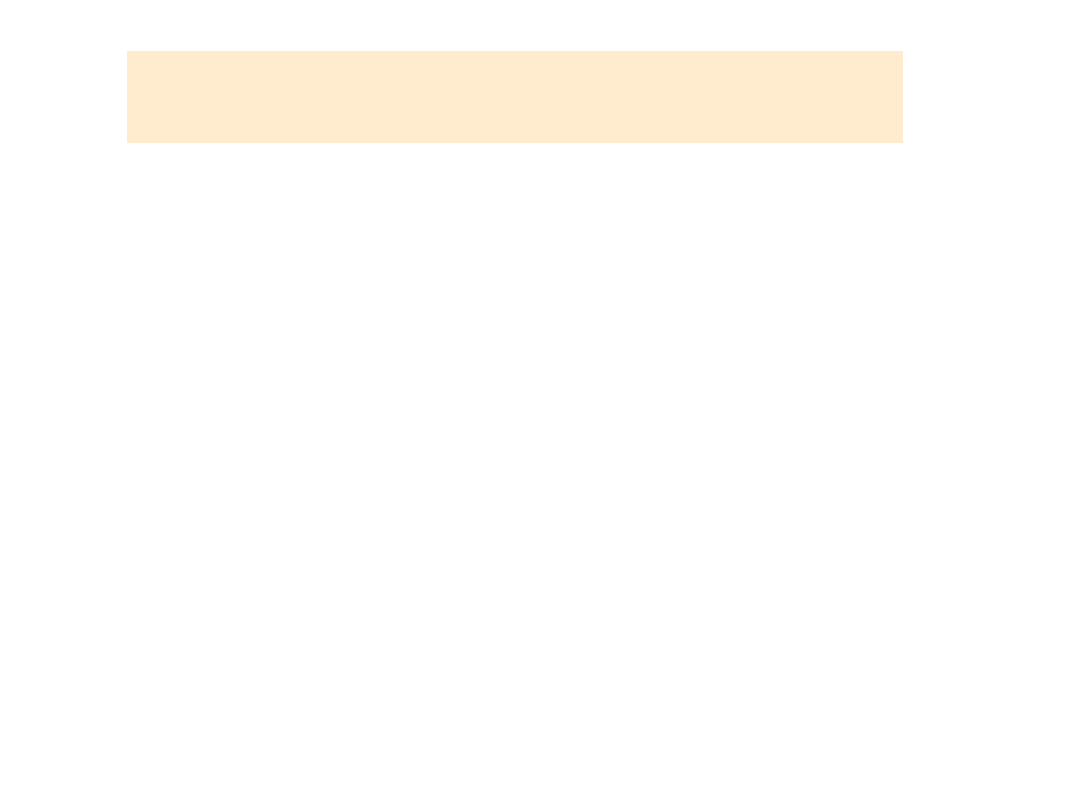
Elektroda
Reakcja elektrodowa
Potencjał
standardowy
/V/
K/K
+
K ⇆ K
+
+ e
- 2,92
Ca/Ca
2+
Ca ⇆ Ca
2+
+ 2e
- 2,84
Na, Na
+
Na ⇆ Na
+
+ e
- 2,71
Mg/Mg
2+
Mg ⇆ Mg
2+
+ 2e
- 2,37
Al/Al
3+
Al ⇆ Al
3+
+ 3e
- 1,66
Zn/Zn
2+
Zn ⇆ Zn
2+
+ 2e
- 0,76
Cr/Cr
3+
Cr ⇆ Cr
3+
+ 3e
- 0,71
Fe/Fe
2+
Fe ⇆Fe
2+
+ 2e
- 0,44
Cd/Cd
2+
Cd ⇆ Cd
2+
+ 2e
- 0,43
Co/Co
2+
Co ⇆ Co
2+
+ 2e
- 0,25
Ni/Ni
2+
Ni ⇆ Ni
2+
+ 2e
- 0,24
Sn/Sn
2+
Sn ⇆ Sn
2+
+ 2e
- 0,14
Pb/Pb
2+
Pb ⇆ Pb
2+
+ 2e
- 0,13
H
2
/H
+
H
2
⇆
2H
+
+ 2e
0,00
Cu/Cu
2+
Cu
2+
+ 2e ⇆ Cu
+ 0,345
Hg/Hg
2+
Hg
2+
+ 2e ⇆ Hg
+ 0,854
Ag/Ag
+
Ag
+
+ e⇆Ag
+ 0,800
Au/Au
+
Au
+
+ e ⇆ Au
+ 1,420

SZEREG ELEKTROCHEMICZNY -
ZNACZENIE
1. Znajomość standardowych
potencjałów elektrod umożliwia
obliczanie siły elektromotorycznej
ogniw złożonych z dwóch dowolnych
półogniw.

Obliczając SEM danego ogniwa zapisujemy schemat ogniwa, tak by symbol
półogniwa w którym zachodzi redukcja, znalazł się po prawej stronie.
Jest to ogólnie przyjęta zasada schematycznego zapisywania ogniw!
Np. schemat ogniwa Daniella w którym zachodzi reakcja:
Cu
2+
(aq) + Zn (s) Cu (s) + Zn
2+
(aq)
zapiszemy:
Zn ZnSO
4
CuSO
4
Cu
Zn/Zn
2+
Zn <=> Zn
2+
+ 2e
- 0,76 V
Cu/Cu
2+
Cu
2+
+ 2e <=> Cu
+ 0,345 V
Wartości potencjałów odpowiednich półogniw
wynoszą
:
SEM STANOWI RÓŻNICĘ POTENCJAŁÓW ELEKTRODY PRAWEJ I LEWEJ:
E = +0,34V - (-0,76V) = 1,10 V

• SEM ogniwa zbudowanego z dwóch
metali jest tym większą im dalej od
siebie są one położone w szeregu
napięciowym.
SZEREG ELEKTROCHEMICZNY -
ZNACZENIE
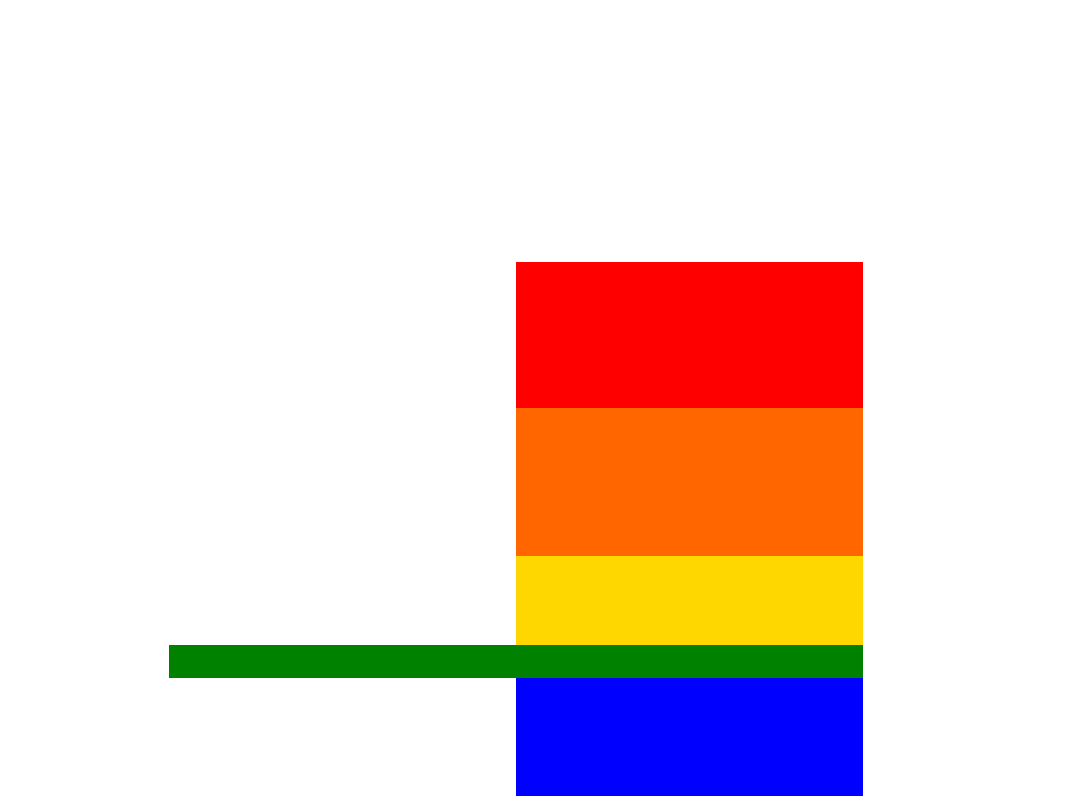
2. Potencjały standardowe substancji
informują o ich właściwościach.
SZEREG ELEKTROCHEMICZNY -
ZNACZENIE
Wypierają H
2
z wody, pary,
kwasów
Li
K
Ca
Na
Wypierają H
2
z pary,
kwasów
Mg
Al
Mn
Zn
Fe
Wypierają H
2
z tylko z
kwasów
Ni
Sn
Pb
H
2
Nie wypierają
H
2
z kwasów
Cu
Ag
Pt
Au

• Metale o dodatnim potencjale reagują
TYLKO
z kwasami utleniającymi
czemu towarzyszy redukcja niemetalu
wchodzącego w skład kwasu:
3Cu + 8HNO
3
3Cu (NO
3
)
2
+ 2NO +4H
2
O
• Metale w stanie wolnym zachowują
się jak reduktory. Są tym
silniejszymi reduktorami im niższy
jest ich potencjał standardowy.
SZEREG ELEKTROCHEMICZNY -
ZNACZENIE

Praktyczny podział ogniw
galwanicznych
• nieodwracalne
ogniwa galwaniczne
(ogniwa pierwotne)
• ogniwa odwracalne
- akumulatory
(ogniwa wtórne)
• ogniwa paliwowe
, w których
substraty reakcji elektrodowych
doprowadzane są z zewnątrz do
powierzchni elektrod.

ELEKTROLIZA

ELEKTROLIZA
• W ogniwie galwanicznym energia
elektryczna powstaje w wyniku
przebiegającej w nim samorzutnie reakcji
chemicznej.
• Urządzenie zbudowane w taki sam sposób
jak ogniwo, lecz w którym przebieg reakcji
wymuszony jest przez przyłączenie
elektrod do zewnętrznego źródła prądu
stałego nazywane jest elektrolizerem.
• Proces zachodzący w elektrolizerze to
ELEKTROLIZA
.
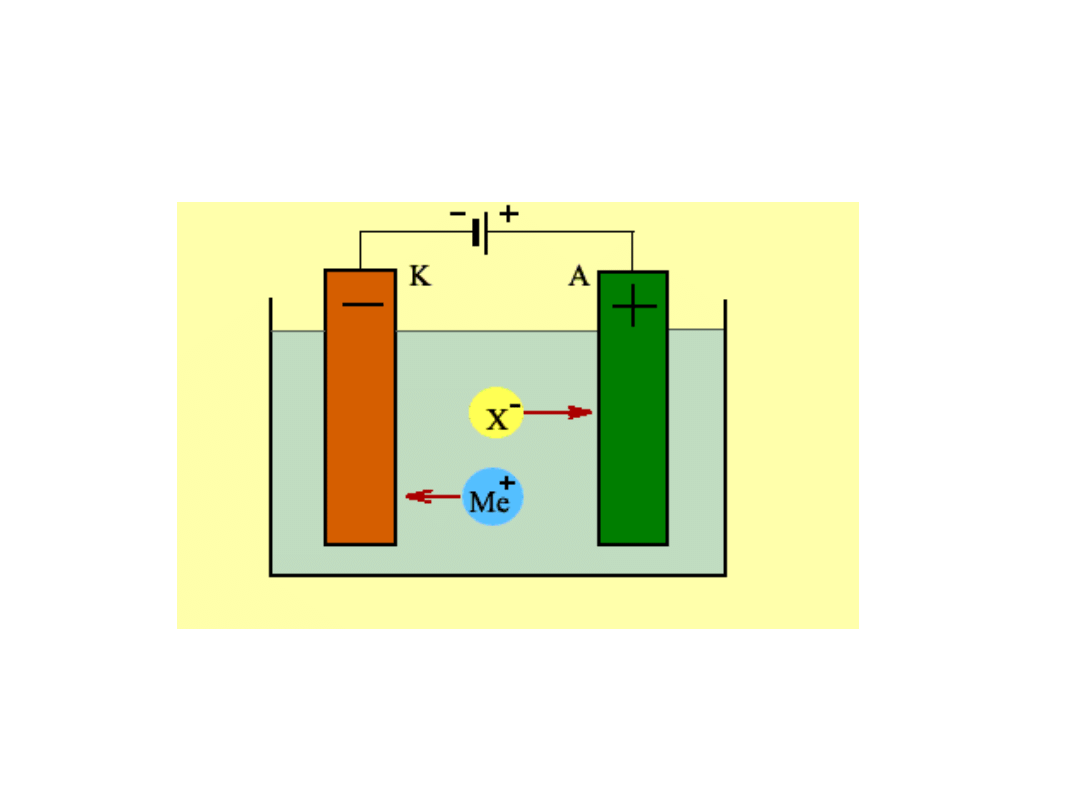
ELEKTROLIZA
Katoda: reakcja redukcji (-) elektrony płyną z zewnętrznego źródła prądu
Anoda: reakcja utleniania (+) elektrony płyną do zewnętrznego źródła prądu
.

• Michael Faraday (1833 r) - pierwsze ilościowe
badania nad zjawiskiem elektrolizy.
• masa substancji ulegającej przemianie na
elektrodzie jest proporcjonalna do
przepuszczonego przez elektrolit ładunku
elektrycznego
• masy różnych substancji ulegających podczas
elektrolizy przemianom elektrochemicznym na
elektrodach wskutek przepływu tej samej
wielkości ładunku elektrycznego są proporcjonalne
do ich równoważników elektrochemicznych.
ELEKTROLIZA

m= k
e
It
m – masa substancji, która uległa przemianie chemicznej
I- natężenie prądu [A]
t- czas elektrolizy [s]
k
e
- równoważnik elektrochemiczny, odpowiadający masie
substancji, która uległa przemianie pod wpływem ładunku
jednego kulomba [g/C]
k
e
= G/ zF
G – masa molowa reagenta [g/mol]
z- liczba elektronów biorąca udział w reakcji
F- stała Faradaya, czyli ładunek niesiony przez 1 mol elektronów,
96 480 C/mol
ELEKTROLIZA

• Procesy chemiczne przebiegające na
powierzchni elektrod podczas
przepływu prądu zależą od
właściwości chemicznych zarówno
metalu jak i składników roztworu, a
ponadto od różnicy potencjałów
pomiędzy elektrodami.
ELEKTROLIZA

• Reakcje katodowe (reakcje redukcji)
np.:
Cu
2+
+ 2e
-
Cu
2H
3
O
+
+ 2e
-
H
2
+ 2H
2
O
• Kolejność wydzielania substancji jest związana z ich
położeniem w szeregu elektrochemicznym.
• Jeżeli elektrolit stanowią obojętne sole metali I grupy układu
okresowego np. NaCl, Na
2
SO
4
to na katodzie zachodzi
reakcja redukcji wody:
2H
2
O + 2e
-
H
2
+ 2OH
-
Nie można otrzymać metali alkalicznych z roztworów
wodnych ich soli!
Redukcja tych kationów zachodzi łatwo ze stopionych
soli
ELEKTROLIZA

Reakcje anodowe (reakcje utleniania). Istotny jest
materiał anody.
• ELEKTRODY NIEROZPUSZCZALNE
(Pt, C, Pd, Au).
Rolą elektrody jest transport elektronu od substancji z
roztworu do obwodu zewnętrznego elektrolizera.
Jeżeli w roztworze obecne są jony halogenkowe (Cl
-
, I
-
) to na
anodzie wydzielają się chlorowce:
2Cl
-
Cl
2
+ 2e
-
Utlenianie wody
jest jedyną reakcją anodową w roztworach
siarczanów , azotanów, fosforanów (jony te nie
ulegają utlenieniu w środowisku wodnym)
2H
2
O O
2
+ 4H
+
+ 4e
-
ELEKTROLIZA

• ELEKTRODY ROZPUSZCZALNE
uczestniczące
w procesie utleniania anodowego (elektrody
wykonane z Fe, Zn, Cu, Ni).
Może nastąpić roztwarzanie elektrody:
Cu Cu
2+
+ 2e
-
ELEKTROLIZA

• Zastosowanie elektrolizy
• jedyna przemysłowa metoda
otrzymywania fluoru
• metoda otrzymywania metali
alkalicznych w wyniku elektrolizy
stopionych soli
• otrzymywanie powłok galwanicznych
• otrzymywanie metali o wysokiej
czystości (elektrorafinacja miedzi)
ELEKTROLIZA

KOROZJA MATERIAŁÓW

KOROZJA
• Korozja jest to proces niszczenia
metali w wyniku reakcji
elektrochemicznych i chemicznych
zachodzących podczas zetknięcia się
metali z otaczającym je
środowiskiem gazowym albo ciekłym.
Proces zaczyna się na powierzchni
metalu.

Biorąc za podstawę klasyfikacji przyczyny
zjawiska rozróżnia się trzy rodzaje korozji:
• elektrochemiczną
• chemiczną
• biologiczną
Korozja elektrochemiczna jest najczęściej
spotykanym typem korozji.
Korozji ulegają nie tylko metale, ale także
materiały konstrukcyjne takie jak beton czy
tworzywa sztuczne.
KOROZJA

• Właściwym procesem korozyjnym
wywołanym przez działanie ogniw
korozyjnych jest proces anodowy
(przejście atomów metalu M do
roztworu w postaci jonów dodatnich
M
n+
, gdzie n oznacza ich ładunek
M M
n+
+ n e
KOROZJA METALI

• Uwolnione w procesie anodowym
elektrony zużywane są w równolegle
przebiegającym procesie katodowym.
Może to być wydzielanie wodoru: w
przypadku kwaśnego roztworu elektrolitu
depolaryzacja wodorowa przebiega
według równania reakcji:
2H
+
+ 2e H
2
albo redukcja rozpuszczonego w
obojętnym roztworze elektrolitu tlenu
(depolaryzacja tlenowa) według równania:
1/2 O
2
+ 2e + H
2
O 2 OH
-
KOROZJA METALI

Proces anodowy i katodowy biegną w różnych
miejscach powierzchni metalu.
Lokalne ogniwa korozyjne można podzielić na:
• ogniwa powstałe wskutek zetknięcia dwóch
różnych metali
• ogniwa powstałe w wyniku zetknięcia metalu z
wtrąceniami niemetalicznymi (np. tlenek metalu)
• ogniwa wytworzone wskutek częściowej
pasywacji metalu, tj. częściowego pokrycia go
tlenkami
• ogniwa powstałe w rezultacie napięć
mechanicznych, występujących w
niejednorodnym chemicznie metalu czy stopie.
• ogniwa stężeniowe tworzące się wówczas, gdy
kawałek metalu styka się z roztworami o różnych
stężeniach soli lub tlenu
KOROZJA METALI
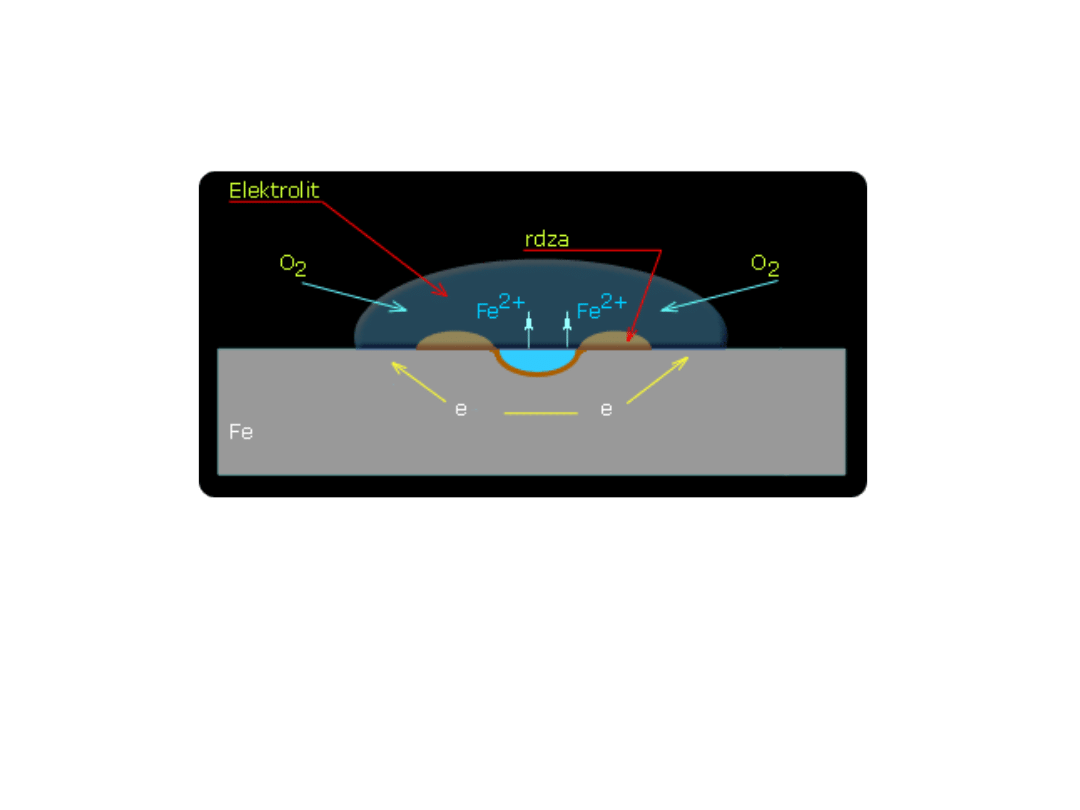
KOROZJA METALI
O
2
+ 4e
-
+ H
2
O 4
OH
-
2Fe 2Fe
2+
+
4e
-

• W przypadku płytki z żelaza powstające w reakcji
katodowej jony OH
-
spotykają się z dyfundującymi od
obszarów anodowych jonami Fe
2+
dając
nierozpuszczalny Fe(OH)
2
. Pod wpływem
rozpuszczonego w wodzie tlenu Fe(OH)
2
ulega
powolnemu utlenieniu do Fe(OH)
3
według równania
2Fe(OH)
2
+ H
2
O + 1/2O
2
2Fe(OH)
3
• Mieszanina wodorotlenków Fe(OH)
2
i Fe(OH)
3
, po
dłuższym czasie na skutek reakcji częściowo
przechodzi w tlenki żelaza(III) o różnym stopniu
uwodnienia lub w węglany. Jest to tzw. rdza.
• Dla metali technicznych proces korozji jest znacznie
bardziej skomplikowany, co wynika z niejednorodności
powierzchni i zawartych w nich domieszek.
KOROZJA METALI

W krańcowym przypadku korozję
można rozpatrywać jako wynik
działania lokalnych mikroogniw, w
których rolę mikroanod odgrywa
korodujący metal mikrokatod zaś
obce wytrącenia.
KOROZJA

• Korozja może być także spowodowana
przez przepływ przypadkowych
prądów. Prądy pochodzą z rozmaitego
typu urządzeń (tramwaje, kolej
elektryczna). Np. dla rur zakopanych w
ziemi na granicy styku metal-wilgotna
gleba zachodzą procesy, w wyniku
których w miejscach gdzie prąd
opuszcza przewód zachodzi korozja.
KOROZJA

OCHRONA PRZED KOROZJĄ
Istotny jest dobór tworzywa i jego
odpowiednia obróbka, gdyż wszelkie
niejednorodności sprzyjają korozji.
1. Dobór odpowiedniego metalu lub
stopu.

2. Osłabienie agresywności
środowiska. Sposób ten można
stosować, gdy ilość ośrodka
atakującego jest ograniczona.
Stosuje się w tym przypadku:
• zmniejszenie depolaryzacji
tlenowej
przez usuwanie tlenu i
elektrolitów o odczynie obojętnym
np. odpowietrzanie wody kotłowej
OCHRONA PRZED KOROZJĄ

• inhibitory (opóźniacze).
Są to substancje
organiczne lub nieorganiczne, które
dodane do środowiska agresywnego,
zmniejszają wybitnie szybkość procesów
korozyjnych. Działanie inhibitorów
tłumaczy się tworzeniem trudno
rozpuszczalnych warstewek zaporowych w
miejscach katodowych lub anodowych
metalu.
OCHRONA PRZED KOROZJĄ

• ochrona katodowa
polega na tym, że do
konstrukcji chronionej dołącza się zewnętrzną
anodę w postaci metalu o potencjale
elektrodowym niższym niż materiał chronionej
konstrukcji.
Płyta taka nazywa się PROTEKTOREM.
Połączenie protektora z konstrukcją chronioną
wykonuje się przez bezpośredni styk lub za
pomocą przewodnika. Materiał chronionej
konstrukcji staje się katodą i nie koroduje.
Dobrym materiałem na protektor dla konstrukcji
pracujących w wodzie morskiej jest cynk. Ma on
zastosowanie do ochrony kadłubów statków,
kotłów i rurociągów.
OCHRONA PRZED KOROZJĄ
•
powłoki ochronne metaliczne
na podstawie
działania rozróżnia się powłoki katodowe i anodowe.
POWŁOKI KATODOWE
utworzone są z metalu o potencjale
elektrodowym bardziej elektrododatnim niż metal chroniony w
danych warunkach oddziaływania środowiska.
Działanie powłoki ochronnej katodowej jest czysto mechaniczne,
spełnia swoje zadanie tylko wtedy, gdy powłoka jest całkowicie
szczelna.
Powłokami katodowymi na stali są: nikiel, miedź, cyna, ołów,
chociaż mogą być stosowane również powłoki wielowarstwowe np.
Cu-Ni-Cr.
POWŁOKI ANODOWE
utworzone są z metalu o bardziej
elektroujemnym potencjale elektrodowym niż metal chroniony.
Powłoki te chronią metal elektrochemicznie, nawet jeżeli są
porowate. Dla stopów żelaza najlepszym pokryciem anodowym
jest cynk i kadm.
OCHRONA PRZED KOROZJĄ

• powłoki ochronne niemetaliczne
otrzymuje
się przez wytworzenie na powierzchni metalu
chronionego jego związku chemicznego,
najczęściej tlenku, fosforanu itp. na drodze
reakcji chemicznej lub elektrochemicznej.
Powłoki ochronne niemetaliczne nakładane dzielą się
na:
a) nieorganiczne - emalie, powłoki cementowe
b) organiczne - lakiery, smoły, asfalty, smary i farby
Głównym zadaniem tych powłok jest mechaniczna
izolacja powierzchni metalicznej od środowiska
agresywnego.
OCHRONA PRZED KOROZJĄ
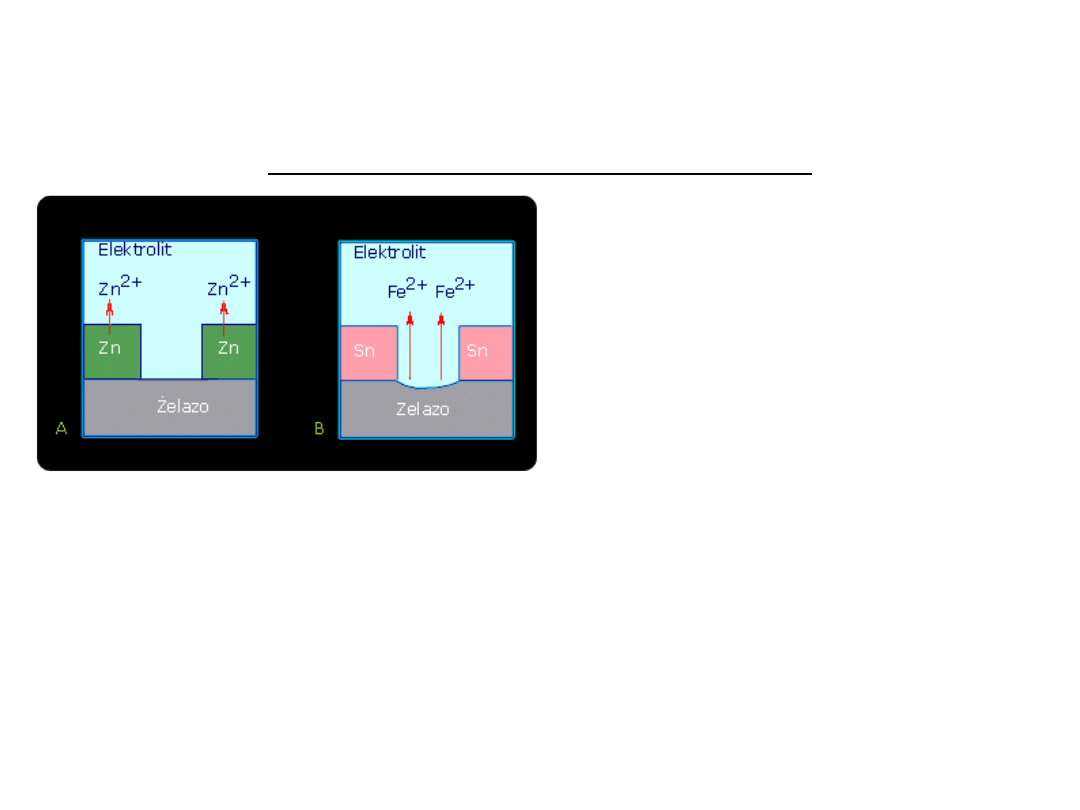
OCHRONA PRZED KOROZJĄ
Przykłady zastosowania powłok metalicznych
Zn/Zn
2+
Zn <=> Zn
2+
+ 2e
- 0,76
Fe/Fe
2+
Fe <=> Fe
2+
+
2e
- 0,44
Sn/Sn
2+
Sn <=> Sn
2+
+ 2e
- 0,14
Fe/elektrolit/Sn.
Fe Fe
2+
+ 2e
Uwolnione elektrony są zużywane w
procesie katodowym (depolaryzacja
wodorowa, gdy roztwór jest kwaśny, a
tlenowa - gdy obojętny.
Zn / elektrolit / Fe

PASYWNOŚĆ METALI
• Właściwość metali polegająca na tym,
że nie ulegają one reakcji anodowego
roztwarzania pomimo osiągnięcia
potencjału, przy którym proces ten
powinien zachodzić.
Jedna z teorii pasywacji zakłada, że na
powierzchni metalu tworzy się cienka
warstewka tlenku, która izoluje metal
od zetknięcia się ze środowiskiem.

Pasywacji ulegają:
• chrom, nikiel, molibden, tytan,
cyrkon – pod wpływem działania
powietrza
• żelazo – pod wpływem działania np.
stężonego kwasu azotowego
PASYWNOŚĆ METALI

Pasywacji sprzyja:
• obecność anionów o działaniu
utleniającym (np. NO
3-
, ClO
3-
)
Pasywacji przeciwdziała:
• obecność jonów halogenkowych,
substancji redukujących oraz
podwyższenie temperatury.
PASYWNOŚĆ METALI

KOROZJA CHEMICZNA

KOROZJA CHEMICZNA
Korozja chemiczna polega na bezpośrednim
ataku czynnika korozyjnego na metal lub stopy.
Przez metal podczas reakcji z czynnikiem
korozyjnym (utleniaczem)
NIE PRZEPŁYWA PRĄD
ELEKTRYCZNY
. Wymiana elektronów między
metalem a utleniaczem przebiega w środowisku
nie wykazującym przewodnictwa jonowego.
Reakcję korozji według mechanizmu
chemicznego można przedstawić za pomocą
ogólnego równania.
mM + nU --> M
m
U
n
M - metal, U - utleniacz

• Najpospolitszym przykładem tego typu
korozji jest korozja w gazach w
podwyższonej temperaturze.
Żelazo czyli stal ogrzewane w powietrzu
lub ogólnie w atmosferze utleniającej,
powleka się warstewką tlenków żelaza
głównie: Fe
3
O
4
, ale powstają także pewne
ilości Fe
2
O
3
i FeO, wskutek bezpośredniej
reakcji między żelazem a tlenem czy też
innym czynnikiem utleniającym.
KOROZJA CHEMICZNA

Korozja chemiczna atakuje zwykle
równocześnie całą powierzchnię metalu
narażoną na zetknięcie z czynnikiem
korozyjnym albo prowadzi do wytworzenia
szczelnie przylegającej ochronnej warstwy
produktów korozji, albo daje w wyniku
warstwę porowatą, nie chroniącą metalu.
W tym drugim przypadku korozja trwa aż
do zupełnego zniszczenia metalu lub
wyczerpania czynnika korozyjnego.
KOROZJA CHEMICZNA
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
Wyszukiwarka
Podobne podstrony:
w10 elektrochemia korozja
wyklad 12nowy procesy elektrodowe i korozja
PROCESY ELEKTROCHEMICZNE I KOROZJA
w10, Elektrotechnika, Podstawy elektroenergetyki i bezpieczeństwo użytkowania urządzeń elektrycznych
elektrochemia korozja
wykład 5 elektroliza i korozja
wyklad 12nowy procesy elektrodowe i korozja
Zagad NE09, Politechnika Wrocławska, PWR - W10- Automatyka i Robotyka, Sem3, Elektro, Podstawy elekt
sc5 druk, Politechnika Wrocławska, PWR - W10- Automatyka i Robotyka, Sem3, Elektro, Podstawy elektro
SC3, Politechnika Wrocławska, PWR - W10- Automatyka i Robotyka, Sem3, Elektro, Podstawy elektrotechn
Elektronika W10 id 159018 Nieznany
korozja elektrochemiczna metali tom
KOROZJA ELEKTROCHEMICZNA
Eegzamin zagadnienia cz1, Politechnika Wrocławska, PWR - W10- Automatyka i Robotyka, Sem3, Elektro,
sciaga elektra, Politechnika Wrocławska, PWR - W10- Automatyka i Robotyka, Sem3, Elektro, Podstawy e
tresc zadan, Politechnika Wrocławska, PWR - W10- Automatyka i Robotyka, Sem3, Elektro, Podstawy elek
więcej podobnych podstron