
Analiza
sekwencyjna
peptydów i białek
Anna Domżalska
Chemia; sem. VI
2012/2013
Peptydy i białka
Są to polimery aminokwasów, w
których poszczególne aminokwasy
zwane resztami aminokwasowymi,
połączone są wiązaniami amidowymi (
inaczej peptydowymi)
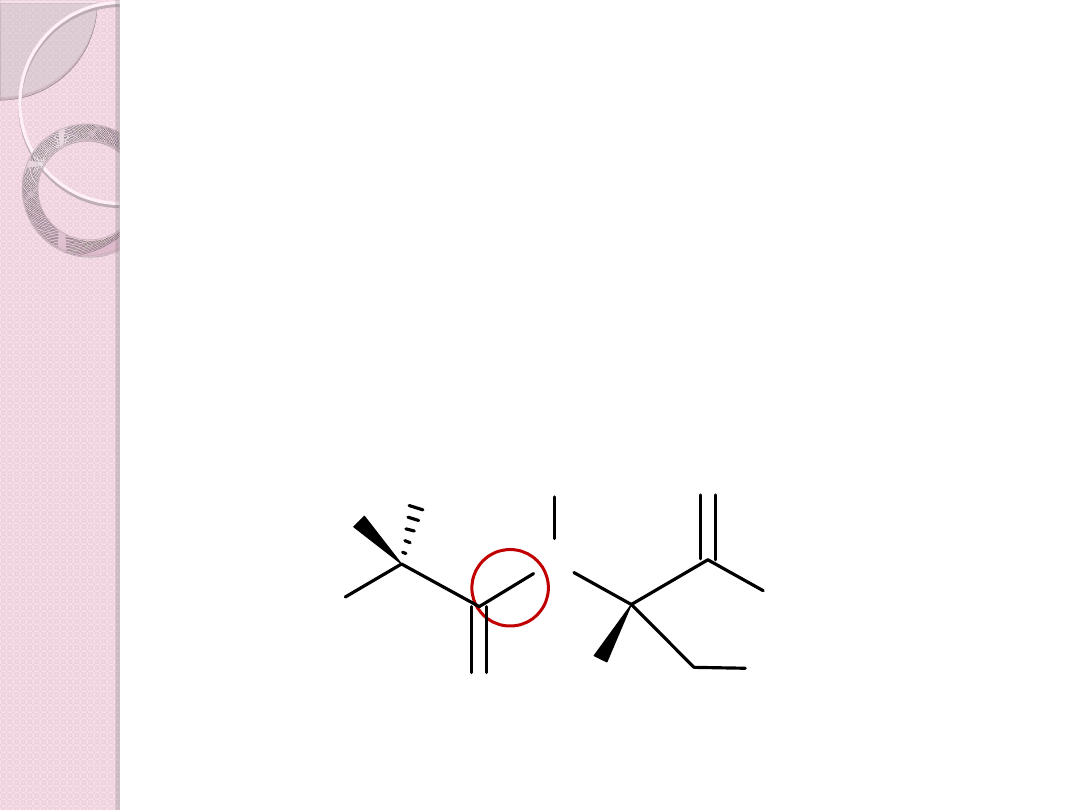
Ala – Ser
OH
N
N
H
2
O
O
N
H
2
H
H
H
OH
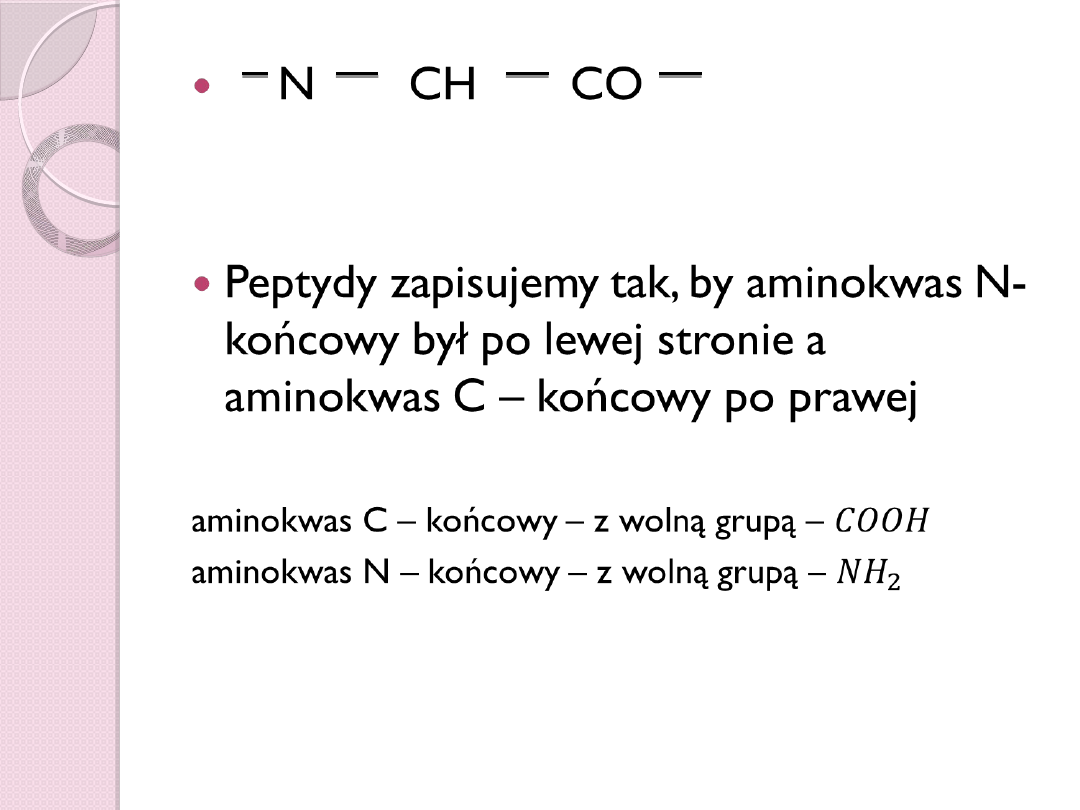
N CH CO
Peptydy zapisujemy tak, by
aminokwas N-końcowy był po
lewej stronie a aminokwas C –
końcowy po prawej
aminokwas C – końcowy – z wolną grupą –
aminokwas N – końcowy – z wolną grupą –
Szkielet białkowy

Jakie aminokwasy wchodzą w skład
peptydu?
Ile jednostek każdego z aminokwasów
występuje w peptydzie?
W jakiej kolejności występują one w
łańcuchu peptydowym?
Określanie struktury peptydów

Rozbicie
peptydu na
składowe
aminokwasy
Rozbicie
peptydu na
składowe
aminokwasy
• hydroliza w roztworze
kwaśnym powoduje
racemizację
Analiza
mieszaniny
aminokwasów
Analiza
mieszaniny
aminokwasów
• Rozdział metodą
chromatograficzna

Analiza mieszaniny
aminokwasów
Nałożenie na szczyt szklanej
kolumny chromatograficznej
wypełnionej specjalnym
adsorbentem i przepuszczanie
przez kolumnę buforów
Różne aminokwasy poruszają się
z różną prędkością a więc znajdą
się w różnym czasie na dnie
kolumny => są rozdzielane w
miarę „ wychodzenia” z kolumny
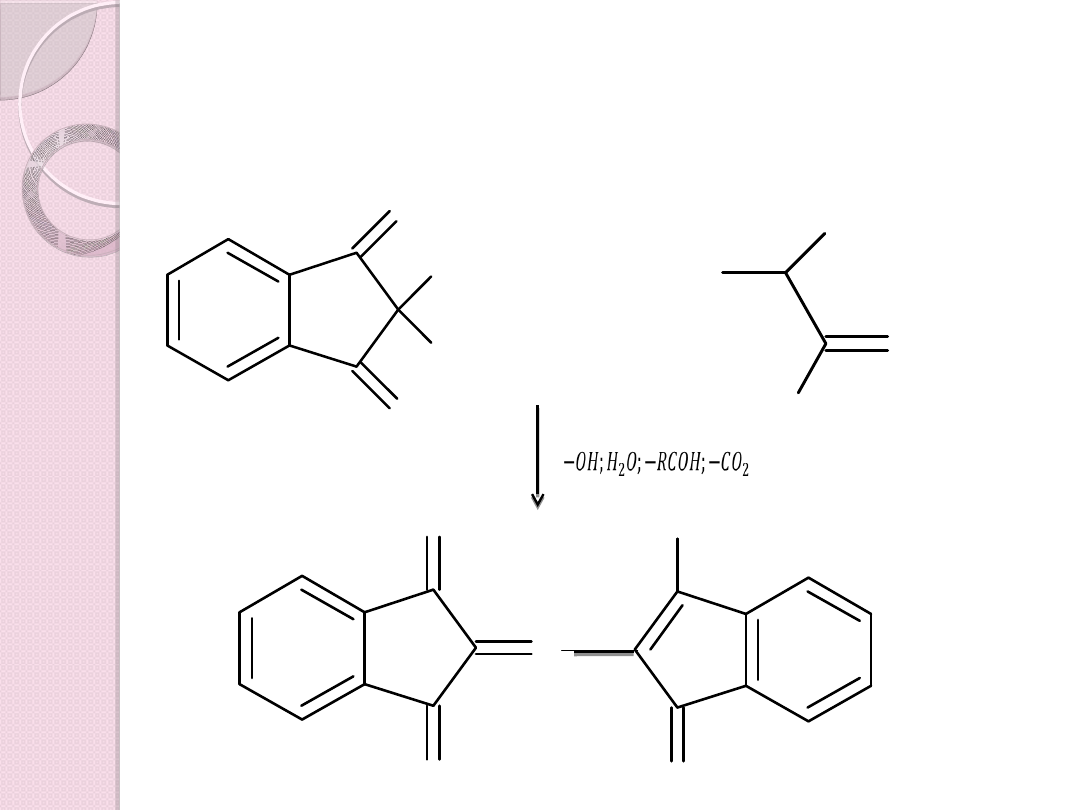
Po wyjściu z kolumny każdy z aminokwasów
miesza się z roztworem ninhydryny =>
fioletowe zabarwienie
+
−𝑂�;�
2
𝑂;−𝑅𝐶𝑂�;−𝐶𝑂
2
Kolor
fioletowy
OH
OH
O
O
N
H
2
O
O
H
R
O
O
NH
O
-
O

Rejestracja różnych czasów
eluncji =>
oznaczenie rodzaju aminokwasów
Intensywność fioletowej barwy
rejestrowana przez spektrometr
=> ilość aminokwasu

Określenie struktury peptydu -
sekwencjonowanie
Sekwencjonowanie – określenie w jakiej
kolejności aminokwasy są ze sobą
połączone
Sekwencjonowanie wykonuje się przez
kolejne odrywanie po jednym aminokwasie
z końca łańcucha peptydowego
( albo z C – końca albo z N-końca)
Aminokwas jest wydzielany i
identyfikowany
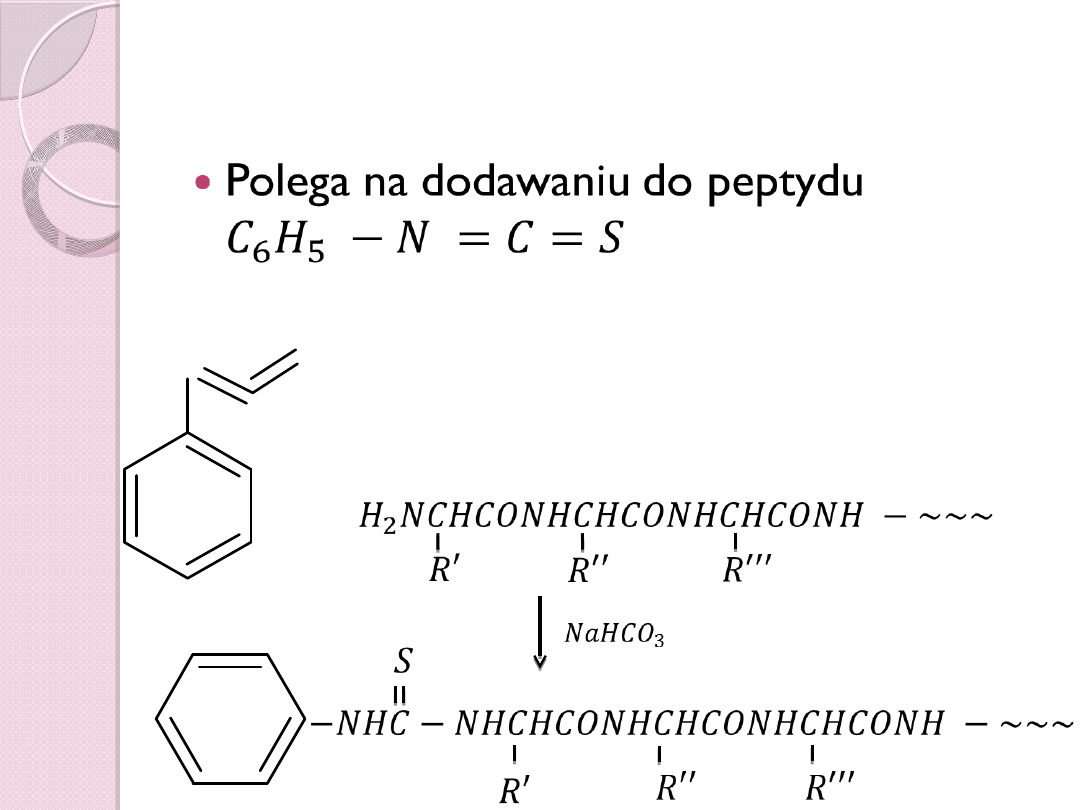
Degradacja Edmana
Polega na dodawaniu do peptydu
+
�
2
𝑁𝐶�𝐶𝑂𝑁�𝐶�𝐶𝑂𝑁�𝐶�𝐶𝑂𝑁� −
𝑅 ′
𝑅 ′′
𝑅 ′′ ′
− 𝑁�𝐶− 𝑁�𝐶�𝐶𝑂𝑁�𝐶�𝐶𝑂𝑁�𝐶�𝐶𝑂𝑁� −
𝑅 ′′ ′
𝑅 ′′
𝑅 ′
�
𝑁𝑎�𝐶 𝑂
3
N
S
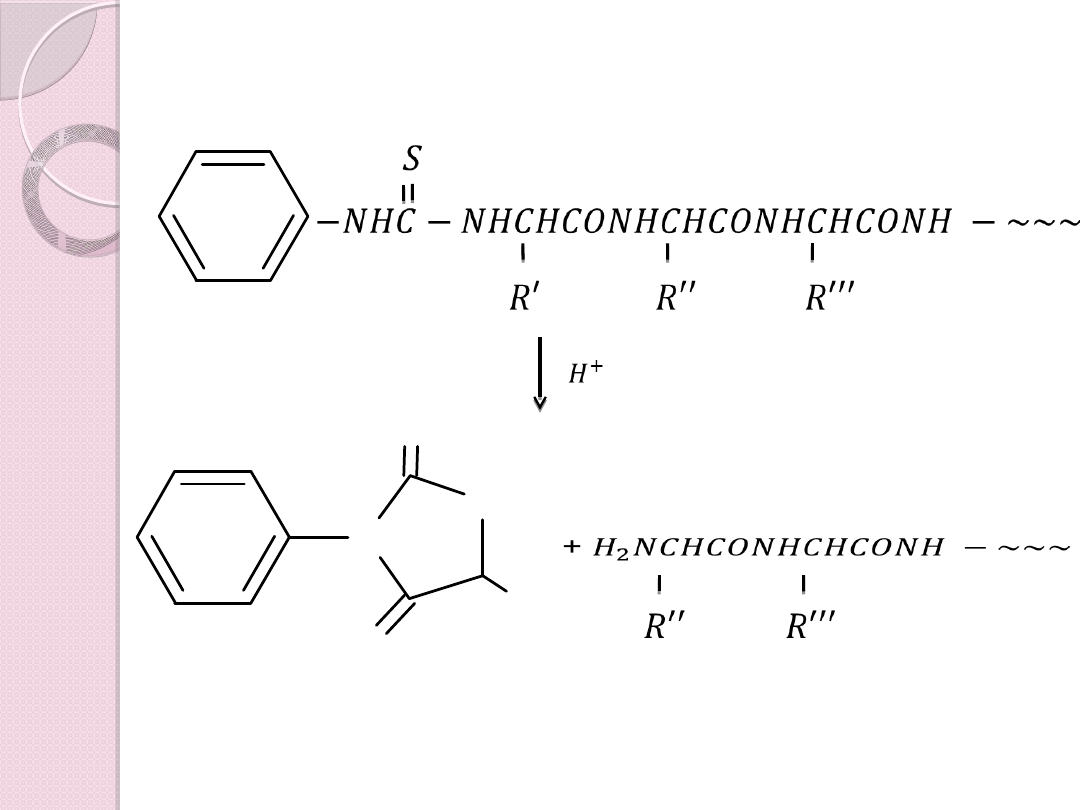
Kolejnym etapem jest łagodna hydroliza
− 𝑁�𝐶− 𝑁�𝐶�𝐶𝑂𝑁�𝐶�𝐶𝑂𝑁�𝐶�𝐶𝑂𝑁� −
𝑅 ′′ ′
𝑅 ′′
𝑅 ′
�
+
¿
�
¿
+
𝑅 ′′
𝑅 ′′ ′
N- fenylotiohydantoina
N
NH
S
R
O
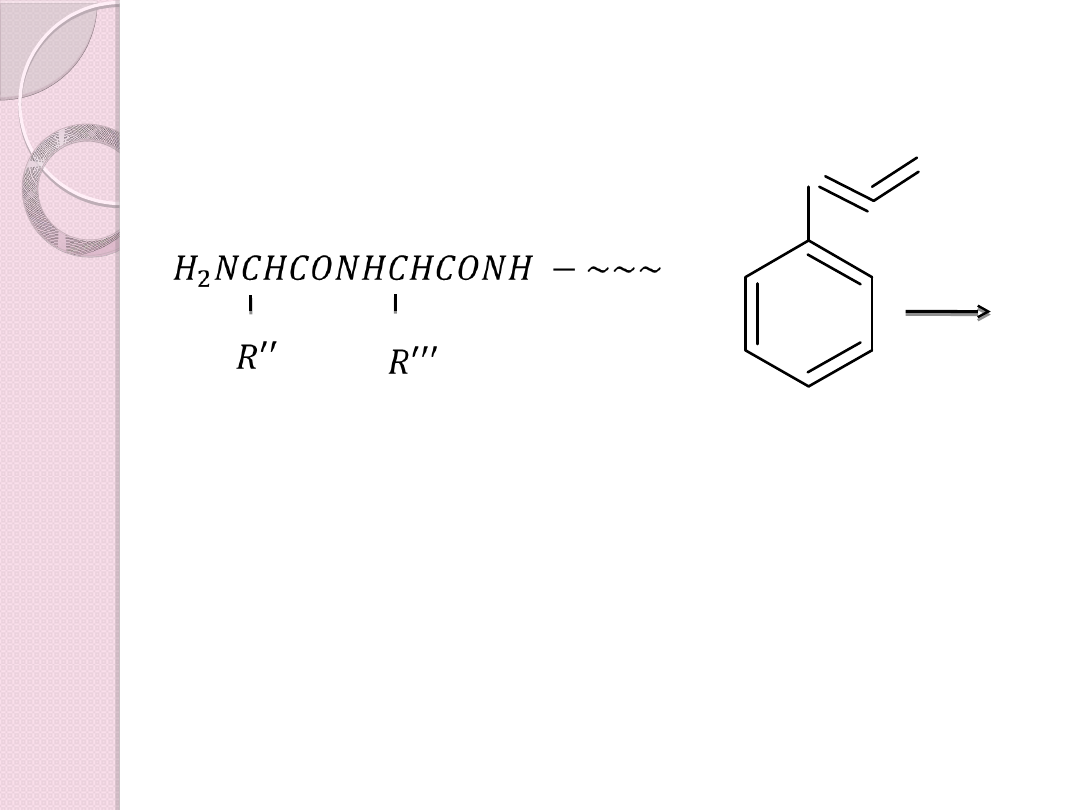
Mając peptyd o skróconym łańcuch możemy
powtórzyć postępowanie
Z kolei otrzymaną N – fenylotiohydantoinę
identyfikuje się chromatograficznie w
porównaniu ze znanymi pochodnymi PTH
typowych aminokwasów
�
2
𝑁𝐶�𝐶𝑂𝑁�𝐶�𝐶𝑂𝑁� −
𝑅 ′′
𝑅 ′′ ′
+
…
N
S

Sekwencjonowanie dużych peptydów i białek
Degradacja Edmana jest niepraktyczna
(ograniczenie metody do ok. 50 cykli)
Stosuje się rozbijanie łańcucha
peptydowego przez częściową hydrolizę na
wiele mniejszych fragmentów
Określa się sekwencję każdego z tych
fragmentów
Fragmenty dopasowuje się

Hydroliza peptydu
Wodnym roztworem kwasu
Jest ona nieselektywna i prowadzi do
przypadkowej mieszaniny małych
fragmentów
Enzymatyczna – jest specyficzna
trypsyna arginina i lizyna
chymotrypsyna fenyloalanina,
tyrozyna,
tryptofan
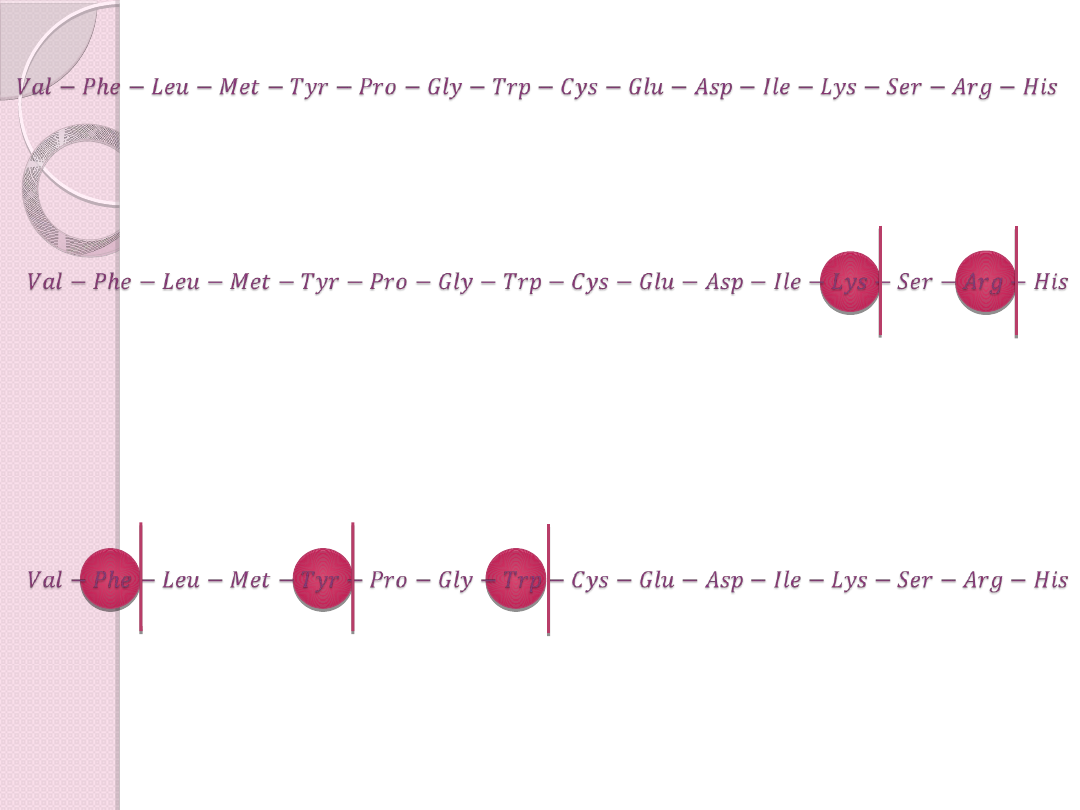
𝑉𝑎�−𝑃h�−𝐿��−𝑀��−𝑇𝑦�−𝑃��−𝐺�𝑦−𝑇��−𝐶𝑦�−𝐺��−𝐴��−𝐼��−𝐿𝑦�−���−𝐴��−�𝑖�
TRYPSYNA
CHYMOTRYPSYNA
𝑉𝑎�−𝑃h�−𝐿��−𝑀��−𝑇𝑦�−𝑃��−𝐺�𝑦−𝑇��−𝐶𝑦�−𝐺��−𝐴��−𝐼��−𝐿𝑦�−���−𝐴��−�𝑖�
𝑉𝑎�−𝑃h�−𝐿��−𝑀��−𝑇𝑦�−𝑃��−𝐺�𝑦−𝑇��−𝐶𝑦�−𝐺��−𝐴��−𝐼��−𝐿𝑦�−���−𝐴��−�𝑖�
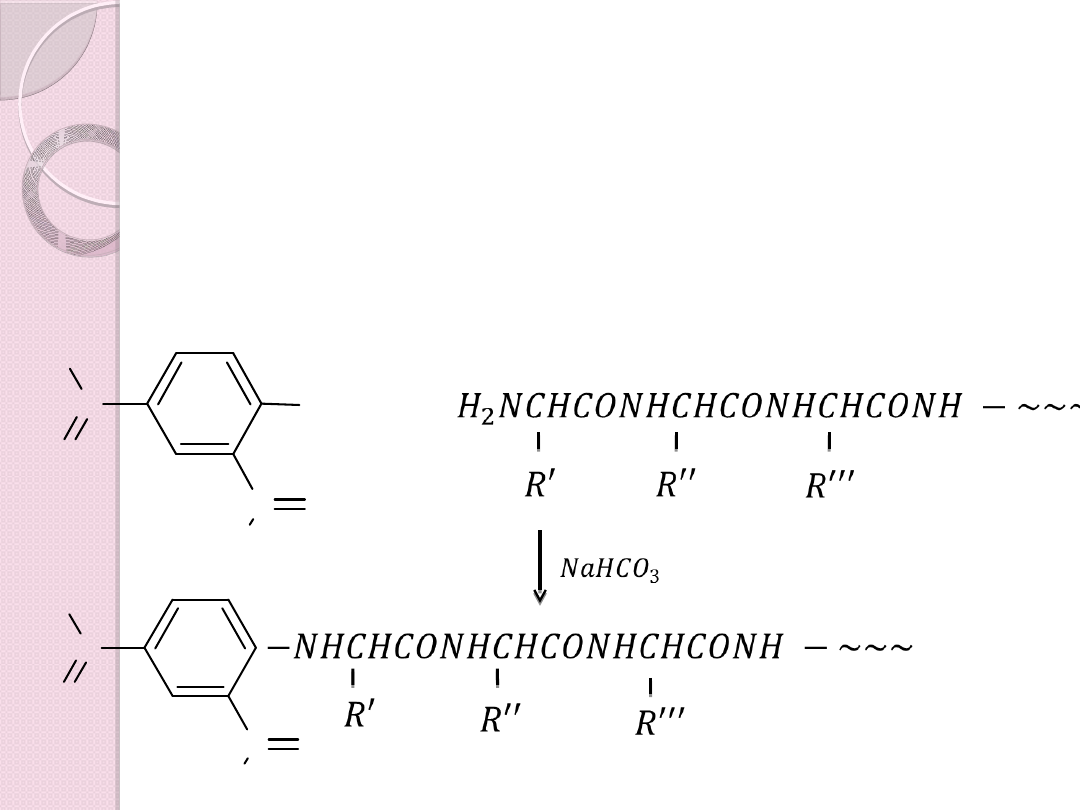
Analiza reszty N – terminalnej – polega
na użyciu 1– fluoro-2,4- dinitrobenzenu,
który ulega nukleofilowemu
podstawieniu wolną grupą aminową
+
�
2
𝑁𝐶�𝐶𝑂𝑁�𝐶�𝐶𝑂𝑁�𝐶�𝐶𝑂𝑁� −
𝑅 ′
𝑅 ′′
𝑅 ′′ ′
− 𝑁�𝐶�𝐶𝑂𝑁�𝐶�𝐶𝑂𝑁�𝐶�𝐶𝑂𝑁� −
𝑅 ′′ ′
𝑅 ′′
𝑅 ′
𝑁𝑎�𝐶 𝑂
3
Analiza reszty terminalnej - Sanger
F
N
+
O
-
O
N
+
O
-
O
N
+
O
-
O
N
+
O
-
O
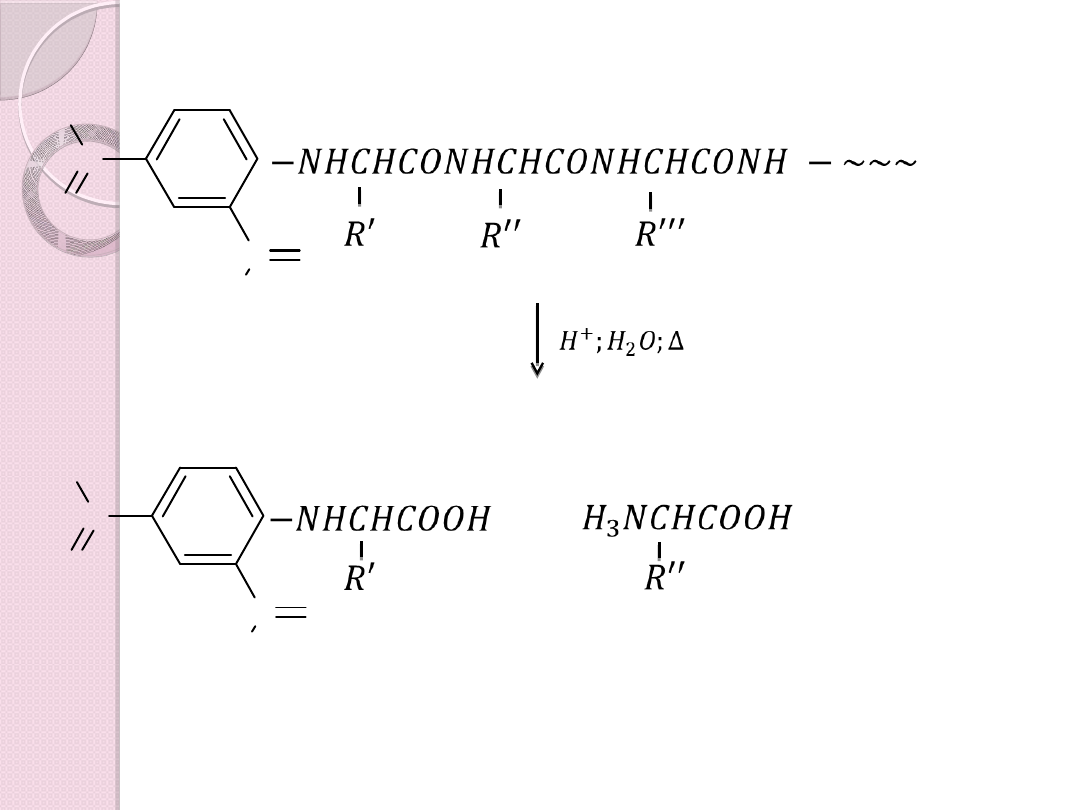
− 𝑁�𝐶�𝐶𝑂𝑁�𝐶�𝐶𝑂𝑁�𝐶�𝐶𝑂𝑁� −
𝑅 ′′ ′
𝑅 ′′
𝑅 ′
+
¿
; �
2
𝑂 ; ∆
�
¿
−𝑁�𝐶�𝐶𝑂𝑂�
𝑅 ′
+
�
3
𝑁𝐶�𝐶𝑂𝑂�
𝑅 ′′
+
+
…
N
+
O
-
O
N
+
O
-
O
N
+
O
-
O
N
+
O
-
O

Analiza reszty terminalnej
Analiza reszty C – terminalnej – jest to metoda
enzymatyczna nie chemiczna. Resztę tę usuwa
się selektywnie za pomocą karboksypeptydazy,
która rozszczepia tylko wiązania peptydowe
przylegające do wolnych grup karboksylowych w
pozycji α w łańcuchach polipeptydowych.
Czynność tę można powtórzyć ze skróconym
peptydem i analizować kolejną grupę
W przypadku długich łańcuchów stosuje się
częściową hydrolizę i analizuje otrzymane
fragmenty

Bibliografia
Robert Thornton Morrison, Robert
Neilson Boyd; Chemia organiczna; Tom
2; wydanie piąte; Wydawnictwo
Naukowe PWN; Warszawa 2011; str.
366-372
John McMurry; Chemia organiczna;
część 4; Wydawnictwo Naukowe PWN;
Warszawa 2012;
str. 998-1005
Document Outline
- Slide 1
- Peptydy i białka
- Slide 3
- Określanie struktury peptydów
- Slide 5
- Analiza mieszaniny aminokwasów
- Slide 7
- Slide 8
- Określenie struktury peptydu - sekwencjonowanie
- Degradacja Edmana
- Slide 11
- Slide 12
- Sekwencjonowanie dużych peptydów i białek
- Hydroliza peptydu
- Slide 16
- Slide 17
- Analiza reszty terminalnej
- Bibliografia
Wyszukiwarka
Podobne podstrony:
8b analiza sekwencyjna białek
8b analiza sekwencyjna białek
Analiza sekwencji biologicznych 1
06 ANALIZA SEKWENCJI CZLOWIEKA A
Analiza sekwencji biologicznych Nieznany (2)
Sekwencje sygna owe bia ek budowa i funkcje
Sekwencje sygna owe bia ek budowa i funkcje
analiza złożonych aktów ruchowych w sytuacjach patologicznych
Prezentacja 2 analiza akcji zadania dla studentow
Wypadkoznawstwo analiza wypadków
Zarz[1] finan przeds 11 analiza wskaz
Analiza czynnikowa II
4 ANALIZA WSKAŹNIKOWA Rachunkowość
analiza finansowa ppt
więcej podobnych podstron