
pKa SUBSTANCJI
Paulina Włodarska,
Iwona Sudoł

Czym jest pKa?
• jest miarą mocy kwasu
• jest ujemnym logarytmem z K
a
pK
a
= –log[K
a
]
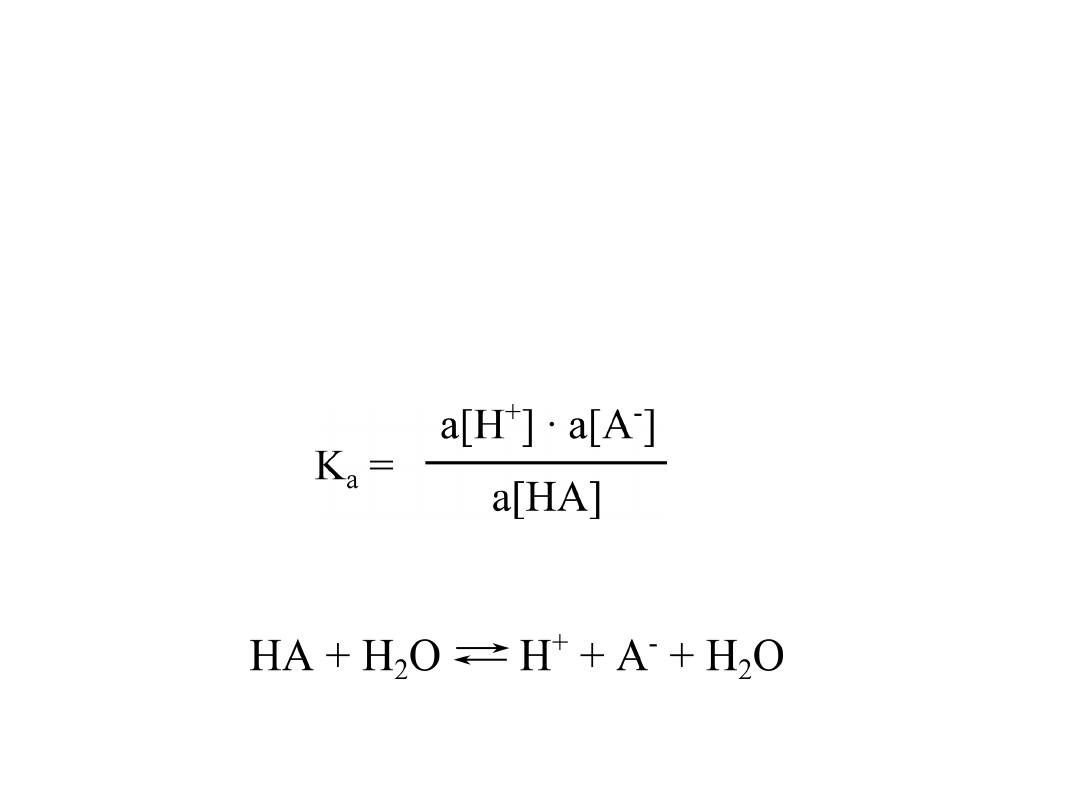
A czym jest K
a
?
Stała dysocjacji kwasu jest miarą jego mocy. Silne
kwasy łatwo oddają protony (są dobrymi donorami
protonów) i charakteryzują się dużymi wartościami K
a
.
Słabe kwasy niechętnie oddają protony, a ich stałe
dysocjacji są małe.
Stałą równowagi tej reakcji zapisać można
następującym wzorem:
W wodzie, kwasy ulegają dysocjacji zgodnie z
poniższym (uproszczonym) równaniem:

• Słabe kwasy to te, które odznaczają się
wartościami pK
a
większymi od 2 (bo
-log(0,01) = 2), a im większa wartość pK
a
,
tym słabszy kwas.
• Miary pK
a
kwasu nie można stosować jako
miary mocy bardzo stężonych i (przede
wszystkim) bezwodnych kwasów mocnych,
ponieważ są one całkowicie zdysocjowane.
W odniesieniu do kwasów tych,
miary pK
a
można stosować jedynie do
pewnych rozcieńczonych roztworów.
• Gdy pH=pK
a
, połowa ilości związku
występuje w formie niezjonizowanej,
połowa w formie zjonizowanej.
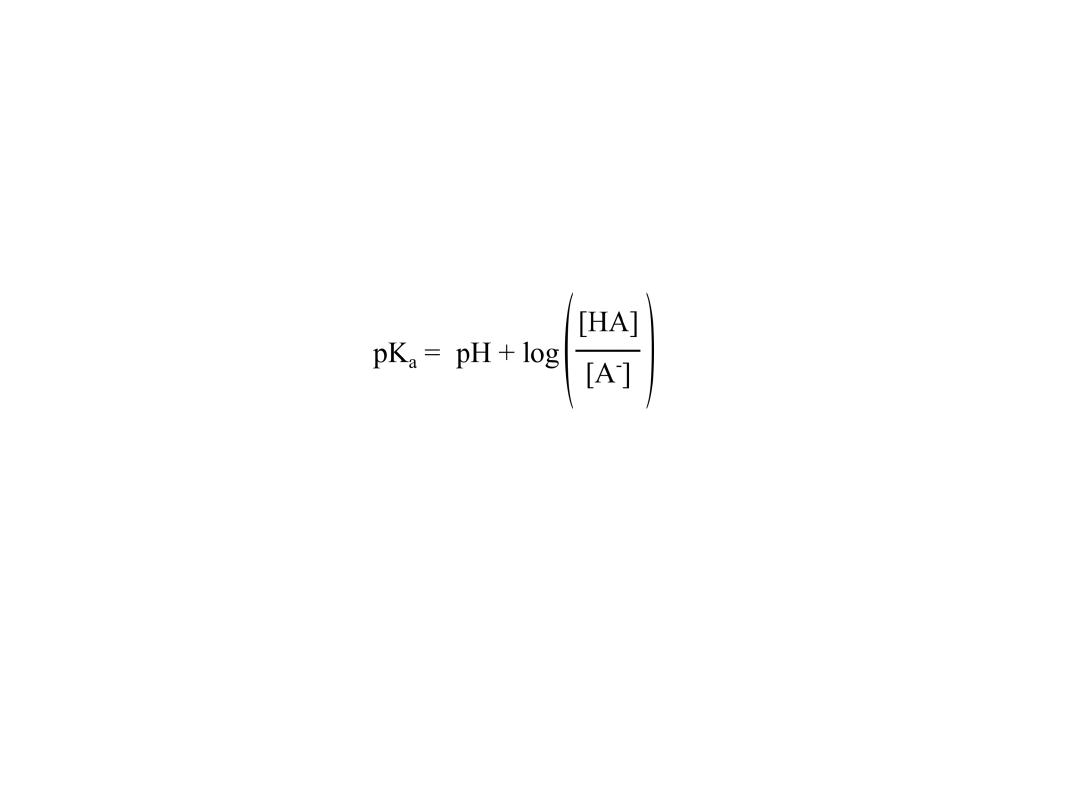
• Po zlogarytmowaniu wzoru na stałą równowagi reakcji
dysocjacji kwasu, otrzymujemy następujący wzór,
łączący pH roztworu kwasu z jego wartością pK
a
:
• Z powyższego wzoru wynika, że pK
a
kwasu równe jest
co do wartości pH, wtedy gdy stosunek stężenia
wolnego (niezdysocjowanego) kwasu do stężenia
anionu powstałego na skutek dysocjacji tego kwasu,
równy jest 1 (bo log(1)=0).

• Ze względu na to, że zasada po przyłączeniu protonu
staje się sprzężonym kwasem, zamiast
charakteryzować substancje za pomocą stałych
kwasowości dla kwasów i zasadowości dla zasad, można
charakteryzować je za pomocą jednej wielkości (pK
a
).
• pK
a
=pK
w
-pK
b
• Suma pKa i pKb w wodzie jest zawsze
równa 14.
• pK
a
=14-pK
b

Dlaczego istotne jest
precyzyjne
wyznaczenie pKa
substancji
leczniczych?

Wchłanianie jest regulowane
przez pKa leku
Alkalizacja pH w świetle pozostawionej części żołądka po
zabiegu gastrektomii (usunięcie żołądka) wpływa na wzrost
stopnia jonizacji słabych kwasów i spadek pKa słabych
zasad. Stała dysocjacji jest to taka wartość pH, przy której
liczba cząsteczek zjonizowanych danego związku jest
równa liczbie cząsteczek niezjonizowanych.
Wartości stałej dysocjacji pKa leku oraz pH środowiska
determinują szybkość dyfuzji biernej leku, która jest
najczęstszym mechanizmem transportu leków przez błony
biologiczne w przewodzie pokarmowym. Wzrost pH w
świetle żołądka po gastrektomii może zatem ograniczać
wchłanianie leków o charakterze kwaśnym.
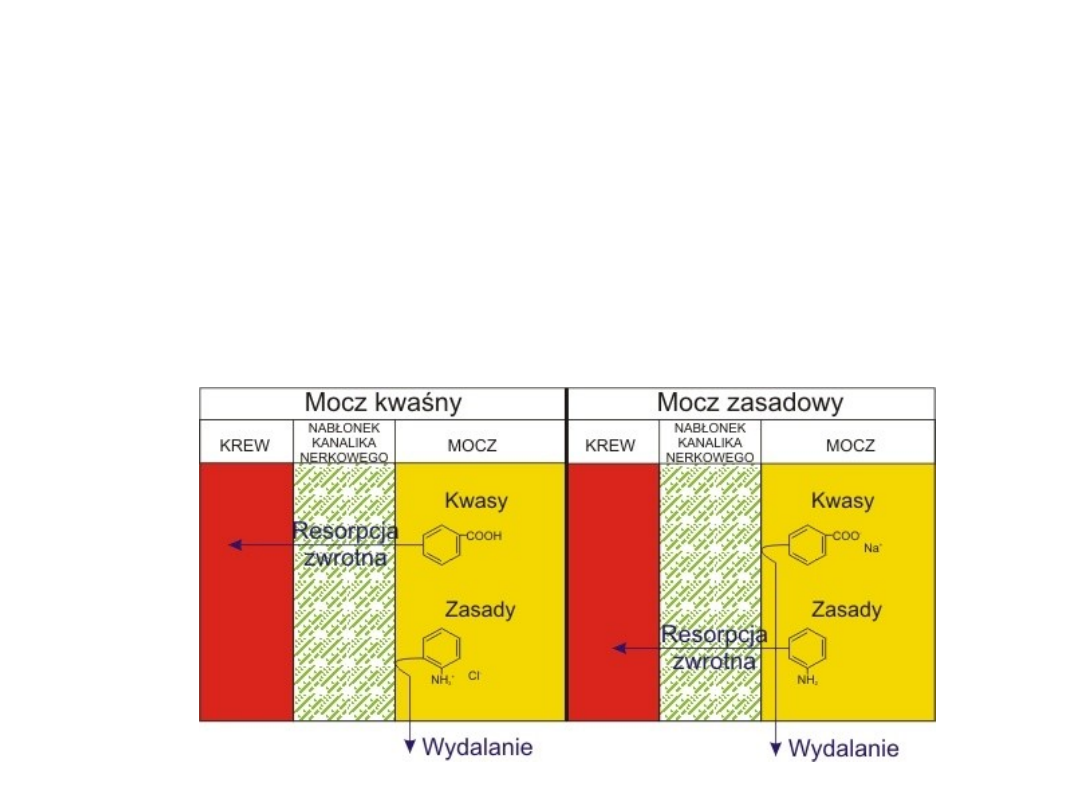
Wpływ pKa substancji leczniczej na
jej wydalanie z organizmu
Przez błony kanalików nerkowych dobrze wchłaniają się zwrotnie
leki w postaci niezjonizowanej. Dlatego w moczu zasadowym
(wysokie pH) leki o charakterze słabych kwasów (pKa od 3 do
7,5 np. kwas acetylosalicylowy, sulfonamidy, fenylbutazon,
barbiturany) przeważnie istnieją jako zjonizowane nie
rozpuszczalne w tłuszczach cząsteczki.
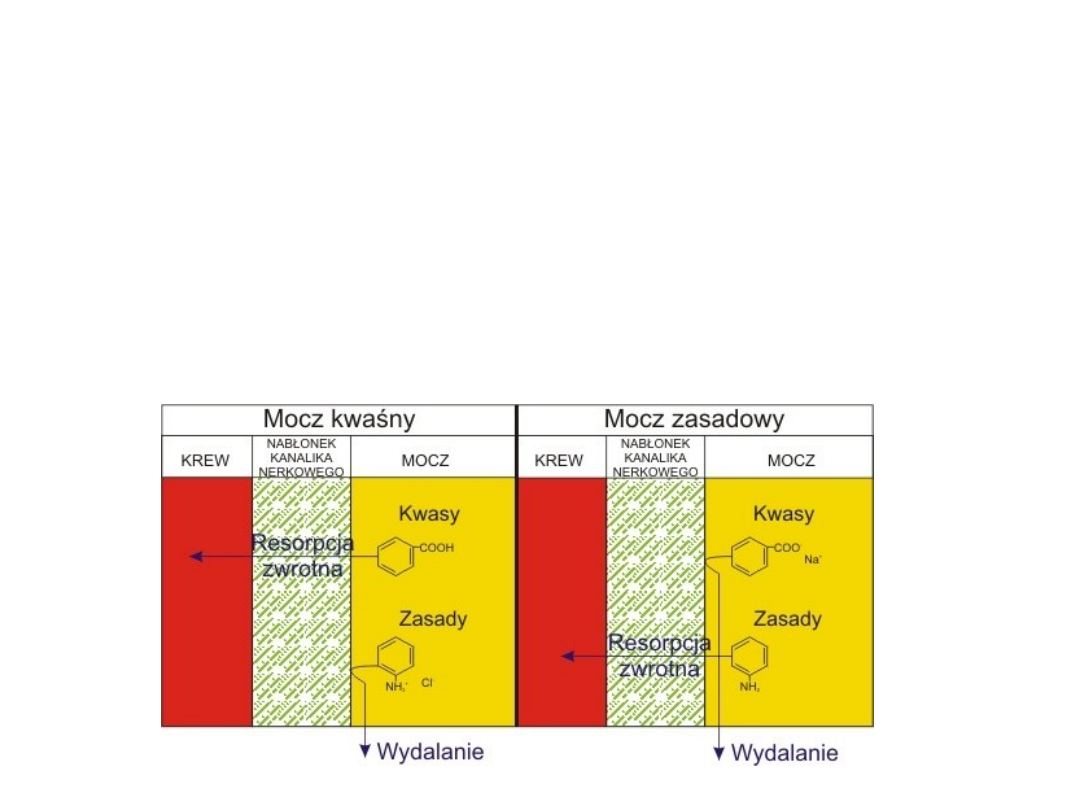
W tej formie są niezdolne do dyfuzji przez komórki
kanalików nerkowych, i w wyniku tego są
wydalane razem z moczem. Odwrotnie, leki o
charakterze słabych zasad (pKa 7,5 do 10,5 np.
kodeina, morfina, chinina, imipramina) będą
ulegały resorpcji zwrotnej w moczu o zasadowym
odczynie pH.

Moc kwasu w określonych warunkach jest stała dla
danego kwasu.
Terapeutyczne właściwości kwasów owocowych ściśle
wiążą się z ich biodostępnością czyli zdolnością
przenikania niezdysocjowanej cząsteczki kwasu
przez barierę warstwy zrogowaciałej. Kwasy
owocowe charakteryzują się większą reaktywnością oraz
zdolnością przenikania przez warstwę rogową naskórka w
postaci niezdysocjowanej.
Skuteczność działania
hydroksykwasów (stosowanych w
dermatologii)
zależy od mocy kwasu.

Aby uzyskać jak największą biodostępność
hydroksykwasów i zwiększyć efektywność
działania preparatu należy zastosować pH
niższe od pKa danego kwasu. W praktyce
kosmetycznej oceniając skuteczność i możliwości
terapeutyczne preparatu służącego do eksfoliacji
należy zwrócić uwagę na jego pH i odnieść ją do pKa
danego kwasu.
Znajomość pK
a
hydroksykwasów umożliwia
stwierdzenie najbardziej optymalnego pH danego
kwasu, a tym samym podniesienie skuteczności jego
działania. Jeśli wartość pH jest równa lub zbliżona do
mocy kwasu wtedy jedynie 50% kwasu pozostaje w
niezdysocjowanej postaci.

Wyznaczanie pK
a
jest przydatne przy
identyfikacji substancji leczniczej
Przykład – SULFONAMIDY
Charakter zasadowy nadaje im nie
podstawiona grupa aminowa przy pierścieniu
aromatycznym (pKb =11,64-12,3), natomiast
charakter kwasowy – ugrupowanie
sulfonamidowe (dla większości związków pKa =
6,5-7,5). Sulfaguanidyna, posiadająca
ugrupowanie sulfaguanidynowe zamiast
sulfonamidowego, jest praktycznie pozbawiona
własności kwasowych (pKa = 12,05).
Document Outline
- Slide 1
- Czym jest pKa?
- A czym jest Ka?
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Wchłanianie jest regulowane przez pKa leku
- Wpływ pKa substancji leczniczej na jej wydalanie z organizmu
- Slide 10
- Slide 11
- Slide 12
- Slide 13
Wyszukiwarka
Podobne podstrony:
pKa SUBSTANCJI 1
(2,3) Działania nieporządane, toksytczne leków Metabolizm, czynniki wpływające na działanie substanc
Szkol Substancje i preparaty chemiczne
Substancje odurzające(1)
Psychiatria W4 28 04 2014 Zaburzenia spowodowane substancjami psychoaktywnymi
19 Substancje toksyczne
5 3 Rozpuszczalność substancji
zmiany w oznakowaniu substancji i preparatów chcemicznych
kom podporowe i substancja pozakom
Substancje antyodżywcze w żywności, różności, dietetyka, ciekawostki, diety, normy
SUBSTANCJE KONSERWUJACE, WNOŻCiK wieczorowe, semestr V, toksykologia
CYNK-GRANULAT, BHP KARTA CHARAKTERYSTYKI SUBSTANCJI NIEBEZPIECZNEJ
informacja o substancjach, preparatach o działaniu rakotwórczym lub mutagennym
SLS, SLES i inne substancje pieniące w kosmetykach
Zagrożeniem chemicznym mogą być substancje chemiczne
Dwie substancje zawarte w popularnych kosmetykach niebezpieczne dla zdrowia
więcej podobnych podstron