MIĘŚNIE GŁADKIE:
BUDOWA, AKTYWNOŚĆ
MOTORYCZNA I
JEJ REGULACJA
Alicja Wojtowicz
Ewelina Bałdyga
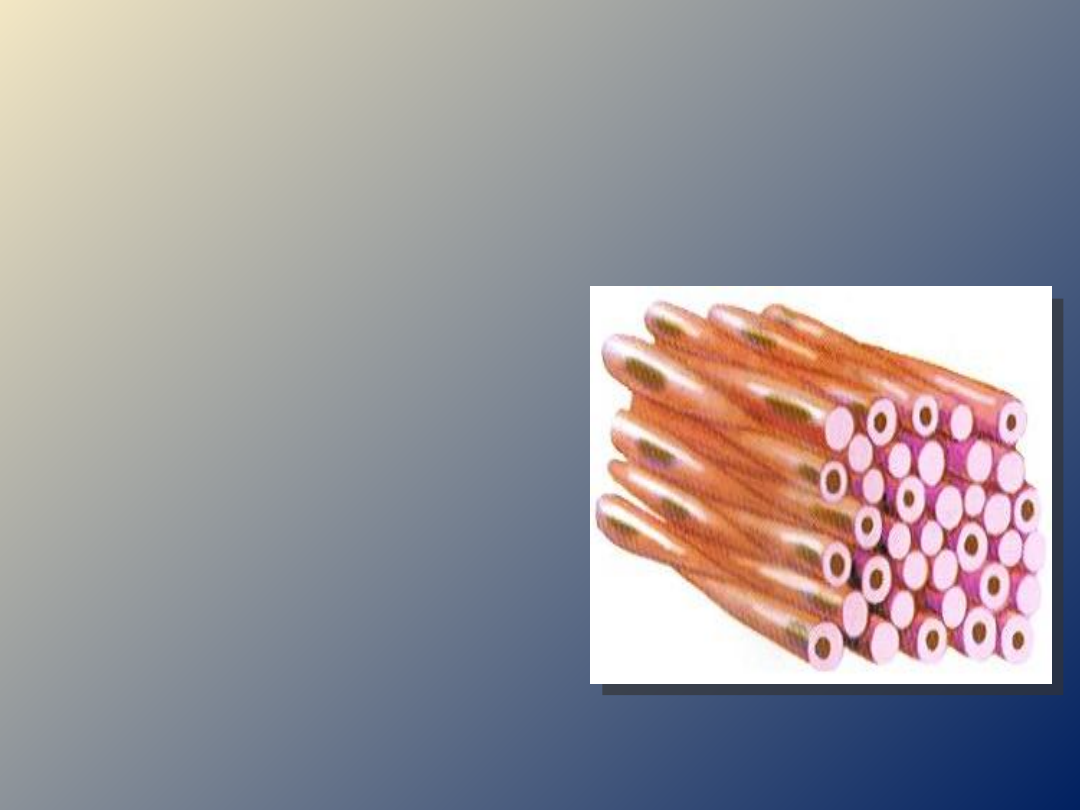
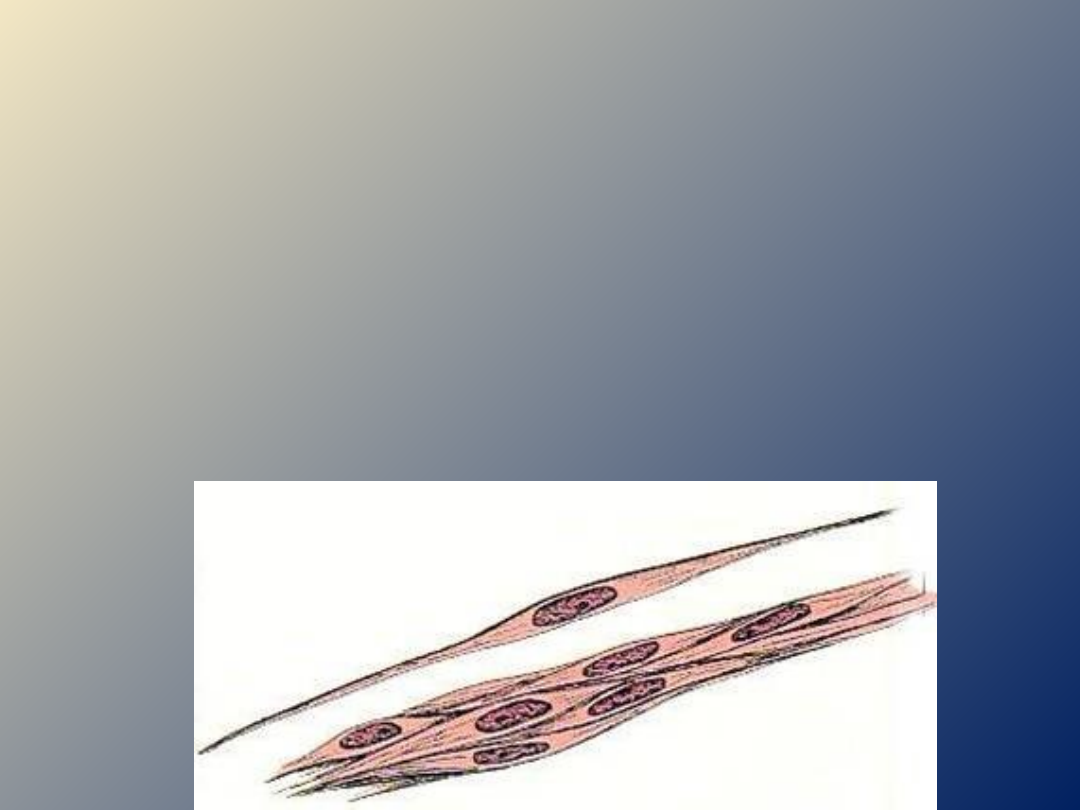
BUDOWA MIOCYTU GŁADKIEGO
o jest wydłużoną komórką kształtu
wrzecionowatego,
jednojądrzasta
o długośc komórki 20-500μm
o nie wykazują regularnej
sarkomerycznej struktury
o każdy miocyt zawiera domeny
kurczliwe i domeny
cytoszkieletowe
o brak kanalików T, białek takich
jak:
troponina czy tropomiozyna
o w obrębie cytoplazmy liczne
ciałka
gęste
,
płytki mocujące
o wzdłuż miocytu rozciągają się
filamety aktynowe i miozynowe
faza
rozkurcz
u
faza
skurcz
u
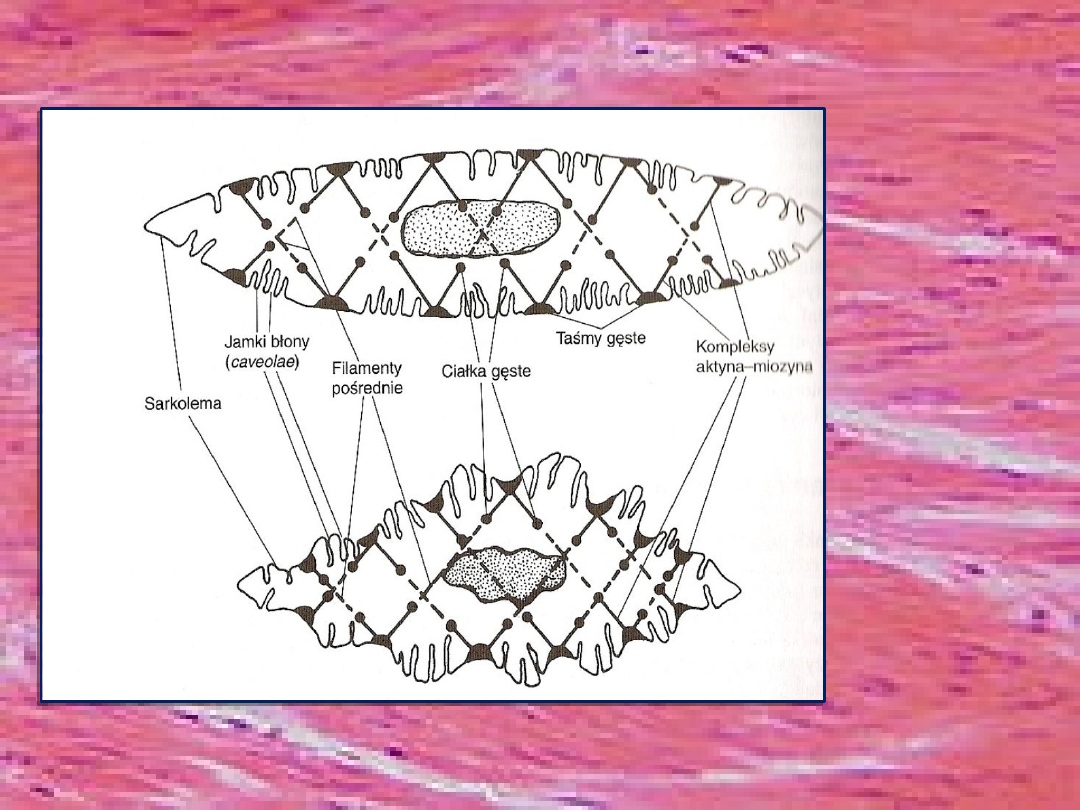
WNĘTRZE MIOCYTU…
Białka aparatu skurczu
W mięśniach gładkich
występuje szereg
białek budujących
filamenty miozynowe i
aktynowe
W mięśniach gładkich
występuje szereg
białek budujących
filamenty miozynowe i
aktynowe
Obecne jest także
białko
charakterystyczne
tylko dla miocytów
gładkich:
KALMODULINA
Obecne jest także
białko
charakterystyczne
tylko dla miocytów
gładkich:
KALMODULINA
MIOZYNA
występuje w
postaci
kilku izoform
są to izoformy
łańcuchów
ciężkich
miozyny: SM1A,
SM1B, SM2A,
SM2B
łańcuchy lekkie
to
postac dwóch
izoform:
SLMC17a i
SMLC17b
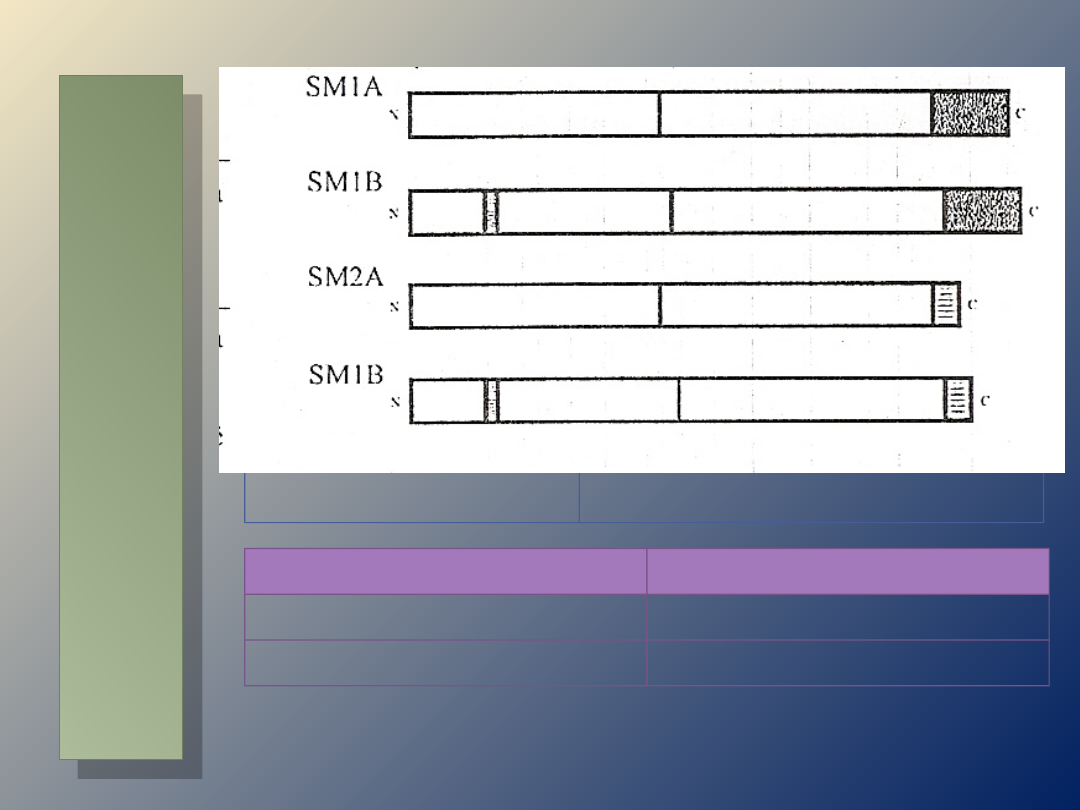
IZOFORMA
CHARAKTERYSTYKA
SM1A
koniec C- sekwencja 43
aminokwasów
SM1B
koniec C- 43
aminokwasy + 7
aminokwasów w główce
SM2A
koniec C- sekwencja 9
aminokwasów
SM2B
koniec C- 9
aminokwasów + 7
aminokwasów w główce
IZOFORMA
CHARAKTERYSTYKA
SMLC17a
bardziej kwaśny
SMLC17b
bardziej zasadowy
C
IĘ
Ż
K
I
I
L
E
K
K
I
Ł
A
Ń
C
U
C
H
M
IO
Z
Y
N
Y
C
IĘ
Ż
K
I
I
L
E
K
K
I
Ł
A
Ń
C
U
C
H
M
IO
Z
Y
N
Y

AKTYNA
aktyna F
Aktyna występuje w
postaci dwóch
izoform: SMα i SMγ
Występują w domenie
kurczliwej miocytów
gładkich
Występują w domenie
kurczliwej miocytów
gładkich
Sekwencje te w
obrębie grup są w 99%
jednakowe…
W czasie skurczu
filamenty aktynowe
współpracują z
kompleksem:
kalmoduliną i kinazą
łańcuchów lekkich
miozyny !!!
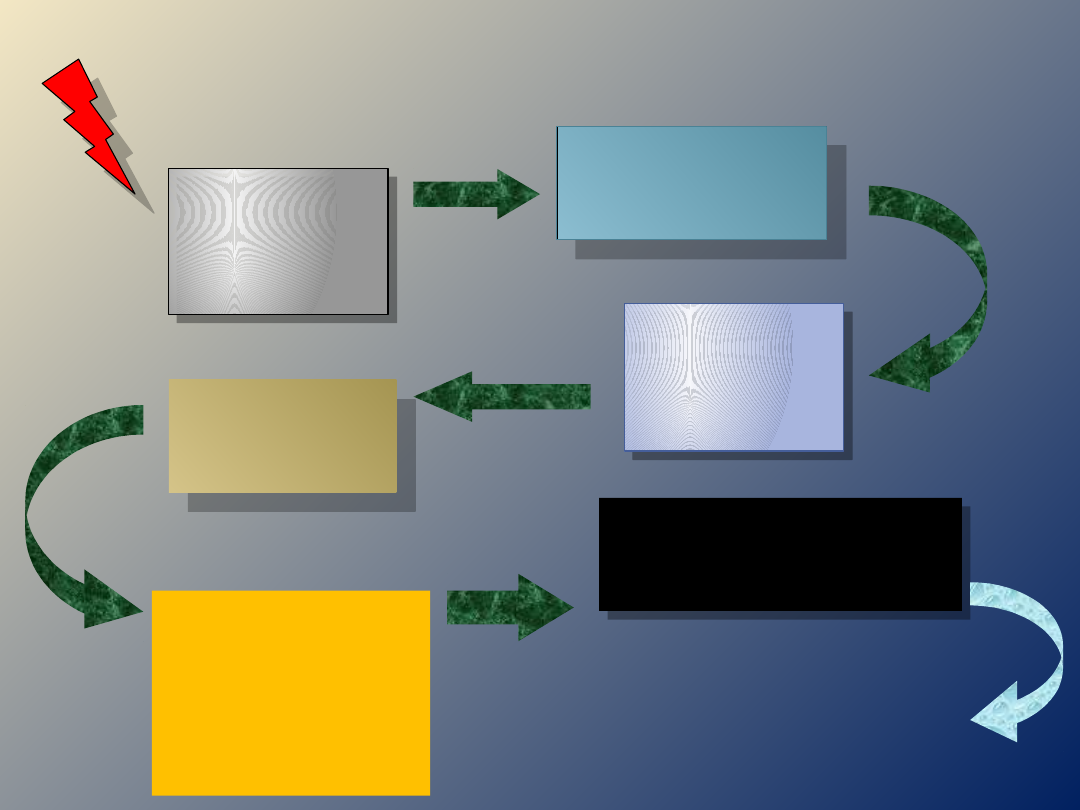
MECHANIZM
SKURCZU
depolaryzac
ja
sarkolemmy
depolaryzac
ja
sarkolemmy
otwarcie
kanałów dla
jonów wapnia
otwarcie
kanałów dla
jonów wapnia
transport
jonów
wapnia do
cytozolu
transport
jonów
wapnia do
cytozolu
kompleks
kalmodulina-
Ca/kinaza
lekkich
łańcuchów
miozyny
połączenie główki
miozyny z aktyną i
hydroliza ATP
połączenie główki
miozyny z aktyną i
hydroliza ATP
SKURCZ
kalmodulina
wiąże jony
wapnia
kalmodulina
wiąże jony
wapnia

wielojednostkowe
MIĘŚNIE GŁADKIE
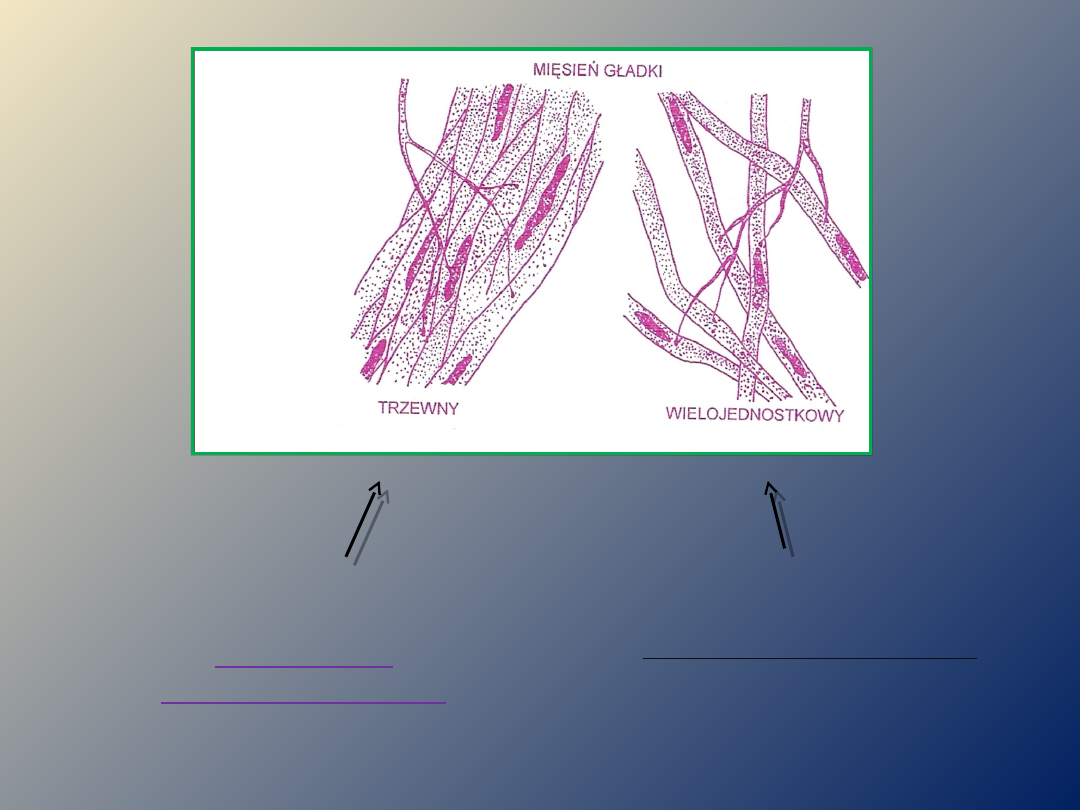
Pobudzenie skurczu
zachodzi dzięki tzw.
komórkom
rozrusznikowym
generujące fale wolne,
zdolne do rytmicznych
inicjacji impulsów !!!
Pobudzenie skurczu
zachodzi dzięki
neuroprzekaźnikom
układu
autonomicznego (gł.
acetylocholiny i
noradrenaliny) !!!

Regulacja aktywności motorycznej mięśni
gładkich
MODYFIKACJA FILAMENTÓW MIOZYNOWYCH
miozyna w wyniku fosforylacji aktywuje się dzięki aktywnej kinazie
łańcuchów lekkich miozyny
wykazuje wtedy aktywnośc motoryczna i enzymatyczną
w obrazie aktywnej miozyny występują oddziaływania między
główkami sąsiednich cząsteczek miozyny, a w nieaktywnej
zaobserwowano
wewnątrzcząsteczkowe kontakty główek
w miozynie nieaktywnej główki ułożone są asymetrycznie
ADP
wprowadza asymetrię między główkami miozyny
regulacja aktywności różnych
fosfataz
ma wpływ na pobudzenie
miozyny
FILAMENTY AKTYNOWE DOMENY KURCZLIWEJ
BIAŁKO WIĄŻĄCE WAPŃ
STOSUNEK MOLOWY:
14 : 2 :
1

Znacznie wzmacnia hamujący wpływ kaldesmonu na aktywność
ATPazy aktomiozynowej, choć w nieobecności kaldesmonu sama
stymuluje tą aktywność
Znacznie wzmacnia hamujący wpływ kaldesmonu na aktywność
ATPazy aktomiozynowej, choć w nieobecności kaldesmonu sama
stymuluje tą aktywność
Białko oddziałujące ze wszystkimi składnikami
Jego oddziaływaniom z
Powoduje zmniejszenie aktywności generacji siły mięśni gładkich i
poprzecznie prążkowanych
Nie wywiera wpływu na fosforylację lekkich łańcuchów miozyny, ale
w jego obecności do generacji takiej samej siły niezbędne są wyższe
poziomy fosforylacji
T R O P O M I O Z Y N A
K A L D E S M O N

W JAKI SPOSÓB KALDESMON
PEŁNI SWOJĄ FUNKCJĘ?
Decydująca rola współzawodnictwa pomiędzy

W P ŁY W S T Ę Ż E N I A J O N Ó W
W A P N I A
Stężenia jonów Ca2+ kontroluje aktywność
Utrzymywanie napięcia przez
toniczne włókna mięśni gładkich
W czasie rozkurczu:
Kaldesmon utrzymuje filamenty aktynowe w stanie niezdolnym do
aktywacji miozyny, a jednocześnie wiąże domenę regulatorową miozyny i
stabilizuje nieufosforylowany łańcuch miozyny
Po stymulacji mięśnia:
Zmiany konformacyjne kaldesmonu (pod wpływem białka wiążącego wapń
lub fosforylacji) umożliwiają oddziaływania aktyny z miozyną

ROLA CYTOSZKIELETU
W AKTYWNOŚCI MOTORYCZNEJ
Zmiany bierne
–dostosowywanie się struktury cytoszkieletu
do zmienionego kształtu włókna mięśniowego
Zmiany aktywne
– generowanie siły lub utrzymywanie
napięcia, bądź zapobieganie nadmiernemu
skracaniu komórek

CYTOSZKIELET AKTYNOWY
Czynniki hamujące polimeryzację aktyny blokują lub
znacząco zmieniają właściwości kurczliwe komórek
mięśni gładkich
Częściowo odpowiada za utrzymywanie komórki w stanie
skurczu
Reorganizacja i sieciowanie filamentów cytoszkieletu
aktynowego mogą przyczyniać się do utrzymywania
długotrwałego napięcia mięśniowego
sieciowanie filamentów aktynowych
powoduje„utrwalanie” struktury komórki po skurczu
(dzięki kalponinie – białku o właściwościach podobnych
do kaldesmonu)

Brak ekspresji kalponiny powodowoduje znaczne obniżenie odporności
mechanicznej tkanek zawierających mięśnie gładkie, a tym samym osłabia
integralność ścian naczyń krwionośnych
Brak ekspresji kalponiny powodowoduje znaczne obniżenie odporności
mechanicznej tkanek zawierających mięśnie gładkie, a tym samym osłabia
integralność ścian naczyń krwionośnych
Ponadto kalponina wykazuje zdolność do oddziaływania z:
• desminą (białkiem filamentów pośrednich)
• mikrotubulami
• Alfa-aktyniną i filaminą – tworzy żele aktynowe o wysokiej sprężystości
Ponadto kalponina wykazuje zdolność do oddziaływania z:
• desminą
(białkiem filamentów pośrednich)
• mikrotubulami
• Alfa-aktyniną i filaminą
– tworzy żele aktynowe o wysokiej sprężystości
HIPOTEZA 1:
Białko to podobnie jak kaldesmon może bezpośrednio uczestniczyć w
regulacji aktywności aktomiozyny mięśni gładkich
HIPOTEZA 2:
Jest ona obecna głównie lub wyłącznie w domenie cytoszkieletowej, a nie
kurczliwej
Nie reguluje bezpośrednio aktywności aparatu skurczu
HIPOTEZA 1:
Białko to podobnie jak kaldesmon może bezpośrednio uczestniczyć w
regulacji aktywności aktomiozyny mięśni gładkich
HIPOTEZA 2:
Jest ona obecna głównie lub wyłącznie w domenie cytoszkieletowej, a nie
kurczliwej
Nie reguluje bezpośrednio aktywności aparatu skurczu
K A L P O N I N A

FILAMENTY POŚREDNIE
Występują we wszystkich mięśniach gładkich.
W mięśniach gładkich trzewnych filamenty te tworzy
wyłącznie desmina.
W naczyniowych mięśniach gładkich występują
również filamenty zbudowane z wimentyny.
Tworzą we włóknach luźne wiązki ciągnące się wzdłuż długiej osi
komórki, oddziałujące z cytoszkieletem ponadbłonowym.
F U N K C J E :
1. Utrzymywanie kształtu komórek
2. Udział w przekazywaniu siły generowanej w aparacie skurczu na
powierzchnię komórek
Występują we wszystkich mięśniach gładkich.
W
mięśniach gładkich trzewnych
filamenty te tworzy
wyłącznie
desmina.
W
naczyniowych mięśniach gładkich
występują
również filamenty zbudowane z
wimentyny.
Tworzą we włóknach luźne wiązki ciągnące się wzdłuż długiej osi
komórki, oddziałujące z cytoszkieletem ponadbłonowym.
F U N K C J E :
1. Utrzymywanie kształtu komórek
2. Udział w przekazywaniu siły generowanej w aparacie skurczu na
powierzchnię komórek

M I K R O T U B U L E
W kilku przypadkach obserwowano,
że czynniki depolimeryzujące
mikrotubule prowadzą do wzrostu
szybkości skurczu lub napięcia
różnych mięśni gładkich.
Indukowanany przez
depolimeryzację mikrotubul wzrost
aktywności motorycznej włókien
mięśni gładkich jest częściowo
spowodowany aktywacją kinazy
zależnej od Rho.
Mikrotubule pełnią aktywną rolę
w regulacji funkcji mięśni
gładkich.
W kilku przypadkach obserwowano,
że czynniki depolimeryzujące
mikrotubule prowadzą do wzrostu
szybkości skurczu lub napięcia
różnych mięśni gładkich.
Indukowanany przez
depolimeryzację mikrotubul wzrost
aktywności motorycznej włókien
mięśni gładkich jest częściowo
spowodowany aktywacją kinazy
zależnej od Rho.
Mikrotubule pełnią aktywną rolę
w regulacji funkcji mięśni
gładkich.

DZIĘKUJĘ ZA UWAGĘ…
Na podstawie artykułu Renaty Dąbrowskiej i
Roberta Makucha, KOSMOS, Problemy Nauk
Biologicznych, tom50, numer 4, 2001
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
Wyszukiwarka
Podobne podstrony:
seminarium z fizjo mięśnie
fizjo - mięśnie plus synapsy
fizjo MIĘŚNIE
ES miesni w zaniku prostym, konspekty fizjo
fizjo mail, SCIAGA Z FIZJO KOL 1 NR 2, Sprzężenie elektro-mechaniczne w mięśniu szkieletowym
2 fizjo czescB miesnie gladkie
fizjo mail, Fizjologia mieśni gładkich, B
sciagi do druku na fizjo wysilku miesnie, materiały fizjo, Fizjologia wysiłku fizycznego
ES miesni odnerwionych, konspekty fizjo
kom. mięśniowa, AWF, fiziologia, Fizjo prezentacje z cwiczen
ifmsa fizjo cw 2A miesnie(1)
Układ mięśniowy
Mięśnie brzucha ppt
Środki zwiotczające mięśnie poprzecznie prążkowane
więcej podobnych podstron