Nomenklatura według systemu
CIP oraz Fischera
1. Elementy stereochemii
Aleksandra Leszczyńska
CIP - reguła
pierwszeństwa
Cahna-Ingolda-Preloga
System wyrażania konfiguracji absolutnej opracowali trzej
chemicy Cahn, Ingold i Prelog w 1958 r., a ulepszyli w 1964
r.
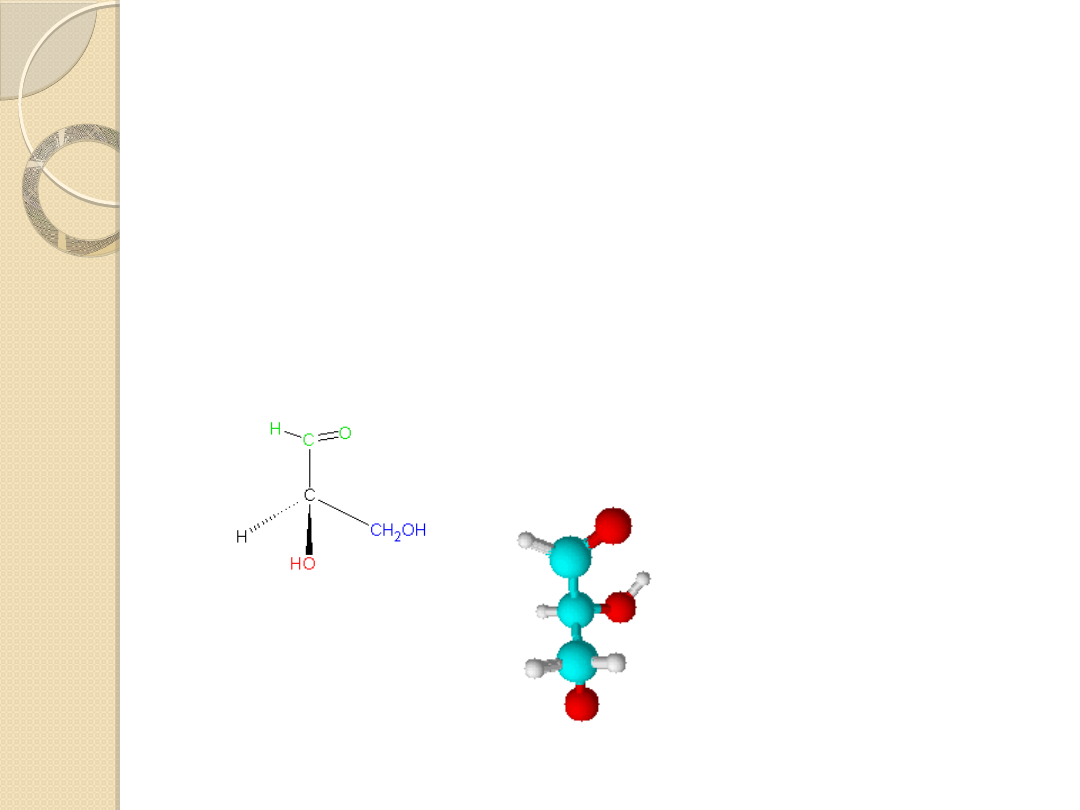
Metoda jest oparta na rzeczywistym trójwymiarowym
wzorze związku, którego konfigurację chcemy wyrazić. Dla
węgla lub innych atomów połączonych z czterema różnymi
ligandami
model
przestrzenny
cząsteczki
można
przedstawić, jak poniżej:
kierunek
patrzenia
kierunek
patrzeni
a
( R )
( S )

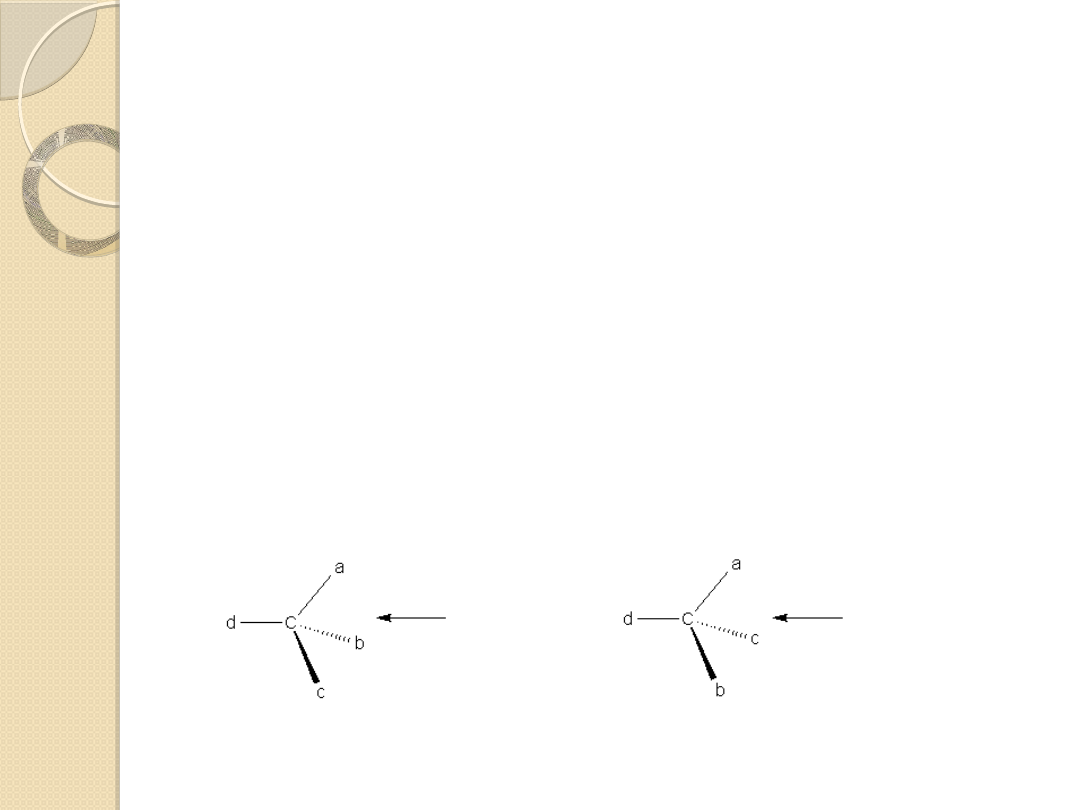
W celu określenia, który podstawnik traktujemy
jako najważniejszy, stosujemy się do trzech
zasad:
1 ZASADA
Jeżeli atomy połączone z centrum asymetrii są różne,
najważniejszy jest ten, o największej liczbie atomowej.
Cięższe izotopy są ważniejsze od lżejszych.
I > Br > Cl > S > P > Si > F >
O > N
>
C > H
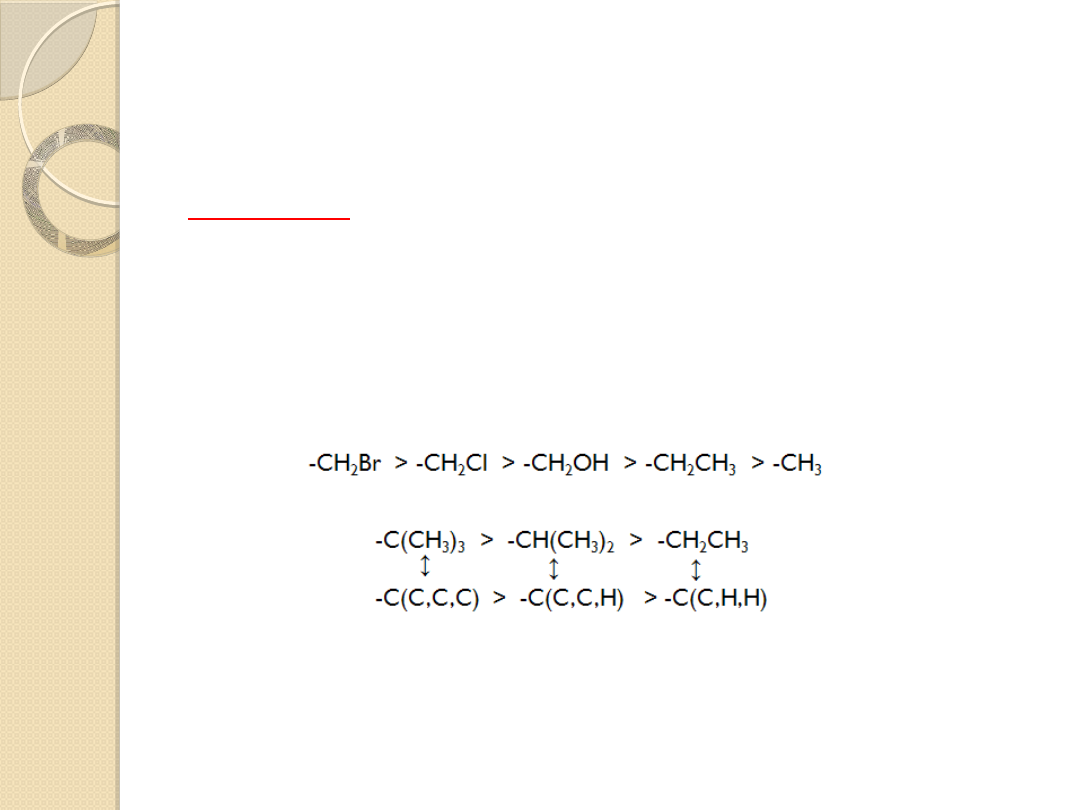
W celu określenia, który podstawnik traktujemy
jako najważniejszy, stosujemy się do trzech
zasad:
1I ZASADA
Jeżeli atomy bezpośrednio przyłączone do wiązania
podwójnego nie różnią się liczbą atomową, należy
rozważyć drugie, trzecie lub czwarte atomy, licząc od
atomu węgla wiązania podwójnego, aż do momentu,
kiedy napotka się różnicę.
-CH
2
OH > -CH(CH
3
)
2
↕ ↕
-C(O,H,H) > -C(C,C,H)
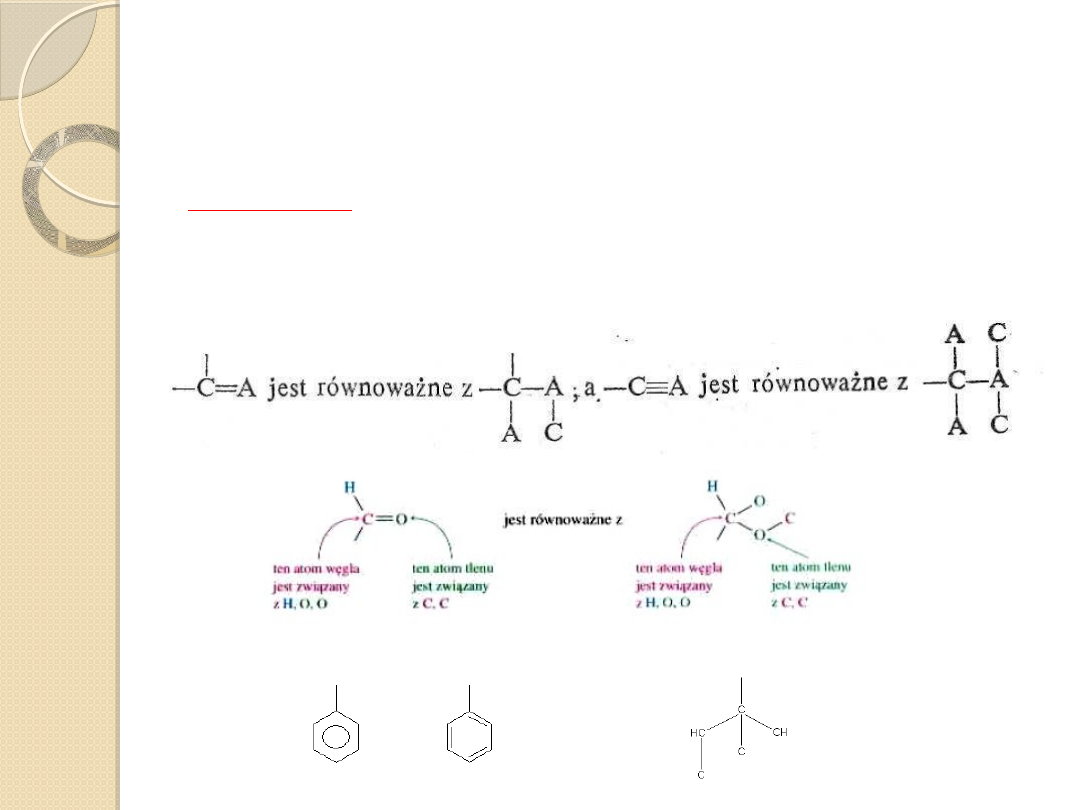
W celu określenia, który podstawnik traktujemy
jako najważniejszy, stosujemy się do trzech
zasad:
III ZASADA
W przypadku wiązania podwójnego lub potrójnego,
atomy połączone takim wiązaniem traktuje się
podwójnie (potrójnie).
równe
równoważne z
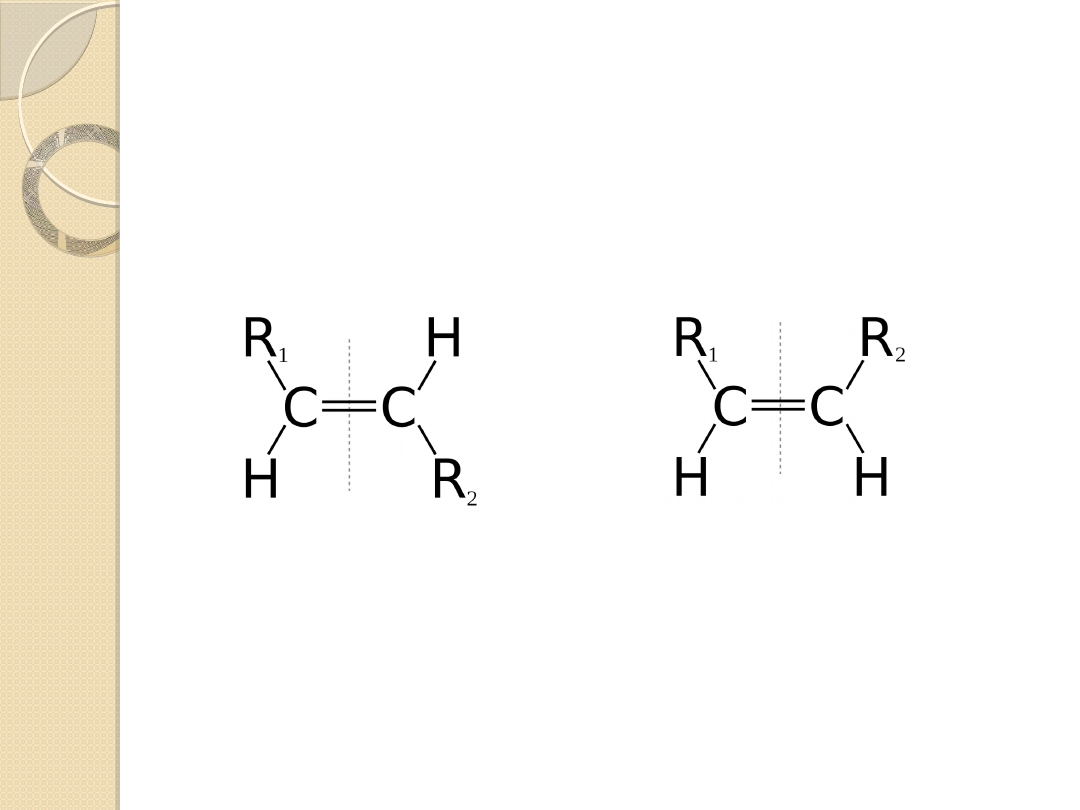
(E)-
(Z)-
grupy ważniejsze są
grupy ważniejsze są
po przeciwnych stronach
po tej samej stronie
Reguła pierwszeństwa:
oznaczanie E, Z
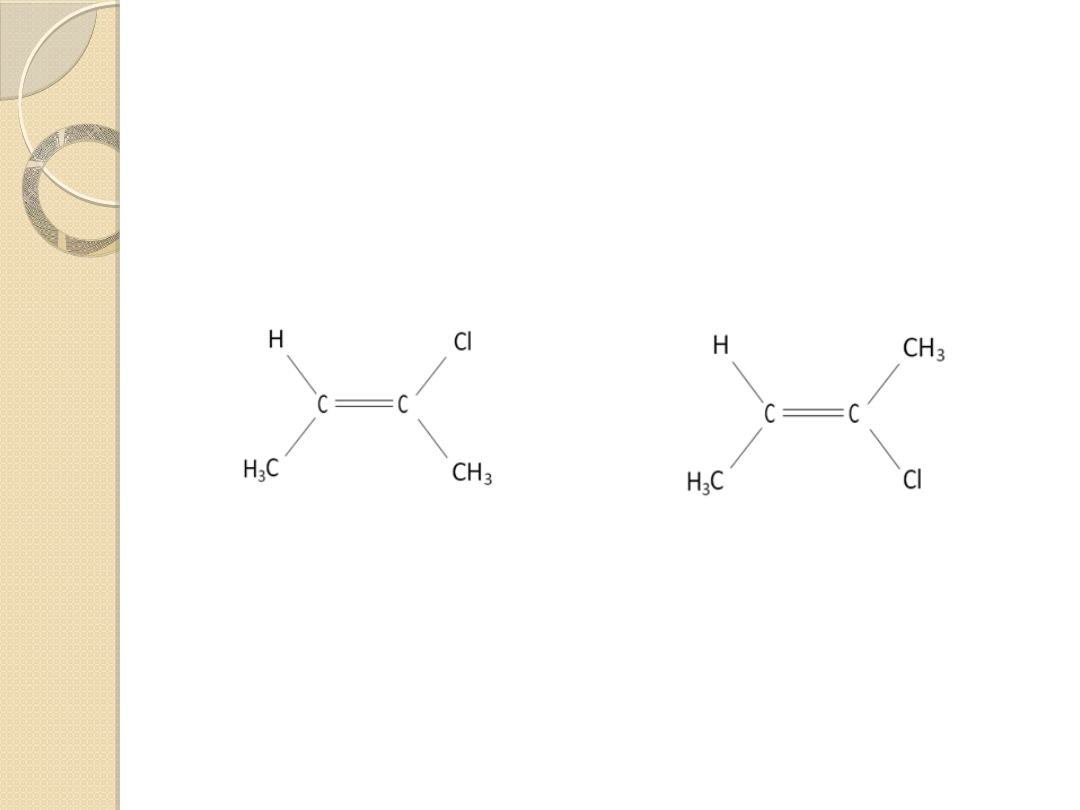
Przykłady:
a)
b)
mniej
ważn
y
mniej
ważn
y
mnie
j
waż
ny
mniej
ważny
ważniejsz
y
ważniejszy
ważniejszy
ważniejszy
(E)-2-chloro-2-buten
(Z)-2-chloro-2-buten
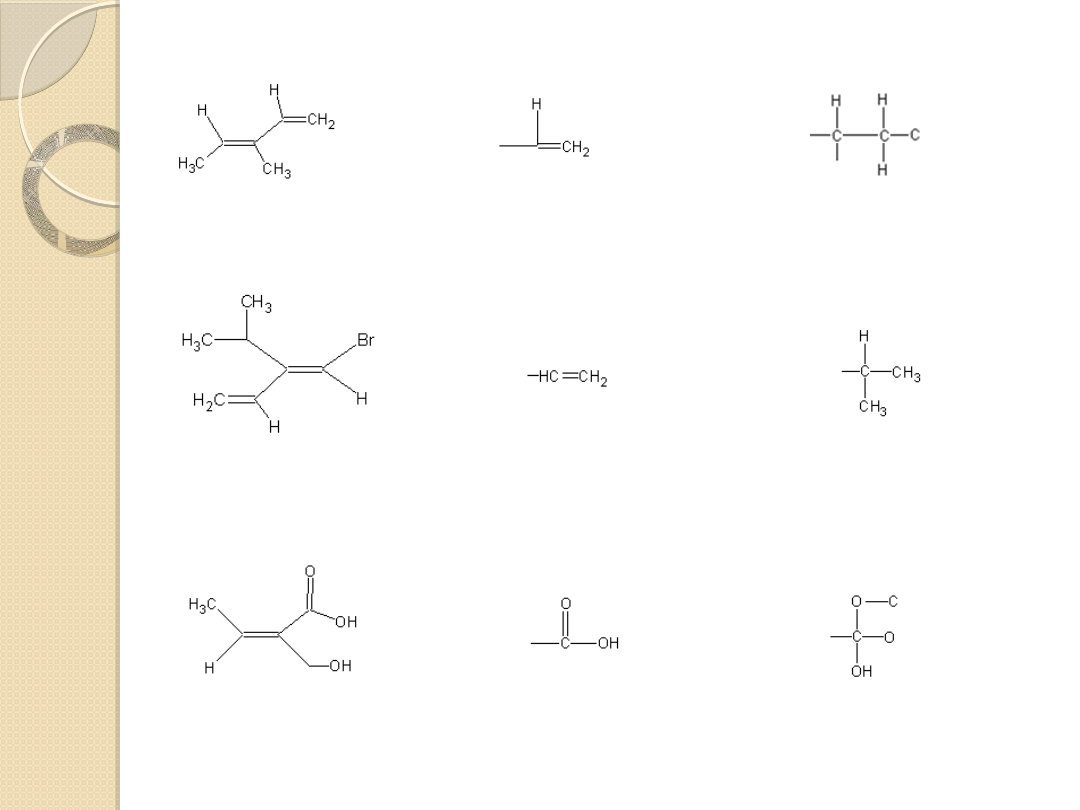
(E) -3-metylo-1,3-pentadien
(E) -1-bromo-2-izopropylo-1,3-butadien
Kwas (Z) – 2-hydroksymetylo-2-butenowy
równoważne z
grupa winylowa ma pierwszeństwo
przed
równoważne z

W roku 1891 Emil Fischer
zaproponował metodę opartą na
rzutowaniu tetraedrycznego atomu
węgla na płaszczyznę. Metoda ta
zwana jest
projekcją Fischera.
=
=
wiązania
wchodzące
pod
płaszczyznę
wiązania
wychodzące
ponad
płaszczyznę
( R)-gliceroaldehyd
(projekcja Fischera)
Projekcja Fischera
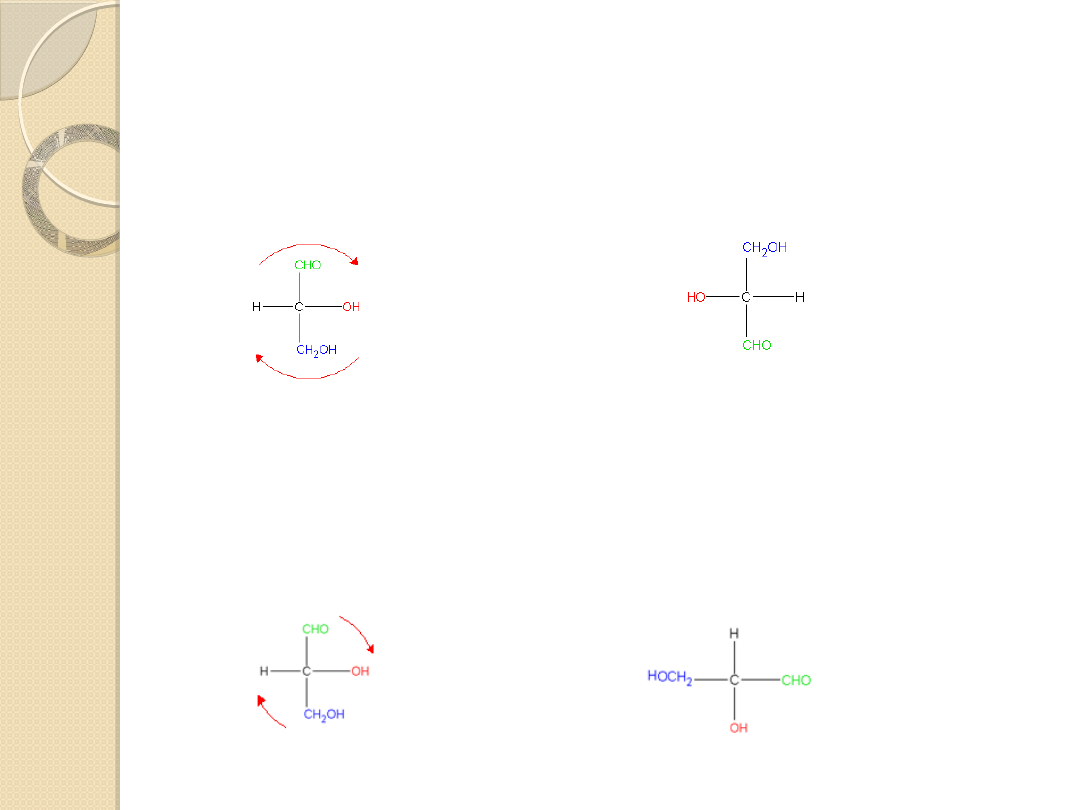
Projekcje Fishera można obracać na kartce o 180° bez zmiany ich
konfiguracji,
ale nie o 90° czy 270°. Obrót o 180° nie zmienia konwencji Fishera-
podstawniki znajdujące się przed i za płaszczyzną zachowują swoje
pozycje.
Na przykład w projekcji ( R)-gliceroaldehydu grupy –H i –OH wystają
przed płaszczyzną zarówno przed, jak i po obrocie o 180°.
180°
taki sam jak
(R)-gliceroaldehyd
( R)-gliceroaldehyd
Natomiast rotacja o 90° łamie konwencję Fishera, bo zmienia
grupy będące przed i za płaszczyzną. W rezultacie odwrócona
projekcja przedstawia
(S)-gliceroaldehyd.
NIE
jest taki
sam
90°
R)-gliceroaldehyd
(S)-gliceroaldehyd
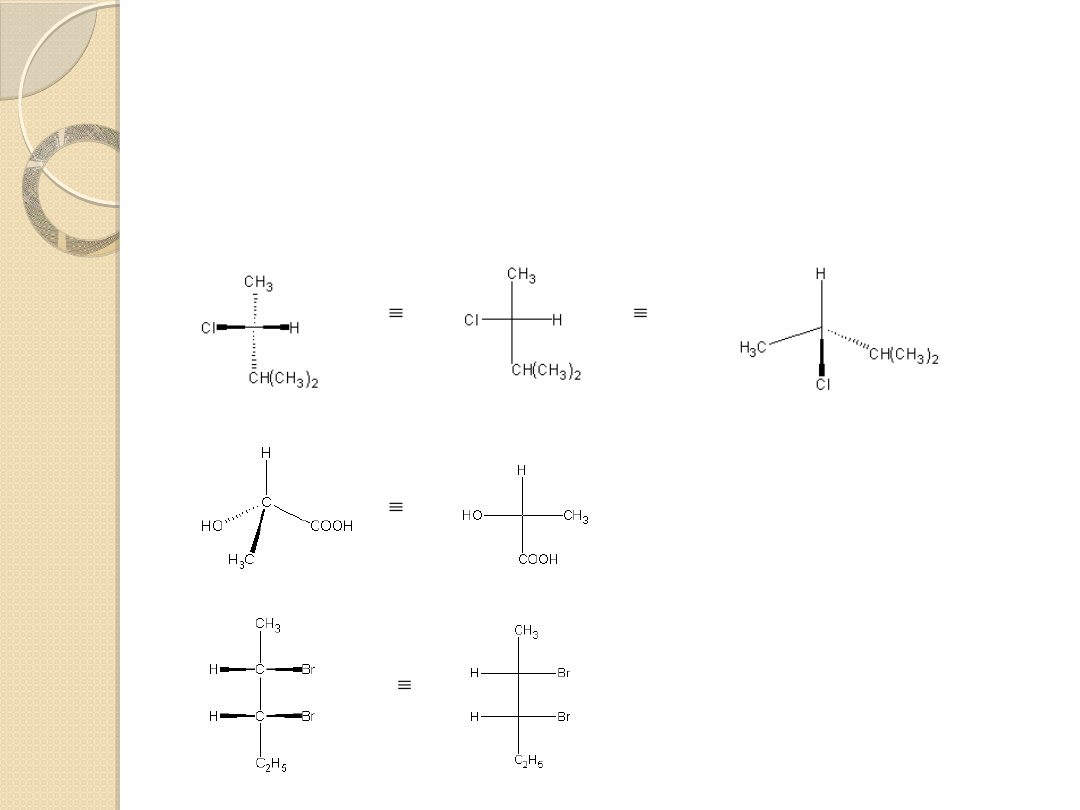
W projekcji Fishera można pozostawić jeden z podstawników w
niezmienionej
pozycji, a pozostałe trzy przemieścić albo zgodnie z kierunkiem
obrotu wskazówek
zegara, albo przeciwnie. Na przykład:
( R)-2-chloro-3-metylobutan
Konfiguracja R, S
kwas (S)-(+)-mlekowy
(2S,3R)-2,3-dibromopentan
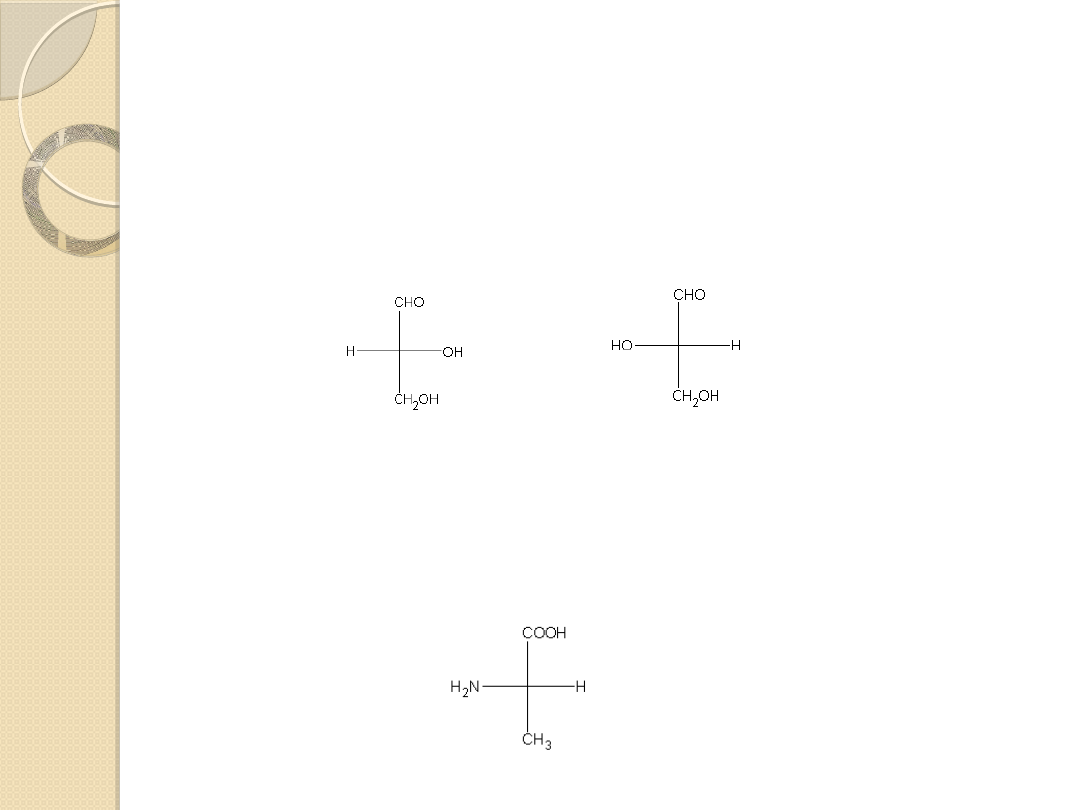
Konwencja Fishera- szeregi L i D
W projekcie Fishera większość występujących naturalnie cukrów ma
grupę hydroksylową na najniższym centrum stereogenicznym
skierowaną w prawo – D-cukry.
L-cukry
mają
grupę
hydroksylową
na
najniższym
centrum
stereogenicznym skierowana
w lewo.
W projekcji Fishera występujące naturalnie aminokwasy przedstawia się
umieszczając grupę –COOH na górze, podobnie jak przy rysowaniu
wzoru węglowodanu, a następnie umieszczając grupę –NH
2
po lewej
stronie.
aldehyd D-(+)-glicerynowy aldehyd L-(-)-glicerynowy
L-(+)-alanina

G.Hallas, Stereochemia związków organicznych,
Państwowe Wydawnictwo Naukowe, Warszawa 1968
R.T.Morrison, R.N. Boyd, Chemia organiczna,
Wydawnictwo Naukowe PWN, Warszawa 1994
J. McMurry, Chemia organiczna, Wydawnictwo Naukowe
PWN SA, Warszawa 2003
Bibliografia:
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Przykłady:
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
Wyszukiwarka
Podobne podstrony:
KAT NRS 1 1b regulator poziomu pl
1Wykład 1b 25 02 2014 METODY TECHNICZNEGO NORMOWANIA PRACYid 19226 pptx
! Regulacja ilości i aktywności enzymuid 42 pptx
Genetyka regulacja funkcji genow
REGULACJA UKLADU KRAZENIA 2
33 Przebieg i regulacja procesu translacji
8 ocena jakości układów regulacji
WYKŁAD 11 SPS 2 regulatory 0
Wykł 1B wstępny i kinematyka
WYKŁAD 7 Szeregowy regulacja hamowanie
Wzajemna regulacja gruczołów wydzielania wewnętrznego, pętle sprzężeń między gruczołami
TS09 dokł regulacji
więcej podobnych podstron