Fosforylacja oksydacyjna i mitochondrialne systemy transportujące
14
Peter A. Mayes, PhD, DSc
WPROWADZENIE
Mitochondrion określa się mianem „sifowni" komórki, ponieważ wewnątrz tej organelli zachodzi wychwytywanie większości energii pochodzącej z utleniań tkankowych. Mitochond-rialny proces wytwarzania bogatoenergetycz-nego związku (ATP), sprzężony z oddychaniem, określa się mianem fosforylacji oksydacyjnej.
ZNACZENIE BIOMEDYCZNE
Fosforylacja oksydacyjna umożliwia organizmom tlenowym związać znacznie większą część dostępnej energii swobodnej substratów oddechowych w porównaniu z organizmami beztlenowymi. Przebieg tego procesu wyjaśnia teoria chemiosmotyczna. Niektóre leki (np. amobarbital) i trucizny (np. cyjanek, tlenek węgla) hamują iaricuch oddechowy i wtórnie fosforylację oksydacyjną, zwykle z fatalnymi następstwami. Obecnie znamy wiele wad dziedzicznych, dotyczących składników mitochon-drialnego łańcucha oddechowego i fosforylacji oksydacyjnej. Wady te ujawniają się w postaci iniupatii, encefalopalii, a często i kwasicy mle-czanowej.
ŁAŃCUCH ODDECHOWY ZBIERA I UTLENIA RÓWNOWAŻNIKI REDUKUJĄCE
Cała użyteczna energia, uwalniana podczas utleniania kwasów tłuszczowych i aminokwasów, oraz niemal cała energia z utleniania
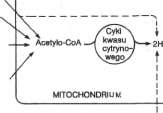
węglowodanów jest dostępna w obrębie mito-chondriów w postaci równoważników redukujących ( —H lub elektrony). Mitochondria zawierają zespół katalizatorów, nazwany łańcuchem oddechowym. Zbiera on i przenosi równoważniki redukujące, kierując je do ich końcowej reakcji z tlenem, w której powstaje woda. Mitochondria zawierają również układ enzymatyczny gromadzący uwalnianą energię swobodną w postaci bogatoenergetycznego wiązania fosforanowego. Poza tym zawierają one układy enzymatyczne warunkujące wytwarzanie większości równoważników redukujących zbieranych przez łańcuch oddechowy. Są to enzymy P-oksydacji i cyklu kwasu cytrynowego. Ten ostatni układ jest końcowym szlakiem metabolicznym wspólnym dla utleniania wszystkich głównych składników pokarmowych. Powiązania te przedstawiono na ryc. 14-1.
SKŁADNIKI ŁAŃCUCHA
ODDECHOWEGO
SĄ UPORZĄDKOWANE
W KOLEJNOŚCI WZRASTAJĄCYCH
POTENCJAŁÓW RED. OKS.
Zasadnicze składniki łańcucha oddechowego przedstawiono na ryc. 14-2. Wodory lub elektrony przepływają stopniowo przez łańcuch oddechowy — od składników bardziej elektroujem-nych do bardziej elektrododarniego tlenu. Rozpiętość red.-oks. układu od NAD+/NADH do O2/2H2O wynosi 1,1 V (p. tab. 13-1).
Główny łańcuch oddechowy w mitochond-riach katalizuje ciąg reakcji, przebiegających od dehydrogenaz, współdziałających z NAD, przez
148 / ROZDZIAŁ 14
POKARM I
Kwasy tłuszczowe
ATP
Ttuszcze—.®
p- Oksydacja
Glicerol
Węgło- -g
woda my—*
g
1
. Glukoza itp
Łańcuch oddechowy
. Aminokwasy
I ADP
Białka — i-
Pozamitochondrialne źródła równoważników redukujących
Ryc. 14-1. Rola mitochondrialnego łańcucha oddechowego w przekształcaniu energii chemicznej pożywienia w ATP. Utlenianiu większości składników pokarmu towarzyszy wytwarzanie równoważników redukujących (2H), które są zbierane przez łartcuch oddechowy w cełu ich utlenienia i sprzężonego z tym wytwarzania ATP.
Substral Y
Cytochromy
-^l^-
H+ H+ 2H+ 2H+
Ryc. 14-2. Przenoszenie równoważników redukujących w łańcuchu oddechowym.
Pro I i na
3-Hyd ro k sy acyl o-Co A
3-Hyd roksymaślan
Glutami niań
Jabtczan Izocytrynian
Glice ro lo-3-f osf o ran
Bursztynian Cholina
Fp
(FAD) FeS
Acyło-CoA Sarkozyna Dl metyl og li cyna
\..
-Cyt
■Cytc
Cu
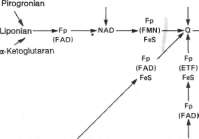
Ryc. 14-3. Składniki mitochondrialnego łańcucha oddechowego. FeS uczestniczy w transporcie elektronów, zbierając je z flawoproteiny lub cytochromu b: Cyt — cytochrom, ETF — flawoproteina przenosząca elektrony, FeS — białko że I a zos i arko we, Fp — flawoproteina, Q — ubichinon.
FOSFORYLACJA OKSYDACYJNA / 149
Forma całkowicie utleniona. Forma samlchlronowa
ożyli chfnonowa (wolny radnik}
OH
Forma zredukowana,
czyli chinolowa (hydrochincn)
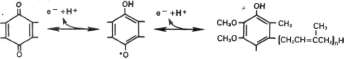
Ryc. 14-4. Struktura ubichinonu (Q), n — liczba jednostek izoprenoidowych; waha się ona w granicach 6—10, tj. Q6-io-
flawoproteiny i cytochromy do tlenu cząsteczkowego, Nie wszystkie substraty są związane z łańcuchem oddechowym przez dehydrogena-zy współdziałające z NAD; niektóre ze względu na ich bardziej dodatnie potencjały red.-oks. (np. fumaran/bursztynian; P- tab. 13-1) wiążą się bezpośrednio z dehydrogenazami będącymi fiawoproteinami, które z kolei są związane z cytochromami łańcucha oddechowego (ryc. 14-3).
Poza wspomnianymi przenośnikami w łańcuchu oddechowym znajduje się dodatkowy przenośnik łączący flawoproteiny z cytochro-mcm b, białkiem o najniższym potencjale ok-sydo/edukcyjnym w Łańcuchu cytochromo-wym. Ten dodatkowy przenośnik, który nazwano ubichinonem lub CoQ (koenzymem Q; p. ryc. 14-4), występuje w mitochondriach w warunkach tlenowych w utlenionej formie chino-nowej, a w warunkach beztlenowych w zredukowanej formie chinolowej, Ubichinon jest składnikiem lipidów mitochondrialnych, zawierających przede wszystkim fosfolipidy, tworzące część struktury błony mitochondrialnej. Struktura koenzymu Q jest bardzo podobna do budowy witamin K i E; podobna jest również do plastochinonu znajdującego się w chloroplas-tach. Wszystkie te związki charakteryzują się poliizoprenoidowym fańcuchem bocznym. W mitochondriach koenzym Q występuje w znacznym stechiometrycznym nadmiarze względem pozostałych członów łańcucha oddechowego. Ten fakt sugeruje, że jest on ruchomy m_ elementem łańcucha oddechowego i że zbiera on równoważniki redukujące z bardziej nieruchomych kompleksów flawoproteinowych i przenosi je na cytochromy.
Innym składnikiem, występującym również w preparatach łańcucha oddechowego jest bial-c (Fe:S; żelazo niehemowe). Jlii (metało-
Pr—Cvl-S
flawoproteinami) i 7. cytochromem b. Zarówno siarka, jak i żelazo uczestniczą w jednoelek-tronowym mechanizmie oksyd o redukcyjnym (ryc. 14-5).
Ryc, 14-5. Kompleks białka żelazosiarkowego (^6484).®— siarka nietrwała w środowisku kwaśnym, Pr — apoprotein3, Cys — reszta cysteinowa. Niektóre białka żeiazosiarkowe zawierają 2 atomy żelaza i 2 atomy siarki
Na rycinie 14-3 przedstawiono, zgodnie z współczesnymi poglądami, sekwencję zasadniczych składników łańcucha oddechowego. N a elektroujemnym końcu łańcucha dehydrogeńa-zy katalizują przeniesienie elektronów z sub-stratów na NAD łańcucha. Sposoby tego przenoszenia mogą być dosyć różne, a-Ketokwasy — pirogronian i a-ketoglutaran — mają własne kompleksy dehydrogenaz, zawierające liponian 1 FAD, które pośredniczą w przenoszeniu elektronów na NAD łańcucha oddechowego. Inne dehydrogenazy, np. dehydrogenaza h( + )-3-hy-droksyacylo-CoA, D(—)-3-hydroksymaśIanowa,
150 / ROZDZIAŁU
prolinowa, glutami ni a nowa, jabtczanowa lub izocytrynianowa, przenoszą elektrony bezpośrednio na NAD łańcucha oddechowego.
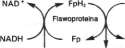
Zredukowany NAD łańcucha oddechowego jest z kolei utleniany przez dehydrogenazę NADH, która jest metalofloawoproteiną. Enzym ten zawiera Fe:S i FMN i jest ściśle związany z łańcuchem oddechowym. Przenosi on równoważniki redukujące na koenzym Q. Koenzym Q stanowi w łańcuchu oddechowym również punkt zbiorczy dla równoważników redukujących, pochodzących z innych substra-tów, które przez flawoproteinowe dehydroge-nazy kontaktują się bezpośrednio z łańcuchem oddechowym. Takimi substratami są burszty-nian, cholina, giiceróló:5-Fósibran;~sarkozyna, dimetyloglicyna i acylo-CoA (ryc. 14-3). W de-hydrogenazach tych substratów część flawino-wą stanowi FAD.
Elekt£o^y_zCoQ przepływają następnie przez. yhHy^7yTyen cząsteczkowy. Cytochromy są ułożone zgodnie ze wzrastającym potencjałem oksydoredukcyjnym. Znajdujący się na końcu łańcucha cytochrom aa3(ok-sydaza cytochromowa) odpowiada za ostateczne połączenie równoważników redukujących
z tlenem cząsteczkowym. Enzym _ten_zawięra miedź, składnik wielu oksydaz. Oksydaza cytochromowa ma bardzo duże powinowactwo do tlenu, co pozwala na funkcjonowanie łańcucha oddechowego z maksymalną szybkością, aż do momentu, w którym tkanka zostanie całkowicie pozbawiona tlenu. Ponieważ jest to reakcja nieodwracalna (jedyna w łańcuchu), nadaje ona kierunek przemieszczania się równoważników redukujących w łańcuchu oddechowym i do sprzężonego z nim wytwarzania ATP. Organizacja strukturalna łańcucha oddechowego była przedmiotem wielu hipotez. Istotnym odkryciem było stwierdzenie niemal starych stosunków molowych miedzy składnikami łańcucha oddechowego. Funkcjonalnie i strukturalnie składniki łańcucha oddechowego są zgrupowane w wewnętrznej błonie mitochondrialnej w 4 lipidowo-białkowc kompleksy łańcucha oddechowego. Powyższe dane wskazują, że przenośniki mają w błonach określoną orientację przestrzenną. Cytochrom c jest jedynym rozpuszczalnym cytochromem i tak jak koenzym Q wydaje się być bardzo ruchomym składnikiem łańcucha oddechowego łączącym nieruchome kompleksy (ryc, 14-6).
&&
Karboksyna
TTFA
BAL
Antymycyna Kompleks II! I
yt b, FeS. Cyt c,
■
H;S
CO* CN * ,'x Kompleks IV I
Cyt a Cyt
I
Związki rozprzęgające
O ligo mycy na
ATP ADP + P,
ATP
Miejsce sprzęgające 3
Malonian
Bursztynian
NADH
Związki rozprzęgające
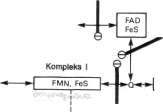
Kompleks II
Plerycydyna A Amobarbltal ^_1_^ Rotenon Oligomyoyna" i j'O ^\
ADP + P,
adp+p, ATP
Mtejsce sprzęgające 2
Miejsce sprzęgająca 1
Ryc. 14-6. Proponowane miejsca hamowania (0) tańcucha oddechowego prze* niektóre leki, substancje
chemiczne i antybiotyki. Zaznaczono „miejsca sprzęgające", które tworząc gradient protonowy wspierają
fosforylację. BAL (dimerkaprol); TTFA jest czynnikiem chelatującym Fe, Kompteks I — oksydo/eduktaza
NADH : ubichinon; kompleks tl •— oksydoreduktaza bursztynian : ubichinon; kompleks III —oksydoreduk-
taza ubichinot: utleniony cytochrom c; kompleks IV — oksydoreduktaza zredukowany cytochrom c: tlen.
Inne skróty jak na ryc. 14-3,
FOSFORYLACJA OKSYDACYJNA / 151
ŁAŃCUCH ODDECHOWY UMOŻLIWIA ZMAGAZYNOWANIE ZNACZNEJ CZĘŚCI ENERGII CHEMICZNEJ UTLENIAM BIOLOGICZNYCH
ADP jest cząsteczką, która wiąże w postaci bogatoenergetycznych fosforanów część energii swobodnej uwalnianej w procesach katabolicz-nych. Powstający ATP może z kolei przekazać tę energię swobodną procesom wymagającym energii. Stąd też ATP bywa nazywany „monetą obiegową" komórki (p. ryc. 12-8).
Wjęakcjach glikolizy powstają 2 bogatoener-gęticznejrugy fosforanowe, co jest równoważ-ne ok. 61 kJ/moI glukozy (p. tab. 19-1). Wynika z.tęgo^że ilość energii wychwytywanej w procesie glikolizy, w reakcjach fosforylacji substrato-wej, jest mata, jako że 1 mol glukozy,"ulegając całkowitemu spaieniu dostarcza ok. 2780 kJ. Reakcje cyklu kwasu cytrynowego, końcowego szlaku całkowitego uflemania"glukozy, obejmują 1 .^tap fosforylacii — przekształcenie
y
sukcynylo-CoA w bursztyniajŁ_co pozwala wytworzyć następne 2 boga to energetyczne wiąza-"hia__fosforaiiowe na moTglukozy, Wszystkie wspomniane powyżej fosfbrylacje zachodzą na po4pjnje_jybstratu. Wyniki badań prowadzonych na nie naruszonych oddychających mito-chondriach wykazują, że utlenieniu substratów J^ADk^h^i")ńh
oddechowy towarzyszy wbudowanie 3 mol fosforanu nieorganicznego w 3 mol ADP i powstanie w ten sposób 3 mol ATP na każde ]j2 mol zużytego O2, tzn. stosuneTt P:O = 3 (ryc. 14-6). Jeżeli natomiast substrat ulega utlenieniu przy udziale dehydrogenazy flawinowej, powstaje tylko 2 mol ATP, a stosunek P:O = 2. Reakcje te są znane jako fosforyiacje oksydacyjne (fosforylacjc na poziomie łańcucha oddechowego). Uwzględniając reakcje odwodorowania w szlaku katabolicznym glukozy zarówno w gli-kolizie, jak i w cyklu kwasu cytrynowego oraz fosforyiacje substratowe można obliczyć, że niemal 42% energii swobodnej, pochodzącej ze spalenia glukozy, zostaje związane w postaci bogatoenergetycznych wiązań fosforanowych. Jest oczywiste, ze to łańcuch oddechowy odpowiada za znaczną część puli tworzonego ATP.
KONTROLA ODDYCHANIA W MITOCHONDRIACH ZABEZPIECZA STAŁE DOSTARCZANIE ATP
Szybkość oddychania mitochondriów może być kontrolowana przez stężenie ADP. Dzieje się tak, ponieważ utlenianie i fosforyłacja są ze sobą ściśle sprzężone, tzn. utlenianie w łańcuchu oddechowym nie może zachodzić bez towarzyszącej fosforylacji ADP. Chance i Williams podali 5 czynników, które mogą kontrolować szybkość oddychania w mitochondriach {tab. 14-1).
Tabela 14-1. Stany kontroli oddechowej
|
|
Czynniki ograniczające szybkość oddychania |
Stan |
1 |
Brak ADP i substratu |
Stan |
2 |
Brak tylko substratu |
Stan |
3 |
Aktywność samego łańcucha oddechowego, gdy wszystkie substraty i ADP są obecne w stężeniach wysycających |
Stan |
4 |
Brak tytko ADP |
Stan |
5 |
Brak tylko tlenu |
Zasadniczo większość komórek w okresie spoczynkowym znajduje się w stanie metabolicznym 4, w którym szybkość oddychania zależy od dostępności ADP. W czasie wykonywania pracy następuje przemiana" ATP w ADP, co powoduje zwiększenie szybkości oddychania, a to z kolei prowadzi do uzupełnienia zapasu ATP (ryc. 14-7). Należy dodać, że w pewnych warunkach szybkość funkcjonowania łańcucha oddechowego może zależeć również od stężenia fosforanu nieorganicznego. Gdy szybkość oddychania się zwiększa (np. podczas pracy), metabolizm komórki zbliża się do stanu 3 lnb stanu 5, wówczas łańcuch oddechowy albo osiąga stan wysycenia, albo pO2 zmniejsza się poniżej Km dla cytochromu ay Niewykluczone, że sprawność przenośnika ADP/ATP, który ułatwia wejście cytoplazmatycznego ADP do wnętrza mitochondrionu, może być czynnikiem ograniczającym szybkość fosforylacji oksydacyjnej.
Proces utleniań biologicznych, w których energia swobodna, powstała w wyniku utleniania składników pokarmowych, staje się dostępna i może być związana, przebiega stopniowo,
152 / ROZDZIAŁ 14
Ciepto
T\
Procesy zużywające energię
SUBSTHAT
Ryc. 14-7. Rota ADP w kontroli oddechowej.
wydajnie (40—45%) i podlega kontroli — a nie wybuchowo, nieskutecznie i w sposób niekontrolowany. Pozostała energia swobodna, która nie została związana w formie bogatoenergety-cznego wiązania fosforanowego, uwalnia się w postaci ciepła. Nie znaczy to, że jest „stracona", gdyż dzięki temu układ oddechowy, jako całość, jest dość egzoergiczny, aby być w stanie nierównowagi, co pozwala na ciągły jednokierunkowy przepływ elektronów i stałe zaopatrywanie komórki w ATP. U zwierząt stałocieplnych zapewnia to utrzymanie odpowiedniej temperatury ciała.
WIELE ZNANYCH TRUCIZN TO INHIBITORY ŁAŃCUCHA ODDECHOWEGO
Wiele informacji dotyczących łańcucha oddechowego uzyskano po zastosowaniu związków, których przypuszczalne miejsce działania przedstawiono na ryc. 14-6. Do celów opisowych związki te można podzielić na inhibitory łańcucha oddechowego, inhibitory fosforylacji oksydacyjnej i związki rozprzęgające fosforyla-cję oksydacyjną.
Inhibitory, które hamują oddychanie przez blokowanie łańcucha oddechowego, działają w 3 miejscach. W miejscu pierwszym działają,. barbiturany (np. amobarbital), antybiotyk piery-cydyna A oraz jad rybi — rotenon. Inhibitory te hamują utlenianie substratów.Hofe kontaktują się bezpośrednio z łańcuchem oddechowym przez NAD-zaJeżne dehydrogenazy, jak np. 3-hydroksymaślan.
Dimerkaprol i antymycyna AJiamują łańcuch oddechowy między cytochromem.b a cytochro-mem c. Klasyczne trucizny, jak H2S, tlenek węgla i cyjanki hamują oksydazę cytócEfomo-wą. Karboksyna i TTFA swoiście hamują przeniesienie równoważników redukujących z dehydrogenazy bursztynianowej na koenzym (^ natomiast malonian jest inhibitorem kompety-cyjnym dehydrogenazy bursztynianowej.
Antybiotyk oUgomycyna całkowicie hamuje utlenianie i fosforylację w nie uszkodzonych mitochondriach. Jednakże, w obecności .związku rozprzęgającego — di nitrofenolu — zachodzi utlenia,nie_hez. towarzyszącej fosforylacji, co wskazuje, że oligomycyna nie działa bezpośrednio" na łańcuch oddechowy, lecz na etapie fosforylacji (p. ryc. 14-8).
Atraktylozyd hamuje fosforylację oksydacyjną, "która zależy od transportu nukleotydów adeninowych przez wewnętrzną błonę mito-chondrialną. Przyjmuje się, że hamuje on przenośnik nukleotydów adeninowych, odpowiedzialny za transport ADP do wnętrza, a ATP na zewnątrz mitochondrionu (p. ryc. 14-16).
Działanie związków rozprzedających polega na „odłączeniu" procesu utleniania w łańcuchu oddechowym od fosforylacji. Wskutek tego oddychanie przebiega w sposób niekontrolowany, ponieważ stężenie ADP lub P, nie ogranicza już szybkości oddychania. Najczęściej stosowanym związkiem rozprzęgającym jest 2,4-dini-trofenol, ale także inne związki działają w podobny sposób, np. dinitrokrezol, pentachlorofenol i CCCP (m-chlorokarbonyiocyjanidofenylohy-drazon). Ten ostatni jest ok. 100-krotnie aktywniejszy od dinitrofenolu.
:
FOSFORYLACJA OKSYDACYJNA / 153
ADP
|
Stan 4 |
i |
|
|
a" — |
|
|
|
|
\ |
i Stan 3 |
|
|
ADP f |
\ (v \ Związek razprzegąjący |
d" |
B |
i |
\Stan4 |
c |
|
|
Ollgomycyna ^1 |
i |
|
> |
i | Związek 1 |
S5 |
|
|
\i rozprzęgający \ |
|
|
|
|
|
|
i |
|
3 Minuty
Ryc. 14-8. Kontrola oddechowa w mitochond-riach. Doświadczenie A: na wykresie przedstawiono szybkość zużycia tlenu w stanie 4, która ulega przyspieszeniu po dodaniu ADP. Gdy cały egzogenny ADP zostanie ufosforylowany do ATP, wówczas szybkość oddychania maleje do wartości w stanie 4. Dodanie związku rozprzedającego, np. dinitrofenolu, uniezależnia oddychanie od fosforylacji. W doświadczeniu B: dodanie oNgomycyny hamuje fosforylację dodanego uprzednio ADP i w związku z tym obserwujemy hamowanie oddychania. Dodanie z kolei związku rozprzedającego zwiększa szybkość zużycia tlenu, ponieważ uniezależnia oddychanie od fosforylacji.
TEORIA CHEMIOSMOTYCZNA WYJAŚNIA MECHANIZM SPRZĘŻENIA UTLENIANIA Z FOSFORYLACJA
W ciągu ubiegłych lat przedstawiono wiele hipotez dotyczących sprzężenia utleniania z fos-forylacją. Można je podzielić na 2 zasadnicze grupy. Hipotezy sprzężenia chemicznego postulowały bezpośrednie sprzężenie chemiczne na wszystkich etapach procesu, tak, jak ma to miejsce w reakcjach tworzących ATP w glikoli-zie. Jednakże hipotezy te odrzucono, ponieważ nie udało się nigdy wyizolować bogatoener-getycznych pośredników, które miały łączyć utlenianie z fosfory lacją.
Według innych hipotez energia pochodząca z utleniania jest przechowywana w stanach konformacyjnych cząsteczek. Zmiana konformacji miała prowadzić do tworzenia bogato-energetycznych wiązań fosforanowych.
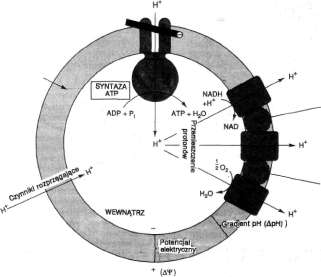
Teoria chemiosmotyczna postuluje, że utlenianie przenośników w łańcuchu oddechowym prowadzi do tworzenia jonów wodorowych, które są wyrzucane na zewnątrz sprzęgającej błony mitochondriałnej. Różnica potencjałów elektrochemicznych, wynikająca z asymetrycznego rozmieszczenia jonów wodorowych (protonów, H+), jest zużywana następnie do napędzania mechanizmu odpowiedzialnego za tworzenie ATP (ryc 14-9).
Łańcuch oddechowy jest pompą protonową
Według Mitchella, pierwotnym etapem procesu fosforylacji oksydacyjnej jest przemieszczenie protonów (H +)1n£|^wjiait4£z>iblony sprzęgającej (tzn. wewnętrznej hłoriy mitochondriałnej) napędzane przez utleniania w łańcuchu oddechowym. Każdy z kompleksów łańcucha oddechowego I, III i IV (p. ryc. 14-6} działa jako pompa protonowa. Postulował on również, że błona jest zasadniczo nieprzepuszczalna dla jonów, a zwłaszcza dla protonów, które gromadzą się na zewnątrz błony, wytwarzając trans-membranową różnice potencjału elektrochemicznego (Au,h+). Na tę różnicę składa się potencjał chemiczny (różnica pH) oraz potencjał elektryczny. Różnica potencjału elektrochemicznego jes^zużywana-przez błonową syntazę ATP (syn-taza ATP, transportująca H+), która w obecności ADP i Pj wytwarza ATP (ryc. 14-9). Nie ma tu więc bogatoenergetycznego pośrednika wspólnego dla utleniania i fosforylacji, jak to sugerowano w hipotezie sprzężenia chemicznego.
Według pierwotnej wersji teorii łańcuch oddechowy jest tak ułożony w błonie, że tworzy 3 pętle utłeniająco-redukcyjne (o/r). Na rycinie 14-10 przedstawiono schematycznie pojedynczą pętlę zawierającą przenośnik wodoru i przenośnik elektronów. Jednakże ten wymóg trudno było pogodzić w pełni ze znanymi składnikami błonowych kompleksów łańcucha oddechowego, np. kompleks IV nie zawiera przenośnika wodoru. Co więcej, nie jest znana dokładna liczba protonów pompowanych przez każdy kompleks, przypadająca na każdy transportowany elektron. Na rycinie 14-11 przedstawiono cykl Q, wyjaśniający możliwy mechanizm pompowania protonów przez kompleks III.
Powierzchnię błony wewnętrznej pokrywają Jednostki fosforylujące" odpowiedzialne za biosyntezę ATP (ryc. 14-12). Każda z nich składa się z wielu różnych białek. Hydrofilowy
154 / ROZDZIAŁ 14
O lig o mycy na
Błona sprzęgająca
NA ZEWNĄTRZ
Ubtahfnon
Cytochrom c
Byc. 14-9. Założenia teorii chemiosmotycznej dotyczącej fosforytacji oksydacyjnej. F1( Fo, czynniki białkowe warunkujące fosforylację Syntaza ATP, transportująca H + (FiFo), działa jako wtórna pompa protonowa. Pierwotna pompa protonowa funkcjonuje w wyniku sprzężenia utleniania z przemieszczeniem protonów z wewnętrznej na zewnętrzną powierzchnię błony. To przemieszczenie H + prowadzą kompleksy łańcucha oddechowego I, III i IV, z których każdy działa jako pompa protonowa. Związki rozprzęgające, takie jak di nitrofenol, powodują „przeciek" H+ przez błonę, skutkiem czego jest zanik elektrochemicznego gradientu protonów. Oligomycyna swoiście blokuje transport H+ przez Fo.
NA ZEWNĄTRZ |
BŁONA SPRZĘGAJĄCA |
WEWNĄTRZ |
Ryc. 14-10. Pętla oksydoredukcyjna (o/r) przemieszczająca protony (teoria criemiosmotyczna).
FOSFORYLACJA OKSYDACYJNA / 155
WEWNĘTRZNA BŁONA MITOCHONDRIALNA
CYTOZOL (NA ZEWNĄTRZ)
Ryc. 14-11. Pompujący protony cykl koenzymu Q. QH* jest zakotwiczony po obu stronach btony przez przyłączenie się do białka wiążącego Q, natomiast CIH2 i Q są ruchome. Cytochromy zaznaczono odpowiednio jako b, c-|.
Jednostki fosforylujące
BŁONA ZEWNĘTRZNA

B
U8Ł0NA -: j ZEWNĘTRZNA
f BŁONA*--*] WEWNĘTRZNA
rinr
Działanie ultradźwiękami
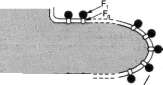
Cząstki submitochondrialne powstałe z fragmentów błony wewnętrznej
Ryc. 14-12. Budowa błon mitochondrialnych. Cząstki submitochondrialne są „przenicowane", tzn, mają odwróconą orientację błony, a więc i odwrócony błonowy gradient protonów. Na ich powierzchni zewnętrznej znajdują się Fi. Taki preparat pozwala prowadzić badania zamkniętych systemów błonowych.
* * I
■■- Jt3>/
156 / ROZDZIAŁ 14
Pj ADP Pj + ADP
Ryc. 14-13. Syntaza ATP, transportująca H+ (Mitchell).
ATP
kompleks tych białek określa się mianem Fj (czynnik sprzęgający I; ang. factor 1); wystaje on w kierunku małriks i wy|fa7il]jei aktywność _syntązyATP (ryc. t4-9).JEtje5tpołąc2.ony przez tzw. szyjkę (ang. stalk) z—błonowym f hydrofobowym) kompleksem-biaŁŁ-owym. Tkanym FD (czynnik sprzęgający wiążący oligomycyne), który prawdopodobnie zajmuje całą szerokość błony (ryc. 14-9). Protony przechodzą przez kompleks Fo— F, (syntazę. ATP, transportują-£&Ji+), co umożliwia syntezę ATP z ADP i Pj. Ciekawe, że podobne jednostki fosforylujące znaleziono na wewnętrznej powierzchni błony plazmatycznej bakterii i na zewnętrznej powierzchni błony tylakoidowej chloropiastów. Charakterystyczne, że błonowy gradient protonów skierowany jest w mitochondriach i bakteriach z zewnątrz do wewnątrz, ale w odwrotnym kierunku w chloroplastach.
Mechanizm sprzężenia przemieszczania protonów z anizotropowym (wektorowym) układem syntezy ATP nie jest wyjaśniony. Jeden 7. modeli proponowanych przez Mitchella jest przedstawiony na ryc. 14-13. Para protonów atakuje jeden z tlenów P,, tworząc wodę i aktywny Pj, który natychmiast reaguje z ADP, tworząc ATP. Wyniki innych badań wskazują, że bezpośrednia reakcja syntezy ATP nie jest głównym etapem wymagającym dostarczenia energii — jest nim raczej etap uwalniania ATP z centrum aktywnego syntazy. Niewykluczone, że wymaga to konformacyjnych zmian cząsteczki
Dane doświadczalne potwierdzają teorię chemiosmotyczną
1. Dodanie protonów (kwasu) do środowiska inkubacyjnego zawierającego mitochondria prowadzi do wytwarzania ATP.
Fosforylacja oksydacyjna nie zachodzi
w układach rozpuszczalnych, w których nie ma
możliwości występowania wektorowej syntazy
ATP, Aby fosforylacja oksydacyjna mogła za
chodzić, w układzie inkubacyjnym muszą być
zamknięte pęcherzyki błonowe (ryc. 14-9).Składniki łańcucha oddechowego są uło
żone w błonie w sposób asymetryczny (poprze
czna asymetria), co jest zgodne z wymaganiami
teorii chemiosmotycznej.
Teoria chemiosmotyczną wyjaśnia zjawisko kontroli oddechowej
Powstała wskutek przemieszczania protonów różnica potencjałów elektrochemicznych po obu stronach błony hamuje dalsze przenoszenie ~ równoważników redukujących przez łańcuch oddechowy dopóty, dopóki nie zostanie ona rozładowana w wyniku wstecznego transportu protonów przez błonę przy udziale wektorowej syntazy ATP. To z kolei zależy od dostępności ADP i Pi.
Tłumaczy działanie związków rozprzęgających
Te związki (np. dinitrofenol) są amfipatyczne (p. str. 190) i zwiększają przepuszczalność błony mitochondrialnej d!a protonów (ryc. 14-9), zmniejszając w ten sposób potencjał elektrochemiczny i „zwierając" syntazę ATP. Dlatego też w ich obecności utlenianie może przebiegać bez fosforylacji.
Tłumaczy istnienie mitochondrialnych układów transportujących na zasadzie wymiany przeciwprądowej
Te układy transportujące są konsekwencją wymogu, że aby utrzymać gradient elektro-
FOSFORYLACJA OKSYDACYJNA / 157
chemiczny błona sprzęgająca musi być nieprzepuszczalna dla protonów i innych jonów (patrz poniżej).
WZGLĘDNA
NIEPRZEPUSZCZALNOŚC
WEWNĘTRZNEJ BŁONY
MITOCHONDRIAŁNEJ
NARZUCA POTRZEBĘ OBECNOŚCI
PRZENOŚNIKÓW
Systemy transportu wymiennego znajdują się w błonie i katalizują wymianę przeciwprądową anionów z OH~ oraz kationów z H + . Każdy z tych systemów jest niezbędny do zachowania równowagi elektrycznej i osmotycznej podczas pobierania i uwalniania zjonizowanych metabolitów.
Roz m i eszczen ie c ha rakterystycz nych
enzymów, tzw. znacznikowych,
w przedziałach rozdzielonych błonami
mitochondrialnymi
Mitochondria mają błonę zewnętrzną przepuszczalną dla większości metabolitów, błonę wewnętrzną, która jest wybiórczo przepuszczalna i pofałdowana w tzw. grzebienie, oraz macierz .wewnątrz mitochondrionu (ryc. 14-12). Działając na mitochondrion digitoniną można usunąć z niego błonę zewnętrzną, której enzymami znacznikowymi są monoaminooksyda-za, syntetaza acyio-CoA, acylotransferaza glicerolo fosforanowa, acylotransferaza lizofosfa-tydowa i ibsfolipaza A2, W przestrzeni między-błonowej znajduje się kinaza adenylanowa oraz
kinaza kreatynowa. W Wonie wewnętrznej jest nagromadzony fosfolipid — kardiolipina.
W macierzy mitochondriainej znajdują się rozpuszczalne enzymy cyklu kwasu cytrynowego i enzymy P-oksydacji kwasów tłuszczowych. Oba procesy wymagają udziału układów transportujących metabolity oraz nukleotydy przez wewnętrzną błonę mitochondrialną. Dehydro-genaza bursztynianowa znajduje się na wewnętrznej powierzchni mitochondriainej błony wewnętrznej, gdzie przenosi równoważniki redukujące bezpośrednio na ubichinon łańcucha oddechowego, z pominięciem kompleksu I łańcucha oddechowego. Na powierzchni matryk-sowej wewnętrznej błony mitochondriainej znajduje się również dehydrogenaza 3-hydro-ksymaślanowa. Na zewnętrznej powierzchni błony wewnętrznej zlokalizowana jest dehydrogenaza glicerolo-3-fosforanowa, co pozwala jej uczestniczyć w „mostku" glicerolofosforano-wym (układ wahadłowy glicerolofosfuran-dihyd-roksyaceton, ryc. 14-14).
Utlenianie pozamitochondrialnego NADH odbywa się za pośrednictwem „mostków" substratowych
Wewnętrzna błona mitochondrialna nie jest przepuszczalna dla NADH, który jest stale wytwarzany w cytozolu w reakcji szlaku glikoli-tyczncgo, katalizowanej przez dehydrogenazę gliceraldehydo-3-fosforanową (p. ryc. \9-2).Je-dńakże w warunkach tlenowych pozamitochon-drialny NADH nie gromadzi się i ulega przypuszczalnie utlenieniu w mitochondrialnym łańcuchu oddechowym. Rozważano kilka mechanizmów, według których ten proces mógłby
CYTOZOL
WEWNĘTRZNA BŁONA MłTOCHONDRIALNA
NAD
DEHYDROGENAZA GLICEROLO-3-FOSFORANOWA
Dlhydroksyacetonofosforan "*■
GI icerolo-3-fosfo ra n
GI icerolo-3-f osf oran
DEHYDROGENAZA GLICEROLO-3-FOSFORANOWA
■Dlhydroksyacetonofosforan
FAD
FADH2
t
Łańcuch oddechowy
Ryc. 14-14. Mostek glicerolofosf ora nowy {układ wahadłowy glicerolo-3-fosforan : dihydroksyacetono-
fosforan) transportujący równoważniki redukujące z cytozolu do mitochondrionu. Ponieważ mitochond
rialna dehydrogenaza giicerolo-3-fosforanowa znajduje się na zewnętrznej powierzchni btony wewnętrz
nej, układ ten nie wymaga transportu substratów przez błonę.
158 / ROZDZIAŁ 14
CYTOZOL
BŁONA
MITOCHONDRION
NADł
OEHYDROGENAZA JA8ŁCZAN0WA
DEHYDROGENA2A JABŁCZANOWA
Szczawiooctan
a-KG
NADH + H+
a-KG
AMIN0TRANSFERA2A
Asp
Asp
![]()
Jabłczan,
Glutaminian
^Jabłczan NAD*
AMINOTHANSFERAZA
Szczawiooctan
Glutaminian
Ryc. 14-15. Mostek jabłczanowo-asparaginianowy (układ wahadłowy jabłczan : asparaginian) przenoszący równoważniki redukujące z cytozolu do mttochondrionu. 1 — przenośnik a-ketoglutaranowy, 2 — przenośnik glutaminianowo-asparaginianowy (przenoszący z glutaminianem proton, symport).
przebiegać. Jednym z nich jest przenoszenie równoważników redukujących przez błonę mi-tochondriałną za pośrednictwem par substra-tów sprzężonych odpowiednimi dehydrogena-zami. Niezbędnym warunkiem przebiegu tego procesu jest obecność swoistej dehydrogenazy po obu stronach wewnętrznej błony mitochond-rialnej. Na rycinie 14-14 przedstawiono mechanizm przenoszenia przy użyciu „mostka" glice-rolofosforano wego. Należy zwrócić uwagę, że w związku z tym procesem zostaną wytworzone tylko 2, a nie 3 mol ATP na atom zużytego tlenu, ponieważ enzym mitochondrialny jest flawoproteiną związaną z łańcuchem oddechowym bez udziału NAD. U niektórych gatunków aktywność FAD-zależnego enzymu (mitochon-drialnego) zmniejsza się po tyreoidektomii i zwiększa po podaniu tyroksyny. Chociaż obecność tego układu wahadłowego wykazano w mięśniach skrzydłowych owada i w mięśniu białym i może on mieć znaczenie w wątrobie, to w innych tkankach (np. w mięśniu sercowym) stwierdza się niedobór mitochondrialnej dehydrogenazy glicerolo-3-fosforanowej. Przeto uważa się, że bardziej uniwersalny jest układ transportujący wykorzystujący jabłczan i dehydrogenazy jabłczanowe, cytoplazmatyczną i mito-chondrialną. Ten „mostek" (układ wahadłowy jabłczan : asparaginian) przedstawiono na ryc. 14-15, Złożoność tego układu wynika z nie-
przepuszczalności wewnętrznej błony mitochondrialnej dla szczawiooctanu. Szczawiooctan, kosztem glutaminianu, musi najpierw ulec transaminacji do asparaginianu, z którego po jego przejściu przez błonę mitochondrialną zostanie w cytozolu odtworzony szczawiooctan.
Transport jonów w mitochondriach jest procesem wymagającym dostarczenia energii
Aktywnie oddychające mitochondnaj wjctó-rych zachodzi fosforylacja oksydacyjna, utrzymują lub gromadzą kationy, takie jak K+,Na+, Ca2 + i Mg2 + oraz P*. Rozprzężenie fosforylacji oksydacyjnej za pomocą dinitrofenolu prowadzi do ucieczki jonów z mitochondrionu, ale pobieranie jonów ze środowiska nie jest hamowane przez oligomycynę, co sugeruje, że energia konieczna do procesu transportu nie pochodzi z bogatoenergetycznego wiązania fosforanowego, powstającego podczas fosforylacji ADP. Przyjmuje się, że wymianę kationów napędza pierwotna pompa protonowa.
Układy transportujące zabezpieczają równowagę elektryczną i osmotyczną po obydwu stronach błony mitochondrialnej (p. ryc. 14-16)
Wewnętrzna błona mitochondrialną swobodnie przepuszcza elektrycznie obojętne małe
FOSFORYLACJA OKSYDACYJNA / 159
Wewnętrzna
NA ZEWNĄTRZ błona WEWNĄTRZ
mltochondrlalna N-Ety)orraieimłd
OH"
H3PO4"
N-Etyloma!eJmld i Hyd r o teycyn am on lan
Pirogronian"
Jabtazan1"
_Jabłczan'-
Cytrynian*-+ Hł
Jablczarr
et-Ketoglutaran1" . ADP3" ■
■ATP*
ków lub układów transportujących, ułatwiających ich transport przez błonę. Okazuje się, że aniony monokarboksylowe przenikają przez błonę łatwiej ze względu na mniejszy stopień dysocjacji tych kwasów. Uważa się, że nie-zdysocjowany i dobrze rozpuszczalny w lipidach kwas jest tym rodzajem cząsteczki, która przechodzi przez błonę lipidową.
Transport anionów dikarboksylowych i tri-karboksylowych jest ściśle związany z przenoszeniem fosforanu nieorganicznego. Ten ostatni łatwo przechodzi przez błonę jako jon HZPO~, wymieniając się z OH". Pobranie jabłczanu przez przenośnik anionów dikarboksylowych wymaga na wymianę fosforanu nieorganicznego po przeciwnej stronie błony. Pobranie cytrynianu, izocytrynianu, lub ds-akonitanu przez transporter anionów trikarboksylowych wymaga na wymianę jabłczanu. Transport ac-ketoglutaranu również zachodzi na zasadzie wymiany z jabłczanem. Dzięki użyciu mechanizmów wymiany przeciwp radowej (antyport) zostaje więc zachowana równowaga osmotyczna. Transport cytrynianu przez wewnętrzną błonę mitochondrialną zależy nie tylko od przenoszenia jabłczanu, lecz także od transportu fos-
Atraktylozyd i
Byc. 14-16. Układy przenośnikowe w błonie mi-
tochondrialnej, 1 ~ przenośnik fosforanowy, 2 — sprzężony transport (symport) pirogro-nianu, 3 — przenośnik anionów dikarboksylo-wych, 4 — przenośnik anionów trikarboksylo-wych, 5 — przenośnik a-ketoglutaranowy, 6 — przenośnik nukleotydów adeninowych, Zaznaczono miejsca hamowania (0) przez N-etylomaleimid, hydroksycynarnonian i atraktylozyd, W błonie znajdują się również (nie pokazano) przenośniki: gluta-minianowo-asparaginianowy (ryc. 14-15), glutaminowy, ornttynowy i karrtitynowy (ryc. 24-1).
cząsteczki, takie jak tlen, woda, CO2 i NH3, oraz kwasy monokarboksylowe, takie jak 3-hy-droksymasłowy, acetooctowy i octowy. Długo-łańcuchowe kwasy tłuszczowe są przenoszone do mitochondriów jako pochodne karnityny (p. ryc. 24-1), a specjalny przenośnik w wewnętrznej bionie rnitochondrialnej umożliwia sprzężony transport pirogronianu z H+ {kotransport, symport), co jest równoznaczne ze zużyciem transmembranowego gradientu protonów. Aniony dikarboksylowe i trikarboksylowe oraz aminokwasy wymagają swoistych przenośni-
Wewnętrzna
NA ZEWNĄTRZ ^„a WEWNĄTRZ
mliocriondrialna
|
|
F1 |
|
|
|
|
|
|
|
} |
|
|
|
|
|
|
|
t ATP"" _J |
|
|
|
|
|
|
|
j |
|
"l |
0) |
|
|
|
|
|
|
Ryc. 14-17. Współdziałanie przenośnika fosforanowego (1) z przenośnikiem nukleotydów adeninowych (2) podczas syntezy ATP. Przedstawiony sprzężony transport (symport) H+/Pj jest odpowiednikiem przeć i wtrans portu (antyport) Pj/OH~ (ryc. 14-16). Na każdą zsyntetyzowaną w mito-chondriach i uwalnianą cząsteczkę ATP, mitochon-drion pobiera 3 protony. Natomiast pobiera tylko 2 protony, jeżeli zsyntetyzowana cząsteczka ATP zostanie zużyta wewnątrz mttochondrionu.
160 / ROZDZIAŁ 14
forami nieorganicznego. Przenośnik nukleoty-dów adeninowych umożliwia wymianę ATP z ADP, ale nie z AMP. Pozwala on wyjść cząsteczce ATP z mitochondrionu do pozamito-chondrialnych miejsc zużywających energię oraz zapewnia powrót ADP do wnętrza mitochondrionu, gdzie służy do syntezy ATP (ryc. 14-17), Na+ może wymieniać się z H + , zużywając gradient protonów. Uważa się, że aktywny transport Ca2h do mitochondriów zachodzi z przemieszczeniem I ładunku (uniport). prawdopodobnie na zasadzie antyportu CaJ + /H+, Uwalnianie wapnia z mitochondriów jest ułatwione przez wymianę z Na+.
Jonofory umożliwiają swoistym kationom transport przez błonę
Jonofory uzyskały taką nazwę ze względu na ich zdolność do kompleksowania swoistych kationów i ułatwiania ich transportu przez błony biologiczne. Ta właściwość jonoforów wynika z ich lipofilowego charakteru, który umożliwia penetrację błon lipidowych, takich jak błona mitochondrialna. Za przykład może posłużyć walinomycyna umożliwiająca przechodzenie K+ przez błonę mitochondriainą. w następstwie czego dochodzi do rozładowania potencjału błonowego między środowiskiem zewnętrznym i wewnętrznym mitochondrionu. Nigerycyna również działa jako jonofor dla K+, ale na zasadzie wymiany z H + . Prowadzi to do zniesienia transmembranowego gradientu pH. W obecności walinomycyny i nigerycyny, zostaje wyeliminowany zarówno potencjał błonowy, jak i gradient pH i stąd całkowite hamowanie fosforylacji. Klasyczne związki rozprzęgają-ce, takie jak dinitrofenol, są w rzeczywistości jonoforami protonowymi.
Transhydrogenaza transportująca H* wytwarza wewnątrzmitochondrialny NADPH
Znajdująca się w wewnętrznej błonie mito-chondrialnej energetycznie zależna transhydrogenaza katalizuje przeniesienie H+ z wewnątrz-mitochondrialnego NADH na NADP, tworząc NADPH, który jest sprzężony z przemieszczeniem protonów ze środowiska zewnętrznego do wnętrza mitochondrionu. Wydaje się, że
enzym działa jako energetycznie zależny bufor red.-oks. i jako źródło NADPH dla enzymów wewnątrzmitochondrialnych, takich jak dehyd-rogenaza glutaminianowa i hydroksylazy uczestniczące w syntezie steroidów.
Niedoczynność łańcucha oddechowego jest przyczyną choroby
Niedobory lub brak większości oksydore-duktaz łańcucha oddechowego są przyczyną śmiertelnej miopatii tnitochondrialnej niemowląt i dysfunkcji nerek. MELAS (miopatia mitochondrialna, encefalopatia, kwasica mkczano-wa i udar) jest dziedzicznym zespołem chorobowym, wynikającym z niedoboru oksydoreduk-tazy NADH; ubichinon {kompleks 1) lub ok-sydazy cytochromowej. Opisano wiek chorób spowodowanych niedoborem któregoś z enzymów mitochondrialnych (Scholte).
PIŚMIENNICTWO
Boyer PD: The unusual enzymology of ATP synthase.
Biochemistry 1987;26:8503. Cross RL: The mechanism and regulation oT ATP
synthesis by FrATPases. Annu Rev Biochem
1981;50:<581. Hatefi Y: The mitochondrial electron transport
and oxidative phosphorylation system. Annu
Rev Biochem 1985;54:1015. Hinkle PC, McCarty RE: How cells make ATP.
Sci Am (March) 197K;238:104. Mitchcll P: BCeilin's respiratory chain concept
and its chemiosmotic consequences. Science
1979;206:1148. Nicholls DG: Bioenergetics: An introduetion to
the Chemiosmotic Theory. Academic Press,
1982. Prince RC: Tbe proton pump of cytochrome
oxidase. TIBS 1988;13:159.
Schohe HR, et al: Defects in oxidative phosphorylation. Biochemical iiwestigations in skeletal
muscle and expression of the lesion in
other cells. / Inher Metab Dis 1987;I0, Suppl
1:81. Tyler DD: The mitochondrial ATP synthase.
Page 117 in: Membranę Structure and Func-
tion, Vol. 5. Bittar EE (editor). Wiicy, 1984. Tyler DD, Sutton CM: Mitochondrial trans-
porting systems. Page 181 in: Membranę
Structure and Function. Vol 5. Bittar EE
(editor). Wiley, 1984.
Węglowodany o znaczeniu fizjologicznym
15
Peter A. Mayes, PhD, DSc
WPROWADZENIE
Węglowodany są szeroko rozpowszechnione w świecie roślinnym i zwierzęcym. Odgrywają one rolę zarówno strukturalną, jak i metaboliczną. W roślinach glukoza jest syntetyzowana z dwutlenku węgla i wody w procesie fotosyntezy i przechowywana jako skrobia lub ulega przekształceniu w błonnik szkieletu roślinnego. Zwierzęta mogą syntetyzować niektóre węglowodany, wykorzystując do tego celu tłuszcz i białka, ale większa część węglowodanów zwierzęcych jest pochodzenia roślinnego.
ZNACZENIE BIOMEDYCZNE
Znajomość struktury i właściwości węglowodanów fizjologicznie ważnych jest niezbędna do zrozumienia ich roli w ekonomii organizmu ssaków. Glukoza jest najważniejszym węglowodanem, ponieważ większość węglowodanów zawartych w pokarmach wchłania się do krwio-biegu jako glukoza lub jest przekształcana w nią w wątrobie, a w organizmie z glukozy mogą powstać wszystkie inne cukry. Glukoza jest istotnym źródłem energii w tkankach, ssaków (z wyjątkiem przeżuwaczy) i uniwersalnym „paii-wem" dla płodu. Jest ona przekształcana w inne cukry odgrywające swoiste role, np. glikogen jako spichlerz; ryboza w kwasach nukleinowych; galaktoza w laktozie mleka, w pewnych lipidach złożonych oraz w połączeniu z białkami w glikoproteinach i proteoglikanach. Do chorób związanych z zaburzeniami węglowodanów zalicza się cukrzycę, galaktozemic, zaburzenia spichrzania glikogenu i nietolerancję mleka.
WĘGLOWODANY SĄ ALDEHYDOWYMI LUB KETONOWYMI POCHODNYMI ALKOHOLI WIELOHYDROKSYLOWYCH
Węglowodany klasyfikuje się następująco:
Monosacharydy są to węglowodany, które nie ulegają hydrolizie do form prostszych. Na podstawie liczby atomów węgla można je podzielić na triozy, tetrozy, pentozy, heksozy i hcptozy; oraz na aldozy i ketozy zależnie od obecności grupy aldehydowej lub ketonowej. Przykładami są:
Aldoza Ketoza
Triozy (C3H6O3)
Tetrozy (C.H.OJ
Pentozy (CBH10Os)
Heksozy (C6H12O0)
Aldehyd Dihydro-
glicerynowy ksyaceton
Erytroza Erytruloza
Ryboza Rybuloza
Glukoza Fruktoza
Disacharydy to węglowodany, które podczas hydrolizy rozpadają się na 2 cząsteczki takich samych lub różnych monosacharydów. Przykładami są sacharoza, laktoza i maltoza.
Oligosacharydy to cząsteczki, które podczas hydrolizy rozpadają się na 3—6 jednostek monosacharydowych. Przykładem może być maltotrioza*.
Polisacharydy w wyniku hydrolizy rozkładają się na ponad 6 cząsteczek monosacharydów. Przykładami polisacharydów, które mogą być liniowe lub rozgałęzio-
* Należy podkreślić, że nie jest to trioza, ale trisacharyd zbudowany z 3 reszt a-glukozy.
II — Biochemia
162 / ROZDZIAŁ 15
ne, są skrobie i dekstryny. Niekiedy określa się je jako heksozany lub pentozany, w zależności od rodzaju monosacharydów otrzymywanych w wyniku hydrolizy.
GLUKOZA JEST GŁÓWNYM MONOSACHARYDEM
Struktura glukozy może być przedstawiona 3 sposobami
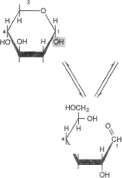
Chociaż wzór strukturalny w formie prostego łańcucha (aldoheksoza, ryc. 15-1 A) pozwala zrozumieć niektóre właściwości glukozy, to strukturą uprzywilejowaną termo dynamicznie i warunkującą jej pozostałe właściwości chemiczne jest forma cykliczna. W większości przypadków wzór strukturalny glukozy może być przedstawiony jako płaski pierścień narysowany perspektywicznie, jak zaproponował Ha-worth (ryc. 15-1B). Na podstawie analizy dy-
0 11 |
|
II ■c |
-H |
H—2C |
-OH |
H-«C |
-OH |
frakcji promieni rentgenowskich ustalono, że ten sześcioczłonowy pierścień zawierający 1 atom tlenu, w rzeczywistości istnieje w formie krzesełkowej (ryc. 15-1C).
Cukry występują w formie różnych rodzajów izomerów
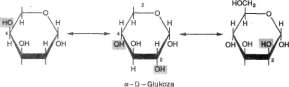
Związki o takim samym wzorze strukturalnym, ale różnej konfiguracji przestrzennej są znane jako stereoizomery. Warunkiem powstania izomerów przestrzennych są asymetryczne atomy węgla (atomy węgla połączone z 4 różnymi atomami lub grupami). Liczba możliwych izomerów danego związku zależy od liczby asymetrycznych atomów węgla (n) i równa się 2n. Glukoza, z 4 asymetrycznymi atomami węgla, ma 16 izomerów. Ważniejsze rodzaje izomerów glukozy są następujące:
1. Izomery konf iguracyjne D i L. Określenie izomerujako formy D lub jej lustrzanego odbicia jako formy L jest uwarunkowane przestrzennym podobieństwem do macierzystego związku rodziny węglowodanów, trójwęglowe-go cukru — aldehydu glicerynowego (gliceroza jest nazwą nie wskazaną). Formy L i D tego cukru, wraz z odpowiadającymi im izomerami glukozy, przedstawiono na ryc. 15-2. Ustawie-
i
eCH,OH
<C —H
I
'CHjOH
Aldehyd L-pllcerynowy
'C-H
t HO-JC-H
I H-SC-OH
I HO— «C -H
I *C —H
I 'CHsOH
C—H I H-C —OH
CHjOH
Aldehyd D-gtfoeryrtowy (D-G!loeroza)
C —H
I H-C —OH
( HO—C —H
m
Ć
i H-C —OH
H-C I CH,OH
a-D-Glutoza
Ryc. 15-1. a-D-Glukoza. A — forma łańcuchowa, B — wzór rzutowy Hawortha, C — konformacja krzesełkowa.
L-Glukoza
D- Glukoza
Ryc. 15-2. D- i L-lzomery aldehydu glicerynowego i glukozy.
WĘGLOWODANY O ZNACZENIU FIZJOLOGICZNYM / 163
Fu ran
Plran
HOCHj
I
HOCH
HCOH
nie grup — H i -OH wokół atomu węgla (tj. 5 atomu, węgla w glukozie) przylegającego do końcowego węgla pierwszorzędowego alkoholu warunkuje przynależność cukru do szeregu D lub
L. Jeżeli grupa — OH przy tym atomie węgla (atomie odniesienia) znajduje się po stronie prawej (jak przedstawiono na ryc. 15-2), to cukier należy do szeregu D; jeśli grupa — OH znajduje się po stronie lewej, to cukier należy do szeregu L. Większość monosacharydów występujących u ssaków ma konfigurację D, a enzymy warunkujące ich metabolizm są swoiste dla tej konfiguracji.
Obecność asymetrycznych atomów węgla nadaje również cząsteczce aktywność optyczną. Gdy strumień światła spolaryzowanego przechodzi przez roztwór izomeru optycznego, wówczas płaszczyzna polaryzacji przechodzącego światła spolaryzowanego może zostać skręcona w prawo, prawoskrętność (+), lub w lewo, lewoskręt-ność (—). Związek może być oznaczony D(—), D( + ), L( —) lub L(-t-), co wskazuje na jego pokrewieństwo strukturalne 2 aldehydem D-lub L-gliceryn owym, oraz wskazuje, że wykazuje on niekoniecznie ten sam kierunek skręca lno-ści optycznej co aldehyd, np. naturalnie występującą formą fruktozy jest D(—) izomer.
Mieszanina równych ilości izomerów D i L nie wykazuje żadnej aktywności optycznej, gdyż aktywności każdego z izomerów wzajemnie się znoszą. Mieszaninę taką nazywamy racemiczną lub DL-mieszaniną. Związki otrzymywane syntetycznie są z konieczności racemi-czne, ponieważ każdy z izomerów powstaje z taką samą łatwością.
Piranozowe i furanozowe formy
pierścieniowe. Podstawą terminologii jest
fakt, że trwale struktury pierścieniowe mono
sacharydów są podobne do struktury pierście
nia piranu lub furanu (ryc. 15-3). Ketozy mogą
również występować w formach pierścienio
wych (np. D-fruktofuranoza lub D-fruktopira-
noza) (ryc. 15-4). W przypadku znajdującej się
w roztworze glukozy, ponad 99% jej cząsteczek
znajduje się w postaci piranozowej; a więc mniej
niż 1% znajduje się w postaci furanozowej.a i p Ano mery. Struktura pierścieniowa
aldozy jest półacetalem, ponieważ została utwo
rzona w wyniku reakcji grupy aldehydowej
z grupą alkoholową (ryc. 15-5). Podobnie pierś
cieniowa struktura ketozy jest półketalem. Kry
staliczna glukoza jest a-D-glukopiranozą.
W roztworze zachowuje się struktura cykliczna,
ale pierwszy atom węgla (karbonylowy) staje się
H OH
■i- D- GI u kołu ranoza
n-OGIukopIranoza
OH H
a-D-FruktopIranoza
Ryc. 15-3. Postacie pira nożowa i furanozowa glukozy.
OH H a - D-Fru ktof u r an oza
Ryc. 15-4. Postacie pira nożowa i furanozowa fruktozy.
asymetryczny (anomeryczny atom węgla). Wynikiem tego jest powstanie mieszaniny zawierającej a-glukopiranozę (36%) i P-glukopira-nozę (63%) oraz śladowe ilości oc i P anomerów glukofuranozy (1%). Ustalaniu się równowagi w tym układzie towarzyszy zmiana skręcalności optycznej (mutarotacja), w miarę otwierania się
164 / ROZDZIAŁ 15
HOCH,
HOCH
h/h \oh
\ /
HO\OH H/H
W
H OH
/f-OGIukopIranoza (0-anomer)
H OH
«r-D-Glukoplranoza
(fl-anomer)
HO\OH
Acykliczna forma aldehydowa
Ryc. 15-S. cc- i p-stereoizomery D-glukopiranozy. Mechanizm mutarotacji.
pierścienia pó lace tal owego i jego odtwarzania, wraz ze zmianami położenia grup — H i — OH przy pierwszym atomie węgfa. Pośrednikiem w tym procesie jest przypuszczalnie uwodniona
prostolańcuchowa cząsteczka acykliczna, aczkolwiek analiza polarograficzna wykazała, że najwyżej 0,0025% glukozy istnieje w formie acyklicznej. Rotacja optyczna obserwowana w roztworach glukozy jest prawoskretna; z tego powodu w praktyce klinicznej często używa się nazwy dekstroza zamiast glukoza.
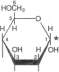
Epimery. Izomery różniące się konfigu
racją — OH i — H przy atomach węgla 2, 3 lub
4 glukozy nazywamy epimerami. Najważniej
szymi biologicznie epimerami glukozy są man-
noza i galaktoza, utworzone przez epimeryzację
odpowiednio przy węglu 2 i 4 (ryc. 15-6).Izomery konstytucyjne — aldoza,
ketoza. Fruktoza ma ten sam wzór cząstecz
kowy co glukoza, lecz różni się wzorem struk
turalnym. Przy drugim atomie węgla cząsteczki
fruktozy znajduje się potencjalna grupa ketono
wa (ryc. 15-7), natomiast glukoza zawiera po
tencjalną grupę aldehydową w pozycji 1 (ryc.
15-8).
Wiele monosacharydów to związki fizjologicznie ważne
Pochodne trioz powstają w wyniku metabolicznej degradacji glukozy w ciągu glikolitycz-
HOCH,
HOCH
H OH a-D-Galaktoza Ryc. 15-6. Epirneryzacja glukozy
H H a-D-Mann ola
CH,OH
I
C=O
CH,OH
CHiOH
i
c=o
I
HO —C — H
H-C-OH i CH,OH
CHjOH
ć=o
I H-C — OH
H-C -OH CH,OH
CH,OH
C = O I HO— C— H
H—C —OH H —C—OH
CH,OH
CH3OH
i
c=o
HO—C—H
H—C —OH
I H—C —OH
I H—C —OH
CHiOH
Dihydroksyaceton D-(Jsyluloza D-Rybuloza D-Fruktoza
Ryc. 15-7. Przykłady ketoz o znaczeniu fizjologicznym.
D-Sedoheptuloza
WĘGLOWODANY O ZNACZENIU RZJ O LOGICZNYM / 165
|
|
CHO |
|
|
|
|
H-C-OH |
|
|
|
|
CH,OH |
|
|
|
Aldehyd D-gllcarynowy |
|
||
|
" CHO * |
|
CHO |
|
|
HO-Ć-H |
|
H-C-OH |
|
|
H-C-OH |
|
H-C-OH |
|
|
CHjOH |
|
CHiOH |
|
|
D-Treoza |
|
D-Erytroza |
|
|
ł |
|
ł |
|
CHO |
CHO |
CHO |
CHO |
|
HO-Ć-H |
H-Ć -OH |
HO-Ć-H |
H-Ć -OH |
|
HO-Ć-H j |
LJA /* LJ n v^ w n |
H-Ć-OH |
H-Ć -OH |
|
H -C -OH |
H-C -OH |
H-Ć -OH |
H-C -OH |
|
Ćh3oh |
CH.OH |
CHiOH |
CHjOH |
|
D-LIksoza |
D-Ksyloza |
D-Arablnoza |
D-Ryboia |
|
CHO |
|
r 1 CHO CHO |
|
|
H-C-OH |
|
HO-C-H H-Ć-OH |
|
|
HO-Ć-H |
|
HO-C-H HO-Ć-H |
|
|
HO-Ć-H |
|
H-Ć-OH H-Ć-OH |
|
|
H-C-OH |
|
H-C-OH H-Ć-OH |
|
|
Ćh,oh |
|
CH,OH CH,OH |
|
|
O-Galakloza |
|
D-Mannoza D -Glukoza |
|
|
Ryc. 15-8. Współzależności strukturalne aldoz |
szeregu D. D-Treoza nie ma znaczenia fizjologicznego. |
|||
Szereg utworzono przez teoretyczne dodawanie jednostki CH2O do grupy -CHO cukru. |
|
|||
coo-
OH
OH
nym. Pochodne trioz, tetroz, pentoz i 7-wcg-lowego cukru (sedoheptulozy) powstają w procesie degradacji glukozy w cyklu pentozofos-foranowym. Pentozy są istotnym składnikiem nukleotydów, kwasów nukleinowych i wielu koenzymów (tab. 15-1). 2 heksoz najważniejsze fizjologicznie są; glukoza, galaktoza, fruktoza i mannoza (tab. 15-2).
Na rycinie 15-8 przedstawiono strukturę znaczących biochemicznie aldoz, a ryc. 15-7 budowę 5 ważnych w metabolizmie ketoz.
Ważną rolę odgrywają kwasy karboksylowe pochodne glukozy, takie jak D-glukuronian (uczestniczący w tworzeniu gtukuronidów i występujący jako składnik glikozaminoglikanów) i jego pochodne metaboliczne, L-iduronian (skiadnik glikozaminoglikanów) (ryc, 15-9) i L-gulonian (metabolit szlaku kwasu uronowe-go; p. ryc. 22-1).
Ryc. 15-9. a-D-Glukuroman (z lewej) 1 p-L-iduro-
nian (z prawej).
Cukry tworzą glikozydy, reagując z innymi związkami lub między sobą
Glikozydy są to związki powstające w wyniku kondensacji między grupą hydroksylową, znajdującą się na anomerycznym atomie węgla monosacharydu lub reszty monosacharydowej, a drugim związkiem, którym może — lecz nie
166 / ROZDZIAŁ 15
Tabela 15-1. Pentozy |
mające znaczenie fizjologiczne |
|
|
Cukier |
Występowanie |
Znaczenie biochemiczne |
Znaczenie kliniczne |
D-Ryboza |
Kwasy nukleinowe |
Składnik strukturalny kwasów nukleinowych i koenzymów, np. ATP, NAD, NADP, flawoprote-in. Metabolit pośredni w cyklu pentozofosfora-rrowym |
|
D-Rybuloza |
Powstaje w procesach metabolicznych |
Związek pośredni w cyklu pentozofosforan owym |
|
D-Arabinoza |
Guma arabska Gumy śliwkowa i czereśniowa |
Składnik glikoprotein |
|
D-Ksyloza |
Gumy drzewne proteoglikany, glikozaminoglikany |
Składnik głikoprotein |
|
D-Liksoza |
Mięsień sercowy |
Składnik liksoflawiny izolowanej z mięśnia sercowego człowieka |
|
L-Ksyluloza |
Związek pośredni szlaku |
<wasu uronowego |
Pojawia się w moczu w pentozurii wrodzonej |
Tabela 15-2. Heksozy |
mające znaczenie fizjologiczne |
|
|
Cukier |
Źródło |
Znaczenie biochemiczne |
Znaczenie kliniczne |
D-Glukoza |
Soki owocowe. |
„Cukier" organizmu. |
Pojawia się w moczu |
|
Hydrolizat skrobi, sa- |
Przenoszony przez krew. |
(giukozuria) w wyniku |
|
charozy, maltozy i laktozy |
pobierany i wykorzysty- |
zwiększenia stężenia |
|
|
wany przez tkanki |
glukozy we krwi (hiper- |
|
|
|
glikemia) w cukrzycy |
D- Fruktoza |
Soki owocowe. Miód. |
W wątrobie i jelitach |
Dziedziczna nietoleran- |
|
Hydrolizat sacharozy |
przekształca się w gluko- |
cja fruktozy jest przyczy- |
|
i inuliny (z bulw karczo- |
zę i tak zużywa ją orga- |
ną akumulacji fruktozy |
|
chów) |
nizm |
i hipoglikemit |
D-Galaktoza |
Hydrolizat laktozy |
W wątrobie ulega prze- |
Zaburzenia jej metaboli- |
|
|
kształceniu w glukozę |
zmu prowadzą do galak- |
|
|
i jest metabolizowana. |
tozemii i zaćmy |
|
|
Syntetyzowana w gru- |
|
|
|
czole sutkowym tworzy |
|
|
|
laktozę mleka. Składnik |
|
|
|
glikolipidów i glikopro- |
|
|
|
tein |
|
D-Mannoza |
Hydrolizat gum i martno- |
Składnik wielu glikopro- |
|
|
zanów roślinnych |
tein |
|
musi (w przypadku aglikonu — być inny mono-sacharyd. Jeżeli drugą grupa jest hydroksyl, to wiązanie O-gliknzydowe jest połączeniem aceta-lowym, ponieważ jest ono wynikiem reakcji
między półacetalową grupą hydroksylową a inną grupą — OH.
Jeżeli częścią hemiacetalową jest glukoza, to utworzony związek jest glukozydem; jeśli galak-
WĘGLOWODANY O ZNACZENIU FIZJOLOGICZNYM / 167
HO/CH.OH
OH H OH OH
Ryc, 15-10. Streptomycyna (z lewej) i ouabaina (z prawej).
toza — galaktozydent, itd. Jeżeli drugą grupą jest amina, powstaje wiązanie N-glikozydowe, np. między adeniną a rybozą w takich nuk-leotydach, jak ATP (p. ryc. 12-5).
Glikozydy są składnikami wielu leków i przypraw korzennych oraz tkanek zwierzęcych. Aglikonem może być metanol, glicerol, steroł, fenol lub zasada, np. adenina. Wszystkie glikozydy, ważne w medycynie ze względu na ich działanie na mięsień sercowy (glikozydy naser-cowe), zawierają, jako składnik aglikonowy, steroidy. Należą tu pochodne naparstnicy i stro-fantusa, takie jak ouabaina będąca inhibitorem Na+/K+-ATPazy błon komórkowych. GUko-zydami są niektóre antybiotyki, np. streptomycyna (ryc. 15-10).
Deoksycukrom brak atomu tlenu
OH H
Ryc. 15-11. 2- Deoksy- D-rybofuranoza (ano-mer ji),
W deoksycukrach grupę hydroksylową przyłączoną do pierścienia zastąpił atom wodoru. Deoksycukry otrzymuje się w wyniku hydrolizy pewnych biologicznie ważnych związków. Przykładem jest deoksyryboza (ryc. 15-11) występująca w kwasach nukleinowych (DNA).
Deoksycukrem jest również L-fukoza (p. ryc. 15-17), składnik glikoprotein, oraz 2-deoksy-glukoza, znany inhibitor metabolizmu glukozy.
Aminocukry (heksozoaminy) są składnikami glikoprotein, gangliozydów i glikozaminoglikanów
Przykładami aminocukrów występujących w przyrodzie są D-glukozamina (ryc. 15-12), D-galaktozamina i D-mannozamina. Glukoza-mina jest składnikiem kwasu hialuronowego. Galaktozamina (chondrozamina) jest składnikiem chondroityny (p. rozdz. 54),
HOCH
Ryc. 15-12. Giukozamina (2-amino-D-glukopira-
noza) (anomer a). Galaktozamina jest 2-amino-D-
-galaktopiranozą. Zarówno giukozamina, jak i ga
laktozamina występują jako N-acetylowe pochod
ne w większości węglowodanów złożonych, np.
w glikoproteinach.
Niektóre antybiotyki (erytromycyna, karbo-mycyna) zawierają w swojej cząsteczce aminocukry. Uważa się, że aktywność lecznicza związana jest z obecnością aminocukrów w cząsteczkach tych antybiotyków.
168 / ROZDZIAŁ 15
NAJWAŻNIEJSZYMI DISACHARYDAMI SĄ MALTOZA. SACHAROZA I LAKTOZA
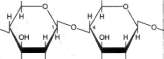
Disacharydy są cukrami złożonymi z 2 reszt monosacharydowych połączonych wiązaniem glikozydowym (ryc. 15-13). Nazwę chemiczną
disacharydów tworzy się na podstawie ich mo-nocukrowych składników. Ważnymi fizjologicznie disacharydami są maltoza, sacharoza, laktoza i trehaloza {tab. 15-3).
W wyniku hydrolizy sacharozy powstaje mieszanina zwana „cukrem inwertowanym", gdyż powstająca w czasie hydrolizy silnie lewoskręt-
Maltoza
Trehaloza
A \
1—o—'
iOH
H OH H OH
0-a-0-Glukoplranozylo-(1-ł4)-a-D-giukopiranoza
H OH H
0-a-OGIukoplranozyto-(1-ł1)-«-[>-g!ukoplranozyd
HOCH2
HO
H OH
OH
H OH OH H
O-/t-D-Fru ktof u ra n ozylo-(2 -• 1 )-a - D-g I u to p I ran ozyd
Celobioza
Laktoza
H OH H OH
O-0-D-GaJal<taptranozylo-(1-.4)-Ł-D-gfukopiranoza
Ryc. 15-13. Struktura typowych disacharydów. Przedrostek a i p odnosi się do konfiguracji przy anomerycznym atomie węgla(*). Jeżeli węgiel anomeryczny drugiej reszty uczestniczy w tworzeniu wiązania glikozydowego, to ta|ją resztę glikozydową nazywa stę furanozydem lub piranozydem. W odróżnieniu od większości innych cukrów, cukier nie mający wolnej potencjalnej grupy aldehydowej lub ketonowej na węglu anomerycznym nie wykazuje właściwości redukujących.
WĘGLOWODANY O ZNACZENIU FIZJOLOGICZNYM / 169
Tabela 15-3. Disacharydy |
||
Cukier |
Źródło |
Znaczenie kliniczne |
Maltoza |
Produkt trawienia amylazą lub hydrolizy skrobi. Kiełkujące ziarna zbóż i słód |
|
Laktoza |
Mleko |
Może pojawiać się w moczu podczas ciąży. Przy niedoborze laktazy, zaburzenie wchłaniania prowadzi do biegunki i wzdęcia |
Sacharoza |
Cukier trzcinowy i z buraków cukrowych. Sorgo, ananasy, marchew |
Przy niedoborze sacharazy, zaburzenie wchłaniania prowadzi do biegunki i wzdęcia |
Trehaloza |
Grzyby i drożdże. Główny cukier hemo-limfy owadów. |
|
na fruktoza powoduje zmianę (inwersję) skręcał no ści optycznej pierwotnie prawoskrętnej sacharozy.
POLISACHARYDY PEŁNIĄ FUNKCJE ZAPASOWE I STRUKTURALNE
Do polisacharydów zalicza się następujące ważne fizjologicznie węglowodany:
Skrobia. Ma budowę łańcucha a-glikozydo-weg"b. Takie związki, rozpadające się w trakcie hydrolizy tylko na cząsteczki glukozy, są homo-polimerami zwanymi glukoza na mi tub glukana-tni. Skrobia jest najważniejszym źródłem węglowodanów w pożywieniu i znajduje się w kaszach, ziemniakach, roślinach strączkowych i innych warzywach. Dwoma głównymi skład-
nikami skrobi s ą: amylo z a (15 20%),two rżąca nierozgałęzioną strukturę helikoidalną (ryc. 15--14), oraz amylopektyna (80—85%), tworząca łańcuchy rozgałęzione. W tej ostatniej do łańcucha głównego są przyłączone wiązaniem 1 -+ó łańcuchy boczne; jedno odgałęzienie przypada na 24—-30 reszt glukozowych połączonych wiązaniami l-*4.
Glikogen (ryc. 15-15). Jest zapasowym polisacharydem organizmów zwierzęcych. Często nazywa się go skrobią zwierzęcą. Ma strukturę bardziej rozgałęzioną niż amylopektyna, bowiem jedno odgałęzienie przyłączone do łańcucha głównego wiązaniem a(l -»-6)-glikozydo-wym przypada na 10—18 reszt a-D-glukopi-ranozowych połączonych wiązaniami a(l-»4)--glikozydowymi,
Inulina. Jest polisacharydem występującym
Ryc. 15-14. Struktura skrobi. A — amyloza o strukturze spiralnego zwoju, B — amylopektyna
z rozgałęzieniami przyłączonymi wiązaniami 1 -»6.
170 / ROZDZIAŁ 15
REGION ZEWNĘTRZNY
Ryc. 15-15. Cząsteczka glikogenu. A — struktura ogólna, B — powiększona struktura w punkcie rozgałęzienia. Liczby w A oznaczają kolejne etapy wzrostu cząsteczki. R — pierwotna reszta glukozy zawierająca, jako jedyna w cząsteczce glikogenu, redukującą grupę przy Cv Rozgałęzienia są bardziej różnorodne niż to przedstawiono na tej rycinie: wartość stosunku wiązań 1 -* 4 do wiązań 1 -* 6 waha się w granicach 10—18.
w bulwach i korzeniach dalii, karczochów i mniszka lekarskiego. Ulega ona hydrolizie do fruktozy, jest więc fruktozanem. Ten cukier zapasowy, w odróżnieniu od skrobi ziemniaków, jest łatwo rozpuszczalny w ciepłej wodzie i bywa używany w badaniach fizjologicznych do określenia szybkości filtracji w kłębuszkach nerkowych.
Dekstryny. Są substancjami powstającymi podczas częściowej hydrolizy skrobi. Pierwszymi produktami trawienia skrobi, tworzonymi w wyniku skracania łańcuchów bocznych amy-lopektyny, są dekstryny graniczne.
Błonnik (celuloza). Jest głównym składnikiem podporowym u roślin. Nie rozpuszcza się w po-
pularnych rozpuszczalnikach. Tworzy, zbudowane z jednostek p-D-glukopiranozowych, połączonych wiązaniami P(l-ł4), długie, proste łańcuchy wzmocnione krzyżowymi wiązaniami wodorowymi. Błonnik nie jest trawiony w przewodzie pokarmowym wielu ssaków, w tym człowieka, z powodu braku hydrolazy działającej na wiązania p. Jest ważnym składnikiem „objętościowym" pożywienia. W żołądku przeżuwaczy i innych trawożernych występują mikroorganizmy zdolne rozbić wiązanie p, co pozwala wykorzystać bionnik jako znaczące źródło energetyczne.
Chiryna. Jest ważnym polisacharydem strukturalnym u bezkręgowców. Znajduje się ona np.
WĘGLOWODANY O ZNACZENIU FIZJOLOGICZNYM I 171
C hity na
HOCH2
HOCH,
H HN*CO«CH3 H HN»CO*CH3
N-Acetyloglukozamina N-Acełylogiu Kozami na
Kwas hiahironowy
HOCH, COO"
H OH Kwas /(-g luku ran owy N-Acatylogukozamlna
4-Siarczan chondroltyny
(Uwaga: występuje również 6-siarczan)
HOCH,
H HN-COCH3
H OH
Kwas 0-glukuronowy Siarczan N-acatylogalaktozaminy
Heparyna
h/h \h Hy
"O.
H NH«SO3~ H OSĄ1
Suttonowana giukozamina Sulfonowany kwas Iduronowy
Ryc. 15-16. Struktura niektórych polisacharydów złożonych.
w pancerzach skorupiaków i owadów. Strukturalnie chityna składa się z jednostek N-acety-lo-D-glukozaminy, połączonych wiązaniami P(l-*4)-glikozydowymi (ryc. 15-16).
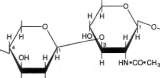
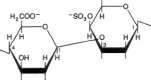
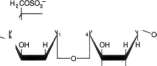
Glikozamiaogliksny (mukopohsacharydy). Składają się z łańcuchów węglowodanów złożonych, charakteryzujących się zawartością ami-nocukrów i kwasów uronowych. Po przyłączeniu tych łańcuchów cukrowych do cząsteczki białka powstaje składnik zwany proteoglikanem. Razem z elastyną i kolagenem, elementami strukturalnymi takich tkanek, jak kość, tworzą substancję podstawową, czyli kitową. Znaczna liczba grup — OH i ładunków ujemnych, które przez odpychanie utrzymują w cząsteczce łańcuchy węglowodanowe osobno, powoduje, że glikozaminoglikany mają właściwość zatrzymywania znacznej ilości wody oraz pęcznienia i dzięki temu zdolność do nadawania właściwości amortyzujących lub poślizgowych innym strukturom. Przykładem są kwas hiałuronowy, siarczan chondroityny i heparyna (ryc. 15-16), omówienie szczegółowo w rozdz. 57,
Glikoproteiny (mukoproteiny). Występują w różnych płynach i tkankach, w tym w błonach komórkowych (p. rozdz. 43 i 57). Są to białka złożone zawierające w różnych ilościach węglowodany, przyłączone jako krótkie lub długie (do 15 jednostek) rozgałęzione lub nierozgałę-zione łańcuchy. Łańcuchy takie nazywa się zwykle łańcuchami oligosacharydowymi. Składniki cukrowe obejmują:
Heksozy
Galaktoza (Gal)
Mannoza (Man)
Acetyloheksozaminy
N-Acetyloglukozarnina N-Acetylogalaktozarriina
(GIcNAc) (GaiNAc)
Pentozy
Arabinoza (Ara) Ksyloza (Xyi)
Metylopentozy
L-Fukoza (Fuc; p. ryc, 15-17)
Kwasy sjałowe
Pochodne N-acylowe kwasu neuraminowego, np. kwas N-acetyloneuraminowy (NeuAc; p. ryc. 15-18), główny kwas sjalowy.
Dojrzale glikoproteiny, oprócz kolagenu, nie zawierają glukozy i w przeciwieństwie do gliko-/aminoglikanów i proteogiikanow nie zawierają kwasów uronowych.
Kwasy sjalowe. Są N- lub O-acylowymi pochodnymi kwasu neuraminowego (ryc. 15-18). Kwas neuraminowy jest 9-węglowym cukrem,
172 / ROZDZIAŁ 15
Jtrs-
O\H HO/0
W
OH H
COCT
Ac —NH
Ryc. 15-17. (i-L Fukoza (6-deoksy-p-L-galakto-za).
stanowią węglowodany, które znajdują się w glikoproteinach i gliko lipid ach. Ich obecność na zewnętrznej powierzchni błony plazmatycz-nej (glikokaliks) wykazano przy użyciu lektyn roślinnych, aglutynin białkowych, które wiążą się swoiście z pewnymi resztami glikozylowy-mi, np. kimkanawalina A jest swoista w stosunku do reszt a-glukozy 1 owych i a-mannozylo-wych.
Glikoforyna. Jest główną integralną gliko-proteiną błony ludzkich erytrocytów. Zbudowana ze 130 reszt aminoacylowych tkwi w błonie lipidowej tak, że zarówno z zewnętrznej, jak i z wewnętrznej (cytoplazmatycznej) powierzchni błony wystają wolne części polipeptydowe. Łańcuchy sacharydowe są przyłączone tylko do części N-końcowej, znajdującej się na zewnątrz powierzchni zewnętrznej błony (p. rozdz, 43).
OH H
Ryc. 15-18. Struktura kwasu N-acetyloneurami-nowego (kwasu sjalowego). Ac = CH3-CO-.
którego strukturę można wyprowadzić, tączac mannozaminę (epimer glukozaminy) z pirogro-nianem. Kwasy sjalowe są składnikami zarówno glikoprotein jak i gangliozydów.
WĘGLOWODANY ZNAJDUJĄ SIĘ W BŁONACH KOMÓRKOWYCH
Lipidową strukturę błon komórkowych opisano w rozdz. 16 i 43. Analiza składników błon komórkowych ssaków wykazuje, że ok. 5%
PIŚMIENNICTWO
Advances in Carbohydrate Chemistry. Academic
Press, 1945—current. Collins PM (editor); Carbokydrates. Chapman
& Hali, 1987. Ferrier RJ, Collins PM; Monosaccharide Chemistry.
Penguin Books, 1972. Hughes RC: The comple* carbohydrates of mam-
malian celi surfaces and their biological roles.
Essays Biochem 1975;11:1. Lindahl U, Hook M: Glycosaminoglycans and their
binding to biological macromolecules. Annu Rev
Biochem 1978;47:385. Pigman WW, Horton D (editors): The Carbohydrates.
Vols — 1A and 1B. Academic Press, 1972. Rees DA: Poiysaccharide Shapes. Wiley, 1977. Sharon N: Carbohydrates. Sci Am 1980;245:90
Wyszukiwarka
Podobne podstrony:
Fosforylacja oksydacyjna i mitochondrium, BIOCHEMIA
Transport elektronów i fosforylacja oksydacyjna, biochemia
sciaga transport elektronów i fosforylacja oksydacyjna, Biochemia
sciaga transport elektronów i fosforylacja oksydacyjna, biochemia
Transport elektronów i fosforylacja oksydacyjna
Oddychanie komorkowe i fosforylacja oksydacyjna
12 Biochemia fosforylacja oksydacyjna nowa
Montwiłł Węzły transportowe w europejskim systemie transportu
SYSTEMY TRANSPOROWE word
wrocław systemy transportowe
zal systemy transportowe
systemy sciaga, systemy transportowe
Relacje miedzy zagospodarowaniem przestrzennym a systemem transportowym, Studia, Sem 5, SEM 5 (wersj
SYSTEM TRANSPORTOWY kolos 2
63 Systemy transportu substancji przez blone
160 Omow wspoldzialanie systemow transportu podczas wytwarzania kwasu solnego w zoladku
Przewozy - studenci-2011-2012, Systemy transportowe I
SYSTEMY TRANSPORTOWE projekt
więcej podobnych podstron
