Spektroskopia absorpcyjna UV/VIS
Podstawy teoretyczne
Metoda ta obejmuje zakres promieniowania: 200 - 1 100 nm
(25 000 - 12 500 cm-1)
100 - 200 nm daleki (próżniowy) nadfiolet (absorpcja O2)
200 - 400 nm bliski nadfiolet
400 - 1 100 nm promieniowanie widzialne (VIS)
Podstawą metod jest selektywna absorpcja promieniowania, powodująca zmiany energii elektronowej ΔEe cząsteczki na skutek przeniesienia elektronów walencyjnych z niższego (praktycznie podstawowego) stanu elektronowego na wyższy poziom energii elektronowej.
Absorpcja promieniowania przez cząsteczki jest selektywna - częsteczki absorbują tylko określone (charakterystyczne dla nich ) kwanty promieniowania (określone przez E, λ, ν).
Warunki absorpcji promieniowania (reguły wyboru)
1. ∆Ee = hν (energia, kwant promieniowania absorbowanego musi odpowiadać różnicy poziomów energetycznych dla elektronów walencyjnych cząsteczki - energia przejścia (warunek niewystarczajacy)
2. Prawdopodobieństwo przejścia absorpcyjnego (moment przejścia) między stanami elektronowymi Rlm # 0 jest określone zmiana momentu dipolowego czasteczki. Przejscie elektronowe jest dozwolone jeśli towarzyszy mu zmiana symetrii gęstości elektronowej
3. Dozwolone są przejścia między stanami o tej samej multipletowości (singlet-singlet, dublet-dublet, itd.)
W wyniku naruszenia tych reguł w widmie mogą pojawić się pasma wzbronione
Mimo tych ograniczeń, liczba możliwych przejść w widmie elektronowym jest bardzo duża, pełna struktura widma elektronowego czasteczkowego jest skomplikowana. Można ją zaobserwować dla małych (dwuatomowych) cząsteczek w fazie gazowej. Np. widmo jodu na rys.
Prawa absorpcji
b
I0 I
I0 - natężenie promieniowania padającego
I - natężenie promieniowania po przejściu przez warstwę absorbującą o grubości b
Ia - natężenie promieniowania zaabsorbowanego
I0 = Ia + I ( jeśli I odb = 0) /: I0
1 = Ia/ I0 + I/ I0 gdzie I/ I0 = T transmitancja, przepuszczalność
100 I/ I0 = T%
1. I = I0 e -kb albo ln I/I0 = -kb
Natężenie promieniowania monochromatycznego, przechodzącego przez jednorodny ośrodek ulega osłabieniu proporcjonalnie do grubości warstwy,
k = współczynnik absorpcji, zależny od λ oraz rodzaju ośrodka absorbującego.
A
2. I = I0 e -cab albo lg I/I0 = A = a c b stąd c = a b
Absorbancja lub ekstynkcja A = lg 1/T lub A = lg 100/T
k = 2.303 a
Natężenie promieniowania monochromatycznego po przejściu przez warstwę roztworu o gr. b oraz stężeniu c ulega osłabieniu proporcjonalnie do b oraz c.
a - współczynnik absorpcji (A/bc), charakterystyczny dla substancji absorbującej, rozpuszczalnika, zależy od λ, nie zależy od c
jeżeli c [g/cm3] oraz b[cm] - a = właściwy wsp. absorpcji
jeżeli c[mol/l] - a = ξ = molowy wsp. absorpcji
a A
c c
T % zmienia się w zakresie 0 - 100%
A zmienia się w zakresie 0 - praktycznie 2, 3
3. A = lg I/I0 = A1 + A2 = A3......
Absorbancja mieszaniny jest równa sumie absorbancji poszczególnych składników w mieszaninie
Dla mieszaniny dwuskładnikowej As = [(k1 -k2)/ 100] c = k2
c - stężenie jednego składnika w %
100-c - stężenie drugiego składnika
k1 oraz k2 są współczynnikami kalibracji k = ab lun ع b
Odstępstwa od praw absorpcji
Selektywność absorpcji
Selektywność absorpcji - czyli pochłanianie określonych, charakterystycznych dla danego związku chemicznego, długości fal, wiąże się z wrażeniem barwy jakiej doznaje się w widzialnym zakresie widma 400-1100nm.
Substancje chemiczne mogą:
- przepuszczać cały zakres widma widzialnego (barwa biała)
- absorbować cały obszar tego promieniowania (barwa czarna), lun
- absorbować selektywnie, niektóre, określone dla tej substancji długości fal.
Barwa wynika z selektywnej absorpcji przez cząsteczki chemiczne.
Po przejściu promieniowania przez taką substancję, określona część (długości fal) zostanie zaabsorbowana, zaś do oczu trafia promieniowanie, które nie zostało zaabsorbowane. Widać barwę dopełniającą , na którą składają się poszczególne długości fali promieniowania przepuszczonego.
Dla substancji nieprzeźroczystych barwa zależy od rodzaju promieniowania odbitego.
Zakres promieniowania widzialnego i odpowiadajace im barwy i barwy dopełniające
∆λ [nm] dl. fali (barwa) promieniowania barwa
absorbowanego dopełniająca
400-450 fiolet żółto-zielona
450-480 niebieska żółta
480-490 zielono-niebieska pomarańczowa
490-500 niebiesko-zielona czerwona
500-560 zielona purpurowa
itd....
Chlor absorbuje zakres bliskiego nadfioletu, fioletu i błękitu (300-450 nm), zaś promieniowanie przepuszczone daje barwą zielonożółtą; brom absorbuje fale 360-600 nm promieniowanie przepuszczane daje wrażenie barwy czerwonobrunatnej
Jaki jest związek pomiędzy barwą substancji a jej budową chemiczną?
Badania Witta wykazały, że zjawisko selektywnej absorpcji przez związki barwne wiąże się z obecnością w ich cząsteczkach pewnych nienasyconych grup funkcyjnych, zwanych chromoforami (chroma - barwa)
Zatem zdolność selektywnej absorpcji promieniowania UV/VIS uwarunkowana jest obecnością w strukturze określonych grup funkcyjnych -chromoforów.
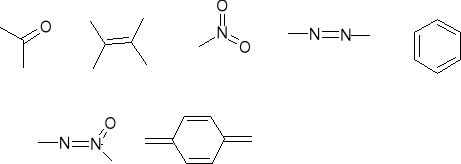
W zależności od rodzaju chromoforu cząsteczka absorbuje określoną, charakterystyczną dla niego część promieniowania Δλ i w widmie cząsteczkowym pojawia się pasmo o charakterystycznej dla tego chromoforu długości fali
Dany chromofor w różnych cząsteczkach absorbuje w przybliżeniu
promieniowanie o tej samej długości fali np. -CH=CH- - 165 nm,
-C=O - 154, 187, 280 nm
C6H6 - 189, 299, 255 nm
Na podstawie znajomości położenia pasma (maximum absorpcji) w widmie danej substancji można zidentyfikować chromofor, odpowiedzialny za tę absorpcję.
Niektóre grupy funkcyjne - auksochromy (gr. kowalencyjnie nasycone z wolnymi parami elektronowymi), przyłączone do chromoforu powodują zmianę położenia pasma chromoforu oraz jego intensywność.
![]()
Położenie pasma danego chromoforu może zmieniać się na skutek wpływu:
otoczenia strukturalnego, które poprzez efekty elektronowe i steryczne zmienia energie elektronów w danym chromoforze,
rozpuszczalnika
pH
Przesunięcie maximum absorpcji
- w kierunku fal dłuższych - przesunięcie batochromowe,
- w kierunku fal krótszych - przesunięcie hipsochromowe
Podwyższenie maximum absorpcji - efekt hiperchromowy
Obniżenie maximum absorpcji - efekt hipochromowy
lgξ
λ λ
Słabe chromofory (np. grupa benzenowa, etylenowa) asbsorbują w zakresie dalekiego nadfioletu (195 nm). Sprzężenie grup etylenowych przesuwa absorpcję w kierunku fal dłuższych: ( -CH=CH-)5 - 326 nm,
(-CH=CH-)11 - 420-480 nm
Widmo UV/VIS a struktura cząsteczki
Selektywna absorpcja promieniowania i odpowiadające tej absorpcji pasma w widmie UV/VIS danej cząsteczki, zależy od przejść elektronów walencyjnych z poziomu podstawowego na wzbudzony w określonych grupach funkcyjnych zwanych chromoforami.
Własności spektralne danej cząsteczki można wyjaśnić w oparciu o klasyfikacje jej elektronów walencyjnych
Elektrony walencyjne w cząsteczce:
δ - tworzące wiązania pojedyncze
π - wiązań podwójnych, potrójnych, aromatycznych
n - niewiążące
Utworzenie wiązania δ lub π oznacza wydzielenie energii, zatem energie stanów
δ oraz π są niższe niż stanu n. Ponieważ wiązanie δ jest mocniejsze niż π, więc energia stanu δ jest niższa niż π
Po absorpcji kwantu promieniowania nastąpi powstanie orbitali antywiążących odpowiednio δ* oraz π* o energii wyższej od energii stanu n (Oznacza to odpychanie pomiędzy atomami czyli osłabienie lub nawet rozerwanie wiązania)
δ*
π*
n
π
δ
δ- δ* > n- δ* > π- π* > n- π*
przejście δ- δ*
C-C, C-H, leżą w obszarze nadfioletu próżniowego <190 nm (CH4 , 125 nm)
przejście π- π* (pasma o dużej intensywności)
wzbudzenie elektronów (słabiej związanych od ) wymaga mniejszej energii, stąd odpowiadąjace pasma występują w bardziej długofalowym obszarze widma
(160-220 nm) , np. etylen - 165 nm,
butadien - 217 nm,
benzen - 180, 200, 255 nm
przejście n- δ* (są wzbronione, ich natężenie jest mniejsze)
charakterystyczne dla związków z wolnymi parami elektronowymi, np.
H20 - 167 nm
formaldehyd - 190 nm
metyloamina - 215 nm
trójmetyloamina - 227 nm
przejście n- π* (bliski nadfiolet i światło widzialne)
charakterystyczne dla grup z wiązaniami podwójnymi w których obecne sa heteroatomy, np. C=O, N=N, N=O
aldehyd octowy - 294 nm
aceton - 279 nm
Wpływ czynników na położenie pasma w widmie UV/VIS
Etylen etylen butadien
π*
δ- δ*
π- π* π*
π π
165 nm 217 nm
Oddziaływania międzycząsteczkowe oraz wewnątrz cząsteczkowe - przejawiają się silniej w widmach elektronowych niż w innych widmach cząsteczkowych
Im większa liczba sprzężonych wiązań podwójnych, tym niższa energia wzbudzenia elektronów π i odpowiednie pasmo przesunięte w stronę dłuższych fal (przesunięcie batochromowe), dla 5, 6 wiązań sprzężonych pojawia się w obszarze światła widzialnego.
butadien - 217 nm
heksatrien - 258
Podstawienie grupami alkilowymi (dodatni efekt indukcyjny)
Ładunki jąder przyciągające elektrony π są silniej ekranowane i przejście
π- π* jest łatwiejsze ze względów elektrostatycznych (ef. batochromowy)
Wprowadzenie podstawników auksochromowych
powoduje przesunięcie batochromowe (na skutek efektu indukcyjnego i
rezonansowego, obniża się energia wzbudzenia, np.
C=C - X X = -O-CO Δλ = 0 (dla π- π*)
X = - OR Δλ = 6 nm (elektroujemność = 3.5)
X = - SR Δλ = 30 nm (elektroujemność = 2.5)
X = - Cl Δλ = 5 nm
X = -NR2 Δλ = 60 nm
Wpływ polarnego rozpuszczalnika na przejście π-π* oraz n-π*
Dla większości przejść stan wzbudzony π* jest bardziej polarny niż
podstawowy, a więc bardziej stabilizowany przez polarny rozpuszczalnik
niż stan podstawowy.
Rozpuszczalnik polarny zbliża do siebie poziomy energetyczne π-π* co
powoduje efekt batochromowy
Gdy cząsteczka zawiera heteroatomy to mogą one oddziaływać
z rozpuszczalnikiem tworząc wiązanie wodorowe. Rozpuszczalnik
polarny w większym stopniu stabilizuje orbital n niż π* w rezultacie
powoduje zwiększenie odległości n-π* (efekt hipsochromowy)
π* π* π*
n
π*
n
π π π π
brak polarnego oddziaływania z hexan etanol
rozpuszczalnika polarnym rozpuszcz.
Wpływ efektów sterycznych
Koplanarnośc układu wiązań podwójnych jest warunkiem maksymalnego rezonansu tj. najbardziej efektywnego nakładania się orbitali π i w związku z tym łatwości przejścia π-π*
izomery cis i trans (łatwiej odróżnić na podstawie widma IR)
izomer trans pochłania silniej przy większej długości fali
izomer cis łatwiej przyjmuje konfigurację nieplanarną
cis 222 nm trans 229 nm
283 nm 295 nm
zakryte 308 nm
Odchylenie układu sprzężonego od położenia płaskiego (zmniejsza natężenie pasma oraz energię rezonansu co powoduje przesunięcie hipsochromowe
Przejścia z przeniesieniem ładunku
W wyniku absorpcji fotonu elektron (najczęściej s lub p) z cząsteczki -
donora przenosi się na niezajęty orbital drugiej molekuły - akceptora.
Po wyemitowaniu pochłoniętego fotonu molekuły wracają do stanu
pierwotnego (to znaczy, że nie nastąpiło utlenienie/redukcja czasteczek.
Przykładem są kompleksy z przeniesieniem ładunku np. kompleksy jodu z benzenem, pirydyną, eterem i in. donorami elektronów.
Charakterystyczną cechą tego przeniesienia jest pojawienie się nowego pasma absorpcji, które nie występuje w widmach oddzielnych składników. Pasmo to jest znacznie oddalone od pasm składników i pojawia się w widzialnej części widma lub bliskim nadfiolecie. To oznacza obniżenie energii stanów elektronowych w kompleksie w stosunku do energii składników. Pasma te charakteryzuje duża intensywność i szerokość.
Zastosowania spektroskopii UV/VIS
Podstawa zastosowań analitycznych jest charakterystyczność położenia i intensywności pasm. Pasma przejść elektronowych są bardzo wrażliwe na oddziaływania wewnątrz oraz międzycząsteczkowe i tylko pełna identyczność widma substancji oraz wzorca w tym samym środowisku (rozpuszczalnik, pH) pozwala na identyfikację substancji.
Oprócz typowych zastosowań metody te mają duże znaczenie w badaniu równowag tworzenia się i struktury kompleksów jonów metali przejściowych (pasma przejść d-d oraz pasma przeniesienia ładunku charakterystyczne dla kompleksów)
Odróżnienie izomerów cis- oraz trans- w widmie UV/VIS umożliwia analizę zawartości tych izomerów.
Badania równowag kwasowo-zasadowych
Widma związków zawierających grupy kwasowe lub zasadowe często zależą od pH roztworu. Wynika to z równowagi form protonizowanej i nieprotonizowanej, z których każda ma inne pasmo absorpcji. Zmiana pH wywołuje przesunięcie równowagi i zwiększenie intensywności pasma jednej formy kosztem pasma drugiej. Przy skrajnych wartościach pH równowaga przesuwa się całkowicie w stronę jednej z form.
Śledząc zależność absorpcji dla wybranej długości fali od pH środowiska (miareczkowanie spektrometryczne)możemy określić stałą dysocjacji pK, która jest równa wartości pH wówczas gdy stężenia obu form są równe.
![]()
Wyszukiwarka
Podobne podstrony:
materiały spektroskopia UV VIS
Spektrofotometria UV VIS Zastosowanie spektrofotometrii w Biochemii
Spektrofotometria UV
spektrometria UV VIS spektrofluorymetria
Spektrofotometria UV, Biol UMCS, I semestr, Chemia nieorganiczna
Spektrofotometria UV-VIS 4
Wykresy zależności dla spektrofotometrii UV VIS
Spektrofotometria UV-VIS, Ochrona Środowiska, Sprawozdania z Chemii Analitycznej Środowiska
Spektroskopia UV-VIS kompleksów metali przejściowych-ćwiczenia, matury z chemii
Spektrofotometria UV VIS
spektroskopia uv vis, spektroskopia ir
Spektroskopia UV konspekt
materiały spektroskopia UV VIS
spektrometria UV VIS spektrofluorymetria
Spektroskopia UV 2
Instrukcja spektroskopia UV VIS
Spektroskopia UV Vis
więcej podobnych podstron
